一种定点突变创制矮化黄瓜种质的方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于生物技术领域,具体涉及一种定点突变创制矮化黄瓜种质的方法。
背景技术
耕地面积随着城市建设的发展已经越来越少。因此,利用有限的耕地进行高密度种植进而增加植物生物量积累是现代农业高产的重要手段,同时也符合现代机械化农业发展的趋势。具有理想株型的植物可有效提高植株抗逆性、光合利用效率以及土地利用率。目前,植物株高普遍利用激素调控,还有一些利用基因调控;例如:在南瓜、西瓜和黄瓜中发现YABBY1基因上B-region的各种不同缺失可使葫芦科瓜类作物主茎缩短;在拟南芥中,通过RNAi沉默木质素合成关键基因HCT的表达,使得拟南芥的株高显著降低。
黄瓜(Cucumis sativus L.)是我国大面积栽培蔬菜之一,且是我国居民日常饮食中重要组成部分。但目前我国栽种的大部分黄瓜植株高大,需耗费大量人力、物力进行栽后管理,不符合现代农业生产发展需求。因此,培育矮化黄瓜种质具有重要的应用价值。
发明内容
本发明的目的为培育矮化黄瓜种质。
本发明首先保护一种培育转基因黄瓜的方法,可包括如下步骤:降低出发黄瓜中蛋白质CsMAPK6的活性和/或表达量,得到转基因黄瓜;与出发黄瓜相比,转基因黄瓜的株高降低;
所述蛋白质CsMAPK6,可为(a1)或(a2):
(a1)SEQ ID NO:3所示的蛋白质;
(a2)在(a1)所述蛋白质的N端或/和C端连接标签得到的融合蛋白。
标签具体如表1所示。
表1.标签的序列
上述方法中,所述降低出发黄瓜中蛋白质CsMAPK6的活性和/或表达量可通过突变黄瓜中蛋白质CsMAPK6的编码基因来实现。
所述蛋白质CsMAPK6的编码基因可为如下(b1)或(b2)或(b3)或(b4)或(b5)的DNA分子:
(b1)编码区如SEQ ID NO:2所示的DNA分子;
(b2)核苷酸序列如SEQ ID NO:2所示的DNA分子;
(b3)核苷酸序列如SEQ ID NO:1所示的DNA分子;
(b4)与(b1)或(b2)或(b3)限定的DNA分子杂交且编码所述蛋白质CsMAPK6的DNA分子;
(b5)来源于黄瓜且与(b1)或(b2)或(b3)限定的DNA分子至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同一性且编码所述蛋白质CsMAPK6的DNA分子。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述蛋白质CsMAPK6的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述蛋白质CsMAPK6的核苷酸序列70%或者更高同一性的核苷酸,只要编码所述蛋白质CsMAPK6,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码SEQ ID NO:3所示的氨基酸序列组成的所述蛋白质CsMAPK6的核苷酸序列具有70%或更高,或75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
上述方法中,所述突变黄瓜中蛋白质CsMAPK6的编码基因可为将SEQ ID No:2所示的CsMAPK6基因突变为CsMAPK6/+1bp;所述CsMAPK6/+1bp是在SEQ ID No:2自5’末端起第41至42位核苷酸之间插入了1个T,保持SEQ ID No:2的其他核苷酸序列不变得到的DNA分子。
上述方法中,所述突变黄瓜中蛋白质CsMAPK6的编码基因是通过将CRISPR/Cas9系统导入黄瓜实现的;所述CRISPR/Cas9系统包括重组表达载体;所述重组表达载体含有表达靶向所述蛋白质CsMAPK6的编码基因的gRNA的DNA分子。
上述方法中,所述gRNA的靶标序列可为SEQ ID No:1自5’末端起第359-380位所示。
本发明还保护突变黄瓜中蛋白质CsMAPK6的编码基因的物质在降低黄瓜株高中的应用;
所述蛋白质CsMAPK6,可为(a1)或(a2):
(a1)SEQ ID NO:3所示的蛋白质;
(a2)在(a1)所述蛋白质的N端或/和C端连接标签得到的融合蛋白。
标签具体如表1所示。
上述应用中,所述突变黄瓜中蛋白质CsMAPK6的编码基因可为将SEQ ID No:2所示的CsMAPK6基因突变为CsMAPK6/+1bp;所述CsMAPK6/+1bp是在SEQ ID No:2自5’末端起第41至42位核苷酸之间插入了1个T,保持SEQ ID No:2的其他核苷酸序列不变得到的DNA分子。
上述应用中,所述突变黄瓜中蛋白质CsMAPK6的编码基因的物质可为CRISPR/Cas9系统;所述CRISPR/Cas9系统包括重组表达载体;所述重组表达载体含有表达靶向所述蛋白质CsMAPK6的编码基因的gRNA的DNA分子。
上述应用中,所述gRNA的靶标序列可为SEQ ID No:1自5’末端起第359-380位所示。
实验证明,采用含有CsMAPK6基因编辑载体的重组农杆菌转化黄瓜品种9930,能够对CsMAPK6基因进行编辑,CsMAPK6基因通过CRISPR/Cas9核酸内切酶编辑之后,可造成CsMAPK6基因突变,当两条同源染色体的CsMAPK6基因均发生突变时,可以导致蛋白质CsMAPK6活性丧失;蛋白质CsMAPK6活性丧失形成株高降低的黄瓜,即矮化黄瓜。采用本发明的方法能够实现对黄瓜的CsMAPK6基因编辑,获得矮化黄瓜。由此可见,蛋白质CsMAPK6可以调控黄瓜的株高,本发明具有重要的应用价值。
附图说明
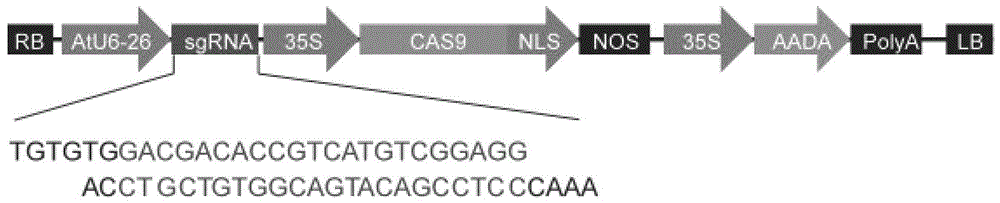
图1为CsMAPK6基因编辑载体的部分结构示意图。
图2为检测纯合突变株的突变类型。
图3为csmapk6突变体的表型及其株高统计结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
黄瓜品种9930记载于如下文献中:苗田田,李强,余宏军,刘鹏,郝佳,蒋卫杰.外施肌醇对黄瓜幼苗低温抗性的影响.中国蔬菜.2021,Vol.1,Issue(2):72-79.
CRISPR/CAS9载体构建试剂盒为杭州百格生物技术有限公司的产品,产品目录号为BGK03。
实施例1、蛋白质CsMAPK6及其编码基因的发现
本发明的发明人经过大量实验,从黄瓜品种9930中发现了CsMAPK6基因。黄瓜品种9930的基因组DNA中,CsMAPK6基因的核苷酸序列如SEQ ID NO:1所示。黄瓜品种9930的cDNA中,CsMAPK6基因的核苷酸序列如SEQ ID NO:2所示。CsMAPK6基因编码蛋白质CsMAPK6,蛋白质CsMAPK6的氨基酸序列如SEQ ID NO:3所示。
实施例2、矮化黄瓜突变株的培育及其验证
利用SEQ ID NO:1所示的CsMAPK6基因的核苷酸序列在E-CRISPR网站(http://www.e-crisp.org/E-CRISP/designcrispr.html)进行靶点设计,得到靶点。本实施例选择其中1个靶点进行实验。靶点序列为:5’-GACGACACCGTCATGTCGGAGG-3’(即SEQ ID No:1自5’末端起第359-380位或SEQ ID No:2自5’末端起第28-49位),对应靶基因为CsMAPK6基因。
一、CsMAPK6基因编辑载体的构建
1、根据靶点设计并合成引物F:5’-TGTGTGGACGACACCGTCATGTCGGAGG-3’和引物R:5’-AAACCCTCCGACATGACGGTGTCGTCCA-3’。分别将引物F和引物R用水稀释至10μM,依次得到引物F稀释液和引物R稀释液。
2、完成步骤1后,取离心管,加入1μL引物F稀释液、1μL引物R稀释液和18μLBufferAneal(CRISPR/CAS9载体构建试剂盒中的组件),充分混匀并短暂离心;之后先95℃处理3min,然后用PCR仪以0.2℃/s缓慢降温至20℃,得到oligo二聚体。
3、完成步骤2后,将oligo二聚体和CRISPR/Cas Vector(CRISPR/CAS9载体构建试剂盒中的组件)进行连接,得到CsMAPK6基因编辑载体。
连接体系为10μL,由1μL oligo二聚体、2μL CRISPR/Cas Vector、1μLBsaI EnzymeMix(CRISPR/CAS9载体构建试剂盒中的组件)和ddH
连接程序为20℃静置1h。
将CsMAPK6基因编辑载体进行测序。测序结果表明,CsMAPK6基因编辑载体为将SEQID No:4所示的DNA双链分子插入CRISPR/Cas Vector的限制性内切酶BsaI的识别位点,得到的重组质粒。
SEQ ID No:4:
AAGGCGATTAAGTTGGGTAACGCCAGGGTTTTCCCAGTCACGACGTTGTAAAAC
GACGGCCAGTGCCAAGCTTCATTCGGAGTTTTTGTATCTTGTTTCATAGTTTGTC
CCAGGATTAGAATGATTAGGCATCGAACCTTCAAGAATTTGATTGAATAAAACA
TCTTCATTCTTAAGATATGAAGATAATCTTCAAAAGGCCCCTGGGAATCTGAAA
GAAGAGAAGCAGGCCCATTTATATGGGAAAGAACAATAGTATTTCTTATATAG
GCCCATTTAAGTTGAAAACAATCTTCAAAAGTCCCACATCGCTTAGATAAGAAA
ACGAAGCTGAGTTTATATACAGCTAGAGTCGAAGTAGTGATTGGACGACACCGT
CATGTCGGGTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTAT
CAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTTTT
CsMAPK6基因编辑载体的部分结构示意图见图1。
二、重组农杆菌的获得
1、将CsMAPK6基因编辑载体导入农杆菌GV3101,得到重组农杆菌,命名为GV3101/CsMAPK6。
2、将CRISPR/Cas Vector导入农杆菌GV3101,得到重组农杆菌,命名为GV3101/CRISPR。
三、csmapk6突变体的获得
由于黄瓜是二倍体植株,当Cas9发挥作用开始剪切特定的基因时,同一个细胞内的两条同源染色体上的两个等位基因都有可能被编辑,产生同样类型或不同类型的突变,所以将一个植株中两个等位基因看成是两个基因编辑事件。纯合突变株指的是该植株的两条同源染色体的CsMAPK6基因发生了相同的突变。双等位基因突变株指的是该植株的两条同源染色体的CsMAPK6基因均发生了突变但突变形式不同。杂合突变株数指的是该植株的两条同源染色体中的一条同源染色体的CsMAPK6基因发生了突变、另一条同源染色体的CsMAPK6基因未发生突变。野生型指的是该植株的两条同源染色体中的CsMAPK6基因均未发生突变。
1、T
(1)选饱满完整的黄瓜品种9930的种子,剥皮后,先在70%(v/v)乙醇水溶液中消毒30s,再置于2.0%次氯酸钠溶液中杀菌15min,最后用无菌水冲洗数遍后播在MS固体培养基上,待其子叶刚刚破壳后(约2-3d),切去生长点及下胚轴,两片子叶均切去上半部分,留取子叶下半部分作为子叶外植体。
MS固体培养基:将MS粉4.43g和蔗糖30g溶于适量去离子水,再加入植物凝胶2.5g,用去离子水定容至1L,调节pH值至5.7-5.8。
(2)将GV3101/CsMAPK6的单菌落接种于含50mg/L卡那霉素和70mg/L利福平的YEB液体培养基,28℃、200rpm/min振荡过夜,得到菌液1。将2mL菌液1加入50mL含50mg/L卡那霉素和70mg/L利福平的YEB液体培养基,28℃振荡培养,得到OD
1/2MS液体培养基:将MS粉2.2g和蔗糖30g溶于适量去离子水,再用去离子水定容至1L,调节pH值至5.7-5.8。
(3)用步骤(2)得到的侵染液侵染子叶外植体15min。侵染结束后用灭菌的滤纸吸干多余侵染液,将子叶外植体背朝下接种于MS分化培养基,28℃暗培养2d。
MS分化培养基:将MS粉4.43g、蔗糖30g、植物凝胶2.5g、6-BA0.5 mg和ABA 1mg溶于适量去离子水,再用去离子水定容至1L,调节pH值至5.7-5.8。
(4)完成步骤(3)后,将子叶外植体转入含卡那霉素25mg/L和羧苄青霉素500mg/L的MS分化培养基,28℃光暗交替培养(16h光照培养/8h暗培养,光照强度为2000lx)15-20d,得到1-1.5cm左右的抗性芽。
(5)完成步骤(4)后,切下抗性芽并将其移入含卡那霉素100mg/L的MS生根培养基诱导生根,获得5-6片叶的抗性黄瓜苗(此时黄瓜根系发育良好)。
MS生根培养基:将MS粉4.43g、蔗糖30g和植物凝胶2.5g溶于适量去离子水,再用去离子水定容至1L,调节pH值至5.7-5.8。
(6)完成步骤(5)后,将抗性黄瓜苗移入盛有无菌土的花盆中,并用保鲜膜遮盖以保持水分,在人工气候室培养一周,然后移到温室在温室适应3-5d,最后移到温室中常规管理,得到T
2、T
(1)T
(2)分别将T
按照上述步骤,将GV3101/CsMAPK6替换为GV3101/CRISPR,其它步骤均不变,得到T
3、T
(1)分别以T
(2)分别将PCR扩增产物进行测序。测序结果与CsMAPK6基因(SEQ ID No:2所示)Cas9目标序列进行比对,统计突变类型。
其中获得1株纯合突变株。该纯合突变株的两条同源染色体的CsMAPK6基因发生了相同的突变,具体为两条同源染色体上在CsMAPK6基因的编码区均发生了“T”1个核苷酸的插入(即SEQ ID No:2自5’末端起第41至42位核苷酸之间插入了1个T),从而引起了移码,导致蛋白质CsMAPK6的功能缺失。该纯合突变株的部分测序结果见图2(csmapk6为纯合突变株,9930为黄瓜品种9930)。
该纯合突变株即为csmapk6突变体。
四、检测csmapk6突变体的株高
实验重复三次,每次统计3株黄瓜幼苗。每次实验步骤如下:
1、取待测黄瓜种子(csmapk6突变体的T
2、完成步骤1后,为尽可能的保证实验条件一致,将生长状态基本一致的待测黄瓜幼苗转移置温室,常规培养。分别在播种起第22天、第29天和第36天观察并记录表型,并统计株高。
部分结果见图3(*为P<0.05,***为P<0.001,****为P<0.0001,csmapk6为csmapk6突变体,9930为黄瓜品种9930)。结果表明,与黄瓜品种9930相比,csmapk6突变体的株高显著降低;黄瓜品种9930和T
黄瓜为二倍体植物,CsMAPK6基因通过CRISPR/Cas9核酸内切酶编辑之后,可造成CsMAPK6基因突变,当两条同源染色体的CsMAPK6基因均发生突变时,可以导致蛋白质CsMAPK6活性丧失;蛋白质CsMAPK6活性丧失形成株高降低的黄瓜,即矮化黄瓜种质。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。
- 一种非侵入式电力负荷监测装置
- 一种非侵入式电力负荷报警监测方法及系统
- 一种非侵入式用电负荷分析方法及装置
- 一种用于非侵入式负荷辨识的负荷事件检测的数据处理方法及设备
- 一种非侵入式的负荷监测方法、装置、设备及存储介质
- 一种非侵入式负荷监测方法、装置及介质
