特异性靶向真菌烯醇化酶1的单克隆抗体及其制备与应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明属于单克隆抗体技术、免疫学技术和生物医药领域,具体涉及一种特异性靶向真菌烯醇化酶1的单克隆抗体及其制备与应用。
背景技术
系统性真菌感染是当前危害人类健康的重大疾病之一,其中白念珠菌是引起侵袭性真菌感染最常见的致病菌。尤其,对于严重烧伤患者、艾滋病人、长期使用免疫抑制剂等出现免疫力缺陷或正常菌群失调的病人。2022年10月,世界卫生组织发布了首份真菌重点病原体清单,将真菌病原体分为三个优先级:极度优先级、高度优先级和中度优先级;其中的极度优先级关注的病原真菌包括白念珠菌(Candida albicans)、烟曲霉菌(Aspergillusfumigatus)、新生隐球菌(Cryptococcus neoformans)和耳念珠菌(Candida auris)。
在中国,从中国医院侵袭性真菌监测网CHIF-NET最新总结的数据中可发现:全国58家中心医院样品中收集到的菌种统计达53种菌,其中89%为念珠菌属,而白念珠菌占比达38.2%。其血液样品中的菌种统计结果也以白念珠菌为主,占比为31.2%,显示白念珠菌仍是我国侵袭性致病真菌中最常见的致病菌。当前,缺乏早期特异性诊断学技术与低毒有效抗真菌药物是系统性真菌感染给临床诊疗带来的最大麻烦。
目前临床上主要的抗真菌药物有:多烯类(两性霉素B)、唑类(如氟康唑)和棘白菌素类(卡泊芬净)等,但即使在发达国家如北美和欧洲地区,系统性白念珠菌血症的死亡率仍高达40%。为第一时间抢救患者,防止错过最佳时机,临床上常常被迫使用大量抗真菌药物优先治疗,应用较多的仍然是唑类药物(氟康唑),但唑类药物属于抑菌剂,临床上的长期应用使真菌对唑类药物呈高度耐药性,敏感性下降几十倍。然而,当今新型抗真菌药物的发展十分缓慢,自1950年代发现第一个抗真菌药物制霉菌素(Nystatin),到本世纪初棘白菌素类药物(卡泊芬净、米卡芬净和阿尼芬净等)上市至今,国内外尚未报道新作用靶点的药物上市。白念珠菌以侵袭免疫功能缺陷或低下的宿主为主,抗体疗法可增强宿主被动免疫力而显得极其重要,所以开发具有高效抗真菌活性且增强机体免疫力的单克隆抗体能成为预防和治疗真菌感染的重要手段。
烯醇化酶(Enolase,Eno),又称2-磷酸-D-甘油酯水解酶(2-phospho-D-glyceratehydrolyase),在胞浆糖酵解过程中负责催化2-磷酸甘油酸(2-Phosphoglyceric acid,2PG)向磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)的转化,对生物体的生长和代谢十分重要。烯醇化酶在不同物种中可能被多个基因所编码。例如,人的基因组中至少有4个编码enolase的基因(ENO1,ENO2,ENO3和ENO4),在酿酒酵母的基因组中也至少含有5个,即ENO1、ENO2、ERR1(Enolase-Related Region 1)、ERR2和ERR3等。然而,在白念珠菌基因组中,只有唯一的enolase编码基因ENO1,且编码的蛋白只有一个白念珠菌Eno1(CaEno1)。CaEno1是白念珠菌中含量最高的蛋白,也是一种多功能蛋白,在白念珠菌细胞内和细胞表面均有分布。细胞表面的Eno1属于细胞壁整合蛋白,被认为是主要的细胞表面抗原和毒力因子,参与了白念珠菌侵袭性感染形成,宿主感染后会因刺激而可以产生保护性抗体。Pitarch等的研究发现,抗Eno1抗体出现在侵袭性念珠菌感染动物模型及临床患者血清中,且在预后较好的念珠菌血症病人血清中含有高滴度的真菌Eno1抗体,提示念珠菌病人血清中的Eno1-IgG在念珠菌血症诊断中具有很大潜力。另有研究发现,经CaEno1免疫的小鼠再次感染白念珠菌时其肾脏组织的载菌量会显著减少,且小鼠存活率明显增加。
综上,CaEno1对真菌细胞自身生长、毒力、致病力等十分重要。CaEno1的定位与哺乳动物细胞不同:CaEno1在细胞内与细胞表面均大量存在,而哺乳动物细胞Eno1则只存在于细胞胞浆中。以CaEno1为靶点,筛选和设计特异性单克隆抗体药物不会影响人体细胞Eno1蛋白功能,比小分子化合物药物更具优势(小分子化合物药物能穿过人体细胞膜影响胞内Eno1蛋白功能)。因此,CaEno1是作为开发治疗侵袭性白念珠菌感染的抗体药物的理想靶点。
现有技术中,尽管在过去的30多年里,科学家们开展了大量基于单克隆抗体免疫疗法抗真菌感染的药物研究工作,然而到现在仍旧没有一款抗真菌的抗体药物获得批准进入市场。2018年安毛毛教授申请了"抗Eno1抗体及其用途”专利(申请号:201811471173.6),但是该专利仅仅报道了其抗体能与已知抗真菌药物(阿尼芬净)合用的效果,没有验证其单独使用的抗真菌效果,并且也没有其抗体与其它抗真菌药合用的结果。另外,也未用验证其抗体是否能与真菌细胞结合。
发明内容
本发明是为了解决上述问题而进行的,目的在于提供一种特异性靶向真菌烯醇化酶1的单克隆抗体及其制备与应用。
本发明提供了一种特异性靶向真菌烯醇化酶1的单克隆抗体,具有这样的特征:特异性靶向真菌烯醇化酶1的单克隆抗体包含重链可变区和轻链可变区,其中,重链可变区的氨基酸序列如SEQ ID NO:1所示:
MKLWLNWIFLVTLLNGIQCEVKLVESGGGLVQPGGSLRISCATSGFTFTDYYMSWVRQPPGKALEWLGFIRNKTKGYTTQYSASVKGRFTISRDNSQSILYLQMNTLRAEDSATYYCARDDDGVRFAYWGQGTLVTVSA,
重链可变区包含互补决定区HCDR1、HCDR2、HCDR3,HCDR1的氨基酸序列为:DYYMS,HCDR2的氨基酸序列为:FIRNKTKGYTTQYSASVKG,HCDR3的氨基酸序列为:DDDGVRFAY,
轻链可变区的氨基酸序列如SEQ ID NO:2所示,
MKLPVRLLVLMFWIPASSSDVVMTQTPLSLPVSLGDQASISCR SSQSLIHRNGNTYLHWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGS GSGTDFTLKISRVEAEDLGVYFCSQSTHVPFTFGSGTKLEIK,
轻链可变区包含互补决定区LCDR1、LCDR2、LCDR3,LCDR1的氨基酸序列为:RSSQSLIHRNGNTYLH,LCDR1的氨基酸序列为:KVSNRFS,LCDR1的氨基酸序列为:SQSTHVPFT。
本发明还提供了编码上述的特异性靶向真菌烯醇化酶1的单克隆抗体的基因,具有这样的特征:编码重链可变区的核苷酸序列如SEQ ID NO:3所示:
ATGAAGTTGTGGCTGAACTGGATTTTCCTTGTAACACTTTTAAATGGTATCCAGTGTGAGGTGAAGCTGGTGGAGTCTGGAGGAGGCTTGGTACAGCCTGGGGGTTCTCTGAGAATCTCCTGTGCAACTTCTGGATTCACCTTCACTGATTACTACATGAGCTGGGTCCGCCAGCCTCCAGGAAAGGCACTTGAGTGGTTGGGTTTTATTAGAAACAAAACTAAAGGTTACACAACACAGTACAGTGCATCTGTGAAGGGTCGGTTCACTATCTCCAGAGATAACTCCCAAAGTATCCTCTATCTTCAAATGAACACCCTGAGAGCTGAGGACAGTGCCACTTATTACTGTGCAAGAGATGATGACGGCGTCCGGTTTGCTTACTGGGGCCAAGGGACTCTGGTCACTGTCTCTGCA,
HCDR1的核苷酸序列为:GATTACTACATGAGC,
HCDR2的核苷酸序列为:
TTTATTAGAAACAAAACTAAAGGTTACACAACACAGTACA GTGCATCTGTGAAGGGT,
HCDR3的核苷酸序列为:
GATGATGACGGCGTCCGGTTTGCTTAC,
编码轻链可变区的核苷酸序列如SEQ ID NO:4所示:
ATGAAGTTGCCTGTTAGGCTGTTGGTGCTGATGTTCTGGATTCCTGCTTCCAGCAGTGATGTTGTGATGACCCAAACTCCACTCTCCCTGCCTGTCAGTCTTGGAGATCAAGCCTCCATCTCTTGCCGATCTAGTCAGAGCCTTATACACAGAAATGGAAACACCTATTTACATTGGTACCTGCAGAAGCCAGGCCAGTCTCCAAAGCTCCTGATCTACAAAGTTTCCAACCGATTTTCTGGGGTCCCAGACAGGTTCAGTGGCAGTGGATCAGGGACAGATTTCACACTCAAGATCAGCAGAGTGGAGGCTGAGGATCTGGGAGTTTATTTCTGCTCTCAAAGTACACATGTTCCATTCACGTTCGGCTCGGGGACAAAGTTGGAAATAAAA,
LCDR1的核苷酸序列为:
CGATCTAGTCAGAGCCTTATACACAGAAATGGAAACACCTA TTTACAT,
LCDR2的核苷酸序列为:
AAAGTTTCCAACCGATTTTCT,
LCDR3的核苷酸序列为:
TCTCAAAGTACACATGTTCCATTCACG。
本发明还提供了一种特异性靶向真菌烯醇化酶1的单克隆抗体的制备方法,具有这样的特征,包括以下步骤:
步骤S1,通过原核表达系统表达纯化得到白念珠菌Eno1全长蛋白分子;
步骤S2,以白念珠菌Eno1全长蛋白分子为抗原,对BALB/c雌性小鼠进行免疫,得到免疫小鼠并取免疫小鼠的脾脏细胞,采用杂交瘤方法制备杂交瘤细胞株,再分别通过一次、二次亚克隆筛选,获得特异性靶向CaEno1的Eno1单克隆抗体及其Eno1单克隆抗体细胞株。
本发明还提供了一种诊断真菌感染的方法,包括将特异性靶向真菌烯醇化酶1的单克隆抗体或其片段与来自受试者的样品相接触。
本发明还提供了特异性靶向真菌烯醇化酶1的单克隆抗体在制备抗真菌感染药物以及抗真菌感染药物增效剂中的应用。
进一步地,本发明提供了特异性靶向真菌烯醇化酶1的单克隆抗体或其抗体片段在制备用于预防或治疗侵袭性真菌感染(如白念珠菌)的抗真菌感染药物以及抗真菌感染药物增效剂中的应用。
进一步地,上述抗真菌感染药物增效剂与抗真菌小分子化合物药物(如氟康唑等)组成组合药物。
发明的作用与效果
根据本发明所涉及的特异性靶向真菌烯醇化酶1的单克隆抗体及其制备与应用,本发明分别提供了特异性靶向真菌烯醇化酶1的单克隆抗体的重链可变区氨基酸序列和轻链可变区氨基酸序列,与已有专利的序列完全不同。本发明中的特异性靶向真菌烯醇化酶1的单克隆抗体的单克隆抗体或其抗体片段不仅能与真菌Eno1蛋白高亲和力结合,还能与真菌细胞结合,从而抑制真菌对宿主细胞的黏附、感染和侵袭。
同时,本发明提供的单克隆抗体具有特异性强和药效好的特点,该单克隆抗体在单独使用时即可显著治疗侵袭性真菌感染,并且在与现有抗真菌小分子化合物药物联合使用时也可以显著增强小分子化合物药物的药效,达到更好的治疗效果。
附图说明
图1是本发明的实施例中的含6*His-tag融合标签的白念珠菌Eno1重组蛋白的表达;
图2是本发明的实施例中的白念珠菌Eno1重组蛋白的纯化时的电泳图;
图3是本发明的实施例中的小鼠免疫与单克隆抗体细胞株的筛选时的结合反应检测结果;
图4是本发明的实施例中的ELISA法检测单克隆抗体与白念珠菌Eno1抗原的结合的检测结果;
图5是本发明的实施例中的ELISA法检测单克隆抗体ENO1-B与白念珠菌Eno1抗原的结合的检测结果;
图6是本发明的实施例中的流式细胞术检测单克隆抗体与白念珠菌结合作用的检测结果;
图7是本发明的实施例中的单克隆抗体抑制真菌SC5314对细胞的黏附的检测结果;
图8是本发明的实施例中的念珠菌系统感染小鼠模型构建及单克隆抗体体内药效检测的活菌落数目检测结果;
图9是本发明的实施例中的念珠菌系统感染小鼠模型构建及单克隆抗体体内药效检测的小鼠存活时间检测结果。
具体实施方式
本发明的一种特异性靶向真菌烯醇化酶1的单克隆抗体的制备方法,包括以下步骤:步骤S1,通过原核表达系统(大肠杆菌系统)表达纯化了白念珠菌Eno1(Candidaalbicans Eno1,CaEno1)全长蛋白分子。步骤S2,以白念珠菌Eno1(Candida albicansEno1,CaEno1)全长蛋白分子为抗原,对BALB/c雌性小鼠进行免疫,取免疫小鼠的脾脏细胞,采用经典杂交瘤技术制备杂交瘤细胞株,再通过一次、二次亚克隆筛选,获得特异性靶向CaEno1的具有高亲和力和生物学活性的Eno1单克隆抗体及其Eno1单克隆抗体细胞株。最后,对Eno1单克隆抗体细胞株进行亚型鉴定和抗体测序,确认Eno1单克隆抗体ENO1-B的亚型(IgG2亚型)和重链轻链序列组成。
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下实施例结合附图对本发明的特异性靶向真菌烯醇化酶1的单克隆抗体及其制备与应用作具体阐述。
实施例1:含6*His-tag融合标签的白念珠菌Eno1重组蛋白的表达
以白念珠菌Eno1全蛋白氨基酸序列为目的序列,通过公司人工合成白念珠菌Eno1全蛋白的基因序列,利用酶切位点(5’Nde I和3’Xho I)将白念珠菌Eno1全蛋白基因序列克隆至含6*His-tag标签的pET-21a(+)质粒中。经测序鉴定后,将含准确目标序列的重组质粒转化至大肠杆菌感受态细胞BL21(DE3)pLysS中,接种于LB固体培养基(含100μg/mlAmpicillin)上培养,在第二天从LB抗性平板中挑取单克隆菌落于LB液体培养基(含100μg/ml Ampicillin)中,在37℃摇床内振荡培养8-12h。按照1:100的比例将菌液接种至100mlLB液体培养基(含100μg/ml Ampicillin)中,于37℃摇床内,240rpm振荡培养。当菌液OD600nm值达0.6-0.8时,向菌液中加入IPTG,至其终浓度为0.1-0.5mM,并于16℃诱导过夜,或25℃诱导12h,或37℃诱导4-6h。收集上述诱导菌液,于4℃离心机,13000rpm离心5-10min,弃上清,收集菌体,于-80℃冻存,待用。含6*His-tag融合标签的白念珠菌Eno1重组蛋白的表达如图1所示。
Eno1蛋白全长氨基酸序列:
MSYATKIHARYVYDSRGNPTVEVDFTTDKGLFRSIVPSGASTGVHEALELRDGDKSKWLGKGVLKAVANVNDIIAPALIKAKIDVVDQAKIDEFLLSLDGTPNKSKLGANAILGVSLAAANAAAAAQGIPLYKHIANISNAKKGKFVLPVPFQNVLNGGSHAGGALAFQEFMIAPTGVSTFSEALRIGSEVYHNLKSLTKKKYGQSAGNVGDEGGVAPDIKTPKEALDLIMDAIDKAGYKGKVGIAMDVASSEFYKDGKYDLDFKNPESDPSKWLSGPQLADLYEQLISEYPIVSIEDPFAEDDWDAWVHFFERVGDKIQIVGDDLTVTNPTRIKTAIEKKAANALLLKVNQIGTLTESIQAANDSYAAGWGVMVSHRSGETEDTFIADLSVGLRSGQIKTGAPARSERLAKLNQILRIEEELGSEAIYAGKDFQKASQL
6*His-tag的白念珠菌Eno1重组蛋白的基因序列:
CATATG
实施例2:白念珠菌Eno1重组蛋白的纯化
用灭菌PBS(pH=7.4)重悬-80℃冻存的菌体。在冰水混合浴条件下超声破碎(200W,工作5s,间歇10s,总时间10min)至菌液澄清透光,13000rpm,4℃离心30min,收集上清。取少量上清样品通过SDS-PAGE电泳检测重组蛋白表达情况,电泳图如图2所示。
SDS-PAGE电泳验证重组蛋白大量表达前提下,先用0.22μm滤器将上清过滤除菌,然后向上清中加入Ni-NTAAgarose亲和柱,于混合仪上室温混合反应60min,然后将混合物于室温静置,使已结合重组蛋白的Ni-NTAAgarose亲和柱在重力作用下自然沉降,吸弃混合物上清,用过滤除菌PBS(pH=7.4)洗涤Ni-NTAAgarose亲和柱三次后并重悬,加入到填料柱中。先用5倍体积的BD液(含咪唑浓度30mM)洗涤至考马斯亮蓝染色液滴入的穿透液不变蓝。然后用5倍体积的BB液(含咪唑浓度150mM)洗脱目的蛋白,并收样。经Ni-NTAAgarose亲和柱纯化的蛋白,进一步通过分子筛HiLoad 16/60Superdex 200prep grade column(GEHealthcare)纯化。蛋白定量后,按照100μl/管分装后置于-80℃保存待用。
实施例3:小鼠免疫与单克隆抗体细胞株的筛选、鉴定及抗体序列测定
以白念珠菌Eno1重组蛋白作为抗原,免疫3只BALB/c小鼠(免疫4次+加强免疫1次),ELISA检测小鼠血清,选择符合质量要求(1:4000稀释,OD450nm值>1)的小鼠,在无菌条件下取其脾脏,将脾脏细胞与Sp2/0骨髓瘤细胞进行融合,接种于96孔板(铺有饲养细胞)。通过加入选择性培养基培养,成功获得融合细胞,即为杂交瘤细胞。从96孔板中取杂交瘤细胞培养上清,ELISA检测每孔的抗体-抗原结合反应强弱(提前1天包被白念珠菌Eno1重组蛋白抗原),检测结果如图3A所示,挑取结合反应强(即OD450nm值大,阳性克隆)孔中的融合细胞,采用有限稀释法在96孔板中进行亚克隆筛选和培养(一次亚克隆)。同样用ELISA检测一次亚克隆筛选板中每孔的抗体-抗原结合反应强弱,检测结果如图3B所示,挑取OD450nm值大的一次亚克隆细胞培养后,在96孔板中再进行二次亚克隆筛选,并用ELISA检测每孔的抗体-抗原结合反应强弱,检测结果如图3C所示,结合杂交瘤细胞状态、质量及生长情况等特点,挑选合适的二次亚克隆杂交瘤细胞株进行扩增培养和冻存。在对二次亚克隆杂交瘤细胞株进行亚型鉴定后,提取杂交瘤细胞株的总RNA,通过5’RACE技术进行抗体测序,确认杂交瘤细胞株为产单克隆抗体杂交瘤细胞株。
实施例4:ELISA法检测单克隆抗体与白念珠菌Eno1抗原的结合
于ELISA专用酶标板(Nunc-Immuno,96-well plate)中,每孔加入100μl蛋白稀释液,包被0.1μg CaEno1抗原。然后将加好样的酶标板置于4℃冰箱中过夜。倒掉板中液体,向每孔中加满PBST(PBS+0.05%Tween-20),静置1min后拍干,重复五次,后倒扣静置5min;随后向每孔加入200μl 5%(v/w)BSA封闭液,于37℃培养箱中放置1h进行封闭,PBST洗板五次,每次静置1min,后倒扣静置5min;在96孔板第一排孔中加入不同待测单克隆样品(起始浓度一致),从左至右2倍倍比稀释后,置于4℃冰箱中孵育过夜,PBST洗板五次,每次静置1min,后倒扣静置5min;每孔加入100μl抗小鼠二抗(辣根过氧化物酶HRP山羊抗小鼠IgG)稀释液(1:10000),于37℃培养箱反应1h,PBST洗板五次,每次静置2min,后倒扣静置5min;避光情况下,于每孔加入100μl TMB底物(ELISA试剂盒中的Substrate solution),于37℃培养箱静置孵育反应30min。向每孔加入50μl的1M H
图4是本发明的实施例中的ELISA法检测单克隆抗体与白念珠菌Eno1抗原的结合的检测结果,图5是本发明的实施例中的ELISA法检测单克隆抗体ENO1-B与白念珠菌Eno1抗原的结合的检测结果。
如图4和图5所示,抗原-抗体相互作用研究显示ENO1-B单抗能够特异性地与抗原白念珠菌Eno1结合,且具有高亲和力。
实施例5:流式细胞术检测单克隆抗体与白念珠菌结合作用
从-80℃中取出标准菌株SC5314,在SDA板上活化两代,于YPD液体培养基中30℃振荡培养12-16h。取过夜菌液,5000rpm,离心2-3min,弃上清,用含2%BSA的灭菌PBS洗3次后重悬菌体,向每个1.5ml的EP管中各加入500μl菌液,吹打混匀,使菌液终浓度为2×10
图6是本发明的实施例中的流式细胞术检测单克隆抗体与白念珠菌结合作用的检测结果。
如图6所示,流式细胞术检测结果表明ENO1-B单抗能与白念珠菌细胞结合,并随着ENO1-B单抗浓度增加,结合的白念珠菌细胞越多,存在剂量依赖关系。
实施例6:抗体影响白念珠菌对细胞的粘附
取用YPD液体培养基培养12h的白念珠菌SC5314,于4℃,3000rpm,离心5min,弃上清收集菌体。用灭菌的PBS(pH=7.4)洗涤菌体3次,并在4℃下,3000rpm,离心5min,收集菌体,用含10%胎牛血清(FBS)的DMEM培养液重悬菌体。使用移液器轻轻吹打菌悬液60次,打散菌体,使之成均匀的单个菌细胞分布的菌液,然后用血球计数皿计数至2×10
图7是本发明的实施例中的单克隆抗体抑制真菌SC5314对细胞的黏附的检测结果。
如图7所示,白念珠菌与人细胞相互作用研究结果发现,ENO1-B单抗能显著降低白念珠菌对细胞的粘附作用。
实施例7:念珠菌系统感染小鼠模型构建及单克隆抗体体内药效检测
将标准菌株SC5314在SDA板上活化2次后,挑取单克隆菌落接种于YPD液体培养基中30℃振荡培养(200rpm/min)培养过夜(16h)。于4℃,3000-5000rpm离心5min收集菌体,用灭菌PBS洗菌体3次,并用灭菌PBS重悬菌体,通过血球计数板计数,调整菌浓度为5×10
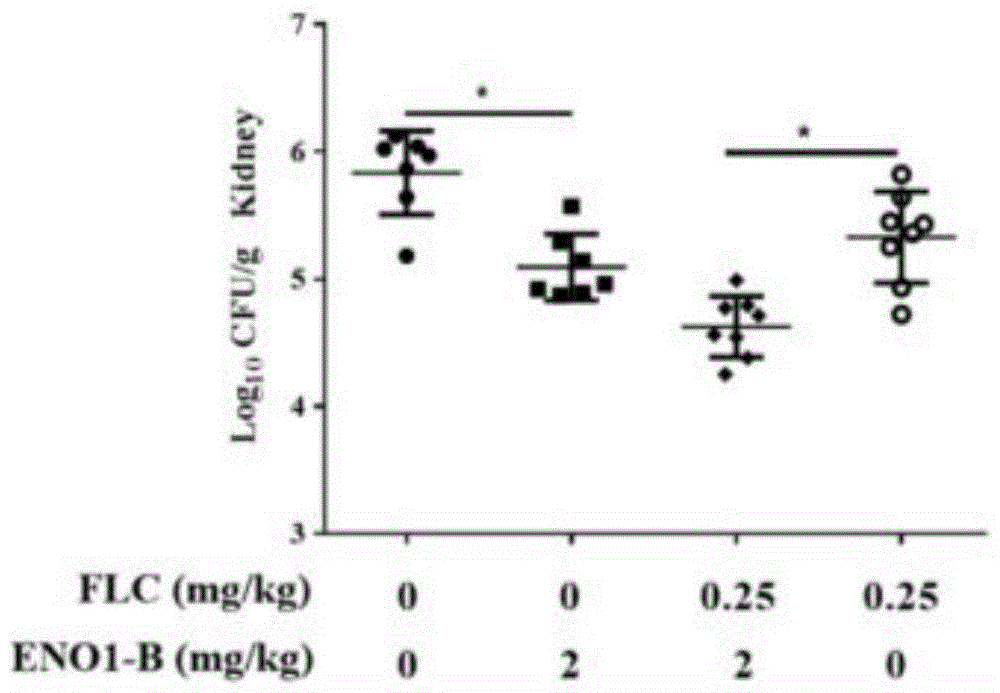
图8是本发明的实施例中的念珠菌系统感染小鼠模型构建及单克隆抗体体内药效检测的活菌落数目检测结果;图9是本发明的实施例中的念珠菌系统感染小鼠模型构建及单克隆抗体体内药效检测的小鼠存活时间检测结果。
如图8和图9所示,小鼠体内研究结果发现,ENO1-B单抗不仅在单独使用时可以显著降低白念珠菌系统感染小鼠肾脏组织载菌量和延长感染小鼠生存时间,而且在与氟康唑联合使用时,与氟康唑单独作用比较,能够显著降低白念珠菌系统感染小鼠肾脏组织载菌量并延长感染小鼠生存时间,进一步显著增强了氟康唑的体内药效,起到增效剂的作用。
实施例的作用与效果
根据实施例1-7,制备得到的ENO1-B单克隆抗体后,以临床条件致病真菌白念珠菌(Candida albicans)为模式生物,对实施例中制备得到的ENO1-B单克隆抗体的抗真菌感染药效进行了体外和体内研究,根据体外研究结果可知:实施例中得到的ENO1-B单抗能够特异性地与抗原白念珠菌Eno1结合,且具有高亲和力;同时能与白念珠菌细胞结合,并随着ENO1-B单抗浓度增加,结合的白念珠菌细胞越多,存在剂量依赖关系;并且还能显著降低白念珠菌对细胞的粘附作用。根据小鼠体内研究结果可知,实施例中得到的ENO1-B单抗不仅在单独使用时可以显著降低白念珠菌系统感染小鼠肾脏组织载菌量和延长感染小鼠生存时间,而且在与氟康唑联合使用时,与氟康唑单独作用比较,显著降低白念珠菌系统感染小鼠肾脏组织载菌量并延长感染小鼠生存时间,进一步显著增强了氟康唑的体内药效,起到增效剂的作用。
因此,本发明的特异性靶向真菌烯醇化酶1的单克隆抗体有特异性结合致病真菌的能力,并能显著抑制致病真菌对宿主细胞的黏附作用,在单独使用及与已知抗真菌药联合使用均有显著抗真菌效果,并且该单克隆抗体的序列为全新的序列。
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
- 付费资源的管理方法、装置和系统
- 虚拟化系统中存储资源的管理方法和装置
- 基于自适应资源调配的地面健康管理方法、系统及装置
- 云数据系统中存储资源的管理方法和装置
- 分布式流式系统的资源管理方法、装置及可读存储介质
- 军事训练计划与资源联动管理方法、装置和系统
- 军事训练计划与军事训练档案的同步方法、装置和系统
