用于抗体高阶结构可比性的NMR方法
文献发布时间:2024-04-18 20:01:30
相关申请的交叉引用
本申请要求于2021年6月29日提交的美国临时专利申请第63/216,501号的优先权和权益,所述美国临时专利申请通过引用并入本文。
技术领域
本申请涉及用于比较核磁共振波谱的方法和其在生物技术产品制造中的应用。
背景技术
蛋白质治疗剂是复杂的药物,其安全性和疗效取决于多种关键质量属性,包含高阶结构(HOS)。表征HOS对于建立生物制药制造的一致性、检测制造变更中的过程相关变化以及建立生物治疗产品之间的可比性至关重要。
最近,已经开发了用于表征治疗性蛋白质如治疗性抗体中的HOS的核磁共振(NMR)波谱法。具体地说,2D异核相关方法允许在原子水平上详细和全面地报告蛋白质结构。在药物开发过程中对治疗性蛋白质进行分析具有一定的挑战性,因为药物制造的工作流程可能与同位素标记或富集不兼容,而同位素标记或富集可以用于增强NMR信号并促进NMR峰分配。替代地,可以应用高级分析方法来促进分配,或使用可能不需要峰分配的更广泛的统计指标来比较波谱。
样品制备、NMR技术、数据处理、数据后处理和数据分析都是目前正在开发的用于改进NMR对治疗性蛋白质的表征的领域。迄今为止,已经开发了用于治疗性蛋白质的单个批次间比较的方法。虽然在两个样品或过程之间进行比较是生物治剂制造过程的一个关键组成部分,但是当只分析一个代表性批次时,给定的过程中也可能存在变化,这种变化可能会被掩盖。了解这种变化并比较不同过程之间的变化对于选择和优化用于生物治剂开发的制造过程非常重要。
因此,应当理解,需要用于表征和比较制造治疗性蛋白质时的过程变异性的NMR方法。
发明内容
已经开发了用于比较多个制造过程的变异性的方法。过程平均的高阶结构简单可比性(ECHOS)-NMR方法允许对制造过程进行比较,而不会因任一过程的批次间变异性而产生失真。过程聚类的主成分分析(PCA)允许检测和比较每个制造过程内以及它们之间的变异性。按过程进行的PCA聚类进一步允许相对于每个主成分对所述过程变化进行统计分析。
本文公开了对NMR方法的另外的改进。使用IdeS作为消化酶用于NMR样品制备使得抗体片段化具有一致性,并产生相对于其它酶具有独特大小范围的片段。另外,与不使用IdeS或使用完整蛋白质获得的波谱分辨率相比,使用IdeS提高了波谱分辨率。还公开了一种噪声消除方法,所述方法简化了NMR波谱并允许对分析物信号进行更准确的统计分析。
本公开提供了一种用于比较蛋白质的制造过程的方法。在一些示例性实施例中,所述方法包括:(a)从至少两个制造过程中获得多个蛋白质样品;(b)制备所述样品用于NMR波谱法;(c)使制备的样品经受NMR实验;(d)从所述NMR实验中获得所述样品的NMR波谱;(e)对所述至少两个制造过程中的每个制造过程的所述波谱求平均;以及(f)比较来自所述至少两个制造过程的所述平均的NMR波谱,以检测蛋白质高阶结构的差异。
在一些方面,所述蛋白质样品包含抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、抗体药物缀合物、抗体/靶向药物缀合物、缀合的单克隆抗体、缀合的单克隆抗体片段或Fc融合蛋白质。
在一些方面,制备所述样品用于NMR波谱法可以包含使所述样品与至少一种水解剂接触的步骤。在具体方面,所述水解剂是酿脓链球菌免疫球蛋白降解酶(IdeS)或其变体。
在一些方面,所述NMR波谱是2D-NMR波谱。在具体方面,2D-NMR波谱是通过相关性波谱法(COSY)、总相关性波谱法(TOCSY)或核欧沃豪斯效应波谱法(NOESY)使用同核NMR实验获得的。在另一具体方面,2D-NMR波谱是通过
在一些其它方面,所述NMR波谱是3D-NMR波谱。在另一方面,所述NMR波谱是4D-NMR波谱。
在一些方面,所述比较包括对来自所述至少两个制造过程的所述平均的NMR波谱应用ECHOS-NMR。
在一些示例性实施例中,用于比较蛋白质的制造过程的方法包括:(a)从至少两个制造过程中获得多个蛋白质样品;(b)制备所述样品用于NMR波谱法;(c)使所述样品经受NMR实验;以及(d)使所得NMR波谱经受主成分分析以比较制造过程,从而检测一级、二级和三级结构以及高阶结构的差异。用于比较蛋白质的制造过程的方法也可以用于比较制造过程以检测蛋白质样品中的所述蛋白质的翻译后修饰的差异。
在一些方面,所述蛋白质可以是抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、抗体药物缀合物、抗体/靶向药物缀合物、缀合的单克隆抗体、缀合的单克隆抗体片段或Fc融合蛋白质。
在一些方面,制备所述样品用于NMR波谱法可以包含使所述样品与至少一种水解剂接触的步骤。在具体方面,所述水解剂是酿脓链球菌免疫球蛋白降解酶(IdeS)或其变体。在另外的方面,制备所述样品用于NMR波谱法可以包括将所述水解样品换成磷酸盐缓冲液的步骤。
在一些方面,所述NMR波谱是2D-NMR波谱。在具体方面,2D-NMR波谱是通过相关性波谱法(COSY)、总相关性波谱法(TOCSY)或核欧沃豪斯效应波谱法(NOESY)使用同核NMR实验获得的。在另一具体方面,2D-NMR波谱是通过
在一些方面,所述主成分分析中的所述NMR波谱按制造过程进行聚类。在具体方面,所述方法进一步包括使所述主成分分析聚类经受统计分析以比较制造过程。
在一些方面,所述方法进一步包括确定所述NMR波谱的促成使用主成分分析而测量的至少一个差异的至少一个区,其中所述区是通过在所述NMR波谱上绘制至少一个负载作为等值线图来确定的。
在一些方面,所述多个蛋白质样品可以是三个、四个、五个或多于五个。
本公开提供了另外一种用于表征蛋白质的方法。在一些示例性实施例中,所述方法包括:(a)获得蛋白质样品;(b)制备所述样品用于NMR波谱法;(c)使所述样品经受NMR实验;(d)从所得NMR波谱的空白区中消除噪声;以及(e)分析所述NMR波谱以表征蛋白质。
在一些方面,步骤(d)包括:(i)将NMR波谱分成箱;(ii)选择NMR波谱的空白区;(iii)确定所选区中的信号强度的标准偏差以设置噪声阈值;以及(iv)调整NMR波谱信号,使得信号是噪声阈值的四分之一的所有箱被设置为零。在具体方面,所述方法进一步包括从分析中排除强度为零的箱。
当结合以下描述和附图考虑时,将更好地认识和理解本发明的这些方面和其它方面。以下描述虽然表明各个实施例及其众多具体细节,但是以说明而非限制的方式给出的。在本发明的范围内可以进行许多替换、修改、添加或重新排列。
附图说明
图1A示出了根据示例性实施例的原始
图1B示出了根据示例性实施例的分箱
图1C示出了根据示例性实施例的
图1D示出了根据示例性实施例的
图1E示出了根据示例性实施例的具有经调整的强度以去除噪声的
图1F示出了根据示例性实施例的
图1G示出了根据示例性实施例的
图1H示出了根据示例性实施例的具有归一化强度的
图1I示出了根据示例性实施例的具有应用于分离的信号和噪声区的阈值的
图1J示出了根据示例性实施例的具有应用于所展示的信号和噪声区的阈值的
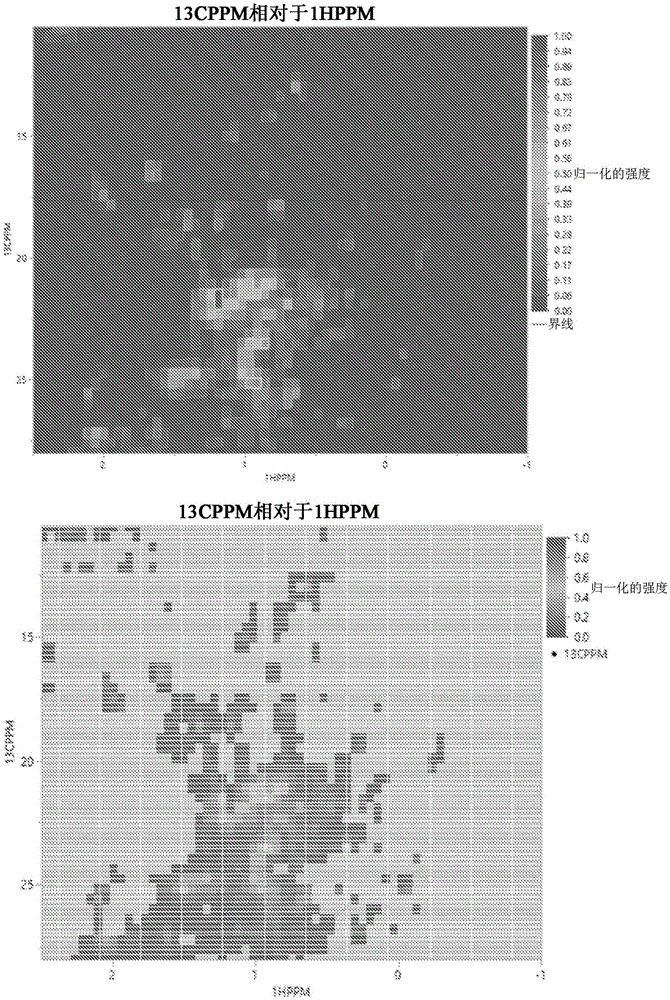
图2示出了根据示例性实施例的两种抗体和两个制造过程的平均和叠加的
图3示出了根据示例性实施例的两种抗体和两个制造过程的ECHOS-NMR分析,其中每种条件下平均有三个样品。
图4A示出了根据示例性实施例的两种抗体和两个制造过程的NMR波谱的居中PCA。
图4B示出了根据示例性实施例的mAb1和两个制造过程的NMR波谱的非居中PCA。
图4B示出了根据示例性实施例的mAb2和两个制造过程的NMR波谱的非居中PCA。
图4D示出了根据示例性实施例的两种抗体和两个制造过程的NMR波谱的PCA的统计分析。
具体实施方式
蛋白质治疗剂是复杂的药物,其安全性和疗效取决于多种关键质量属性(CQA)。一个此类属性是高阶结构(HOS),其包括药物的二级、三级和四级结构。表征HOS对于建立生物制药制造的一致性、检测制造变更中的过程相关变化以及建立生物治疗产品之间的可比性很重要。然而,测量蛋白质的HOS提出了重大的技术和分析挑战。与化学衍生且结构可以绝对确定的小分子药物不同,蛋白质治疗剂的HOS由于其大分子量、蛋白质动力学以及制造过程中的细微差异所引起的产品异质性而排除了绝对表征(Brinson等人,2019,《单克隆抗体(MAbs)》,11(1):94-105)。
通常用于表征mAb药物产品的HOS的方法包含傅里叶变换红外光谱法(FT-IR)和圆二色谱法(CD)。虽然这些方法中的一些可能适合于提供关于mAb的结构信息,但是它们对于蛋白质治疗剂的HOS表征具有几个缺点。CD的实际硬件限制需要相对于典型mAb调配物的稀释蛋白质浓度。CD的另一个问题是敏感性低,特别是在评估结构均匀的蛋白质(如IgG)时,尽管观测到了变化,但并不总是能够定位结构扰动。在这种较低浓度下获得的结果在多大程度上预示较高调配物浓度下的行为仍是未解决的问题。FT-IR可以在很宽的蛋白质浓度范围内操作,但它是一种仅表征二级结构的有限的单一属性方法,并且因此无法提供蛋白质结构的完整度量。类似于CD,FT-IR无法定位任何结构缺陷,从而使其成为相对低信息量的方法。使用FT-IR,NMR波谱通常具有良好的分散性,从而提供了可以定位到蛋白质序列的数百个独立读数。这两种技术的低波谱和结构分辨率也使得难以将波谱方差与结构方差相关联。另外,最近的研究对两种方法报告临床相关HOS方差的敏感性提出了质疑(Arbogast等人,2020,《蛋白质科学实验指南(Curr Protoc Protein Sci)》,100(1):e105)。
NMR波谱法已经成为研究蛋白质高阶结构的重要工具,但是其使用传统上依赖于利用
使用NMR方法表征蛋白质治疗剂是期望的,因为单次2D-NMR实验可以产生提供蛋白质治疗剂的一级、二级、三级和四级结构的全面原子级指纹的波谱图。正确折叠的蛋白质分子通常提供由单独的
虽然已经建立了使用NMR对生物治疗性蛋白质进行批次间比较的方法,但应用仅限于分析两个样品或过程之间的HOS差异。虽然在两个样品或过程之间进行比较是生物治剂制造过程的一个关键组成部分,但是给定的过程中也可能存在变化。能够比较两个或更多个不同过程的变异性,而不是比较每个过程的可能涵盖或可能不涵盖全部产品的一个单独批次,是尚未建立方法的重要实际考虑因素。因此,迫切需要用于比较抗体高阶结构中的制造过程变异性的方法。
本公开阐述了用于分析抗体制造过程的新颖方法。本文公开了对常规NMR方法的各种改进,包含使用IdeS作为消化酶、用于波谱降噪的方法、用于平均ECHOS-NMR的方法和用于NMR波谱的过程分组PCA的方法。
除非另外描述,否则本文所使用的所有技术术语和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。尽管类似或等效于本文所述的任何方法和材料的方法和材料可以用于实践或测试,但现在对特定方法和材料进行描述。
术语“一个(a)”应理解为意指“至少一个”,并且术语“约”和“大约”应理解为允许标准变化,如本领域普通技术人员将理解的,并且在提供范围的情况下,包含端点。如本文所使用的,术语“包含(include)”、“包含(includes)”和“包含(including)”意指是非限制性的,并且被理解为分别意指“包括(comprise)”、“包括(comprises)”和“包括(comprising)”。
如本文所使用的,术语“蛋白质”或“药物蛋白质产品”可以包含具有共价连接的酰胺键的任何氨基酸聚合物。蛋白质包括一个或多个氨基酸聚合物链,在本领域中通常称为“多肽”。“多肽”是指由氨基酸残基、相关的天然存在的结构变体以及通过肽键连接的其合成的非天然存在的类似物、相关的天然存在的结构变体及其合成的非天然存在的类似物构成的聚合物。“合成肽或多肽”是指非天然存在的肽或多肽。合成肽或多肽可以例如使用自动化多肽合成仪合成。各种固相肽合成方法是本领域的技术人员已知的。蛋白质可以包括一种或多种多肽以形成单一功能性生物分子。蛋白质可以包含抗体片段、纳米抗体、重组抗体嵌合体、细胞因子、趋化因子、肽激素等。所关注蛋白质可以包含以下中的任一种:生物治疗性蛋白质、用于研究或疗法的重组蛋白质、trap蛋白质和其它嵌合受体Fc融合蛋白质、嵌合蛋白质、抗体、单克隆抗体、多克隆抗体、人抗体和双特异性抗体。蛋白质可以使用基于重组细胞的生产系统来生产,如昆虫杆状病毒系统、酵母系统(例如,毕赤酵母(Pichiasp.))、哺乳动物系统(例如,CHO细胞和CHO衍生物,如CHO-K1细胞)。对于最近讨论生物治疗性蛋白质及其生产的综述,参见Ghaderi等人,“用于生物治疗性糖蛋白的生产平台-非人类唾液酸化的发生、影响和挑战(Production platforms for biotherapeuticglycoproteins.Occurrence,impact,and challenges of non-human sialylation)”(Darius Ghaderi等人,用于生物治疗性糖蛋白的生产平台-非人类唾液酸化的发生、影响和挑战),28《生物技术和基因工程综述(BIOTECHNOLOGY AND GENETIC ENGINEERINGREVIEWS)》147-176(2012),所述文献的全部教导内容并入本文)。蛋白质可以根据组成和溶解度来分类,并且因此可以包含简单蛋白质,如球状蛋白质和纤维状蛋白质;缀合蛋白质,如核蛋白、糖蛋白、粘蛋白、色蛋白、磷蛋白、金属蛋白和脂蛋白;以及衍生蛋白质,如初级衍生的蛋白质和次级衍生的蛋白质。
在一些示例性实施例中,治疗性蛋白质可以按以下量存在:约1mg/mL、约2mg/mL、约3mg/mL、约4mg/mL、约5mg/mL、约6mg/mL、约7mg/mL、约8mg/mL、约9mg/mL、约10mg/mL、约15mg/mL、约20mg/mL、约25mg/mL、约30mg/mL、约35mg/mL、约40mg/mL、约45mg/mL、约50mg/mL、约55mg/mL、约60mg/mL、约65mg/mL、约70mg/mL、约75mg/mL、约80mg/mL、约85mg/mL、约90mg/mL、约95mg/mL、约100mg/mL、约110mg/mL、约120mg/mL、约130mg/mL、约140mg/mL、约150mg/mL、约160mg/mL、约170mg/mL、约180mg/mL、约190mg/mL、约200mg/mL、约225mg/mL、约250mg/mL、约275mg/mL、约300mg/mL、约325mg/mL、约350mg/mL、约375mg/mL或约400mg/mL。
在一些示例性实施例中,治疗性蛋白质可以是重组蛋白质、抗体、双特异性抗体、多特异性抗体、抗体片段、单克隆抗体、融合蛋白质、scFv和其组合。
如本文所使用的,术语“重组蛋白质”是指由于在已经引入到合适的宿主细胞中的重组表达载体上携带的基因的转录和翻译而产生的蛋白质。在某些示例性实施例中,重组蛋白质可以是抗体,例如,嵌合抗体、人源化抗体或完全人抗体。在某些示例性实施例中,重组蛋白质可以是选自由以下组成的组的同型的抗体:IgG(例如,IgG1、IgG2、IgG3、IgG4)、IgM、IgA1、IgA2、IgD或IgE。在某些示例性实施例中,抗体分子是全长抗体(例如,IgG1或IgG4免疫球蛋白),或者可替代地抗体可以是片段(例如,Fc片段或Fab片段)。
如本文所使用的术语“抗体”包含包括四个多肽链、通过二硫键相互连接的两个重(H)链和两个轻(L)链以及其多聚体(例如,IgM)的免疫球蛋白分子。每个重链包括重链可变区(在本文中缩写为HCVR或VH)和重链恒定区。重链恒定区包括三个结构域CH1、CH2和CH3。每个轻链包括轻链可变区(在本文中缩写为LCVR或VL)和轻链恒定区。轻链恒定区包括一个结构域(CL1)。VH区和VL区可以进一步细分为被称作互补决定区(CDR)的高变区,所述高变区散布有更保守的被称作框架区(FR)的区。每个VH和VL由按照以下顺序从氨基末端到羧基末端排列的三个CDR和四个FR构成:FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。在本发明的不同实施例中,抗大ET-1抗体(或其抗原结合部分)的FR可以与人种系序列相同或可以是天然的或经人工修饰的。可以基于两个或更多个CDR的并列分析来定义氨基酸共有序列。如本文所使用的,术语“抗体”还包含完整抗体分子的抗原结合片段。如本文所使用的,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等包含特异性地结合抗原以形成复合物的任何天然存在的、酶促可获得的、合成的或遗传工程化的多肽或糖蛋白。抗体的抗原结合片段可以例如使用任何合适的标准技术衍生自完整抗体分子,所述标准技术如蛋白水解消化或涉及操纵和表达编码抗体可变结构域以及任选地恒定结构域的DNA的重组基因工程技术。此类DNA是已知的和/或易于从例如商业来源、DNA文库(包含例如噬菌体-抗体文库)获得,或者可以合成。可以通过化学方法或通过分子生物学技术对DNA进行测序和操纵,例如,将一个或多个可变结构域和/或恒定结构域排列成合适的构型、或引入密码子、产生半胱氨酸残基、修饰、添加或缺失氨基酸等。
如本文所使用的,“抗体片段”包含完整抗体的一部分,例如抗体的抗原结合或可变区。抗体片段的实例包含但不限于Fab片段、Fab'片段、F(ab')2片段、scFv片段、Fv片段、dsFv双功能抗体、dAb片段、Fd'片段、Fd片段和分离的互补决定区(CDR)区域以及三功能抗体、四功能抗体、线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。Fv片段是免疫球蛋白重链和轻链的可变区的组合,并且ScFv蛋白是重组单链多肽分子,其中免疫球蛋白轻链和重链可变区通过肽连接子连接。在一些示例性实施例中,抗体片段包括亲本抗体的足够的氨基酸序列,所述氨基酸序列是所述亲本抗体的片段,使得其如亲本抗体那样与同一抗原结合;在一些示例性实施例中,片段与具有与亲本抗体的亲和力相当的亲和力的抗原结合和/或与亲本抗体竞争以与抗原结合。抗体片段可以通过任何方式产生。例如,抗体片段可以通过完整抗体的片段化酶促地或化学地产生和/或抗体片段可以由编码部分抗体序列的基因重组地产生。可替代地或另外地,抗体片段可以完全地或部分地合成产生。抗体片段可以任选地包括单链抗体片段。可替代地或另外地,抗体片段可以包括例如通过二硫键连接在一起的多个链。抗体片段可以任选地包括多分子复合物。功能性抗体片段通常包括至少约50个氨基酸,并且更通常包括至少约200个氨基酸。
术语“双特异性抗体”包含能够与两个或多个表位选择性结合的抗体。双特异性抗体通常包括两个不同的重链,其中每个重链与两个不同分子(例如,抗原)上或同一分子上(例如,同一抗原上)的不同表位特异性结合。如果双特异性抗体能够与两个不同的表位(第一表位和第二表位)选择性地结合,则第一重链对第一表位的亲和力通常比第一重链对第二表位的亲和力低至少一至两个或三个或四个数量级,反之亦然。由双特异性抗体识别的表位可以位于相同或不同的靶标上(例如,位于相同或不同的蛋白质上)。双特异性抗体可以例如通过组合识别同一抗原的不同表位的重链来制备。例如,编码识别同一抗原的不同表位的重链可变序列的核酸序列可以与编码不同重链恒定区的核酸序列融合,并且此类序列可以在表达免疫球蛋白轻链的细胞中表达。
典型的双特异性抗体具有两个重链,所述两个重链各自具有三个重链CDR,随后是CH1结构域、铰链、CH2结构域和CH3结构域以及免疫球蛋白轻链,所述免疫球蛋白轻链不赋予抗原结合特异性但可以与每个重链缔合,或者可以与每个重链缔合且可以与由重链抗原结合区结合的表位中的一个或多个表位结合,或者可以与每个重链缔合且使得所述重链中的一个或两个重链能够与一个或两个表位结合。bsAb可以分成两个主要类别:一类是带有Fc区(IgG样);以及另一类是缺乏Fc区,后者通常小于包括Fc的IgG和IgG样双特异性分子。IgG样bsAb可以具有不同形式,如但不限于三功能抗体、杵臼IgG(kih IgG)、crossMab、orth-Fab IgG、双可变结构域Ig(DVD-Ig)、二合一或双功能Fab(DAF)、IgG-单链Fv(IgG-scFv)或κλ体。非IgG样不同形式包含串联scFv、双抗体形式、单链双抗体、串联双抗体(TandAbs)、双亲和力再靶向分子(DART)、DART-Fc、纳米抗体或通过对接锁定(dock-and-lock,DNL)方法产生的抗体(Gaowei Fan、Zujian Wang和Mingju Hao,双特异性抗体及其应用(Bispecific antibodies and their applications),8《血液学与肿瘤学杂志(JOURNALOF HEMATOLOGY&ONCOLOGY)》130;Dafne Müller和Roland E.Kontermann,双特异性抗体,《治疗性抗体手册(HANDBOOK OF THERAPEUTIC ANTIBODIES265–310)》(2014),其全部教学内容并入本文)。
如本文所使用的,“多特异性抗体”是指对至少两种不同抗原具有结合特异性的抗体。虽然这些分子通常将仅与两种抗原(例如,双特异性抗体,bsAb)结合,但具有另外特异性的抗体,如三特异性抗体和KIH三特异性抗体也可以通过本文所公开的方法来解决。
如本文所使用的,术语“单克隆抗体”不限于通过杂交瘤技术产生的抗体。单克隆抗体可以通过本领域的任何可获得或已知的方式源自单个克隆,包含任何真核、原核或噬菌体克隆。可以使用本领域已知的各种技术来制备可用于本公开的单克隆抗体,包含使用杂交瘤、重组和噬菌体展示技术或其组合。
在一些示例性实施例中,治疗性蛋白质可以从哺乳动物细胞中产生。哺乳动物细胞可以是人来源的或非人来源的,并且可以包含原代上皮细胞(例如,角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾脏上皮细胞和视网膜上皮细胞)、已建立的细胞系及其菌株(例如,293胚肾细胞、BHK细胞、HeLa宫颈上皮细胞和PER-C6视网膜细胞、MDBK(NBL-1)细胞、911细胞、CRFK细胞、MDCK细胞、CHO细胞、BeWo细胞、Chang细胞、Detroit 562细胞、HeLa 229细胞、HeLa S3细胞、Hep-2细胞、KB细胞、LSI80细胞、LS174T细胞、NCI-H-548细胞、RPMI2650细胞、SW-13细胞、T24细胞、WI-28VA13、2RA细胞、WISH细胞、BS-C-I细胞、LLC-MK2细胞、克隆M-3细胞、1-10细胞、RAG细胞、TCMK-1细胞、Y-l细胞、LLC-PKi细胞、PK(15)细胞、GHi细胞、GH3细胞、L2细胞、LLC-RC 256细胞、MHiCi细胞、XC细胞、MDOK细胞、VSW细胞和TH-I、B1细胞、BSC-1细胞、RAf细胞、RK细胞、PK-15细胞或其衍生物)、来自任何组织或器官的成纤维细胞(包含但不限于心脏、肝脏、肾脏、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细管)、淋巴组织(淋巴腺、腺样、扁桃体、骨髓和血液)、脾脏以及成纤维细胞和成纤维细胞样细胞系(例如,CHO细胞、TRG-2细胞、IMR-33细胞、Don细胞、GHK-21细胞、瓜氨酸血症细胞(citrullinemia cell)、邓普斯细胞(Dempsey cell)、Detroit 551细胞、Detroit 510细胞、Detroit 525细胞、Detroit 529细胞、Detroit 532细胞、Detroit 539细胞、Detroit 548细胞、Detroit 573细胞、HEL 299细胞、IMR-90细胞、MRC-5细胞、WI-38细胞、WI-26细胞、Midi细胞、CHO细胞、CV-1细胞、COS-1细胞、COS-3细胞、COS-7细胞、Vero细胞、DBS-FrhL-2细胞、BALB/3T3细胞、F9细胞、SV-T2细胞、M-MSV-BALB/3T3细胞、K-BALB细胞、BLO-11细胞、NOR-10细胞、C3H/IOTI/2细胞、HSDMiC3细胞、KLN205细胞、McCoy细胞、小鼠L细胞、菌株2071(小鼠L)细胞、L-M菌株(小鼠L)细胞、L-MTK'(小鼠L)细胞、NCTC克隆2472和2555、SCC-PSA1细胞、Swiss/3T3细胞、印度麂细胞(Indian muntjaccell)、SIRC细胞、Cn细胞和詹森细胞(Jensen cell)、Sp2/0、NS0、NS1细胞或其衍生物)。
如本文所使用的,术语“消化”是指蛋白质的一个或多个肽键的水解。消化可以用于NMR样品的制备。使用消化的优点是减小了分析物的大小,从而成比例地增加了此分析物的NMR信号。具体地说,关于抗体,抗体的亚结构域可以彼此独立地折叠,并且因此将亚结构域彼此分开提供了增强信号的益处,而不会显著改变蛋白质结构。在不进行同位素标记或富集的情况下,片段化的另外的益处可能是有助于将NMR信号分配给特定的片段化亚结构域。
存在若干种方法用于使用适当的水解剂进行样品中的蛋白质的消化,例如酶促消化或非酶促消化。如本文所使用的,术语“消化酶”是指可以进行蛋白质的消化的大量不同药剂中的任何一种。可以进行酶促消化的水解剂的非限制性实例包含来自赛氏曲霉(Aspergillus Saitoi)的蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、蛋白酶XIII、胃蛋白酶、胰蛋白酶、Tryp-N、糜蛋白酶、曲霉胃蛋白酶I、LysN蛋白酶(Lys-N)、LysC蛋白内切酶(Lys-C)、蛋白内切酶Asp-N(Asp-N)、蛋白内切酶Arg-C(Arg-C)、蛋白内切酶Glu-C(Glu-C)或外膜蛋白T(OmpT)、酿脓链球菌(Streptococcus pyogenes)免疫球蛋白降解酶(IdeS)、嗜热菌蛋白酶、木瓜蛋白酶、链霉蛋白酶、V8蛋白酶或其生物激活片段或同源物或其组合。对于讨论蛋白质消化的可用技术的最近综述,参见Switazar等人,“蛋白质消化:可用技术和最新开发的概述(Protein Digestion:An Overview of the Available Techniques and RecentDevelopments)”(Linda Switzar、Martin Giera和Wilfried M.A.Niessen,蛋白质消化:可用技术和最新开发的概述,12《蛋白质组学研究杂志(JOURNAL OF PROTEOME RESEARCH)》1067-1077(2013))。在示例性实施例中,消化酶是IdeS或IdeS的变体。
治疗调配物可能包括不适用于NMR分析的成分。例如,包括氢原子的赋形剂或缓冲剂可能产生干扰蛋白质分析物检测的不期望NMR信号。在这种情况下,可以使用缓冲液交换或透析步骤将蛋白质分析物转移到合适的缓冲液中。在示例性实施例中,分析物被透析到包括10mM磷酸钠、pH 6.0的缓冲液中。
如本文所使用的,术语“核磁共振”(“NMR”)是指核磁共振波谱法,一种用于观测原子核周围的局部磁场的技术。NMR信号是通过用无线电波将分析物样品的原子核激发成核磁共振而产生的,然后用无线电接收器进行检测。所得NMR波谱提供了关于分析物分子的结构、动力学、反应状态和化学环境的信息。根据分析物和期望数据,有多种不同的NMR技术可供选择。与蛋白质分析相关的NMR技术包含例如1D
在2D异核NMR领域,存在替代性方法子集,包含异核单量子相关(HSQC)、异核多量子相关性波谱法(HMQC)和异核多键相关性波谱法(HMBC)。除非另有说明,否则本文所公开的实验使用HSQC。然而,所公开的方法也可以应用于任何类型的多维NMR实验,包含使用HMQC或HMBC。
NMR波谱可以经受另外的分析,以便进一步解释每个波谱中固有的丰富数据集。如本文所使用的,术语“数据处理”、“数据后处理”或“化学计量学”用于描述在采集后分析NMR数据的方法。存在许多可以用于促进数据处理的软件程序,例如,JMP 15(SAS软件研究所公司(SAS Institute,Inc.))或MATLAB(迈斯沃克公司(Mathworks))。可以选择能够处理大数据集的任何合适的软件。
可以使用例如通过NMR进行的高阶结构简单可比性(ECHOS-NMR)来进一步分析NMR数据(Amezcua等人,2013,《药学杂志(J Pharm Sci),102(6):1724-1733)。ECHOS-NMR涉及通过测量从分箱NMR波谱强度的线性回归分析得到的相关系数来比较两个实验样品之间的相似性。此方法允许对两个分析物之间的总体相似性进行直接的相对比较,而不需要同位素标记或富集。在示例性实施例中,ECHOS-NMR方法进一步应用于来自两个制造过程的平均波谱,并且因此用于比较两个过程而不是两个样品。
用于分析大数据集的常用统计方法是主成分分析(PCA)。PCA通常用于通过将每个数据点仅投射到表示具有最高方差的数据集的维度的前几个主成分上来降维,以获得较低维度的数据,同时尽可能多地保留数据的变化。主成分可以通过数据协方差矩阵的特征分解来计算。在示例性实施例中,PCA图上的每个数据点都表示一个NMR波谱。在示例性实施例中,PCA图上的数据点可以根据分析物抗体的制造过程进行聚类。在示例性实施例中,这些聚类可以经受另外的统计分析,以便比较每个制造过程与其它制造过程的方差。
虽然ECHOS-NMR或PCA是从NMR分析物的确切化学结构中提取的,但是使用这些或其它统计方法检测的NMR波谱之间的统计差异或方差可以与替代性分析方法相关,以便确定每个差异或方差的具体化学来源。
应当理解,本发明不限于任何前述蛋白质、抗体、NMR技术、消化酶、数据处理方法或数据后处理方法,并且任何蛋白质、抗体、NMR技术、消化酶、数据处理方法或数据后处理方法可以通过任何合适的方式选择。
通过参考以下实例,将更充分地理解本发明。然而,以下实例不应被解释为限制本发明的范围。
实例
样品制备。用使用两个不同制造过程(过程1和过程2)制造的mAb1和mAb2批次样品进行NMR实验。用固定化IdeS(Genovis FragIT柱)原位消化mAb1和mAb2批次样品,将其透析到10mM磷酸钠(pH 6.0)中,并浓缩至40mg/mL用于NMR实验。
NMR数据收集。使用标准Bruker脉冲序列(zgesgp,或使用具有梯度的激励雕刻进行水峰压制的1D序列;以及hsqcetgpsp,或通过双重inept转移进行的2D H-1/X相关,使用Echo/Antiecho-TPPI梯度选择的相敏)在于45℃下使用低温冷却探针以800MHz(1H频率)运行的Bruker光谱仪上获得一维
NMR数据处理和后处理。使用NMRFx处理器(壹月科技公司(One Moon Scientific,Inc.))处理一维
一维波谱作为整个波谱或分解成酰胺(6.0-11.5ppm
使二维波谱经受分箱、噪声去除和归一化。二维波谱被分成在
NMR数据分析。在后处理之后,使用ECHOS-NMR或PCA分析来比较表示一维
对于ECHOS-NMR,表示两个波谱的向量在JMP 15中直接相关。报告了每个成对比较的R
对于PCA,使用JMP 15中实施的主成分平台、使用成对估计方法分析表示几个波谱(例如,来自两个过程的几个代表性波谱)的向量,其中主成分是基于协方差创建的。在PCA期间,将数据集中没有变化的箱从分析中丢弃。
为了比较几个组(例如,不同的制造过程),将前两个主成分的分数相对于彼此进行绘制,并绘制按要比较的类别分组的95%置信密度椭圆。椭圆的平均值和标准偏差可以用于组间的统计比较(t-检验)或被绘制用于视觉检查,从而发现可比性或缺乏可比性。
可以进一步分析观测到组间相关差异的主成分的差异来源。感兴趣的主成分的负载(将波谱箱变换成主要成分的系数)可以被绘制成原始波谱化学位移轴上的等值线图,从而产生示出完全促成沿此主成分的差异的区的“虚拟波谱”。在沿一个主成分分离的两个聚类/过程的情况下,此载荷图基本上复制了两个组的差异波谱,从而允许以高分辨率精确定位分析物的差异。
实例1.NMR方法的改进
改进了常规的NMR方法以用于抗体高阶结构(HOS)的定量分析。
在制备用于NMR分析的抗体时,可以用消化酶消化抗体,以便产生更小的片段,用于更高的NMR信号和更高的分辨率分析。用于NMR分析的抗体的常规消化可以用作消化酶,例如木瓜蛋白酶,其在非特异性位点消化抗体并产生大约50、50和50kDa的抗体片段。对于本分析,使用酶IdeS。IdeS和相关酶切割铰链区之下的特定可预测抗体位点,与常规方法相比,这允许实验之间有更大的可比性。另外,IdeS产生大约100、25和25kDa的抗体片段,在NMR信号质量和强度方面提供了独特的结果,所述结果随分析物大小而变化。注意到消化不会显著影响mAb的光谱色散。
对于NMR数据的后处理分析,测试并采用了新颖的降噪方法。例如,二维
包含噪声消除和信号归一化的NMR数据分析的示例性方法在图1中描绘。原始数据的收集如图1A所示,并且分箱如图1B所示。选择不包括来自分析物的信号的“空”区域,如图1C所示,并且基于来自该区域的值的标准偏差设置噪声阈值,如图1D所示。然后计算并应用经调整的强度来排除这种噪声,如图1E所示,从而简化NMR波谱。这种新颖的噪声去除过程允许对NMR数据进行更准确的定量分析,并用于下述实验。
进行信号强度的归一化以控制实验之间的技术变化。感兴趣区域的识别和隔离如图1F和图1G所示。感兴趣区域内的箱的强度被归一化为感兴趣区域的最高强度箱,以便促进波谱之间的定量比较,如图1H所示。
使用来自先前步骤的经调整和归一化的强度,波谱的信号区域可以从波谱的噪声区域中分离出来,如图1I和图1J所示。
实例2.mAb制造的过程变异性的评估
两种单克隆抗体mAb1和mAb2各自使用两个不同的过程(过程1和过程2)制造。为了根据抗体高阶结构(HOS)分析两个过程的过程变异性,开发了新颖的NMR技术。
如上所述,使用NMR分析了根据过程1和过程2制造的三批mAb1和mAb2。对每个过程的每种抗体的
使用ECHOS-NMR对制造过程进行了进一步的比较。每个过程的每种抗体的平均波谱的相关如图3所示。对于这两种抗体,两个制造过程具有高度的可比性,如通过确定系数(R
使用PCA对过程变异性进行另外的分析。基于前两个主成分的得分将每个过程的每种抗体的代表性波谱相对于彼此进行绘制,如图4A所示。绘制了按制造过程分组的95%置信密度椭圆(“聚类”)。这种分析呈现了过程之间和过程内部的视觉变化,与单个批次间比较相比,允许更详细地了解具有潜在质量控制相关性的抗体HOS变化。在图4A和4B所示的实例中,这种PCA分析揭示了对于mAb1,每种成分的相关性在每个过程之间似乎是一致的。相反,对于mAb2,过程1的成分1似乎比过程2更具变异性,而过程2的成分2似乎比过程1更具变异性。图4B和4C还示出了除波谱相似性数之外的方差分解。
可以使用以上建立的每个制造过程的NMR波谱聚类的统计分析来进一步询问PCA分析的数据,如图4D所示。过程变异性可以通过各种方式进行量化和比较,例如通过获取PCA图上的波谱值的平均值或标准偏差。这种分析提供了一种用于比较蛋白质制造过程之间的变异性的简单定量方法。
- 车辆控制装置、车辆、车辆控制装置的处理方法以及存储介质
- 车辆控制装置、车辆、车辆控制装置的处理方法以及存储介质
- 一种车辆行驶风险预警方法、装置、存储介质及电子设备
- 一种车辆预警方法、装置、电子设备及存储介质
- 一种车位确定方法、装置、电子设备、车辆及存储介质
- 一种车辆迎宾方法、车辆迎宾装置、车辆和存储介质
- 车辆的迎宾方法、装置、电子设备及存储介质
