一种伪蒲公英甾醇衍生物及其制备方法和应用
文献发布时间:2024-04-18 20:01:30
技术领域
本发明属于医药技术领域,涉及天然产物衍生化以及新应用,尤其是一种伪蒲公英甾醇衍生物及其制备方法和应用。
背景技术
伪蒲公英甾醇(psi-taraxasterol,pseudotaraxasterol,CAS:464-98-2)属于五环三萜类化合物,可以从多种植物中提取分离获得,例如白苞猩猩草(Euphorbiaheterophylla L.)、蒲公英和Luehea ochrophylla Mart等。其结构与蒲公英甾醇(taraxasterol,CAS:1059-14-9)的差别在于E环上双键的位置。1956年自从被报道以来,关于伪蒲公英甾醇活性的研究有抗炎、抗菌、降血脂、抗疟疾、抗肿瘤、抗病毒、抗水肿、增强血管通透性等,但关于降血糖方面的研究尚未见报道。
α-葡萄糖苷酶能从淀粉分子链非还原性末端依次切开α-1,4糖苷键,并能缓慢水解α-1,6糖苷键,将淀粉转化为葡萄糖,从而升高人体内血糖。抑制α-葡萄糖苷酶通过延缓碳水化合物的消化吸收,延长消化时间,降低葡萄糖的吸收速率,从而成为控制2型糖尿病餐后高血糖的治疗手段之一。此外,α-糖苷酶还可能与其他疾病有关,如癌症、病毒感染和庞贝氏症。因此,α-葡萄糖苷酶是药物研发中重要靶点之一。
目前临床上使用的α-葡萄糖苷酶抑制剂有阿卡波糖、米格列醇、伏格列波糖等,容易引起胃肠道不良反应,如腹泻、胀气等。因此,发现新型高效且低副作用的α-葡萄糖苷酶抑制剂具有重要的研究意义和实际应用价值。
通过检索,发现与本发明专利申请相关的公开文献:
1、期刊杂志:Allelopathic activity and chemical constituents ofextracts from roots of Euphorbia heterophylla L.natural product research,2019,33,2681-2684.从白苞猩猩草分离提取获得了伪蒲公英甾醇等化合物,具有化感作用(Allelopathic activity)。
2、期刊杂志:Taraxacum-A review on its phytochemical andpharmacological profile[J].JEthnopharmacol,2006,107(3):313-323.Katrin等人报道了从西洋蒲公英根中分离得到了伪蒲公英甾醇等化合物,但并没有提及伪蒲公英甾醇及其衍生物具有降血糖和α-葡萄糖苷酶抑制活性。
通过对比,本发明与上述公开文献存在本质的不同,首先本发明合成的多个伪蒲公英甾醇酯是新化合物,没有相关文献报道其结构和活性;其次,伪蒲公英甾醇、伪蒲公英甾醇乙酸酯和丁酸酯虽然曾经从植物中分离提取获得过,但是其降血糖和α-葡萄糖苷酶抑制活性尚未见报道。因此,获得新型伪蒲公英甾醇衍生物以及现有天然伪蒲公英甾醇及其衍生物的新应用是本发明技术方案的动机。
发明内容
本发明的目的在于克服现有技术中的不足之处,提供一种伪蒲公英甾醇衍生物及其制备方法和应用。
本发明解决其技术问题所采用的技术方案是:
一种伪蒲公英甾醇及其衍生物,所述衍生物的结构式如下:
其中,3位R为羰基;或者,3位为β-OH,或者为β-OH的羧酸酯衍生物。
进一步地,所述羧酸酯衍生物为如下中的一种:
进一步地,所述伪蒲公英甾醇及其衍生物在体外能够明显抑制α-葡萄糖苷酶,活性均高于临床用药阿卡波糖,其中活性最好的化合物11(IC
一种如上所述的伪蒲公英甾醇衍生物的制备方法,其合成路线为:
其中PCC为氯铬酸吡啶盐;
或者,
或者,
或者,
进一步地,包括如下步骤:
(1)化合物2的合成:将伪蒲公英甾醇溶于有机溶剂中,加入氯铬酸吡啶盐,室温下搅拌反应1~8h后,薄层层析监测原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(2)化合物3~10的通用合成方法:将伪蒲公英甾醇溶于有机溶剂中,加入不同酸酐,室温下反应1~8h后,薄层层析监测原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(3)化合物11的合成:将伪蒲公英甾醇溶于有机溶剂中,搅拌下加入无水碳酸钾、N,N-二异丙基乙胺、4-二甲氨基吡啶、丁二酸酐,40~80℃反应1~8h,薄层层析监测到原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(4)化合物12的合成:将伪蒲公英甾醇溶于有机溶剂中,缓慢加入N-甲酰-L-亮氨酸、N,N'-二异丙基碳二亚胺、DMAP,室温下反应2~5h,薄层层析监测观察到原料消失,判断反应完毕;将反应液用二氯甲烷稀释,用等体积水萃取,合并有机相后用等体积饱和NaCl水溶液洗涤,无水Na
(5)化合物13的合成:将伪蒲公英甾醇溶于有机溶剂中,缓慢加入Fmoc-D-异亮氨酸、DIC和DMAP,室温下反应2~5h,反应完毕将反应液用二氯甲烷稀释,用等体积水萃取,合并有机相后用等体积饱和NaCl水溶液洗涤,无水Na
将上述中间体溶于DMF中,冰浴下边搅拌边滴加1~100倍体积的吗啉,室温下反应0.5~5h,反应完毕加入1~20体积的冰水淬灭反应,用等体积二氯甲烷萃取,合并后用等体积的饱和NaCl水溶液洗涤1~3次,有机相用无水Na
进一步地,所述步骤(1)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:氯铬酸吡啶盐的摩尔比为:1:1~50;稀盐酸的质量浓度为1%~10%;
步骤(2)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:酸酐的摩尔比为:1:1~50;稀盐酸的质量浓度为1%~10%;
步骤(3)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:无水碳酸钾、N,N-二异丙基乙胺、4-二甲氨基吡啶、丁二酸酐的摩尔比为:1:1~50:1~50:1~50:1~50;稀盐酸的质量浓度为1%~10%;
步骤(4)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯等中的一种或几种的混合物;伪蒲公英甾醇:N-甲酰-L-亮氨酸:N,N'-二异丙基碳二亚胺:DMAP的摩尔比为:1:1~10:1~10:0.1~1。
步骤(5)中伪蒲公英甾醇:Fmoc-D-异亮氨酸:DIC:DMAP的摩尔比为1:1~100:1~100:0.1~10。
如上所述的伪蒲公英甾醇衍生物在制备α-葡萄糖苷酶抑制剂药物方面中的应用。
如上所述的伪蒲公英甾醇衍生物在制备降血糖药物方面中的应用。
如上所述的伪蒲公英甾醇衍生物在制备治疗糖脂代谢紊乱药物方面中的应用。
本发明取得的优点和积极效果为:
1、本发明伪蒲公英甾醇类衍生物具有较好的抑制α-葡萄糖苷酶活性。本发明伪蒲公英甾醇类衍生物还具有降血糖和缓解口服葡萄耐量的活性,葡萄耐量与胰岛素分泌相关,即该类衍生物能够缓解糖脂代谢综合紊乱。
2、本发明方法的反应不需无水无氧操作,操作简便,原料与试剂廉价易得,适合大规模生产和开发。
3、本发明部分化合物制备成氨基酸酯,提高了溶解度。
4、活性研究表明,该类化合物具有抑制α-葡萄糖苷酶活性;其中,化合物11具有高于阳性对照阿卡波糖约410倍的半数抑制浓度。因此,说明该化合物具有良好的应用前景。
5、本发明制备得到的伪蒲公英甾醇衍生物工艺简单且得率高,其衍生物的制备不需要无水无氧等条件,反应收率高且用时短。活性研究表明,该伪蒲公英甾醇衍生物具有良好的抑制α-葡萄糖苷酶的活性,并能改善二型糖尿病小鼠的高血糖症状。因此,说明该类化合物具有良好的应用前景。
附图说明
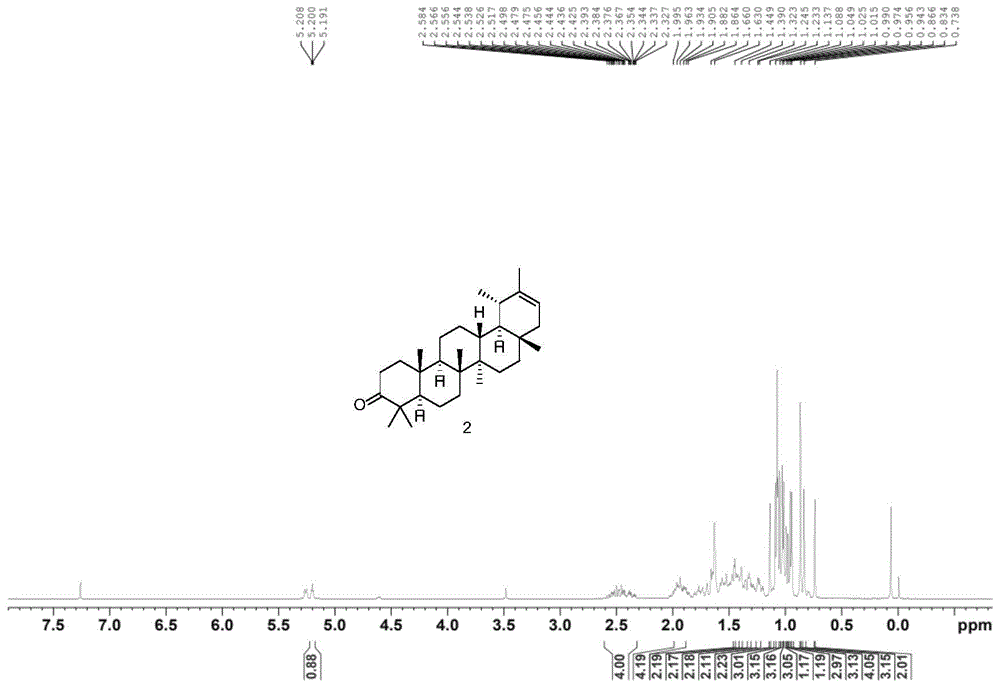
图1为本发明中化合物2在氘代氯仿中的核磁氢谱图;
图2为本发明中化合物3在氘代氯仿中的核磁氢谱图;
图3为本发明中化合物4在氘代氯仿中的核磁氢谱图;
图4为本发明中化合物5在氘代氯仿中的核磁氢谱图;
图5为本发明中化合物6在氘代氯仿中的核磁氢谱图;
图6为本发明中化合物7在氘代氯仿中的核磁氢谱图;
图7为本发明中化合物8在氘代氯仿中的核磁氢谱图;
图8为本发明中化合物9在氘代氯仿中的核磁氢谱图;
图9为本发明中化合物10在氘代氯仿中的核磁氢谱图;
图10为本发明中化合物11在氘代氯仿中的核磁氢谱图;
图11为本发明中化合物12在氘代氯仿中的核磁氢谱图;
图12为本发明中化合物13在氘代氯仿中的核磁氢谱图;
图13为本发明中化合物11对糖尿病小鼠餐后血糖曲线下面积图;注:(
图14为本发明中化合物11对糖尿病小鼠口服葡萄糖耐量的影响;
图15为本发明中化合物11对糖尿病小鼠口服葡萄糖耐量曲线下面积图;注:(
具体实施方式
下面结合实施例,对本发明进一步说明,下属实施例是叙述性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
具体实施例中所涉及的各种实验操作,均为本领域的常规技术,本文中没有特别注释的部分,本领域的普通技术人员可以参照本发明申请日之前的各种常用工具书、科技文献或相关的说明书、手册等予以实施。
一种伪蒲公英甾醇及其衍生物,所述衍生物的结构式如下:
其中,3位R为羰基;或者,3位为β-OH,或者为β-OH的羧酸酯衍生物。
较优地,所述羧酸酯衍生物为如下中的一种:
较优地,所述伪蒲公英甾醇衍生物在体外能够明显抑制α-葡萄糖苷酶,活性均高于临床用药阿卡波糖,其中活性最好的化合物11(IC
一种如上所述的伪蒲公英甾醇衍生物的制备方法,其合成路线为:
其中PCC为氯铬酸吡啶盐;
或者,
或者,
或者,
较优地,包括如下步骤:
(1)化合物2的合成:将伪蒲公英甾醇溶于有机溶剂中,加入氯铬酸吡啶盐,室温下搅拌反应1~8h后,薄层层析监测原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(2)化合物3~10的通用合成方法:将伪蒲公英甾醇溶于有机溶剂中,加入不同酸酐,室温下反应1~8h后,薄层层析监测原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(3)化合物11的合成:将伪蒲公英甾醇溶于有机溶剂中,搅拌下加入无水碳酸钾、N,N-二异丙基乙胺、4-二甲氨基吡啶、丁二酸酐,40~80℃反应1~8h,薄层层析监测到原料消失,判断反应完毕;将反应液倒入5~50倍反应液体积的二氯甲烷中,用等体积的稀盐酸洗涤1~3次,合并有机相,再用等体积的饱和NaHCO
(4)化合物12的合成:将伪蒲公英甾醇溶于有机溶剂中,缓慢加入N-甲酰-L-亮氨酸、N,N'-二异丙基碳二亚胺、DMAP,室温下反应2~5h,薄层层析监测观察到原料消失,判断反应完毕;将反应液用二氯甲烷稀释,用等体积水萃取,合并有机相后用等体积饱和NaCl水溶液洗涤,无水Na
(5)化合物13的合成:将伪蒲公英甾醇溶于有机溶剂中,缓慢加入Fmoc-D-异亮氨酸、DIC和DMAP,室温下反应2~5h,反应完毕将反应液用二氯甲烷稀释,用等体积水萃取,合并有机相后用等体积饱和NaCl水溶液洗涤,无水Na
将上述中间体溶于DMF中,冰浴下边搅拌边滴加1~100倍体积的吗啉,室温下反应0.5~5h,反应完毕加入1~20体积的冰水淬灭反应,用等体积二氯甲烷萃取,合并后用等体积的饱和NaCl水溶液洗涤1~3次,有机相用无水Na
较优地,所述步骤(1)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:氯铬酸吡啶盐的摩尔比为:1:1~50;稀盐酸的质量浓度为1%~10%;
步骤(2)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:酸酐的摩尔比为:1:1~50;稀盐酸的质量浓度为1%~10%;
步骤(3)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯中的一种或几种的混合物;伪蒲公英甾醇:无水碳酸钾、N,N-二异丙基乙胺、4-二甲氨基吡啶、丁二酸酐的摩尔比为:1:1~50:1~50:1~50:1~50;稀盐酸的质量浓度为1%~10%;
步骤(4)中溶解伪蒲公英甾醇的有机溶剂为吡啶、二氯甲烷、三氯甲烷、甲苯等中的一种或几种的混合物;伪蒲公英甾醇:N-甲酰-L-亮氨酸:N,N'-二异丙基碳二亚胺:DMAP的摩尔比为:1:1~10:1~10:0.1~1。
步骤(5)中伪蒲公英甾醇:Fmoc-D-异亮氨酸:DIC:DMAP的摩尔比为1:1~100:1~100:0.1~10。
如上所述的伪蒲公英甾醇衍生物在制备α-葡萄糖苷酶抑制剂药物方面中的应用。
如上所述的伪蒲公英甾醇衍生物在制备降血糖药物方面中的应用。
如上所述的伪蒲公英甾醇衍生物在制备治疗糖脂代谢紊乱药物方面中的应用。
具体地,相关制备及检测如下:
实施例1化合物2的合成
具体反应路线如下:
化合物2的合成方法:
将伪蒲公英甾醇(0.12mmol)溶于1.0mL二氯甲烷中,加入氯铬酸吡啶盐(PCC,0.24mmol),室温下搅拌反应1h后,薄层层析监测(石油醚:丙酮=10:1),观察到原料消失,判断反应完毕。将反应液倒入二氯甲烷(10.0mL)中,用6%稀盐酸(10.0mL×3)洗涤,合并有机相,用饱和NaHCO
实施例2化合物3~10的合成
具体合成路线如下:
化合物3~8的通用合成方法:
将伪蒲公英甾醇(0.12mmol)溶于0.5mL吡啶中,搅拌下加入不同酸酐(0.5mL),室温下反应4h后,薄层层析监测(石油醚:丙酮=10:1),观察到原料消失,判断反应完毕。将反应液倒入10.0mL二氯甲烷中,用6%稀盐酸(10.0mL×3)洗涤,合并有机相,用饱和NaHCO
(1)伪蒲公英甾醇3-O-乙酸酯(3)的合成
酸酐原料为乙酸酐,按照上述合成通法,得白色固体3,产率为100%。
(2)伪蒲公英甾醇3-O-三氟乙酸酯(4)的合成
酸酐原料为三氟乙酸酐,按照上述合成通法,得白色固体4,产率为74.5%。
(3)伪蒲公英甾醇3-O-三氯乙酸酯(5)的合成
酸酐原料为三氯乙酸酐,按照上述合成通法,得白色固体5,产率为77.9%。
(4)伪蒲公英甾醇3-O-三甲基乙酸酯(6)的合成
酸酐原料为三甲基乙酸酐,按照上述合成通法,得白色固体6,产率为81.8%。
(5)伪蒲公英甾醇3-O-正丁酸脂(7)的合成
酸酐原料为正丁酸酐,按照上述合成通法,得白色固体7,产率为60.1%。
(6)伪蒲公英甾醇3-O-异丁酸脂(8)的合成
酸酐原料为异丁酸酐,按照上述合成通法,得白色固体8,产率为85.7%。
化合物9的合成
将伪蒲公英甾醇(50.0mg,0.12mmol)溶于0.5mL吡啶中,搅拌下加入苯甲酸酐(0.351mmol)和甲苯(0.4mL),30℃反应3h,薄层层析监测观察到原料消失,判断反应完毕。将反应液倒入10.0mL二氯甲烷中,用6%稀盐酸(10.0mL×3)洗涤,合并有机相,用饱和NaHCO
化合物10的合成
化合物10的合成方法与上述化合物9的合成方法相同,酸酐选取4-甲氧基苯甲酸酐,收率为60.6%;化合物10结构参数如下:
实施例3化合物11的合成
将伪蒲公英甾醇(0.12mmol)溶于0.5mL吡啶中,搅拌下加入无水碳酸钾(0.23mmol)、N,N-二异丙基乙胺(DIPEA,0.23mmol)、4-二甲氨基吡啶(DMAP,0.07mmol)、丁二酸酐(0.351mmol),80℃反应3h,薄层层析监测观察到原料消失,判断反应完毕。将反应液倒入10.0mL二氯甲烷中,用6%稀盐酸(10.0mL×3)洗涤,合并有机相,用饱和NaHCO
实施例4化合物12的合成
将伪蒲公英甾醇(50.0mg,0.12mmol)溶于无水二氯甲烷(1.0mL)中,缓慢加入N-甲酰-L-亮氨酸(31.3mg,0.23mmol)、N,N'-二异丙基碳二亚胺(DIC,54.0μL,0.36mmol)、DMAP(14.3mg,0.12mmol),室温下反应4.5h,薄层层析(石油醚:丙酮=10:1)监测观察到原料消失,判断反应完毕。将反应液用二氯甲烷稀释至10.0mL,用水(10.0mL×3)萃取,合并后用饱和NaCl(15.0mL×3)洗涤,无水Na2SO4除水,旋干后进行硅胶柱层析,洗脱极性为石油醚:丙酮=200:1~50:1(v/v),得到35.3mg的化合物12,白色固体,产率53.0%。
实施例5化合物13的合成
将伪蒲公英甾醇(50.0mg,0.12mmol)溶解于无水二氯甲烷(1.0mL)中,缓慢加入Fmoc-D-异亮氨酸(82.8mg,0.23mmol)、DIC(36.3μL,0.23mmol)、DMAP(14.3mg,0.12mmol),室温下反应3h,TLC于石油醚:丙酮=10:1下展开,观察到原料消失,产物R
将上述中间体(76.0mg)溶于DMF(1.2mL)中,冰浴下边搅拌边滴加吗啉(0.3mL,20%),室温下反应1h,TLC于石油醚:丙酮=10:1下展开,观察到原料消失,产物R
实施例6化合物1~13的α-葡萄糖苷酶抑制实验
精密称取磷酸二氢钾、磷酸氢二钾,配制成50mM缓冲液,使用稀盐酸将缓冲液调至pH6.8,即得到最终所需的缓冲液。将α-葡萄糖苷酶溶于上述缓冲液中配置成100U/mL的酶储存液,再稀释为浓度0.04U/mL的α-葡萄糖苷酶溶液。再将缓冲液加入底物4-硝基苯基-α-D-吡喃葡萄糖苷(p-NPG)中,配制为0.5mM的p-NPG底物溶液。待测化合物、阳性对照均使用二甲基亚砜(DMSO)配制成实验需要浓度。
本测试体系分为空白组、对照组、化合物空白组、化合物测试组。具体分组如下:
表1α-葡萄糖苷酶反应体系
在上述实验步骤中,依次在96孔酶标板中加入上述试剂,37℃条件下温孵5min,温孵结束后加入底物,继续温孵30min。405nm的酶标仪测定吸光度值(OD),抑制率计算方法如下公式(1):
其中OD
化合物1~13对α-葡萄糖苷酶活性抑制结果如表1所示。
表1化合物1-13对α-葡萄糖苷酶活性抑制活性
注:
表1结果表明,天然的伪蒲公英甾醇1在50μM(94.16±4.30%)和20μM(76.93±9.60%)时对α-葡萄糖苷酶活性抑制作用高于阳性对照阿卡波糖,其衍生物2~13在50μM和20μM浓度下对α-葡萄糖苷酶都具有一定的抑制活性,进一步测试半数抑制浓度(IC
实施例7化合物11的小鼠体内降血糖活性实验
为了验证体外活性最好的化合物11的体内降血糖活性,进一步评价了其对二型糖尿病小鼠的降血糖和缓解葡萄糖耐量的活性。
(1)造模
购买体重为18-22g的昆明雄性小鼠,饲养条件是室温25℃,湿度50%,光暗循环,自由饮水摄食。小鼠适应环境1周后,将小鼠随机分为两个组,分别是高脂饲料组和空白组,分别给予高脂的饲料和普通的饲料喂养,饮水自由。高脂饲料饲养了4周后,禁食不禁水6小时,采用尾尖取血测量两组小鼠的血糖值,然后以100mg/kg的剂量对高脂饲料组的小鼠的腹腔注射链脲佐菌素(STZ),然后继续给高脂饲料。1周后再一次测量血糖值,空腹血糖值大于11.0mM视为造模成功。
(2)分组与给药
在造模成功之后,根据各小鼠的体重和血糖值,随机分为模型组、阳性对照组、给药组,普通饲料喂养的小鼠当做正常组。阳性对照组给予阿卡波糖(150mg/kg),给药组分别给予化合物11(50mg/kg)和(150mg/kg),正常组和模型组给予相同的生理盐水,连续28天灌胃给药,每日1次。模型组、阳性对照组和各给药组的小鼠还是继续高脂饲料喂养,正常组还是普通饲料喂养。
(3)检测小鼠餐后血糖和口服糖耐量
在连续4周的给药治疗结束后,给药前禁食不禁水3h,2h后取血于尾静脉,检测各组小鼠的餐后血糖浓度。
分别在小鼠给药第4周,测小鼠口服葡萄糖耐量。记录各组小鼠空腹血糖值,给药1h后,给予各组小鼠2.0g/kg的葡萄糖,之后分别在30、60、90、120min尾静脉采血测量血糖值,并采用梯形面积法计算曲线下面积。
(4)数据统计
本论文数据采用均数±标准差(X±SEM)表示,数据统计分析使用SPSS统计软件进行差异显著性分析,组内的比较采用配对样本T检验,两组间的比较采用独立样本T检验,多组间的比较采用单因素方差分析(one-wayANOVA)。
(5)实验结果
(i)化合物11对小鼠餐后血糖的影响
根据各组小鼠给药期间的餐后血糖值变化曲线绘制曲线下面积图,如图13所示。连续4周给药2h后测量小鼠的餐后血糖值发现,模型组血糖在4周内上升的趋势,与正常组小鼠血糖呈现显著性差异。阳性对照阿卡波糖(150mg/kg)与模型组相比在血糖值下降了16.2%,化合物11(150mg/kg)与模型组相比血糖值下降了17.6%,化合物11的低剂量组(50mg/kg)与模型组相比血糖值下降了10.8%,均具有显著性差异,说明化合物11在体内能明显降低二型糖尿病小鼠的餐后血糖。
(ii)化合物11对小鼠口服糖耐量的影响
葡萄糖耐量是指机体对血糖浓度的调节能力,若胰岛素分泌不足的人口服葡萄糖后2小时内血糖将高于正常值。本研究连续给药4周后,为了进一步验证其对体内血糖调节作用,测试了化合物11对糖尿病小鼠口服葡萄糖耐量的影响,如图14所示。口服灌胃葡萄糖后,阳性对照组阿卡波糖(150mg/kg)与化合物11(150mg/kg)和(50mg/kg)在30、60、90和120min时的血糖浓度与模型组相比明显下降。由梯形面积法计算糖耐量曲线下面积(AUC)结果可见,如图15所示。模型组糖尿病小鼠的糖耐量AUC明显比正常小鼠升高(p<0.001),且阳性对照阿卡波糖(150mg/kg)、化合物11(150mg/kg)和(50mg/kg)的糖耐量AUC均低于模型组,且具有显著性差异。口服葡萄糖耐量的实验结果,进一步证实化合物11在小鼠体内能有效缓解高血糖症状,且改善胰岛素分泌不足的问题。
综上所述,本发明首次发现了伪蒲公英甾醇以及3位衍生物具有良好的α-葡萄糖苷酶活性抑制,其中化合物4~6和8~13全部为新化合物,其活性更为首次发现。二型糖尿病小鼠模型研究表明,化合物11在体内和体外均具有良好的α-葡萄糖苷酶抑制活性和降血糖活性。此外,伪蒲公英甾醇为天然产物,在食品或中药中广泛分布,其安全性高,因此,伪蒲公英甾醇及其衍生物的新活性的发现具有良好实际应用价值。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
- 用于车辆的充电系统、充电方法和车辆
- 车辆充电装置、系统及车辆管理系统
- 一种储能式轨道车辆充电系统的绝缘检测方法及控制器
- 一种充电装置及其应用其的车辆搬运器充电系统
- 轨道车辆充电控制方法、轨道车辆、充电站和充电系统
- 车辆、车辆充电装置、车辆充电系统和对车辆充电的方法
