一种大片段DNA跨物种转移辅助菌株的构建方法及应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于基因工程和微生物技术领域,具体涉及一种大片段DNA跨物种转移辅助菌株的构建方法及应用。
背景技术
本发明背景技术中公开的信息仅仅旨在增加对本发明的总体背景的理解,而不必被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
对生命体基因组进行改造经常需要导入大片段外源DNA。例如,微生物次级代谢产物及其衍生物具有广泛的生物活性,如抗感染、抗肿瘤、免疫抑制、降血糖等,它们被广泛地用于医药、农业、食品、环保等领域。由于大多数活性化合物的生物合成基因簇在原始菌株和实验室培养条件下不表达,将次级代谢产物的生物合成基因簇进行克隆修饰后导入异源底盘细胞中表达(即异源表达)是挖掘和改造活性次级代谢产物的重要策略。然而,次级代谢产物的生物合成基因簇通常长达几十kb甚至上百kb,通常需要借助大肠杆菌作为中间供体菌,通过接合转移的方式将基因簇导入合适的底盘宿主。许多底盘宿主,如链霉菌等,具有多重限制性修饰系统,能够切割被甲基化修饰的外源DNA,成为限制外源DNA导入的主要屏障之一。其中一种有效的解决途径是将待转移的DNA导入甲基化系统缺失并带有接合转移辅助系统的大肠杆菌中。如大肠杆菌ET12567的DNA甲基化系统dam,dcm和hsdRM缺失并带有接合转移辅助质粒pUZ8002,大肠杆菌WM3064的甲基化系统hsdS缺失并在基因组上整合有接合转移辅助系统RP4。虽然这些DNA甲基化系统缺失的大肠杆菌供体菌被广泛应用于接合转移,但普遍只能用于导入小片段DNA,这主要是由于长达100kb及以上的大片段DNA难以导入ET12567和WM3064等常用的大肠杆菌供体菌。在这种情况下需要将大片段DNA分成较小的片段多次导入,极大地限制了对目标菌株的基因组改造。
为了构建能够转移大片段DNA的大肠杆菌供体菌,Zhou等人(Curr Microbiol(2012)64:185–190)构建了大肠杆菌DH10B的dam和dcm双突变株,将45kb的质粒pMM1成功导入了天蓝色链霉菌和变铅青链霉菌。构建该双突变株需要敲除recA基因的同时以载体的形式导入外源recA,否则dam和recA双突变菌株无法存活。然而,研究表明DNA错配修复时会识别错配碱基附近未甲基化的DNA链并进行消化,再以甲基化的DNA链为模板进行修复,在dam基因突变株中DNA错配修复系统会导致双链DNA断裂从而导致细菌死亡,因此即使表达外源recA仍然难以实现dam基因的敲除。
发明内容
针对目前现有技术的不足,本发明的目的在于提供一种大片段DNA跨物种转移辅助菌株的构建方法及应用。具体的,本发明成功构建了一株大片段DNA跨物种转移的大肠杆菌供体菌,并将其命名为GB05-RedCon。其DNA甲基化系统缺失并能够进行DNA编辑和介导大片段DNA跨物种转移,从而在细胞工厂和人工生命体的构建方面具有重要的应用价值。基于上述研究成果,从而完成本发明。
具体的,本发明的技术方案如下:
本发明的第一个方面,提供一种大片段DNA跨物种转移辅助菌株的构建方法,所述构建方法包括:将出发菌株大肠杆菌的DNA甲基化系统进行敲除,获得大肠杆菌DNA甲基化系统缺失突变株;改造接合转移辅助质粒pUZ8002,将质粒自带的卡那霉素抗性基因和四环素抗性基因进行敲除,并添加氨苄青霉素抗性基因,便于抗性筛选;将改造后的接合转移辅助质粒导入大肠杆菌DNA甲基化系统缺失突变株,经筛选获得正确的转化子,向其中导入Red/ET同源重组辅助质粒pSC101-ccdA-gbaA即得。
本发明的第二个方面,提供上述构建方法获得的大片段DNA跨物种转移辅助菌株。在本发明的一个具体实施方式中,所述菌株为大肠杆菌工程菌,将其命名为GB05-RedCon。
本发明的第三个方面,提供上述大片段DNA跨物种转移辅助菌株在细胞工厂和/或人工生命体构建中的应用。
本发明的第四个方面,提供一种将大片段外源DNA导入底盘宿主的方法,所述方法包括,将所述大片段外源DNA首先导入上述大片段DNA跨物种转移辅助菌株中,通过接合转移的方式导入所述底盘宿主。
上述技术方案的一个或多个有益技术效果:
本发明成功构建一种大片段DNA跨物种转移辅助菌株,其能够复制并制备未甲基化的DNA;高效导入170kb以上的大片段DNA;将大片段DNA通过接合转移的方式导入其他物种;通过可诱导的同源重组对辅助菌株本身基因组及外源DNA进行编辑。总之,上述技术方案构建的菌株在细胞工厂和人工生命体构建方面具有重要的应用价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
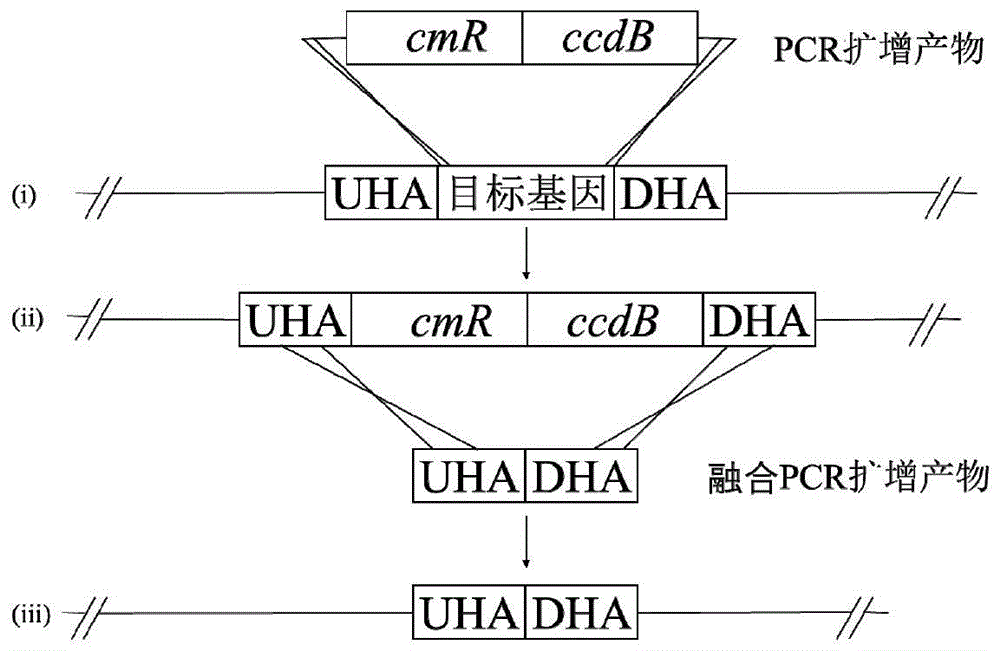
图1为本发明实施例1中利用ccdB反向筛选技术敲除大肠杆菌DNA甲基化系统流程图。
图2为本发明实施例1中大肠杆菌GB2005-dMT甲基化基因缺失PCR检测图。
图3为本发明实施例2中pUZ8002改造质粒酶切鉴定图。A,AfeⅠ酶切鉴定pUZ8002-delkanR-ampR;B,MfeⅠ酶切鉴定pUZ8002-delkanR-delampR;C,AccⅠ酶切鉴定pUZ8002-ampR。
图4为本发明实施例3中172kb外源质粒导入GB05-RedCon(A)和天蓝色链霉菌(B)获得的菌落。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
本发明的一个典型具体实施方式中,提供一种大片段DNA跨物种转移辅助菌株的构建方法,所述方法包括:将出发菌株大肠杆菌的DNA甲基化系统进行敲除,获得大肠杆菌DNA甲基化系统缺失突变株;改造接合转移辅助质粒pUZ8002,将质粒自带的卡那霉素抗性基因和四环素抗性基因进行敲除,并添加氨苄青霉素抗性基因,便于抗性筛选;将改造后的接合转移辅助质粒导入大肠杆菌DNA甲基化系统缺失突变株,经筛选获得正确的转化子,向其中导入Red/ET同源重组辅助质粒pSC101-ccdA-gbaA(见Nucleic Acids Research,2014,42(5):e37)即得。
本发明的又一具体实施方式中,所述出发菌株大肠杆菌具体可以为大肠杆菌GB2005,该菌株由大肠杆菌K-12衍生而来,基因型为:F-mcrAΔ(mmr-hsdRMS-mcrBC)Φ80dlacZΔM15ΔlacX74 endA1 recA1 deoRΔ(ara,leu)7697araD139 galU galK nupGrpsLλ-fhuAIS2ΔrecETΔybcC。该菌株已被广泛应用,可通过市售等方式获得。
所述将出发菌株大肠杆菌的DNA甲基化系统进行敲除的具体方法包括:基于ccdB反向筛选技术敲除基因yhdJ、dcm、mutS和dam。将敲除上述基因后获得的大肠杆菌DNA甲基化系统缺失突变株命名为GB2005-dMT。
其中,所述yhdJ、dcm、mutS和dam的核苷酸序列如SEQ ID NO.1-4所示。
所述ccdB反向筛选技术是本领域所熟知的,其联合Red/ET重组技术可以对DNA序列进行基因敲除、点突变和模块替换等修饰,而不留下任何痕迹。在本发明中,使用ccdB反向筛选技术联合Red/ET重组技术对大肠杆菌GB2005的基因yhdJ、dcm、mutS和dam依次进行敲除,从而敲除其DNA甲基化系统。当然,基于本发明的发明构思,使用其他现有已知方式敲除上述基因同样在本发明的保护范围之内。
所述改造接合转移辅助质粒pUZ8002的具体方法包括:将接合转移辅助质粒pUZ8002转入大肠杆菌GB05-Red中,扩增出片段Kan-ampR,其两端带有pUZ8002质粒上卡那霉素抗性基因kanR的同源臂和AvrⅡ的酶切位点;将所述片段Kan-ampR导入诱导表达重组酶的GB05-Red::pUZ8002中,筛选ampR替换掉kanR的突变株GB05-Red::pUZ8002-delkanR-ampR;提取质粒pUZ8002-delkanR-ampR并用限制性内切酶AfeⅠ进行酶切验证,用限制性内切酶AvrⅡ消化质粒pUZ8002-delkanR-ampR以去除ampR,利用T4 DNA连接酶连接消化得到的线性质粒片段,利用限制性内切酶MfeⅠ对质粒pUZ8002-delkanR-delampR进行鉴定;扩增出片段Tet-ampR,其两端带有pUZ8002质粒上tetR基因的同源臂;将PCR产物Tet-ampR导入诱导表达重组酶的GB05-Red::pUZ8002-delkanR-delampR中,筛选ampR替换掉tetR的突变株GB05-Red::pUZ8002-delkanR-deltetR-ampR,用限制性内切酶AccⅠ对得到质粒pUZ8002-delkanR-deltetR-ampR进行鉴定,其即为改造后的接合转移辅助质粒。在本发明中,将质粒pUZ8002-delkanR-deltetR-ampR可以缩写为pUZ8002-ampR。
本发明的又一具体实施方式中,提供上述构建方法获得的大片段DNA跨物种转移辅助菌株。在本发明的一个具体实施方式中,所述菌株为大肠杆菌工程菌,将其命名为GB05-RedCon。
本发明的又一具体实施方式中,提供上述大片段DNA跨物种转移辅助菌株在细胞工厂和/或人工生命体构建中的应用。
本发明的又一具体实施方式中,所述应用包括:
(a)将活性次级代谢产物生物合成基因簇及其多拷贝版本导入异源底盘细胞,从而激活沉默基因簇表达并获得新型活性代谢产物或者提高活性代谢产物的生产水平;
(b)实现对细菌基因组的大尺度改造,包括底盘细胞改造和人工染色体构建。
本发明的又一具体实施方式中,提供一种将大片段外源DNA导入底盘宿主的方法,所述方法包括,将所述大片段外源DNA首先导入上述大片段DNA跨物种转移辅助菌株中,通过接合转移的方式导入所述底盘宿主。
其中,所述大片段DNA可以为不小于50kb,进一步不小于100kb,更进一步为不小于170kb。
所述大片段DNA可以是次级代谢产物的生物合成基因簇。
所述底盘宿主可以是能够通过接合转移导入DNA的细菌,如链霉菌等,在此不做具体限定。
进一步的,所述大片段DNA的来源可以是任意物种的DNA,或者人工合成的DNA,在此不做具体限定。
此外,需要说明的是,虽然上述以大肠杆菌GB2005作为出发菌株为例,构建大片段DNA跨物种转移辅助菌株,但是基于本申请的发明构思,在不付出创造性劳动的前提下,通过常规替换其他出发菌株或相关生物元件,获取其他大片段DNA跨物种转移辅助菌株等,同样属于本申请的保护范围之内。
现结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;以下实施例中所用材料、试剂和仪器,未经特殊说明,均为本领域中的常规材料、试剂和仪器,均可通过商业渠道获得。
表1实施例中使用的引物序列
实施例1:大肠杆菌DNA甲基化系统缺失突变株的构建
我们选取大肠杆菌GB2005作为目标菌株通过ccdB反向筛选技术进行甲基化系统缺失突变株的构建(图1)。首先在大肠杆菌GB2005中转入pSC101-ccdA-gbaA温度敏感型质粒,其中Red/ET重组系统和ccdA抗毒基因分别由鼠李糖和阿拉伯糖诱导型启动子控制表达。用引物对KOyhdJ-cmR-F和KOyhdJ-ccdB-R扩增cmR-ccdB片段,片段两端各带有60bpyhdJ基因的上下游同源臂,将500ng该线性片段电转到诱导了Red重组系统和ccdA抗毒基因的GB2005::pSC101-ccdA-gbaA中,涂布添加氯霉素和四环素的LB固体培养基平板(蛋白胨10g/L,酵母粉5g/L,氯化钠5g/L,琼脂1.5%),用引物对JC-yhdJ-F和JC-yhdJ-R PCR检测将cmR-ccdB替换yhdJ基因的重组子。然后用yhdJ-UP-F/yhdJ-DN-UP-R和yhdJ-UP-DN-F/yhdJ-DN-R分别扩增yhdJ基因上下游各100bp的DNA片段,并进行融合PCR,将500ng融合后PCR产物电转到只诱导了Red重组系统的GB2005-cmR-ccdB::pSC101-ccdA-gbaA中,获得敲除cmR-ccdB的重组子GB2005-ΔyhdJ::pSC101-ccdA-gbaA。平板中不加抗生素筛选并置于37℃培养箱中培养,以消除pSC101-ccdA-gbaA质粒。利用引物对对JC-yhdJ-F和JC-yhdJ-R对获得的突变株GB2005-ΔyhdJ进行菌落进行PCR鉴定,扩增出303bp的DNA片段表明yhdJ基因被成功敲除。
在GB2005-ΔyhdJ突变株中利用ccdB反向筛选技术敲除dcm基因。将pSC101-ccdA-gbaA温度敏感型质粒转入到大肠杆菌GB2005-ΔyhdJ中。用KOdcm-cmR-F和KOdcm-ccdB-R引物对扩增cmR-ccdB片段,片段两端各带有60bp dcm基因的上下游同源臂,将500ng PCR产物电转到诱导了Red重组系统和ccdA抗毒基因的GB2005-ΔyhdJ::pSC101-ccdA-gbaA中,通过氯霉素筛选将cmR-ccdB替换dcm基因的重组子,用引物对JC-dcm-F和JC-dcm-R对重组子进行PCR检测。然后用引物dcm-UP-F/dcm-DN-UP-R和dcm-UP-DN-F/dcm-DN-R分别扩增dcm基因上下游各100bp的DNA片段,并进行融合PCR,将500ng融合PCR产物电转到只诱导了Red重组系统的GB2005-ΔyhdJ-cmR-ccdB::pSC101-ccdA-gbaA中,获得敲除cmR-ccdB的重组子GB2005-ΔyhdJ-Δdcm::pSC101-ccdA-gbaA。平板中不加抗生素筛选并置于37℃培养箱中培养,以消除pSC101-ccdA-gbaA质粒。通过引物对JC-dcm-F和JC-dcm-R对获得的突变株GB2005-ΔyhdJ-Δdcm进行菌落PCR鉴定,扩增出287bp的DNA片段表明dcm基因被成功敲除。
在GB2005-ΔyhdJ-Δdcm突变株中利用ccdB技术敲除mutS基因。将pSC101-ccdA-gbaA温度敏感型质粒转入到大肠杆菌GB2005-ΔyhdJ-Δdcm中。引物对用KOmutS-cmR-F和KOmutS-ccdB-R扩增cmR-ccdB片段,片段两端各带有60bp mutS基因的上下游同源臂,将500ng PCR产物电转到诱导了Red重组系统和ccdA抗毒基因的GB2005-ΔyhdJ-Δdcm::pSC101-ccdA-gbaA中,通过氯霉素筛选cmR-ccdB替换mutS基因的重组子,然后用引物对JC-mutS-F和JC-mutS-R进行PCR检测。用引物mutS-UP-F/mutS-DN-UP-R和mutS-UP-DN-F/mutS-DN-R分别扩增mutS基因上下游各100bp的DNA片段,并进行融合PCR,将500ng融合PCR产物电转到只诱导了Red重组系统的GB2005-ΔyhdJ-Δdcm-cmR-ccdB::pSC101-ccdA-gbaA中,获得突变株GB2005-ΔyhdJ-Δdcm-ΔmutS::pSC101-ccdA-gbaA。平板中不加抗生素筛选并置于37℃培养箱中培养,以消除pSC101-ccdA-gbaA质粒。通过引物对JC-mutS-F和JC-mutS-R对获得的突变株GB2005-ΔyhdJ-Δdcm-ΔmutS进行PCR鉴定,扩增出320bp的DNA片段即表明mutS基因被成功敲除。
在GB2005-ΔyhdJ-Δdcm-ΔmutS突变株中利用ccdB反向筛选技术敲除dam基因。将pSC101-ccdA-gbaA温度敏感型质粒转入到大肠杆菌GB2005-ΔyhdJ-Δdcm-ΔmutS中。用引物对KOdam-cmR-F和KOdam-ccdB-R扩增cmR-ccdB片段,片段两端各带有60bp dam基因的上下游同源臂,将500ng PCR产物电转到诱导了Red重组系统和ccdA抗毒基因的GB2005-ΔyhdJ-Δdcm-ΔmutS::pSC101-ccdA-gbaA中,通过氯霉素筛选cmR-ccdB替换dam基因的重组子,用引物对JC-dam-F和JC-dam-R对重组子进行PCR检测。然后用引物dam-UP-F/dam-DN-UP-R和dam-UP-DN-F/dam-DN-R分别扩增dam基因上下游各100bp的DNA片段,并进行融合PCR,将500ng融合PCR产物电转到只诱导了Red重组系统的GB2005-ΔyhdJ-Δdcm-ΔmutS-cmR-ccdB::pSC101-ccdA-gbaA中,获得突变株GB2005-ΔyhdJ-Δdcm-ΔmutS::pSC101-ccdA-gbaA。平板中不加抗生素筛选并置于37℃培养箱中培养,以消除pSC101-ccdA-gbaA质粒。利用引物对JC-dam-F和JC-dam-R对突变株进行菌落PCR鉴定。扩增出302bp的DNA片段表明dam基因被成功敲除。该DNA甲基化系统缺失菌株命名为GB2005-dMT,对该菌中敲除的基因进行菌落PCR验证。菌落PCR表明GB2005-dMT中dcm,yhdJ,mutS和dam基因被成功敲除,电泳图见图2。
实施例2:接合转移辅助质粒的改造
将接合转移辅助质粒pUZ8002电转到大肠杆菌GB05-Red中。用引物KanH-ampF和KanH-ampR扩增出片段kan-ampR(1079bp),两端带有50bp pUZ8002质粒上卡那霉素抗性基因kanR的同源臂和AvrⅡ的酶切位点。将PCR产物kan-ampR导入诱导表达重组酶的GB05-Red::pUZ8002中,在含有氨苄青霉素的LB平板上筛选ampR替换掉kanR的突变株GB05-Red::pUZ8002-delKanR-ampR。提取质粒pUZ8002-delKanR-ampR并用限制性内切酶AfeⅠ进行酶切验证(图3A)。用限制性内切酶AvrⅡ消化质粒pUZ8002-delKanR-ampR以去除ampR,利用T4DNA连接酶连接消化得到的线性质粒片段,利用限制性内切酶MfeⅠ对质粒pUZ8002-delKanR-delampR进行鉴定(图3B)。用引物TetH-ampF与TetH-ampR扩增出片段tetR-ampR(1067bp),两端带有50bp pUZ8002质粒上tetR基因的同源臂。将PCR产物tetR-ampR导入诱导表达重组酶的GB05-Red::pUZ8002-delKanR-delampR中,在含有氨苄青霉素的LB平板上筛选ampR替换掉tetR的突变株GB05-Red::pUZ8002-delKanR-deltetR-ampR,用限制性内切酶AccⅠ对得到质粒pUZ8002-delKanR-deltetR-ampR进行鉴定(图3C)。pUZ8002-delKanR-deltetR-ampR缩写为pUZ8002-ampR。
实施例3:大片段DNA跨物种转移辅助菌株的构建
在GB2005-dMT平板上挑取单克隆接种到1.8mL LB液体培养基中,37℃,950rpm过夜培养,取40μL过夜菌转接到1.4mL LB液体培养基中,37℃,950rpm培养2h。离心收集菌体,用无菌水洗2次,将改造后的pUZ8002-ampR质粒取200ng电转至GB2005-dMT中,平板中加入氨苄青霉素进行筛选,37℃过夜培养后挑取单克隆进行质粒提取及酶切鉴定,得到正确的转化子即为跨物种转移辅助菌株大肠杆菌GB05-Con。将Red/ET同源重组辅助质粒pSC101-ccdA-gbaA通过电转导入大肠杆菌GB05-Con,获得既能对基因组和外源DNA进行编辑又能辅助大片段DNA跨物种转移的大肠杆菌GB05-RedCon。
将前期构建的带有接合转移元件及安普霉素抗性筛选标记的一个172kb大质粒电转至大肠杆菌GB05-RedCon中(图4),挑取单克隆进行PCR鉴定,验证正确的转化子接种到氨苄青霉素和安普霉素双抗的液体LB培养基中,37℃,950rpm过夜培养。在250mL三角瓶中加入10mL上述双抗LB液体培养基,取300μL过夜菌转接到三角瓶中,37℃,200rpm培养3h。8000rpm离心8分钟收集菌体,用无抗性LB液体洗菌体两次,弃上清,加入1mL LB液体培养基悬浮菌体。取100μL(孢子量为10
实施例中使用的基因序列信息
yhdJ基因序列:
ATGAGAACAGGATGTGAACCGACCCGGTTTGGTAATGAAGCTAAGACCATTATTCACGGTGATGCGCTTGCCGAACTTAAAAAGATCCCCGCCGAAAGTGTCGATCTGATCTTTGCCGACCCACCATATAACATCGGTAAAAATTTTGATGGTCTGATCGAAGCCTGGAAAGAAGATCTGTTTATCGACTGGCTGTTTGAAGTGATTGCAGAGTGCCACCGCGTTCTGAAAAAGCAGGGCAGCATGTACATCATGAACAGTACGGAAAACATGCCCTTTATCGATCTCCAGTGCCGCAAGCTTTTTACCATCAAAAGTCGCATCGTCTGGTCATATGACAGTTCTGGAGTGCAGGCGAAAAAACACTACGGCTCCATGTACGAACCCATCCTGATGATGGTGAAAGACGCAAAGAACTACACATTCAACGGTGATGCTATTCTGGTAGAAGCCAAAACCGGATCGCAGCGCGCGTTGATCGATTATCGCAAAAATCCTCCACAGCCTTACAATCATCAAAAAGTACCGGGTAACGTTTGGGATTTTCCGCGCGTGCGTTATTTGATGGATGAATATGAAAACCACCCGACGCAAAAACCGGAAGCCTTACTGAAACGCATTATTCTCGCCTCTTCCAACCCAGGCGATATCGTTCTCGACCCGTTTGCTGGTAGCTTTACTACCGGTGCCGTAGCCATCGCCAGCGGACGAAAATTCATTGGTATTGAGATCAACAGCGAGTACATCAAAATGGGGCTTCGACGGCTGGATGTCGCGTCGCATTACTCTGCGGAAGAACTGGCGAAAGTGAAAAAAAGAAAGACCGGCAACCTGTCAAAACGAAGCCGGTTAAGCGAAGTTGACCCCGATCTCATTACAAAGTAA(SEQ ID NO.1)
dcm基因序列:
ATGCAGGAAAATATATCAGTAACCGATTCATACAGCACCGGGAATGCCGCACAGGCAATGCTGGAGAAACTGCTGCAAATTTATGATGTTAAAACGTTGGTGGCGCAGCTTAATGGTGTAGGTGAGAATCACTGGAGCGCGGCAATTTTAAAACGTGCGCTGGCGAATGACTCGGCATGGCACCGTTTAAGTGAGAAAGAGTTCGCCCATCTGCAAACGTTATTACCCAAACCACCGGCACATCATCCGCATTATGCGTTTCGCTTTATCGATCTATTCGCCGGAATTGGCGGCATCCGTCGCGGTTTTGAATCGATTGGCGGACAGTGCGTGTTTACCAGCGAATGGAACAAACATGCGGTACGCACTTATAAAGCCAACCATTATTGCGATCCGGCGACGCATCATTTTAATGAAGATATCCGCGACATCACCCTCAGCCATAAAGAAGGCGTGAGTGATGAGGCGGCGGCGGAACATATTCGTCAACACATTCCTGAACACGATGTTTTACTGGCCGGTTTCCCTTGTCAGCCATTTTCGCTGGCTGGCGTATCGAAAAAGAACTCGCTCGGGCGGGCGCACGGTTTTGCCTGCGATACCCAGGGCACGCTGTTTTTTGATGTGGTACGCATTATCGACGCGCGTCGTCCGGCGATGTTTGTGCTCGAAAACGTCAAAAACCTGAAAAGTCACGACCAGGGTAAAACGTTCCGCATCATCATGCAGACGCTGGACGAACTGGGCTATGACGTGGCTGATGCAGAAGATAATGGGCCAGACGATCCGAAAATCATCGACGGCAAACATTTTCTGCCGCAGCACCGTGAACGCATCGTGCTGGTGGGTTTTCGTCGCGATCTGAATCTGAAAGCCGATTTTACCCTGCGTGATATCAGCGAATGTTTCCCTGCGCAGCGAGTGACGCTGGCGCAGCTGTTGGACCCGATGGTCGAGGCGAAATATATCCTGACGCCGGTGCTGTGGAAGTACCTCTATCGATATGCGAAAAAACATCAGGCGCGCGGTAACGGCTTCGGTTATGGAATGGTTTATCCGAACAATCCGCAAAGCGTCACGCGTACGCTGTCTGCGCGTTATTACAAAGATGGCGCGGAAATTTTAATCGATCGCGGCTGGGATATGGCCACGGGTGAGAAAGACTTTGACGATCCGCTGAATCAGCAACATCGTCCACGTCGGTTAACGCCTCGGGAATGCGCGCGCTTAATGGGTTTTGAAGCGCCGGGAGAAGCGAAATTCCGTATTCCGGTTTCGGACACTCAGGCCTATCGCCAGTTCGGTAACTCGGTGGTCGTGCCGGTCTTTGCCGCGGTGGCAAAACTGCTTGAGCCAAAAATCAAACAGGCGGTGGCGTTGCGTCAGCAAGAGGCACAACATGGCCGACGTTCACGATAA(SEQ ID NO.2)
mutS基因序列:
ATGAGTGCAATAGAAAATTTCGACGCCCATACGCCCATGATGCAGCAGTATCTCAGGCTGAAAGCCCAGCATCCCGAGATCCTGCTGTTTTACCGGATGGGTGATTTTTATGAACTGTTTTATGACGACGCAAAACGCGCGTCGCAACTGCTGGATATTTCACTGACCAAACGCGGTGCTTCGGCGGGAGAGCCGATCCCGATGGCGGGGATTCCCTACCATGCGGTGGAAAACTATCTCGCCAAACTGGTGAATCAGGGAGAGTCCGTTGCCATCTGCGAACAAATTGGCGATCCGGCGACCAGCAAAGGTCCGGTTGAGCGCAAAGTTGTGCGTATCGTTACGCCAGGCACCATCAGCGATGAAGCCCTGTTGCAGGAGCGTCAGGACAACCTGCTGGCGGCTATCTGGCAGGACAGCAAAGGTTTCGGCTACGCGACGCTGGATATCAGTTCCGGGCGTTTTCGCCTGAGCGAACCGGCTGACCGCGAAACGATGGCGGCAGAACTGCAACGCACTAATCCTGCGGAACTGCTGTATGCAGAAGATTTTGCTGAAATGTCGTTAATTGAAGGCCGTCGCGGCCTGCGCCGTCGCCCGCTGTGGGAGTTTGAAATCGACACCGCGCGCCAGCAGTTGAATCTGCAATTTGGGACCCGCGATCTGGTCGGTTTTGGCGTCGAGAACGCGCCGCGCGGACTTTGTGCTGCCGGTTGTCTGTTGCAGTATGCGAAAGATACCCAACGTACGACTCTGCCGCATATTCGTTCCATCACCATGGAACGTGAGCAGGACAGCATCATTATGGATGCCGCGACGCGTCGTAATCTGGAAATCACCCAGAACCTGGCGGGTGGTGCGGAAAATACGCTGGCTTCTGTGCTCGACTGCACCGTCACGCCGATGGGCAGCCGTATGCTGAAACGCTGGCTGCATATGCCAGTGCGCGATACCCGCGTGTTGCTTGAGCGCCAGCAAACTATTGGCGCATTGCAGGATTTCACCGCCGGGCTACAGCCGGTACTGCGTCAGGTCGGCGACCTGGAACGTATTCTGGCACGTCTGGCTTTACGAACTGCTCGCCCACGCGATCTGGCCCGTATGCGCCACGCTTTCCAGCAACTGCCGGAGCTGCGTGCGCAGTTAGAAACTGTCGATAGTGCACCGGTACAGGCGCTACGTGAGAAGATGGGCGAGTTTGCCGAGCTGCGCGATCTGCTGGAGCGAGCAATCATCGACACACCGCCGGTGCTGGTACGCGACGGTGGTGTTATCGCATCGGGCTATAACGAAGAGCTGGATGAGTGGCGCGCGCTGGCTGACGGCGCGACCGATTATCTGGAGCGTCTGGAAGTCCGCGAGCGTGAACGTACCGGCCTGGACACGCTGAAAGTTGGCTTTAATGCGGTGCACGGCTACTACATTCAAATCAGCCGTGGGCAAAGCCATCTGGCACCCATCAACTACATGCGTCGCCAGACGCTGAAAAACGCCGAGCGCTACATCATTCCAGAGCTAAAAGAGTACGAAGATAAAGTTCTCACCTCAAAAGGCAAAGCACTGGCACTGGAAAAACAGCTTTATGAAGAGCTGTTCGACCTGCTGTTGCCGCATCTGGAAGCGTTGCAACAGAGCGCGAGCGCGCTGGCGGAACTCGACGTGCTGGTTAACCTGGCGGAACGGGCCTATACCCTGAACTACACCTGCCCGACCTTCATTGATAAACCGGGCATTCGCATTACCGAAGGTCGCCATCCGGTAGTTGAACAAGTACTGAATGAGCCATTTATCGCCAACCCGCTGAATCTGTCGCCGCAGCGCCGCATGTTGATCATCACCGGTCCGAACATGGGCGGTAAAAGTACCTATATGCGCCAGACCGCACTGATTGCGCTGATGGCCTACATCGGCAGCTATGTACCGGCACAAAAAGTCGAGATTGGACCTATCGATCGCATCTTTACCCGCGTAGGCGCGGCAGATGACCTGGCGTCCGGGCGCTCAACCTTTATGGTGGAGATGACTGAAACCGCCAATATTTTACATAACGCCACCGAATACAGTCTGGTGTTAATGGATGAGATCGGGCGTGGAACGTCCACCTACGATGGTCTGTCGCTGGCGTGGGCGTGCGCGGAAAATCTGGCGAATAAGATTAAGGCATTGACGTTATTTGCTACCCACTATTTCGAGCTGACCCAGTTACCGGAGAAAATGGAAGGCGTCGCTAACGTGCATCTCGATGCACTGGAGCACGGCGACACCATTGCCTTTATGCACAGCGTGCAGGATGGCGCGGCGAGCAAAAGCTACGGCCTGGCGGTTGCAGCTCTGGCAGGCGTGCCAAAAGAGGTTATTAAGCGCGCACGGCAAAAGCTGCGTGAGCTGGAAAGCATTTCGCCGAACGCCGCCGCTACGCAAGTGGATGGTACGCAAATGTCTTTGCTGTCAGTACCAGAAGAAACTTCGCCTGCGGTCGAAGCTCTGGAAAATCTTGATCCGGATTCACTCACCCCGCGTCAGGCGCTGGAGTGGATTTATCGCTTGAAGAGCCTGGTGTAA(SEQ ID NO.3)
dam基因序列:
ATGAAGAAAAATCGCGCTTTTTTGAAGTGGGCAGGGGGCAAGTATCCCCTGCTTGATGATATTAAACGGCATTTGCCCAAGGGCGAATGTCTGGTTGAGCCTTTTGTAGGTGCCGGGTCGGTGTTTCTCAACACCGACTTTTCTCGTTATATCCTTGCCGATATCAATAGCGACCTGATCAGTCTCTATAACATTGTGAAGATGCGTACTGATGAGTACGTACAGGCCGCACGCGAGCTGTTTGTTCCCGAAACAAATTGCGCCGAGGTTTACTATCAGTTCCGCGAAGAGTTCAACAAAAGCCAGGATCCGTTCCGTCGGGCGGTACTGTTTTTATATTTGAACCGCTACGGTTACAACGGCCTGTGTCGTTACAATCTGCGCGGTGAGTTTAACGTGCCGTTCGGCCGCTACAAAAAACCCTATTTCCCGGAAGCAGAGTTGTATCACTTCGCTGAAAAAGCGCAGAATGCCTTTTTCTATTGTGAGTCTTACGCCGATAGCATGGCGCGCGCAGATGATGCATCCGTCGTCTATTGCGATCCGCCTTATGCACCGCTGTCTGCGACCGCCAACTTTACGGCGTATCACACAAACAGTTTTACGCTTGAACAACAAGCGCATCTGGCGGAGATCGCCGAAGGTCTGGTTGAGCGCCATATTCCAGTGCTGATCTCCAATCACGATACGATGTTAACGCGTGAGTGGTATCAGCGCGCAAAATTGCATGTCGTCAAAGTTCGACGCAGTATAAGCAGCAACGGCGGCACACGTAAAAAGGTGGACGAACTGCTGGCTTTGTACAAACCAGGAGTCGTTTCACCCGCGAAAAAATAA(SEQ ID NO.4)
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
