一种绿色磷光主体材料及含有该材料的OLED发光器件
文献发布时间:2023-06-19 09:41:38
技术领域
本发明有机电致发光材料领域,具体涉及一种绿色磷光主体材料及含有该材料的OLED发光器件。
背景技术
有机发光二极管(Organic light emitting diode,OLED),最初是由美籍华裔教授邓青云在实验室中发现的,从此以后人们展开了对OLED的开发与研究。OLED有两大应用领域:照明和显示。
目前国内外对OLED的研究已经取得了显著进展,基于发光层全部采用荧光材料的第一代OLED仅利用单重态激子发光,其内量子效率(IQE)只有25%,基于发光层采用过渡金属磷光材料的第二代OLED通过自旋轨道耦合作用,使得三线态激子的辐射成为可能,理论IQE可达100%。但是,第二代基于磷光材料的OLED仍然面临着很多问题:(1)发光层常采用的过渡金属如Os、Ir、Pt等价格高昂,不利于高效率OLED器件的批量生产;(2)在高电流下三线态-三线态激子容易发生猝灭现象而使得器件效率滚降严重。最近几年来,为了降低器件生产成本,使得OLED真正的走向商业化和产业化,避免在发光层使用贵金属掺杂的磷光材料。
OLED的发展促进了人们对有机电致发光材料的研究。相对于无机发光材料,有机电致发光材料具有以下优点:有机材料加工性能好,可通过蒸镀或者旋涂的方法在任何基板上成膜;有机分子结构的多样性使得可以通过分子结构设计及修饰的方法来调节有机材料的热稳定性、机械性能、发光及导电性能,使得材料有很大的改进空间。
OLED发光器件靠的是在有机半导体材料中传输的载流子(电子和空穴)的重组。众所周知,有机材料的导电性很差,有机半导体中没有延续的能带,载流子的传输常用跳跃理论来描述。为了能使有机电致发光器件在应用方面达到突破,必须克服有机材料电荷注入及传输能力差的困难。科学家们通过器件结构的调整,例如增加器件有机材料层的数目,并且使不同的有机层扮演不同的器件层,例如有的功能材料可以促进电子从阴极注入,有的功能材料可以促进空穴从阳极注入,有的材料可以促进电荷的传输,有的材料则能起到阻挡电子或者空穴传输的作用。当然在OLED发光器件里,最重要的各种颜色的发光材料也要达到与相邻功能材料相匹配的目的。因此,效率好寿命长的OLED发光器件通常是器件结构以及各种有机材料优化搭配的结果,这就为化学家们设计开发各种结构的功能化材料提供了极大的机遇和挑战。
发明内容
发明目的:针对上述技术问题,本发明提供了一种绿色磷光主体材料及含有该材料的OLED发光器件。
为了达到上述发明目的,本发明所采用的技术方案如下:
一种绿色磷光主体材料,其结构式如下所示:
其中,L
R
R
X
m为0、1、2。
进一步地,所述L
进一步地,R
进一步地,R
进一步地,所述绿色磷光主体材料为以下结构式化合物中的任意一种:
进一步地,制备方法如下:
将结构式为
进一步地,混合溶液中乙二醇二胺醚和水的体积比为1:1-5。
一种OLED发光器件,包括阴极、阳极和发光层,所述发光层至少含有一种上述的绿色磷光主体材料。
一种电子显示设备,包括上述的OLED发光器件。
一种照明装置,包括上述的OLED发光器件。
本发明的有益效果:
本发明设计的新型绿色磷光主体材料是一种具有中间禁阻结构的双极性绿色磷光主体材料,其中间体链接基团为电子传输能力非常高的给电子基团,并且通过单键的方式链接,增加了材料分子的空间位阻,进而大大降低了材料分子的平面性及结晶性,提高了材料分子的玻璃化转变温度及热稳定性,大大提高了有机电致发光器件的稳定性及使用寿命。
通过增加中间链接基团的长度及空间位阻,降低材料分子的共轭效应,增加阻断效果,进而提高材料分子的三线态能级,有效阻止掺杂材料三线态能量的回传给主体材料,进而提高材料的量子效率,进而提高有机电致发光器件的发光效率。
本发明设计的绿色磷光主体材料,其更为突出的特点为具有较高的三线态能级的同时具有适当的HOMO及LUMO能级,能够和目前市场主流的电子传输材料及空穴传输材料达到很好的匹配,以使有机电致发光器件具有更低的驱动电压及更长的寿命。
附图说明
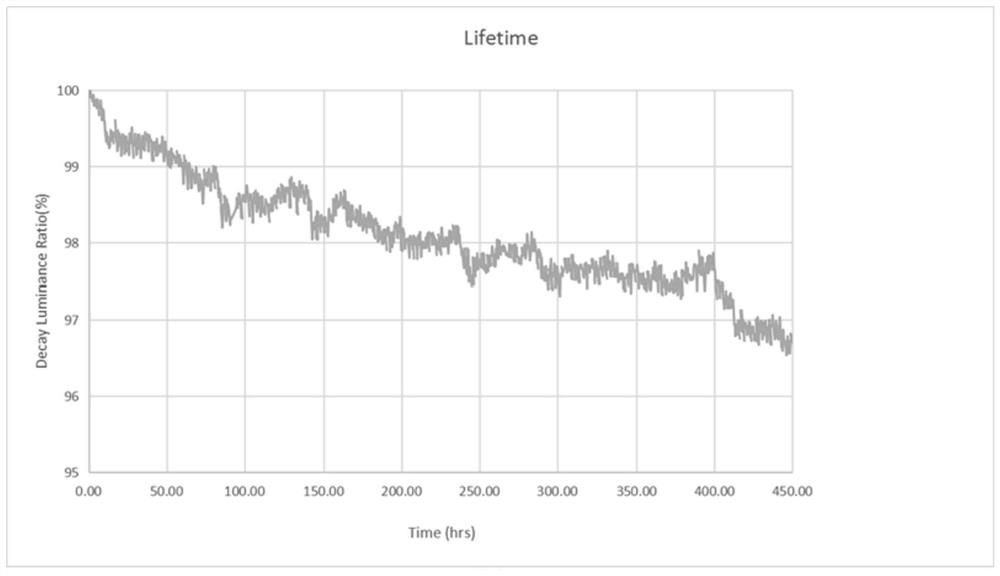
图1为本发明应用例1中的有机电致发光器件的发光强度与发光时间变化的关系图;
由图1可知应用例1中的有机电致发光器件的寿命(T97%)为412小时。
具体实施方式
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1:
绿色磷光主体材料(1)的合成方法包括以下步骤:
(1)
将化合物1((Z)-N'-hydroxy-N-(pyridin-2-yl)carbamimidic chloride)(10g,171g/mol,1eq,58.48mmol)加入到无水THF中(100g,化合物1质量的10倍),氮气保护下降温至0℃,将三氟乙酸酐(1.1eq,210g/mol,64.33mmol,13.51g),滴加完毕后继续搅拌30min后缓慢恢复室温,继续反应3h,反应用饱和NaHCO
(2)
将化合物2(2-chloro-[1,2,4]triazolo[1,5-a]pyridine)(6g,153g/mol,39.22mmol)、化合物3(dibenzo[b,d]furan-1-ylboronic acid)(1eq,8.31g,212g/mol,39.22mmol)和碳酸钠(2eq,8.31g,105.99g/mol,78.44mmol)加入到乙二醇二胺醚(120g,化合物2的20倍质量)和水(120g,化合物2的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.36g,304.37g/mol,1.18mmol)和乙酸钯(II)(0.5%eq,0.044g,224.51g/mol,
0.19mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到化合物4(2-(dibenzo[b,d]furan-1-yl)-[1,2,4]triazolo[1,5-a]pyridine)(9.67g,收率
86.5%),MS(EI):285(M
(3)
将化合物4(9g,285g/mol,31.58mmol)加入到乙酸(180g,化合物4的20倍质量)和浓硫酸(180g,化合物4的20倍质量),混匀后再将N-溴代琥珀酰亚胺(1.0eq,5.62g,177.98g/mol,31.58mmol)避光反应2h,反应液倒入冰水混合物中,快速搅拌,将洗出的固体滤出,再经过柱层析后得到化合物5(2-(6-bromodibenzo[b,d]furan-1-yl)-[1,2,4]triazolo[1,5-a]pyridine)(6.49g,收率56.6%),MS(EI):363(M
(4)
氮气保护下,将化合物5(2-(6-bromodibenzo[b,d]furan-1-yl)-[1,2,4]triazolo[1,5-a]pyridine)(363g/mol,16.53mmol,6g),化合物6(diisopropyl(isopropoxymethyl)boronate)(1eq,188.16g/mol,16.53mmol,3.11g)加入到无水THF(60g,化合物5的10倍质量)中,混合冷却至-78℃后,滴加正丁基锂的2.5M正己烷溶液(1.1eq,64g/mol,18.18mmol,7.3ml),滴毕后搅拌反应30min恢复室温,继续反应1h,反应液用饱和氯化铵溶液淬灭(120g,化合物5的20倍质量),再用二氯甲烷(120g,化合物5的20倍质量)萃取,分液后有机相干燥并减压浓缩,石油醚洗涤,得到化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5.05g,收率92.8%),MS(EI):329(M
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物8(3-bromo-9-(3-phenylquinoxalin-2-yl)-9H-carbazole)(1eq,6.82g,449g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应20h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(1)(8.88g,收率89.4%),MS(EI):654(M
实施例2:
绿色磷光主体材料(2)的合成方法包括以下步骤:
步骤1-4与实施例1相同,步骤如下所示:
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物9(9-(3-([1,1'-biphenyl]-3-yl)quinoxalin-2-yl)-3-bromo-9H-carbazole)(1eq,7.97g,525g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(2)(9.61g,收率86.7%),MS(EI):730(M
实施例3:
绿色磷光主体材料(4)的合成方法包括以下步骤:
步骤1-4与实施例1相同,步骤如下所示:
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物10(9-(3-([1,1'-biphenyl]-4-yl)quinoxalin-2-yl)-3-bromo-9H-carbazole)(1eq,7.97g,525g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(4)(9.11g,收率82.2%),MS(EI):730(M
实施例4:
绿色磷光主体材料(17)的合成方法包括以下步骤:
步骤1-4与实施例1相同,步骤如下所示:
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物11(3-bromo-9-(4-(3-phenylquinoxalin-2-yl)phenyl)-9H-carbazole)(1eq,7.97g,525g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(17)(10.04g,收率90.5%),MS(EI):730(M
实施例5:
绿色磷光主体材料(33)的合成方法包括以下步骤:
步骤1-4与实施例1相同,步骤如下所示:
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物12(3-bromo-9-(4-(3-phenylquinoxalin-2-yl)phenyl)-9H-carbazole)(1eq,7.97g,525g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(33)(9.55g,收率86.1%),MS(EI):730(M
实施例6:
绿色磷光主体材料(44)的合成方法包括以下步骤:
步骤1-4与实施例1相同,步骤如下所示:
(5)
将化合物7((9-([1,2,4]triazolo[1,5-a]pyridin-2-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,329g/mol,15.19mmol)、化合物13(9-(3-(3-(9H-carbazol-9-yl)quinoxalin-2-yl)phenyl)-3-bromo-9H-carbazole)(1eq,9.33g,614g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物7的20倍质量)和水(100g,化合物7的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.14g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.075mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(44)(9.65g,收率77.6%),MS(EI):819(M
实施例7:
绿(1色)磷光主体材料(49)的合成方法包括以下步骤:
将化合物14(4-bromopyridine)(10g,156.95g/mol,63.71mmol)、化合物3(dibenzo[b,d]furan-1-ylboronic acid)(1eq,13.51g,212g/mol,63.71mmol)和碳酸钠(2eq,13.51g,105.99g/mol,127.42mmol)加入到乙二醇二胺醚(200g,化合物14的20倍质量)和水(200g,化合物14的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.58g,304.37g/mol,1.91mmol)和乙酸钯(II)(0.5%eq,0.072g,224.51g/mol,0.32mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到化合物15(4-(dibenzo[b,d]furan-1-yl)pyridine)(15.30g,收率98%),MS(EI):245(M
(2)
将化合物15(4-(dibenzo[b,d]furan-1-yl)pyridine)(15g,245g/mol,61.22mmol)加入到乙酸(300g,化合物15的20倍质量)和浓硫酸(300g,化合物15的20倍质量),混匀后再将N-溴代琥珀酰亚胺(1.0eq,10.89g,177.98g/mol,61.22mmol)避光反应2h,反应液倒入冰水混合物中,快速搅拌,将洗出的固体滤出,再经过柱层析后得到化合物16(4-(6-bromodibenzo[b,d]furan-1-yl)pyridine)(9.58g,收率48.6%),MS(EI):322(M
(3)
氮气保护下,将化合物16(4-(6-bromodibenzo[b,d]furan-1-yl)pyridine)(322g/mol,27.95mmol,9g),化合物6(diisopropyl(isopropoxymethyl)boronate)(1eq,188.16g/mol,27.95mmol,5.65g)加入到无水THF(90g,化合物16的10倍质量)中,混合冷却至-78℃后,滴加正丁基锂的2.5M正己烷溶液(1.1eq,64g/mol,30.75mmol,12.3ml),滴毕后搅拌反应30min恢复室温,继续反应1h,反应液用饱和氯化铵溶液淬灭(180g,化合物16的20倍质量),再用二氯甲烷(180g,化合物16的20倍质量)萃取,分液后有机相干燥并减压浓缩,石油醚洗涤,得到化合物17((9-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronicacid)(7.29g,收率90.3%),MS(EI):289(M
(4)
将化合物17((9-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronic acid)(7g,289g/mol,24.22mmol)、化合物8(3-bromo-9-(3-phenylquinoxalin-2-yl)-9H-carbazole)(1eq,10.87g,449g/mol,24.22mmol)和碳酸钠(2eq,5.13g,105.99g/mol,48.44mmol)加入到乙二醇二胺醚(140g,化合物17的20倍质量)和水(140g,化合物17的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.22g,304.37g/mol,0.73mmol)和乙酸钯(II)(0.5%eq,0.027g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(49)(10.84g,收率72.9%),MS(EI):614(M
实施例8:
绿色磷光主体材料(60)的合成方法包括以下步骤:
步骤1-3与实施例1相同,步骤如下所示:
(4)
将化合物17((9-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronic acid)(7g,289g/mol,24.22mmol)、化合物18(9-(3-(9H-carbazol-9-yl)quinoxalin-2-yl)-3-bromo-9H-carbazole)(1eq,13.03g,538g/mol,24.22mmol)和碳酸钠(2eq,5.13g,105.99g/mol,48.44mmol)加入到乙二醇二胺醚(140g,化合物17的20倍质量)和水(140g,化合物17的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.22g,304.37g/mol,0.73mmol)和乙酸钯(II)(0.5%eq,0.027g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(60)(11.97g,收率70.3%),MS(EI):703(M
实施例9:
绿色磷光主体材料(65)的合成方法包括以下步骤:
步骤1-3与实施例1相同,步骤如下所示:
(4)
将化合物17((9-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronic acid)(7g,289g/mol,24.22mmol)、化合物11(3-bromo-9-(4-(3-phenylquinoxalin-2-yl)phenyl)-9H-carbazole)(1eq,12.72g,525g/mol,24.22mmol)和碳酸钠(2eq,5.13g,105.99g/mol,48.44mmol)加入到乙二醇二胺醚(140g,化合物17的20倍质量)和水(140g,化合物17的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.22g,304.37g/mol,0.73mmol)和乙酸钯(II)(0.5%eq,0.027g,224.51g/mol,0.12mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(60)(12.85g,收率76.9%),MS(EI):690(M
实施例10:
绿色磷光主体材料(97)的合成方法包括以下步骤:
将化合物19(2-(dibenzo[b,d]furan-2-yl)-[1,2,4]triazolo[1,5-a]pyridine)(5g,329g/mol,15.19mmol)、化合物8(3-bromo-9-(3-phenylquinoxalin-2-yl)-9H-carbazole)(1eq,6.82g,449g/mol,15.19mmol)和碳酸钠(2eq,3.22g,105.99g/mol,30.38mmol)加入到乙二醇二胺醚(100g,化合物18的20倍质量)和水(100g,化合物18的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.139g,304.37g/mol,0.46mmol)和乙酸钯(II)(0.5%eq,0.017g,224.51g/mol,0.076mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(97)(7.13g,收率71.8%),MS(EI):654(M
实施例11:
绿色磷光主体材料(145)的合成方法包括以下步骤:
将化合物20((8-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,289g/mol,17.3mmol)、化合物8(3-bromo-9-(3-phenylquinoxalin-2-yl)-9H-carbazole)(1eq,7.77g,449g/mol,17.3mmol)和碳酸钠(2eq,3.67g,105.99g/mol,34.6mmol)加入到乙二醇二胺醚(100g,化合物19的20倍质量)和水(100g,化合物19的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.158g,304.37g/mol,0.52mmol)和乙酸钯(II)(0.5%eq,0.019g,224.51g/mol,0.087mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(145)(8.21g,收率77.3%),MS(EI):614(M
实施例12:
绿色磷光主体材料(157)的合成方法包括以下步骤:
将化合物20((8-(pyridin-4-yl)dibenzo[b,d]furan-4-yl)boronic acid)(5g,289g/mol,17.3mmol)、化合物21(3-bromo-9-(3-(9,9-dimethyl-9H-fluoren-1-yl)quinoxalin-2-yl)-9H-carbazole)(1eq,9.77g,565g/mol,17.3mmol)和碳酸钠(2eq,3.67g,105.99g/mol,34.6mmol)加入到乙二醇二胺醚(100g,化合物19的20倍质量)和水(100g,化合物19的20倍质量)中,搅拌混匀后再依次加入三(邻甲苯基)膦(3%eq,0.158g,304.37g/mol,0.52mmol)和乙酸钯(II)(0.5%eq,0.019g,224.51g/mol,0.087mmol),升温至回流反应15h后,将有机相分出,水洗后减压浓缩,再经过柱层析后得到绿色磷光主体材料(157)(7.9g,收率62.6%),MS(EI):730(M
性能测试:
应用例1:
采用ITO作为反射层阳极基板材料,并依次用水、丙酮、N
在ITO阳极基板上方,沉积厚度为10nm的HAT-CN形成空穴注入层(HIL);
在空穴注入层(HIL)上方蒸镀NPD形成厚度为120nm的空穴传输层(HTL);
将本发明实施例1中的绿色磷光主体材料1作为主体材料、GD-19作为绿光掺杂材料(GD-19用量为绿色磷光主体材料1重量的5%)通过蒸镀在空穴传输层(HTL)上形成厚度为20nm的发光层;
将ETM和LiQ以1:1的比例混合蒸镀得到厚度为35nm的电子传输层(ETL),在电子传输层(ETL)上方蒸镀厚度为2nm的LiQ形成电子注入层(EIL);
此后将镁(Mg)和银(Ag)以9:1的比例混合蒸镀得到厚度为15nm的阴极,在上述阴极封口层上沉积65纳米厚度的DNTPD,此外,在阴极表面以UV硬化胶合剂和含有除湿剂的封装薄膜(seal cap)进行密封,以保护有机电致发光器件不被大气中的氧气或水分所影响至此制备获得有机电致发光器件。
应用例2-12
分别以本发明实施例2-12中的绿色磷光主体材料2、4、17、33、44、49、60、65、97、145、157作为发光层主体材料,其他部分与应用例1一致,据此制作出应用例2-12的有机电致发光器件。
对照例1、2
与应用例1的区别在于,使用GH-1及GH-2代替本发明的绿色磷光主体材料1,其余与应用例1相同。
上述应用例制造的有机电致发光器件及对照例制造的有机电致发光器件的特性是在电流密度为10mA/cm
表1:
由如上表1的实验对比数据可知,采用本发明所述的绿色磷光主体材料制备的有机电致发光器件与对照例相比,电压大幅度降低,发光效率显著提高。由此可见,本发明的化合物能使器件的驱动电压大大降低,大幅度减少了电能的消耗、显著提高了发光效率。另外通过降低驱动电压,有机电致发光器件的寿命有显著提高。
- 一种绿色磷光主体材料及含有该材料的OLED发光器件
- 新型双极性绿色磷光主体材料及含有该材料的OLED发光器件
