高度有效抗TFPI抗体组合物
文献发布时间:2023-06-19 10:52:42
技术领域
本公开内容涉及用于治疗血友病的高度有效抗TFPI抗体组合物(highlyefficient anti-TFPI antibody composition)。
背景技术
抗TFPI抗体是抗组织因子途径抑制剂(anti-tissue factor pathwayinhibitor)(下文中称为抗TFPI)重组抗体,其是对组织因子途径抑制剂(下文中称为TFPI)具有高亲和力的人IgG4单克隆抗体。
抗TFPI抗体被用作血友病治疗剂,其通过抑制TFPI与激活因子X(activatedfactor X,FXa)之间的结合并在外源性凝血途径中诱导下游凝血因子FX的激活来使血液凝固。
抗TFPI抗体是IgG4型抗体,并且当将其应用于通常的抗体产生过程时,出现的问题是在该过程期间聚合物的产生提高,从而导致产品的治疗作用降低,并且该过程的再现性由于在低pH值下抗体的高不稳定性而很低。
特别地,当聚合物以适当水平或更高水平存在于最终抗TFPI抗体浓缩物中时,该聚合物具有不良影响,因为它降低了抗TFPI抗体对抗原TFPI的结合亲和力,导致抗体的效力的降低。
因此,过程条件进行适当地保持,以便防止在抗TFPI抗体产生过程中聚合物的产生,并且在抗体纯化过程中不可避免地产生的聚合物应被选择性地去除。
因此,开发高度有效抗TFPI抗体治疗剂必须需要开发用于纯化高纯度抗TFPI抗体的过程。
因此,为了产生高度有效抗TFPI抗体组合物,本发明人对针对以下过程的条件进行了研究,并且已经发现可产生高度有效的抗TFPI抗体,从而完成了本公开内容:用于吸附蛋白质杂质的亲和色谱过程中的中和过程,用于在混合模式色谱纯化过程中使抗TFPI抗体聚合物之产生最小化以及选择性去除所产生聚合物的过程,以及用于在第一超滤和渗滤过程、第二超滤和渗滤过程以及最终浓缩过程中使抗TFPI抗体纯化产率最大化的过程。
[现有技术文献]
[专利文献]
(专利文献1)韩国专利No.10-1744899
(专利文献2)韩国专利No.10-1804988
[非专利文献]
(非专利文献1)1:Defining your product profile and maintaining controlover it,part 2:challenges of monitoring host cell proteinimpurities.BioProcess Int 2005;3:52-4,6,8
(非专利文献2)2:CHOPPI:A Web Tool for the Analysis of ImmunogenicityRisk from Host Cell Proteins in CHO-Based Protein Production.BiotechnolBioeng.2014Nov;111(11):2170-2182.
(非专利文献3)3:Reducing risk,improving outcomes:bioengineering lessimmunogenic protein therapeutics.Clin Immunol.2009May;131(2):189-201
(非专利文献4)4:A systematic assessment of MHC class II peptidebinding predictions and evaluation of a consensus approach.PLoS ComputBiol.2008Apr 4;4(4):e1000048.
发明内容
技术问题
本公开内容的目的是通过以下来提供具有非常低的HCP和LPA含量的高度有效抗TFPI抗体组合物:(i)通过在低pH亲和色谱洗脱过程之后引入中和过程来使聚合物的产生最小化,以便在亲和色谱过程中提高抗体稳定性;(ii)通过选择有效纯化树脂来确定聚合物分离条件,以便在混合模式色谱过程中选择性去除抗TFPI抗体中包含的聚合物,以及(iii)在最终浓缩过程中使抗TFPI抗体纯化产率最大化的同时使抗TFPI抗体聚合物的形成最小化,以便产生高度有效抗TFPI抗体组合物。
本公开内容的技术问题不限于上述技术问题,并且本领域技术人员从以下描述中可清楚地理解未提及的其他技术问题。
技术方案
为了实现以上目的,本公开内容提供了药用高度有效抗TFPI抗体组合物,其包含用于治疗血友病的抗TFPI抗体,其中药物物质(drug substance)中HCP和LPA的总含量为10ng/mg或更低。
HCP(host cell protein,宿主细胞蛋白)是在CHO细胞中发现的一众独特蛋白质,所述细胞在抗TFPI抗体产生中用作宿主,并且细胞培养物中HCP的含量极高,高达约500,000ng/mg。在另一方面,LPA(可浸出蛋白A(leachable protein A))是在纯化过程中从树脂中解离的蛋白A杂质,并且其含量根据纯化条件在产品之间可能不同,但是通常为约10ng/mg。因此,HCP杂质的含量相对地高于LPA杂质的含量,并且为了使抗TFPI抗体组合物有效,降低HCP和LPA的含量是必要且非常重要的。
如果将抗TFPI抗体组合物中的HCP含量维持在小于10.0ng/mg,以及组合物中LPA的含量维持在小于1.0ng/mg,则当将该组合物作为治疗药物施用于人体时,其具有降低免疫原性副作用的优异特性,并因此作为抗TFPI抗体组合物可表现出优异的作用。
在本公开内容的一个实施方案中,HCP和LPA的总含量可以是5ng/mg或更低。
如果将抗TFPI抗体组合物中HCP和LPA的总含量维持在5ng/mg或更低,则当将该组合物作为治疗药物施用于人体时,其具有降低免疫原性副作用的优异特性,并因此作为抗TFPI抗体组合物可表现出优异的作用。
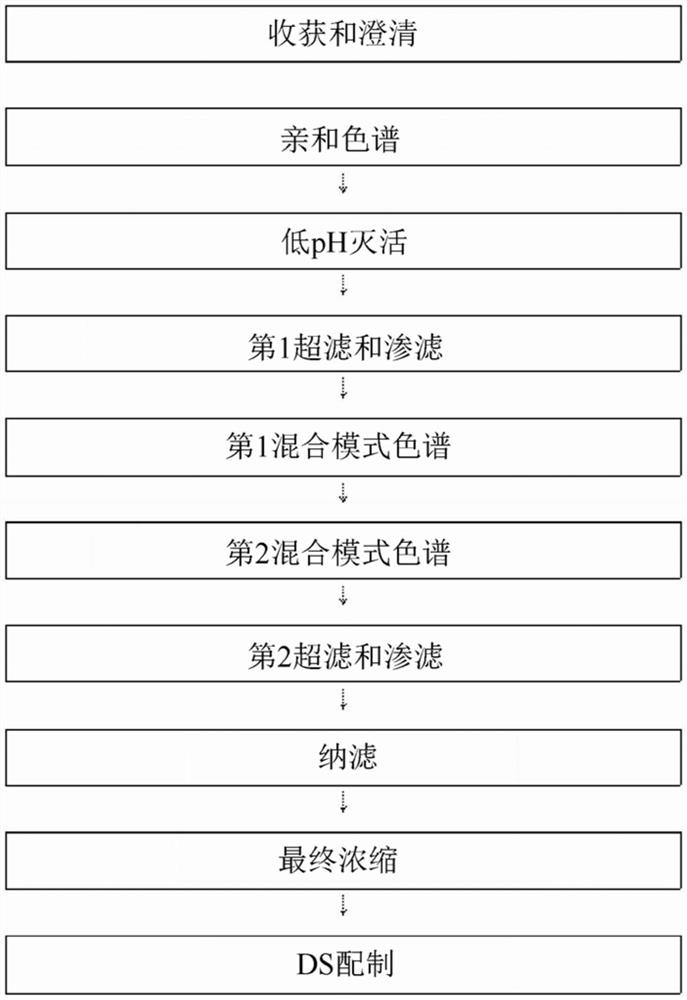
在本公开内容的另一个实施方案中,高度有效抗TFPI抗体组合物可通过以下过程来产生:将包含抗TFPI的培养物澄清的过程、亲和色谱过程、病毒灭活过程、第一超滤和渗滤过程、混合模式色谱过程、纳滤(nano-filtration)过程以及最终浓缩过程。
在本公开内容的另一个实施方案中,在混合模式色谱过程之后,可还包括第二超滤和渗滤过程。
在本公开内容的另一个实施方案中,通过使用不同类型的柱树脂进行两个或更多个多种混合模式色谱(plural mixed-mode chromatography)过程,混合模式色谱过程可去除98%或更多的抗TFPI抗体聚合物。
如果98%或更多的聚合物被去除,则当将该组合物作为治疗药物施用于人体时,其具有降低免疫原性副作用和提高抗TFPI抗体与TFPI的结合亲和力的优点,并因此作为抗TFPI抗体组合物可表现出更好的活性。
在本公开内容的另一个实施方案中,亲和色谱过程可包括以下步骤:在pH 4.0至6.0下,使通过亲和色谱柱的洗出液(eluate)中和;以及使经中和洗出液在室温(15至25℃)下静置8至16小时。
在本公开内容的另一个实施方案中,浓缩过程可包括冲洗溶液(rinse solution)循环/回收过程。
在本公开内容的另一个实施方案中,药物物质中抗TFPI抗体聚合物的含量可以小于1%。
在本公开内容的另一个实施方案中,药物物质的EC
当药物物质的EC
在本公开内容的另一个实施方案中,可产生高纯度抗TFPI抗体组合物,其中药物物质中HCP的含量小于10.0ng/mg,并且药物物质中LPA的含量小于1.0ng/mg,并且与此同时,作为最终产品的药物物质中HCP含量/抗TFPI抗体的单位含量比作为起始原料的经澄清培养物中HCP含量/抗TFPI抗体的单位含量低至少10,000倍。
如果将抗TFPI抗体组合物维持为高纯度抗TFPI抗体组合物,其中药物物质中HCP的含量小于10.0ng/mg,并且药物物质中LPA的含量小于1.0ng/mg,并且与此同时,经过纯化过程的药物物质中HCP含量/抗TFPI抗体的单位含量比经澄清培养物中HCP含量/抗TFPI抗体的单位含量低至少50,000倍,当将该抗TFPI抗体组合物作为治疗药物施用于人体时,其具有降低免疫原性副作用的优点,并因此作为抗TFPI抗体组合物可表现出更好的活性。
在本公开内容的另一个实施方案中,药物物质中HCP的含量可以小于10.0ng/mg,并且药物物质中LPA的含量可以小于1.0ng/mg,并且与此同时药物物质的结合活性EC
如果HCP和LPA的总含量为5.0ng/mg或更低,而结合活性EC
发明有益效果
根据本公开内容,具有非常低的HCP和LPA的含量的高度有效抗TFPI抗体组合物通过使聚合物的产生最小化,有效去除所产生的聚合物以及在浓缩过程中使冲洗溶液再循环,从而使纯化产率最大化来提供。因此,高度有效抗TFPI抗体组合物可有效地用于治疗抗体诱导的血友病患者以及用于预防凝血疾病(blood coagulation disease)。
附图说明
图1示意性地示出了用于产生本公开内容的高度有效抗TFPI抗体组合物的整个过程的流程图。
图2A示出了以下的结果:在非还原条件下对150kDa(其是抗TFPI抗体组合物的固有尺寸)进行SDS-PAGE分析(左),以及在还原条件下对50kDa重链和25kDa轻链进行SDS-PAGE分析(右),以便确定在从培养物收获和澄清过程至病毒灭活过程的过程中的物质中的抗体,以及确定杂质去除方式。所示SDS-PAGE凝胶的样品泳道如下:泳道1和9-标志物;泳道2-经澄清培养物;泳道3-亲和色谱未结合溶液(ACU);泳道4-亲和色谱洗涤物(ACW);泳道5-亲和色谱柱洗涤物(ACCW);泳道6-亲和色谱洗出液(ACE);泳道7-亲和色谱中和洗出液(ACEN);泳道8-病毒灭活溶液(VI)。
图2B示出了以下的结果:在非还原条件下对150kDa(其是抗TFPI抗体组合物的固有尺寸)进行SDS-PAGE分析(左),以及在还原条件下对50kDa重链和25kDa轻链进行SDS-PAGE分析(右),以便确定从第一超滤和渗滤过程至第二混合模式色谱过程的过程中的物质中的抗体,以及确定杂质去除方式。所示SDS-PAGE凝胶的样品泳道如下:泳道1和10-标志物;泳道2-第一UF渗余物(retentate);泳道3-第一UF渗透物(permeate);泳道4-第一混合模式流通物溶液(第1MM FT);泳道5-第一混合模式柱洗涤物(第1MM CW);泳道6-第二混合模式加载溶液(第2MM加载);泳道7-第二混合模式未结合溶液(第2MM未结合);泳道8-第二混合模式洗出液(第2MM洗脱);泳道9-第二混合模式柱洗涤物(第2MM CW)。
图2C示出了以下的结果:在非还原条件下对150kDa(其是抗TFPI抗体组合物的固有尺寸)进行SDS-PAGE分析(左),以及在还原条件下对50kDa重链和25kDa轻链进行SDS-PAGE分析(右),以便确定从第二超滤和渗滤过程至药物物质配制过程的过程中的物质中的抗体,以及确定杂质去除方式。所示SDS-PAGE凝胶的样品泳道如下:泳道1和8-标志物;泳道2-第二UF渗余物(第2UF渗余物);泳道3-第二UF渗透物(第2UF渗透物);泳道4-纳滤液;泳道5-最终渗余物;泳道6-最终浓缩渗透物;泳道7-药物物质。
具体实施方式
本公开内容的高度有效抗TFPI抗体组合物可通过如下所述的优化方法来产生。然而,本公开内容不被理解为限于本公开内容的实施方案,并且最佳条件可随着过程条件的改变而改变。
培养物收获和澄清过程旨在去除培养物中包含的细胞和细胞碎片。该过程在15至25℃下进行。
首先,按顺序为POD保持器(POD holder)配备POD过滤器,并随后旋转保持器的柄以防止液体泄漏至除入口和出口之外的部分,以及用200至300L的注射用水冲洗过滤器。
此后,使培养物澄清缓冲液通过来洗涤安装在保持器中的POD过滤器和连接至出口的无菌囊式过滤器(capsule filter)。打开培养物收获阀以启动培养物澄清,并在培养物澄清期间将POD过滤器系统的压力调节至不超过29psi(2巴)。
在如上所述完成培养物澄清之后,用培养物澄清缓冲液进行后洗涤(post-washing)。在后洗涤完成之后,将其中包含所收集经澄清培养物的容器称重,并将其用于下一过程。培养物收获和澄清过程的过程参数和QA/PA(品质/性能属性)示于下表1中。
[表1]
亲和色谱过程旨在从培养物中吸附抗TFPI抗体组合物并将其回收。该过程使用Mabselect sure树脂在15至25℃下进行,但不限于此,也可使用常规的蛋白A(Protein A)树脂。
首先,使用AKTA纯化系统进行包装评价,以确定适用性。另外,将CIP溶液冲洗15分钟,并随后用柱洗涤缓冲液进行消毒(sanitization)。
在用平衡缓冲液进行平衡之后,将经澄清培养物连接并吸附,并收集通过柱的样品作为未结合的溶液。在吸附完成之后,通过用平衡缓冲液冲洗进行再平衡。此时,将通过柱的再平衡溶液与未结合的溶液收集在一起。在再平衡过程完成之后,将柱用洗涤缓冲液洗涤,并收集通过柱的洗涤溶液。
在洗脱过程中,将柱用亲和色谱洗脱缓冲液冲洗,并自达到0.8倍凝胶体积的时间点起收集洗出液。通过使用pH调节溶液将pH调节至4.0至6.0来使如上所述收集的洗出液中和,并将经中和洗出液在15至25℃下储存直至下一过程。在该过程完成之后,在用柱洗涤缓冲液冲洗树脂的同时进行柱洗涤。用CIP缓冲液进行柱CIP,持续15分钟,并用平衡缓冲液使柱的pH稳定。此后,通过用凝胶储存溶液冲洗将柱填充,并随后使其与系统分离并将其储存。
亲和色谱过程的过程参数和QA/PA示于下表2中。
[表2]
病毒灭活过程旨在在低pH下使囊膜病毒灭活。
在该实验中,病毒灭活过程在15至25℃下进行。在移动式洁净小室(clean booth)中,通过在搅拌洗出液的同时添加pH调节溶液(0.1M HCl),将来自亲和色谱的经中和洗出液的pH调节至pH为3.0至3.8(对照pH 1,其是参考pH),并在18至24℃下进行病毒灭活,持续45分钟至105分钟。
在病毒灭活完成之后,用pH调节溶液将所得溶液再次调节至pH 4.5至5.5(对照pH2)。此后,使用无菌囊式过滤器将pH经调节的处理溶液过滤到滤液收集袋中。在过滤完成之后,对经病毒灭活的溶液进行第一超滤和渗滤过程,这是下一个过程。病毒灭活过程的过程参数和QA/PA示于下表3中。
[表3]
第一超滤和渗滤过程旨在在第一混合模式色谱过程的加载条件下对经病毒灭活的溶液进行超滤和渗滤。
实际过程如下进行。
为UF保持器配备膜,并用扭矩扳手(torque wrench)将其拧紧至预定压力,使得固定板被压下。将装配的UF保持器命名为“UF系统”。通过用第一超滤和渗滤CIP溶液循环对UF系统进行CIP,并将其用注射用水和第一超滤和渗滤缓冲液冲洗以使pH稳定。
此后,通过调节渗透物阀和渗余物阀将TMP压力调节至1.0±0.5巴。将经病毒灭活的溶液浓缩至10±5mg/mL,并用对应于5至15倍浓缩体积的平衡缓冲液(第一超滤和渗滤缓冲液)进行渗滤,并随后检查pH和电导率是否将符合标准,并将渗滤终止。
此后,将0.22μm过滤器连接至渗余物管路(retentate line),并在过滤的同时进行后洗涤。然后,关闭渗透物阀,并且将对应于最终渗余物质量的约10vol%至30vol%的渗滤缓冲液注射到供给管路(feed line)中以对浓缩器和供给管路中的停滞液体(liquidstagnant)进行加压,并且在不排液(drainage)的情况下进行第一后洗涤。
将对应于最终渗余物质量的20vol%至40vol%的渗滤缓冲液注射到供给管路中并循环1分钟,并随后在冲洗溶液完全排出的同时进行第二后洗涤,从而将渗余物浓度调节至最终目标浓度(3至7mg/mL)。此后,将经过滤的第一UF渗余物称重,并附上记录纸。如上所述进行的第一超滤和渗滤过程的过程参数和QA/PA示于下表4中。
[表4]
第一混合模式色谱过程旨在去除杂质,例如HCP和LPA,并提高纯度。
第一混合模式色谱纯化过程使用PPA混合模式树脂在15至25℃下进行。首先,使用AKTA纯化系统进行包装评价,以确定适用性。此后,通过用CIP溶液冲洗并使柱洗涤缓冲液通过柱来进行灭菌过程,并随后通过用平衡缓冲液冲洗来进行平衡过程。
在通过上述过程完成平衡之后,将第一UF渗余物连接,并随后进行流通过程。对于第一混合模式色谱纯化,以流通模式过程加载样品,并自加载时间点起开始收集流通溶液。在样品加载完成之后,注射平衡缓冲液,并进行再平衡过程以完全回收剩余在柱中的流通溶液。
此后,通过用柱洗涤缓冲液冲洗来进行柱洗涤,并且用CIP缓冲液进行柱CIP。在CIP完成之后,通过用平衡缓冲液冲洗来使柱pH稳定。同时,将柱用凝胶储存溶液填充,并随后将其与系统分离并分开储存。
如上所述进行的第一混合模式色谱过程的过程参数和QA/PA示于下表5中。
[表5]
该过程旨在去除聚合物抗体和剩余的杂质,例如HCP。
第二混合模式色谱纯化过程使用CHT陶瓷羟基磷灰石树脂在15至25℃下进行。首先,使用AKTA纯化系统进行包装评价,以确定适用性。
此后,将第一混合模式色谱流通溶液用稀释缓冲液以1∶1的比例稀释,并检查其是否符合pH和电导率标准。其在灭菌和过滤之后用作加载溶液(loading solution)。然后,通过用CIP 1溶液冲洗并使柱洗涤缓冲液通过柱来进行灭菌,并且通过用平衡缓冲液冲洗来进行平衡。在如上所述完成平衡之后,将第二混合模式色谱加载溶液连接并进行吸附过程。在吸附完成之后,通过用平衡缓冲液冲洗进行再平衡过程。
在再平衡完成之后,将柱用洗脱缓冲液冲洗,并收集洗出液,直至UV峰降低低于0.1AU。此时,当UV峰不符合标准时,则另外加载对应于两倍凝胶体积的洗脱缓冲液,使得UV值符合标准。
此后,通过用柱洗涤缓冲液冲洗来进行柱洗涤。在柱洗涤过程完成之后,通过以CIP 2->CIP 3->CIP 2->CIP 1的顺序的加载溶液来进行柱CIP。另外,通过用凝胶储存溶液冲洗将柱填充,并随后使其与系统分离并储存。将所收集的洗出液称重,并随后进行过滤并在15至25℃下储存,直至用于下一过程。第二混合模式色谱过程的过程参数和操作条件示于下表6中。
[表6]
第二超滤和渗滤过程旨在将第二MM洗出液浓缩至目标浓度,并随后用配制缓冲液对洗出液进行渗滤。
通过用第二超滤和渗滤CIP溶液循环对UF系统进行CIP,并用注射用水以及第二超滤和渗滤缓冲液冲洗以使pH稳定。另外,通过调节渗透物阀和渗余物阀将TMP压力调节至1.0±0.5巴。
此后,将第二混合模式色谱洗出液浓缩至20±5mg/mL,并用对应于5至15倍浓缩体积的平衡缓冲液(第二超滤和渗滤缓冲液)进行渗滤。测量其pH和电导率,并且当它们符合标准时,将渗滤终止。
另外,将渗透物阀关闭,将对应于最终渗余物质量的10vol%至30vol%的第二超滤和渗滤缓冲液注射到供给管路中,并在不排出液体的情况下转移浓缩器和供给管路中停滞液体的同时进行第一后洗涤。
同时,将对应于最终渗余物质量的10vol%至30vol%的第二超滤和渗滤缓冲液注射到供给管路中并循环1分钟,并随后在完全排出冲洗溶液的同时进行第二后洗涤,从而调节渗余物浓度至目标浓度(10至20mg/mL)。
此后,将A1HC(深度过滤器(Depth filter),预过滤器(Pre-filter))和Durapore0.1μm过滤器的过滤器组连接至第二超滤和渗滤渗余物收集容器,并进行渗余物的过滤。在过滤完成之后,进行用3至7L渗滤缓冲液的后洗涤,从而将第二超滤和渗滤渗余物的最终浓度调节至5至15mg/mL。
将如上所述过滤的第二超滤和渗滤渗余物称重,并将其在15至25℃下储存,直至用于下一过程。第二超滤和渗滤过程的过程参数和QA/PA示于下表7中。
[表7]
从上述分析结果可以看出,通过第二超滤和渗滤过程获得的抗TFPI抗体组合物中HCP的含量为5.3ng/mg,抗TFPI抗体组合物中LPA的含量为0.4ng/mg,以及HCP和LPA的总含量为5.7ng/mg。如上所述,抗体组合物中HCP和LPA的含量非常低,并因此可以看出,该抗体组合物作为抗TFPI抗体组合物可表现出优异的作用。
纳滤过程旨在使用纳米过滤器(nano-filter)去除病毒。
纳滤过程使用纳米过滤器(Viresolve Pro)在15至25℃下进行。首先,将纳米过滤器用注射用水冲洗,并随后用纳滤缓冲液洗涤。此后,将压力调节器的压力调节至2.0±0.5巴,并且打开压力阀以开始纳滤。
在纳滤完成之后,用1至3L的纳滤缓冲液进行后洗涤,并随后将纳滤液称重。纳滤过程的过程参数和QA/PA示于下表8中。
[表8]
从以上分析结果可以看出,通过纳滤过程获得的抗TFPI抗体组合物中HCP的含量为4.5ng/mg,抗体组合物中LPA的含量为0.4ng/mg,以及HCP和LPA的总含量为4.9ng/mg。如上所述,HCP和LPA的含量非常低,并因此可以看出,该抗体组合物作为抗TFPI抗体组合物可表现出非常优异的作用。
最终浓缩过程旨在将纳滤液浓缩至最终目标浓度。首先,将渗透物阀打开,通过用最终浓缩CIP溶液循环进行CIP,并通过用注射用水和最终浓缩缓冲液冲洗来使pH稳定。
此后,通过调节渗透物阀和渗余物阀将TMP压力调节至1.0±0.5巴,并将纳滤液浓缩至36±10mg/mL。在浓缩完成之后,进行另外的浓缩,直至最终质量的70%,并随后注射对应于所降低30%的10vol%的最终浓缩缓冲液,并在无液体泄漏的情况下转移填充在浓缩物储存管路(concentrate storage line)中的液体的同时进行第一后洗涤。另外,注射对应于剩余20vol%的最终浓缩缓冲液并循环1分钟,并且在完全排出冲洗溶液的同时进行第二后洗涤。获得最终浓缩物并测量其质量。最终浓缩过程的过程参数和QA/PA示于下表9中。
[表9]
从以上分析结果可以看出,通过最终浓缩过程获得的抗TFPI抗体组合物中HCP的含量为3.9ng/mg,抗体组合物中LPA的含量为0.5ng/mg,以及HCP和LPA的总含量为4.4ng/mg。如上所述,抗体组合物中HCP和LPA的含量非常低,并因此可以看出,该抗体组合物作为抗TFPI抗体组合物可表现出优异的作用。
药物物质配制过程旨在通过添加赋形剂聚山梨酯80来提高药物物质的稳定性,并以目标浓度配制药物物质。
首先,向最终渗余物添加赋形剂聚山梨酯80并将其搅拌以充分混合,并且将经搅拌的溶液通过0.2μm过滤器过滤,从而配制药物物质。
[表10]
从以上分析结果可以看出,通过药物物质配制过程获得的抗TFPI抗体组合物中HCP的含量为4.1ng/mg,抗体组合物中LPA的含量为0.4ng/mg,以及抗体组合物中HCP和LPA的总含量为4.5ng/mg。如上所述,抗体组合物中HCP和LPA的含量非常低,并因此可以看出,该抗体组合物作为抗TFPI抗体组合物可表现出优异的作用。
为了确定所产生的药物物质中的抗体并确定杂质去除方式,在还原和非还原条件下进行SDS-PAGE分析。
在该过程期间从中纯化抗TFPI抗体组合物的主要样品中,非还原条件下150kDa(其是抗体的固有尺寸)的带,以及还原条件下50kDa重链和25kDa轻链(图2、3和4)被认为为主要带。作为结果,既没有非特异性带出现,也没有杂质污染。另外,在该过程期间去除了杂质,或者在未结合的溶液中未检测到作为主要带的抗体带。
因此,可以确定,本公开内容的纯化过程是用于从原材料培养物中有效地产生未被杂质、微生物和病毒污染的高度有效抗TFPI抗体组合物的最佳过程。
在下文中,将描述总结以下的结果:通过进行针对本公开内容效果的对照实验而获得的结果。
本公开内容的特征在于通过引入使亲和色谱洗出液中和的过程来使聚合物的产生最小化。
为了使聚合物的产生最小化,首先通过将亲和色谱洗脱过程的pH维持在3.2至3.6来洗脱抗TFPI抗体组合物。接下来,在低pH下进行病毒灭活,持续1小时至1小时30分钟以确保病毒稳定性,并随后在提高的pH下进行下一过程。为了确定是否可通过引入中和过程来使聚合物的产生最小化,如下进行了三个对照实验。
<实验例1>
对于一般抗体,在低pH亲和色谱洗脱过程之后立即进行病毒灭活,并且在这种情况下,在病毒灭活之后,来自洗脱过程的洗出液的纯度从96.0%降低至85%,并且其聚合物含量提高了11%。
<实验例2>
在低pH亲和色谱洗脱过程之后,在无pH调节的情况下使洗出液在室温下静置8至16小时,并随后进行病毒灭活过程。在这种情况下,在静置8至16小时之后在病毒灭活之后,洗脱之后立即的96%纯度降低至83%,并且聚合物含量提高了13%。
<实验例3>
在低pH亲和色谱洗脱过程之后,将洗出液中和至pH为4.8至5.2,使其在室温下静置8至16小时,并随后再次滴定至低pH并进行病毒灭活过程。在这种情况下,在病毒灭活之后,洗脱之后立即的96%纯度降低至91%,并且聚合物含量提高了5%。
考虑到这些实验例,可以确定,通过在亲和色谱洗脱过程之后立即通过pH中和过程使物质稳定,并随后进行病毒灭活过程将聚合物形成抑制了约两倍。
以上实验例1至3的结果总结于下表11中。
[表11]
为了检查聚合物形成与抗TFPI抗体作用之间的相关性,通过提高聚合物形成来构建分别具有100%、90%和60%的单体含量的抗TFPI抗体,并对其结合活性效力进行测试。
由100%单体构成的抗TFPI抗体在结合活性效力测试中的EC
[表12]
抗TFPI抗体是IgG4型抗体,并且与IgG1型抗体相比具有更高的聚合物产生速率。随着聚合物的产生,抗TFPI抗体对TFPI的结合亲和力降低,并因此抗体的作用降低。因此,应适当地维持过程条件以防止在产生过程中产生聚合物。然而,仅当可通过选择性地去除中间过程中所产生的聚合物来产生高纯度抗体样品时,才可开发出高度有效抗体治疗剂。
为了在该过程期间选择性去除包含在抗体中的聚合物,本发明人在筛选之后选择了混合模式树脂(其是最有效的纯化树脂CHT陶瓷羟基磷灰石),并建立了最佳的聚合物分离条件。作为结果,确定了通过使用CHT树脂的纯化过程去除了12%至23%的聚合物,并因此获得了接近100%的纯度。
[表13]
超滤和渗滤过程的回收率受压力条件、蛋白质特性和蛋白质浓度影响。
因此,确定了在相同条件下根据蛋白质回收方法可提高回收率。即,确定了通过在使冲洗溶液循环的同时,甚至回收吸附在膜上的蛋白质,可提高产率。
- 高度有效抗TFPI抗体组合物
- 含抗GRP78抗体作为有效成分的药物组合物
