用于癌症治疗的抗LYPD3 CAR T细胞疗法
文献发布时间:2023-06-19 11:21:00
优先权
本申请要求于2018年7月20人提交的美国临时申请序列号62/700,942的权益,其通过引用全部并入本文。
背景技术
技术领域
本公开提供了治疗癌症的方法。更具体地,本公开提供了包含靶向LYPD3的嵌合抗原受体(CAR)的组合物和包含包含对LYPD3具有特异性的CAR的T细胞的组合物及其制备和使用方法。
相关技术说明
在过去的十年里,嵌合抗原受体(CAR)T细胞疗法已成为治疗各种血液癌症的成功疗法。这种治疗策略涉及T细胞的体外工程化以选择性地识别肿瘤细胞表面表达的抗原分子,从而导致免疫系统激活,肿瘤细胞清除并改善患者预后。尽管成功地治疗了许多类型的白血病和淋巴瘤,但CAR T细胞对实体瘤的疗效仍然有限。一种实体瘤类型,鳞状细胞癌,包括起源于头颈部、食道、肺部、膀胱和子宫颈的癌症,其目前大部分缺乏有效的治疗。
含有Ly6/PLAUR结构域的蛋白质3(LYPD3)被标识为潜在的CAR T细胞靶标并在多种鳞状细胞癌亚型中表达。LYPD3是一种普遍功能未知的细胞表面蛋白,尽管先前研究已表明它与细胞-基质相互作用和肿瘤进展有关。重要的是,LYPD3表达是两极化的,因此其在鳞状细胞癌的浸润前期过表达,因此,LYPD3的靶向消除可能具有强大的抗肿瘤特性,但对正常细胞的毒性有限。
发明内容
提供概要是为了介绍一些概念,这些概念将在下面的详细描述中进一步描述。本概要的目的既不旨在标识所要求保护的主题的关键或必要特征,也不旨在用作帮助限制所要求保护的主题的范围。
CAR T细胞疗法是一种治疗方法,其中将患者的T细胞分离并在实验室中进行修饰,这样修饰的T细胞将攻击癌细胞。修饰分离的T细胞以表达嵌合抗原受体(CAR),其结合患者癌细胞上的某种蛋白质(例如LYPD3)。然后大量的CAR T细胞在实验室中生长,并通常通过输注给予患者。CAR T细胞疗法也称为嵌合抗原受体T细胞疗法。
一方面,本公开提供了一种嵌合抗原受体(CAR),其中所述CAR包含:(1)与LYPD3特异性地结合的细胞外结合结构域;(2)跨膜结构域;和(3)至少一个胞质信号传导结构域。
在CAR的某些实施方式中,细胞外结合结构域包含特异性地结合LYPD3的单链可变片段(scFv)。在一个实施方式中,scFv包含与SEQ ID NO:10的氨基酸序列具有至少95%序列同一性的氨基酸序列。
在CAR的某些实施方式中,跨膜结构域包含源自以下分子的氨基酸序列:T细胞受体的α链、所述T细胞受体的β链、所述T细胞受体的ζ链、CD3-ε、CD3-ζ、CD4、CD5、CD8、CD9、CD16、CD22、CD28、CD33、CD37、CD45、CD64、CD80、CD86、CD134、CD137或CD154。在一些实施方式中,跨膜结构域包含源自CD8的氨基酸序列。在一个实施方式中,跨膜结构域包含与SEQID NO:11的氨基酸序列具有至少95%序列同一性的氨基酸序列。在另一个实施方式中,跨膜结构域包含SEQ ID NO:11的氨基酸序列
在CAR的某些实施方式中,至少一个胞质信号传导结构域包含源自以下分子的至少一个氨基酸序列:CD2、CD3-ζ、CD3-γ、CD3-δ、CD3-ε、CD5、CD7、CD22、CD27、CD28、CD30、CD40、CD66d、CD79a、CD79b、4-1BB(CD137)、OX40、PD-1、ICOS、淋巴细胞功能相关抗原1(LFA-1)、LIGHT、NKG2C、B7-H3、FcR-γ、FcR-β或TCR-ζ。在某些实施方式中,至少一个胞质信号传导结构域包含源自CD3-ζ的氨基酸序列。在一个实施方式中,至少一个胞质信号传导结构域包含与SEQ ID NO:14的氨基酸序列具有至少95%序列同一性的氨基酸序列。在另一个实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:14的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含源自CD28的氨基酸序列。在一个实施方式中,至少一个胞质信号传导结构域包含与SEQ ID NO:12的氨基酸序列具有至少95%序列同一性的氨基酸序列。在另一个实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:12的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含源自4-1BB的氨基酸序列。在一个实施方式中,至少一个胞质信号传导结构域包含与SEQ ID NO:13的氨基酸序列具有至少95%序列同一性的氨基酸序列。在另一个实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:13的氨基酸序列。
在一些实施方式中,CAR包含三个胞质信号传导结构域,其中第一胞质信号传导结构域源自CD28,其中第二胞质信号传导结构域源自CD3,并且其中第三胞质信号传导结构域源自4-1BB。在一个实施方式中,所述第一胞质信号传导结构域包含与SEQ ID NO:14的氨基酸序列具有至少95%序列同一性的氨基酸序列,所述第二胞质信号传导结构域包含与SEQID NO:12的氨基酸序列具有至少95%序列同一性的氨基酸序列,并且所述第三胞质信号传导结构域包含与SEQ ID NO:13的氨基酸序列具有至少95%序列同一性的氨基酸序列。在另一个实施方式中,所述第一胞质信号传导结构域包含SEQ ID NO:14的氨基酸序列,所述第二胞质信号传导结构域包含SEQ ID NO:12的氨基酸序列,并且所述第三胞质信号传导结构域包含SEQ ID NO:13的氨基酸序列。
另一方面,本公开提供了一种激活的T细胞的群体,所述T细胞包含如本文所公开的嵌合抗原受体(CAR)。在某些实施方式中,激活的T细胞的群体以治疗表达LYPD3的癌症的治疗有效量存在。
另一方面,本公开提供了一种药物组合物,其包含表达如本文所公开的CAR的激活的T细胞的群体和药学上可接受的载体。在某些实施方式中,所述药学上可接受的载体支持对所述激活的T细胞的群体的维持。在所述药物组合物的一些实施方式中,所述组合物进一步包含至少一种治疗剂。
另一方面,本公开提供了一种分离的核酸,其包含编码如本文所公开的CAR的核苷酸序列。
另一方面,本公开提供了一种在患有表达LYPD3的癌症的受试者中诱导T细胞应答的方法,其中所述方法包括向所述受试者施用治疗有效量的如本文所公开的激活的T细胞的群体或药物组合物,其中所述施用诱导对所述癌症的抗肿瘤反应。在所述方法的某些实施方式中,癌症选自肺癌、头颈癌、宫颈癌、尿路上皮癌、黑色素瘤、乳腺癌、前列腺癌、结肠癌、肾细胞癌、卵巢癌、神经母细胞瘤、横纹肌肉瘤、白血病和淋巴瘤。
另一方面,本公开提供了一种制备表达如本文所公开的嵌合抗原受体(CAR)的激活的T细胞的群体的方法,其中所述方法包括:(1)用编码如本文所公开的CAR的核酸来转染或转导分离的T细胞;和(2)在转染或转导后扩增该表达CAR的T细胞,其中通过在IL-2和/或CD3和CD28抗体的存在下培养来扩增所述T细胞。在某些实施方式中,所述分离的T细胞是从哺乳动物分离的。在一个实施方式中,哺乳动物是人。在某些实施方式中,人是患有表达LYPD3的癌症的受试者。在某些实施方式中,分离的T细胞对于所述患有表达LYPD3的癌症的受试者是自体的。
本公开的另一方面提供了本文描述和说明的所有内容。
附图说明
结合附图,在以下描述中解释了本公开的前述方面和其他特征:
图1是显示在转导的小鼠淋巴细胞中LYPD3 CAR表达的图。
图2是显示路易斯(Lewis)肺癌细胞激活LYPD3 CAR T细胞的图。
图3是显示LYPD3 CAR T细胞对路易斯肺癌细胞杀伤效率的图。
图4A-4D是显示LYPD3 CAR T细胞对小鼠肺癌的体内功效的图和图像。图4A:在施用LYPD3 CAR T细胞后的指定时间点处单个路易斯肺肿瘤大小的蜘蛛图(图4A)。图4B:显示于(4A)中的肿瘤的平均体积。图4C:切除后的肿瘤图像。图4D:对照组和LYPD3 CAR组的肿瘤重量(单尾t检验)。
图5是显示在施用LYPD3 CAR T细胞后缺乏明显毒性的图。如图所示,各种剂量的LYPD3 CAR T细胞处理后的C57BL/6小鼠每日称重。
图6A-6D是显示人LYPD3 CAR T细胞对人癌细胞有反应性的图和FACS图。图6A:在人PBMC中的LYPD3 CAR表达。图6B:LYPD3CAR T细胞激活对抗MCF7乳腺癌细胞。图6C:与MCF7乳腺癌细胞共培养后,未转导的(6C)或LYPD3 CAR(图6D)T细胞的IFN-γ表达。
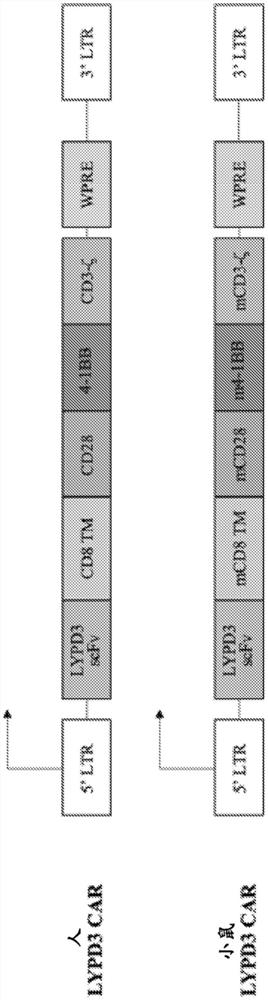
图7显示示例性LYPD3 CAR构建体的示意图。
具体实施方式
为了促进对本公开原理的理解,现将参考优选实施方式,并将施用特定语言来描述它们。然而,将理解的是,并不旨在限制本公开的范围,而是可以预期本公开涉及的本领域技术人员通常会想到的对本文所示的本公开的这种改变和进一步修改。
本文所使用的冠词“一个/种(a/an)”指的是该文法的一个或多个(即至少一个)语法对象。例如,“一个元素”指至少一个元素,并且可以包括一个以上的元素。
术语“约”用于提供数值范围端点的灵活性,前提是给定值可以“略高”或“略低”于端点,而不会影响所需结果。
在整个说明书中,除非上下文另有要求,否则术语“包含(comprise)”、“包括(include)”及其变体(例如“包含(comprises/comprising)”、“包括(includes/including)”)将被理解为意味包含陈述的组件、特征、元素或步骤或一组组分、特征、元素或步骤,但不排除任何其他整数或步骤或一组整数或步骤。列举为“包括”、“包含”或“具有”某些元素的实施方式也涵盖“基本上由这些元素组成”和“由这些元素组成”。
除非在此另有指出,否则本文中数值范围的列举仅旨在用作分别指代落入该范围内的每个单独值的简写方法,并且每个单独值都被并入说明书中,就如同其在本文中被单独叙述一样。例如,如果将浓度范围规定为1%至50%,则该值(例如2%至40%,10%至30%,或1%至3%等)在本说明书中被明确地列举。这些仅是具体意图的实施例,并且在所列举的最小值和最大值之间并包括所列举的最小值和最大值的数值的所有可能组合应被认为在本公开中明确地陈述。
除非另有定义,则本文中所使用的所有技术术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。
定义
如在本文中所使用的,“治疗”、“疗法”和/或“治疗方案”指对患者表现出的疾病、病症或生理状况或患者可能易感的疾病、病症或生理状况作出的临床干预。治疗的目的包括减轻或预防症状、减慢或停止疾病、病症或状况的发展或恶化和/或疾病、病症或状况的缓解。
术语“有效量”或“治疗有效量”指足以产生有益或期望的生物学和/或临床结果的量。“有效量”或“治疗有效量”可以由熟练的医疗专业人员团队确定,并且可以包括使用影像学检查、生物标志物检查或其他检查。关于癌症,治疗有效量的施用预防癌症的转移,导致实体瘤的大小或质量减小,或导致肿瘤坏死。
如在本文中所使用的术语“疾病”包括但不限于影响生物体一部分的任何异常状况和/或结构或功能失调。它可能是由外部因素(例如传染病)或由内部功能异常(例如癌症、癌症转移等)引起的。
如本领域已知的,癌症通常被认为是不受控的细胞生长。本发明的组合物和方法可用于治疗表达LYPD3的任何癌症及其任何转移。实施例包括但不限于肺癌、头颈癌、宫颈癌、尿路上皮癌、黑色素瘤、乳腺癌、前列腺癌、结肠癌、肾细胞癌、卵巢癌、神经母细胞瘤、横纹肌肉瘤、白血病、淋巴瘤、鳞状细胞癌、小细胞肺癌、肺小细胞癌、胃肠道癌、胰腺癌、胶质母细胞瘤、肝癌、膀胱癌、肝癌、大肠癌、子宫宫颈癌、子宫内膜癌、唾液腺癌、间皮瘤、肾癌、外阴癌、胰腺癌、甲状腺癌、肝癌、皮肤癌、黑色素瘤、脑癌、神经母细胞瘤、骨髓癌、各种类型的头颈癌、急性淋巴细胞白血病、急性髓细胞性白血病、尤因肉瘤和周围神经上皮瘤。在某些实施方式中,所述癌症是肺癌、头颈癌、子宫颈癌或尿路上皮癌。
如在本文中所使用的,术语“受试者”和“患者”在本文中可互换使用并且指人类和非人类动物。本公开的术语“非人类动物”包括所有脊椎动物,例如哺乳动物或非哺乳动物,例如非人灵长类、绵羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。在某些实施方式中,所述受试者是怀疑患有癌症或患有(have/suffer from)癌症的人类患者。在一个实施方式中,所述人类是怀疑患有表达LYPD3的癌症的受试者。在另一个实施方式中,所述人类是患有表达LYPD3的癌症的受试者。在另一个实施方式中,所述人类是患有表达LYPD3的癌症的受试者。
如在本文中所使用的术语“嵌合抗原受体”定义为细胞表面受体,其包含细胞外结合结构域、跨膜结构域和至少一个胞质信号传导结构域,并非天然存在于单个蛋白质中的组合。这特别地包括其中细胞外结构域和胞质结构域并非天然存在于单个受体蛋白质上的受体。此外,嵌合抗原受体不同于天然T细胞淋巴细胞中表达的T细胞受体(TCR)。
如本文中所使用的术语“CAR T细胞”指T细胞或其群体,其已经通过分子生物学方法修饰以在T细胞或T细胞的群体表面上表达嵌合抗原受体(CAR)。CAR是工程化多肽,具有细胞外结合结构域,其预定义了与期望靶标表达的特异性地结合,可操作地连接至(例如作为融合,由一个或多个二硫键链接的分离的链)T细胞激活结构域的胞内部分。通过绕过MHCI类和II类限制,CD8+和CD4+亚群的CAR工程化T细胞都可以被招募用于重定向靶细胞识别。最常见的CAR是免疫球蛋白结合功能(例如作为源自单克隆抗体的单链可变片段(scFv))与CD3-ζ(CD3β)跨膜和胞质结构域(内域)的融合体。这类分子应答于其靶标的免疫球蛋白结合功能的识别而导致ζ信号的传输。但是,有许多替代。举例来说,来自天然T细胞受体(TCR)α和β信号链的抗原识别结构域可用作结合功能。或者,可以使用受体胞外域(例如CD4胞外域)或细胞因子(其导致对带有同源细胞因子受体的细胞的识别)。结合功能所需要的就是它以特定方式结合具有高亲和力的给定靶标。
在某些实施方式中,CAR工程化多肽包含:(1)胞外结合结构域,(2)跨膜结构域,和(3)至少一个胞质信号传导结构域。
胞外结合结构域也可称为抗原结合结构域并能包括将与目的抗原(即LYPD3)结合的任何结构域。在某些实施方式中,结合结构域包含抗体序列、变体或其片段。在某些实施方式中,抗体序列包括但不限于CH1、CH2或CH3结构域、重链、轻链、单链可变片段(scFv)、域抗体、双特异性抗体、CDR、Fab区、Fv、Fc区或其片段。在某些实施方式中,结合结构域可以是受体或配体序列或其片段。在某些实施方式中,抗体结合结构域结合肿瘤抗原或肿瘤相关抗原。在一个实施方式中,胞外结合结构域与特异性地结合LYPD3。在某些实施方式中,特异性地结合LPYD3的胞外结合结构域是scFv,其特性结合LYPD3,该LYPD3包含与SEQ ID NO:10的氨基酸序列具有至少95%序列同一性的氨基酸序列。在一个实施方式中,胞外结合结构域包含SEQ ID NO:10的氨基酸序列。在一个实施方式中,胞外结合结构域由SEQ ID NO:10的氨基酸序列组成。
CAR还包含跨膜结构域。跨膜结构域可以是源自或从本领域已知的任何分子获得的任何跨膜结构域。在某些实施方式中,跨膜结构域与CAR的胞外结合结构域融合。跨膜结构域可以源自天然或合成来源。在某些实施方式中,跨膜结构域可以是源自任何膜结合或跨膜蛋白。在某些实施方式中,跨膜选自但不限于T细胞受体的α、β或ζ链、CD3-ε、CD3-ζ、CD4、CD5、CD8、CD9、CD16、CD22、CD28、CD33、CD37、CD45、CD64、CD80、CD86、CD134、CD137或CD154。在一个实施方式中,跨膜结构域源自CD8。在某些实施方式中,跨膜结构域包含与SEQID NO:11的氨基酸序列具有至少95%序列同一性的氨基酸序列。在一个实施方式中,跨膜结构域包含SEQ ID NO:11的氨基酸序列。在一个实施方式中,跨膜结构域由SEQ ID NO:11的氨基酸序列组成。
CAR还包含至少一个信号传导结构域,其也称为CAR的胞内信号传导结构域和/或细胞质共刺激信号传导结构域。胞质信号传导结构域负责T细胞的至少一种正常效应子功能的激活,并且是淋巴细胞对抗原的有效反应所必需的。术语“效应子功能”指细胞的特定功能。例如T细胞的效应子功能抗原是细胞溶解活性或辅助活性,其包括细胞因子的分泌。因此,术语“胞质共刺激信号传导结构域”指蛋白质的一部分,其转导效应子功能信号并指导细胞执行特定功能。尽管可以使用整个胞内信号传导结构域,但在很多情况下,不必使用整个链(即,信号传导结构域可以源自整个蛋白质)。就使用胞内信号传导结构域的截短部分而言,只要其转导效应子功能信号,就可以使用这样的截短部分代替完整链。术语胞内信号传导结构域可源自并包括足以转导效应子功能信号的胞内信号传导结构域的任何截短部分。在某些实施方式中,胞内信号传导结构域选自T细胞受体(TCR)和在抗原受体参与后启动信号转导的共受体的胞质序列。在某些实施方式中,胞内信号传导结构域选自但不限于CD2、CD3-ζ、CD3-γ、CD3-δ、CD3-ε、CD5、CD7、CD22、CD27、CD28、CD30、CD40、CD66d、CD79a、CD79b、4-1BB(CD137)、OX40、PD-1、ICOS、淋巴细胞功能相关抗原1(LFA-1)、LIGHT、NKG2C、B7-H3、FcR-γ、FcR-β和TCR-ζ。在一个实施方式中,胞内信号传导结构域源自CD3-ζ、CD28和/或4-1BB。在某些实施方式中,至少一个胞质信号传导结构域包含源自CD3-ζ的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含与SEQ ID NO:14的氨基酸序列具有至少95%序列同一性的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:14的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域由SEQ ID NO:14的氨基酸序列组成。在一个实施方式中,至少一个胞质信号传导结构域包含源自CD28的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含与SEQ IDNO:12的氨基酸序列具有至少95%序列同一性的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:12的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域由SEQ ID NO:12的氨基酸序列组成。在一个实施方式中,至少一个胞质信号传导结构域包含源自4-1BB的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含与SEQ ID NO:13的氨基酸序列具有至少95%序列同一性的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域包含SEQ ID NO:13的氨基酸序列。在某些实施方式中,至少一个胞质信号传导结构域由SEQ ID NO:13的氨基酸序列组成。在某些实施方式中,CAR包含三个胞质信号传导结构域,并且胞质信号传导结构域源自CD28、CD3和4-1BB。在一个实施方式中,第一胞质信号传导结构域源自CD28,第二胞质信号传导结构域源自CD3,并且第三胞质信号传导结构域源自4-1BB。在某些实施方式中,第一胞质信号传导结构域包含与SEQ ID NO:14的氨基酸序列具有至少95%序列同一性的氨基酸序列,第二胞质信号传导结构域包含与SEQ ID NO:12的氨基酸序列具有至少95%序列同一性的氨基酸序列,并且第三胞质信号传导结构域包含与SEQ ID NO:13的氨基酸序列具有至少95%序列同一性的氨基酸序列。在某些实施方式中,第一胞质信号传导结构域包含SEQ ID NO:14的氨基酸序列,第二胞质信号传导结构域包含SEQ ID NO:12的氨基酸序列,并且第三胞质信号传导结构域包含SEQ ID NO:13的氨基酸序列。在某些实施方式中,第一胞质信号传导结构域由SEQID NO:14的氨基酸序列组成,第二胞质信号传导结构域由SEQ ID NO:12的氨基酸序列组成,并且第三胞质信号传导结构域由SEQ ID NO:13的氨基酸序列组成。
如在本文中所使用的,当指抗体/抗原、配体/受体、核酸/互补核酸或其他结合对(例如细胞因子与细胞因子受体)时,术语“特异性地结合”或“选择性结合”表示结合反应,其决定了蛋白质和其他生物制剂的异质群体中蛋白质的存在。因此,在指定条件下,特定抗体或其结合结构域与特定抗原结合且不与样品中存在的其他蛋白质大量结合。特异性地结合还可以指例如预期方法的结合化合物、核酸配体、抗体或源自抗体的抗原结合位点的结合组合物与其靶标结合的亲和力比任何其他结合化合物比通常至少高25%、通常至少高50%、通常至少高出100%(两倍)、通常至少高十倍、通常至少高20倍、最通常高至少100倍。
适用于人类、灵长类、哺乳动物、哺乳动物受试者、动物、兽医学科、安慰剂受试者、研究受试者、实验受试者、细胞、组织、器官或生物液体的术语“施用”指但不限于使外源性配体、试剂、安慰剂、小分子、药剂、治疗剂、诊断剂或组合物与受试者、细胞、组织、器官或生物液体等接触。“施用”也可以指例如治疗、药代动力学、诊断、研究、安慰剂和实验方法。细胞的处理包括试剂与细胞的接触以及试剂与液体的接触,其中液体与细胞接触。“施用”还可以包括例如通过试剂、诊断剂、结合组合物或另一种细胞对细胞的体外和离体处理。施用途径可以包括但不限于静脉内给药或输注技术。输注技术可以包括通过针头或导管施用激活的T细胞的群体。通常,输注指激活的T细胞的群体经静脉内或皮下施用。在某些实施方式中,激活的T细胞的群体是全身施用。在某些实施方式中,激活的T细胞的群体是静脉内使用(即通过静脉内(IV)注射)。优选的施用途径是腹膜内或静脉内。
术语“减毒”和“减毒的”涵盖细菌、病毒、寄生虫、感染性生物、朊病毒、细胞、感染性生物中的基因等,其经修饰以降低对宿主的毒性。宿主可以是人或动物宿主、或器官、组织或细胞。给出非限制性实施例,病毒可以被减毒以减少与宿主细胞的结合,以降低从一个宿主细胞到另一个宿主细胞的扩散。减毒可以通过测量例如毒性的标记或标记,LD
CAR T细胞
本公开部分涉及源自效应子细胞的CAR T细胞的制备和在接受者中的用途。一方面,本公开涉及表达嵌合抗原受体(CAR)的激活的T细胞的群体,所述CAR包含特异性地结合LYPD3的胞外结构域。LYPD3(含有Ly6/PLAUR结构域3),也称为C4.4A、GPI锚定的转移相关蛋白C4.4A同源物、GPI锚定的转移相关蛋白同源物、MIG-C4或基质胶诱导基因C4蛋白。
用于本文所公开的方法中的T细胞可以通过本领域已知的方法分离,包括市售分离方法(参见例如Cartellieri等,A Novel Ex Vivo Isolation and ExpansionProcedure for Chimeric Antigen Receptor Engrafted Human T Cells,2014;和Ghassemi等,Reducing Ex Vivo Culture Improves the Antileukemic Activity ofChimeric Antigen Receptor(CAR)T Cells,2018)。T细胞的来源包括但不限于外周血、脐带血、骨髓或其他造血细胞来源。可以采用多种技术来分离细胞以分离或富集所需的T细胞。此外,扩增T细胞的方法是本领域已知的(参见,例如参见,例如Cartellieri等,A NovelEx Vivo Isolation and Expansion Procedure for Chimeric Antigen ReceptorEngrafted Human T Cells,2014和Ghassemi等,Reducing Ex Vivo Culture Improvesthe Antileukemic Activity of Chimeric Antigen Receptor(CAR)T Cells,2018)。分离和扩增调节性T细胞的方法也是可商购的(参见例如BD Biosciences,San Jose,Calif.;STEMCELL Technologies Inc.,Vancouver,Canada;eBioscience,San Diego,Calif.;Invitrogen,Carlsbad,Calif.)。在一些实施方式中,可通过在IL-2的存在下培养来扩增所述T细胞。在某些实施方式中,可通过在抗CD3抗体和/或抗CD28抗体的存在下培养来扩增所述T细胞。在一些实施方式中,可通过在IL-2的存在下培养来扩增所述T细胞,和通过在抗CD3抗体和/或抗CD28抗体的存在下培养来扩增所述T细胞。
细胞的分离方法包括但不限于密度梯度离心、偶联至修饰细胞密度的粒子、用抗体包被的磁珠进行磁性分离、亲和层析;加入或与单克隆抗体(mAb)集合使用的细胞毒剂,其包括但不限于补体和细胞毒素,以及用附着在固体基质(例如板或芯片)上的抗体淘选、淘析、流式细胞仪、或任何其他方便的技术。
分离的T细胞对于如本文所公开的治疗方法所施用的受试者可以是自体的或非自体的。从受试者中分离出自体细胞,向其施用包含CAR的激活的T细胞的群体。在某些实施方式中,从受试者中分离出自体细胞,向其施用重组表达CAR的分离和扩增的细胞。在一些实施方式中,细胞可以通过白细胞去除术获得,其中从抽出的血液中选择性地去除白细胞,进行重组,然后重新输血至供体受试者中。或者,可以使用来自不是受试者的非自体供体的同种异体细胞。在非自体供体的情况下,如本领域所公知的,对细胞进行分型并与人白细胞抗体(HLA)匹配以确定合适的相容性水平。对于自体和非自体细胞,可任选地将细胞冷冻保存直至准备使用本领域公知的方法用于遗传操作和/或施用于受试者。
因为细胞因子的释放是T细胞激活和功效的必要结果,所以对于有效的基于CAR T细胞的疗法,优选的是至少一部分活化的T细胞产生一种或多种细胞因子,例如选自IL-1β、IL-2、TNF-α和IFN-γ的一种或多种细胞因子。此外,至少一部分活化的T细胞的群体优选地表达一种或多种表面标记物,其选自由CD2、CD28、CTLA4、CD40配体(gp39)、CD28、CD25、CD69、CD16/CD56、MHC I类、MHC II类、CD8、CD4、CD3/TcR、CD54、LFA-1和VLA-4组成的组。
治疗组合物
本文所述的细胞组合物可以单独地或与药学上可接受的载体组合以足以诱导适当的抗肿瘤反应的量施用于受试者。应答抗原包括但不限于特异性免疫应答、非特异性免疫应答、特异性和非特异性应答、先天应答、初级免疫应答、适应性免疫、次级免疫应答、记忆免疫应答、免疫细胞激活、免疫细胞增殖、免疫细胞分化和细胞因子表达。
本公开提供了通过向受试者施用有效量的CAR T细胞的群体在受试者中产生抗肿瘤免疫的方法。如在本文中所使用的,“有效量”指提供治疗或预防益处的量。CAR T细胞的有效量可以通过医生考虑年龄、体重、肿瘤大小、感染或转移的程度以及患者(受试者)的情况的个体差异来确定。通常可以指出,包含本文所述的表达CAR的活化的T细胞的群体的药物组合物可以以10
包含表达本文所述的嵌合抗原受体的激活的T细胞的群体的细胞组合物的有效量可以在一剂激活的T细胞的群体中一次施用,但不限于一剂。因此,施用可以是表达嵌合抗原受体的激活的T细胞的群体的二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九、二十或更多次剂量。如果施用的剂量不止一次,则施用间隔可以是间隔一分钟、两分钟、三、四、五、六、七、八、九、十或更多分钟,间隔约一小时、两小时、三、四、五、六、七、八、九、十、11、12、13、14、15、16、17、18、19、20、21、22、23、24小时等等。在小时的上下文中,术语“约”指在正负30分钟内的任意时间间隔。剂量的施用也可以以一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天或更长时间及其任意组合。本发明不限于在时间上等距间隔的给药间隔,但也可以包含非等间隔的剂量,例如由在1天、4天、7天和25天给药组成的启动时间表。
如在本文中所使用的,术语“药学上可接受的载体”或“药学上可接受的赋形剂”指当与激活的T细胞的群体组合时允许T细胞的群体保持生物学活性的任何材料。实施例包括但不限于任何标准药物载体,例如磷酸盐缓冲盐溶液、水、乳化剂,例如油/水乳化剂、基于氨基酸的缓冲剂或碳酸氢盐缓冲溶液和各种类型的润湿剂。在某些实施方式中,当施用于受试者时,载体不产生不利的、过敏的或其他不良反应。在一些实施方式中,包含载体的药物组合物不含热原以及其他可能对受试者有害的杂质。药学上可接受的载体可以包括任何和所有溶剂、分散介质、包衣、抗菌和抗真菌剂、等渗剂和吸收延迟剂等;其使用在本领域是众所周知的。可接受的载体、赋形剂或稳定剂对接受者无毒,并且优选地在使用的剂量和浓度下是惰性的,并且包括缓冲剂,例如磷酸盐、柠檬酸盐或其他有机酸;抗氧化剂,例如抗坏血酸;低分子量多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡糖糖、甘露糖或糊精;螯合剂,例如EDTA;糖醇,例如甘露醇或山梨糖醇;成盐的抗衡离子,例如钠;和/或非离子表面活性剂,例如吐温、普朗克尼或聚乙二醇(PEG)。包含这类载体的组合物通过众所周知的常规方法配制(参见例如Remington'sPharmaceutical Sciences,18th edition,A.Gennaro,ed.,Mack Publishing Co.,Easton,Pa.,1990;和Remington,The Science and Practice of Pharmacy 21st Ed.MackPublishing,2005)选择的载体和所用载体的量可以取决于给药方式。
特定受试者/患者的“有效量”根据多种因素而变化,例如待治疗的病症或癌症、患者的整体健康状况、给药途径和剂量以及副作用的严重程度。提供了治疗和诊断方法的指南(参见例如Maynard等,(1996)A Handbook of SOPs for Good Clinical Practice,Interpharm Press,Boca Raton,Fla.;Dent(2001)Good Laboratory and Good ClinicalPractice,Urch Publ.,London,UK)。待施用的细胞数的确定由本领域技术人员来确定,并将部分取决于癌症的程度和严重程度,以及是否正在施用转染的细胞以治疗现有癌症或预防癌症。根据本公开,包含激活的T细胞的药物组合物的制备对于本领域技术人员是已知的。
表达本公开的嵌合抗原受体的激活的T细胞的群体可以以一种或多种剂量施用,其中每个剂量包含至少100细胞/kg体重;至少1000细胞/kg体重;至少10000细胞/kg体重;至少100000细胞/kg体重;至少1000000细胞/kg体重;至少10000000细胞/kg体重;至少100000000细胞/kg体重;至少1x10
可以使用给药时间表例如每周一次、每周两次、每周三次、每周四次、每周五次、每周六次、每周七次、每两周一次、每三周一次、每四周一次、每五周一次等。给药时间表包括给药的总时间段为例如一周、两周、三周、四周、五周、六周、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、长达十二个月或更长。
提供了上述给药时间表的周期。周期可以例如约每七天重复;每14天重复;每21天重复;每28天重复;每35天重复;每42天重复;每49天重复;每56天重复;每63天重复;每70重复等等。一个周期之间可能会出现不加药的间隔,其中间隔大约例如7天;14天;21天;28天;35天;42天;49天;56天;63天;70天等。在该上下文中,术语“约”指正负一天、正负两天、正负三天、正负四天、正负五天、正负六天、或正负七天。
根据本公开的CAR T细胞也可以与一种或多种其他治疗剂一起施用。与其他治疗剂共施用的方法是本领域众所周知的(例如Hardman等(eds.)(2001)Goodman and Gilman's The Pharmacological Basis of Therapeutics,10th ed.,McGraw-Hill,New York,N.Y;Poole and Peterson(eds.)(2001)Pharmacotherapeutics for Advanced Practice:A Practical Approach,Lippincott,Williams&Wilkins,Phila.,Pa.;Chabner and Longo(eds.)(2001)Cancer Chemotherapy and Biotherapy,Lippincott,Williams&Wilkins,Phila.,Pa.)。可以是受试者的治疗方案的一部分的其他试剂,例如其他免疫疗法、检查点抑制剂、免疫肿瘤药物、靶向试剂、化学疗法和/或放射。可以与本公开的组合物组合使用的试剂/治疗方案的实施例包括但不限于阻断CTLA-4、PD-1和/或PD-L1、CSF-1R抑制剂的药物、纳武利尤单抗、派姆单抗、易普利姆玛、阿特朱单抗、阿仑单抗、阿维单抗、奥法木单抗、纳武利尤单抗、派姆单抗、利妥昔单抗、度伐利尤单抗、细胞因子疗法、干扰素、α-干扰素、白介素、白介素-2、树突状细胞疗法(例如Sipuleucel-T)、CHOP、环磷酰胺、甲氨蝶呤、5-氟尿嘧啶、长春瑞滨、阿霉素、多西他赛、博来霉素、达卡巴嗪、芥子碱、卡巴嗪、泼尼松龙、依托泊苷、顺铂、表柔比星、亚叶酸和奥沙利铂。本公开的组合物可以在另外的治疗剂之前、与另外的治疗剂同时、或在另外的治疗剂之后施用。
共施用不必指单个人同时施用,而是可以包括间隔数小时甚至数天、数周或更长时间施用,只要多种治疗剂的施用是单一治疗技术的结果。共施用可以包括在替代性CAR T细胞之前、之后或同时施用本发明的CAR T效应细胞。在示例性的治疗方案中,本公开的CART细胞应细胞可以在多日方案中作为初始剂量给予,而替代性CAR T细胞在随后的施用日给予;或在多日方案中以初始剂量给予的替代性CAR T细胞,在以后的施用日给予本公开的CAR T效应细胞。另一方面,本公开的替代性CAR T细胞和CAR T效应小可以在多日方案中隔日施用。这并不意味着可能的施用方案的限制列表。
治疗剂的有效量是通常减少或减轻癌症症状至少10%,更通常至少20%,最通常至少30%,通常至少40%,更通常至少50%,最通常至少60%,经常至少70%,更经常至少80%,最经常至少90%,常规至少95%,更常规至少99%,最常规至少99.9%。例如,与对照组或接受其他癌症治疗的患者或与治疗前相同的患者相比,如本文中所公开的活化的CART细胞的群体的施用减少肿瘤生长约1%、约5%、约10%、约20%、约30%、约40%、约10%、约50%、约60%、约70%、约80%、约90%、或约100%持续约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约1年、约2年、约5年、或约10年或更久。
可通过与例如冻干粉剂、浆剂、水溶液或混悬剂形式的生理上可接受的载体、赋形剂或稳定剂混合来制备治疗剂的制剂以用于存储(参见例如Hardman 5(2001)Goodman andGilman's The Pharmacological Basis of Therapeutics,McGraw-Hill,New York,N.Y.;Gennaro(2000)Remington:The Science and Practice of Pharmacy,Lippincott,Williams,and Wilkins,New York,N.Y.;Avis等(eds.)(1993)Pharmaceutical DosageForms:Parenteral Medications,Marcel Dekker,NY;Lieberman等(eds.)(1990)Pharmaceutical Dosage Forms:Tablets,Marcel Dekker,NY;Lieberman等(eds.)(1990)Pharmaceutical Dosage Forms:Disperse Systems,Marcel Dekker,NY;Weiner和Kotkoskie(2000)Excipient Toxicity and Safety,Marcel Dekker,Inc.,New York,N.Y.)。
制备方法
本公开提供了一种制备如本文所公开的嵌合抗原受体(CAR)的活化的T细胞的群体的方法,其中所述方法包括:(1)用编码如本文所公开的CAR的核酸来转染或转导分离的T细胞;和(2)在转染或转导后扩增表达该CAR的T细胞,其中通过在IL-2和/或CD3和CD28抗体的存在下培养来扩增所述T细胞。在某些实施方式中,通过在IL-2的存在下培养来扩增所述T细胞。在某些实施方式中,通过在抗CD3抗体的存在下培养来扩增所述T细胞。在某些实施方式中,通过在抗CD28的存在下培养来扩增所述T细胞。在某些实施方式中,通过在IL-2、抗CD3抗体和抗CD28抗体的存在下培养来扩增所述T细胞。在某些实施方式中,所述分离的T细胞是从哺乳动物分离的。在一个实施方式中,所述哺乳动物是人。在某些实施方式中,所述人是患有表达LYPD3的癌症的受试者。在所述方法的一个实施方式中,所述分离的T细胞对于所述患有表达LYPD3的癌症的受试者是自体的。
以下实施例是通过说明性而非限制性方式提供的。
实施例
材料和方法
构建体设计。表达LYPD3-CAR的MP71逆转录病毒构建体是使用标准分子生物学技术产生的。
细胞系和培养基。HEK-293T、Jurkat、LLC和MCF7细胞购自ATCC。来自匿名捐赠者的外周血单核细胞(PBMC)购自Hemacare。将细胞在DMEM+10%FBS、RPMI+10%FBS或X-Vivo+5%人血清A/B中培养。
逆转录病毒载体产生。逆转录病毒载体通过使用标准磷酸钙沉淀方案瞬时转染HEK-293T细胞来制备。在48小时收获病毒上清液并用于转导T细胞。
T细胞转导和扩增。在逆转录病毒转导前,将PBMC通过与T细胞激活珠和人IL-2培养2天来激活。为了转导,将新鲜收获的逆转录病毒上清液通过在32℃下2000g离心2小时,旋转装载到每组织每孔含15mg RetroNectin的无组织培养物处理过的24孔板上(ClontechLaboratories)。将激活的PBMC装载到板上并在32℃以600g旋转30分钟。T细胞在35℃和5%CO
CAR染色。所有抗体购自Biolegend。转导后4天,重组CAR的表达通过Fab染色随后流式细胞术来检测。
CD69染色。所有抗体购自Biolegend。将LYPD3 CAR转导或对照未转导的T细胞与靶细胞共孵育过夜(图2中的LLC和图6中的MCF7)。然后收集T细胞并用CD3和CD69抗体然后,然后通过流式细胞仪分析。
体外IFNγ的产生。所有抗体购自Biolegend。将LYPD3 CAR转导或未转导的T细胞与MCF7靶细胞以1:2效应子比靶标的比率共培养过夜。将T细胞用布雷菲德菌素A和莫能菌素处理4小时,然后收集T细胞应用流式细胞仪检测胞内IFNγ的表达。采用可行的CD4+和CD8+淋巴细胞门控策略。
T细胞杀伤试验。将过表达小鼠LYPD3的路易斯肺癌(LLC)肿瘤细胞用CellTraceCFSE标记并与不同比率的未转导或LYPD3-CAR-T细胞共培养过夜。活的LLC细胞通过流式细胞仪分析,并根据活的LLC细胞计算T细胞杀伤效率。
体内肿瘤的接种和治疗。6-8周大的C57BL/6小鼠皮下植入1e6LLC细胞。当肿瘤易察觉时,腹膜内注射环磷酰胺(300mg/kg)。然后,24小时后,将10e6未转导的或LYPD3-CAR-T细胞通过尾静脉注射入小鼠体内。定期监测肿瘤的生长和小鼠体重,直至达到研究终点,如图4所示。在终点,收获所有LLC肿瘤、拍照并称重。
实施例1:LYPD3 CAR-T细胞杀死表达LYPD3的鳞状癌细胞。
本文提供的第一批数据证明了LYPD3 CAR T细胞对表达LYPD3抗原的鳞状癌细胞的产生、激活和肿瘤杀伤效率(图1-3)。图1显示了LYPD3 CAR在转导的小鼠淋巴细胞中的表达。通过Fab染色,小鼠淋巴细胞为约77.6%LYPD3 CAR阳性。
图2详述了通过CD69激活检测LYPD3阳性路易斯肺癌(LLC)细胞对LYPD3 CAR T细胞的激活。将未转导的或LYPD3 CAR T细胞与工程化以过表达LYPD3的LLC细胞共培养过夜,然后将T细胞用CD3和CD69抗体染色,然后通过流式细胞仪进行分析。
图3显示了LYPD3 CAR T细胞对LYPD3阳性肿瘤细胞的杀伤效率。基于与未转导的或LYPD3 CAR-T细胞以指定比率共培养过夜后存在的活的LLC细胞的数量来计算杀伤效率。这三个图共同表明鼠LYPD3 CAR-T细胞能够特异性识别并杀死携带LYPD3抗原的肿瘤细胞。
实施例2:LYPD3 CAR-T细胞的临床前抗肿瘤效力无明显毒性。
前述实施例说明了小鼠LYPD3 CAR-T细胞对LYPD3阳性肿瘤细胞的体外刺激和细胞毒活性。为了证明这些发现在癌症治疗中的适用性,将C57BL/6小鼠皮下植入工程化以表达LYPD3的1e6 LLC细胞。一旦可察觉肿瘤,将环磷酰胺(300mg/kg)腹腔注射进行预处理。24小时后,将10e6(未转导的)或LYPD3 CAR-T细胞通过尾静脉注射。
如图4所示,使用这种LYPD3 CAR-T细胞疗法治疗鳞状上皮性肺癌小鼠导致平均减轻2倍以上的小鼠肿瘤负荷,视个体(图4A)和平均(图4B)肿瘤体积而定、在研究终点出现肿瘤(图4C)、和终点的肿瘤重量(图4D)。这些发现证明了LYPD3 CAR-T细胞疗法对小鼠肺癌的临床前疗效。
此外,毒性研究表明施用LYPD3 CAR-T细胞的动物耐受这种治疗并保持正常体重(图5)。因为LYPD3 CAR-T细胞显示抗肿瘤功效且无明显毒性,这些细胞代表了一种新的基于T细胞的过继性治疗方法,用于LYPD3相关的癌症的治疗。
实施例3:LYPD3 CAR-T细胞对人乳腺癌的反应性。
先前的实施例说明了LYPD3 CAR-T细胞能够选择性地杀死携带LYPD3抗原的小鼠肿瘤细胞。为了提供在人体中保持同样过程的证明,人PBMC被工程化以表达人LYPD3 CAR。在以下实施例中,将同源表达LYPD3的人MCF7乳腺癌细胞用作靶细胞。
图6包含FACS数据,其显示人LYPD3 CAR T细胞对人癌细胞的反应性。图6A证明了人PBMC中强大的LYPD3 CAR表达,如通过人Fab染色定量的,而图6B详述了表达内源性LYPD3的人癌细胞对LYPD3 CAR-T细胞的刺激。与MCF7乳腺癌细胞共培养过夜后,收集CAR-T细胞并用CD3和CD69抗体染色,然后用流式细胞仪定量。这些结果证明,与小鼠LYPD3 CAR-T细胞(图1-3)一样,人LYPD3CAR-T细胞在表达LYPD3抗原的肿瘤细胞存在下被激活。
人LYPD3 CAR-T细胞刺激在图6C和6D中进一步详述,其显示了未转导的(6C)或LYPD3 CAR(图6D)T细胞与MCF7乳腺癌细胞以1:2效应子与靶标比率共培养过夜后的IFNγ表达。与<1%IFNγ阳性对照细胞相比,INFγ阳性检测结果表明,约10.4%的LYPD3CAR-T细胞在与MCF7细胞孵育后被激活。
上述实施例表明先前的小鼠LYPD3 CAR-T细胞结果可以容易地应用于人T细胞和癌症,这可以通过对LYPD3阳性乳腺癌细胞由强大的人CAR-T细胞激活作用来证明。总之,这些结果揭示了LYPD3CAR-T细胞疗法作为一种有前景的新疗法用于治疗表现出LYPD3抗原细胞表面表达的多种肿瘤。
SEQ ID NO:1.LYPD3-scFv的核酸序列
SEQ ID NO:2.跨膜结构域的核酸序列
SEQ ID NO:3.CD28共刺激信号传导结构域的核酸序列
SEQ ID NO:4.41BB共刺激信号传导结构域的核酸序列
SEQ ID NO:5.CD3胞内信号传导结构域的核酸序列
SEQ ID NO:6.小鼠LYPD3 CAR跨膜结构域的核酸序列
SEQ ID NO:7.小鼠LYPD3 CAR的CD28共刺激信号传导结构域的核酸序列
SEQ ID NO:8.小鼠LYPD3 CAR的41BB共刺激信号传导结构域的核酸序列
SEQ ID NO:9.小鼠LYPD3 CAR的CD3胞内信号传导结构域的核酸序列
SEQ ID NO:10.LYPD3-scFv的氨基酸序列
SEQ ID NO:11.跨膜结构域的氨基酸序列
SEQ ID NO:12.CD28共刺激信号传导结构域的氨基酸序列
SEQ ID NO:13.41BB共刺激信号传导结构域的氨基酸序列
SEQ ID NO:14.CD3胞内信号传导结构域的氨基酸序列
SEQ ID NO:15.小鼠LYPD3 CAR的跨膜结构域的氨基酸序列
SEQ ID NO:16.小鼠LYPD3 CAR的CD28共刺激信号传导结构域的氨基酸序列
SEQ ID NO:17.小鼠LYPD3 CAR的41BB共刺激信号传导结构域的氨基酸序列
SEQ ID NO:18.小鼠LYPD3 CAR的CD3胞内信号传导结构域的氨基酸序列
SEQ ID NO:19.NM_014400.3人类含LY6/PLAUR结构域的3(LYPD3),mRNA
SEQ ID NO:20.NM_055215.2含ly6/PLAUR结构域的蛋白3前体[人类]
本说明书中提到的任何专利或出版物都指示了本发明所属领域的技术人员的水平。这些专利和出版物的引用程度与在此具体引用的程度相同,就好像每个单独的出版物均被明确地和单独地指出通过引用并入。在有冲突的情况下,以本说明书包括定义为准。
本领域技术人员将容易地理解,本发明非常适合于实现目的并获得所提及的目的和优点以及其中固有的目的和优点。本文所述的本公开目前代表优选的实施方式,是示例性的,并且不旨在作为本发明范围的限制。本领域技术人员将想到其中的改变和其他用途,这包括在由权利要求的范围所限定的本发明的宗旨内。
没有承认任何参考文献(包括本说明书中引用的任何非专利或专利文件)构成现有技术。特别地,将理解的是,除非另有说明,否则本文中任何文件的引用均非承认这些文件中的任何文件构成美国或任何其他国家的本领域公知常识的一部分。对参考文献的任何讨论均陈述了其作者的主张,并且申请人保留对本文引用的任何文件的准确性和相关性提出质疑的权利。除非另外明确指出,否则本文引用的所有参考文献通过引用整体并入。在引用的参考文献中发现的任何定义和/或描述之间存在任何差异的情况下,本公开将决定其含义。
- 用于癌症治疗的抗LYPD3 CAR T细胞疗法
- 用于癌症治疗的抗oxMIF/抗CD3抗体
