一种检测牛精液中BVDV1型的组合物、试剂盒及应用
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及病毒检测技术领域,涉及一种检测牛精液中BVDV1型的组合物、试剂盒及应用。
背景技术
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)为黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)病毒,根据病毒5’-UTR基因序列将BVDV分为BVDV1型和BVDV2型。该病毒可引起牛的病毒性腹泻病(BVD),还可感染猪、羊、鹿等其他反刍动物,引起呼吸、胃肠道系统疾病、母畜流产等症状;同时,BVDV可引起免疫抑制而易继发其它传染病,死亡率极高;给养殖业造成巨大的经济损失,在世界范围内属于动物检疫的重点对象。《中华人民共和国进境动物检疫疫病名录》将其列为二类传染病。2014年9月,我国口岸首次从澳大利亚牛血清中检出该病毒。因此,早期诊断对该病的及时发现和快速控制都非常重要。
近年来,因我国奶牛养殖业发展及动物育种改良的需要,先后批准从乌拉圭、新西兰、澳大利亚等国进口种牛,同时与澳大利亚、新西兰、美国等国均签署了进口牛精液检疫和卫生条件议定书,议定书中规定输入牛精液需进行BVDV检测。此外,国内也有用于育种的牛精液产品贸易。然而,对垂直传播的病毒检测需要更高的灵敏性要求,因此,提高检测敏感性避免漏检,以及加强检测规范性,是牛精液检疫技术的重中之重。
微滴式数字PCR(droplet digital PCR,ddPCR)技术是新一代PCR技术,用油包水的方法进行反应,使核酸分子分布于每个微滴中,经PCR扩增后,经过微滴检测,根据泊松分布原理计算出拷贝数,可实现核酸准确定量。相比荧光定量PCR方法更灵敏准确,受PCR反应抑制物的影响小,可实现复杂来源样品中极低含量核酸分子稳定检出。
而目前,国内对牛精液中BVDV1型检测方法为分子生物学检测法,主要有常规PCR法和荧光定量PCR法,当牛精液中病原含量极其微少时,存在检不出的现象。目前还没有采用ddPCR技术检测BVDV1型的方法,而基于现有技术中检测BVDV1型所存在灵敏性差等问题,亟待建立适合牛精液中BVDV1型检测的超灵敏、稳定、快速的检测方法。
发明内容
本发明的目的是提供一种检测牛精液中BVDV1型的组合物、试剂盒及应用,以解决上述现有技术存在的问题,提供了一种包含引物和探针的组合物,利用该组合物能快速、灵敏、准确检测牛精液中的BVDV1型。
为实现上述目的,本发明提供了如下方案:
本发明提供一种检测牛精液中BVDV1型的组合物,包括引物对和探针,其中所述引物对为上游引物如SEQ ID NO:1所示和下游引物如SEQ ID NO:2所示的核苷酸序列,所述探针为5’端连接FAM且3’端连接BHQ1的如SEQ ID NO:3所示的核苷酸序列。
本发明还提供一种检测牛精液中BVDV1型的方法,包括基于微滴式数字PCR,且利用权利要求1所述的组合物扩增牛精液样品的步骤。
优选的是,所述微滴式数字PCR反应体系为20μL,其包括以下组分:2×ddPCR预混液10μL,上、下游引物各1.6μL,探针0.4μL,模板1μL,补充水至20μL。
优选的是,所述微滴式数字PCR反应条件为:95℃10min;95℃30sec,60℃1min,共40个循环;98℃5min,16℃保存;
所述微滴式数字PCR反应条件中的升温速度和降温速度均为2.5℃/sec。
具体的检测牛精液中BVDV1型的方法,包含如下操作:对经反转录后的牛精液样品进行微滴式数字PCR(QX200 Droplet Reader,BIO-RAD,USA)反应,每个反应总体积为20μL,各组分如下:2×ddPCR预混液10μL,上、下游引物各1.6μL(800nmol/L),探针0.4μL(200nmol/L),模板1μL,补充水至20μL。将充分混匀的PCR体系转移到微滴发生板上对应的样品孔中,在每个注油孔中加入70μL微滴发生专用油,将微滴发生板放到微滴发生卡适配器上,套上密封垫,最后把微滴发生卡适配器放置于微滴发生仪中进行反应。将反应生成的微滴转移入96孔PCR板上,并贴上热封膜,然后用热封仪密封后,置于PCR仪中进行扩增。反应程序参数为:95℃预变性10min;95℃变性30sec,60℃退火延伸1min,共40个循环;98℃稳定微滴5min,16℃保存。在PCR反应过程中温度升降速度设置在2.5℃/sec。最后用微滴分析仪对扩增产物进行计数分析。根据分析得到的拷贝数对检测结果进行判断。
本发明还提供一种检测牛精液中BVDV1型的试剂盒,包括权利要求1所述的组合物。
本发明还提供一种所述的组合物或所述的试剂盒在检测牛精液中BVDV1型中的应用。
本发明公开了以下技术效果:
(1)本发明提供的ddPCR方法检测灵敏度高于现有的荧光定量PCR方法,可检测到低至单个拷贝的目的核酸(1copies/μL),且无需依赖标准曲线即可对样品初始拷贝数进行定量,可实现BVDV1型的精准检疫。
(2)本发明通过实验验证,提供了ddPCR反应过程中最适的退火温度,以提高ddPCR的扩增效率。
(3)本发明提供的引物特异性好,与牛传染性鼻气管炎病毒(IBRV)、蓝舌病病毒(BTV)、牛布氏杆菌(Brucella)和牛型结核分枝杆菌(Mycobacterium bovis)核酸无交叉反应。
(4)本发明提供的引物稳定性好,样品经过不同时间后进行检测,其组内和组间阳性微滴占比的变异系数均小于0.5%,说明重现性高。
(5)本发明提供的ddPCR方法受抑制物影响小,荧光定量PCR方法的检测容易受反应抑制物的影响呈现假阴性,而利用ddPCR的微滴反应体系,能有效避免假阴性的出现。
(6)在低浓度病毒下,本发明提供的ddPCR方法的检测效果显著优于荧光定量PCR方法。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例中不同退火温度牛病毒性腹泻病毒1型微滴式数字PCR法扩增一维散点图;
图2为本发明实施例中荧光定量PCR标准曲线(A)和灵敏性检测结果(B)图;其中,B图曲线1~10分别为1×10
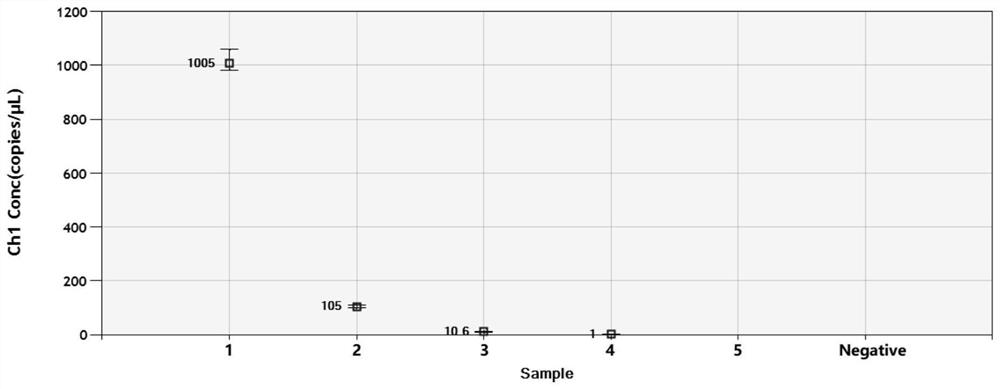
图3为本发明实施例中牛病毒性腹泻病毒1型微滴式数字PCR法灵敏性检测中目标基因拷贝数结果图;其中,1~5分别为1×10
图4为本发明实施例中牛病毒性腹泻病毒1型微滴数字PCR法特异性检测结果一维散点图(A)和目标基因拷贝数结果图(B);其中,1~5分别为阳性对照、牛传染性鼻气管炎病毒、蓝舌病病毒、牛布氏杆菌和牛型结核分枝杆菌核酸样品;NC为阴性对照。
具体实施方式
现以实施例方式对本发明技术方案进行具体说明,但其不应该被认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
以下实施例中所用到的牛病毒性腹泻病毒(BVDV1型)、牛传染性鼻气管炎病毒(IBRV)、蓝舌病病毒(BTV)、牛布氏杆菌(Brucella)和牛型结核分枝杆菌(Mycobacteriumbovis)核酸样品以及90份牛精液样品(含30份BVDV1型临床样品)均由呼和浩特海关技术中心提供。
实施例1BVDV1型ddPCR方法的建立
1、引物和探针的设计
将GenBank公布的BVDV的5’-UTR基因序列(如有登录号:AJ304384.1\EU180029.1\GU395536.1\KF205297.1\LT901625.1MF347399.1\MG323524.1\MG670546.1\MH198309.1)进行序列比对,进一步确定了BVDV 5’-UTR基因的保守区域(其序列如SEQ ID NO:4所示)。根据保守区域,设计1对BVDV引物和1条Taqman探针,由生工生物工程(上海)股份有限公司合成,具体序列见表1。
其中SEQ ID NO:4:
AGGCTAGCCATGCCCTTAGTAGGACTAGCAAAATGAGGGGGGTAGCAACAGTGGTGAGTTCGTTGGATGGCTGAAGCCCTGAGTACAGGGCAGTCGTCAGTGGTTCGACACCTAGGATGGTAGGTCTCGAGATGCCACGTGGACGAGGGCATGCCCACAGCACATCTTAGCCTGAGCGGGGGTCGCCCAGGTGAAAGCGGTACAGACAGACCGCTACGAATACAGCCTGATAGGGTGCTGCAGA;
表1 BVDV1型ddPCR检测引物和探针序列
2、病毒基因组的提取
使用病毒基因组DNA/RNA小量提取试剂盒(宝生物工程(大连)有限公司,货号AK2802)操作说明书进行病毒DNA或RNA提取,提取的DNA在-80℃保存备用。
提取的RNA进行cDNA转录,转录体系20μL,包括5×AMV Buffer 4μL,dNTP(2.5mmol/L)2μL,RNasin(40U/μL)0.5μL,10μM反转录引物2μL,AMV反转录酶(5U/μL)1μL,RNA模板10.5μL,混匀,然后置PCR仪进行反转录,反转录程序为:42℃60min;99℃5min,cDNA转录完成后-80℃保存备用。以上试剂均购自宝生物(大连)生物工程有限公司。
3、BVDV 5’-UTR基因DNA质粒模板的合成
用上述引物(BVDV-F和BVDV-R)将所获得BVDV的cDNA样品进行普通PCR扩增,收集扩增片段送至宝生物(大连)生物工程有限公司测序,通过NCBI的BLAST工具比对,为目标序列SEQ ID NO:5;
其中,SEQ ID NO:5:
TGAGTACAGGGCAGTCGTCAGTGGTTCGACACCTAGGATGGTAGGTCTCGAGATGCCACGTGGACGAGGGCATGCCCACAGCACATCTTAGCCTGAGC;
然后将所述片段连接到Trans-T1感受态细胞中,命名为pBVDV质粒。用质粒提取试剂盒(南京诺唯赞生物科技有限公司)提取质粒。用NanoDrop 1000紫外可见分光光度计(Thermo Scientific)定量纯化后的DNA稀释成1.0×10
4、ddPCR的建立
利用上述所设计的引物及探针,使用ddPCR Supermix for Probes试剂盒(BIO-RAD,USA),用20μL ddPCR扩增体系,包括:2×ddPCR Supermix 10μL,200nmol/L探针0.4μL,800nmol/L上、下游引物各1.6μL,模板DNA 1μL,灭菌去离子水4.9μL。根据引物长度、碱基含量等优化反应条件,反应程序设置为:95℃10min;40个循环:95℃30sec,50℃~65℃1min;98℃稳定微滴5min,16℃保存。(升降温速度为2.5℃/sec)
结果显示:在60℃时,荧光信号的强度最大,中间弥散的微滴数最少,并且阳性微滴和阴性微滴之间的划分明显,阳性微滴数与阴性微滴数趋于稳定。因此,选用60℃作为最优退火温度,见图1。
实施例2荧光定量PCR方法检测引物和探针的有效性
利用上述ddPCR引物及探针,使用TransStart Probe qPCR SuperMix试剂盒(北京全式金生物技术有限公司),按照25μL反应体系进行荧光定量PCR实验,见表2。
表2 25μL荧光定量PCR反应体系
反应条件为:94℃30sec;94℃5sec,58℃30sec,共40个循环。
实验结果显示:线性关系良好,在40个循环内最低检出浓度为1×10
实施例3ddPCR方法灵敏性检测
根据荧光定量PCR的检测结果,剔除超过ddPCR动态范围的高浓度模板后进行ddPCR检测,以确定该所建立的方法的检测灵敏度。具体检测方法同实施例1中ddPCR的建立,优化后的反应参数,建立灵敏性检测试验。
检测结果显示:ddPCR对阳性质粒的最低检出浓度为1×10
实施例4ddPCR方法重复性和稳定性检测
选取稀释度为1×10
结果表明,阳性微滴数占总微滴数占比的组内重复变异系数为0.01%~0.08%,组间变异系数为0.02%~0.1%。均低于0.5%,该检测方法重复性和稳定性良好,表3-4。
表3组内重复性试验结果
表4组间重复性试验结果
实施例5ddPCR方法特异性检测
用IBRV、BTV、牛布氏杆菌和牛型结核分枝杆菌核酸为模板,按优化后的反应参数,建立特异性试验。用pBVDV质粒做为阳性对照组,同时设立阴性对照。
结果显示:该方法只对阳性样品有扩增,对其他样品均无扩增,表明该方法特异性较好,见图4A-B。
实施例6建立的ddPCR方法对临床样品检测
使用本发明实施例1提供的BVDV 1型ddPCR方法检测90份牛精液样品,其中已知30份BVDV1型阳性样品。同时,检测结果与OIE诊断用的荧光定量PCR检测结果进行比较。
结果显示,ddPCR结果:30份为阳性,60份为阴性,与已知结果一致;荧光定量PCR检测结果:27份为阳性,63份为阴性,其中27份阳性结果与已知结果一致,另外3份结果不一致的样品再用ddPCR方法检测出阳性,与已知结果一致。因此,说明本发明提供的ddPCR检测方法比荧光定量PCR检测方法更加灵敏。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110> 广东海洋大学 呼和浩特海关技术中心
<120> 一种检测牛精液中BVDV1型的组合物、试剂盒及应用
<160> 5
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
tgagtacagg gcagtcgtca 20
<210> 2
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gctcaggcta agatgtgctg t 21
<210> 3
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
cgagatgcca cgtggacgag ggca 24
<210> 4
<211> 244
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
aggctagcca tgcccttagt aggactagca aaatgagggg ggtagcaaca gtggtgagtt 60
cgttggatgg ctgaagccct gagtacaggg cagtcgtcag tggttcgaca cctaggatgg 120
taggtctcga gatgccacgt ggacgagggc atgcccacag cacatcttag cctgagcggg 180
ggtcgcccag gtgaaagcgg tacagacaga ccgctacgaa tacagcctga tagggtgctg 240
caga 244
<210> 5
<211> 98
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
tgagtacagg gcagtcgtca gtggttcgac acctaggatg gtaggtctcg agatgccacg 60
tggacgaggg catgcccaca gcacatctta gcctgagc 98
- 一种检测牛精液中BVDV1型的组合物、试剂盒及应用
- 一种阿胶中驴、牛源性巢式荧光PCR检测引物、探针组合物、试剂盒及检测方法与应用
