用于流体样本中运动物体的基于运动的无标记检测的设备和方法
文献发布时间:2023-06-19 11:55:48
相关申请
本申请要求于2018年10月18日提交的美国临时专利申请第62/747,285号的优先权,并且其全部内容通过引用结合于此。根据35U.S.C.§119和任何其他适用的法规,要求优先权。
技术领域
技术领域通常涉及用于检测体液中的运动物体的设备和方法。一个特定的实施例涉及检测和计数体液中的寄生虫。该设备和方法利用全息散斑分析和深度学习来检测运动物体,例如体液中的寄生虫。
背景技术
寄生虫感染影响全球数十亿人,导致巨大的社会经济负担。尽管通常与低收入国家有关,但在发达国家,寄生虫感染也日益引起人们对健康的关注。仅在美国,数以百万计的人就受到各种寄生虫的影响,这可能导致严重的疾病甚至死亡。从单细胞病原细菌和寄生原生动物到多细胞寄生虫和体外寄生虫,运动性(motility)在引起疾病的生物中是常见的。运动性是细胞或生物体利用自身能量自行移动的能力。生物体从一个位置移动到另一个位置的能力对于成功感染和传播具有明显的好处,而运动性通常是毒力的关键。尽管运动性对寄生虫的生活方式很重要,但寄生虫运动性仍然是研究不足的领域,而基于运动的诊断在很大程度上仍未得到充分研究。
人类非洲锥虫病(HAT)(也称为昏睡病)和恰加斯病(即美国锥虫病)是可活动的原生动物寄生虫引起的被忽视的热带病(NTD)的示例。作为NTD,从历史上看,它们很少受到关注,对世界上最贫困的人口造成了不成比例的影响,并且缺乏足够的医疗干预手段来进行诊断和治疗。没有疫苗,并且现有的化学疗法具有高毒性和耐药性。这两种破坏性疾病,HAT和恰加斯病,是由相关的锥虫寄生虫引起的。布氏锥虫(布氏冈比亚锥虫和布氏罗得西亚锥虫亚种)是HAT的病因,相关物种引起动物疾病,给世界上一些最贫穷的地区带来了沉重的经济负担。寄生虫通过采采蝇传播给人类,并在血液和组织中在细胞外存活,对中枢神经系统(CNS)产生巨大影响。HAT在撒哈拉以南非洲大约30个国家中很流行,约有6500万人面临感染的危险。报告的病例数已降至历史低点,但过去的病例数下降之后是主要的流行病。因此,HAT仍然是重要的人类健康风险。另一方面,恰加斯病是由克氏锥虫(克氏锥虫)引起的,它侵入宿主细胞并在其中复制,从而导致宿主组织内出现严重的病理状况。恰加斯病主要是由锥蝽的叮咬传播的,但是其他传播途径包括输血和摄入被污染的食物或饮料。该疾病在拉丁美洲是地方性流行,影响了超过600万人。据估计,在美国,超过300,000人受到感染,并且随着全球化和气候变化影响疾病传播媒介的分布,预计还会进一步增加。
两种锥虫病都可分为初始阶段,在该阶段锥虫在血液中循环并且药物治疗是最有效的(I期HAT和急性恰加斯病),而如果不是不可能的话,后期治疗阶段极其困难(II期HAT和慢性恰加斯病)。因此,早期检测对于这两种疾病都是至关重要的。但是,快速而灵敏的诊断仍然具有挑战性,特别是在资源有限的情况下。在HAT的诊断中,评估疾病的阶段以确定适当的治疗策略也很重要。在I期HAT,锥虫保留在血液和淋巴液中,而II期HAT的特征是锥虫穿过血脑屏障并侵入中枢神经系统(CNS),引起神经系统症状,如果不加以治疗,最终会死亡。由于用于治疗I期和II期HAT的药物是不可互换的,并且II期的药物可能更具毒性,因此识别疾病的阶段以告知治疗方案的选择非常重要。当前的阶段的确定是通过腰椎穿刺收集脑脊髓液(CSF)并在显微镜下检查CSF中是否存在白细胞(WBC)和锥虫。
两种锥虫物种的长度通常为约20μm,宽度为约3μm,并且使用鞭毛介导的运动性进行寄生虫推进。在大量体液(例如血液和CSF)中检测这些运动性寄生虫是一项重要的临床挑战。数十年来,布氏冈比亚锥虫HAT的标准筛选测试是锥虫病(CATT)的卡片凝集测试,可检测针对特定寄生虫抗原的抗体的存在。但是,CATT在某些领域受到实际限制以及特异性和敏感性低的困扰。此外,通常必须通过直接目视观察血样来确认CATT检测呈阳性。已经开发了几种分子和免疫学检测方法,包括聚合酶链反应(PCR)和快速诊断测试(RDT),但是这些方法受到特异性或敏感性不足、对复杂设备和训练有素的人员的需求或生产成本高的限制。因此,显微评估仍广泛用于主要或次要诊断,并且直接观察CSF仍然是HAT阶段确定的唯一方法。每毫升全血通常包含数十亿个红细胞(RBC)、数百万个白细胞(WBC)和数亿个血小板。相比之下,血液寄生虫血症在感染过程中会波动,并且通常低于100寄生虫/mL,这使得锥虫体的显微镜鉴定成为一个麻烦的问题。因此,直接观察法的低灵敏度需要分析分离设备,例如离心或离子交换纯化,这部分限制了在资源有限的环境中进行分析的能力。因此,仍然主要需要开发具有高灵敏度和通量的新方法,其可以降低成本并简化诊断。
发明内容
为了解决这一重要挑战,本发明涉及用于检测样本中的运动物体的系统和方法,其可用于例如检测体液中的寄生虫。该系统和方法利用基于无透镜、时间分辨的全息散斑成像的经济有效且可现场携带的光学设备,以无标签、高通量和灵敏地检测各种体液和混浊介质中的运动性寄生虫。代替染色目标分析物或使用分子生物标记物,该技术利用自驱动寄生虫(或其他运动性微生物或细胞)的移动作为生物标记物和内源性对比机制。结果,样本制备非常简单和快速,不需要任何台式规模的样本处理设备/装备,并且不需要冷藏、离心或纯化。
因此,本发明的一个实施例涉及一种成像平台,用于无标记检测样本中的运动物体。例如,运动物体可以是生物体,例如寄生虫或其他合适的运动物体。成像平台包括一个或多个基本上光学透明的样本保持物,例如毛细管或其他合适的样本保持物。成像平台还具有可移动的扫描头,其包含一个或多个相干光源以及与一个或多个相干光源相关联的相应的图像传感器。例如,扫描头可以仅是单个相干光源(例如,激光二极管)和单个图像传感器(例如,互补金属氧化物半导体(CMOS)),或者扫描头可以具有用于每个样本保持物的相干光源和图像传感器。相干光源指向相应的样本保持物,并且相应的图像传感器位于相应的样本保持物下方,以获得包含在样本保持物中的样本的图像序列。作为示例,图像传感器可以记录容纳在样本保持物中的样本的随时间变化的全息散斑图案(例如,“运动”)。
成像平台具有被配置为接收由图像传感器获得的随时间变化的全息散斑图案图像序列的计算设备。该计算设备包括计算运动分析软件,其被配置为生成一个或多个样本保持物内的运动物体的三维(3D)对比度图。该计算设备还具有基于深度学习的分类器软件,以识别三维(3D)对比图中的运动物体。
在另一方面,成像平台还可以包括平移台,其被配置为沿一个或多个样本保持物平移可移动的扫描头。
例如,平移台可以被配置为使扫描头沿着一个或多个光学透明样本保持物线性地移动,以允许扫描头在样本保持物的不同部分(例如,沿着样本保持物的长度的不同部分)获得图像序列。
在成像平台的另一方面,样本包括生物流体,例如血液。在另一方面,生物流体包括血液或脑脊髓液。
在另一方面,样本保持物是一个或多个毛细管。例如,毛细管可以是细长的矩形管(即,具有矩形的横截面)。
在成像平台的另一方面,一个或多个相干光源可以是将光投射到一个或多个样本保持物上的激光二极管、发光二极管和/或激光器,或前述的任何组合。
在另一方面,平移台可包括一个或多个保持可移动的扫描头的线性运动轴以及经由皮带耦接到可移动的扫描头的步进电机。平移台可以被配置为移动扫描头以沿着样本保持物的不同区域或区块捕获随时间变化的全息散斑图案。
在成像平台的另一特征中,可移动的扫描头可以进一步包括用于图像传感器的一个或多个散热器。例如,散热器可以被布置为消散由可操作地耦接到图像传感器的电路板产生的热量。散热器可以是定制的金属(例如铝)元件,并且可以设置在电路板和每个图像传感器之间,以防止图像传感器由于过热而损坏或发生故障。
在另一方面,计算运动分析软件被配置为执行目标函数归一化(OFN),以抑制样本内强烈散射的物体。
本发明的另一个实施例涉及使用成像平台来例如检测流体样本中的运动物体的方法。该方法包括将流体样本装载到一个或多个基本上光学透明的样本保持物中。可移动的扫描头被平移到一个或多个样本保持物的不同区域。图像传感器获得流体样本的随时间变化的全息散斑图案图像序列。然后,计算设备使用基于深度学习的分类器软件识别样本中的一个或多个运动物体。
在方法的另一方面,通过使用计算运动分析软件生成图像序列中运动物体的三维(3D)对比图,然后使用基于深度学习的分类器软件在运动物体的三维(3D)对比图中识别运动物体,计算设备识别图像序列中的一个或多个运动物体。
在使用成像平台的方法的另一方面,在将流体样本装载到样本保持物中之前,首先将流体样本暴露于裂解缓冲液。
在该方法的另一方面,在平移可移动的扫描头和图像传感器之前,允许流体样本沉降,以获得流体样本的随时间变化的全息散斑图案图像序列。
在该方法的又一方面,基于深度学习的分类器软件确定和/或输出样本中的运动物体的计数。在另一方面,基于深度学习的分类器软件确定和/或输出样本中运动物体的浓度。
在该方法的另一方面,基于深度学习的分类器软件输出样本的阳性或阴性分类。这可以与获取样本中运动物体的计数和/或浓度分开,或者除此以外。例如,可以使用基于深度学习的分类器软件对样本中运动物体的数量进行计数,然后将其用于计算样本中的运动物体的浓度(给定已知体积的样本),然后基于运动物体的计数或浓度,将特定样本分类为目标运动物体的阳性(+)或阴性(-)。例如,阈值截止值可以用于在阳性样本或阴性样本之间划界。
在该方法的另一方面,样本包括生物样本。在另一方面,样本包括环境样本。在另一方面,运动物体包括寄生虫。
本发明的另一实施例涉及一种检测样本中的运动物体的方法。该方法包括使用可移动的扫描头(包含一个或多个相干光源和相应的与一个或多个相干光源相关联的图像传感器)获得样本的多个随时间变化的全息散斑图案图像序列。使用配置为接收由图像传感器获得的随时间变化的全息散斑图案图像序列的计算设备,来处理多个随时间变化的全息散斑图案图像序列。计算设备包括被配置为生成一个或多个样本保持物内的运动物体的三维(3D)对比图的计算运动分析软件,以及用于识别三维(3D)对比图中的运动物体的基于深度学习的分类器软件。
在另一方面,该方法进一步包括计算设备,其使用计算运动分析软件生成一个或多个样本保持物内的运动物体的三维(3D)对比度图。然后,计算设备使用基于深度学习的分类器软件在三维(3D)对比图中识别运动物体。
在另一方面,该方法还包括确定和/或输出运动物体的计数的计算设备。在另一方面,该方法包括确定和/或输出样本中的运动物体的浓度的计算设备。
在成像平台的一个示例中,要被筛选的流体样本被相干光源(例如激光二极管)照射,并且互补金属氧化物半导体(CMOS)图像传感器被放置在样本下方以记录样本的随时间变化的全息散斑图案(例如“移动”)。可以使用移动到包含要分析的样本的三维体积的不同区域的扫描头,来获得随时间变化的全息散斑图案。扫描头可以包括多个光源和图像传感器,它们可以并行地对多个样本成像(或者将单个样本划分为多个测试体积)。当然,在其他实施例中,可以仅使用单个光源和图像传感器。
然后,通过基于全息的习惯编写的计算运动分析(CMA)算法对由图像传感器获得的图像序列进行分析,以生成特定于样本体积中寄生虫的运动的三维(3D)对比度图。最后,基于深度学习的分类器用于使用重建的3D运动图自动检测和计数寄生虫(或其他运动物种)的信号图案(请参见图3A至图3M)。
构造并配置根据本发明的示例性成像平台,以增加通量并减少用于快速筛选大体积流体(约3.2mL以上)的检测限制(LoD)。在此示例中,成像平台包括安装在平移台上的三个相同的无透镜散斑成像模块,以并行筛选三个单独的样本管。每个成像模块都被平移到包含液体样本的毛细管的不同部分,其中,CMOS图像传感器在移动到下一部分之前捕获高帧率视频序列。使用这种方法,可以使用示例性成像平台在约20分钟内制备,筛选和分析约3.2mL以上的流体样本。与标准台式光学显微镜相比,这种成像平台设计使筛选的样本量增加了几个数量级(这对于检测低浓度的寄生虫非常重要)。另外,成像平台可以显著更紧凑和轻便(例如,重约1.69kg以下)。此外,由于在轴向方向上通过计算机筛选了相对较大的样本量,因此成像设备的光机械设计不需要高精度,这也使该平台具有很高的成本效益,其中,即使在极少量的制造条件下,其零件的总成本也可能在1850美元左右或更低。
使用锥虫测试了示例性成像平台,以测试移动平台,并证明了其检测加标全血和CSF样本中寄生虫的能力,这对HAT的诊断和阶段确定以及急性恰加斯病的诊断非常重要。使用布氏锥虫(锥虫的非人类感染亚种)作为布氏冈比亚锥虫、布氏罗得西亚锥虫和克氏锥虫的模型寄生虫,在一系列浓度下进行了加标实验。通过基于深度学习的分类,显示使用该成像平台可以可靠地检测出每毫升全血中低至10个寄生虫和每毫升CSF中3个寄生虫。此外,证实了该平台成功地通过成像阴道锥虫(阴道锥虫)检测体液中的其他运动性寄生虫,这是导致滴虫病的原生动物寄生虫,滴虫病是最常见的非病毒性传播疾病(STD),影响美国370万人和全世界2.75亿人。因此,无标签、基于运动性寄生虫检测平台可以提供一种经济高效的便携式方法,用于在资源有限的环境中快速、灵敏地筛选锥虫和其他运动性寄生虫,或者作为研究3D运动生物体的高通量分析研究工具。虽然本文描述的示例性成像平台用于检测寄生虫,但是应该理解,该平台可以用于检测不是寄生虫的其他运动物种。例如,这包括精子和能运动的其他多细胞或单细胞物种。
附图说明
参照附图进一步详细描述实施例的前述和其他方面,其中,相似的附图标记指代相似的元件,并且对于相似的元件的描述将在所有相关的情况下适用于所有描述的实施例。具有相同附图标记和不同字母的附图标记(例如,104a,104b,104c)指代相同的元件,并且在具体实施方式中不带字母的数字的使用指代每个相同的元件。
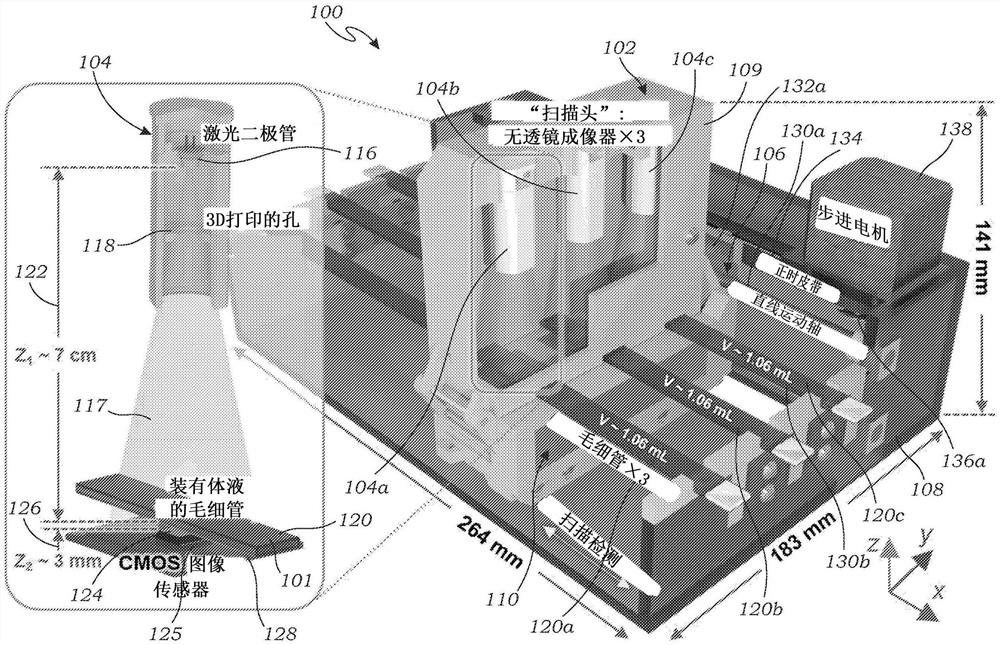
图1A是根据本发明的一个实施例的用于检测样本中的运动物体的成像平台的示意图。该设备基于无透镜全息图的时间分辨散斑成像。尺寸仅出于说明目的,并且可以在图1A中明确说明的范围之外变化。所示的设备是高通量的体液筛查设备,可在约20分钟内筛查并分析约3.2mL的流体样本。
图1B是根据图1A的示意图制造的成像平台的示例性实施例的照片。图1B的成像平台由计算设备(例如,膝上型计算机)(也用于处理所获取的数据)控制。
图1C是用于图1A和图1B的成像平台的印刷电路板的电子示意图,其示出了所选择的电子部件以及与计算设备(例如,膝上型计算机)的接口。
图2是根据本发明的一个实施例的用于使用图1A的成像平台测试全血和脑脊髓液(CSF)的样本制备和成像过程的图示。
图3A至图3M示出了根据本发明的一个实施例的,具有OFN的CMA算法,与基于深度学习的识别相结合,用于敏感和无标记检测溶血中的锥虫。这些步骤以列出的顺序(步骤a至k)执行,并带有可选的步骤(1)和(m)。
图4A至图4E是示出根据本发明的一个实施例的在约14.7mm
图5A至图5D是示出对于示例性成像平台(被构建和测试用于检测裂解的全血和人工CSF样本中的锥虫)的LoD的定量的曲线图。图5A是用于在裂解的全血中检测锥虫的校准曲线(对数标度)。虚线表示期望值(y=x)。测量值由显示数据点的点表示。误差线显示3个独立测量的标准偏差,由显示数据点的点表示。图5B是图5A的放大图,示出了低浓度测量值(线性标度),包括阴性对照(无锥虫)。在三个阴性对照样本中未发现假阳性。类似于图5A和图5B,图5C和图5D是用于人工CSF中锥虫检测的校准曲线。图5D中的虚线对应于阴性对照结果的平均值+3×SD。
图6A和图6B是示出使用示例性成像平台的用WBC加标的人工CSF内的锥虫体的成像结果的图像。图6A是图像序列中的原始全息图之一。图6B是通过具有OFN的CMA算法处理的图像的示例。图6B示出了五个信号点。
图7A和图7B是示出使用示例性成像平台在磷酸盐缓冲盐水(PBS)中的阴道锥虫(阴道锥虫)的成像结果的图像。图7A是图像序列中的原始全息图之一。图7B是由CMA算法处理的图像的示例。由于滴虫具有很强的光学相位,因此此处不应用OFN。图7B示出了三个信号点。
图8A和图8B是示出使用示例性成像平台在培养基内的阴道锥虫的成像结果的图像。图8A是图像序列中的原始全息图之一。图8B是在没有OFN的情况下由CMA算法处理的图像的示例。图8B示出了三个信号点。
图9A至图9D是示出了用于差分分析的减法帧间隔δ
图10A至图10C示出了在由图像传感器加热之后,由于对流导致的玻璃管内部速度场的模拟。图10A是示出在将1mm高的玻璃管加热7秒之后的速度大小分布的示图(侧视图)。显示了玻璃管的中间横截面。图10B是示出玻璃管内的最大流体速度大小随加热时间变化的曲线图。不同的曲线对应于玻璃管的不同内部高度。图10C是示出在加热7秒之后作为通道高度的函数的最大流体速度大小的曲线图。
图11A至图11F是示出了OFN如何抑制由于在溶血中表现出的强散射颗粒而引起的潜在的“假阳性”图像。TP表示对应于锥虫的“真阳性”散斑;FP表示“假阳性”。如图11D所示,在施加OFN之后,图11C中阴性对照样本的假阳性被抑制,而真阳性信号被保留(图11A和图11B中的“TP”)。在阳性样本中,由于气泡(图11A左下角的“FP”)而产生了强烈的假阳性,其全息图和向后传播的振幅图像分别显示在图11E和图11F中。如图11B中所示,通过OFN有效地消除了强假阳性。
图12A至图12D是示出了在人工CSF中证明的OFN如何抑制由于强散射粒子而引起的潜在“假阳性”的图像。TP表示对应于锥虫的“真阳性”散斑;FP表示“假阳性”。如图12D所示,在施加OFN之后,如图12C所示的阴性对照样本中明显的由于加标的WBC引起的假阳性被抑制,而真阳性被保留在图12A和图12B所示的阳性样本中。
图13是示出自动检测锥虫产生的信号的卷积神经网络(CNN)的结构的图形。在图13的图形中,C是通道数;K是卷积滤波器的大小;S是步长;P是丢弃(dropout)的概率。
图14是将各种现有检测方法与当前公开的方法进行比较的表。
图15是与图1A至图1C的成像平台一起使用的示例性神经网络的示意图。
具体实施方式
本发明涉及成像平台,用于无标记检测样本中的运动物体200(参见图2)。图1A至图1C示出了根据本发明的一个实施例的用于执行样本101的无透镜全息时间分辨散斑成像的成像平台100。成像平台100由五个主要模块组成:(1)具有一个或多个无透镜全息散斑成像器104的扫描头102(图1A和图1B所示并在本文中描述的成像平台100的图示实施例具有三个成像器104a、104b、104c),(2)平移台106,(3)固定成像平台100组件的主壳体108,(4)被配置为控制和自动化成像平台100各种功能的电子电路110,(5)具有控制程序114(提供图形用户界面(GUI)115)的计算设备112。GUI115被配置为使用户能够启动除各种其他功能之外的当前样本筛选,例如自定义图像采集参数、执行衍射图的实时取景、拍摄快照、查询结果、样本跟踪、生成报告和输出以及停止采集。
扫描头102包括容纳在扫描头壳体109内的一个或多个无透镜成像器104a、104b、104c(例如,由3D打印的塑料、模制的塑料、成形的金属等打印)。每个无透镜成像器104a、104b、104c包括照明源116。照明源116可以是具有约1mW的输出功率的激光二极管,诸如650nm的激光二极管(产品号AML-N056-650001-01,阿里玛激光公司(Arima LasersCorp.),中国台湾桃园),或其他合适的照明设备。例如,除了激光二极管以外的照明源116包括发光二极管(LED)、另一激光源等。
来自照明源116的发射光117穿过可选的孔118。孔118可以是3D打印的孔或其他适当构造的孔(例如,模制的、机加工的等)。孔118的作用是限制所发射的光的发射角度并避免光泄漏到相邻的成像器104中。孔118是可选的并且在所有实施例中可能不存在。孔118用于防止光泄漏到附近的图像传感器124。在光泄漏不是问题的实施例中(例如,在无透镜成像器104的间隔或配置不遭受光泄漏的情况下),可以省略孔。
样本101被装载到基本上光学透明的流体保持器120a、120b、120c(也称为“样本支持物”)中。术语“基本上光学透明”是指该元件足够透明以通过具有足以识别样本101中的运动物体200的质量的元件来获得样本101的图像168。在一个实施例中,每个流体保持器120a、120b、120c是玻璃毛细管。毛细管的横截面轮廓可以是矩形,或其他合适的横截面轮廓,例如圆形、椭圆形等。流体保持器120填充有样本101(例如,要被筛选的体液),并且被定位在照明源116下方的z
成像器104a、104b、104c中的每一个具有位于与相应照明源116相对应的流体保持器120的相对侧上的图像传感器124,使得它可以根据扫描头102的位置,在样本101的一部分中,通过样本101成像从照明源116发射的光117的衍射或散斑图案。例如,在所示的实施例中,图像传感器124位于流体保持器120下方,而照明源116位于流体保持器120上方。图像传感器124可以是任何合适的图像传感器,例如具有1.67μm像素尺寸和6.4mm×4.6mm(29.4mm
因为每个图像传感器124具有产生热量的一个或多个电路板125,所以散热器128可选地插入电路板125之间并布置在扫描头102的侧面上以散发热量并防止图像传感器124发生故障和/或损坏。散热器128可以是定制的铝散热器,或其他合适的散热器,包括其他材料和构造。
在本文描述的示例中使用的实施例使用具有三个相同的无透镜成像器104a、104b、104c(对三个不同的毛细管120a、120b、120c进行成像)的扫描头102。这些管120a、120b、120c可以装载来自不同患者或同一患者的样本。应当理解,也可以使用更多(或更少)的无透镜成像器104。
平移台106被配置为移动扫描头102,以便使成像器104相对于流体保持器120移动,使得成像器104可以获取包含在各个流体保持器120中的样本101的不同区域的图像168。在所示的实施例中,平移台106沿着流体保持器120的长度在直线方向上移动扫描头102,并因此被称为线性平移台106。在所示的实施例中,线性平移台106包括两个线性运动轴130a、130b,其被安装成平行于流体保持器120的纵向轴线对齐。运动轴130a、130b可以是中国深圳的马克布洛克有限公司的产品85421号,或其他合适的运动轴。线性平移台还具有两个线性运动滑块132,它们与运动轴130a、130b耦接并可相对运动轴130a、130b可控制地移动。线性运动滑块132可以是中国深圳的马克布洛克(Makeblock)有限公司的产品86050号。线性平移台106还包括可操作地耦接到两个正时皮带轮(timing pulley)136a、136b(例如,产品615418号,ServoCity,Winfield,KS,或其他合适的正时皮带)的正时皮带134(例如,产品B375-210XL号,ServoCity,Winfield,KS,或其他合适的正时皮带)和可操作地连接到正时皮带134的步进电机138(例如,产品324号,阿达夫工业有限公司(AdafruitIndustries LLC.),纽约州(New York City),纽约市(NY),或其他合适的电动机)。
使用螺钉或其他合适的紧固件,将扫描头102安装到运动滑块132上。具有安装的运动滑块132的扫描头102沿着固定的线性运动轴130a、130b运动。步进电机138提供动力以驱动所连接的正时皮带134和正时皮带轮136,以沿着线性运动轴130a、130b来回移动扫描头102。虽然本文中利用和公开的特定线性平移台106可以与成像平台100一起使用,但是应当理解,可以使用被配置为相对于流体保持器120沿线性方向移动扫描头102的其他平移机构和设备。这些可以包括被机械地耦接或链接到扫描头102以施加线性运动的基于电动机或基于伺服的设备。同样地,平移台106可以根据要扫描的样本量在不同的方向上平移。例如,可以在正交(或其他方向)上扫描三维体积以覆盖样本体积。因此,可以结合平移台106使用各种不同的平移运动。
计算设备112被配置为控制成像平台100的操作。在所示的实施例中,计算设备112是膝上型计算机,但是计算设备112可以包括其他基于计算机的设备(例如,个人计算机或者在某些情况下是平板计算机或其他便携式计算设备)。计算设备112可以包括一个或多个微处理器111、存储设备160、图形处理单元(GPU)161和显示器163。
参照图1C的示意图,电子电路110包括被配置为使成像平台100自动化的印刷电路板(PCB)142。PCB 142包括经由USB 2.0接口(或其他合适的接口)可操作地连接至计算设备112的微控制器144(例如,TeensyLC,PJRC)。微控制器144还包括照明驱动器电路146(例如,激光二极管驱动器电路或其他合适的驱动器电路)和步进电机驱动器电路148。照明驱动器电路146可以由恒流电路构建。例如,在激光二极管驱动器电路的情况下,照明驱动器电路146可以由产品编号LM317DCYR,德州仪器(Texas Instruments)构建。步进电机驱动器电路148可以是产品编号TB6612,Adafruit,或其他合适的步进电机驱动器电路。
在所示的实施例中,照明源116(例如,激光二极管)和步进电机138使用12V电源适配器150供电。由金属氧化物半导体场效应晶体管(MOSFET)构成的各种数字开关156a、156b、156c由微控制器144的数字输出控制,以在未使用时切断激光二极管116和图像传感器124的供电。具体地,为了控制对图像传感器124的供电,包括切断对图像传感器124的供电,切断图像传感器124的USB 3.0电缆的电源线,并将基于MOSFET的数字开关156a插入电源线中。
计算设备112包含用于控制从成像平台100获得的数据并与该数据交互的控制程序114。例如,在本文公开的特定实施例中,控制程序114是用C-Sharp编程语言(C#)编写的基于
因此,控制程序114控制成像平台100以获得随时间变化的全息散斑图案图像序列。在将样本101装载到成像平台100上的流体保持器120a、120b、120c中之后,并且使样本101沉降预定的等待时间(例如,等待时间为3-4分钟,例如,裂解全血的等待时间为4分钟,人工CSF的等待时间为3分钟,有关详细信息,请参见图2),用户按下GUI 115上的“记录”按钮即可开始采集。控制程序114被配置为对成像平台100进行编程以在预定数量的离散位置处扫描流体保持器120a、120b、120c,以使样本101在流体保持器120a、120b、120c内的不同区域进行成像。例如,在示出的实施例中,成像平台100可以被编程为在36个离散位置(在空间上相邻的位置之间的距离为约4.7mm)扫描流体保持器120a、120b、120c。这导致每个无透镜散斑成像器104的总筛查体积为36(离散扫描位置)×29.4mm
图像传感器124的温度在通电时升高,导致温度梯度引起的液体样本101的对流流动。在图10A至图10C中示出了示例性成像平台100的温度梯度引起的对流的示例。为了减轻这些问题,可以采取两种措施。首先,代替单向扫描36个位置,成像平台100可以被配置为以往返方式扫描。例如,假设这36个位置由位置#1,#2,……,#36表示,这些位置在空间上是有序的。代替以#1,#2,……,#36的顺序进行扫描,控制程序114对成像平台100进行编程以按9个位置的较大步长进行扫描,并且只要扫描头102不能以此步长向前移动(因为9个位置的步长移过端点位置#1或#36),扫描头102就会移动到最小位置号的未扫描位置。换句话说,在该示例中,成像平台100首先扫描位置#1,#10,#19和#28。然后,将扫描头102移回到位置#2,之后是#11,#20和#29,依此类推。该扫描图案在很大程度上防止了在毛细管120的给定部分处的热量积聚,该热量在扫描头102回到其附近之前具有足够的时间冷却。作为第二措施,可以在扫描位置之间添加预定的“停机时间”(例如,六(6)秒“停机时间”或5-10秒的“停机时间”)以允许图像传感器124冷却。在给定位置完成的采集之后,通过添加到USB 3.0电缆中的基于MOSFET的数字开关156a切断图像传感器124的电源。在预定的等待时间(例如,六秒)之后,步进电机138将扫描头102移动到下一个位置,在该位置上,图像传感器124的电力被恢复以捕获下一组图像168。
所获取的图像168的序列(例如,影片或剪辑)被保存到存储设备160(例如,硬盘驱动器)以进行处理。捕获未压缩的8位图像168的所有三个图像传感器124生成的总数据速率为约421MB/s,其略微超过诸如硬盘驱动器(例如,固态硬盘驱动器(SSD))的典型存储设备160(见图1C)的平均写入速度。因此,在随机存取存储器158(RAM)中创建用于每个图像传感器124的队列以临时缓冲输入的图像数据,并且创建另一个线程以将图像数据不断地从缓冲器移入存储设备160(例如,SSD)。然而,由于在上述位置之间的停机期间,所有剩余的图像数据可以被完全保存到存储设备160(例如,SSD),因此由于受限的写入速度,每次测试总图像获取时间不会增加。作为更节省时间的替代,所获取的图像168可以被临时存储在RAM中,同时它们被不断地移动到GPU以用于与每个图像序列对应的批处理。以这种方式,可以与图像获取同时执行图像处理,从而减少了每次测试的总时间。
利用CMA算法162(例如,编程为CMA软件162)从噪声全息图和散斑干涉图中的粒子运动生成3D对比数据,并且还应用基于深度学习的分类来识别与受关注寄生虫相对应的信号。作为示例,图3A至图3M描绘了用于从裂解的全血中检测锥虫的示例性过程(即,CMA算法和基于深度学习的分类方法),而在其他应用设置(例如,CSF中的锥虫检测)中,可以对过程进行细微更改,如下所述。CMA算法162被配置为将由每个图像传感器124在每个扫描位置处获取的原始全息衍射图案作为输入。CMA软件162可用于计数样本101中的运动物种的数量,然后可用于计算样本101的物种的浓度(给定已知体积的样本)。CMA软件162还可基于运动物种的计数或浓度将特定样本分类为阳性(+)或阴性(-)。例如,阈值截止值可以用于在阳性样本或阴性样本之间划界。可以在GUI115上将分析结果呈现给用户。另外,可以使用GUI115观看运动物体200的运动的电影。如本文所述,尽管成像平台100特别适合于检测寄生虫,但是它还可以用于其他运动物种(例如,精子或其他生物运动物种)。在其他实施例中,样本101可以包括生物样本,但是也可以包括环境样本。
为了维持对于寄生虫检测技术必不可少的高帧频(约26.6fps),将每个图像传感器124的全视场(FOV)分为两半,每半为约14.7mm
为了解决这一挑战,可以利用由于运动的锥虫在血液中的快速运动而导致的检测到的散斑图案的时空变化。开发了利用此优势的CMA算法162(或CMA软件162),该算法涉及全息反向传播、差分成像(对于锥虫运动具有最佳调整的帧间隔)和时间平均,在样本体积内的每个水平横截面上进行。在每个差分成像步骤中都引入了目标函数归一化(OFN),以抑制由于样本中不需要的、强烈散射的物体而引起的潜在假阳性。然后,对该算法进行图像后处理和基于深度学习的分类,以识别由锥虫引起的信号(有关详细信息,请参见下面的说明)。图4D至图4E例示了该计算过程的结果,其中,经处理的图像168中的“热点”对应于运动性锥虫。为了更好地说明这一点,基于图4E中三个热点的计算出的3D位置(由白色箭头指示),创建了反向传播衍射图样的振幅和相位通道的对焦电影。尽管被样本中其他非运动物体(例如细胞屑)产生的干扰图样部分掩盖了,但在该视频中可以看到这些锥虫的快速运动。
类似地,在图6A和图6B中示出了在WBC加标的人工CSF样本中对锥虫成像的结果。因为CSF主要是透明的介质,所以与活动的锥虫信号水平(即图6B中的热点)相比,由介质中的准静态散射体引起的背景噪声水平要低得多。数字聚焦的振幅和相位电影也显示了这些活动锥虫的低噪声重建。
如下面的表1中所详述,用于成像和检测这些锥虫的总图像处理时间的>80%花费在CMA算法162上,对于每个记录的图像序列,该算法涉及约6百万像素图像168的数千个快速傅立叶变换(有关详细信息,请参见下面的“方法”部分)。因此,基于图形处理单元(GPU)164的并行计算,有助于CMA算法162的加速。对于血液和CSF样本,使用单个GPU 164,一个实验的整个图像处理任务(三个并行图像传感器124总共有216个图像序列)分别需要约26分钟和约21分钟。当使用两个GPU 164时,由于给每个GPU 164一个单独的图像序列以在给定时间进行处理,因此GPU 164之间的干扰最小,并且可以实现最大的并行度。因此,当使用两个GPU 164时,观察到约2倍的加速,导致血液和CSF实验的总图像处理时间分别为约13分钟和约11分钟。结合所有其他样本制备步骤,血液和CSF样本的每次测试总检测时间分别为约20分钟和约17分钟(详细信息请参见图2)。
表1
通过执行系列稀释实验,确定示例性成像平台100的LoD,以检测裂解的全血中的锥虫,结果如图5A和图5B所示。在这些实验中,将锥虫感染的小鼠血液感染到未感染的血液中,以产生一系列寄生虫浓度,包括0mL
对于布鲁氏菌,阶段确定对于确定最合适的治疗方案至关重要。目前,这是通过腰椎穿刺收集CSF并在显微镜下检查CSF来完成的。CSF中≤5μL
尽管选择了寄生虫布鲁氏菌来验证成像平台100的基于运动的检测方法,但是应当理解,该方法广泛地适用于多种运动微生物的检测。作为对示例性成像平台100在完全不同的运动性寄生虫上的性能的初步测试,选择了阴道锥虫。阴道锥虫是引起毛滴虫病的原生动物寄生虫,毛滴虫病是美国和世界范围内最常见的非病毒性STD。阴道锥虫感染男女的泌尿生殖道。尽管通常无症状,但是阴道锥虫感染与其他健康状况(包括人类免疫缺陷病毒(HIV)感染,早产,盆腔炎和前列腺癌)相关的风险增加有关。对于滴虫的诊断,细胞培养后再进行显微镜检查仍然是最好,最可靠的方法,因为它具有很高的灵敏度,并且可以从每毫升含有最少三个寄生虫的接种物中检测出阴道锥虫。然而,它受到高成本、不便、检查时间长以及对样本污染的敏感性的限制。最常见的诊断方法是湿式显微镜,灵敏度低(51%-65%)。因此,高度灵敏的无透镜时间分辨全息散斑成像方法可能会带来很多好处。
仅对CMA算法162进行了微小的调整(参见以下讨论),就证明了示例性成像平台100可以检测磷酸盐缓冲盐水(PBS)和培养基中的阴道锥虫(见图7A和图7B,图8A和图8B)。基于这些实验,可以看出,与CSF中的锥虫相比,阴道锥虫产生明显更强的信号强度(见图6A和图6B),这与阴道锥虫的强烈运动和强光散射有关。这表明该平台可以潜在地用于实现类似的,甚至更好的阴道锥虫敏感性水平,例如,达到每毫升≤3个寄生虫。根据不同的临床需求,可能需要更多的测试来从不同的环境(例如培养基和尿液)建立阴道锥虫的LoD,例如从稀释的阴道分泌物或直接从尿液中检测阴道锥虫。
基于无透镜时间分辨全息散斑成像,已经提出了用于基于运动的寄生虫检测的新成像平台100和方法。新的成像平台100已被证明对裂解血液和CSF中锥虫的快速检测有效,实现其LoD优于当前的寄生虫学方法(请参见图5A至图5D和图14)。这种自动化技术具有提高寄生虫筛选效率的潜力,同时减少了对基于PCR或显微检测方法必不可少的高度专业化且昂贵的设备和专业知识的需求。在示例中使用的示例性成像平台100的所有部分的总成本(不包括笔记本电脑112)不到$1850;且在大批量生产时,可以很容易地将成本降低到$500-1000。包括所有样本制备步骤在内的总分析时间仅为约20分钟,与大多数现有方法相当或更快(请参见图14)。这种基于运动的方法无需特殊的检测试剂、冷藏、离心或纯化,即可实现高灵敏度,使它对于分析不同类型的样本(例如血液,CSF)更具通用性,并且不易受到世界不同地区的寄生虫亚种或分离株之间差异的影响。因此,所提供的原型可以很容易地适应任何有电或电池供电的既定或移动诊所,代表了一种进步,可以作为对现有诊断方法的有用补充。
当CSF中的寄生虫病处于传统方法的LoD内,并且当CSF中的WBC仍然匮乏时,这种诊断方法也可能有益于改善血液HAT或恰加斯病感染的诊断,或有助于更早识别II期HAT病例。成像平台100对于疾病治疗之后的随访也可能是有用的,以便对患者进行筛查以进行更早和更敏感的复发检测。这些进步可能会改善患者的治疗效果并提高疾病的治愈率。除了HAT之外,动物锥虫病还严重限制了经济发展。因此,将基于运动的检测方法应用于筛查受感染的牲畜和开发病媒控制方案,可能有助于使流行地区摆脱贫困。在恰加斯病的情况下,该技术可适用于筛查献血者或血液制品以及甘蔗汁和阿萨伊汁制品,以帮助减少各种传播途径。鉴于有大量人口处于危险之中,以简单、自动化的方式快速分析样本的各种类型的样本/液体的能力,对于制定可行的策略来在疾病发病率因根除工作而下降的地区筛选样本将特别重要。
成像平台100和无标记检测方法利用寄生虫的运动图案来最大化检测信噪比(SNR)。锥虫以其不断的运动而被了解,而运动对于它们的存活以及在宿主中的毒力至关重要。锥虫的游泳行为非常复杂。由于鞭毛侧向附着在细胞体上,寄生虫易位伴随细胞体旋转,从而导致“开瓶器(corkscrew)”游动。此外,除细胞易位外,鞭毛还产生快速的三维跳动模式。布氏锥虫的平均跳动频率在向前移动的细胞中估计为18.3±2.5Hz,在向后移动的细胞中为13.1±0.8Hz,而向前移动的细胞的旋转频率为2.8±0.4Hz。根据奈奎斯特采样率,与平均跳动频率(向前移动)匹配的帧速率等于36.6fps。换句话说,至少36.6fps的帧速率能够记录与每个鞭毛拍打(stroke)相对应的散斑变化;甚至更高的帧速率也可以以更精细的时间分辨率记录散斑变化,这对应于鞭毛拍打期间的不同时间点。假设使用最佳减法时间间隔(Δt)和时间窗(T)(参见下面的讨论,图9A和图9B),较高的帧速率导致由运动寄生虫以及更多帧引起的更丰富的时间分辨散斑变化信息,可以用于平均,从而可以整体提高SNR。但是,由于目标是基于运动而不是跳动图案的高保真度记录来产生对比度,因此低于36.6fps的帧速率也可以用于检测目的。考虑到扫描时间和所获取的数据量,约26.6fps的帧速率可以成功地用于成像平台100。可以使用更快的图像传感器100和数据接口来实现更高的帧速率,来提高成像平台100的性能,从而在不增加数据采集时间的情况下提高SNR。
布鲁氏杆菌被广泛用作锥虫研究的模型微生物,因为它对人类无致病性,因此可以安全地进行实验。可以预期,本文公开的成像平台100和方法将容易地适用于布氏冈比亚锥虫、布氏罗得西亚锥虫和克氏锥虫,因为它们的运动基本相似。出于安全考虑,在整个测试过程中都使用了小鼠血液和人工CSF溶液,但裂解缓冲液也适用于人类血液。可能需要对来自地方病地区的患者样本进行进行进一步研究,以建立本技术用于诊断各种锥虫病的敏感性和特异性。
许多运动生物体可引起人类感染。成像平台100和公开的方法还可被配置为自动区分不同的寄生虫。例如,为每个检测到的信号生成的幅度和相位电影(请参见图3M)可以使训练过的临床医生根据形态、尺寸和运动模式来区分不同的运动寄生虫,这类似于在明场和相衬显微镜下观察每个活的寄生虫。这些可以可选地在GUI 115上呈现给用户。该区域特定病原体的流行也可以在这方面有所帮助。此外,基于卷积神经网络(CNN)或递归神经网络(RNN)的经过训练的视频分类器,可以利用足够的训练数据来区分和自动识别各种寄生虫。在图15中示出了用于使用成像平台100确定运动寄生虫的特征的示例性神经网络166的示意图。受过训练的神经网络166分析图像168的序列,并确定样本101中运动寄生虫的特征,例如,检测到的寄生虫的类型、流体保持器120中的样本101的3D体积中的寄生虫的3D位置、以及寄生虫物体的计数。
在示例中,使用锥虫来证明无透镜时间分辨全息散斑成像用在检测寄生虫感染中的可行性。尽管该方法利用了锥虫的活动性,但该平台广泛适用于其他运动寄生虫,包括其他真核生物寄生虫,例如阴道锥虫(请参阅图7A、图7B、图8A、图8B)以及此处未测试的其他流体样本。原则上,该平台也可用于血样中Loa loa(L.loa)微丝蚴的检测,与我们在此研究的寄生虫相比,其明显更大(长度约0.2-0.3毫米)。对于这样的大型运动寄生虫,作为一种替代方法,D’安布罗西奥(D’Ambrosio)等人使用了一种基于手机的检测方法,利用了在成像室中与L.loa微丝蚴碰撞引起的RBC移位(参见,D’Ambrosio,M.V.等人,Point-of-carequantification of blood-borne filarial parasites with a mobile phonemicroscope.Sci.Transl.Med.7,286re4-286re4(2015))。这种设计非常紧凑且具有成本效益,但是与筛查并自动处理约0.8mL全血或约3.2mL CSF的方法相比,它的检测体积小得多(约0.01mL),与L.loa相比,将其用于检测寄生虫原生动物(如锥虫)具有很大的挑战,锥虫的尺寸和质量均比其小一个数量级,寄生性较低,并且光散射弱得多。
运动细菌还引起许多人类疾病。尽管细菌通常比锥虫小得多,但基于运动的检测与光学放大相结合的概念也可用于细菌病原体的无标记检测。基于运动的检测可能会用于筛查其他体液,例如尿液或稀释的粘膜分泌物和粪便样本。因此,本文公开的成像平台100和方法具有相当大的潜力影响各种全球健康挑战。最后,将运动用作生物标志物和内源性对比剂可以为临床诊断带来新的可能性。作为对光散射和光致密性介质具有鲁棒性的无标记3D成像方式,它还可用于以高通量方式研究各种流体环境中的运动微生物。
裂解缓冲液制备:使用磁力搅拌器在磁力混合器上,将44mM氯化钠(产品编号为71379,Sigma Aldrich)、57mM磷酸二钠(产品编号为30412,Sigma Aldrich)、3mM磷酸一钾(产品编号60220,Sigma Aldrich)、55mM葡萄糖(产品编号G8270,Sigma Aldrich)和0.24%(w/v)十二烷基硫酸钠(产品编号L4390,Sigma Aldrich)在试剂级水(产品编号23-249-581,Fisher Scientific)中混合2小时。然后使用一次性过滤单元(产品编号09-740-65B,Fisher Scientific)过滤溶液以进行灭菌,并在室温下保存。该缓冲溶液可裂解全血的所有成分,包括RBC和WBC,但不会溶解锥虫。
人工CSF制备:根据先前的方法,将1.25M氯化钠、260mM碳酸氢钠(产品编号SX0320-1,EMD Millipore)、12.5mM磷酸氢二钠(产品编号S6566,Sigma Aldrich)和25mM氯化钾(产品编号P5405,Sigma Aldrich)充分混合,并加入10mM氯化镁(产品编号208337,Sigma Aldrich)制成10X人工CSF。然后使用一次性过滤单元将溶液过滤以进行灭菌。用试剂级水将10X储备溶液稀释十倍,制成1X人工CSF。
培养锥虫:如在Oberholzer,M.,Lopez,M.A.,Ralston,K.S.&Hill,K.L.“Approaches for Functional Analysis of Flagellar Proteins in AfricanTrypanosomes”,Methods in Cell Biology 93,21-57(Elsevier,2009)所述,在含有10%热灭活胎牛血清(产品编号10438026,Gibco)的HMI-9培养基中,在5%CO
收集锥虫感染的小鼠血液:所有涉及小鼠的实验均按照UCLA机构动物护理和使用委员会(IACUC)的指南和规定、关于人文关怀和动物使用的NIH公共卫生服务政策、USDA动物福利法规、以及根据IACUC批准的协议ARC#2001-065的AAALAC国际认证标准进行。如在Kisalu,N.K.,Langousis,G.,Bentolila,L.A.,Ralston,K.S.&Hill,K.L.的“Mouseinfection and pathogenesis by Trypanosoma brucei motility mutants”(由布鲁氏锥虫运动突变体引起的小鼠感染和发病机理),Cell.Microbiol.16,912-924(2014)中所描述进行小鼠感染,其中进行以下修改:给雌性BALB/cJ小鼠(产品编号000651,JacksonLaboratory(杰克逊实验室),年龄11-24周)腹膜内注射0.1-0.2mL冰冷的磷酸盐缓冲盐水和1%葡萄糖(PBS-G)中的5×10
从人血中分离WBC:Ficoll-Paque PREMIUM(产品编号45-001-751,FisherScientific)用于根据制造商的说明书使用密度梯度分离法从血液中体外分离单核细胞。在取消对患者的身份识别和相关信息后,从加州大学洛杉矶分校血液和血小板中心(UCLABlood and Platelet Center)获取了人类血液样本,并将其用于从血液中分离WBC。通过将混合物从移液管中抽入和抽出,将2mL乙二胺四乙酸(EDTA)处理的血液与2mL无菌PBS(产品编号10-010-049,Fisher Scientific)在5mL离心管(产品编号14-282-300,FisherScientific)中混合。将3mL Ficoll-Paque PREMIUM放入15mL锥形离心管(产品编号14-959-53A,Fisher Scientific)中,将稀释的血液样本小心地铺放在Ficoll-Paque PREMIUM上。使用带有旋转转子(Allegra X-22R,Beckman-Coulter)的离心机,将悬浮液在19℃下以400×g的速度离心40分钟。离心后,除去含有血浆和血小板的上层,并将单核细胞转移到无菌离心管中。为了洗涤细胞分离物,将其与6mL PBS混合并在19℃下以400×g离心达13分钟。重复洗涤步骤两次,并将沉淀物悬浮在1mL PBS中。通过在血细胞计数器中计数来确定WBC的浓度,并相应地稀释至PBS中的8×10
用于血液样本的校准曲线分析的方案:将新鲜收集的锥虫感染的小鼠血液在未感染的小鼠血液(Balb/C,雌性,合并的,肝素钠,Charles River Inc.)中稀释至大约10
用于CSF样本的校准曲线分析的方案:每次测量均新鲜采集培养的锥虫,以确保寄生虫的运动能力一致。锥虫生长至约1×10
用于成像的样本制备:使用血液和人工CSF样本进行实验。通过将毛细管(流体保持器120)的一端浸入凡士林果冻中以堵塞该端,来制备硼硅酸盐毛细管(内部尺寸:1毫米高×10毫米宽×约30厘米长;产品编号LRT-1-10-67,Friedrich&Dimmock,Inc.)。也可以使用塑料毛细管,例如由丙烯酸制成的那些,来代替玻璃。使用无尘纸(Kimwipe)(产品编号06-666,Fisher Scientific)去除多余的果冻,并用石蜡膜(产品编号13-374-12,FisherScientific)密封管端。对于每个管,准备4mL样本。对于血液样本,将3mL裂解缓冲液与1mL未感染或感染的全血在离心管中混合。对于CSF样本,将100μL WBC储备溶液放入锥虫感染的人工CSF中,使最终混合物中有2×10
培养阴道锥虫:在37℃下,在补充有10%马血清(Sigma)、10U/ml青霉素-10μg/ml链霉素(Invitrogen)、180μM硫酸亚铁铵和28μM磺基水杨酸的改良TYM培养基中
如图1A和图1B所示,成像平台100由五个主要模块组成:(1)具有三个无透镜全息散斑成像器104的扫描头102,(2)线性平移台106,(3)扫描头壳体109,(4)电子电路110和(5)具有控制程序114的计算设备112,下面将对示例中使用的示例性成像平台100进行详细说明。
(1)扫描头102:三个相同的无透镜成像器104彼此相邻地构建,由使用3D打印机(Objet 30Pro,Stratasys(斯特塔西))的包括3D打印的塑料的扫描头壳体109容纳。如图1A所示,每个无透镜成像器104使用650nm的激光二极管(产品编号:AML-N056-650001-01,Arima Lasers Corp.,中国台湾桃园)作为照明源116,其输出功率约为1mW。发射的光117穿过3D打印的孔118以限制其发射角并避免光泄漏到相邻的成像器104中。流体保持器120a、120b、120c各自包括填充有待筛选的样本101(体液)的玻璃毛细管,并且被放置在激光二极管下方约7cm(z
(2)线性平移台106:线性平移台106是由两个线性运动轴130a、l30b(产品编号85421,马克布洛克有限公司(Makeblock Co.,Ltd),中国深圳)、两个线性运动滑块132a、132b(产品编号为86050,马克布洛克有限公司(Makeblock Co.,Ltd),中国深圳)、正时皮带134(产品编号为B375-210XL,ServoCity,Winfield,KS),两个正时皮带轮136a、136b(产品编号为615418,ServoCity,Winfield,KS)和步进电机138(产品编号324,AdafruitIndustries LLC.,纽约州(NewYork City),纽约市(NY))构成。扫描头102利用螺钉安装在运动滑块132a、132b上。
(3)扫描头壳体109:扫描头102的壳体109由3D打印的塑料制成。成像平台的外壳(成像平台100的主壳体108)由激光切割的1/4英寸丙烯酸板制成。
(4)电子电路110:印刷电路板(PCB)142被定制地构建以使成像平台100自动化,并且包括经由USB 2.0连接到膝上型计算机112的微控制器144(Teensy LC,PJRC),激光二极管驱动器电路146由恒流电路(产品编号LM317DCYR,Texas Instruments)和步进电机驱动器电路148(产品编号TB6612,Adafruit)构成。激光二极管116和步进电机138使用12V电源适配器150供电。由金属氧化物半导体场效应晶体管(MOSFET)构建的各种数字开关156a、156b、156c由来自微控制器144的数字输出控制,以在未使用时切断激光二极管116和图像传感器124的电源。具体地,为了切断图像传感器124的电源,切断图像传感器的USB 3.0电缆的电源线,并且将基于MOSFET的数字开关插入电源线。
(5)控制程序114:除了各种其他功能(例如自定义图像采集参数、执行衍射图的实时取景、拍摄快照并停止采集)外,具有图形用户界面115的用C#编写的Windows应用程序还可使用户启动当前样本的筛选。
在将样本装载到成像平台100上并沉降了3-4分钟的等待时间(对于裂解的全血为4分钟,对于人工CSF为3分钟,详情参见图2)之后,用户按下GUI 115上的“记录”按钮开始采集。在筛选期间,该设备被编程为在36个离散位置(在空间上相邻的位置之间的距离为约4.7mm)扫描毛细管120a、120b、120c。这导致每个无透镜散斑成像器的总筛查体积为36(离散扫描位置)×29.4mm
图像传感器124的温度在通电时升高,导致温度梯度引起液体样本101的对流流动(见图10A至图10C)。为了减轻这些问题,使用了如本文所述的扫描位置步进方法和扫描位置之间的停机时间方法。如上所述,代替单向扫描36个位置,成像平台100以往返方式扫描。让这36个位置由位置#1,#2,……,#36表示,这些位置在空间上是有序的。代替以#1,#2,……,#36的顺序进行扫描,控制程序114对成像平台100进行编程以按9个位置的较大步长进行扫描,并且只要扫描头102不能以此步长向前移动,它就会返回到位置号最小的未扫描位置。即,成像平台100首先扫描位置#1,#10,#19和#28。然后,将扫描头102返回到位置#2,之后是#11,#20和#29,依此类推。该扫描图案在很大程度上防止了在毛细管120的给定部分处的热量积聚,该热量在扫描头102回到其附近之前具有足够的时间冷却。作为第二措施,可以在扫描位置之间添加6秒的“停机时间”以允许图像传感器124冷却。在给定位置完成采集之后,通过添加到USB 3.0电缆中的基于MOSFET的数字开关156a切断图像传感器124的电源。在6秒的等待时间之后,步进电机138将扫描头102移动到下一个位置,在该位置上,图像传感器124的电力被恢复以捕获下一组图像168。
在示例的测试期间,所获取的图像168被保存到SSD 160以进行处理。捕获未压缩的8位图像168的所有三个图像传感器124生成总数据速率为约421MB/s,略高于固态驱动器(SSD)的平均写入速度。因此,在膝上型计算机112的RAM 158中为每个图像传感器124创建队列以临时缓冲输入的图像数据,并且创建另一个线程以将图像数据不断地从缓冲器移入SSD。然而,由于在上述位置之间的停机期间,所有剩余的图像数据可以被完全保存到SSD,因此由于受限的写入速度,每次测试总图像获取时间不会增加。作为更节省时间的替代,所获取的图像168可以被临时存储在RAM 158中,同时它们被不断地移动到GPU 164以用于与每个图像序列对应的批处理。以这种方式,可以与图像获取同时执行图像处理,从而减少了每次测试的总时间(请参见上面的结果,图2和表1)。
CMA算法162用于从噪声全息图和散斑干扰图案中的粒子运动产生3D对比度,并且应用基于深度学习的分类来识别与受关注的寄生虫相对应的信号。作为示例,图3描绘了用于从裂解的全血中检测锥虫的程序,而在其他应用设置(例如,CSF中的锥虫检测)中,对程序进行了较小的更改,如下所述。CMA算法162将由每个图像传感器在每个扫描位置处获取的原始全息衍射图案作为输入。A
对于由每个图像传感器获取的每个8位原始图像(参见图3A),将其除以表示激光二极管照明源不均匀性的“背景”强度图案,该强度图案先前在阴性对照实验中根据高斯平滑和平均的原始图像168计算得出,并存储以供其他实验使用。此后,将全息图进一步归一化(除以其自身的平均值),得到照明校正后的全息图
在裂解的血液的情况下,由于大多数细胞屑趋于在4分钟的等待时间内完全沉降(请参见图2),因此应用“梯度的田村系数”(ToG)自动聚焦标准来自动确定流体样本底部的z距离(请参见图3C),用zb表示。然后,将数字z扫描的范围定义为[z
在诸如物体/粒子稀疏的CSF的透明介质的情况下,将自动聚焦到通道底部可能具有挑战性。因此,每个毛细管的z
待扫描的z距离表示为z
其中,S#表示基于角频谱的反向传播,HP表示高通滤波,并且i=1,...,N
接下来,应用具有OFN的时间平均差分分析(参见图3E),得出:
其中,δ
z堆栈C
F中的候选信号点的分割是通过2D中值滤波(3×3像素窗口,像素尺寸=1.67μm),阈值化(阈值=0.01用于检测裂解血液中的锥虫,而0.02用于检测CSF中的锥虫)之后进行膨胀(盘状结构元素,半径=2像素,像素尺寸=1.67μm)和搜索连接的像素区域来执行的。小于5个像素的连接区域将被丢弃。从F(不进行2D中值滤波)裁剪以这些连接区域的像素值加权质心为中心的64×64像素图像斑块,并将其用于基于深度学习的分类器进行下游识别。
建立并训练CNN(该CNN包含三个卷积块,然后是两个完全连接的层)以识别由活动锥虫产生的真实信号点。详细的网络结构如图13所示,分别进行了从裂解血液和CSF样本中锥虫检测的训练(有关详细信息,请参见下面的“用于识别锥虫的卷积神经网络(CNN)的构建和训练”)。
对每个捕获的图像序列和每个图像传感器124重复图像处理步骤(参见图3A至图3J)。将所有位置检出的锥虫总数量相加,然后除以总筛选体积(约3.18mL),以计算检出的寄生虫病。对于裂解血液,将其乘以因子4,即通过裂解引入的稀释因子,以计算原始全血样本中的寄生虫血症。
该技术还提供了使用以下步骤以3D定位运动微生物并生成它们的聚焦振幅和相位电影以进行近距离观察的能力。对于通过CNN分类器分类为阳性的每个信号点,使用相应的z堆栈D
使用获得的每种运动微生物的3D位置,通过将记录的原始图像序列A
这里,使用了笔记本电脑112,该笔记本电脑配备有Intel Core i7-6700K中央处理器(CPU)111@4.00GHz、64GB的RAM和两个用于图像处理的Nvidia GTX 1080GPU 164。表1总结了使用单个GPU 164或同时使用两个GPU 164进行图像处理工作流所需的时间。在此,假设在图像获取期间,由成像设备124捕获的图像168被临时存储在CPU RAM 158中,并且以与扫描位置相对应的批量被恒定地移动到GPU存储器,在该位置由GPU 164(或多个GPU)进行处理。这样,可以在图像获取期间同时执行图像处理,从而缩短了每次测试的时间要求。通过在启动计时器之前将现有数据从硬盘驱动器160预加载到计算机112的RAM 158中,可以模拟这种情况,这可以合理地估算处理的时间成本。由于获取的图像168的数量以及裂解血液和CSF的图像处理工作流不同(请参见前面的小节和方法),因此分别计算它们的计时结果。在表1中,裂解血液和CSF的计时结果由“/”分开。
为了针对成像平台100的三个通道中的每一个通道预先校准z距离范围,安装了一根底部外表面被故意弄脏了的毛细管。然后,当扫描头位于其扫描范围的两端以及中间时捕获三个全息图,并分别使用三个全息图自动聚焦到脏的表面
使用角谱方法将衍射图样反向传播到给定的z距离,该方法涉及2D快速傅立叶变换(FFT),具有自由空间传递函数的空间频域中的矩阵乘法以及逆FFT。但是,由于已知锥虫的大致尺寸,因此在空间频域中将高通滤波器添加到传递函数中,以抑制其他噪声和伪影。
自由空间传播的相干传递函数由下式给出
其中z是传播距离,λ是光波长,f
在H的顶部,添加了两个高通滤波器H
其中,σ
其中σ
结合了H、H
其中,min{H
减法帧间隔δ
δ
N
其中,R是记录序列的帧频(即系统中的26.6fps)。通过最佳地选择δ
针对血液和脑脊髓液(CSF),通过评估由CMA与OFN一起处理的图像的平均信噪比(SNR)(对应于图3H),δ
如图9A和图9B所示,对于裂解的血液,δ
对于CSF(参见图9C和图9D),对于δ
OFN对于减少由于样本中的粒子/物体的强烈散射而减少潜在的假阳性是必不可少的(参见图11和图12以比较具有和不具有OFN的结果)。在稍微随时间变化的照明和液体漂移的情况下,CMA处理后,强烈散射的颗粒/物体(例如未裂解的细胞,细胞屑团块,CSF样本中的加标白细胞(WBC)甚至气泡)会产生强烈的对比度(热点)。这些热点可能类似于锥虫造成的热点,从而导致假阳性检测。因此,为了将具有弱散射和强运动的受关注寄生虫(尤其是锥虫)与具有强散射和弱运动的其他不想要的物体区分开来,我们使用目标函数本身来归一化对应于等式2的帧减法。具有适当选择的y的指数函数进一步选择性的抑制了强烈散射的物体。对于裂解血液中的锥虫检测,根据目测判断“真阳性”信号与潜在“假阳性”信号之间的所得区别来选择y=2;用于CSF中锥虫的检测,y=3。
生成用于训练/验证的阳性图像
从具有相对高浓度的加标锥虫浓度的实验数据中手动识别阳性图像。对于血液,使用为约10
生成阴性图像以进行训练/验证
阴性训练/验证图像完全来自阴性对照实验(与图5中报告的数据没有重叠)。一项阴性对照测试用于填充血液的训练/验证库;由于每个测试的“假阳性”较少,因此将两个阴性对照测试用于CSF。对阴性图像进行分割时,使用较低的强度阈值(血液0.008,CSF0.015)生成更多图像,从而产生5834份用于血液的阴性图像和2586份用于CSF实验的图像。分别使用血液和CSF的四比一比例将图像随机分为训练集和验证集。通过以三种不同的方式镜像图像,对阴性训练库进行了与阳性训练集相似的数据增强,从而使阴性训练库大小扩大了4倍。此外,为了提高训练有素的分类器对未见的数据的鲁棒性,我们还通过复制阴性图像并乘以因子1.5来进行增强。因此,阴性训练库的总放大因子为8倍。
网络架构
CNN 166由三个卷积块和两个完全连接的(FC)层构成(请参见图13)。每个卷积块由卷积层(滤波器尺寸=5×5,步幅=1,16通道),然后是整流线性单元(ReLU)层和最大池化层(滤波器尺寸=3×3,步幅=2)组成。第一FC层具有128个输出节点,第二FC层具有2个输出节点,代表两个类(锥虫和非锥虫)。然后,将输出传递到分类器(softmax)层以生成类概率。在训练期间,将丢弃(dropout)(p=0.5)添加到第一FC层。训练相同的网络体系结构以分别识别血液和CSF中的锥虫信号。
网络训练
CNN 166是在TensorFlow(版本1.7.0)和Python(版本3.6.2)中实现的。使用截断的正态分布(均值=0,标准差=5.5×10
CMA算法162使用CUDA C++进行了加速,并在具有双Nvidia GTX 1080图形处理单元164(GPU)的便携式计算机112上运行。CMA算法162中计算量密集的数学运算是快速傅立叶变换(FFT)和逆FFT(IFFT)。Nvidia CUDA快速傅立叶变换库(cuFFT)库用于执行这些操作。推力库用于执行图像的归约(即所有元素的总和),然后进一步用于计算图像的均值以进行归一化。使用自定义编写的CUDA内核函数实现了对实数或复数值图像的其他各种基本数学运算。CUDA代码经过精心优化,以并行化计算,最大化效率并最小化GPU内存使用。例如,当对每个z距离执行衍射图样的反向传播时,每个z距离只计算一次高通滤波的相干传递函数(等式3至8),该时间序列中的所有帧都可以重复使用该函数。当使用OFN(等式2)进行时均差分分析时,在每个给定时间仅需要(δ
在执行FFT之前,将原始图像168(垂直:1374像素,水平:3840像素)填充为1536×4096像素的大小。为填充的像素分配未填充图像的平均值,以减少不连续性造成的伪影。因为新尺寸是2和3的幂(1536=2
当图像传感器124打开时,其温度升高,从而在其上方产生温度梯度。因此,玻璃管120内的流体样本101将逐渐开始流动,也使玻璃管内的粒子定向移动。结果,由于“拖尾”效应,由CMA算法162产生的运动微生物的信号将减弱;并且同时,其他不想要的粒子的运动会增加背景噪声和假阳性检测,这是不希望的。由于对流引起的流体样本101的速度与流体通道的高度有关。由于通道壁附近的阻力,较细的通道将在加热开始后的给定时间导致流体速度降低。然而,作为权衡,较细的通道也导致降低的筛选吞吐量。
COMSOL Multiphysics仿真软件用于估计通道内部的流速。如图10A所示,创建了填充有水的通道(内部高度1mm,内部宽度10mm,被均匀厚度为0.67mm的二氧化硅壁包围)。选择通道的6厘米截面作为仿真的受关注区域。在通道的中心,将CMOS图像传感器124(建模为表面温度为313K的恒定热源)放置在通道的下表面下方1mm处。约313K是图像采集期间图像传感器124的最高温度(请参见“方法”),该温度是通过红外摄像机(FLIR C2)进行实验测量的。参考温度(室温)设置为293K。使用非等温流对通道内部的水和通道外部的空气进行建模。
图10B至图10C示出了该仿真的结果。显示了通道内部的最大流体速度幅度,代表了最坏的情况。如所期望的,流体速度随着加热开始后的时间和通道高度的增加而增加(参见图10B)。进一步确定加热开始后在t=7s时(c)中最大流体速度与通道高度之间的关系,大约与图像采集的持续时间相对应(从图像传感器的FOV的上半部分切换到下半部分时会有时间间隔)。同样,在t=7s时的流体速度代表了最坏的情况,即流体速度最大。如图10C所示,在1mm的通道高度处,流体速度为约2.9μm/s。在61帧(约2.3s)的单个图像序列的持续时间内,由于流体流动引起的位移上限为约6.7μm,这与锥虫的长度相比是可以接受的。相反,如果通道高度为2mm,则位移的上限为约28μm,这将导致强烈的拖尾现象和信号减弱。结果,在本文进行的实验中使用的通道高度被选择为1mm。
尽管已经示出和描述了本发明的实施例,但是在不脱离本发明的范围的情况下可以进行各种修改。因此,除了所附权利要求及其等同物之外,本发明不应受到限制。因此,在不脱离所附权利要求的范围的情况下,可以对所公开的实施例进行各种改变和修改。例如,不需要在实施例中描述的所有组件,并且替代实施例可以包括所描述的组件的任何合适的组合,并且可以修改组件的总体形状和相对尺寸。同样,在附图中发现的尺寸和其他限制也不限制本发明的范围。
- 用于流体样本中运动物体的基于运动的无标记检测的设备和方法
- 用于借助至少一个声学脉冲确定运动辅助装置的周围环境中的至少一个物体的位置和/或运动的方法和周围环境检测设备
