包括病毒清除工序的蜂毒提纯方法以及利用其的用于预防或治疗炎症性疾病的组合物
文献发布时间:2023-06-19 11:55:48
技术领域
本发明涉及包括病毒清除工序的蜂毒提纯方法以及利用其的用于预防或治疗炎症性疾病的组合物。
背景技术
蜂毒已知具有强力的抗菌、抗炎效果,在民间和中医配方中一直用于关节炎、痛风等疾病。这样的蜂毒的主要成分为蜂毒肽(Melittine),为肽成分,已知具有抗炎和抗菌作用、强力的镇痛作用、免疫力增强等作用,为了将这样的蜂毒用于医药品,在蜂毒的提纯工序中,必须清除病毒。
动物源性医药品需要病毒清除工序的验证的原因在于,通过实验来验证病毒去除工序是否以有效清除或灭活可能存在于动物器官或组织中的感染性病毒的方式来设计。这是为了去除动物源性医药品在生产过程中因病毒没有死亡而流入人体发生病毒感染及潜在的风险。
根据动物源性医药品的病毒安全性评价指南,病毒清除工序可以分为使用物理方法分离病毒的方法和通过化学或物理处理减少感染性的方法。以物理方式分离病毒的方法由极微滤、色谱分析法、冷乙醇分馏等,通过化学或物理处理减少病毒的感染性的方法有强酸处理、伽马射线照射、热处理、有机溶剂/去污剂(S/D)处理等
然而,若简单地将如上所述的病毒清除工序适用于蜂毒提纯方法,则发生给存在于蜂毒的主要生理活性物质的含量带来影响的问题,因此需要使这样的问题最小化的研究。
发明内容
技术问题
本发明所要提供一种包括病毒清除工序的蜂毒提纯方法,该方法作为在不影响蜂毒的主要生理活性物质的含量的同时有效去除包括病毒在内的蛋白质及其他杂质等的方法,其包括:步骤(a),制备包含蜂毒的蜂毒液;步骤(b),通过酸处理将在上述步骤(a)中制备的蜂毒液的pH值调节为2.0至4.0,来第一次灭活病毒;以及步骤(c),通过10nm至20nm的纳米过滤器过滤在上述步骤(b)中调节pH值的蜂毒液,来第二次去除病毒。
然而,本发明所要实现的技术问题并不局限于以上所提及的问题,本发明所属技术领域的普通技术人员可以通过以下的记载明确理解未提及的其他技术问题。
技术方案
本发明提供一种包括病毒清除工序的蜂毒提纯方法,包括:步骤(a),制备包含蜂毒的蜂毒液;步骤(b),通过酸处理将在上述步骤(a)中制备的蜂毒液的pH值调节为2.0至4.0,来第一次灭活病毒;以及步骤(c),通过10nm至20nm的纳米过滤器过滤在上述步骤(b)中调节pH值的蜂毒液,来第二次去除病毒。
在上述步骤(a)中,蜂毒液中还可以包含选自由活性炭碳纳米管以及碳纤维组成的组中的一种以上的碳基吸附剂。
在上述步骤(b)中,可以通过酸处理,第一次灭活包括牛病毒性腹泻病毒(BVDV)或寨卡病毒(ZIKV)的病毒。
在上述步骤(b)中,酸处理可以通过使用0.1M至1.0M浓度的强酸处理1小时至20小时的方式来执行。
在上述步骤(b)中中,调节pH值的蜂毒液中的蜂毒肽含量可以保持在45重量百分比以上。
在上述步骤(c)之前,还可以包括通过0.05μm至1μm的膜过滤器过滤在上述步骤(b)中调节pH值的蜂毒液来预先去除蛋白质的步骤。
在上述步骤(c)中,可以通过纳米过滤器第二次去除包括选自由牛病毒性腹泻病毒、寨卡病毒、猪细小病毒(PPV)以及杆状病毒(BACV)组成的组中的一种以上的病毒。
在上述步骤(c)中,纳米过滤器的材质可以为聚醚砜树脂(PES)。
在上述步骤(c)中过滤的蜂毒液可以将蜂毒肽及蛋白质的含量均保持在45重量百分比以上,同时,具有600mL/小时以上的过滤率或60%以上的收率。
在上述步骤(c)之后,本发明还可以包括:步骤(d),通过0.1μm至1μm的除菌过滤器过滤在上述步骤(c)中过滤的蜂毒液;以及步骤(e),冷冻干燥在上述步骤(d)中过滤的蜂毒液。
本发明的一实例提供包含通过上述方法制备的蜂毒作为有效成分的用于预防或治疗炎症性疾病的药学组合物。
本发明的另一实例提供包含通过上述方法制备的蜂毒作为有效成分的用于预防或改善炎症性疾病的化妆品组合物。
发明的效果
本发明的包括病毒清除工序的蜂毒提纯方法的特征在于,包括通过酸处理将蜂毒液的pH值调节为2.0至4.0的步骤及通过10nm至20nm的纳米过滤器过滤蜂毒液的步骤作为必需的步骤,可以在不影响蜂毒的主要生理活性物质的含量的同时以很高的过滤率及收率有效去除牛病毒性腹泻病毒、寨卡病毒、猪细小病毒、杆状病毒等多种病毒以及其他杂质等。
因此,通过本发明的方法制备的蜂毒可以有用地用作用于预防、改善或治疗炎症性疾病的组合物。
附图说明
图1a及图1d示出通过电泳及高效液相色谱(HPLC)分析在实施例1~实施例3中制备的蜂毒的结果;
图2示出在实施例2中制备的蜂毒或蜂毒(原料)的Raw264.7细胞毒性评价结果;
图3a及图3b示出通过电泳及高效液相色谱分析在实施例4~实施例5中制备的蜂毒的结果;
图4a及图4b示出通过电泳及高效液相色谱分析在实施例4及比较例1中制备的蜂毒的结果;
图5示出在实施例4及比较例1中制备的蜂毒的Raw264.7细胞毒性评价结果;
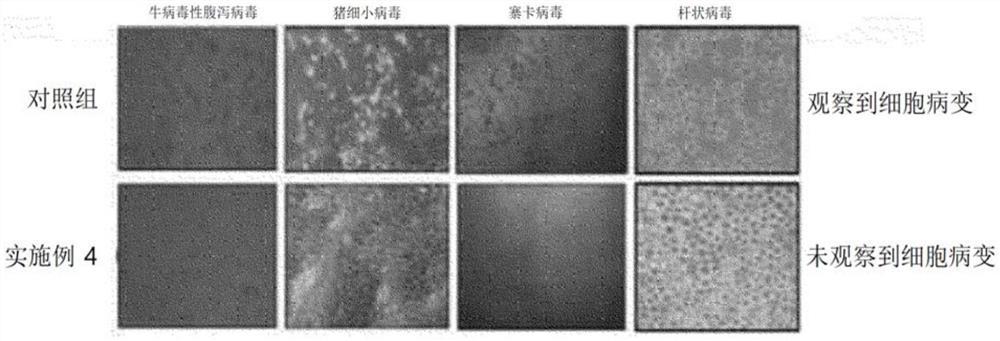
图6a及图6b为示出根据本发明一实例的病毒清除工序的验证流程的示意图;
图7示出为了验证病毒清除工序,在实施例4的包括病毒清除工序的蜂毒制备方法中,如图6a及图6b所示,在酸处理工序之前掺入病毒,在纳米过滤器工序后用病毒培养细胞处理的情况下,观察其形态变化(即,细胞病变效应(CPF))的结果。
具体实施方式
本发明人在研究在不影响蜂毒的主要生理活性物质的含量的同时有效去除牛病毒性腹泻病毒、寨卡病毒、猪细小病毒、杆状病毒等多种病毒以及其他杂质等的方法的过程中,通过组合最优化的酸处理及纳米过滤器工序来确认得到提高的效果,从而完成本发明。
以下,详细说明本发明。
包括病毒清除工序的蜂毒提纯方法
本发明提供一种包括病毒清除工序的蜂毒提纯方法,包括:步骤(a),制备包含蜂毒的蜂毒液;步骤(b),通过酸处理将在上述步骤(a)中制备的蜂毒液的pH值调节为2.0至4.0,来第一次灭活病毒;以及步骤(c),通过10nm至20nm的纳米过滤器过滤在上述步骤(b)中调节pH值的蜂毒液,来第二次去除病毒。
在本说明书中,“病毒清除”是包括病毒的灭活及去除两者的概念,病毒的灭活是指通过化学或物理处理减少病毒的感染力,病毒的去除是指以物理方式去除可能存在于动物源性原料中的病毒粒子。
另一方面,病毒根据动物源性宿主、有无包膜、病毒的大小以及核酸的种类进行分类,成为上述病毒清除对象的病毒有牛病毒性腹泻病毒(Bovine Viral Diarrhea Virus;BVDV)、寨卡病毒(Zika virus;ZIKV)、猪细小病毒(Porcine Parvovirus;PPV)以及杆状病毒(Baculovirus;BACV)等。
表1
如表1所示,牛病毒性腹泻病毒为包裹有包膜的(enveloped)、中等大小(约为40nm~60nm)的、单链核糖核酸病毒,对物理-化学灭活示出平均水平的抵抗性。牛病毒性腹泻病毒相对不耐热,对有机溶剂敏感,在酸性环境下不稳定,但在碱性环境中稳定。并且,寨卡病毒是直径约为50nm的球形,正二十面体的核衣壳被源自宿主细胞的内质网的外膜包裹。包膜表现出M(membrane)和E(envelope)两种蛋白质,具有约11-kb的阳性单链核糖核酸。另一方面,猪细小病毒为一种非脂质包膜型脱氧核糖核酸病毒(二十面体形),属于细小病毒科(直径为18nm~24nm)。这样的细小病毒科可以耐受极端的高热,在油性溶剂中稳定,相对在酸性pH中耐受。并且,杆状病毒是一种在无脊椎动物,尤其是在昆虫中出现的独特病毒,在甲壳类动物中也出现该类病毒。病毒粒子包含分子量为(30~110)×10
首先,本发明的包括病毒清除工序的蜂毒提纯方法包括制备包含蜂毒的蜂毒液的步骤(步骤(a))。
具体地,上述蜂毒液可以通过将蜂毒放入纯化水或缓冲溶液中完全溶解使蜂毒占0.01重量百分比至20.0重量百分比来制备的。若上述蜂毒液中的蜂毒(原料)的含量小于0.01重量百分比,则具有通过最终产物中的蜂毒(提纯蜂毒)的生理活性效果微乎其微的问题,若上述蜂毒液中的蜂毒的含量大于20.0重量百分比,则具有蜂毒的提纯效率低下的问题。
并且,上述蜂毒液中还包含选自由活性炭碳纳米管以及碳纤维组成的组中的一种以上的碳基吸附剂,由此可以去除其余的杂质等。
之后,选择性地可以在减压过滤的条件下,通过0.1μm至1μm的除菌过滤器过滤蜂毒液。
接下来,本发明的包括病毒清除工序的蜂毒提纯方法包括通过酸处理将在步骤(a)中制备的蜂毒液的pH值调节为2.0至4.0,来第一次灭活病毒的步骤(步骤(b))。
具体地,上述酸处理工序可以看作用于在不影响蜂毒的主要生理活性物质(蜂毒肽、磷脂酶A2等)的含量的同时通过该工序第一次灭活包括牛病毒性腹泻病毒或寨卡病毒的病毒的工序。由此,通过上述酸处理,可以将上述蜂毒液的pH值调节为2.0至4.0,优选地,可以将pH值调节为2.5至3.5,但不限定于此。
更具体地,上述酸处理可以通过使用0.1M至1.0M浓度的强酸处理1小时至20小时的方式来执行。上述强酸可以包含选自由盐酸、乙酸、硫酸、硝酸以及氢氟酸组成的组中的一种以上,若上述强酸的浓度小于0.1M,则具有在酸处理工序中需要大量的强酸的问题,若上述强酸的浓度大于1.0M,则具有影响蜂毒的主要生理活性物质的隐患。并且,优选地,上述酸处理进行1小时至20小时,更优选地,进行1小时至6小时,但不限定于此。若上述酸处理的时间过短,则具有无法充分实现病毒的灭活的问题,若上述酸处理时间过长,则具有影响主要生理活性物质带而降低药理活性效果的问题。
调节pH值的上述蜂毒液可以将蜂毒肽含量保持在40重量百分比以上,优选地,可以保持在45重量百分比以上,但不限定于此。
之后,可以选择性地通过碱处理将调节pH值的上述蜂毒液的pH值校正为4.5至5.5。上述碱可以通过使用0.1M至1.0M浓度的氢氧化钠等碱进行处理来执行。若上述碱的浓度小于0.1M,则具有在碱处理工序中需要过多量的碱的问题,若上述碱的浓度大于1.0M,则具有影响蜂毒的主要生理活性物质的隐患。
接下来,本发明的包括病毒清除的方法包括通过10nm至20nm纳米过滤器过滤在上述步骤(b)中调节pH值的蜂毒液,来第二次去除病毒的步骤(步骤(c))。
具体地,上述纳米过滤器工序可以看作用于在不影响蜂毒的主要生理活性物质(蜂毒肽、磷脂酶A2、蜂神经毒肽等)的含量的同时通过该工序第二次去除包括选自由牛病毒性腹泻病毒、寨卡病毒、猪细小病毒以及杆状病毒组成的组中的一种以上的病毒的工序。另一方面,若使用有机溶剂代替上述纳米过滤器工序,则具有不仅显著降低收率,还会显著降低药理活性效果的问题。
尤其,在上述纳米过滤器工序中使用的纳米过滤器的气孔保持10nm至20nm,即使尺寸小的病毒病毒(例如,牛病毒性腹泻病毒、寨卡病毒、猪细小病毒等)也能够有效去除。上述纳米过滤器的材质可以选择多种,从过滤率的层面看,最优选为聚醚砜树脂,但不限定于此。
在上述步骤(c)中过滤的毒液可以将蜂毒肽及蛋白质的含量均保持在45重量百分比以上,同时,可具有600mL/小时以上的过滤率或60%以上的收率。
由此,在使用纳米过滤器之前,本发明选择性地还可以包括通过0.05μm至1μm的膜过滤器过滤在上述步骤(b)中调节pH值的蜂毒液来预先去除蛋白质的步骤。在此情况下,上述膜过滤器的分子量阻断值(cut-off)可以为200kDa。
之后,本发明还可以包括:通过0.1μm至1μm的除菌过滤器过滤在上述步骤(c)中过滤的蜂毒液的步骤(步骤(d));以及冷冻干燥在上述步骤(d)中过滤的蜂毒液的步骤(步骤(e))。在此情况下,上述冷冻干燥(freeze drying,FD)可以在-40℃至-120℃的温度下急速冻结原料后,在具有0.1托(Torr)~0.9托的真空度的冷冻干燥机中通过逐步施加低温的热量来使固体状态的冰升华,从而可获得质量比普通干燥的更高的干燥产品。更优选地,可以在-80℃至-100℃的温度下以0.2托至0.5托的真空度进行冷冻干燥。
用于预防或治疗炎症性疾病的的药学组合物
本发明提供包含通过上述方法制备的蜂毒作为有效成分的用于预防或治疗炎症性疾病的药学组合物。
通过上述方法制备的蜂毒是指在将主要生理活性物质(蜂毒肽、磷脂酶A2以及蜂神经毒肽等)的含量保持在规定水平以上的同时有效地去除病毒以及其他杂质等的状态。
优选地,本说明书中的“炎症性疾病”为选自由过敏、皮肤炎、特应性皮肤炎、结膜炎、牙龈炎、鼻炎、中耳炎、咽喉炎、扁桃体炎、肺炎、胃溃疡、胃炎、克罗恩病、结肠炎、痛风、强直性脊髓炎、风湿热、狼疮、纤维肌痛(fibromyalgia)、银屑病性关节炎、骨关节炎、类风湿性关节炎、肩关节周围炎、腱炎、腱鞘炎、腱周围炎、肌炎、肝炎、膀胱炎、肾炎、干燥综合征(Sjogren'ssyndrome)、多发性硬化症以及急慢性炎症组成的组中的一种以上,但不限定于此。
本发明用于预防或治疗炎症性疾病的药学组合物可以分别根据通常的方法制剂化为散剂、颗粒剂、片剂、胶囊剂、悬浮液、乳剂、糖浆、喷雾剂等口服剂型,外用剂、栓剂及灭菌注射液的形态来使用,为了剂型化,可以包含在制备药学组合物时通常使用的适当的载体、赋形剂或稀释剂。
在制剂化的情况下,可以使用通常使用的填充剂、增重剂、结合剂、湿润剂、崩解剂、表面活性剂等稀释剂或赋形剂来制备。
在本发明的用于预防或治疗炎症性疾病的药学组合物中,通过上述方法制备的蜂毒的优选给药量根据患者的状态、体重、疾病的程度、药物形态、给药途径以及时间而不同,普通技术人员可通过上述因素适当地选择。然而,为了优选的效果,能够以一天0.0001mg/kg至2000mg/kg的量给药,优选地,能够以300mg/kg至2000mg/kg的量给药。可以一天给药一次,也可以分为数次给药。但上述给药量并不限制本发明的范围。
用于预防或改善炎症性疾病的化妆品组合物
本发明提供包含通过上述方法制备的蜂毒作为有效成分的用于预防或改善炎症性疾病的化妆品组合物。
关于上述“通过上述方法制备的蜂毒”以及“炎症性疾病”,已在上述内容中说明,因此将省略重复说明。
并且,此外添加的配合成分不受限制,并且,上述任意成分在不损及本发明的目的及效果的范围内可以任意配合,但优选地,相对于总重量,能够以0.01重量百分比~5重量百分比配合,更优选地,能够以0.01重量百分比~3重量百分比配合,但不限定于此。
上述化妆品组合物可以呈溶液、乳化物或粘性混合物的形状,但不限定于此。
除上述化合物外,上述化妆品组合物中包含的成分还可以包含通常用于化妆品组合物的成分作为有效成分,可以包含如稳定剂、溶解剂、维生素、颜料及香料的普通辅助剂及载体,但不限定于此。
上述化妆品组合物可制备为在相关领域通常制备的任意剂型,可以制备为乳液、霜剂、化妆水、面膜、粉底霜、润肤乳、美容液或护发用品,但不限定于此。具体地,上述化妆品组合物可以包括护肤水、柔肤水、爽肤水、收敛剂、润肤乳、护肤乳、保湿护肤液、营养护肤液、按摩霜、营养霜、保湿霜、护手霜、粉底霜、精华液、营养精华素、面膜、香皂、洗面奶、卸妆乳、卸妆霜、身体乳或沐浴露的剂型,但不限定于此。
进而,本发明提供用于包含通过上述方法制备的蜂毒的用于预防或治疗炎症性疾病的药学组合物的用途。
并且,本发明提供用于包含通过上述方法制备的蜂毒的用于预防或改善炎症性疾病的化妆品组合物的用途。
并且,本发明提供包括向个体给药通过上述方法制备的蜂毒的步骤的症性疾病的预防或治疗炎方法。
在本发明中,“个体”是指需要治疗疾病的对象,更具体地,是指人类或非人类的灵长类、小鼠(mouse)、大鼠(rat)、狗、猫、马以及牛等哺乳动物。
如上所述,本发明的包括病毒清除工序的蜂毒的提纯方法的特征在于,包括通过酸处理将蜂毒液的pH值调节为2.0至4.0的步骤及通过10nm至20nm的纳米过滤器过滤蜂毒液的步骤作为必需的步骤,可以在不影响蜂毒的主要生理活性物质的含量的同时能够以很高的过滤率及收率有效去除牛病毒性腹泻病毒、寨卡病毒、猪细小病毒、杆状病毒等多种病毒以及其他杂质等。尤其,10nm至20nm的纳米过滤器具有能够有效去除多种病毒的优点。
因此,通过本发明的方法制备的蜂毒可以有用地用作用于预防、改善或治疗炎症性疾病的组合物。
以下,通过公开优选实施例来帮助理解本发明。但下述实施例只是更加容易理解本发明而提供,本发明的内容并不限定于下述实施例。
实施例
实施例1:酸pH 2处理
以向纯化水中加入蜂毒完全溶解后使蜂毒成为5.0重量百分比的方式来制备蜂毒液。首先,在减压过滤的条件下,通过0.22μm气孔(pore)的除菌过滤器过滤蜂毒液。之后,使用0.2M浓度的盐酸处理1小时至15小时来将蜂毒液的pH值调节为2,由此第一次灭活病毒后,使用0.2M浓度的氢氧化钠进行处理来将蜂毒液的pH值校正为5。然后,在减压过滤的条件下,通过0.22μm气孔的膜过滤器预先过滤蜂毒液后,在-80℃以下的温度下急速冷冻,在0.5托以下的真空状态下冷冻干燥来制备粉末状态的蜂毒。在此情况下,对照组(Control)以不经酸处理而冷冻干燥的方式制备。
实施例2:酸pH 3处理
使用0.2M浓度的盐酸将蜂毒液的pH值调节为3后,处理1小时至15小时。除将蜂毒液的pH值调节为2以外,以与实施例1相同的方法制备蜂毒。
实施例3:酸pH 4处理
使用0.2M浓度的盐酸将蜂毒液的pH值调节为4后,处理1小时至15小时。除将蜂毒液的pH值调节为4以外,以与实施例1相同的方法制备蜂毒。
实验例1:酸处理工序的最优化
通过电泳及高效液相色谱分析在实施例1~实施例3中制备的蜂毒的蛋白质含量,其结果如表2、图1a至图1d所示。
表2
如表2所示,在如实施例1,经酸处理的pH值过低的情况下,具有蜂毒肽含量显著地减少的问题,经确认,如实施例2~实施例3,经酸处理使pH值为3至4为优选。并且,在酸处理时间过长的情况下,具有蜂毒肽含量显著地减少的问题,经确认,酸处理时间以保持1小时至15小时为优选,尤其以保持1小时至6小时为优选。
实验例2:根据酸处理工序最优化的药理活性效果
(1)Raw264.7细胞毒性评价
使用从韩国细胞株银行(Cat No.KCLB40071)购买的作为巨噬细胞的Raw264.7细胞,利用包含10%的胎牛血清(Fetal bovine serum,FBS,Hyclone公司)和100IU/ml的青霉素(penicillin)以及100μg/ml的链霉素(streptomycin)的杜尔贝科改良伊戈尔培养基(Dulbecco's modified Eagle medium,DMEM,Hyclone公司),在5%的CO
培养作为巨噬细胞的Raw264.7细胞后,分别添加4种不同浓度的实施例2的pH 3的处理时间不同的蜂毒后,为了确认细胞存活率而施行MTT法(methylthiazol tetrazoliumbromide,Sigma Aldrich公司)。在24孔培养板(24well plate)(BD,Falcon公司)的各孔(well)接种(seeding)适量的细胞(5×10
如表3所示,经确认,与酸处理时间无关地,在实施例2中制备的蜂毒或蜂毒(原料)直至5μg/ml的浓度为止均示出无毒性。
(2)一氧化氮释放(Nitric Oxide release)测定
为了测定一氧化氮释放,将作为巨噬细胞的Raw264.7细胞(cell)以2.5×10
在此情况下,在所使用的试样中,对照组为不对蜂毒进行酸处理而仅经过冷冻干燥工序来制备,以此来比较酸处理工序前后的一氧化氮释放活性。
如表3所示,经确认,对照组、实施例2的pH 3的按照处理时间,即处理3小时、6小时以及15小时的提纯蜂毒试样的一氧化氮(NO)抑制水平均示出相近的数值。这说明提纯蜂毒工序中的酸处理工序不影响提纯蜂毒的一氧化氮释放活性。
(3)炎症性肿瘤坏死因子α(TNF-alpha)测定
为了测定肿瘤坏死因子α,将作为巨噬细胞的Raw264.7细胞以2.5×10
在此情况下,在所使用的试样中,对照组为不对蜂毒进行酸处理而仅经过冷冻干燥工序来制备,以此来比较酸处理工序前后的肿瘤坏死因子α活性。
如表3所示,确认在酸处理的时间为6小时以内的情况下,示出与没有酸处理而仅经过冷冻干燥工序的对照组相近的肿瘤坏死因子α抑制能力,而在酸处理时间为15小时的情况下,相比于对照组,肿瘤坏死因子α的抑制活性降低。这说明当将提纯蜂毒工序中的酸处理工序设定为6小时以内时,不影响提纯蜂毒的肿瘤坏死因子α活性。
表3
实施例4:纳米过滤器(PES)的利用
以向纯化水中加入蜂毒完全溶解后使蜂毒成为5.0重量百分比的方式来制备蜂毒液。在此情况下,可以使用活性炭去除异物及异味。之后,在减压过滤的条件下,通过0.22μm气孔的除菌过滤器过滤蜂毒液。之后,使用0.2M浓度的盐酸处理3小时来将蜂毒液的pH值调节为3来第一次灭活病毒后,使用0.2M浓度氢氧化钠进行处理将蜂毒液pH值校正为5。在此情况下,可以通过超滤(UF,ultrafiltration)工序代替氢氧化钠来校正pH值。之后,在减压过滤条件下,通过0.1μm气孔的膜过滤器预先过滤蜂毒液后,通过20nm气孔的聚醚砜树脂材质的纳米过滤器(
在此情况下,对照组以不经酸处理及纳米过滤器工序而冷冻干燥的方式制备。
实施例5:纳米过滤器(聚偏氟乙烯(PVDF))的利用
除使用聚偏氟乙烯(PVDF)材质的纳米过滤器替代聚醚砜树脂材质的纳米过滤器(
实验例3:纳米过滤器工序的最优化(1)
通过电泳及高效液相色谱分析在实施例4~实施例5中制备的蜂毒的蛋白质含量及过滤率,其结果如表4、图3a及图3b所示。
表4
如表4所示,经确认,与纳米过滤器的材质无关地,在纳米过滤器工序后,蜂毒的蜂毒肽含量及蛋白质含量相似,纳米过滤器工序不影响蜂毒主要成分的含量。尤其,经确认,在如实施例4的聚醚砜树脂材质的情况下,相比于如实施例5的聚偏氟乙烯材质,过滤率非常显著。
比较例1:有机溶剂的利用
以向纯化水中加入蜂毒完全溶解后使蜂毒成为5.0重量百分比的方式来制备蜂毒液。首先,在减压过滤的条件下,通过0.22μm气孔的除菌过滤器过滤蜂毒液。之后,使用0.2M浓度的盐酸处理3小时将蜂毒液的pH值调节为3来第一次灭活病毒后,使用0.2M浓度氢氧化钠进行处理将蜂毒液的pH值校正为5。之后,向蜂毒液加入70%的乙醇进行沉淀后,在常温下放置1小时后,放入纯化水并搅拌。然后,通过使用3kDa以下的超滤膜过滤及浓缩来去除乙醇。之后,在减压过滤的条件下,通过0.22μm气孔的除菌过滤器再次过滤蜂毒液,然后,在-80℃以下的温度下急速冷冻,在0.5托以下的真空状态下冷冻干燥来制备粉末状态的蜂毒。
在此情况下,对照组以不经酸处理及有机溶剂工序而冷冻干燥的方式制备。
实验例4:纳米过滤器工序的最优化(2)
通过电泳及高效液相色谱分析在实施例4以及比较例1中制备的蜂毒的蛋白质含量及收率,其结果如表5、图4a及图4b所示
表5
如表5所示,经确认,在实施例4及比较例1的情况下,蜂毒的蜂毒肽含量及蛋白质含量相似,如比较例1,在使用有机溶剂的情况下,收率显著降低。
实验例5:根据纳米过滤器工序最优化的药理活性效果
(1)Raw264.7细胞毒性评价
通过与实验例4的Raw264.7细胞毒性评价相同的方法执行,其结果如表6所示。
如表6所示,经确认,在实施例4及比较例1中制备的蜂毒直至5μg/ml为止均示出无毒性。
(2)一氧化氮释放测定
通过与实验例4的一氧化氮释放测定相同的方法执行,其结果如表6所示。
如表6所示,经确认,在实施例4以及比较例1中制备的蜂毒均在浓度上示出有意义的一氧化氮活性抑制,其活性抑制水平在两个工序中均示出相近的数值。
(3)炎症性肿瘤坏死因子α的测定
通过与实验例4的炎症性肿瘤坏死因子α测定相同的方法执行,其结果如表6所示。
如表6所示,经确认,在实施例4中制备的蜂毒与对照组(control)相似地,浓度著地示出肿瘤坏死因子α的抑制能力,相反,相比于对照组(control),在比较例1中制备的蜂毒的肿瘤坏死因子α抑制活性降低。
表6
实验例6:病毒清除工序的验证
为了病毒清除工序的验证,在包括实施例4的病毒清除工序的蜂毒制备方法中,如图6a及图6b所示,观察了如下情况下的形态变化(即,细胞病变效应):1)在酸处理工序之前掺入病毒后,在酸处理工序后在病毒培养细胞处理的情况;2)在纳米过滤器工序之前掺入病毒后,在纳米过滤器工序后在病毒培养细胞处理的情况;以及3)在酸处理工序之前掺入病毒后,在纳米过滤器工序后在病毒培养细胞处理的情况,其结果如表7及图7所示。在此情况下,病毒培养细胞使用马-达氏牛肾细胞(Madin-Darby bovine kidney cell)作为牛病毒性腹泻病毒的培养细胞,使用猪肾传代细胞(Procine Kidney cell,PK15)作为猪细小病毒的培养细胞,使用非洲绿猴肾细胞(VERO cell)作为寨卡病毒的培养细胞,使用SF9 cell细胞作为杆状病毒的培养细胞。
如表7所示,可以确认,1)若通过最优化的酸处理工序,则如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒减少指数(virus reduction factor,Ri)以常用对数值表示为1.24(±0.14)至7.60(±0.33),可以灭活如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒。尤其,经确认,可以强力灭活如牛病毒性腹泻病毒及寨卡病毒的核糖核酸病毒。
并且,可以确认,2)若通过纳米过滤器工序,则如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒减少指数以常用对数值表示为4.45(±0.41)至7.53(±0.53),可以灭活如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒。
即,经确认,通过组合酸处理及纳米过滤器工序,如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒减少指数的积累以常用对数值表示为6.04(±0.53)至15.13(±0.86),确认可以充分强力地灭活如牛病毒性腹泻病毒、猪细小病毒、寨卡病毒以及杆状病毒的所有病毒。
表7
以下,说明包含根据本发明制备的蜂毒的组合物的制备例,这些制备例仅具体说明本发明,并不限定本发明。
制备例1
使用根据实施例4制备的蜂毒,按照下述表8所示的组成比制备注射剂组合物。
表8
制备例2
使用根据实施例4制备的蜂毒,按照下述表9所示的组成比制备片剂组合物。
表9
制备例3
使用根据实施例4制备的蜂毒,按照下述表10所示的组成比制备软膏剂组合物。.
表10
制备例4
使用根据实施例4制备的蜂毒,按照下述表11所示的组成比制备贴剂组合物。
表11
制备例5
使用根据实施例4制备的蜂毒,按照下述表12所示的组成比制备护肤液型制剂组合物。
表12
制备例6
使用根据实施例4制备的蜂毒,按照下述表13所示的组成比制备霜剂型制剂组合物。
表13
前述的本发明的说明仅用于例示,应该理解的是,本发明所属技术领域的普通技术人员可以在不变更本发明的技术思想或必需特征的情况下轻松变形为其他具体形态。因此,以上所述的实施例在所有方面仅为例示,并不限定本发明。
- 包括病毒清除工序的蜂毒提纯方法以及利用其的用于预防或治疗炎症性疾病的组合物
- 含毛柿提取物作为活性成分的用于预防或治疗炎症性疾病、过敏性疾病或哮喘的药物组合物
