一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组和试剂盒
文献发布时间:2023-06-19 12:08:44
技术领域
本发明涉及生物检测技术领域,具体来说,涉及一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组和试剂盒。
背景技术
原发性肉碱缺乏症(Primary Carnitine Deficiency,以下简称PCD)是一种常染色体隐性遗传病,其临床特点为肉碱代谢出现异常。该病的致病基因为编码有机阳离子转运2型(OCTN2)的SLC22A5基因。PCD的发病年龄跨度较大,但大多数患儿于1个月至7岁发病,平均发病年龄在2岁左右。不同患者的临床表现差异较大,主要有:(1)急性能量代谢障碍,表现为低酮型低血糖、高血氨及代谢性酸中毒等;(2)心肌病,表现为心室肥厚、心功能不全、心律失常及肌酸激酶升高等;(3)肌病,表现为肌无力、肌张力减退、肌痛、运动耐力差、肌肉型肌酸激酶升高、肌纤维内脂质沉积等;(4)肝脏损害,表现为肝肿大、脂肪肝、肝功能异常等,一些出现肝损伤的患儿会急性起病,表现为抽搐、进行性意识障碍等,常被误诊为Reye综合征。此外,反复腹痛、呕吐、胃食管反流等消化道症状,反复感染、喘息等呼吸道表现以及贫血等也有报道。
PCD患病率为(0.8~2.5)/10万。不同地区的患病率存在差异,德国约为0.3/10万,美国约为0.5/10万,葡萄牙约为1/10万,澳大利亚约0.8/10万,沙特阿拉伯约为1.2/10万,日本约2.5/10万;我国上海地区为2.4/10万,浙江省为3.1/10万,中国香港患病率约为1.1/10万,中国台湾患病率约为0.8/10万。本实验室在郑州采集了388例健康备孕人群的DNA,发现致病变异位点NM_003060.3:exon8:c.1400C>G:p.S467C的携带率为1.55%(6/388),以此推算发病率约为5.98/10万,高于目前文献报道的发病率,目前为止,关于该位点的文献大多数为案例报道,缺乏该致病变异在中国人群中的流行病学报道。综合其他致病位点,PCD在中国的真实发病率必然远高于目前的文献报道。
目前国内外对于原发性肉碱缺乏症筛查方法有全基因组Sanger测序、串联质谱、临床检查。其中全基因的测序费用过高,很难满足目前临床实际需求。
建立快速、准确的检测原发性肉碱缺乏症的方法具有重要意义。结合国内情况,在早期筛查出原发性肉碱缺乏症,对于新生儿患者应用肉碱替代治疗,维持血浆游离肉碱水平正常或接近正常,可以避免其发育不良问题。相比较而言,荧光PCR是针对遗传物质DNA/RNA进行检测的手段,准确度较高,假阳性率较低,有助于进行普遍筛查,降低原发性肉碱缺乏症新生儿出生率,同时可以帮助更多的患病儿童维持正常生活。目前,还没有专门针对该变异位点的荧光定量PCR引物、探针和试剂盒。本发明采用实时荧光定量PCR的方法,能够在较短的时间内实现原发性肉碱缺乏症携带者与患者的筛查。
发明内容
针对相关技术中的上述技术问题,本发明提出一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组和试剂盒,能够克服现有技术的上述不足。
为实现上述技术目的,本发明的技术方案是这样实现的:
一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组,所述探针引物组包括用于扩增SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点的上下游引物以及针对所述变异位点的MGB探针,所述探针引物组的序列为:
SLC22A5-F1的序列如SEQ ID NO.1所示;
SLC22A5-R1的序列如SEQ ID NO.2所示;
SLC22A5-F2的序列如SEQ ID NO.3所示;
SLC22A5-R2的序列如SEQ ID NO.4所示;
SLC22A5-F3的序列如SEQ ID NO.5所示;
SLC22A5-F4的序列如SEQ ID NO.6所示;
SLC22A5-R4的序列如SEQ ID NO.7所示;
SLC22A5-F5的序列如SEQ ID NO.8所示;
SLC22A5-R5的序列如SEQ ID NO.9所示;
SLC22A5-Probe1的序列如SEQ ID NO.10所示;
SLC22A5-Probe2的序列如SEQ ID NO.11所示;
SLC22A5-Probe4的序列如SEQ ID NO.12所示;
SLC22A5-Probe6的序列如SEQ ID NO.13所示。
进一步地,SLC22A5-Probe1的5'端标记FAM,3'端标记MGB。
进一步地,SLC22A5-Probe2、SLC22A5-Probe4、SLC22A5-Probe6的5'端均标记VIC,3'端均标记MGB。
根据本发明的另一方面,提供了一种用于检测SLC22A5基因高频致病变异的荧光定量PCR试剂盒,包括针对检测位点设计的探针引物组,所述探针引物组包括用于扩增SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点的上下游引物以及针对所述变异位点的MGB探针,所述探针引物组的序列为:
SLC22A5-F1的序列如SEQ ID NO.1所示;
SLC22A5-R1的序列如SEQ ID NO.2所示;
SLC22A5-F2的序列如SEQ ID NO.3所示;
SLC22A5-R2的序列如SEQ ID NO.4所示;
SLC22A5-F3的序列如SEQ ID NO.5所示;
SLC22A5-F4的序列如SEQ ID NO.6所示;
SLC22A5-R4的序列如SEQ ID NO.7所示;
SLC22A5-F5的序列如SEQ ID NO.8所示;
SLC22A5-R5的序列如SEQ ID NO.9所示;
SLC22A5-Probe1的序列如SEQ ID NO.10所示;
SLC22A5-Probe2的序列如SEQ ID NO.11所示;
SLC22A5-Probe4的序列如SEQ ID NO.12所示;
SLC22A5-Probe6的序列如SEQ ID NO.13所示。
进一步地,所述荧光定量PCR试剂盒还包括适用于高CG序列的高效DNA聚合酶、dNTPs、适用于高GC序列的缓冲液体系及用于校准反应液体积的ROX参比荧光染料。
进一步地,当FAM和VIC双通道都出现明显的扩增曲线,且FAM通道和VIC通道的Ct值差距不大于1.0时,待测样本为SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点携带者DNA;当VIC通道出现明显的扩增曲线,且FAM通道无明显扩增曲线,或有微弱扩增曲线且双通道间Ct值相差大于2.0时,待测样本为SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点的野生型DNA;当FAM通道出现明显的扩增曲线,且VIC通道无明显扩增曲线,或有微弱扩增曲线且双通道间Ct值相差大于2.0,待测样本为纯合突变的患者DNA。
本发明的有益效果:本发明的探针引物组和试剂盒可用于快速、准确地体外检测人全血样本中SLC22A5基因NM_003060转录本上的c.1400C>G变异,检测结果用于原发性肉碱缺乏症(primary carnitine deficiency,PCD)的辅助诊断,该变异的致病性明确,且在正常人群中携带率较高(1.55%,6/388);该反应体系可以使用人基因组DNA溶液作为模板,也可以使用未溶血的全血作为模板直接检测,省去了DNA提取的过程;该反应体系的探针/引物群经过优化,等位基因之间的扩增效率差异达到最大化,使实验人员可以方便准确的解读结果,不需要进行内参基因的比对或使用delta-delta-Ct法进行计算分析;该反应体系既适用于Ct值的判读,也可以使用终点法进行判读;相较于NGS和其他检测手段,荧光定量PCR的成本低廉,准确性得到公认,适合在临床推广。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是根据本发明实施例2所述的log对数曲线实验结果;
图2是根据本发明实施例2所述的Linear线性扩增曲线实验结果;
图3是根据本发明实施例3所述的log对数曲线实验结果;
图4是根据本发明实施例3所述的Linear线性扩增曲线实验结果;
图5是根据本发明实施例4所述的log对数曲线实验结果;
图6是根据本发明实施例4所述的Linear线性扩增曲线实验结果;
图7是根据本发明实施例5所述的log对数曲线实验结果;
图8是根据本发明实施例5所述的Linear线性扩增曲线实验结果;
图9是根据本发明实施例6所述的log对数曲线实验结果;
图10是根据本发明实施例6所述的Linear线性扩增曲线实验结果;
图11是根据本发明实施例7所述的终点法进行SNP分型的结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种用于检测SLC22A5基因高频致病变异的荧光定量PCR试剂盒,包括针对检测位点设计的探针引物组,所述探针引物组包括用于扩增SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点的上下游引物以及针对所述变异位点的MGB探针,所述探针引物组的序列如表1-2所示:
表1引物序列
表2MGB探针序列
采用上述试剂盒对待测样本进行检测的方法为:
(1)按照表3进行试剂配制;
表3试剂配制
(2)扩增程序如表4所示。
表4扩增程序
实施例2
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当使用野生型DNA作为模板时,检测结果如表5所示:
表5野生型DNA检测结果
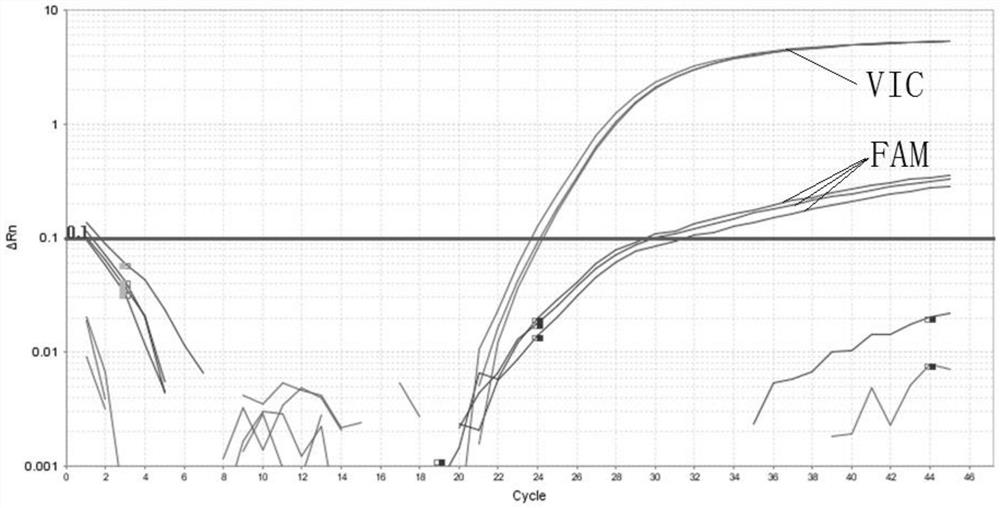
其中,样本235、237和611为野生型人基因组DNA,3/2-BLANK为使用纯化水的空白对照。阈值线设置为0.1。由表5可知,VIC信号的平均Ct值为24.07,标准差为0.3106;而FAM信号的平均Ct值为30.34,标准差为1.0510;log对数曲线实验结果如图1所示,Linear线性扩增曲线实验结果如图2所示,linear曲线中几乎观测不到FAM通道的扩增曲线。
实施例3
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当使用杂合型DNA作为模板时,检测结果如表6所示:
表6杂合型DNA检测结果
其中,样本SLC22A5-1-1、SLC22A5-2-2和SLC22A5-3-2均为变异位点NM_003060.3:exon8:c.1400C>G的杂合型人基因组DNA,SLC22A5-BLANK为使用纯化水的空白对照。阈值线设置为0.1。由表6可知,VIC信号的平均Ct值为25.19,标准差为0.0656;而FAM信号的平均Ct值为24.65,标准差为0.0451;log对数曲线实验结果如图3所示,Linear线性扩增曲线实验结果如图4所示。
实施例4
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当PCD患者的纯合突变DNA作为模板时,检测结果如表7所示:
表7纯合突变DNA检测结果
其中,样本Homozygous-DNA-1至Homozygous-DNA-6为人工合成的SLC22A5基因片段,并且带有纯合突变的NM_003060.3:exon8:c.1400C>G变异位点;BLANK-1、BLANK-2和BLANK-3为使用纯化水为模板的空白对照。阈值线设置为0.1。由表7可知,VIC信号的平均Ct值为30.51,标准差为0.2828;而FAM信号的平均Ct值为26.26,标准差为01700。log对数曲线实验结果如图5所示,Linear线性扩增曲线实验结果如图6所示。
实施例5
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当使用正常人的野生型全血(EDTA抗凝)时,检测结果如表8所示:
表8野生型全血检测结果
其中,样本whole blood-1至whole blood-6为正常人的全血样本,tap water-1至tap water-6为使用纯化水的空白对照。阈值线设置为0.1。由表8可知,VIC信号的平均Ct值为33.54,标准差为0.1854;而FAM信号的平均Ct值为36.81,标准差为0.3863;空白对照均无Ct值。log对数曲线实验结果如图7所示,Linear线性扩增曲线实验结果如图8所示。
实施例6
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当使用携带者的杂合型全血(EDTA抗凝)时,检测结果如表9所示:
表9杂合型全血检测结果
其中,样本SLC22A5-1-1、SLC22A5-2-2和SLC22A5-3-2为携带者的全血样本。阈值线设置为0.1。由表9可知,VIC信号的平均Ct值为28.78,标准差为0.0393;而FAM信号的平均Ct值为28.48,标准差为0.0351。log对数曲线实验结果如图9所示,Linear线性扩增曲线实验结果如图10所示。
实施例7
采用实施例1所述的试剂盒检测SLC22A5基因高频致病变异,当使用终点法进行SNP分型时,结果如表10和图11所示。
表10SNP分型结果
其中,样本Homozygous-DNA-1至Homozygous-DNA-5为人工合成的SLC22A5基因片段,并且带有纯合突变的NM_003060.3:exon8:c.1400C>G变异位点;235-3/2、237-3/2和611-3/2为野生型的人基因组DNA;SLC22A5-1-1、SLC22A5-2-2和SLC22A5-3-2为携带者的杂合型人基因组DNA;BLANK-1、BLANK-2、BLANK-3和BLANK-4为使用纯化水为模板的空白对照。阈值线设置为自动。由表10可知,根据终点法判定的SNP和样本基因型完全一致,符合率为100%。
综上所述,使用本发明所述的试剂盒检测SLC22A5基因高频致病变异,当使用SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点携带者DNA作为模板时,可以观察到FAM和VIC双通道都出现了明显的扩增曲线,且FAM通道和VIC通道的Ct值差距不大于1.0;当使用SLC22A5基因NM_003060.3:exon8:c.1400C>G变异位点的野生型DNA作为模板时,可以观察到VIC通道出现明显的扩增曲线,且FAM通道无明显扩增曲线,或有微弱扩增曲线且双通道间Ct值相差大于2.0;纯合突变的患者DNA作为模板时,可以观察到FAM通道出现明显的扩增曲线,且VIC通道无明显扩增曲线,或有微弱扩增曲线且双通道间Ct值相差大于2.0;该反应体系既适用于Ct值的判读,也可以使用终点法进行判读;相较于NGS和其他检测手段,荧光定量PCR的成本低廉,准确性得到公认,适合在临床推广。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 北京华诺奥美医学检验实验室有限公司
<120> 一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组和试剂盒
<160> 13
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
atggtgggca agtttggagt 20
<210> 2
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gtaaacgaag tagggagaca ggat 24
<210> 3
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ggagtcacgg ctgcctttt 19
<210> 4
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ggtaaacgaa gtagggagac agg 23
<210> 5
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
agtcacggct gccttttcc 19
<210> 6
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
cacggctgcc ttttcca 17
<210> 7
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
ccaaggtaaa cgaagtaggg aga 23
<210> 8
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tcccacagtg gtgagaaaca tg 22
<210> 9
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
cgaagtaggg agacaggatg ct 22
<210> 10
<211> 15
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
agtcagctgc acagc 15
<210> 11
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
agtcagctcc acagca 16
<210> 12
<211> 14
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
ggagtcagct ccac 14
<210> 13
<211> 13
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
gctccacagc atc 13
- 一种用于检测SLC22A5基因高频致病变异的荧光定量PCR探针引物组和试剂盒
- 一种用于检测高频基因致病变异的引物组和探针组及试剂盒
