USP35作为用药靶标在制备治疗肾细胞癌的药物中的用途
文献发布时间:2023-06-19 18:37:28
技术领域
本申请涉及医药技术领域,具体涉及去泛素化酶USP35作为用药靶标在制备药物中的用途,更具体涉及去泛素化酶USP35在制备治疗肾透明细胞癌的药物中的应用。
背景技术
肾细胞癌是常见的泌尿系统恶性肿瘤,全球平均每年新增430000例。肾透明细胞癌是肾细胞癌的主要组织学亚型,约占全部病例的75%,乳头状肾细胞癌和嫌色细胞癌分别占15%和5%。肾透明细胞癌也是引发肾细胞癌相关死亡的主要亚型,因此肾透明细胞癌是临床研究的焦点。
肾癌的临床治疗经历了非特异性免疫疗法、针对特意受体的靶向治疗和目前新的免疫治疗药物几个阶段。非特异性免疫疗法主要是使用IL-2和IFN-α等细胞因子,但细胞因子使用剂量高,收效微;靶向治疗主要包括血管内皮生长因子和血小板源生长因子等相关受体的配体,mTOR、MET和AXL等酪氨酸蛋白激酶受体的抑制剂等;免疫治疗药物主要是免疫检验点抑制剂,如PD-1抑制剂纳武单抗和帕博利珠单抗。虽然新的治疗策略取得了一定疗效,但药物治疗的优化组合仍不明确,剂量强度、患者选择性和治疗时间等仍是有待优化的关键方面,新的特异性的生物靶点的鉴定能够为个性化治疗方案的制订提供有力支撑。
发明内容
本发明要解决的技术问题是寻找USP35在肾透明细胞癌发生发展中的作用机制,并由此提出去泛素化酶USP35作为用药靶标在制备治疗肾透明细胞癌药物中的用途。
USP家族是去泛素化酶最大的家族,包含50多种半胱氨酸蛋白酶。USPs与多种肿瘤的发生发展密切相关,被认为是肿瘤治疗的潜在靶点。本发明聚焦USP家族,筛选出USP35通过拮抗凋亡和铁死亡促进肾透明细胞癌生长。本发明揭示了USP35通过发挥去泛素化酶功能稳定凋亡抑制蛋白和氧化还原调节蛋白NRF2的表达,抵抗细胞凋亡和铁死亡的发生。抑制USP35表达能够诱导凋亡和铁死亡,进而抑制肾透明细胞癌生长,为肾透明细胞癌的临床治疗提供潜在靶点。
通过研究发现,USP35以酶活依赖的方式稳定5种凋亡抑制蛋白(cIAP1,cIAP2,XIAP,Survivin,Livin)的水平,抑制细胞凋亡。USP35以酶活依赖的方式稳定NRF2表达,抑制细胞铁死亡。USP35缺失会降低上述凋亡抑制蛋白和NRF2蛋白水平,诱导细胞凋亡和铁死亡,抑制肾透明细胞癌生长。
具体而言,本发明研究发现:
(1)通过对去泛素化酶USP家族系统性筛选,鉴定出USP35与肾透明细胞癌发生发展密切相关;
(2)USP35通过稳定5种凋亡抑制蛋白的表达抑制细胞凋亡,包括cIAP1,cIAP2,XIAP,Survivin和Livin;
(3)USP35催化NRF2去泛素化,稳定NRF2表达;
(4)USP35缺失抑制肾透明细胞癌细胞生长;
(5)USP35缺失抑制裸鼠肾透明细胞癌移植瘤生长。
根据以上意外的发现完成本发明,并提出了USP35通过相互作用底物调控在肾透明细胞癌发生中的作用。
一方面,本发明提供去泛素化酶USP35作为用药靶标在制备治疗肿瘤的药物中的用途。
另一方面,本发明提供沉默去泛素化酶USP35表达和/或抑制去泛素化酶USP35活性的物质在制备治疗肿瘤的药物中的用途。
优选的,所述肿瘤为肾细胞癌。
优选的,所述肾细胞癌为肾透明细胞癌。
进一步地,本发明还提供去泛素化酶USP35作为用药靶标在制备抑制肾细胞癌生长的药物中的用途。
进一步地,本发明还提供沉默去泛素化酶USP35表达和/或抑制去泛素化酶USP35活性的物质在制备抑制肾细胞癌生长的药物中的用途。
优选的,所述去泛素化酶USP35通过稳定多种凋亡抑制蛋白和NRF2表达抑制肾透明细胞癌细胞凋亡和铁死亡,其包含:(1)USP35以酶活依赖的方式稳定5种凋亡抑制蛋白的表达,抑制细胞凋亡;和(2)USP35以酶活依赖的方式稳定NRF2表达,抑制细胞铁死亡。
优选的,所述USP35稳定的5种凋亡抑制蛋白是指cIAP1,cIAP2,XIAP,Survivin和Livin。
优选的,所述USP35抑制细胞铁死亡是指USP35降低NRF2泛素化水平,抑制NRF2降解,增强细胞抵抗铁死亡的能力。
进一步的,本发明还提供了去泛素化酶USP35缺失会降低上述凋亡抑制蛋白和NRF2蛋白水平,诱发细胞凋亡和铁死亡,抑制肾透明细胞癌生长。
与现有技术相比,本发明的有益效果是:
(1)针对人源去泛素化酶在肾透明细胞癌发生发展的中的作用和机制仍需深入探究,本发明筛选并鉴定了人源去泛素化酶USP35作为肿瘤促进因子在肾透明细胞癌发生发展中的促癌作用。
(2)针对USP35是如何调控肿瘤发生的这一问题,本发明阐明了USP35通过稳定5种凋亡抑制蛋白和NRF2蛋白表达,抑制肾透明细胞癌凋亡和铁死亡的发生,从而促进肿瘤发生发展的作用机制。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1为本发明实施例1中USP35和6种IAP蛋白表达水平检测结果图;
图2为本发明实施例1中USP35与IAPs相互作用结果图;其中A为USP35与Survivin相互作用结果图,B为USP35与clAP2相互作用结果图,C为USP35与XIAP相互作用结果图,D表明野生型USP35有效降低cIAP2蛋白泛素化水平,E表明野生型USP35有效降低XIAP蛋白泛素化水平。
图3为本发明实施例2中验证USP35催化NRF2去泛素化,稳定NRF2表达的实验结果图,其中,A图表明USP35敲低的肾透明细胞癌细胞系OS-RC-2,769-P和786-O中NRF2蛋白水平显著降低;B图表明过表达USP35以剂量依赖的方式稳定NRF2表达;C图表明USP35与NRF2相互作用;D图表明过表达USP35有效抑制NRF2泛素化,而酶活突变的USP35对NRF2泛素化没有影响。
图4为本发明实施例3中验证USP35抑制肾透明细胞癌发生铁死亡的实验结果图,其中,A、B图表明DOX诱导的USP35敲低能够显著增强RSL-3诱导的铁死亡;C图表明在USP35缺失的细胞中恢复NRF2表达有效缓解RSL-3诱导的铁死亡。
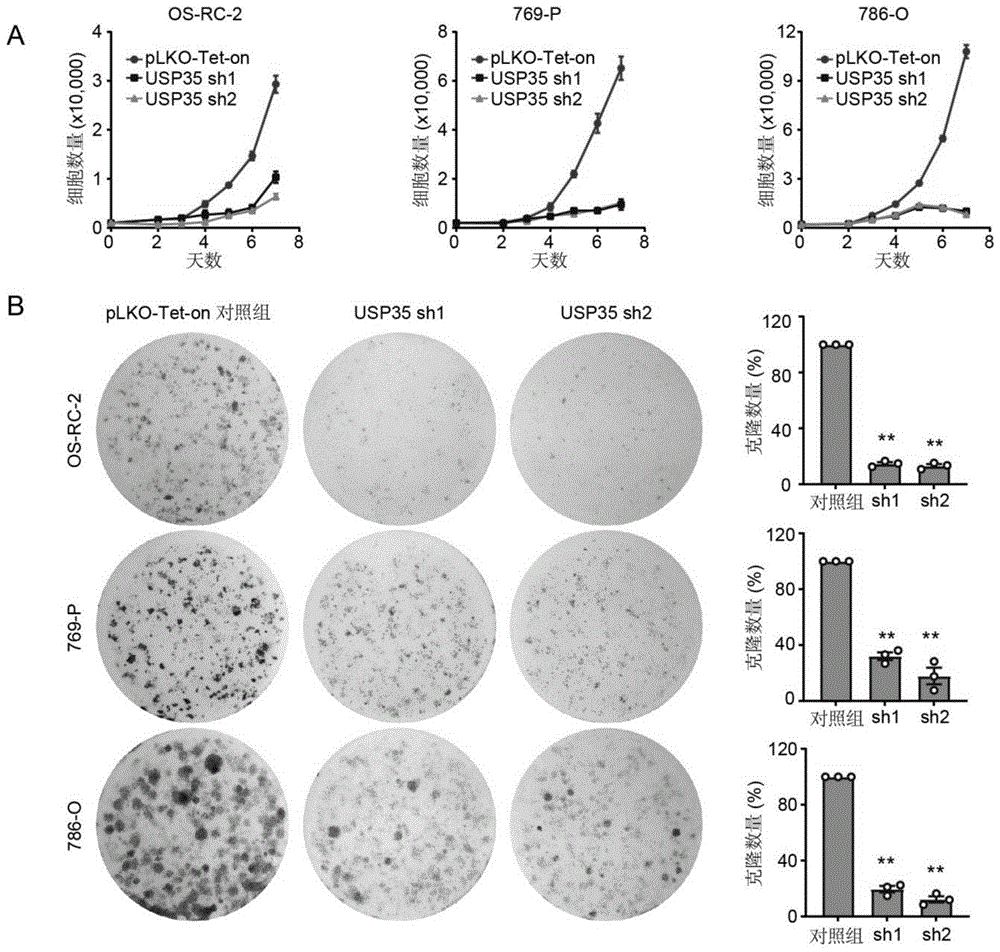
图5为本发明实施例4中验证USP35缺失抑制肾透明细胞癌细胞生长的实验结果图,其中,A图表明USP35敲低的细胞系7天的细胞数目显著降低;B图表明敲低USP35的细胞克隆数目明显减少。
图6为本发明实施例4中检测USP52缺失对肾透明细胞癌细胞生长作用的实验结果图,其中,A图表明USP52敲低的细胞系7天的细胞数目没有显著改变;B图表明敲低USP52细胞克隆数目没有显著性改变。
图7为本发明实施例5中验证USP35缺失抑制裸鼠肾透明细胞癌移植瘤生长的实验结果图。
具体实施方式
以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
实施例1、USP35通过稳定多种凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)表达抑制细胞凋亡
用于外源共表达的USP35和6种人源IAPs的质粒信息如下:
表1:质粒构建信息表
其中,HA标签的载体质粒为pCDNA3-HA,Flag标签的载体质粒为pCDNA3.1-Flag,3Flag标签的载体质粒为p3Flag-CMV-7.1。
表2:USP35 C450A突变体质粒构建信息表
在NCBI网站查找USP35基因的CDS序列,并将编码450位半胱氨酸的密码子改为编码丙氨酸的密码子,设计前后引物(如表2),搭配表1中构建野生型USP35的引物,构建USP35C450A突变体。同样,HA标签的载体质粒为pCDNA3-HA,3Flag标签的载体质粒为p3Flag-CMV-7.1。
为确保质粒的保真性,所有目的片段扩增均使用Q5高保真DNA聚合酶,反应体系如表3。
表3:Q5高保真DNA聚合酶反应体系表
将以上反应体系在PCR仪上进行扩增,扩增程序如表4。
表4:Q5高保真DNA聚合酶扩增程序表
扩增完成后,配制0.8%的琼脂糖凝胶,将PCR的产物按120V电压电泳,最后使用Axygen切胶回收试剂盒进行回收,详细步骤如下。
1、电泳30分钟后,将目的条带切下,称凝胶的重量,按对应重量加入3倍体积的Buffer DE-A,置于75℃的金属浴上加热至完全溶解。
2、溶解完全的凝胶中加入1.5倍体积的Buffer DE-B至,混匀并加入放在2ml DNA提取制备管中,室温12000g离心1分钟。
3、弃掉滤液,向制备管中加入500μl Buffer W1,室温12000g离心1分钟。
4、弃掉滤液,向制备管中加入700μl Buffer W2,室温12000g离心1分钟。重复该步骤。
5、将制备管放入新的1.5ml离心管中,加入25μl无菌水,静置2分钟,12000g离心1分钟。即为纯化的PCR产物。
纯化完成后用对应的限制性内切酶将载体和目的基因PCR产物酶切,用Axygenclean up试剂盒回收酶切产物,详细步骤如下。
1、用对应的限制性内切酶将载体和目的基因PCR产物酶切,用Axygen clean up试剂盒回收酶切产物,详细步骤如下。
2、向酶切产物或PCR产物中加入3倍体积的Buffer PCR-A,混合均匀并转移到2ml的DNA制备管中,室温12000g离心1分钟。
3、弃掉滤液,向制备管中加入700μl的Buffer W2,室温12000g离心1分钟。
4、弃掉滤液,向制备管中加入400μl的Buffer W2,室温12000g离心1分钟。
5、弃掉滤液,室温12000g空离1分钟。
6、将制备管放入新的1.5ml离心管中,加入25μl无菌水,静置3分钟,12000g离心1分钟,得到具有粘性末端的载体和目的基因。
用T4 DNA连接酶将载体与目的基因连接,载体和目的片段摩尔比为1:3,反应体系如表5。
表5:T4 DNA连接酶反应体系表
16℃连接过夜或者25℃连接2小时,接着进行转化,转化步骤如下。
1、在-80℃冰箱取出制备好的Trans T1感受态,冰上解冻,将10μl的连接产物加入到100μl的感受态中,在冰上冰浴30分钟。
2、将水浴锅温度调至42℃,感受态在42℃水浴中热击1分钟。
3、热击好的感受态放置在冰上5分钟。
4、接着在感受态中加入1ml不含抗生素的LB液体培养基,放在摇床中37℃,220rpm每分钟,摇1小时。
5、将感受态放在离心机中4000g离心5分钟,去上清,100μl的培养基重悬沉淀,用涂布棒将菌液均匀涂布在含相应抗生素的LB固体培养基上。
6、将细菌培养皿放在37℃培养箱中培养12-16小时。
7、挑取细菌单克隆扩大培养,测序鉴定阳性克隆并提取质粒。
利用质粒提取试剂盒提质粒,提取步骤如下。
1、配置含100μg/ml氨苄霉素抗性的液体LB培养基,按每管5ml分装至15ml无菌离心管中,接种阳性克隆,37℃摇床中按220rpm每分钟摇12-16小时。
2、菌液放入离心机7000g离心5分钟,弃上清,留取沉淀。
3、用250μl Buffer S1重悬细菌沉淀,转移到1.5ml无菌Ep管中。
4、向Ep管中加入250μl的Buffer S2,上下颠倒几次使溶液透亮,菌体裂解充分,时间不宜超过5分钟。
5、向Ep管中加入350μl的Buffer S3,上下颠倒,直至出现白色絮状沉淀,12000g离心10分钟。
6、将离心后的上清转移至制备管中,12000g离心1分钟,弃掉滤液。
7、将制备管放回2ml离心管中,向制备管中加入500μl的Buffer W1,12000g离心1分,弃掉滤液。
8、将制备管重新放回2ml离心管中,向制备管中加入700μl的Buffer W2,12000g离心1分钟,弃掉滤液。重复该步骤。
9、将制备管放回2ml离心管中,12000g空离1分钟,充分去掉残留液体,开盖室温放置2-5分钟。
10、将制备管放入新的1.5ml离心管中,加入60μl无菌水,静置3分钟,12000g离心1分钟。纯化得到的质粒再次测序,序列准确无误后进行后续实验。
在本实施例中,外源性共表达USP35和6种人源IAPs蛋白,包括cIAP1,cIAP2,XIAP,Survivin,Livin和BIRC8,利用不同标签通过免疫印迹实验分别检测USP35和6种IAP蛋白表达水平,结果表明,野生型USP35能够增加5种IAP蛋白表达,包括cIAP1,cIAP2,XIAP,Survivin和Livin【图1A和B】,而USP35酶活突变体(C450A,C450A表示USP35酶活突变体,即酶活位点450位半胱氨酸(C)突变为丙氨酸(A))不影响IAP蛋白水平【图1A和B】,说明USP35以酶活性依赖的方式稳定cIAP1,cIAP2,XIAP,Survivin和Livin蛋白表达。
图1为USP35和6种IAP蛋白表达水平检测结果,其中,C450A表示USP35酶活突变体,即酶活位点450位半胱氨酸(C)突变为丙氨酸(A)。
然后我们从中选取了Survivin,cIAP2和XIAP蛋白进行免疫共沉淀实验用以检测USP35与IAPs相互作用情况,具体地,在细胞中分别共转染带不同标签的USP35和Survivin、USP35和cIAP2、USP35和XIAP,使用USP35标签抗体进行免疫沉淀,然后通过免疫印迹实验分别检测目的蛋白Survivin、cIAP2和XIAP是否与USP35存在相互作用。结果表明Survivin,cIAP2和XIAP均能与USP35发生相互作用【图2A,B和C】。进一步对IAPs泛素化水平进行检测,鉴于Survivin泛素化信号会被抗体免疫球蛋白重链(50KDa)和轻链(25KDa)掩盖,我们选取了cIAP2和XIAP蛋白进行泛素化水平检测,具体地,在细胞中分别共转染USP35和cIAP2、USP35酶活突变体C450A和cIAP2,经蛋白酶体抑制剂PS-341处理用以抑制蛋白降解,分别使用cIAP2和XIAP的标签抗体Flag进行免疫沉淀,然后利用泛素抗体通过免疫印迹实验检测cIAP2和XIAP蛋白的泛素化水平。结果表明野生型USP35能够有效降低cIAP2和XIAP蛋白泛素化水平,USP35酶活突变体对cIAP2和XIAP蛋白泛素化水平没有影响【图2D和E】。上述结果说明USP35通过降低IAPs泛素化水平,稳定cIAP1,cIAP2,XIAP,Survivin和Livin蛋白表达。
实施例2、USP35催化NRF2去泛素化,稳定NRF2表达
为进一步寻找USP35调控的其他底物蛋白,在本实施例中,首先利用慢病毒感染-药物筛选法构建USP35敲低的肾透明细胞癌细胞系OS-RC-2、769-P和786-O,具体地,在HEK293细胞中进行慢病毒包裹,裂解细胞获得携带目的质粒的慢病毒,然后在OS-RC-2、769-P和786-O细胞中进行慢病毒感染,利用嘌呤霉素筛选稳转细胞株。转录组测序结果的致癌基因集富集分析(Oncogenic signature enrichment analysis)结果显示编码NRF2的基因NFE2L2具有显著性差异改变,我们进一步利用免疫印迹实验检测USP35缺失对NRF2蛋白表达的影响,结果显示在USP35敲低的肾透明细胞癌细胞系OS-RC-2,769-P和786-O中NRF2蛋白水平显著降低【图3A】。过表达USP35以剂量依赖的方式稳定NRF2表达【图3B】。免疫共沉淀结果表明USP35与NRF2相互作用【图3C】。
Keap1是调控NRF2泛素化的关键因子,通过整合到cullin-3-Rbx泛素连接酶上促进NRF2泛素化。免疫沉淀结果表明Keap1过表达显著升高NRF2泛素化水平,过表达USP35能够有效抑制NRF2泛素化,而酶活突变的USP35对NRF2泛素化没有影响【图3D】。上述结果说明USP35通过拮抗泛素化介导的NRF2蛋白酶体降解,稳定NRF2表达。
实施例3、USP35抑制肾透明细胞癌发生铁死亡
NRF2是细胞氧化还原调控的关键蛋白,能够拮抗铁死亡的发生。鉴于上述结果揭示USP35能够调控NRF2泛素化和稳定性,本实施例进一步研究USP35通过调控NRF2对肾透明细胞癌铁死亡的作用。在USP35野生型和敲低的肾透明细胞癌OS-RC-2和769-P细胞中,分别经铁死亡诱导剂RSL3以及RSL3与铁死亡抑制剂ferrostatin-1联合处理,利用PI染色实验检测细胞发生铁死亡情况,结果显示,USP35敲低能够显著增强RSL3诱导的铁死亡,铁死亡抑制剂ferrostatin-1有效抑制USP35缺失增强的铁死亡【图4A和B】。为了进一步证明NRF2在USP35缺失引发的细胞铁死亡敏感性增强中的作用,利用质粒外源转染技术在USP35缺失的细胞中恢复NRF2表达,PI染色实验显示恢复NRF2表达会有效缓解RSL3诱导的铁死亡【图4C】。由此说明,USP35通过稳定NRF2表达水平抵抗肾透明细胞癌铁死亡的发生。
实施例4、USP35缺失抑制肾透明细胞癌细胞生长
为了明确USP35对细胞生长的影响,利用实施例2中构建的USP35敲低的肾透明细胞癌细胞系OS-RC-2、769-P和786-O,通过细胞计数实验和克隆形成实验检测USP35表达水平对细胞生长的影响。细胞计数结果表明,USP35敲低的细胞系7天的细胞数目显著降低【图5A】,细胞克隆实验也显示,敲低USP35的细胞克隆数目明显减少【图5B】。由此说明,USP35敲低能够有效抑制细胞增殖。
利用慢病毒感染-药物筛选法构建USP52敲低的肾透明细胞癌细胞系OS-RC-2和769-P(具体构建方法同实施例2),利用细胞计数和克隆形成实验检测USP52缺失对肾透明细胞癌生长的作用。细胞计数结果显示USP52野生型和敲低细胞系7天的细胞数目没有显著差异,细胞克隆实验显示USP52野生型和敲低细胞克隆数目没有显著性改变【图6A和B】。该实验结果说明USP52敲低对肾透明细胞癌细胞生长没有显著影响。
实施例5、USP35缺失抑制裸鼠肾透明细胞癌移植瘤生长
为了探究USP35缺失对免疫缺陷小鼠肾透明细胞癌移植瘤发生的作用,本实施例使用6周龄balb/c雌性裸鼠,每组8只,利用实施例2中构建的肾透明细胞癌OS-RC-2细胞和OS-RC-2USP35低表达细胞系分别进行裸鼠皮下注射。接种7天后,腹腔注射DOX用以诱导USP35表达沉默。与体外结果相一致,小鼠移植瘤体积和重量统计结果均显示USP35缺失会显著抑制移植瘤的形成【图7A,B和C】。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
