协氧蛋白FHb及其重组菌X33-pPICZαA-102C300C-FHb2和应用
文献发布时间:2023-06-19 19:20:08
技术领域
本发明属于基因工程技术领域,具体地涉及一种协氧蛋白FHb及其重组菌X33-pPICZαA-102C300C-FHb2和应用。
背景技术
毕赤酵母是继大肠杆菌之后最常用的蛋白质表达系统,目前它广泛用于实验室规模的蛋白质制备、表征和结构分析。在生物药物领域,可通过毕赤酵母表达生产各种蛋白质,例如胰岛素、乙型肝炎表面抗原、人血清白蛋白和表皮生长因子等。与大肠杆菌和枯草芽孢表达系统相比具有许多优点,例如可以实现有效的分泌表达,减少后期分离和纯化目标蛋白所需的工作量,外源基因整合到基因组中可稳定表达以及简便廉价的高密度生物质积累。
毕赤酵母X33属于野生型菌株,可以快速利用甲醇,将重组载体整合到菌株基因组上,结合载体上的醇氧化酶启动子(AOX),控制外源蛋白在宿主中的表达。当前,在发酵过程中,由于毕赤酵母为高好氧微生物,常常会因为设备供氧能力有限,限制了细胞密度和氧化降解甲醇的速率,从而限制其目标蛋白的表达量。
黄素血红蛋白(Flavohemoglobin,FHb)是一类存在于细菌、酵母等单细胞生物中的血红蛋白。它包含一个n端血红蛋白结构域和一个c端氧化还原酶结构域,它们具有NAD(P)H和FAD的潜在结合位点。FHb被认为在O
针对毕赤酵母高密度发酵过程中氧气利用率的问题,本发明通过克隆黄素血红蛋白基因FHb,构建了产褐藻胶裂解酶的高表达菌株,提高了菌体在发酵后期低氧环境中对氧气的利用率,最终提高了褐藻胶裂解酶的产量。
发明内容
本发明要解决的技术问题在于提供一种协氧蛋白FHb及其重组工程菌X33-pPICZαA-102C300C-FHb-2和应用,所述协氧蛋白能够提高毕赤酵母工程菌分泌褐藻胶裂解酶的效率。
本发明是通过下述技术方案实现:
一种协氧蛋白FHb的基因,其核苷酸序列如SEQ ID N0.1所示。
所述协氧蛋白FHb,其氨基酸序列如SEQ ID N0.2所示。
一种重组表达载体,所述重组表达载体包含所述褐藻胶裂解酶基因和协氧蛋白FHb的基因,所述褐藻胶裂解酶基因的核苷酸序列如SEQ ID N0.3所示。
一种重组菌X33-pPICZαA-102C300C-FHb2,所述重组菌包括所述重组表达载体,将所述协氧蛋白FHb的基因连接到褐藻胶裂解酶基因的末端,形成串联表达盒。
所述协氧蛋白FHb的基因在提高褐藻胶裂解酶分泌效率中的应用,所述的褐藻胶裂解酶分泌表达为在真核表达系统中分泌表达。
优选为毕赤酵母菌X33表达系统。
协氧蛋白FHb的基因:
atgactgccccagaaatctaccagatccaggatttgactgaggaccaaaagaccttcatcagaaactccgtgccaatcttga
aggacgctggtgaaactttgaccgccaagttctaccagtacatgatctccaactacgacgaggtcaagccatacttcaacg
agactaaccagaagctgctgaagcagccaagaattttggccttcgccttgttgaagtacgccgagaacattgacgacttgtc
cccattgactgctttcgttcaccagatcgttgttaagcacgttggtctgcagattaaggctgagcactacccaatcgttggtgg
ttccttgcttaagactatggccgagttgttgggtccagaattggctactccagctttcttgaaggcttgggctactgcttacggt
aacttggcccagattttgatcaacgctgaatgggccgagttccaaaagcaaaagtggcacgacttcaaagagttcaaggtc
accaagatcgagaacgagtgtgacgacgttaagtccgtttacttcactccagttgagggtgagatcgctaagccattggatg
gtcagtacgtctgcatcagatggaagttgccaggtgagaagttcgagaagtctagagagtactccttgtcctccagaccaa
acaacaacacctacagaatctccgtcagactgttggagaacggtaagatttccaccttcgtccacaaccagttgaaggtcg
gtgacatcattactgttgctcctccagctggtcagttgttgtacgaagaatctcagaaggacgccgttttcttcatcggtggtat
tggtatcaccccagtcgtgtccattatggaaactgctttggagagaggtcagagggtcactttgttctactccaacagaactt
ccaagtccaccgctttcagaggttggttgaaagagctgaagtccaagttcaacttgcagctgaccgtgaaagagttcgtttc
cgaggaacaagttactgagggtgtcgaccagattaactccgctcaattgcagagatccgacatccaaactgtttccccaga
gaacgaggtttacttggttggtccagttccatatatgcagttcgtgtcctccgagttgaacaagttgggtgttcagaacatccactccgagttcttcggtccaactgttgttgcttaa.
协氧蛋白FHb的氨基酸序列:
MTAPEIYQIQDLTEDQKTFIRNSVPILKDAGETLTAKFYQYMISNYDEVKPYFN
ETNQKLLKQPRILAFALLKYAENIDDLSPLTAFVHQIVVKHVGLQIKAEHYPIV
GGSLLKTMAELLGPELATPAFLKAWATAYGNLAQILINAEWAEFQKQKWHDF
KEFKVTKIENECDDVKSVYFTPVEGEIAKPLDGQYVCIRWKLPGEKFEKSREY
SLSSRPNNNTYRISVRLLENGKISTFVHNQLKVGDIITVAPPAGQLLYEESQKD
AVFFIGGIGITPVVSIMETALERGQRVTLFYSNRTSKSTAFRGWLKELKSKFNL
QLTVKEFVSEEQVTEGVDQINSAQLQRSDIQTVSPENEVYLVGPVPYMQFVSSELNKLGVQNIHSEFFGPTVVA.
褐藻胶裂解酶的基因:
actgaatctggttctggttcttcttctggtggttcttcctccggatcttcttcttcctcatcctcttccggtggatcatcctctggtg
gatcaggtggtagtagttcaggtggatctttggacccaaacttgccaccatcttccaacttcgatttgtccgcttggtacttgtc
cgttccaactgataacaacggtgacggtaaggccgactccatcaaagaaaacgatttgaacgctggttacgccgacggta
cttacttttacactgctgctgatggtggtatggtgttcagatgtccaatctgtggttacaagacttctaccaacacctcctacac
cagaaccgagttgagagaaatgctgagaagaggtgacacctccattgctactcaaggtgtcaacggtaacaactgggtttt
cggttctgctccagcttccgctagagaagctgctggtggtgtagatggtgttttgagagctactttggccgttaaccacgttac
tactactggtgactctggtcaggttggtagagttatcgttggtcagatccacgctaacaacgacgaaccattgagactgtact
acagaaagttgccaggtcactccaagggttccgtttacattgctcatgaacctaacggtggttccgactcttggtacgacatg
attggttctagatcctcctctgcttctgacccatctgacggtattgctttggacgaagtttggtcctacgaggttaaggttgtcg
gtaacactttgaccgtgaccatcttcagagctggtaaggacgacgttgttcaggttgttgacatgggtaactccggttacgat
gttgctgaccagtaccagtacttcaaggccggtgtttacaaccagaacaatactggtaactgttccgactacgttcaggttactttctacgctttggagcaatctcacgatcatcatcaccatcaccactaa.
本发明相对于现有技术具有益效果:
1、本发明通过在核苷酸序列为SEQ ID N0.3,即原褐藻胶裂解酶基因的末端,构建协氧蛋白基因FHb与褐藻胶裂解酶编码基因相结合的表达载体,提高了产褐藻胶裂解酶工程菌在低氧环境中的分泌表达。
2、本发明提供了一种协氧蛋白FHb的基因,能在低氧的环境中提高菌体对氧气的利用率,实现褐藻胶裂解酶的高表达,特别是为毕赤酵母菌表达褐藻胶裂解酶基因提供了有效的元件。
附图说明
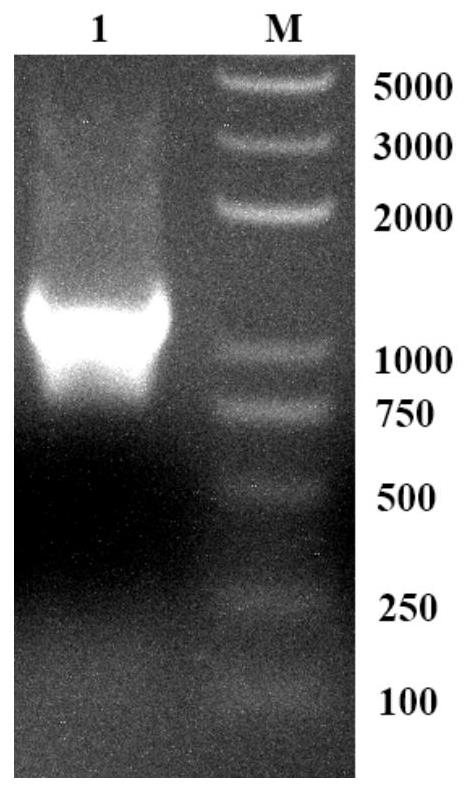
图1是实施例1中扩增协氧蛋白FHb的基因电泳图;其中泳道M:marker DNA;泳道1为协氧蛋白FHb的基因片段;
图2是实施例1中pPICZαA-102C300C-FHb重组质粒构建示意图;
图3是实施例2中构建协氧蛋白FHb的基因的工程菌与改造前的对照组干重的比较图;
图4是实施例2中构建协氧蛋白FHb的基因的工程菌与改造前的对照组褐藻胶裂解酶酶活的比较图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
以下实施例中所采用的的分子生物学实验技术包括PCR扩增、质粒提取、DNA片段连接、凝胶电泳等具体参见《分子克隆实验指南》(第三版)(Sambrook J,Russell DW,Janssen K,Argentine J.黄培堂等译,2002,北京:科学出版社)。
实施例1协氧蛋白重组工程菌的构建和筛选
通过一步克隆的方式,构建协氧蛋白FHb的基因与褐藻胶裂解酶基因相结合的表达载体,结合高通量的筛选方法,从克隆中获得褐藻胶裂解酶活力最高的阳性克隆子,具体包括以下步骤:
(1)FHb基因的调取及纯化:协氧蛋白原始序列从National Center forBiotechnology Information网站上下载,原始序列如SEQ ID N0.6所示,经密码子优化后人工合成,连接在pUC57质粒上,构建pUC57-FHb菌株。提取pUC57-FHb菌株的质粒(
正向引物:5'-caccatcaccactaagcggccgccaagcttgatgactgcccca-3',
反向引物5'-tgttctagaaagctggcggccgcttaagcaacaacagttggaccg-3'。
协氧蛋白FHb的基因的原始序列:
atgaccgctccagaaatctatcagattcaagacctcactgaggaccagaagactttcattaggaactcagttcctattt tgaaggacgctggagaaactttgactgctaagttttatcagtacatgatttctaattatgatgaagtcaagccatactttaatgagacaaatcaaaaactgttgaaacagcccaggattttagcgtttgctctcctcaagtatgcagaaaacattgacgatttgagcccgctaactgctttcgttcaccagatcgttgtaaagcatgttggactgcagattaaagctgagcactacccaattgtcggtggatcgttgttgaagacaatggctgaactcttgggacctgagcttgctacacctgcgtttctcaaggcatgggcaaccgcttacggaaatcttgctcaaatcctgataaacgctgaatgggcagagttccagaagcagaagtggcatgatttcaaagagtttaaagtgaccaaaatcgaaaatgaatgtgacgatgtgaagtctgtttatttcactccagtagaaggagagatagcaaaacctttggatgggcaatacgtctgcatcagatggaaattacctggggaaaagtttgagaaatctagggagtactctctttcttccaggccaaacaacaatacctacagaatctctgtcaggttgttggaaaatggtaaaatttcgacatttgttcacaatcaactgaaggtgggagacataatcactgtagcaccacccgctggacaattgttatacgaagaatctcaaaaggatgctgttttttttatcggaggtattggtatcactccagtagtatcaatcatggaaactgcccttgaaaggggtcagagagttacattattttactccaatagaacctcaaagagtactgcctttagaggttggttgaaagaactaaagagtaaattcaatttgcaactgacagtgaaggaattcgtctctgaagaacaagttactgaaggtgtagaccaaatcaattctgctcaattacagagatcagacatccaaacggtgtcgccggagaatgaagtttatctggttggacctgttccatacatgcagtttgttagctctgagctcaacaaactgggagtccaaaatattcattccgagttctttggaccaactgtggttgcttga.
(2)酶切线性化pPICZαA-102C300C质粒:用Not I(TaKaRa)单酶切pPICZαA-102C300C质粒,制得线性化载体片段。线性化的载体用Fast DigestDpn I进行消化处理,处理后的片段使用纯化试剂盒(
(3)pPICZαA-102C300C-FHb质粒的构建及验证:利用DNA无缝克隆(Clon ExpressII One Step Cloning Kit试剂盒),根据重组基因和线性化的pPICZαA-102C300C片段的DNA浓度,进行适当稀释后进行重组连接,将连接后的体系热激法转化E.coli DH5α,然后涂布LB(Zeocin)平板进行阳性重组子的筛选。以pPICZαA载体通用引物对构建的载体进行单克隆测序验证。pPICZαA-102C300C-FHb质粒的构建过程见图2。
(4)毕赤酵母菌株X33-pPICZαA-102C300C-FHb2的构建:将测序正确的转化子活化后提取质粒(
(5)重组菌株的高通量筛选:将阳性转化子挑选至48孔深孔板中进行培养,每个孔添加1mL BMGY液体培养基。30℃,200rpm,每24h添加1%甲醇,连续诱导3天。4000rpm离心5min,取上清进行褐藻胶裂解酶酶活力检测,筛选出酶活力高的菌株。
实施例2含协氧蛋白菌株的生长和产酶水平评价
(1)将实施例1构建的菌株与不含协氧蛋白FHb的基因构建的重组菌株作为对照组分别接种20mL液体YPD培养基中,37℃、200r/min震荡培养24h,作为种子液。
(2)吸取1mL种子液至20mL BMGY培养基,每24h添加1%甲醇进行诱导产酶,共诱导5次,前四天30℃、200r/min振荡培养,后两天30℃,50r/min振荡培养。每24h取2mL菌液5000r/min离心5min,沉淀测定干重,上清测定酶活。
(3)取洁净玻璃制的扁形称量瓶,置于105℃干燥箱中,瓶盖斜支于瓶边,加热2h,取出盖好,置干燥器内冷却0.5h,称量,并重复干燥至前后两次质量差不超过2mg,即为恒重。
(4)褐藻胶裂解酶的酶活测定采用DNS法,酶活力单位定义:1个酶活力单位(U)定义为每1min产生1μmol还原糖所需的酶量。
(5)毕赤酵母菌体干重和褐藻胶裂解酶酶活的测定:与对照组(13.05g/L)相比,由含协氧蛋白的产褐藻胶裂解酶毕赤酵母工程菌在发酵144h时干重为13.25g/L,呈上升趋势,而对照组的菌体量呈下降趋势,如图3所示。协氧蛋白FHb的基因可以使毕赤酵母在低氧环境中产褐藻胶裂解酶由7.76U/mL增加至10.46U/mL,增长了34.8%(见图4)。
- 蛋白质及基因的应用、以及重组载体、表达盒、重组菌及构建方法
- 一种铜绿假单胞菌疫苗重组蛋白SBP及其制备方法及应用
- 协氧蛋白FHb及其重组菌X33-pPICZαA-102C300C-FHb1和应用
- 协氧蛋白VHb及其重组菌X33-pPICZαA-102C300C-Vgb和应用
