一种蝎毒素来源的穿膜多肽的制备方法及应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医药工程技术领域,具体涉及一种细胞穿膜肽及其应用。
背景技术
蝎子又称为全蝎,为治风要药,具有息风镇痉、通络止痛、攻毒散结的功效,在典籍记载中,蝎子常以全蝎入药,但蝎子的药用价值主要在它的药理毒素成分。蝎毒中的活性成分主要由蛋白质成分和非蛋白质成分两部分组成,其中非蛋白质成分中主要含有粘多糖、组织胺、5-羟色胺、有机酸及微量元素等,而发挥主要功能作用的蛋白质成分则主要由小分子多肽组成,这些小分子多肽通常被称为蝎毒素,它们往往由20-80个氨基酸组成,在组成蝎毒素的这些氨基酸中又含有数个半胱氨酸,这些半胱氨酸可相互作用形成多个二硫键,这样的结构可以发挥蝎毒多肽的生物功能以及提高其稳定性。
目前所发现的蝎毒多肽已有300种,这些蝎毒多肽为离子通道抑制剂,其具有抗癫痫、抗血栓、抗肿瘤、镇痛等生物活性。除此以外,部分蝎毒多肽还具有细胞穿膜肽的特点,可以作为细胞穿膜肽的蝎毒素的氨基酸序列中往往会含有大量的精氨酸或赖氨酸等碱性基团,具有此特点的蝎毒素可以透过细胞膜进入细胞内发挥生物活性。
OpiCalcin1是一类从蝎子中分离得到的一种由33个氨基酸残基组成的具有细胞穿膜功能的肽类毒素,该肽由Cys3-Cys17,Cys10-Cys21和Cys16-Cys32三对二硫键构成,经过1HNMR测定发现,OpiCalcin1中含有一个半胱氨酸结的ICK基序和三条β链。OpiCalcin1是一个碱性多肽,在组成OpiCalcin1的33个氨基酸中,有11个氨基酸残基带有正电荷,有4个氨基酸残基带有负电荷,整条OpiCalcin1链的净电荷为正电荷;另外OpiCalcin1还是一条亲水性多肽,在全部的33个氨基酸残基中,极性氨基酸残基所占比例为58%。
本研究主要围绕蝎毒素OpiCalcin1系列多肽进行合成、纯化以及穿膜活性分析,以在之前的研究基础上进行进一步的功能探究,以将蝎毒素OpiCalcin1进行老药新用,发挥其新的药用价值。
发明内容
本发明依托上述研究进行,通过化学合成法合成了蝎毒素OpiCalcin1(简称Opi1)不同片段,并用异硫氰酸荧光素对其进行荧光标记,探究了蝎毒素Opi1系列穿膜肽的穿膜效果,在与TAT进行比对后发现了一种穿膜效果更好且毒性更小的细胞穿膜肽Opi1 17-33及Opi1 23-33,此细胞穿膜肽有望成为一种新型的细胞穿膜肽,为药物载体提供一种新的选择。
本发明的第一目的在于以截短的方式对OpiCalcin1多肽进行优化,提供了两条穿膜功能优异且细胞毒性较低的多肽Opi1 17-33 CSKKCKRRGTNPEKRCR和Opi1 23-33RRGTNPEKRCR。
本发明通过对蝎毒素OpiCalcin1的完整序列进行分析,并根据序列长度或碱基基序将其划分为:Opi1 1-16、Opi1 17-33、Opi1 1-11、Opi1 12-22、Opi1 23-33、FITC-Opi13-11、FITC-Opi1 16-24、FITC-Opi1 25-33这八部分,然后以成熟的细胞穿膜肽TAT作为阳性对照多肽。各肽段及阳性对照多肽的氨基酸序列及分子量如下表1所示:
表1不同OpiCalcin1肽段序列
流式细胞术结果显示,Opi1 17-33以及Opi1 23-33的细胞穿膜肽的穿膜效果较好,细胞内平均荧光强度要远远高于阳性对照肽TAT。接着,对这九条多肽进行细胞毒性分析,结果表明,TAT、Opi1 1-16、Opi1 17-33、Opi1 1-11细胞毒性较小,尤其是多肽Opi1 17-33不但穿膜效果高于TAT,而且细胞毒性也远小于TAT。
本发明第二目的,提供了上述细胞穿膜肽的制备方法,主要包括如下步骤:
1)对蝎毒素OpiCalcin1的完整序列进行分析,并根据序列长度以及碱基基序将其划分为:Opi1 1-16、Opi1 17-33、Opi1 1-11、Opi1 12-22、Opi1 23-33、FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33这8部分,然后以成熟的细胞穿膜肽TAT作为阳性对照多肽。
2)在序列确定好之后,采用Fmoc固相合成法对肽段进行合成:以氨基树脂或wang树脂为固相载体,然后选用Oxyma为活化剂,以DIC为缩合剂,在60℃条件下使氨基酸之间发生缩合反应,然后用茚三酮检测试剂来判断缩合反应是否反应完全,若反应完全,则连有氨基酸的树脂与茚三酮检测试剂在水浴加热条件下则不显色,若反应不完全则会显蓝紫色,此时,便需要重新进行反应。
3)在按照氨基酸序列使粗品多肽连接成功之后,则需要在末端连接一个连接基团,以使荧光素与多肽进行连接,选用芴甲氧羰基-6-氨基己酸(ACP)作为连接基团对FITC荧光素进行连接,使肽段得到绿色荧光标记。
4)将荧光标记好的多肽进行纯化和分析:用液相色谱法,在C18柱中进行分析与纯化,通过LC-MS判断目标峰的位置,然后依据出峰时间对目标峰进行收集,并通过分析型LC判断其纯度,之后用冻干机对纯的穿膜肽进行冻干,得到的荧光穿膜肽注意避光保存,以避免荧光猝灭。
5)经过前期合成并纯化出细胞穿膜肽在HEK293T细胞上进行穿膜活性分析:采用荧光显微镜以及流式细胞术对用细胞穿膜肽孵育之后的细胞进行定性和定量的分析,进而判断细胞穿膜肽的穿膜效果。
6)采用CCK8法针对前期合成的细胞穿膜肽进行细胞毒性分析。
本发明的第三目的,提供了细胞穿膜肽的应用,具体指在制备转运载体中的应用。该转运载体中的活性成分可包含细胞穿膜肽及其他活性成分,也可以以细胞穿膜肽作为唯一活性成分。
优选的,转运载体包括药物转运载体、核定位序列转运载体、探针转运载体。
由于细胞穿膜肽在对细胞不造成任何损伤的情况下便能进入细胞,并可以成功作为siRNA、核苷酸、大分子药物、蛋白质等的载体,在新型药物载体领域得到了广泛的应用。
除此以外,CPPs在细胞成像、核定位、pH敏感和热靶向递送等方面的应用受到了重视:
在细胞成像方面,细胞穿膜肽被用来通过在靶部位捕获标记的肽探针来促进内化。CPPs的高效率特性使其成为成像领域的一种很有前途的工具;在核定位方面,为了提高核定位效率,将带有核定位序列(NLSS)的CPPs直接或间接连接到DNA或基因载体上,可以促进核定位。
除此以外,由于肿瘤环境和生理环境之间的pH梯度,细胞穿膜肽通过与纳米粒进行连接,如酸降解交联,保护层的去除或酶降解,允许它们在肿瘤微环境中发挥控制作用。当细胞穿膜肽与含药的纳米颗粒进行连接时,提高了纳米颗粒的治疗效率,降低了药物毒性。
本发明第四目的,提供了一种转运载体,以上述细胞穿膜肽作为活性成分,将siRNA、核苷酸、大分子药物、蛋白质等药物,探针,核定位序列(NLSS),含药纳米颗粒转运至细胞内实现相应疗效。
本发明的有益保障及效果:
本发明提供了一种细胞穿膜肽、制备方法及应用,通过截短的方式对OpiCalcin1多肽进行优化,提供了两条穿膜功能优异且细胞毒性较低的多肽Opi1 17-33CSKKCKRRGTNPEKRCR和Opi1 23-33 RRGTNPEKRCR。通过实验验证,本发明的细胞穿膜肽穿膜效果优异且细胞毒性低,同时也克服了合成蝎毒素OpiCalcin1完整序列费时费力的缺陷。
本发明筛选得到的细胞穿膜肽可用于制备药物、核定位序列以及探针等的转运载体,提高靶向效率。与传统的以蝎毒入药相比,针对蝎毒素进行合成来探索其穿膜活性,为药物载体提供了一种新的选择。
附图说明
图1为Opi1细胞穿膜肽合成路线:(A)FITC-Opi1 1-16合成路线;(B)FITC-Opi117-33合成路线;(C)FITC-Opi1 1-11合成路线;(D)FITC-Opi1 12-22合成路线;(E)FITC-Opi1 23-33合成路线。
图2为TAT及Opi1细胞穿膜肽合成路线:(A)FITC-TAT合成路线;(B)FITC-Opi1 3-11合成路线;(C)FITC-Opi1 16-24合成路线;(D)FITC-Opi1 25-33合成路线。
图3为Opi1不同细胞穿膜肽的LC及ESI-MS分析结果:(A)FITC-Opi1 1-16粗品多肽的LC谱图,目标峰出峰时间为26.053min;(B)FITC-Opi1 1-16的ESI-MS结果,分子量为2346.6580;(C)FITC-Opi1 1-16多肽的纯化结果,纯度为:97.071%;(D)FITC-Opi1 17-33粗品多肽的LC谱图,目标峰出峰时间为13.981min;(E)FITC-Opi1 17-33的ESI-MS结果,分子量为2552.0160;(F)FITC-Opi1 17-33多肽的纯化结果,纯度为:95.872%;(G)FITC-Opi11-11粗品多肽的LC谱图,目标峰出峰时间为38.213min;(H)FITC-Opi1 1-11的ESI-MS结果,分子量为1771.1080;(I)FITC-Opi1 1-11多肽的纯化结果,纯度为:99.586%;(J)FITC-Opi1 12-22粗品多肽的LC谱图,目标峰出峰时间为16.112min;(K)FITC-Opi1 12-22的ESI-MS结果,分子量为1773.0030;(L)FITC-Opi1 12-22多肽的纯化结果,纯度为:96.668%;(M)FITC-Opi1 23-33粗品多肽的LC谱图,目标峰出峰时间为32.805min;(N)FITC-Opi1 23-33的ESI-MS结果,分子量为1875.1190;(O)FITC-Opi1 23-33多肽的纯化结果,纯度为:91.655%。
图4为TAT及Opi1细胞穿膜肽的LC及ESI-MS分析结果:(A)FITC-TAT粗品多肽的LC谱图,目标峰出峰时间为29.787min;(B)FITC-TAT的ESI-MS结果,分子量为2061.0704;(C)FITC-TAT多肽的纯化结果,纯度为:99.204%;(D)FITC-Opi1 3-11粗品多肽的LC谱图,目标峰出峰时间为33.833min;(E)FITC-Opi1 3-11的ESI-MS结果,分子量为1597.7356;(F)FITC-Opi13-11多肽的纯化结果,纯度为:99.586%;(G)FITC-Opi1 16-24粗品多肽的LC谱图,目标峰出峰时间为31.247min;(H)FITC-Opi1 16-24的ESI-MS结果,分子量为1612.6771;(I)FITC-Opi1 16-24多肽的纯化结果,纯度为:96.370%;(J)FITC-Opi125-33粗品多肽的LC谱图,目标峰出峰时间为31.318min;(K)FITC-Opi1 25-33的ESI-MS结果,分子量为1561.6442;(L)FITC-Opi1 25-33多肽的纯化结果,纯度为:92.106%。
图5为10μM浓度下,FITC标记的TAT及Opi1系列的不同穿膜肽在HEK293T细胞中的细胞摄取结果(比例尺为100px)对比。
图6为10μM浓度下,FITC标记的TAT及Opi1系列的不同穿膜肽在HEK293T细胞中的流式细胞检测结果对比。
图7为TAT及Opi1系列的不同穿膜肽在HEK293T细胞中的细胞毒性对比。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件进行。除非另外说明,否则百分比和份数按体积计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1、Opi1多肽片段合成
按照OpiCalcin1序列的长度不同将其分为Opi1 1-16、Opi1 17-33、Opi1 1-11、Opi1 12-22、Opi1 23-33这五条肽段进行合成,并对合成的肽段进行纯化,准备用于穿膜实验探究。
此外,大部分细胞穿膜肽的共同特征是组成他们的氨基酸序列中均含有大量的碱性氨基酸,在对OpiCalcin1序列进行分析时发现,在组成OpiCalcin1的33个氨基酸中有三部分的碱基基序,分别为Opi1 8-11 KRCK、Opi1 19-24 KKCKRR、Opi1 30-33 KRCR,因此,我们围绕这三段碱基基序进行了新的肽段的合成。根据OpiCalcin1的碱基基序的分布情况将其OpiCalcin1序列分为Opi1 3-11、Opi1 16-24和Opi1 25-33三段。
上述八条肽段序列参见上表1,采用Fmoc固相合成法以上八条多肽进行了合成,以及FITC荧光标记,用于后续的穿膜活性实验,并选用细胞穿膜肽TAT作为阳性对照多肽。
实施例2、细胞穿膜肽的合成及荧光标记
不同序列的细胞穿膜肽的合成方法近似,FITC-Opi1 1-16、FITC-Opi1 17-33、FITC-Opi1 1-11、FITC-Opi1 12-22、FITC-Opi1 23-33的合成路线参见图1;FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33以及阳性参照肽FITC-TAT的合成路线参见图2。具体合成过程如下:
A、细胞穿膜肽Opi1的合成
1)树脂准备与溶胀:称取400mg Rink Amide Resin(取代值=0.43mmol/g)置于多肽合成管中,加入25ml二氯甲烷(DCM)静置30min使其充分溶胀。待溶胀结束后将DCM抽掉,并用N,N-二甲基甲酰胺(DMF)将其冲洗5遍,操作结束后可见树脂层变厚。
2)脱Fmoc保护:所用的Rink Amide Resin具有Fmoc保护基,我们需脱掉Fmoc保护基以使氨基酸与树脂进行连接。脱Fmoc保护加入20%哌啶/7.1%Oxyma/DMF溶剂进行脱保护,第一次在接肽管中加入6ml脱保护混合试剂,置于35度气浴恒温振荡器中振摇5min,反应结束后抽干,再次加入6ml脱保护混合试剂,置于35度气浴恒温振荡器中振摇5min,脱保护结束后用DCM和DMF依次对其清洗5遍,之后取出部分树脂进行茚三酮检验,水浴加热3min后若树脂变为蓝紫色,则代表脱保护成功。
3)活化C端的第一个氨基酸:称取1mmol C端第一个氨基酸,加入活化剂Oxyma,用NMP进行充分溶解后加入DIC再次进行混匀,氨基酸活化时间1min,将活化后的氨基酸后加入放有树脂的接肽管中,在60℃,60R的条件下反应20min,使氨基酸与树脂进行缩合反应。缩合反应结束后用DCM及DMF依次清洗5遍,之后用毛细管蘸取少量数值加入茚三酮检测试剂进行检测,若树脂没有变蓝紫色,则说明氨基酸与载体树脂连接成功,若有部分变色,则说明氨基酸缩合反应反应不完全,则需要重新称取1mmol氨基酸并加入Oxyma活化剂、DIC缩合剂,重新投入接肽管中进行反应,反应条件仍然是60℃,60R的条件下反应20min,反应结束后继续用茚三酮试剂进行检测,观察是否反应完全。
4)脱Fmoc保护:连完C端第一个氨基酸后,需要脱掉第一个氨基酸上氨基的Fmoc保护基以使氨基酸与下一个氨基酸进行连接。脱Fmoc保护加入20%哌啶/7.1%Oxyma/DMF溶剂进行脱保护,第一次在接肽管中加入6ml脱保护混合试剂,置于35度气浴恒温振荡器中振摇5min,反应结束后抽干,再次加入6ml脱保护混合试剂,置于35度气浴恒温振荡器中振摇5min,脱保护结束后用DCM和DMF依次对其清洗5遍,之后取出部分树脂进行茚三酮检验,水浴加热3min后若树脂变为蓝紫色,则代表脱保护成功。
5)第一个氨基酸脱保护之后再对第二个氨基酸进行活化,活化步骤按照第一个氨基酸的步骤进行,并将活化后的氨基酸投入到接肽管中,使第二个氨基酸与第一个氨基酸进行缩合反应,反应结束后进行茚三酮检测,连接成功后对其进行脱Fmoc保护,并继续活化下一个氨基酸,操作步骤与前一个氨基酸一致,直至完成最后一个氨基酸的连接。
7)Linker的连接:为了使FITC与肽链更好的连接,我们选用芴甲氧羰基-6-氨基己酸(ACP)作为连接基团对FITC荧光素进行连接。对最后一个氨基酸进行脱保护之后,加入1mmol ACP,加入活化剂Oxyma,用NMP进行充分溶解后加入DIC再次进行混匀,ACP活化时间1min,将活化后的ACP加入放有树脂的接肽管中,在60℃,60R的条件下反应20min,使ACP与肽链进行连接,连接结束后用DCM和DMF对肽链依次冲洗5遍,然后用茚三酮进行检测,看其是否反应完全。
上述步骤中,茚三酮检测试剂的配制参见表2:
表2茚三酮检验试剂配制
茚三酮检测法用于检验在多肽合成过程中所用的氨基酸中氨基保护基Fmoc是否脱掉,以及氨基酸缩合反应是否反应完全的定性检测。当氨基裸露时,氨基能够与茚三酮反应产生颜色反应,除脯氨酸、羟脯氨酸和茚三酮反应生成黄色物质外,所有的α-氨基酸都能和茚三酮反应生成蓝紫色物质。检验时按照试剂1:试剂2=2:1的比例混合,将待检多肽加入茚三酮检测试剂中,水浴加热3min,观察其颜色变化。
B、对细胞穿膜肽Opi1进行荧光标记
1)FITC的连接:由于ACP上的氨基也具有Fmoc保护基团,所以在连接FITC之前需要对ACP进行脱Fmoc保护,ACP进行脱保护之后,称取6倍当量的FITC用DMF对其进行溶解后再加入12倍当量的DIEA,加接肽管中使FITC与肽链进行过夜避光反应,反应结束后取出接肽管,用DCM和DMF对其进行冲洗5遍,将未反应完全的FITC以及所用试剂洗掉。
3)树脂切割:序列中所有氨基酸全部连接完成后,准备TFA、苯酚、水以及TIPS准备进行切割,按照88%TFA、5%苯酚、5%ddH2O、2%TIPS进行切割液的配制,将配制好的切割液加入接肽管中,剧烈震荡3h,使固相树脂载体与目标肽链进行分离,并脱掉氨基酸侧链的保护基团。
4)粗品多肽的获得:将切割完成后的多肽过滤到离心管中,用氮气吹TFA,除去滤液中的TFA,然后用准备好的冰乙醚对肽链进行沉淀,3000rpm,离心5min,弃上清,沉淀即为粗品多肽。
C、对用FITC荧光标记细胞穿膜肽Opi1进行纯化和分析
粗品多肽的纯化:将粗品多肽用一定比例的水和乙腈进行溶解,溶解后的多肽用0.22μm的滤膜进行过滤,取部分滤液进行LC-MS分析,以确定目标肽段的出峰位置和验证目标肽段的分子量。LC-MS分析完成后按照下表3的洗脱梯度进行LC分析以及制备型LC的纯化,计算多肽的纯度以及保留时间。
表3 LC洗脱梯度
Opi1不同细胞穿膜肽的LC及ESI-MS分析结果参见图3和图4,各项结果汇总于下表4中:
表4 Opi1不同细胞穿膜肽的LC及ESI-MS分析结果
实施例3OpiCalcin1系列穿膜肽的透膜活性分析
1、细胞复苏。
从-80℃冰箱中取出冻存的HEK 293T细胞,冻存管迅速置于37℃水中快速摇晃震荡,使其迅速融化。然后用酒精擦拭冻存管管口,用吸管吸出细胞悬液转移到离心管中加入新鲜的培养基混匀,800rpm,离心5min。离心结束后,弃去上清液,加入适量含10%胎牛血清的DMEM培养基之后接种在培养瓶中并放入CO
2、细胞传代
从CO
3、细胞种板
从CO
4、细胞摄取实验
细胞消化计数后,用含血清的DMEM培养基将HEK293T细胞按每皿10000个细胞数目接种到24孔板中,培养48h,显微镜下观察细胞是否已完全贴壁。待细胞完全贴壁后吸走旧培养基,每孔分别加入1ml无血清培养基孵育2h。之后吸走旧培养基,每孔分别加入1ml含有10μM的FITC-CPPs的DMEM溶液,37℃条件下分别孵育2h。孵育完之后用PBS缓冲液清洗细胞2遍。加入200μl细胞固定液将细胞固定之后,用PBS清洗2遍,再加入DAPI进行孵育10min,再次用PBS进行清洗2遍。使用荧光显微镜,选择绿色通道和蓝色通道观察FITC-CPPs和DAPI的荧光效果。
5、流式细胞实验
细胞消化计数后,用含有血清的DMEM培养基将HEK 293T细胞按每孔20万细胞的数目接种在12孔细胞平板中,过夜培养。显微镜下观察细胞状态良好后,吸走旧培养基,每孔加入l ml无血清培养基,37℃下孵育2h。吸走旧培养基,每孔加入l ml含有10μM的FITC-CPP的DMEM溶液,每个样品设置3个平行复孔,37℃条件下孵育2h。加入PBS缓冲液冲洗3次。加入胰蛋白酶消化细胞2min后,加入冷的培养基终止消化,之后用移液器轻轻吹打细胞,并将细胞转移至离心管中,1200rpm,4℃,离心5min。离心后,弃去上清液,加入冷的0.5ml PBS缓冲液,重悬细胞并转移至流式管中,在流式细胞仪上测定每个样品的FITC荧光强度。
荧光显微镜观察显示,阳性对照组FITC-TAT、FITC-Opi1 17-33、FITC-Opi1 12-22、FITC-Opi1 23-33穿透细胞的效果较好,而FITC-Opi1 1-16、FITC-Opi1 1-11、FITC-Opi1 25-33的细胞穿透效果较差(图5)。
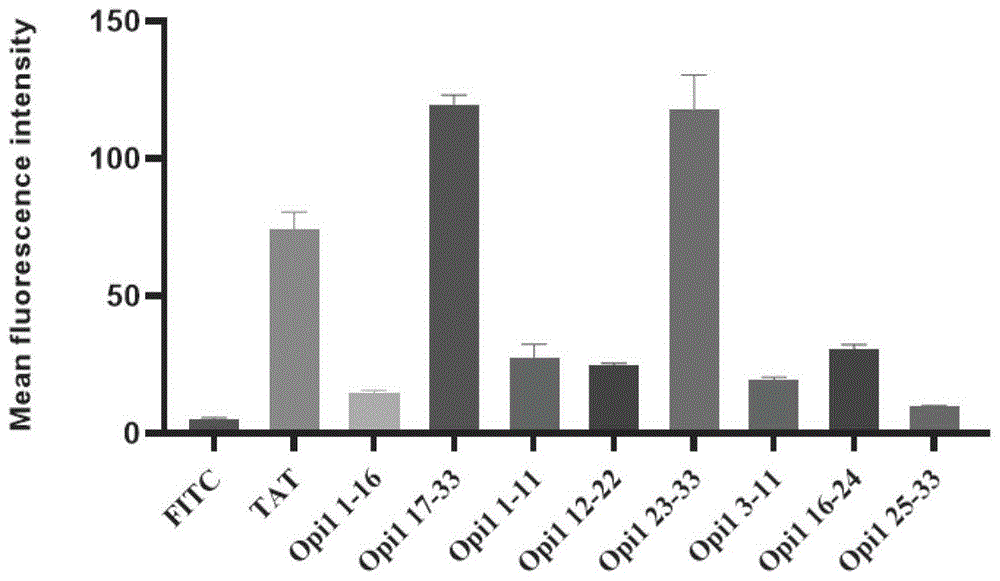
将FITC-TAT、FITC-Opi1 1-16、FITC-Opi1 17-33、FITC-Opi1 1-11、FITC-Opi112-22、FITC-Opi1 23-33、FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33这9条肽链以10μM的浓度孵育细胞,进行流式细胞分析,通过流式细胞实验对胞内平均荧光强度进行定量分析,分析结果显示:FITC-Opi1 17-33、FITC-Opi1 23-33的胞内平均荧光强度强于阳性对照组FITC-TAT,而阴性对照组未连多肽的FITC胞内几乎没有荧光,其余的多肽FITC-Opi1 1-16、FITC-Opi1 1-11、FITC-Opi1 12-22、FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33的穿膜效果较差(图6)。
实施例4 OpiCalcin1系列穿膜肽的细胞毒性分析
细胞穿膜肽作为一种新型的药物递送载体,需要对细胞没有或只有较低的毒性,因此我们对合成的FITC-Opi1 1-16、FITC-Opi1 17-33、FITC-Opi1 1-11、FITC-Opi1 12-22、FITC-Opi1 23-33、FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33这8条肽链以及阳性对照多肽TAT进行细胞毒性分析,对多肽的安全性进行评估。
采用CCK8细胞毒性评价。细胞消化计数后,用含有血清的DMEM培养基将HEK293T细胞按每孔8000个细胞的数目接种在96孔细胞培养板中,过夜培养。显微镜下观察细胞状态良好后,吸走旧培养基,每孔加入100μl含有10μM的FITC-CPP的DMEM溶液,每个样品设置4个平行复孔,37℃条件下孵育2h,之后在加入10μl WST-8试剂,在细胞培养箱中培养2h。最后将96孔板置于酶标仪上,在450nm波长下测定其吸收值。
细胞毒性分析结果如图7所示:在用10μM的细胞穿膜肽对细胞进行孵育两个小时后,细胞穿膜肽FITC-TAT、FITC-Opi1 1-16、FITC-Opi1 17-33、FITC-Opi1 1-11几乎没有细胞毒性,尤其是FITC-Opi1 17-33、FITC-Opi1 1-11对细胞的影响较阳性对照肽TAT的更小,符合细胞穿膜肽毒性低的特点;而FITC-Opi1 12-22、FITC-Opi1 23-33、FITC-Opi1 3-11、FITC-Opi1 16-24、FITC-Opi1 25-33这五条多肽有轻微的细胞毒性。
综上,通过荧光显微镜以及流式细胞术分析,FITC-Opi1 17-33、FITC-Opi1 23-33具有比阳性对照肽TAT更好的穿膜效果;通过CCK8实验发现FITC-Opi1 17-33较阳性对照肽TAT的细胞毒性更小,而细胞穿膜肽FITC-Opi1 23-33的细胞穿膜效果虽然也比阳性对照肽TAT的细胞穿透效果好,但是FITC-Opi1 23-33的细胞毒性相对FITC-Opi1 17-33和TAT较大。细胞毒性要求不高的情况下,由于FITC-Opi1 23-33其序列小,易于合成和人体吸收,可选择该穿透肽,细胞毒性要求高时,优选FITC-Opi1 17-33。
以上已对本发明的实例进行了具体说明,但本发明并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 一种蛋白多肽类药物双重微球及其制备方法和胰岛素双重微球
- 一种多肽增强的纳米纤维素基薄膜材料及其制备方法
- 一种聚苯胺/纤维素导电复合膜及其制备方法和应用
- 一种甲壳素-硅酸四乙酯复合膜的制备方法及其应用
- 一种肿瘤归巢穿膜肽tLyP-1修饰的去铁蛋白纳米笼及其制备方法
- 一种蝎毒素多肽及制备拥有类似天然生理功能的蝎毒素多肽的方法
- 一类融合表达穿膜肽的海洋来源抗氧化蛋白及其制备方法与应用
