瑞香烷型二萜类化合物及其在抗艾滋病毒中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及医药技术领域,更具体地,涉及一种瑞香烷型二萜类化合物及其制备方法、药物组合物和在抗艾滋病毒中的应用。
背景技术
艾滋病,即获得性免疫缺陷综合征(Acquired immune deficiency syndrome,AIDS),是由人免疫缺陷病毒(Human immunodeficiency virus,HIV)感染导致机体免疫系统被逐渐破坏,抵抗力下降,并导致机会性感染及肿瘤风险增加,最终导致死亡的严重传染性疾病。艾滋病已成为危害公共卫生及社会稳定的重大问题,目前艾滋病的传播与流行逐渐由高危人群向一般人群蔓延,因此,艾滋病的预防诊断与治疗形势依然严峻,迫切需要寻找能彻底治愈及控制疾病的方法。
瑞香狼毒(Stellera chamaejasme L.)为瑞香科(Thymelaeaceae)狼毒属多年生草本植物,以根入药,其味辛性平,归肺、心、肾经;主治疠病、疖痈、瘰疠、顽痞、溃疡,主要分布东北、河北、内蒙古、甘肃、青海、宁夏、西藏等省区;目前,从瑞香狼毒中已分离得到160多个化合物,包括二萜、黄酮和木脂素类等化合物,药理学研究表明瑞香狼毒中的二萜化合物具有抗肿瘤等作用。
发明内容
本发明提供了一种瑞香烷型二萜类化合物及其制备方法、药物组合物和在抗艾滋病毒中的应用。
为实现上述目的,本发明的技术方案如下:
一种瑞香烷型二萜类化合物,具有如式I、II所示的结构:
本发明另一方面提供了上述瑞香烷型二萜类化合物的制备方法,具体而言,所述瑞香烷型二萜类化合物是从瑞香狼毒根部中提取分离获得。
在上述技术方案中,所述瑞香烷型二萜类化合物的制备方法,包括以下步骤:
S1、取瑞香狼毒根部,干燥并粉碎,加入溶剂回流提取,合并提取液后浓缩,得浸膏;
S2、将浸膏加入到8-12倍质量的水中混悬后,分别用石油醚、二氯甲烷和乙酸乙酯萃取,将二氯甲烷萃取物经硅胶柱色谱,使用二氯甲烷-甲醇洗脱,收集馏分后利用硅胶薄层层析检识,合并依次得到馏分A、B、C、D、E、F和G;将石油醚萃取物经硅胶柱色谱,使用石油醚-乙酸乙酯洗脱,收集馏分后利用硅胶薄层层析检识,合并依次得到馏分H、I、J、K、L、M、N和O;
S3、将馏分G经ODS柱色谱,使用甲醇-水梯度洗脱,收集到60-70个馏分后,利用硅胶薄层层析检识,合并为7个馏分G1~G7。将馏分G2经Sephadex LH-20凝胶柱色谱,使用二氯甲烷-甲醇梯度洗脱,收集到50-60个馏分后,利用硅胶薄层色谱检识,合并为5个馏分P1~P5,将馏分N经ODS柱色谱,使用甲醇-水梯度洗脱,收集到30-40个馏分后,利用硅胶薄层层析检识,合并为7个馏分N1~N7;
S4、以甲醇-水为流动相,利用HPLC法分别在馏分N2和P3中制备得到结构式如式Ⅰ和Ⅱ所示的瑞香烷型二萜类化合物。
具体地,在上述技术方案中,步骤S3中,将馏分G经ODS柱色谱,使用体积比为(30:70)-(100:0)的甲醇-水梯度洗脱,并收集60-70个馏分合并为7个馏分G1~G7;将馏分G2经Sephadex LH-20凝胶柱色谱,使用体积比为(100:0)-(0:100)的二氯甲烷-甲醇梯度洗脱,收集50-60个馏分;将馏分N经ODS柱色谱,使用体积比为(70:30)-(100:0)的甲醇-水梯度洗脱,并收集30-40个馏分合并为7个馏分N1~N7。
具体地,在上述技术方案中,步骤S1中,所述溶剂为88-98V%的乙醇水溶液,且其加入质量为瑞香狼毒的8-15倍,回流提取的次数为2-3次,每次提取2-3h。。
具体地,在上述技术方案中,步骤S2中,将二氯甲烷萃取物经硅胶柱色谱,使用体积比为(100:0)-(0:100)的二氯甲烷-甲醇洗脱,并收集50-60个馏分;将石油醚萃取物经硅胶柱色谱,使用体积比为(100:0)-(0:100)的石油醚-乙酸乙酯洗脱,并收集60-70个馏分。
具体地,在上述技术方案中,步骤S4中,所述流动相中甲醇-水的体积比为(80:20)-(85:15)。
本发明再一方面还提供了一种含有上述瑞香烷型二萜类化合物或其在药物上可接受的盐的药物组合物。
进一步地,在上述技术方案中,所述药物组合物还包含药学上可接受的载体、增效剂或赋形剂。
具体地,在上述技术方案中,所述增效剂可以是以下物质的任一种:叠氮胸苷(齐多夫定)、去羟肌苷、拉米夫定、阿巴卡韦、替诺福韦酯、恩曲他滨、齐多拉米双夫定、阿巴卡韦双夫定、奈韦拉平、奥美拉平、依非伟伦、依曲伟林、达芦那韦、阿扎那韦、利托那韦、茚地那韦、洛匹那韦、替拉那韦、地瑞那韦、多替拉韦、拉替拉韦、艾博卫泰等。
含有作为活性成份的本发明的瑞香烷型二萜类化合物和常规药物赋形剂或辅剂的药物组合物亦包含在本发明内。通常本发明药物组合物含有的重量占比为0.01-95.00%,在单元剂型中本发明化合物一般含量为0.01-10.00mg,优选地,单元剂型含有0.01-1.00mg。
优选地,在上述技术方案中,所述药物组合物的剂型包括片剂、胶囊剂、颗粒剂、口服液、糖浆剂、膏剂、注射剂、冲剂、滴丸或微丸中的任一种。
本发明活性部位的药物组合物可根据本领域公知的方法制备。用于此目的时,如果需要,可将本发明活性部位与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人药或兽药使用的适当的施用形式或剂量形式。
本发明活性部位或含有它的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、静脉注射、肌肉注射、皮下注射、腹腔注射、鼻腔、口腔粘膜、眼、肺和呼吸道、皮肤、阴道、直肠等,优选口服给药。
给药剂型可以是液体剂型、固体剂型或半固体剂型。液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括o/w型、w/o型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等。固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂、喷雾剂等;半固体剂型可以是软膏剂、凝胶剂、糊剂等。
本发明活性部位可以制成普通制剂、也可以是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
本发明又一方面还提供了上述瑞香烷型二萜类化合物或上述药物组合物在制备抗艾滋病毒药物中的应用。
本发明与现有技术相比,具有以下优点:
(1)本发明提供了一种瑞香烷型二萜类化合物,即目前未有这类结构报道,同时提供了一种操作简单可行、重复性好、提取纯度高的从瑞香狼毒中提取获得该瑞香烷型二萜类化合物的方法;
(2)试验结果表明,本发明所提供的瑞香烷型二萜类化合物对HIV-1病毒具有显著的抗艾滋病毒活性,EC
附图说明
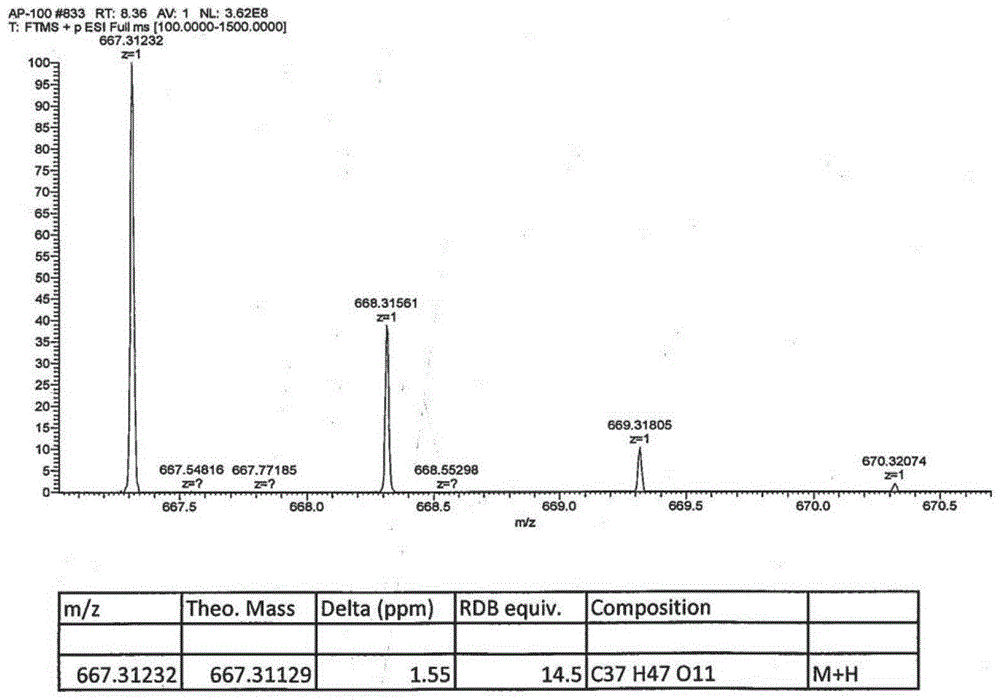
图1为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide A的HR-ESI-MS谱;
图2为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide A的
图3为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide A的
图4为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide A的HMBC谱;
图5为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide A的NOESY谱;
图6为本发明实施例1所制得的瑞香烷型二萜类化合物stelleratenoide F的HR-ESI-MS谱;
图7为本发明实施例2所制得的瑞香烷型二萜类化合物stelleratenoide F的
图8为本发明实施例2所制得的瑞香烷型二萜类化合物stelleratenoide F的
图9为本发明实施例2所制得的瑞香烷型二萜类化合物stelleratenoide F的HMBC谱;
图10为本发明实施例2所制得的瑞香烷型二萜类化合物stelleratenoide F的NOESY谱。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例中,如无特别说明,所用手段均为本领域常规的手段。
本文中所用的术语“包含”、“包括”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
在本发明的以下实施例中,所用的原料均为市售产品,未经特殊处理直接使用。
实施例1
一种瑞香烷型二萜类化合物的制备方法,包括以下步骤:
S1、称取干燥的瑞香狼毒59Kg,加入质量为瑞香狼毒的10倍的95v%的乙醇水溶液作为溶剂回流提取3次,每次提取2h,合并提取液后浓缩,得到9.2Kg浸膏;
S2、将浸膏(9.2Kg)加入到10倍质量的水(92L)中混悬后,分别用混悬液等倍量体积的石油醚、二氯甲烷和乙酸乙酯萃取,分别萃取三次,得到1149g石油醚萃取物、3781g乙酸乙酯萃取物(舍弃)和463g二氯甲烷萃取物(舍弃),将石油醚萃取物经硅胶柱色谱,使用体积比为100︰0、90︰10、80︰20、70︰30、60︰40、50︰50、40︰60、30︰70、20︰80、10︰90、0︰100的石油醚-乙酸乙酯梯度洗脱,收集馏分后利用硅胶薄层层析检识,合并依次得到馏分H、I、J、K、L、M、N和O;
S3、将馏分N经ODS柱色谱,使用体积比为70︰30、80︰20、90︰10、100︰0的甲醇-水梯度洗脱,收集到38个馏分后,利用硅胶薄层层析检识,合并为7个馏分N1~N7;
S4、利用HPLC法,以体积比分别为82︰18的甲醇-水的流动相在馏分N2中制备得到化合物stelleratenoide A。
下述为实施例1所制得的化合物stelleratenoide A的物理性质和检测数据,具体如下:
白色无定形粉末,易溶于三氯甲烷、甲醇;根据高分辨质谱(HR-ESI-MS,图1)m/z667.3123[M+H]
1
13
1
在HMBC谱(图3)中,可观察到H-19(δ
在NOESY谱(图5)中,H-1与H-11、H-1与H-19a、H-1与H-9',H-7与H-8、H-14具有NOE相关,由此可以确定这些氢在同一平面上,为β取向;H-5与H-10、H-10'具有NOE相关,确定这些氢在另一平面上,为α取向。
综上所述,确定了新化合物stelleratenoide A的结构如下:
实施例2
一种瑞香烷型二萜类化合物的制备方法,包括以下步骤:
S1、称取干燥的瑞香狼毒59Kg,加入质量为瑞香狼毒的10倍的95v%的乙醇水溶液作为溶剂回流提取3次,每次提取2h,合并提取液后浓缩,得到9.2Kg浸膏;;
S2、将浸膏(9.2Kg)加入到10倍质量的水(92L)中混悬后,分别用混悬液等倍量体积的石油醚、二氯甲烷和乙酸乙酯萃取,分别萃取三次,得到1149g石油醚萃取物(舍弃)、3781g乙酸乙酯萃取物(舍弃)和463g二氯甲烷萃取物,将二氯甲烷萃取物经硅胶柱色谱,使用体积比为100︰0、90︰10、80︰20、70︰30、60︰40、50︰50、40︰60、30︰70、20︰80、10︰90、0︰100的二氯甲烷-甲醇梯度洗脱,每500mL 1个馏分,共收集到56个馏分,利用硅胶薄层层析检识,合并依次得到馏分A、B、C、D、E、F和G;
S3、将馏分G经ODS柱色谱,使用体积比为30︰70、40︰60、50︰50、60︰40、70︰30、80︰20、90︰10、100︰0的甲醇-水梯度洗脱,收集到62个馏分后,利用硅胶薄层层析检识,合并为7个馏分G1~G7。将馏分G2经Sephadex LH-20凝胶柱色谱,使用体积比为100︰0、90︰10、80︰20、70︰30、60︰40、50︰50、40︰60、30︰70、20︰80、10︰90、0︰100的二氯甲烷-甲醇梯度洗脱,收集到5个馏分后,利用硅胶薄层色谱检识,合并为5个馏分P1~P5;
S4、利用HPLC法,以体积比为80:20的甲醇-水的流动相在馏分P3中制备得到化合物stelleratenoide F。
下述为实施例2所制得的化合物stelleratenoide F的物理性质和检测数据,具体如下:
白色无定形粉末,易溶于三氯甲烷、甲醇;根据高分辨质谱(HR-ESI-MS,图6)m/z1031.4063[M+H]
1
13
1
/>
在HMBC谱(图9)中,可观察到H-3(δ
在NOESY谱(图10)中,H-1与H-11,H-1与H-19,H-1与H-9',H-7'与H-9',H-7与H-8、H-14具有NOE相关,由此可以确定这些氢在同一平面上,为β取向;H-3与H-2、H-5,H-10与H-5、H-10',H-2'与H-5'具有NOE相关,确定这些氢在另一平面上,为α取向。
综上所述,确定了新化合物stelleratenoide F的结构如下:
试验例1
本试验例公开了上述化合物stelleratenoide A和stelleratenoide F的抗艾滋病毒活性试验。
1、实验材料和仪器
实验材料包括:
MT-2细胞株,HIV-1
DMEM培养基、RPMI-1640培养基、PBS缓冲液、PBS-T缓冲液、胎牛血清(FBS)和胰蛋白酶均购自美国Gibco公司;
p24单克隆抗体和HIV-1 IgG从美国国立卫生研究院艾滋病研究所获得;
stelleratenoide A、stelleratenoide F分别为实施例1和实施例2制备获得;wikstroelide F、chamaedaphnelide B(抗HIV药理活性显著)为市售产品;
MTT、DMSO、Triton X-100、脱脂奶粉、Bio-goat-anti-human-IgG和3,3',5,5'-四甲基联苯胺(TMB)购自美国Sigma公司;
p24标准品和链霉素标记的辣根过氧化酶(SA-HRP)购自美国Zymedg公司。
实验仪器包括:
二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司);
全波长酶标仪(美国Thermo Fisher Scientific公司);
BIOFUGE STRATOS离心机(美国Thermo Fisher Scientific公司);
IX73倒置电子显微镜(日本Olympus公司);
移液器(德国Eppendorf公司);
超净工作台;
Milli-Q超纯水器(美国Millipore公司);
十万分之一分析天平(瑞士Mettler Toledo公司);
自动高压消毒锅(日本Sanyo公司);
pH计(德国Eppendorf公司);
96孔板、离心管、吸管等相关耗材(美国Corning公司)。
2、抗HIV-1
具体过程如下:
(1)将浓度梯度的stelleratenoide A、stelleratenoide F化合物和阳性药wikstroelide F、chamaedaphnelide B加入到96孔细胞培养板,50μl/孔;
(2)在上述药物孔中,分别加入50μl/孔的HIV-1
(3)将MT-2细胞加入96孔细胞培养板中,100μl/孔、1×10
(4)次日弃上清,换新鲜RPMI-1640培养基(含10%FBS);
(5)MT-2细胞被感染第4天后,用显微镜观察细胞病变效应CPE,用100μl/孔5%Triton X-100裂解病毒(按1:1与病毒上清混合)后,上清中p24抗原的含量用ELISA方法测定。
具体方法如下:
①包被:在96半孔板中每孔加入5μg/ml的p24单克隆抗体(用pH=9.6磷酸盐缓冲液溶解),置于4℃冰箱过夜,次日用PBS-T缓冲液(含0.05%Tween-20)洗板3次;
②封闭:每孔加入150μl的2%脱脂牛奶(pH=7.2,PBS溶解),37℃孵育1h,PBS-T洗板3次;
③加样:加入p24与5%Triton-X 100混合液(1:1),50μl/孔,37℃孵育1h,PBS-T洗板3次;
④加一抗:加入HIV-IgG(PBS,1μg/ml),50μl/孔,37℃孵育1h,PBS-T洗板3次;
⑤加二抗:加入生物素标记的羊抗人IgG(加入2%脱脂奶粉按1:10000配制),50μl/孔,37℃孵育1h,PBS-T洗板3次;
⑥链霉素标记物:加入SA-HRP(加入10%羊血清按1:10000配制),50μl/孔,37℃孵育1h,PBS-T洗板6次;
⑦显色:每孔加入50μl的3,3',5,5'-四甲基联苯胺(TMB)溶液,反应3-10min;
⑧终止:加入1M H
3、对MT-2细胞的毒性检测
具体过程如下:
(1)MT-2细胞经胰酶消化后,100μl/孔1×10
(2)次日,将浓度梯度的stelleratenoide A、stelleratenoide F化合物和阳性药wikstroelide F、chamaedaphnelide B分别加入细胞中,每孔50μl,另加入空白培养基50μl,以DMEM空白培养基作为空白对照,37℃、5%CO
(3)弃掉上清,加入0.5mg/ml的MTT溶液(母液用PBS溶解成5mg/ml置于4℃冰箱保存),100μl/孔,37℃、5%CO
(4)弃掉上清,加入DMSO,150μl/孔,振荡5-10min至蓝色结晶溶解;
(5)用酶标仪读取吸光度(测量波长为570nm),根据软件计算stelleratenoide A、stelleratenoide F、和阳性对照wikstroelide F、chamaedaphnelide B的CC
4、检测结果
检测结果如下表1所示。
表1抗HIV-1
表1所示的结果表明,瑞香烷型二萜类化合物stelleratenoide A和stelleratenoide F对于HIV-1病毒具有明显的抑制作用,EC
试验例2
本试验例公开了上述化合物stelleratenoide A和stelleratenoide F对HIV-1病毒的潜伏激活试验。
1、实验材料和仪器
实验材料包括:
HIV潜伏细胞系模型J-Lat 10.6细胞系从复旦大学基础医学院医学分子病毒学重点实验室获得;
RPMI-1640培养基、PBS缓冲液、胎牛血清(FBS)和胰蛋白酶均购自美国Gibco公司;
Prostratin购自美国Sigma-Aldrich公司;
stelleratenoide A和stelleratenoide F分别为实施例1和实施例2制备获得;
Wikstroelide E、chamaedaphnelide B(HIV潜伏激活药理活性显著)和p24单克隆抗体为市售产品;
青霉素/链霉素双抗溶液购自美国Invitrogen公司;
MTT、DMSO、Triton X-100、脱脂奶粉、Bio-goat-anti-human-IgG和3,3',5,5'-四甲基联苯胺(TMB)购自美国Sigma公司;
p24标准品和链霉素标记的辣根过氧化酶(SA-HRP)购自美国Zymedg公司。
实验仪器包括:
二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司);
全波长酶标仪(美国Thermo Fisher Scientific公司);
BIOFUGE STRATOS离心机(美国Thermo Fisher Scientific公司);
IX73倒置电子显微镜(日本Olympus公司);
移液器(德国Eppendorf公司);
超净工作台;
Milli-Q超纯水器(美国Millipore公司);
十万分之一分析天平(瑞士Mettler Toledo公司);
自动高压消毒锅(日本Sanyo公司);
pH计(德国Eppendorf公司);
96孔板、离心管、吸管等相关耗材(美国Corning公司)。
2、对HIV-1潜伏感染细胞模型J-Lat 10.6细胞系的激活效应
具体过程如下:
(1)取对数生长期的J-Lat 10.6细胞,1200rpm/min离心5min后,弃上清,收集细胞,调整细胞浓度至1×10
(2)分别加入浓度梯度的stelleratenoide A、stelleratenoide F化合物处理J-Lat 10.6细胞,以wikstroelide F、chamaedaphnelide B、prostratin作为阳性药;
(3)48h后1200rpm/min将细胞培养板离心5min,收集细胞上清,加入等体积的5%Triton X-100,4℃裂解过夜;
(4)ELISA法测定HIV-1 p24抗原的含量,具体方法如下:
①包被:用包被缓冲液(pH=9.6,0.85M的碳酸钠/碳酸氢钠缓冲液)将p24单克隆抗体稀释至浓度为5μg/ml,加入到96孔聚苯乙烯半孔板中,每孔50μl,4℃放置过夜;
②洗涤:每孔加入200μl PBS-T洗液洗涤1次;
③封闭:每孔加入150μl的2%脱脂奶粉,37℃孵育1h,洗板1次;
④样品和标准品的孵育:标准品HIV-1p24蛋白按照最大浓度为200ng/ml进行倍比稀释7个浓度,以PBS为空白对照组,样品则用PBS按一定比例稀释将浓度控制在标准曲线范围以内,每孔加入50μl,37℃孵育1h,洗板3次;
⑤一抗孵育:每孔加入50μl用PBS稀释至1μg/ml的HIV-1 IgG,37℃孵育1h,洗板3次;
⑥二抗孵育:用2%脱脂牛奶按1:10000比例稀释生物素标记的羊抗人IgG,每孔加入50μl,37℃孵育1h,洗板3次;
⑦标记物孵育:用10%山羊血清按1:10000比例稀释链霉素标记的辣根过氧化酶SA-HRP,每孔加入50μl,37℃孵育1h,洗板6次;
⑧显色:每孔加入50μl的3,3',5,5'-四甲基联苯胺(TMB),室温孵育显色2-5min,等待空白PBS孔即将出现浅蓝色时,每孔加入25μl 1M的H
⑨检测:在酶标仪中检测450nm波长下的吸光度值,以吸光度为横坐标,标准品HIV-1 p24浓度为纵坐标绘制标准曲线,再根据样品吸光度值计算出对应的HIV-1 p24浓度。
3、对J-Lat 10.6细胞活力影响测试
具体过程如下:
(1)将J-Lat 10.6细胞以1×10
(2)次日,将浓度梯度的stelleratenoide A、stelleratenoide F、wikstroelideF、chamaedaphnelide B和prostratin化合物加入细胞中,每孔50μl,另加入空白培养基50μl,以空白培养基作为空白对照,37℃、5%CO
(3)每孔加入20μl CCK8,继续将培养板置于37℃培养4h;
(4)在酶标仪上采用450nm波长检测吸光度,最后分别计算出stelleratenoide A、stelleratenoide F、wikstroelide F、chamaedaphnelide B和prostratin对J-Lat 10.6细胞存活率的影响。
4、检测结果
检测结果如下表2所示。
表2对J-Lat 10.6细胞系的激活效应和细胞活力影响的检测结果
表2所示的结果表明,stelleratenoide A和stelleratenoide F均可显著促进J-Lat 10.6细胞中HIV-1 p24的表达以及病毒颗粒的释放,表现出明显的潜伏激活作用;与阳性药组wikstroelide F、chamaedaphnelide B和prostratin相比,stelleratenoide A和stelleratenoide F潜伏激活的EC
产品实施例1以stelleratenoide A、stelleratenoide F为原料药的片剂
本产品实施例公开一种以stelleratenoide A为原料药的片剂,其组份如下:
取stelleratenoide A与羟丙基甲基纤维素、滑石粉、乳糖、硬脂酸镁混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,压片。
本产品实施例公开一种以stelleratenoide F为原料药的片剂,其组份如下:
取stelleratenoide F与羟丙基甲基纤维素、滑石粉、乳糖、硬脂酸镁混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,压片。
产品实施例2以stelleratenoide A、stelleratenoide F为原料药的胶囊剂
本产品实施例公开一种以stelleratenoide A为原料药的胶囊剂,其组份如下:
取stelleratenoide A与淀粉、焦亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装入胶囊。
本产品实施例公开一种以stelleratenoide F为原料药的胶囊剂,其组份如下:
取stelleratenoide F与淀粉、焦亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装入胶囊。
产品实施例3以stelleratenoide A、vtelleratenoide F为原料药的颗粒剂
本产品实施例公开一种以stelleratenoide A为原料药的颗粒剂,其组份如下:
取stelleratenoide A与淀粉、亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装袋。
本产品实施例公开一种以stelleratenoide F为原料药的颗粒剂,其组份如下:
取stelleratenoide F与淀粉、亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装袋。
产品实施例4以stelleratenoide A、stelleratenoide F为原料药的口服液
本产品实施例公开一种以stelleratenoide A为原料药的口服液,其组份如下:
上述组分混匀后,采用口服液常规制备方法,分装即可。
本产品实施例公开一种以stelleratenoide F为原料药的口服液,其组份如下:
上述组分混匀后,采用口服液常规制备方法,分装即可。
产品实施例5以stelleratenoide A、stelleratenoide F为原料药的注射剂
本产品实施例公开一种以stelleratenoide A为原料药的注射剂,其组份如下:
上述组分混匀后,采用注射剂常规制备方法,即可得100支。
本产品实施例公开一种以stelleratenoide F为原料药的注射剂,其组份如下:
上述组分混匀后,采用注射剂常规制备方法,即可得100支。
产品实施例6以stelleratenoide A、stelleratenoide F和齐多夫定为原料药的片剂
本产品实施例公开一种以stelleratenoide A和齐多夫定为原料药的片剂,其组份如下:
取stelleratenoide A、齐多夫定和羟丙基甲基纤维素、滑石粉、乳糖、硬脂酸镁混合均匀,加无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,压片。
本产品实施例公开一种以stelleratenoide F和齐多夫定为原料药的片剂,其组份如下:
取stelleratenoide F、齐多夫定和羟丙基甲基纤维素、滑石粉、乳糖、硬脂酸镁混合均匀,加无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,压片。
产品实施例7以stelleratenoide A、stelleratenoide F和利匹韦林为原料药的胶囊剂
本产品实施例公开一种以stelleratenoide A和利匹韦林为原料药的胶囊剂,其组份如下:
取stelleratenoide A和利匹韦林,与淀粉、焦亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装入胶囊。
本产品实施例公开一种以stelleratenoide F和利匹韦林为原料药的胶囊剂,其组份如下:
取stelleratenoide F和利匹韦林,与淀粉、焦亚硫酸氢钠混匀后,加入无水乙醇制成软材,过24目筛,制成颗粒,干燥,加入硬脂酸镁,混匀,装入胶囊。
产品实施例8以stelleratenoide A、stelleratenoide F和洛匹那韦为原料药的注射剂
本产品实施例公开一种以stelleratenoide A和洛匹那韦为原料药的注射剂,其组份如下:
上述组分混匀后,采用注射剂常规制备方法,即可得100支。
本产品实施例公开一种以stelleratenoide F和洛匹那韦为原料药的注射剂,其组份如下:
/>
上述组分混匀后,采用注射剂常规制备方法,即可得100支。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。
应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 抗艾滋病毒的瑞香烷型二萜类化合物及其制备方法和应用
- 抗艾滋病毒的瑞香烷型二萜类化合物及其制备方法和应用
