一种甘蔗渣为原料发酵生产乳酸单体的重组菌及其应用
文献发布时间:2024-04-18 19:52:40
技术领域:
本发明涉及发酵工程和基因工程技术领域,具体涉及一种以甘蔗渣为原料生产乳酸单体的生产菌株及其应用,具体为纤维素水解酶编码基因的克隆、表达、木质纤维素的水解和以水解得到的还原糖为原料的乳酸单体的发酵生产。
背景技术:
微生物可以利用葡萄糖、木糖和半乳糖等单糖来发酵生产乳酸,随着菌种改造技术和发酵生产技术的提升,可以利用淀粉等原料进行发酵生产乳酸。淀粉等原料是人们生活中不可或缺的食物来源,过度使用可能会引起与人争粮等不可避免的伦理问题,利用可再生的生物质资源,可以很好的解决这个问题,同时又可以缓解由于生物质不妥善利用带来的环境问题。因此,微生物发酵法较化学合成法和酶法转化法有着原料来源广泛、安全系数高、产物光学纯度高和对环境污染小等特点,促进了微生物发酵法在乳酸合成领域的快速发展。发酵法生产L-乳酸的主要工具是微生物,所以微生物的选育尤为重要,国内外的发酵法产乳酸的研究进展不仅仅是发酵工艺的开发与优化,更重要的是发酵菌株的自然选育和利用基因工程的方法构建可以产乳酸的工程菌株。
乳酸菌属和根霉属可以用于工业中生产乳酸,由于乳酸菌可以高产乳酸而且具有很高的耐酸性,因此常用来生产乳酸的一类菌株,乳酸菌属包括干酪乳杆菌(Lactobacillus casei)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、嗜酸乳杆菌(Lactobacillus acidophilus)和瑞士乳杆菌(Lactobacillus helveticus)。近年来,乳酸产业的菌株选育和生产研究得到广泛的关注,Taniguchi等在2004年提出干酪乳杆菌和铅黄常球菌IFO两种乳酸菌,水解木质纤维素得到50g/L的木糖和100g/L的葡萄糖,通过发酵的方式生产乳酸产量为95g/L(Horiuchi,et al.Production of L-lactic acid from amixture of xylose and glucose by co-cultivation of lactic bacteria[J].AppliedMicrobiology and Biotechnology,2004,66(2):160-165.);Mass R W在2007年使用纤维素酶和菌株Bacillus coagulansDSM2314水解经过石灰预处理的麦麸2706g,经50℃发酵55h,发酵结束后乳酸总量为711g,转化率为43%(Jansen,et al.Lactic acid productionfrom lime-treated wheat straw by Bacillus coagulans:neutralization of acid byfed-batch addition of alkaline substrate[J].Applied Microbiology&Biotechnology,2008,78(5):751-758.)。Ge X Y等于2008年将乳杆菌和黑曲霉混合直接利用菊芋发酵生产乳酸,发酵方式为分批补料发酵和同步糖化发酵,发酵结束时乳酸产量为120.5g/L。
发明内容:
本发明目的是,通过基因克隆与基因重组技术在乳酸单体生产菌种中实现纤维素水解酶分子的分泌表达,获得具有代谢木质纤维素能力的乳酸单体生产菌种,所获得的菌种能够直接以甘蔗渣为原料高效合成乳酸单体,由此可拓展乳酸单体大规模生产的原料供给,优化以甘蔗渣为原料生产乳酸单体的生产技术,应用于甘蔗渣为原料的乳酸单体的规模化生产。
为了实现上述目的,本发明提供的技术方案之一,是一种表达纤维素水解酶的生产乳酸单体的重组菌株,所述重组菌以具有乳酸单体生产能力的菌株为出发菌;
进一步地,所述纤维素水解酶的编码基因具有SEQ ID NO.1、2和3所示的核苷酸序列;
所述纤维素水解酶编码基因的表达可以是在宿主基因组中整合SEQ ID NO.1、2和3所示的编码基因,也可以将包含SEQ ID NO.1、2和3所示的编码基因的表达载体转入宿主细胞中实现;
优选地,所述纤维素水解酶编码基因采用的表达载体包括但不限于pUC18,pUC19,pBR322,pBlueScript SK(-),pMD18,pMD19,pMD20,pHY300PLK,pET20a,pET20b,pET22a,pET22b,pET28a,pET28b、pND113、pHY-WZX或pBL-WZX;
更优选地,所述表达载体,含有来源于地衣芽胞杆菌淀粉酶启动子Pamy和含有来源于地衣芽胞杆菌淀粉酶Spamy的信号肽。
进一步地,所述重组菌株采用的出发菌株包括但不限于大肠杆菌、酿酒酵母、热带假丝酵母、凝结芽胞杆菌、枯草芽胞杆菌、巨大芽胞杆菌、谷氨酸棒杆菌、地衣芽胞杆菌等;
优选地,所述重组菌株是以乳酸单体生产菌株大肠杆菌CGMCC NO.11060为出发菌株,通过分子克隆与基因重组技术获得的;
优选地,所述重组菌为大肠杆菌090B-bga-egla-cbhc,所述菌株是依据SEQ IDNO.3、SEQ ID NO.1和SEQ ID NO.2的顺序将所示的β-葡糖糖苷酶编码基因bga、内切葡聚糖酶编码基因egla和外切葡聚糖酶编码基因cbhc依次克隆入pBL-WZX质粒中,并在大肠杆菌CGMCC NO.11060进行表达所得。
优选地,所述重组菌为大肠杆菌090B-bga-cbhc-egla,所述菌株是依据SEQ IDNO.3、SEQ ID NO.2和SEQ ID NO.1的顺序将所示的β-葡萄糖苷酶编码基因bga、外切葡聚糖酶编码基因cbhc和内切葡聚糖酶编码基因egla依次克隆入pBL-WZX质粒中,并在大肠杆菌CGMCC NO.11060进行表达所得。
优选地,所述重组菌为大肠杆菌090B-cbhc-egla-bga,所述菌株是依据SEQ IDNO.2、SEQ ID NO.1和SEQ ID NO.3的顺序将所示的外切葡聚糖酶编码基因cbhc、内切葡聚糖酶编码基因egla和β-葡萄糖苷酶编码基因bga依次克隆入pBL-WZX质粒中,并在大肠杆菌CGMCC NO.11060进行表达所得。
更优选地,所述重组菌为大肠杆菌090B-egla-cbhc-bga,所述菌株是将SEQ IDNO.1、SEQ ID NO.2和SEQ ID NO.3所示的内切葡聚糖酶编码基因egla、外切葡聚糖酶编码基因cbhc和β-葡萄糖苷酶编码基因bga依次克隆入pBL-WZX质粒中,并在大肠杆菌CGMCCNO.11060进行表达所得。
所得的大肠杆菌090B-bga-egla-cbhc、090B-bga-cbhc-egla、090B-cbhc-egla-bga和090B-egla-cbhc-bga具备合成分泌内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的能力并且具有降低纤维素链聚合度、水解纤维素生成为可发酵代谢利用的葡萄糖的能力。
本发明提供的技术方案之二,是技术方案一中所述重组菌的应用,特别是在以甘蔗渣为原料生产乳酸中的应用;
进一步地,本研究中使用的甘蔗渣中含纤维素41.8%、半纤维素21.8%,具体以甘蔗渣为原料生产乳酸的方法如下:
摇瓶发酵方法:以预处理后的甘蔗渣为发酵培养基,按照5%-10%的接种量将生产菌株种子液接入发酵培养基中,在30℃~37℃、转速100-250r/min下好氧培养1~3h,加入2.0~10.0%(w/v)的碳酸钙,密封,进入厌氧发酵阶段,转速为50~150r/min,发酵温度30℃~37℃,厌氧发酵周期36~48h;进一步地,发酵过程中用5~35wt%氢氧化钙悬浊液维持pH在6.5~7.1之间,直至发酵结束,
摇瓶用甘蔗渣的预处理方法为:绝干重的甘蔗渣,经1.0%~2.0%的氢氧化钠溶液按料液比为1:10 -15的比例(m:v)混合后,在110℃~120℃高温高压灭菌处理0.5~2h,调节pH为6.0-7.0,补加氢氧化钠溶液体积1-1.5倍的去离子水,混匀,再次灭菌,即获得摇瓶用发酵培养基。
发酵罐发酵方法:以预处理后的甘蔗渣为发酵培养基,按照1~10%(v/v)的接种量将生产菌株种子液接种到发酵培养基中,开始乳酸发酵,温度控制37℃~50℃,关闭通气,搅拌转速调为100~200r/min,流加5%~35%氢氧化钙悬浊液维持pH在6.0~7.5,发酵周期100~110h;
发酵罐用甘蔗渣的预处理方法为:绝干重的甘蔗渣,经1.0%~2.0%的氢氧化钠溶液按料液比为1:10 -15(m:v)的比例,在110℃~120℃高温高压灭菌处理0.5~2h,调节pH为6.0-7.0,浓缩至原体积的20-40%,再次灭菌,即获得发酵罐用发酵培养基。
有益效果:
本发明通过串联表达内切葡聚糖酶编码基因egla、外切葡聚糖酶编码基因cbhc和β-葡萄糖苷酶编码基因bga,构建了能够利用甘蔗渣生产乳酸的重组大肠杆菌。并意外的发现上述三种纤维素水解酶的表达顺序对乳酸产量有极大的影响。其中将egla、cbhc、bga三个基因按顺序依次克隆构建的大肠杆菌090B-egla-cbhc-bga具有最高的内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶酶活以及乳酸生产能力,并且远高于其他顺序构建的菌种。
本发明提供的利用甘蔗渣为原料生产乳酸的菌株,能够将废弃的生物质原料转化为高附加值的乳酸单体,乳酸单体的发酵罐发酵水平可以达到127.72g/L,L-乳酸的纯度为99.8%,甘蔗渣到乳酸的转化率可以达到42.5%,糖酸转化率为97.0%。
本发明有助于乳酸大规模生产的原料供给,减少对粮食或糖类的依赖,优化甘蔗渣原料生产乳酸的技术,我国甘蔗渣的年产量2.7×10
附图说明:
图1分泌表达纤维素水解酶重组质粒pND-egla-cbhc-bga的图谱和线性化图谱。
图2重组菌悬液在以CMC-Na为底物的刚果红培养基上透明圈出现情况。
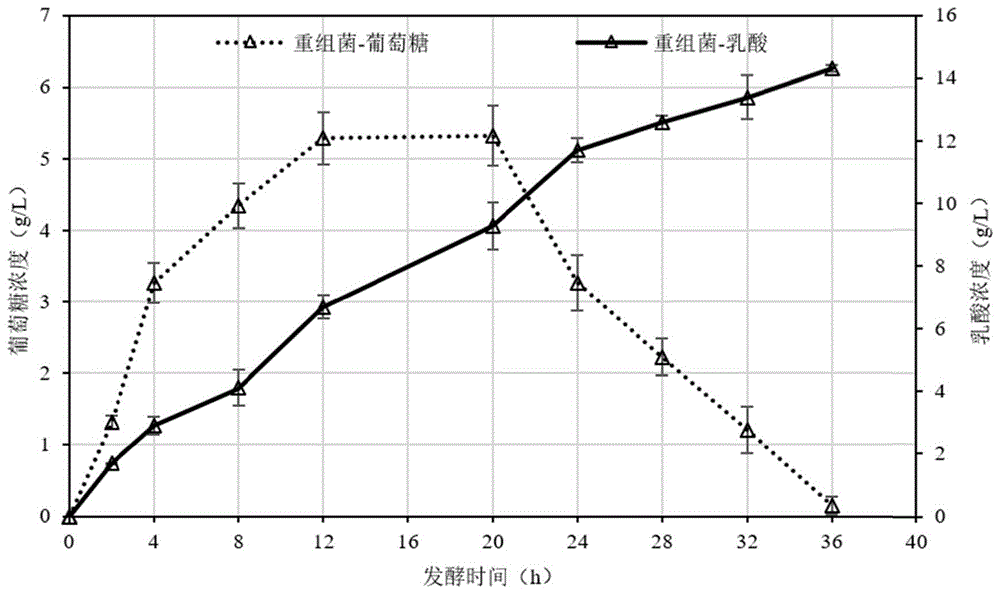
图3重组菌利用甘蔗渣生产乳酸的情况。
具体实施方式:
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
本发明所采用的出发菌株为代谢工程大肠杆菌(Escherichia coli)CGMCCNO.11060(已公开于ZL201580000781.7中),是一株L-乳酸单体生产菌,已保藏于中国普通微生物菌种保藏管理中心(简称CGMCC),保藏日期均为2015年7月7日。
本发明所采用的纤维素水解酶,是黑曲霉来源的纤维素水解酶,其编码基因为通过密码子优化后经化学合成获得,内切葡聚糖酶编码基因egla、外切葡聚糖酶编码基因cbhc和β-葡萄糖苷酶编码基因bga,其核苷酸序列分别具有SEQ ID NO.1、2或3的序列特征。
本发明所使用的质粒pBL-WZX为现有技术,其序列信息和构建方法已通过中国发明专利(王正祥,牛丹丹.中国发明专利,ZL200510081648.7)公开;本发明用于代谢甘蔗渣合成乳酸的菌种的构建方法,是通过基因克隆与基因重组技术,在表达载体中进行克隆和获得纤维素水解酶的表达质粒,并转化入乳酸生产菌株中获得重组菌,实现纤维素水解酶的分泌表达;或通过基因的定点整合将纤维素水解酶表达盒整合到乳酸生成菌株的基因组中获得重组菌,实现纤维素水解酶的分泌表达;进一步通过建立并优化发酵条件与工艺,用于以甘蔗渣为原料的乳酸的工业化制造。
本发明根据egla、cbhc、bga三个基因不同的串联顺序,将SEQ ID NO.1、SEQ IDNO.2和SEQ ID NO.3所示的内切葡聚糖酶、外切葡聚糖酶和β-葡糖糖苷酶编码基因的PCR产物用BamH I酶切后,按不同的顺序克隆入经SmaⅠ和BamHⅠ双酶切的pBL-WZX质粒中,得到重组质粒,并在大肠杆菌CGMCCNO.11060进行表达。分别获得了大肠杆菌090B-bga-egla-cbhc,大肠杆菌090B-bga-cbhc-egla,大肠杆菌090B-cbhc-egla-bga和大肠杆菌090B-egla-cbhc-bga。
本发明采用的主要实验方法如下:
1、基因克隆、基因重组与表达质粒的构建常规分子克隆操作参考文献方法(Sambrook等。Molecular Cloning:A Laboratory Manual,1989)进行。纤维素水解酶编码基因作为本发明中的目标基因;基础表达载体为pBL-WZX(王正祥,牛丹丹。中国发明专利,ZL200510081648.7)。纤维素水解酶的编码基因经PCR扩增后克隆入pBL-WZX的表达载体中,获得表达纤维素水解酶的重组质粒。
2、染色体DNA的提取
大肠杆菌染色体DNA提取方法按文献(诸葛键王正祥。工业微生物实验技术手册,中国轻工业出版社,1994)进行。
3、质粒DNA的提取质粒DNA的提取在用一定浓度的溶菌酶裂解细胞壁后使用Sigma公司的质粒小提试剂盒进行。
4、基因扩增DNA扩增在0.2mL PCR薄壁管中进行。PCR扩增条件为:1×(95℃5min);30×(94℃10s,58℃30s,72℃30~300s);1×(72℃10min)。依据不同扩增长度,PCR反应的延伸温度和时间有所不同。除特别注明外,所有PCR反应都使用2×Hieff DNA聚合酶进行。
5、重组菌中纤维素水解酶的分泌表达及酶活力测定
(1)通过划线或点种在LB平板上接入重组菌,37℃下培养12-18h,之后挑取单菌落接种至甘油为碳源的M9培养基(甘油0.5%~1.0%,十二水磷酸氢二钠0.5%~2.5%,氯化钠0.02%~0.1%,磷酸二氢钾0.1%~1.0%,氯化铵0.01%~0.5%;pH7.0)上,150-200rpm,37℃下培养12h,将菌悬液点在以CMC-Na为底物的刚果红平板上,观察透明圈的情况。
(2)通过划线或点种在LB平板上接入重组菌,37℃下培养12-18h,之后挑取单菌落接种至LB液体培养基中150~200r/min,37℃下培养12h,再按照初始OD
外切葡聚糖酶酶活检测的基本方法是:将50μL稀释后的酶液于50℃下预热5min,实验组先加入350μL 1%的CMC-Na溶液,准确反应30min,再加入600μL DNS;对照组加入600μL DNS,再加入350μL 1%的CMC-Na溶液,反应结束后,煮沸7min,冷却至室温后,补加水2mL,测定540nm下的吸光度值。
内切葡聚糖酶酶活检测的基本方法是:取30mL 1%的CMC-Na溶液于50℃下预热5min。实验组加入500μL稀释后的酶液;对照组加入500μL大肠杆菌(B0013-090B,即出发菌株CGMCC11060)发酵液的上清液,50℃下准确反应30min,煮沸10min终止反应,冷却至室温后,用NDJ-5S型旋转粘度计多次测定反应液的粘度。
β-葡萄糖苷酶酶活检测的基本方法是:将50μL稀释后的酶液于50℃下预热5min。实验组:先加入350μL 10μmol/L的纤维二糖溶液,准确反应30min,加入400μL 0.1mol/L的NaOH溶液终止酶促反应,再加入400μL 0.1mol/L的HCl调节pH至5~6,用酶电极法测葡萄糖的浓度A1;对照组:先加入400μL0.1mol/L的NaOH,维持相同的时间后,再加入350μL 10μmol/L的纤维二糖溶液,混合均匀,再加入400μL 0.1mol/L的HCl调节pH至5~6,用酶电极法测葡萄糖的浓度A2,差值ΔA为葡萄糖的增加量。
酶活力定义:
外切葡聚糖酶酶活定义:在50℃、pH 5.0特定条件下,反应30min,1mL酶液在单位时间内水解CMC-Na释放1μmol纤维二糖为一个酶活力单位(U)。
内切葡聚糖酶酶活定义:酶活定义:在50℃、pH 5.0特定条件下,反应30min,1mL酶液单位时间内水解1mg CMC-Na为一个酶活力单位(U)。
β-葡糖糖苷酶酶活定义:在50℃、pH5.0的条件下反应30min,1mL酶液在单位时间内水解纤维二糖释放1μmol葡萄糖为一个酶活力单位(U)。
7、摇瓶发酵实验
取重组菌种的单个菌落,接种于50~100mL的LB液体培养基中,30℃~37℃、100~250r/min摇床培养5~15h,作为一级种子液。将一级种子液按照5%接种于在250mL三角瓶中装50mL以甘油为碳源的M9培养基(十二水磷酸氢二钠0.5%~2.5%,氯化钠0.02%~0.1%,磷酸二氢钾0.1%~1.0%,氯化铵0.01%~0.5%,0.5%~1.0%甘油;pH7.0)接入生产菌株30℃~37℃,100~250r/min,恒温培养5~12h,作为二级种子液。
预处理后的甘蔗渣为发酵培养基,按照5%~10%的接种量将生产菌株种子液接入发酵培养基中,在30℃~37℃、转速100~250r/min下好氧培养1~3h,加入2.0~10.0%(w/v)的碳酸钙,密封,进入厌氧发酵阶段转速为50~150r/min,发酵温度30℃~37℃,培养36~48h;发酵过程中用5~35wt%氢氧化钙悬浊液维持pH在6.5~7.1之间,直至发酵结束。
预处理甘蔗渣作发酵培养基:绝干重的甘蔗渣,经1~2%的氢氧化钠溶液按料液比为1:10~15的比例,在110℃~120℃高温高压灭菌处理0.5~2h,调节pH为6.0~7.0,补加氢氧化钠溶液体积1~1.5倍的去离子水,混匀,115~121℃灭菌10~20min,即获得发酵培养基;
8、发酵罐发酵实验
取发酵菌种的单个菌落,接种于50~100mL的LB液体培养基中,30℃~37℃、100~250r/min摇床培养5~15h,作为一级种子液。将一级种子液按照起始OD
将二级种子液按照1~10%(v/v)的接种量接种到预处理后的甘蔗渣制备的发酵培养基中(绝干重的甘蔗渣经1.0%~2.0%的氢氧化钠溶液按料液比为1:10~15的比例混合后,110℃~120℃高温高压灭菌处理0.5~2h,调节pH为6.0~7.0,浓缩至原体积的20~40%,115℃~121℃蒸汽灭菌30min~50min),开始乳酸发酵,温度控制37℃~50℃,关闭通气,搅拌转速调为100~200r/min,流加5%~35%氢氧化钙悬浊液维持pH在6.0~7.5,发酵周期100~110h。取样测定发酵液中残糖和乳酸的含量。
9、发酵过程分析
样本制备:取1mL需要检测的发酵液,8000r/min,离心5min,吸取适量的上清稀释合适的倍数。
葡萄糖和乳酸含量的测定:将样品适当稀释后使用SBA-40C型生物传感仪进行葡萄糖浓度和乳酸浓度的测定,取三次平行数据的平均值。
在本发明中,采用的出发菌株为CGMCC NO.11060也称作B0013-090B或090B。在出发菌株CGMCC NO.11060基础上顺序表达SEQ ID NO.1、2和3获得重组菌并命名为:重组大肠杆菌090B-egla-cbhc-bga。
以下通过具体实施例对本发明作进一步地解释说明。
实施例1游离表达纤维素水解酶
为实现目的蛋白的分泌表达,采用pBL-WZX作为表达质粒,质粒pBL-WZX中含有来源于地衣芽胞杆菌的淀粉酶启动子Pamy和来源于地衣芽胞杆菌的淀粉酶信号肽Spamy。
对来源于黑曲霉的内切葡聚糖酶egla、外切葡聚糖酶cbhc和β-葡萄糖苷酶bga的编码基因(分别如SEQ ID NO.1、2、3所示)进行化学合成,将合成的基因序列通过PCR扩增(引物见表1),PCR扩增产物根据不同的顺序克隆入质粒pBL-WZX中:
(1)依据SEQ ID NO.3、SEQ ID NO.1和SEQ ID NO.2的顺序将所示的β-葡糖糖苷酶编码基因bga、内切葡聚糖酶编码基因egla和外切葡聚糖酶编码基因cbhc的PCR产物用BamHI酶切后依次克隆入经SmaⅠ和BamHⅠ双酶切的pBL-WZX质粒中,得到重组质粒pND-bga-egla-cbhc。
(2)依据SEQ ID NO.3、SEQ ID NO.2和SEQ ID NO.1的顺序将所示的β-葡糖糖苷酶编码基因bga、外切葡聚糖酶编码基因cbhc和内切葡聚糖酶编码基因egla的PCR产物用BamHI酶切后依次克隆入经SmaⅠ和BamHⅠ双酶切的pBL-WZX质粒中,得到重组质粒pND-bga-cbhc-egla。
(3)依据SEQ ID NO.2、SEQ ID NO.1和SEQ ID NO.3的顺序将所示的外切葡聚糖酶编码基因cbhc、内切葡聚糖酶编码基因egla和β-葡萄糖苷酶编码基因bga的PCR产物用BamHI酶切后依次克隆入经SmaⅠ和BamHⅠ双酶切的pBL-WZX质粒中,得到重组质粒pND-cbhc-egla-bga。
(4)依据SEQ ID NO.1、SEQ ID NO.2和SEQ ID NO.3的顺序将所示的内切葡聚糖酶编码基因egla、外切葡聚糖酶编码基因cbhc和β-葡萄糖苷酶bga编码基因的PCR产物用BamHI酶切后依次克隆入经SmaⅠ和BamHⅠ双酶切的pBL-WZX质粒中,得到重组质粒pND-egla-cbhc-bga(见图1)。
将表达质粒pND-bga-egla-cbhc、pND-bga-cbhc-egla、pND-cbhc-egla-bga和pND-egla-cbhc-bga分别转化入乳酸单体生产菌株CGMCC NO.11060,获得了重组菌090B-bga-egla-cbhc、090B-bga-cbhc-egla、090B-cbhc-egla-bga和090B-egla-cbhc-bga。
表1本发明使用的引物序列
(1)酶活测定
分别以4种重组菌为生产菌株,通过划线或点种在LB平板上接入重组菌,37℃下培养12h,之后挑取单菌落接种至LB液体培养基中200r/min,37℃下培养12h,再按照初始OD
纤维素水解酶的酶活力如表2所示,重组菌090B-egla-cbhc-bga在这四株重组菌中内切葡聚糖酶、外切葡聚糖酶和β-葡糖糖苷酶的酶活力均最高。因此,将其确定为后续发酵甘蔗渣生产乳酸的生产菌株。
表2重组菌分泌表达三种酶的酶活力
(2)以第一步得到酶活力最高的菌株090B-egla-cbhc-bga,通过划线或点种在LB平板上接入重组菌,37℃下培养12h,之后挑取单菌落接种至在以甘油为碳源的M9培养基上(十二水磷酸氢二钠1.51%,氯化钠0.05%,磷酸二氢钾0.3%,氯化铵0.1%,0.5%甘油;pH7.0),200rpm,37℃下培养12h,将菌悬液点在以CMC-Na为底物的刚果红平板上,以及将商品木聚糖酶释后点入点样孔,观察透明圈的情况。
结果如图2所示,重组菌点样孔周围出现明显的透明圈,因此能体现纤维素水解酶的活性,说明了纤维素水解酶在乳酸单体生产菌株中实现了分泌表达。进一步证明了表达了纤维素水解酶的乳酸单体生产菌株具有了代谢的能力。
实施例2重组菌摇瓶发酵利用甘蔗渣生产乳酸
分别以090B-bga-egla-cbhc、090B-bga-cbhc-egla、090B-cbhc-egla-bga和090B-egla-cbhc-bga以及出发菌株CGMCC NO.11060为生产菌株。
分别挑取重组菌种090B-bga-egla-cbhc、090B-bga-cbhc-egla、090B-cbhc-egla-bga和090B-egla-cbhc-bga以及CGMCC NO.11060的5个单菌落,分别接种于50mL的LB液体培养基中,37℃、250r/min摇床培养12h,作为一级种子液。
将一级种子液按照初始OD
(1)按照10%(v/v)的接种量分别将生产菌株090B-egla-cbhc-bga和出发菌株CGMCC NO.11060转入发酵培养基(绝干重的甘蔗渣2.0g经1.5%的氢氧化钠溶液,料液比为1:10的比例,115℃高温高压处理1h,调节pH为6.5,补加去离子水25mL并混匀后,115℃灭菌15min,备用)中,加入3.0g碳酸钙后,用封口膜密封直接进入厌氧发酵阶段,100r/min,发酵温度37℃,持续培养36h,发酵过程中用25wt%氢氧化钙悬浊液维持pH在6.5-7.1之间。取样测定发酵液中乳酸的含量。
在摇瓶中直接转厌氧的发酵条件下,重组菌090B-egla-cbhc-bga发酵的乳酸产量为13.0g/L,乳酸转化率为37.70%(以绝干重的甘蔗渣计),糖酸转化率为85.88%,乳酸转化速率为0.361g/(L·h)。出发菌株CGMCC NO.11060的发酵体系中未检测到乳酸。
(2)按照10%(v/v)的接种量分别将生产菌株090B-egla-cbhc-bga和出发菌株CGMCC NO.11060转入发酵培养基(绝干重的甘蔗渣2.0g经1.5%的氢氧化钠溶液,料液比为1:10的比例,115℃高温高压处理1h,调节pH为6.5,补加去离子水25mL并混匀后,115℃灭菌15min,备用)中,在37℃、转速200r/min下好氧培养2h后,加入3.0g碳酸钙后,用封口膜密封进入厌氧发酵阶段,100r/min,发酵温度37℃,持续培养36h,发酵过程中用25wt%氢氧化钙悬浊液维持pH在6.5-7.1之间。取样测定发酵液中乳酸的含量。
结果如图3所示,在摇瓶的发酵条件下,重组菌090B-egla-cbhc-bga发酵的乳酸产量为14.3g/L,乳酸转化率为41.47%(以绝干重的甘蔗渣计),糖酸转化率为94.46%,乳酸转化速率为0.397g/(L·h)。出发菌株CGMCC NO.11060的发酵体系中未检测到乳酸。
(3)按照10%(v/v)的接种量分别将生产菌株090B-bga-egla-cbhc、090B-bga-cbhc-egla、090B-cbhc-egla-bga和090B-egla-cbhc-bga转入发酵培养基(绝干重的甘蔗渣2.0g经1.5%的氢氧化钠溶液,料液比为1:10的比例,115℃高温高压处理1h,调节pH为6.5,补加去离子水25mL并混匀后,115℃灭菌15min,备用)中,在37℃、转速200r/min下好氧培养2h后,加入3.0g碳酸钙后,用封口膜密封进入厌氧发酵阶段,100r/min,发酵温度37℃,持续培养36h,发酵过程中用25wt%氢氧化钙悬浊液维持pH在6.5-7.1之间。取样测定发酵液中乳酸的含量。
重组菌发酵利用甘蔗渣生产乳酸的结果如表3所示,重组菌090B-egla-cbhc-bga相较于其他三株重组菌乳酸生产能力最高,因此,确定为后续发酵甘蔗渣生产乳酸的生产菌株。
表3重组菌发酵利用甘蔗渣的乳酸产量
实施例3发酵罐利用甘蔗渣发酵产乳酸
取发酵菌种090B-egla-cbhc-bga的单个菌落,接种于50mL的LB液体培养基中,37℃、250r/min摇床培养12h,作为一级种子液。将一级种子液按照起始OD
将二级种子液按照10%(v/v)的接种量接种到发酵培养基中(绝干重的甘蔗渣15Kg经1.5%的氢氧化钠溶液按料液比为1:10混合,115℃高温高压处理1h,调节pH为6.0~7.0,浓缩至45L,121℃蒸汽灭菌45min),进行乳酸发酵,温度控制37℃,关闭通气,搅拌转速调为100r/min,流加25%氢氧化钙悬浊液维持pH在7.0,在此条件下厌氧发酵维持106h。
发酵结束后,经检测发酵液中乳酸的浓度为127.72g/L,葡萄糖含量为0.42g/L,乳酸得率0.97g/g葡萄糖,乳酸得率0.425g/g甘蔗渣。
本发明涉及的内切葡聚糖酶编码基因egla、外切葡聚糖酶编码基因cbhc和β-葡萄糖苷酶编码基因bga,其核苷酸序列分别具有SEQ ID NO.1、2或3的序列特征,具体如下:
SEQ ID NO.1egla核苷酸序列765bp
SEQ ID NO.2cbhc核苷酸序列1341bp
SEQ ID NO.3bga核苷酸序列2694bp
/>
/>
- 以甘蔗渣为原料同步发酵生产乙醇和丁二酸的方法与应用
- 一种乳酸菌发酵黄芪的微生态制剂及其制备方法和应用
- 一种以钙盐法生产乳酸的发酵液为原料生产α-半水硫酸钙晶须并同步回收乳酸单体的方法
- 一种以钙盐法生产乳酸的发酵液为原料生产α-半水硫酸钙晶须并同步回收乳酸单体的方法
