基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物
文献发布时间:2024-04-18 19:58:21
技术领域
本申请涉及生物制药领域,具体涉及一种基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物。
背景技术
人呼吸道合胞病毒(Human respiratory syncytial virus,RSV)属于副黏病毒科的肺病毒属(Pneumovirus),主要引起6个月以下婴儿患细支气管炎和肺炎等下呼吸道感染疾病,并会引起较大儿童和成人患鼻炎、感冒等上呼吸道感染疾病。RSV的形态为球形,具有包膜,直径约为120nm至300nm。RSV的基因组为单股负链RNA,主要编码10种蛋白质,即为融合糖蛋白F、黏附糖蛋白G、小疏水蛋白SH、M1基质蛋白、M2基质蛋白、N蛋白、P蛋白、L蛋白、NS1非结构蛋白和NS2非结构蛋白。融合糖蛋白F(Fusion glycoprotein,F)是激发机体产生保护性抗体的主要病毒抗原之一。
RSV是引起婴幼儿下呼吸道感染的重要病毒病原,绝大多数的婴幼儿在2岁以内感染过RSV至少一次。对于1岁以内的婴幼儿,RSV感染引起的死亡人数占总死亡人数的6.7%,仅次于疟疾。对于5岁以内的婴幼儿,RSV感染引起的死亡人数占总死亡人数的6.29%,仅次于肺炎球菌。在我国,26.5%的婴幼儿急性呼吸道感染是因RSV感染引起,老人和存在免疫缺陷的病人也易遭受RSV引起的严重感染,且有RSV感染史的人易出现肺功能异常、支气管哮喘等肺部疾病。
RSV疫苗是预防RSV感染的有效措施之一,RSV疫苗被列为二十一世纪应优先发展的疫苗之一,但目前尚无安全有效的RSV疫苗问世。目前,RSV疫苗的研发主要基于融合糖蛋白F,存在诱发机体产生中和抗体水平较低的问题。因此,有必要提供一种新型的免疫原以提高诱发机体产生中和抗体的水平,对RSV疫苗的应用与发展具有重要意义。
发明内容
针对现有技术的不足之处,本申请提供了一种基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物。
本申请的技术方案如下:
第一方面,本申请提供了一种基于呼吸道合胞病毒融合前F蛋白的突变体,所述突变体是由呼吸道合胞病毒融合前F蛋白的全长或部分区域发生突变获得,所述突变包括一个或多个点突变;
其中,当所述突变包括一个点突变时,所述一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点;
当所述突变包括多个点突变时,所述多个点突变中的至少一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点。
可选地,所述呼吸道合胞病毒融合前F蛋白的氨基酸序列包括如SEQ ID NO:1所示的氨基酸序列,或者包括与SEQ ID NO:1所示的氨基酸序列至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%相似性的氨基酸序列。
可选地,所述突变包括呼吸道合胞病毒融合前F蛋白的全长或部分区域的至少一个弗林蛋白酶切割位点RRXR突变为GSAS,其中,X为任意氨基酸。
第二方面,本申请提供了一种核酸分子,所述核酸分子包括:
第一核苷酸序列,用于编码呼吸道合胞病毒融合前F蛋白的全长或部分区域的氨基酸序列;和/或
第二核苷酸序列,用于编码如第一方面中任意一种所述的突变体的氨基酸序列。
可选地,所述核酸分子还包括下述核苷酸序列中的一种或多种:
(a)第三核苷酸序列,用于编码信号肽的氨基酸序列;
(b)第四核苷酸序列,用于编码T4纤维蛋白三聚体的氨基酸序列;
(c)第五核苷酸序列,用于编码SARS-CoV-2跨膜区的氨基酸序列;
(d)第六核苷酸序列,用于表征嵌合内含子;
(e)第七核苷酸序列,用于表征土拨鼠肝炎病毒转录后调控元件。
可选地,所述第一核苷酸序列如SEQ ID NO:3所示,或者所述第一核苷酸序列为与SEQ ID NO.3所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第二核苷酸序列如SEQ ID NO:4所示,或者所述第二核苷酸序列为与SEQ ID NO.4所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第三核苷酸序列如SEQ ID NO:5或SEQ ID NO:6所示,或者所述第三核苷酸序列为与SEQ ID NO.5所示的核苷酸序列至少具有80%相似性的核苷酸序列,或者所述第三核苷酸序列为与SEQ ID NO.6所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第四核苷酸序列如SEQ ID NO:7所示,或者所述第四核苷酸序列为与SEQ ID NO:7所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第五核苷酸序列如SEQ ID NO:8所示,或者所述第五核苷酸序列为与SEQ ID NO:8所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第六核苷酸序列如SEQ ID NO:9所示,或者所述第六核苷酸序列为与SEQ ID NO:9所示的核苷酸序列至少具有80%相似性的核苷酸序列;
和/或,所述第七核苷酸序列如SEQ ID NO:10所示,或者所述第七核苷酸序列为与SEQ ID NO:10所示的核苷酸序列至少具有80%相似性的核苷酸序列。
可选地,所述核酸分子包括依序串联的第六核苷酸序列、第三核苷酸序列、第一核苷酸序列、第四核苷酸序列和第七核苷酸序列,其中,所述第三核苷酸序列如SEQ ID NO:5所示;
或者,所述核酸分子包括依序串联的第六核苷酸序列、第三核苷酸序列、第二核苷酸序列、第五核苷酸序列和第七核苷酸序列,其中,所述第三核苷酸序列如SEQ ID NO:6所示。
第三方面,本申请提供了一种重组表达载体,所述重组表达载体包括载体,以及装载于载体上的如第二方面中任意一种所述的核酸分子。
可选地,所述载体为腺病毒、安卡拉牛痘病毒或水泡性口炎病毒;
优选地,所述载体为基因组中缺失E1编码区和E3编码区的AdC68型黑猩猩腺病毒;
更优选地,所述载体为基因组中缺失E1编码区和E3编码区并且将E4-orf6区域替换为人Ad5型腺病毒的E4-orf6区域的AdC68型黑猩猩腺病毒。
第四方面,本申请提供了一种重组病毒,所述重组病毒是将如第三方面中任意一种所述的重组表达载体转染病毒包装细胞,然后经细胞培养制备而成。
第五方面,本申请提供了一种药物组合物,包括如第一方面中任意一种所述的突变体、或如第二方面中任意一种所述的核酸分子、或如第三方面中任意一种所述的重组表达载体、或如第四方面中所述的重组病毒。
可选地,所述药物组合物还包括药学上可接受的佐剂和/或辅料;
和/或,所述药物组合物的剂型为滴鼻剂、注射剂、气雾剂、口服制剂、栓剂或胃肠外制剂;
和/或,所述药物组合物为重组蛋白疫苗、DNA疫苗、mRNA疫苗、重组病毒载体疫苗或抗呼吸道合胞病毒感染的药物制剂。
可选地,所述药物组合物为重组蛋白疫苗,所述重组蛋白疫苗包括如第一方面中任意一种所述的突变体;
或者,所述药物组合物为DNA疫苗,所述DNA疫苗包括如第二方面中任意一种所述的核酸分子;
或者,所述药物组合物为mRNA疫苗,所述mRNA疫苗包括编码如第一方面中任意一种所述的突变体的mRNA序列;
或者,所述药物组合物为重组病毒载体疫苗,所述重组病毒载体疫苗包括如第三方面中任意一种所述的重组表达载体、或如第四方面中所述的重组病毒;
或者,所述药物组合物为抗呼吸道合胞病毒感染的药物制剂,所述抗呼吸道合胞病毒感染的药物制剂包括如第一方面中任意一种所述的突变体、或如第二方面中任意一种所述的核酸分子、或如第三方面中任意一种所述的重组表达载体、或如第四方面中所述的重组病毒。
本申请提供了一种基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物,具有如下技术效果:
所述突变体是由呼吸道合胞病毒融合前F蛋白的全长或部分区域发生突变获得,所述突变包括一个或多个点突变,当所述突变包括一个点突变时,所述一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点,当所述突变包括多个点突变时,所述多个点突变中的至少一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点,所述突变体具有理想的免疫原性,能够诱导机体产生高滴度的中和抗体,可应用于制备治疗或预防RSV感染的疫苗和/或药物。
所述核酸分子、所述重组表达载体、所述重组病毒以及所述药物组合物均能应用于制备治疗或预防RSV感染的疫苗和/或药物,具有免疫效果理想和免疫持久性长的优点,所述疫苗和/或药物可以采用成熟的生产工艺进行规模化生产,以快速满足市场需求。
附图说明
下面结合附图,通过对本申请的具体实施方式详细描述,将使本申请的技术方案及其有益效果显而易见。
图1为本申请实施例中提供的pAdC68XY3-preF的结构示意图。
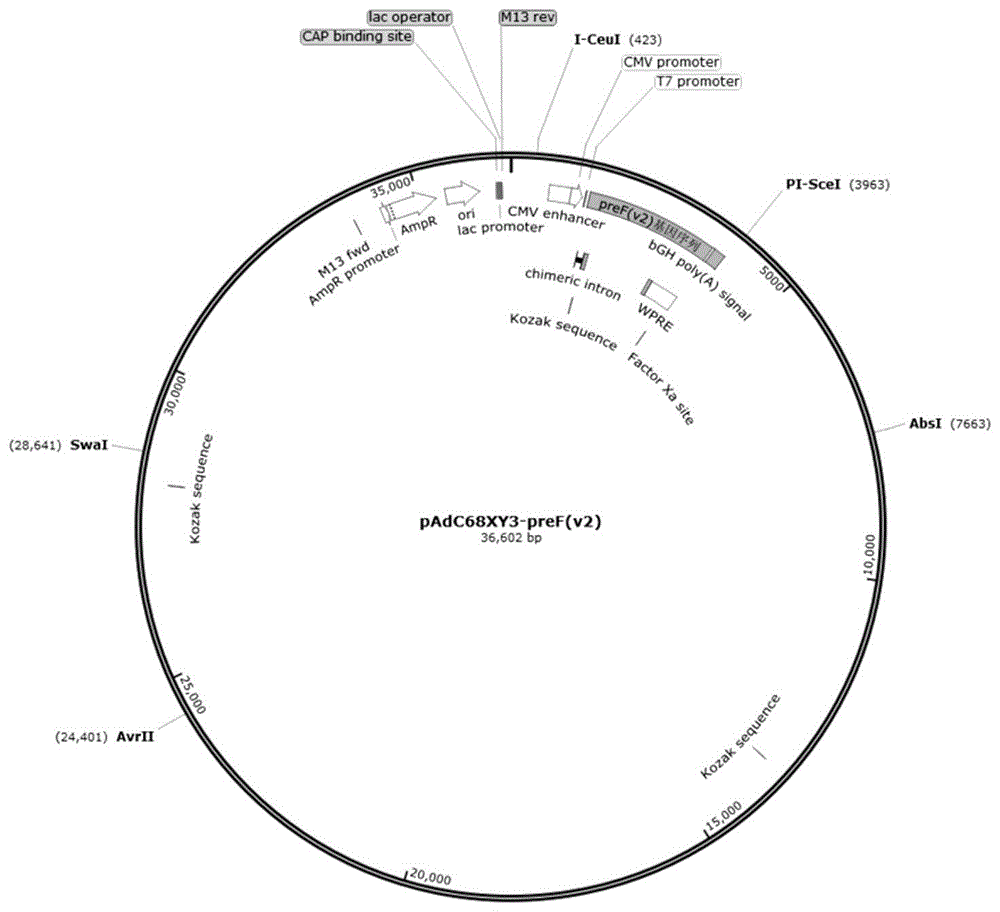
图2为本申请实施例中提供的pAdC68XY3-preF(v2)的结构示意图。
图3为本申请实施例中提供的preF基因片段的结构示意图。
图4为本申请实施例中涉及的部分PCR产物的琼脂糖凝胶电泳图,其中,泳道M代表Marker;泳道1代表以preF-N端基因片段和preF-C端基因片段为重叠PCR模板,使用上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道2代表以pAdC68XY3-preF基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道3代表以rAdC68XY3-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道4代表以rAd5-preF基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道5代表以rMVA-preF基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道6代表以rVSV-preF基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物。
图5为本申请实施例中提供的rAdC68XY3-preF的电镜图。
图6为本申请实施例中涉及的部分蛋白质印迹(Western Blot,WB)图谱,其中,泳道M代表蛋白分子量Maker,泳道1代表经rAdC68XY3-preF感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇),泳道2代表经rAdC68XY3-preF(v2)感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇);泳道3代表经rAd5-preF感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇),泳道4代表经rMVA-preF感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇),泳道5代表经rVSV-preF感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇)。
图7为本申请实施例中提供的preF(v2)基因片段的结构示意图。
图8为本申请实施例中涉及的部分PCR产物的琼脂糖凝胶电泳图,其中,泳道M代表Marker,泳道C代表以rAdC68XY3-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道1代表以rAd5-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物;泳道2代表以rMVA-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物,泳道3代表以rVSV-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物。
图9为本申请实施例中提供的rAdC68XY3-preF(v2)的电镜图。
图10为本申请实施例中涉及的部分蛋白质印迹(Western Blot,WB)图谱,其中,泳道M代表蛋白分子量Maker,泳道1代表经rAdC68XY3-preF(v2)感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇);泳道2代表经rAd5-preF(v2)感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇),泳道3代表经rMVA-preF(v2)感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇),泳道4代表经rVSV-preF(v2)感染后的HEK293A细胞的细胞培养上清液样品(添加有5mmol/L的二硫苏糖醇)。
图11为本申请实验例1中实验组1至实验组8以及阴性对照组的小鼠血清特异性IgG抗体滴度图。
图12为本申请实验例2中实验组1至实验组8以及阴性对照组的特异性IFN-γ平均斑点数图。
具体实施方式
本申请研究了一种基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物,所述突变体是呼吸道合胞病毒融合前F蛋白的全长或部分区域发生突变获得,所述突变包括一个或多个点突变,其中,当所述突变包括一个点突变时,所述一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点,当所述突变包括多个点突变时,所述多个点突变中的至少一个点突变发生于所述呼吸道合胞病毒融合前F蛋白的弗林蛋白酶切割位点。
如本申请所用,“至少一个”是指一个或多个,“多个”是指两个或两个以上。“至少一个”、“至少一种”、“一种或多种”、、“一个或多个”或其类似表达,指的是这些项中的任意组合,包括单个(种)或复数个(种)的任意组合。例如,“a、b或c中的至少一个(种)”或“a,b和c中的至少一个(种)”均可表示为:a、b、c、a-b(即a和b)、a-c、b-c或a-b-c,其中,a,b和c分别可以是单个(种)或多个(种)。
如本申请所用,“呼吸道合胞病毒融合前F蛋白”简称preF糖蛋白,preF糖蛋白是融合糖蛋白F的亚稳态糖蛋白,即天然融合糖蛋白F主要有亚稳态的preF糖蛋白和稳定的融合后F糖蛋白。preF糖蛋白存在于RSV颗粒的表面以及RSV感染细胞的胞质内,在RSV的不同成熟阶段中,preF糖蛋白以不同的糖基化形式存在。
如本申请所用,“呼吸道合胞病毒融合前F蛋白的至少部分片段”是指preF糖蛋白的部分片段或preF糖蛋白全长,preF糖蛋白的部分片段例如可以是preF糖蛋白的胞外区片段。在本申请的一些实施例中,preF糖蛋白的部分片段的氨基酸序列如SEQ ID NO:1所示。可以理解的是,preF糖蛋白的部分片段的氨基酸序列也可以是与SEQ ID NO:1所示的氨基酸序列至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%相似性的氨基酸序列。
“相似性”是指两个氨基酸序列或两个核苷酸序列之间的相关性,例如:preF糖蛋白的部分片段的氨基酸序列与SEQ ID NO:1所示的氨基酸序列之间的相关性。在本申请实施例中,至少具有80%以上相似性可以理解为80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列相似性,对应相似性的数值为整数;也可以进一步理解为80.1%、81.2%、82.3%、83.4%、84.5%、85.6%、86.7%、87.8%、88.9%、89.8%、90.3%、91.7%、92.2%、93.5%、94.8%、95.9%、96.6%、97.5%、98.4%或99.9%,但小于100%的序列相似性,对应相似性的数值为小数。
如本申请所用,“点突变”是指特定位点的氨基酸的取代、缺失或插入。
如本申请所用,“弗林蛋白酶切割位点”是指Furin酶能识别切割的片段,其中,Furin酶是真核动物体内一种高度特异性的丝氨酸内切蛋白酶,属于前体蛋白转化酶家族,能识别切割前体蛋白进而激活其活性。弗林蛋白酶切割位点的最短序列为-R-X-X-R(切割位点)-,其中,R为精氨酸(Arg),X为任意氨基酸。
在本申请的一些实施例中,所述突变包括preF糖蛋白的全长或部分区域的至少一个弗林蛋白酶切割位点RRXR突变为GSAS,其中,X为任意氨基酸。可以理解的是,可以是preF糖蛋白的部分片段的全部弗林蛋白酶切割位点RRXR均突变为GSAS,也可以是preF糖蛋白的部分片段的部分弗林蛋白酶切割位点RRXR突变为GSAS,也可以是preF糖蛋白全长的全部弗林蛋白酶切割位点RRXR均突变为GSAS,也可以是preF糖蛋白全长的部分弗林蛋白酶切割位点RRXR突变为GSAS。
在本申请的一些实施例中,突变体的氨基酸序列为SEQ ID NO:2所示的氨基酸序列,或者与SEQ IDNO:2所示的氨基酸序列至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%相似性的氨基酸序列。具有如SEQ ID NO:2所示氨基酸序列的突变体命名为preF(v2)。
本申请的“核酸分子”是指由许多核苷酸聚合成的生物大分子化合物,例如可以是通过聚合酶链式反应(PCR)或通过体外翻译产生的脱氧核糖核酸(DNA)片段、核糖核酸(RNA)片段以及寡核苷酸片段中的任意一种,以及通过连接、切割、内切核酸酶作用或外切核酸酶作用中的任意一种或多种产生的片段,可以是单链的或双链的。在本申请实施例中,核酸分子包括编码区和非编码区,非编码区例如包括启动子、内含子、外显子以及终止子中的一种或多种,非编码区还可以任选地包括增强子或其他表达调控元件。
在本申请的一些实施例中,核酸分子包括第一核苷酸序列和/或第二核苷酸序列,其中,第一核苷酸序列用于编码preF糖蛋白的全长或部分区域的氨基酸序列,第二核苷酸序列用于编码突变体的氨基酸序列。
如本申请所用,“和/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。比如,“A和/或B”包括A、B以及A+B三种并列方案。又比如,“A,及/或,B,及/或,C,及/或,D”的技术方案,包括A、B、C、D中任一项(也即均用“逻辑或”连接的技术方案),也包括A、B、C、D的任意的和所有的组合,也即包括A、B、C、D中任两项或任三项的组合,还包括A、B、C、D的四项组合(也即均用“逻辑与”连接的技术方案)。
在本申请的一些实施例中,第一核苷酸序列如SEQ ID NO:3所示,或者第一核苷酸序列为与SEQ IDNO.3所示的核苷酸序列具有不低于80%的相似性的核苷酸序列。
在本申请的一些实施例中,第二核苷酸序列如SEQ ID NO:4所示,或者第二核苷酸序列为与SEQ IDNO.4所示的核苷酸序列具有不低于80%的相似性的核苷酸序列。
在本申请的一些实施例中,核酸分子还包括下述核苷酸序列中的一种或多种:
(a)第三核苷酸序列,用于编码信号肽的氨基酸序列;
(b)第四核苷酸序列,用于编码T4纤维蛋白三聚体的氨基酸序列;
(c)第五核苷酸序列,用于编码SARS-CoV-2跨膜区的氨基酸序列;
(d)第六核苷酸序列,用于表征嵌合内含子;
(e)第七核苷酸序列,用于表征土拨鼠肝炎病毒转录后调控元件。
对于(a),“信号肽”是指一类引导表达蛋白由细胞内分泌至细胞外的多肽,长度例如为5个至30个氨基酸。在本申请的一些实施例中,信号肽选自催乳素前导序列多肽(Prolactin Leader sequence,PL)、Js信号肽(JEV signal peptide)以及IL2信号肽中的至少一种。
在本申请的一些实施例中,第三核苷酸序列用于编码PL的氨基酸序列,第三核苷酸序列如SEQ IDNO:5所示,或者第三核苷酸序列为与SEQ ID NO.5所示的核苷酸序列至少具有80%相似性的核苷酸序列。
在本申请的一些实施例中,第三核苷酸序列用于编码Js信号肽的氨基酸序列,第三核苷酸序列如SEQ ID NO:6所示,或者第三核苷酸序列为与SEQ ID NO.6所示的核苷酸序列至少具有80%相似性的核苷酸序列。
对于(b),“T4纤维蛋白三聚体”是指通过T4纤维蛋白折叠体(T4 fibritinfoldon,来源于噬菌体)形成的一个稳定的类似三角形的3价受体结构域。
在本申请的一些实施例中,第四核苷酸序列如SEQ ID NO:7所示,或者第四核苷酸序列为与SEQ IDNO:7所示的核苷酸序列至少具有80%相似性的核苷酸序列。
对于(c),“SARS-CoV-2跨膜区”是指新型冠状病毒S蛋白的跨膜结构域(Transmembrane Domain,TMD),其中,新型冠状病毒S蛋白可以是新型冠状病毒原型株(代号为wuhan-hu-1,基因组对应的GenBank编号为MN908947)的S蛋白,也可以是新型冠状病毒变异株的S蛋白,新型冠状病毒变异株包括但不限于是Alpha新型冠状病毒变异株、Beta新型冠状病毒变异株、Gamma(Zeta)新型冠状病毒变异株、Delta新型冠状病毒变异株、Lambda新型冠状病毒变异株或Omicron新型冠状病毒变异株。
在本申请的一些实施例中,第五核苷酸序列如SEQ ID NO:8所示,或者第五核苷酸序列为与SEQ IDNO:8所示的核苷酸序列至少具有80%相似性的核苷酸序列。
对于(d),“嵌合内含子”是指一种组合型的内含子,其具有提高外源基因表达的转录水平的作用。
在本申请的一些实施例中,第六核苷酸序列如SEQ ID NO:9所示,或者第六核苷酸序列为与SEQ IDNO:9所示的核苷酸序列至少具有80%相似性的核苷酸序列。
对于(e),“土拨鼠肝炎病毒转录后调控元件”是指一段顺式作用的RNA元件,其是增强目标基因表达的转录后调控元件,英文名称为Woodchuck Hepatitis Virus Post-transcriptional Regulatory Element,简称为WPRE。
在本申请的一些实施例中,第七核苷酸序列如SEQ ID NO:10所示,或者第七核苷酸序列为与SEQ ID NO:10所示的核苷酸序列至少具有80%相似性的核苷酸序列。
在本申请的一些实施例中,核酸分子包括依序串联的第六核苷酸序列、第三核苷酸序列、第一核苷酸序列、第四核苷酸序列和第七核苷酸序列,其中,第三核苷酸序列如SEQID NO:5所示。
在本申请的一些实施例中,核酸分子包括依序串联的第六核苷酸序列、第三核苷酸序列、第二核苷酸序列、第五核苷酸序列和第七核苷酸序列,其中,所述第三核苷酸序列如SEQ ID NO:6所示。
本申请实施例的重组表达载体包括载体以及装载于载体上的核酸分子,核酸分子参照前文描述。
如本申请所用,“重组表达载体”是指一种核酸分子构建体,其含有与合适的控制序列可操作地连接的核酸分子,控制序列能够实现核酸分子在合适的表达系统中表达。在本申请的一些实施例中,重组表达载体为pAdC68XY3-preF。在本申请的另一些实施例中,重组表达载体为pAdC68XY3-preF(v2)。
如本申请所用,“载体”是指利用基因工程重组技术将目标核酸分子转移至受体细胞进行扩增和表达的工具,例如可以是质粒、病毒、粘粒等,病毒例如可以是腺病毒、安卡拉牛痘病毒(MVA)、水泡性口炎病毒(VSV)等,腺病毒例如可以是Ad5型人腺病毒、Ad26型人腺病毒、AdC3型黑猩猩腺病毒、AdC7型黑猩猩腺病毒、AdC68型黑猩猩腺病毒等。
在本申请的一些实施例中,载体为基因组中缺失E1编码区和E3编码区的AdC68型黑猩猩腺病毒,例如载体为基因组中缺失E1编码区和E3编码区并且将E4-orf6区域替换为人Ad5型腺病毒的E4-orf6区域的AdC68型黑猩猩腺病毒。
本申请的重组病毒是将上述任意一种重组表达载体转染病毒包装细胞,然后经细胞培养制备而成,其中,细胞例如可以是昆虫细胞、哺乳动物细胞、植物细胞等,哺乳动物细胞例如可以是COS(绿猴细胞系)、CHO(中国仓鼠卵巢细胞系)、小鼠细胞、人类细胞等。在本申请的一些实施例中,重组病毒为重组腺病毒,对应的病毒包装细胞为HEK293细胞。
本申请的药物组合物包括上述任意一种突变体、或上述任意一种核酸分子、或上述任意一种重组表达载体、或上述任意一种重组病毒。
如本申请所用,“药物组合物”包括治疗目的的组合物和免疫/预防目的的组合物,其中,“治疗目的”是指改善或减轻呼吸道合胞病毒感染的至少一种症状,可以延迟呼吸道合胞病毒感染的恶化或进展,或可以延迟或阻止因呼吸道合胞病毒感染而引起的其他疾病或并发症的发作。所述免疫/预防目的是指可以刺激或引起生物体产生免疫应答以达到预防呼吸道合胞病毒感染目的。药物组合物例如可以是减毒活疫苗、灭活疫苗、亚单位疫苗、重组基因疫苗、重组病毒载体疫苗、核酸疫苗或抗呼吸道合胞病毒药物制剂。
在本申请的一些实施例中,药物组合物包括rAdC68XY3-preF重组腺病毒。
在本申请的一些实施例中,药物组合物包括rAdC68XY3-preF(v2)重组腺病毒。
如本申请所用,“免疫”是指机体免疫系统识别自身与异己物质,并通过免疫应答排出抗原性异物,以维持机体生理平衡的功能,包括天然免疫和获得性免疫。在本申请的一个实施例中,通过对受试者注射有效量的rAdC68XY3-preF重组腺病毒或rAdC68XY3-preF(v2)重组腺病毒,而引起机体免疫系统针对免疫原(preF糖蛋白的胞外区蛋白)的免疫应答反应。
如本申请所用,“受试者”是指能够发生细胞免疫应答的任何生物体,包括人类和其他哺乳类动物,还包括已被RSV感染且尚未治愈、曾被RSV感染且已治愈或具有RSV感染风险的任何个体。落入本申请范围内的合适的哺乳类动物包括但不限于:灵长类、家畜(例如羊、牛、马、猴、猪等)、实验室试验动物(例如兔、鼠等)、宠物(例如猫、狗等)和圈养野生动物(例如狼、狐狸、鹿等)。在本申请实施例中,受试者为试验小鼠。
如本申请所用,“有效量”是指足以以统计上显著的方式导致正在治疗的疾病的一种或多种症状改善的给药剂量,或是能够刺激细胞免疫应答以达到预防疾病目的的给药剂量。有效量取决于众多因素,例如:药物的活性、采用的递送方式等,且可以由本领域技术人员根据对象的个体情况容易地确定。
在本申请的一些实施例中,药物组合物还包括药学上可接受的佐剂和/或辅料。
如本申请所用,“佐剂”是指通过增强巨噬细胞活性促进机体T细胞或B细胞的反应,参与半抗原或抗原免疫应答的天然的或合成的物质,佐剂能增强药物组合物的特异性免疫反应,从而提升药物组合物的免疫效果。可与本申请实施例的药物组合物共同施用的佐剂包括但不限于干扰素、趋化因子、肿瘤坏死因子、颗粒溶素、乳铁蛋白、卵白蛋白和白细胞介素。
如本申请所用,“辅料”是指生产药物组合物和调配处方时所用的赋形剂和附加剂,具有赋形、保护活性成分、提高稳定性、增溶、助溶、缓控释等重要功能,以使药物组合物达到一定的保质期和生物利用度,从而提高药物组合物的安全性和有效性。可与本申请实施例的药物组合物共同施用的辅料包括但不限于糖、蛋白、氨基酸和高分子聚合物。
在本申请的一些实施例中,药物组合物的剂型为滴鼻剂、注射剂、气雾剂、口服制剂、栓剂或胃肠外制剂。
在本申请的一些实施例中,滴鼻剂选自自气雾剂、喷雾剂或粉雾剂。
在本申请的一些实施例中,口服制剂选自片剂、粉末剂、丸剂、散剂、颗粒剂、细粒剂、软/硬胶囊剂、薄膜包衣剂、小丸剂、舌下片或膏剂。
在本申请的一些实施例中,胃肠外制剂选自经皮剂、软膏剂、硬膏剂、外用液剂、可注射或可推注制剂。
在本申请的一些实施例中,药物组合物为重组蛋白疫苗、DNA疫苗、mRNA疫苗、重组病毒载体疫苗或抗SARS-CoV-2药物制剂。
在本申请的一些实施例中,药物组合物为重组蛋白疫苗,药物组合物包括上述任意一种所述的突变体。
在本申请的一些实施例中,药物组合物为DNA疫苗,药物组合物包括上述任意一种所述的核酸分子。
在本申请的一些实施例中,药物组合物为mRNA疫苗,药物组合物包括编码上述任意一种所述的突变体的mRNA序列。
在本申请的一些实施例中,药物组合物为重组病毒载体疫苗,药物组合物包括上述任意一种所述的重组表达载体、或上述任意一种所述的重组病毒。
在本申请的一些实施例中,药物组合物为抗呼吸道合胞病毒感染的药物制剂,抗呼吸道合胞病毒感染的药物制剂包括上述任意一种所述的突变体、或上述任意一种核酸分子、或上述任意一种重组表达载体、或上述任意一种重组病毒。
本申请实施例还提供了一种免疫方法,具体为:将有效量的上述药物组合物以鼻喷给药、滴鼻给药、气溶胶吸入式给药、肌肉注射、皮下注射或口服给药的方式中的至少一种给药于受试者。
下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本申请一部分实施例,而不是全部的实施例。基于本申请中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本申请保护的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor LaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。下列实施例中涉及的动物实验在GLP(Good Laboratory Practice)实验室条件下开展,并按照“动物福利伦理审查实验室动物指南”处理动物。
除非另行定义,文中所使用的所有专业与科学用语与本领域技术人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用,但不能限制本申请的内容。术语“第一”、“第二”、“第三”、“第四”、“第五”、“第六”以及“第七”仅用于描述目的,而不能理解为指示或暗示相对重要性,也并非指示或暗示先后顺序。
Ⅰ、本申请实施例中涉及细胞、质粒以及病毒的说明详见下表1:
表1本申请实施例中涉及细胞、质粒、病毒及动物的说明
Ⅱ、本申请实施例中涉及的基因片段、蛋白、试剂、溶液以及培养基的说明:
本申请实施例中涉及的除引物之外的基因片段由生工生物工程(上海)股份有限公司合成。
本申请实施例中涉及的所有引物是由武汉擎科生物技术有限公司合成。
本申请实施例中涉及的限制性内切酶(如:(如:NotI、KpnI、XmaI、BamHI和PacI))、归位内切酶(如:PI-SceI和I-CeuI)、连接酶(如:T4连接酶)、酶切缓冲液(10×NEBCutSmart buffer)、PCR反应混合液(2×PrimerSTAR mix)以及双蒸水(ddH
本申请实施例中涉及的胶回收试剂盒、质粒提取试剂盒、PCR产物回收试剂盒以及病毒RNA/DNA提取试剂盒均购自美国的Axygen公司。
本申请实施例中涉及的Lipofectamine
本申请实施例中涉及的PVDF(Polyvinylidene-Fluoride)膜购自美国默克(Merck)公司。
本申请实施例中涉及的辣根过氧化物酶(HRP)标记的羊抗鼠IgG购自上海碧云天生物技术有限公司。
本申请实施例中涉及的3,3’,5,5’-四甲基联苯胺(TMB)购自美国的KPL公司。
本申请实施例中涉及的MEM培养基和DMEM培养基均购自美国的Hyclone实验室,LB培养基为自行配制,每100mL的LB液体培养基中包括:1.0g的蛋白胨,0.5g的酵母粉,以及1.0g的NaCl,对于LB固体培养基是在LB液体培养基配方的基础上添加20g/L的琼脂。
本申请实验例中涉及的Elispot板购自深圳市达科为生物技术股份有限公司。
本申请实验例中涉及的碳酸钠缓冲液(pH为9.6)配方为:1000mL的碳酸钠缓冲液中,包括8.4g的碳酸氢钠(NaHCO
本申请实验例中涉及的PBST缓冲液为含有0.1%(质量百分数)吐温-20的PBS缓冲液。
本申请实验例中涉及的封闭液为含有10%(质量百分数)脱脂奶粉的PBS缓冲液。本申请实验例中涉及的RPMI-1640培养基购自SIGMA公司(货号为R6504)。
Ⅲ、重组病毒表达目标蛋白的实验过程说明
以rAdC68XY3-preF(v2)的表达为例进行说明,具体包括如下步骤:
S1、将HEK293细胞按5×10
S2、当单孔内HEK293细胞的汇合率达到90%时,将rAdC68XY3-preF(v2)接种于对应孔内,rAdC68XY3-preF(v2)按照感染复数(Multiplicity Of Infection,MOI)0.2进行接种,并设置未接种有rAdC68XY3-preF(v2)的HEK293细胞作为阴性对照,在37℃的条件下静置培养48h,培养结束后先将粘壁细胞刮于细胞培养液中,再将细胞培养液离心,并分别收集上清液和沉淀,将该上清液标记为细胞培养上清液;向沉淀中加入100μL的哺乳动物细胞裂解液并置于冰上裂解,裂解充分后3500×g离心5min,取上清标记为细胞裂解液;
S3、制备细胞培养上清液待检样品和细胞裂解液待检样品:分别取80μL的细胞培养上清液和80μL的细胞裂解液,然后分别加入20μL五倍浓缩的SDS-PAGE上样缓冲液(5×SDS-PAGE Loading Buffer),并分别在100℃下煮沸5min,分别获得细胞培养上清液待检样品和细胞裂解液待检样品;
S4、结合聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹(Western Blot,WB)技术检测步骤S300获得的细胞培养上清液待检样品和细胞裂解液待检样品中preF(v2)蛋白的表达。
其中,结合SDS-PAGE和WB技术检测步骤S3获得的细胞培养上清液待检样品和细胞裂解液待检样品中preF(v2)蛋白表达的方法包括如下步骤:
S401、将步骤S3的细胞培养上清液待检样品和细胞裂解液待检样品分别进行8%SDS-PAGE电泳,电泳条件为:(ⅰ)保持电压100V的电压条件20min;(ⅱ)保持电压160V的电压条件80min;
S402、电泳结束后用湿转法将目标蛋白(preF(v2)蛋白)转印至PVDF膜,然后将附着有目标蛋白的PVDF膜浸泡于含5%(质量百分比)脱脂奶粉的PBST溶液中,在4℃下封闭过夜;
S403、采用PBST溶液清洗封闭后的PVDF膜两次,然后将PVDF膜浸泡于鼠抗D25单克隆抗体稀释液(稀释比例为1:5000)中,在37℃下孵育1h;
S404、采用PBST溶液清洗完成步骤S403的PVDF膜两次,然后将PVDF膜浸泡于辣根过氧化物酶(HRP)标记的羊抗鼠IgG稀释液(稀释比例为1:5000)中,在37℃下孵育1h;
S405、采用PBST溶液清洗完成步骤S404的PVDF膜两次,然后将ECL显色液加至于PVDF膜的附着有目的蛋白的一面上,化学发光法显色。
本申请实施例中其他重组病毒的表达参照上述实验过程,其中,rMVA-preF、rVSV-preF、rMVA-preF(v2)和rVSV-preF(v2)表达所使用的感染细胞均为BHK-21细胞,并且对应步骤S2中的MOI为5。
下面结合实施例、对比例和实验例进一步说明本发明的技术方案和有益效果。
实施例1
本实施例提供了rAdC68XY3-preF及其制备方法,rAdC68XY3-preF的制备方法包括如下步骤:
1.1、制备pShuttle-preF重组质粒
本实施例选择未插入外源基因的pShuttle-CMV质粒作为pShuttle-preF的载体,pShuttle-CMV质粒为穿梭型质粒,其上含有CMV增强子、CMV启动子、T7启动子、嵌合内含子、bGH poly(A)加尾信号以及NotI和KpnI双酶切位点,并且具有卡那霉素(Kanamycin,Kana)抗性。
将preF基因片段插入至pShuttle-CMV质粒的多克隆位点以获得pShuttle-preF重组质粒,其中,图3示出了preF基因片段(未示出Kozak序列)的结构组成,preF基因片段包括依序串联的第六核苷酸序列、第三核苷酸序列、第一核苷酸序列、第四核苷酸序列和第七核苷酸序列组成,preF基因片段的核苷酸序列如SEQ ID NO:11所示,第六核苷酸序列如SEQID NO:9所示,第三核苷酸序列如SEQ ID NO:5所示,第一核苷酸序列如SEQ ID NO.3所示,第四核苷酸序列如SEQ ID NO:7所示,第七核苷酸序列如SEQ ID NO:10所示。
pShuttle-preF重组质粒的制备方法包括如下步骤:
S1.1.1、在preF基因片段的3’端和5’端分别添加NotI和KpnI酶切位点,然后进行基因合成以获得preF-hO基因片段,以preF-hO基因片段作为模板,采用上游引物PreF-PS-F(核苷酸序列如SEQ ID NO:12所示)和下游引物PreF-PS-R1(核苷酸序列如SEQ ID NO:13所示)对模板进行N端PCR扩增以获得preF-N端基因片段,以及采用上游引物PreF-PS-F1(核苷酸序列如SEQ ID NO:14所示)和下游引物PreF-PS-R(核苷酸序列如SEQ ID NO:15所示)对模板进行C端PCR扩增以获得preF-C端基因片段,再以preF-N端基因片段和preF-C端基因片段为重叠PCR模板,使用上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增,获得preF基因片段全长的PCR产物(命名为preF-PCR片段)
S1.1.2、采用NotI和KpnI限制性内切酶对preF-PCR片段进行双酶切,酶切完全后采用胶回收试剂盒回收目的基因片段;
S1.1.3、采用NotI和KpnI限制性内切酶对未插入外源基因的pShuttle-CMV质粒进行双酶切,酶切完全后采用胶回收试剂盒回收质粒骨架;
S1.1.4、在T4连接酶的作用下,将步骤S1.1.2的目的基因片段与步骤S1.1.3的质粒骨架置于16℃连接过夜,获得连接产物;
S1.1.5、采用热激转化方式将步骤S1.1.4的连接产物导入至大肠杆菌TOP10感受态细胞中,然后涂布于含有100μg/mL卡那霉素抗性的LB平板上,37℃静置培养过夜后挑取单菌落依次进行LB液态培养、提取质粒和质粒测序操作,测序结果正确的质粒即为pShuttle-preF重组质粒。
对上述步骤需要说明的是,步骤S1.1.3可以在步骤S1.1.1和步骤S1.1.2之前进行,也可以与步骤S1.1.1和步骤S1.1.2同时进行。
其中,步骤S1.1.1中N端PCR扩增、C端PCR扩增以及重叠PCR均为20μL反应体系,其中,DNA聚合酶为10μL,上游引物为1μL,下游引物为1μL,模板为1μL,双蒸水为7μL。N端PCR扩增和C端PCR扩增的PCR反应程序均为:①98℃预变性3min;②98℃变性25s;③54℃退火25s;④72℃延伸25s;⑤重复②~④30个循环;⑥72℃,3min。重叠PCR的PCR反应程序为:①98℃预变性3min;②98℃变性25s;③54℃退火25s;④72℃延伸45s;⑤重复②~④30个循环;⑥72℃,3min。
1.2、制备pAdC68XY3-preF重组表达载体
选择自行构建的pShuttle-preF重组质粒和商购的pAdC68XY3-GFP重组质粒制备pAdC68XY3-preF重组表达载体,pAdC68XY3-preF重组表达载体的制备方法包括如下步骤:
S1.2.1、采用PI-SceI和I-CeuI归位内切酶对pShuttle-preF进行双酶切,酶切完全后采用胶回收试剂盒回收目的基因片段,目的基因片段包括preF基因片段以及用于表达preF糖蛋白胞外区蛋白的表达框;
S1.2.2、采用PI-SceI和I-CeuI归位内切酶对pAdC68XY3-GFP进行双酶切,酶切完全后采用胶回收试剂盒回收载体骨架;
S1.2.3、在T4连接酶的作用下,将步骤1.2.1的目的基因片段与步骤1.2.2的载体骨架置于16℃连接过夜,获得pAdC68XY3-preF连接产物;
S1.2.4、采用热激转化方式将pAdC68XY3-preF连接产物导入至大肠杆菌TOP10感受态细胞中,然后涂布于含有100μg/mL卡那霉素抗性的LB平板上,37℃静置培养过夜后挑取单菌落依次进行LB液态培养、提取质粒和质粒测序操作,测序结果正确的质粒即为pAdC68XY3-preF重组表达载体;
S1.2.5、采用PacI限制性内切酶酶切pAdC68XY3-preF重组表达载体,以使pAdC68XY3-preF重组表达载体线性化,其中,酶切体系为50μL,酶切体系包括:5μL的酶切缓冲液(10×NEB CutSmart buffer),5μL的PacI限制性内切酶,10μg的pAdC68XY3-preF,余量为双蒸水(ddH2O),酶切温度为37℃,酶切时间为3h,采用1%琼脂糖凝胶电泳检测酶切完全后,采用PCR产物回收试剂盒回收酶切产物,并采用微量核酸定量仪对回收的酶切基因片段进行定量分析。
1.3、制备rAdC68XY3-preF重组腺病毒以及鉴定rAdC68XY3-preF重组腺病毒基因组中的preF基因片段
对步骤S1.2.5回收的酶切基因片段进行转染操作,采用LipofectamineTM2000试剂盒进行转染操作,并选择HEK293细胞作为表达系统。根据LipofectamineTM2000试剂盒的操作说明,将酶切基因片段转染于汇合度为60~70%的HEK293细胞内。
在LipofectamineTM2000试剂盒操作说明的“接种细胞”步骤中,用于培养HEK293细胞的培养基为MEM培养基,并在转染前2h将MEM培养基更换为DMEM培养基。转染5h后,更换培养基为含10%(体积百分比)胎牛血清的DMEM培养基。
转染隔日,在倒置显微镜下观察细胞病变,直至60%的HEK293细胞出现噬斑时收集细胞。将收集的细胞在室温(25℃)与-80℃之间反复冻融3次,然后在1200×g的转速下离心5min,收集上清液,获得的上清液中包含rAdC68XY3-preF重组腺病毒,并将上清液分装后置于-80℃超低温冰箱保存备用。
采用病毒RNA/DNA提取试剂盒对上述保存的上清液进行全基因组提取操作,然后以提取的rAdC68XY3-preF重组腺病毒基因组DNA为模板,在上游引物PreF-PS-F和下游引物PreF-PS-R的存在下进行PCR扩增,其中PCR反应体系为20μL,PCR反应体系由10μL的PCR反应混合液(2×PrimerSTAR mix)、1μL的上游引物PreF-PS-F、1μL的下游引物PreF-PS-R、1μL的模板以及7μL的ddH
PCR反应结束后,将PCR产物进行1%琼脂糖凝胶电泳,并将以正常HEK293细胞的全基因组DNA作为模板进行PCR获得的PCR产物作为阴性对照,将以pAdC68XY3-preF作为模板进行PCR获得的PCR产物作为阳性对照,1%琼脂糖凝胶电泳结果如图4所示。采用胶回收试剂盒切胶回收目的条带并测序,测序结果正确代表目的条带即为preF基因片段。
1.4、rAdC68XY3-preF重组腺病毒的纯化及检定
1.4.1、小规模扩增rAdC68XY3-preF
具体包括如下步骤:
S1.4.1.1、提供汇合度为90%的HEK293细胞,将rAdC68XY3-preF按照MOI 2接种于所述HEK293细胞中,并置于37℃、5%(体积百分比)CO
S1.4.1.2、待培养至70%以上的HEK293变圆和脱落时,使用细胞刮将粘壁细胞刮下,然后将细胞培养液2265×g离心10min,并分别收集上清液和细胞沉淀;
S1.4.1.3、将步骤S1.4.1.2收集的细胞沉淀重悬于PBS缓冲液中,并在室温(25℃)与-80℃之间反复冻融3次,2265×g离心10min以收集上清液,并将收集的上清液与步骤S1.4.1.2收集的上清液合并,获得rAdC68XY3-preF保存液。
1.4.2、纯化rAdC68XY3-preF
具体包括如下步骤:
S1.4.2.1、在生物安全柜中,向一50mL的离心管中缓慢加入12mL密度为1.4g/mL的氯化铯溶液,然后加入9mL密度为1.2g/mL的氯化铯溶液,接着在不连续梯度的顶部加入13mL的rAdC68XY3-preF保存液,获得待纯化的rAdC68XY3-preF样品;
S1.4.2.2、将步骤S1.4.2.1中待纯化的rAdC68XY3-preF样品置于4℃、100000×g离心120min,离心后抽吸病毒带,获得包含rAdC68XY3-preF的溶液;
S1.4.2.3、将步骤S1.4.2.2中包含rAdC68XY3-preF的溶液转移至无菌的离心管内,向其中加入等体积的10mmol/L的Tris-HCl缓冲液(pH为7.9),获得稀释的rAdC68XY3-preF悬液;
S1.4.2.4、另取一离心管,向其中加入20mL密度为1.35g/mL的氯化铯溶液,然后在氯化铯溶液的顶部加入15mL的步骤S5.2.3中稀释的rAdC68XY3-preF悬液,平衡所述离心管后,置于4℃、100000×g离心18h,离心后收集蓝白色病毒带;
S1.4.2.5、将步骤S1.4.2.4获得的蓝白色病毒带置于10000道尔顿的纤维素酯膜中,然后在4℃下透析至PBS溶液中以去除氯化铯,获得纯化的rAdC68XY3-preF溶液,加入10%(体积百分数)甘油后分装存于-80℃冰箱中以备用,纯化的rAdC68XY3-preF如图5所示。
1.4.3、rAdC68XY3-preF的滴度检定
采用腺病毒滴度-TCID
1.4.4采用SDS-PAGE和WB技术鉴定rAdC68XY3-preF表达preF糖蛋白的胞外区蛋白
如图6所示,rAdC68XY3-preF感染HK293细胞48h后获得的细胞培养上清液待检样品中能检测到preF糖蛋白的胞外区蛋白,说明rAdC68XY3-preF在HEK293细胞中成功地表达了preF糖蛋白的胞外区蛋白。
实施例2
本实施例提供了rAd5-preF重组腺病毒及其制备方法,相较于实施例1中rAdC68XY3-preF,本实施例中rAd5-preF的区别之处仅在于:将载体由“pAdC68XY3”替换为人5型腺病毒载体rAd5-CMV-Dest,并且将preF基因片段插入至人5型腺病毒载体rAd5-CMV-Dest的E1区域。
本实施例中rAd5-preF的制备方法参照实施例1进行,将制得的纯化的rAd5-preF溶液加入10%(体积百分数)甘油后分装存于-80℃冰箱中以备用,纯化的rAd5-preF溶液中rAd5-preF的滴度为1.8×10
实施例3
本实施例提供了rMVA-preF重组安卡拉牛痘病毒及其制备方法,相较于实施例1中的rAdC68XY3-preF,本实施例中rMVA-preF的区别之处仅在于:将载体由“pAdC68XY3”替换为安卡拉牛痘病毒MVA。
rMVA-preF的制备方法包括如下步骤:
S3.1、构建pLW-73-preF重组表达载体:参照专利ZL200780035385.3构建获得pLW-73载体,将preF基因片段经PCR扩增后使用XmaI和BamHI双酶切以获得酶切产物,采用XmaI和BamHI双酶切pLW-73载体后获得的载体骨架与所述酶切产物连接,并将连接产物转化DH5α大肠杆菌感受态,37℃培养过夜后挑取测序正确的阳性克隆子。
S3.2、制备rMVA-preF:将MVA病毒(Ankara株)按照MOI 0.01感染BHK-21细胞1h,然后将步骤S3.1构建的pLW-73-preF表达载体转染BHK-21细胞72h,离心收集细胞,采用DMEM重悬收集的细胞获得细胞悬浮液,将细胞悬浮液置于-60℃/37℃反复冻融三次后,超声1min,收集病毒液并分装,接着依照专利ZL200780035385.3记载的方法进行6~7轮空斑纯化,筛选获得阳性病毒;将阳性病毒按照MOI 5感染汇合度约90%的BHK-21细胞,37℃培养72h后离心,离心收集细胞,采用DMEM重悬收集的细胞获得细胞悬浮液,将细胞悬浮液置于-60℃/37℃反复冻融三次后,超声1min,收集病毒液,再将收集的病毒液进行氯化铯密度梯度离心纯化,获得纯化的rMVA-preF溶液,采用SDS-PAGE和WB技术鉴定rMVA-preF表达preF糖蛋白的胞外区蛋白。
S3.3、测定rMVA-preF的滴度:采用完全DMEM培养基对纯化的rMVA-preF溶液进行10倍系列稀释,对应10
实施例4
本实施例提供了rVSV-preF重组水泡性口炎病毒及其制备方法,相较于实施例1中的rAdC68XY3-preF,本实施例中rVSV-preF的区别之处仅在于:将载体由“pAdC68XY3”替换为水泡性口炎病毒VSV。
S4.1、构建重组表达载体:参照文献(N D Lawson,E AStillman,M A Whitt and JK Rose.Recombinant vesicular stomatitis viruses from DNA[J].PNAS,1995:Vol.92,4477-4481)构建获得pVSVFL(+)质粒,同时依照文献方法从pET28a载体中扩增T7终止子,并分别同N、P、L基因进行融合PCR后插入pSK(+)质粒中以获得pSK-N重组质粒、pSK-P重组质粒和pSK-L重组质粒;继续参照文献方法,在preF基因片段经PCR扩增后的产物的5’端加入MluI酶切位点,并在3’端加入NheI酶切位点,然后使用MluI和NheI分别双酶切pVSVFL(+)质粒和preF基因片段,接着采用T4连接酶将酶切后的载体和基因片段相连获得连接产物,将连接产物转化至DH5α大肠杆菌感受态,37℃培养过夜后挑取测序正确的阳性克隆子,获得pVSV-preF重组质粒;
S4.2、制备rVSV-preF:采用含有10%FBS的DMEM培养基培养BHK-21细胞,待细胞汇合度约为70%时,将vTF7-3病毒按照MOI 10感染BHK-21细胞,37℃培养30min后将pVSV-preF重组质粒、pSK-N重组质粒、pSK-P重组质粒和pSK-L重组质粒使用lip 2000转染BHK-21细胞,pVSV-preF重组质粒:pSK-N重组质粒:pSK-P重组质粒:pSK-L重组质粒的质量比为10:5:4:2,并将转染后的细胞继续置于37℃培养56h,离心收集细胞,并置于-60℃/37℃反复冻融三次,12000r/min离心5min,并收集上清液;取5mL的上清液再次感染BHK-21细胞,置于37℃培养48h后收集裂解物,1250×g离心10min收集上清,然后将上清经0.22μm过滤,获得rVSV-preF。
S4.3、rVSV-preF重组腺病毒的扩增与纯化:将步骤S4.2制得的rVSV-preF按照MOI0.1感染BHK-21细胞,37℃培养48h后离心收集细胞,并置于-60℃/37℃反复冻融三次,12000r/min离心5min,收集病毒上清液;取20mL的病毒上清液加入至一SW40离心管中,并从离心管的底部缓慢加入20mL的10%蔗糖溶液,置于28000r/min离心2h,弃上清并收集沉淀,采用PBS缓冲液重悬沉淀以制得纯化的rVSV-preF溶液,采用SDS-PAGE和WB技术鉴定rVSV-preF表达preF糖蛋白的胞外区蛋白。
S4.3、测定rVSV-preF的滴度:将浓度为5×10
实施例5
本实施例提供了rAdC68XY3-preF(v2)重组腺病毒及其制备方法,相较于实施例1的rAdC68XY3-preF,本实施例中rAdC68XY3-preF(v2)的区别之处在于:将目的基因片段由“preF”替换为“preF(v2)”。图7示出了preF(v2)基因片段的结构组成(未示出Kozak序列),preF(v2)基因片段的核苷酸序列如SEQ ID NO.16所示(未示出Kozak序列),preF(v2)基因片段包括依序串联的第六核苷酸序列、第三核苷酸序列、第二核苷酸序列、第五核苷酸序列和第七核苷酸序列,第六核苷酸序列如SEQ ID NO:9所示,第三核苷酸序列如SEQ ID NO:5所示,第二核苷酸序列如SEQ ID NO.4所示,第五核苷酸序列如SEQ ID NO:8所示,第七核苷酸序列如SEQ ID NO:10所示。
本实施例中rAdC68XY3-preF(v2)的制备方法参照实施例1进行,制备过程中构建的重组表达载体为pAdC68XY3-preF(v2),纯化的rAdC68XY3-preF(v2)溶液中rAdC68XY3-preF(v2)的滴度为3.5×10
实施例6
本实施例提供了rAd5-preF(v2)重组腺病毒及其制备方法,相较于实施例1中rAdC68XY3-preF,本实施例中rAd5-preF的区别之处仅在于:将载体由“pAdC68XY3”替换为人5型腺病毒载体rAd5-CMV-Dest,并且将preF基因片段替换为preF(v2)基因片段,preF(v2)基因片段插入至人5型腺病毒载体rAd5-CMV-Dest的E1区域。
本实施例中rAd5-preF(v2)的制备方法参照实施例1进行,以rAd5-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物电泳图如图8所示。如图10所示,rAd5-preF(v2)感染HK293细胞48h后获得的细胞培养上清液待检样品中能检测到preF(v2)蛋白,说明rAd5-preF(v2)在HEK293细胞中成功地表达了preF(v2)蛋白。将制得的纯化的rAd5-preF(v2)溶液加入10%(体积百分数)甘油后分装存于-80℃冰箱中以备用,纯化的rAd5-preF(v2)溶液中rAd5-preF(v2)的滴度为9.5×10
实施例7
本实施例提供了rMVA-preF(v2)重组安卡拉牛痘病毒及其制备方法,相较于实施例1中的rAdC68XY3-preF重组腺病毒,本实施例中rMVA-preF(v2)的区别之处仅在于:将载体由“pAdC68XY3”替换为安卡拉牛痘病毒MVA,并且将preF基因片段替换为preF(v2)基因片段。
本实施例中rMVA-preF(v2)的制备方法参照实施例3进行,以rMVA-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物电泳图如图8所示。如图10所示,rMVA-preF(v2)感染HK293细胞48h后获得的细胞培养上清液待检样品中能检测到preF(v2)蛋白,说明rMVA-preF(v2)在HEK293细胞中成功地表达了preF(v2)蛋白。将制得的纯化的rMVA-preF(v2)溶液加入10%(体积百分数)甘油后分装存于-80℃冰箱中以备用,纯化的rMVA-preF(v2)溶液中rMVA-preF(v2)的滴度8.3×10
实施例8
本实施例提供了rVSV-preF(v2)重组水泡性口炎病毒及其制备方法,相较于实施例1中的rAdC68XY3-preF重组腺病毒,本实施例中rVSV-preF(v2)的区别之处仅在于:将载体由“pAdC68XY3”替换为水泡性口炎病毒VSV,并且将preF基因片段替换为preF(v2)基因片段。
本实施例中rVSV-preF(v2)的制备方法参照实施例3进行,以rVSV-preF(v2)基因组作为模板,并以上游引物PreF-PS-F和下游引物PreF-PS-R进行PCR扩增获得的PCR产物电泳图如图8所示。如图10所示,rVSV-preF(v2)感染HK293细胞48h后获得的细胞培养上清液待检样品中能检测到preF(v2)蛋白,说明rVSV-preF(v2)在HEK293细胞中成功地表达了preF(v2)蛋白。将制得的纯化的rVSV-preF(v2)溶液加入10%(体积百分数)甘油后分装存于-80℃冰箱中以备用,纯化的rVSV-preF(v2)溶液中rVSV-preF(v2)的滴度1.2×10
对比例
本对比例提供了rAdC68XY3-GFP重组腺病毒及其制备方法,制备方法包括如下步骤:
S1’、采用PacI限制性内切酶酶切pAdC68XY3-GFP重组病毒质粒,以使pAdC68XY3-GFP重组病毒质粒线性化,其中,酶切体系为50μL,酶切体系包括:5μL的酶切缓冲液(10×NEB CutSmart buffer),5μL的PacI限制性内切酶,10μg的pAdC68XY3-GFP重组腺病毒质粒,余量为双蒸水(ddH
S2’、步骤S1’中酶切完全后,采用PCR产物回收试剂盒回收酶切产物,并采用微量核酸定量仪对回收的酶切基因片段进行定量分析;
S3’、将步骤S2’回收的酶切基因片段进行转染操作,采用LipofectamineTM2000试剂盒进行转染操作,并选择HEK293细胞作为表达系统,根据LipofectamineTM2000试剂盒的操作说明,将酶切基因片段转染于汇合度约为70%的HEK293细胞内,其中,在LipofectamineTM2000试剂盒操作说明的“接种细胞”步骤中,用于培养HEK293细胞的培养基为MEM培养基,并在转染前2h将MEM培养基更换为DMEM培养基,转染5h后,更换培养基为含10%(质量百分比)胎牛血清的DMEM培养基;
S4’、在步骤S3’的转染隔日,在倒置显微镜下观察细胞病变,直至60%的HEK293细胞出现噬斑时收集细胞,将收集的细胞在室温(25℃)与-80℃之间反复冻融三次,然后在1200×g的转速下离心5min,收集上清液,获得的上清液中包含rAdC68XY3-GFP重组腺病毒;
S5’、将步骤S4’的上清液按照上述5.1和5.2依次进行小规模扩增和纯化操作,获得纯化的rAdC68XY3-GFP溶液,纯化的rAdC68XY3-GFP溶液中rAdC68XY3-GFP的滴度为1.0×10
实验例1
本实验例旨在比较实施例1至实施例8以及对比例的重组病毒诱导机体产生特异性IgG抗体几何平均滴度的差异。
选取六十只试验小鼠(约3~7天时间适应环境),动物经检验检疫后随机分为十组,每组六只,每组的具体情况详见下表2:
表2为实验例1中分组情况一览表
对各组的试验小鼠进行肌肉注射免疫,每只每次免疫0.1mL,每3周免疫一次,共免疫二次,第二剂免疫二十一天后眼眶取血,其中,每只试验小鼠接受的对应重组病毒的免疫量均过量,以确保每只试验小鼠均被有效感染。采用酶联免疫反应(Enzyme LinkedImmunoSorbent Assay,ELISA)法检测试验小鼠血清中特异性IgG抗体滴度,包括如下步骤:
S
S
S
S
S
S
实验结果如表3所示:
表3实验组1至实验组8以及阴性对照组的小鼠血清特异性IgG抗体滴度一览表
由表3和图11可知,实验组1至实验组8中小鼠血清特异性IgG抗体滴度在6400以上,可达25600,说明rAdC68XY3-preF重组腺病毒、rAd5-preF重组腺病毒、rMVA-preF重组腺病毒、rVSV-preF重组腺病毒、rAdC68XY3-preF(v2)重组腺病毒、rAd5-preF(v2)重组腺病毒、rMVA-preF(v2)重组腺病毒以及rVSV-preF(v2)重组腺病毒均能诱导机体产生特异性IgG抗体,由此可知:preF蛋白和preF(v2)蛋白均能诱导机体产生理想的特异性IgG抗体水平,且preF(v2)蛋白诱导机体产生特异性IgG抗体的水平高于preF蛋白。
实验例2
本实验例旨在比较实施例1至实施例8以及对比例的重组病毒对小鼠脾细胞特异性T细胞免疫效果差异。
选取六十只试验小鼠(约3~7天时间适应环境),动物经检验检疫后随机分为十组(实验组1至实验组8、阴性对照组1和阴性对照组2),每组六只,分组情况参照实验例1的表2。
对各组的试验小鼠进行肌肉注射免疫,每只每次免疫0.1mL,每3周免疫一次,共免疫二次,第二剂免疫二十一天后取各组试验小鼠的脾细胞,其中,每只试验小鼠接受的对应重组病毒的免疫量均过量,以确保每只试验小鼠均被有效感染。采用酶联免疫斑点技术(Enzyme Linked Immunospot Assay,ELISpot)方法检测小鼠脾细胞特异性T细胞免疫效果,包括如下步骤:
Sa’、向预包被有干扰素-γ(IFN-γ)和IL-4抗体的Elispot板加入RPMI-1640培养基,每孔加入200μL的RPMI-1640培养基,室温静置10min后倒去液体以备用;
Sb’、配制含有多肽刺激物的脾细胞悬浮液,其中,脾细胞悬浮液的溶液为含有10%(质量百分数)胎牛血清的RPMI 1640培养基,脾细胞悬浮液中脾细胞的浓度为5×10
Sc’、向完成步骤Sa’的Elispot板中加入步骤Sb’的脾细胞悬浮液,每种脾细胞悬浮液做三个复孔,每孔加入100μL的脾细胞悬浮液,然后将Elispot板置于37℃孵育54h;
Sd’、步骤Sc’孵育结束后,按照Elispot板的说明书进行斑点显色操作,并使用酶联斑点成像系统进行斑点计数,计算5×10
实验结果如表4所示:
表4实验组1至实验组8以及阴性对照组的特异性IFN-γ平均斑点数一览表
由表4和图12可知,实验组1至实验组8的特异性IFN-γ平均斑点数均在145以上,可达530,并且实验组1至实验组8的特异性IL-4斑点数均在18以上,可达70,说明rAdC68XY3-preF重组腺病毒、rAd5-preF重组腺病毒、rMVA-preF重组腺病毒、rVSV-preF重组腺病毒、rAdC68XY3-preF(v2)重组腺病毒、rAd5-preF(v2)重组腺病毒、rMVA-preF(v2)重组腺病毒以及rVSV-preF(v2)重组腺病毒均能诱导机体产生较强的特异性T细胞免疫,并且preF(v2)蛋白诱导Th1(IFN-γ)细胞免疫的效果优于preF蛋白。此外,实验组1至实验组8的特异性IFN-γ平均斑点数相差较大,以及IL-4平均斑点数之间差异较小,说明无论是使用preF作为免疫原,还是使用preF(v2)作为免疫原,两者的特异性T细胞免疫均偏向于Th1(IFN-γ),而非Th2(IL-4)。
实验例3
本实验例旨在比较实施例1至实施例8以及对比例的重组病毒诱导机体产生中和抗体的滴度水平的差异。
选取五十四只试验小鼠(约3~7天时间适应环境),动物经检验检疫后随机分为九组(实验组1至实验组8和阴性对照组),每组六只,实验组1至实验组8的具体情况参照实验例1的表2,阴性对照组为:采用对比例中纯化的rAdC68XY3-GFP溶液对试验小鼠进行免疫。
对各组的试验小鼠进行肌肉注射免疫,每只每次免疫0.1mL,每3周免疫一次,共免疫二次,第二剂免疫二十一天后眼眶取血,其中,每只试验小鼠接受的对应重组病毒的免疫量均过量,以确保每只试验小鼠均被有效感染。采用中和法检测小鼠血清对重组病毒的中和抗体效价,包括如下步骤:
Sa”、配制RSV稀释液,RSV稀释液中RSV的浓度为2×10
Sb”、将150μL的步骤Sa”中RSV稀释液、150μL的热灭活血清(将稀释后的待测小鼠血清经热灭活处理后而获得)以及5μL的豚鼠补体相混合,然后置于37℃孵育1h,获得病毒血清混合物;
Sc”、提供每孔内长满MRC-5单层细胞的24孔板,每孔内加入100μL的步骤Sb”获得的病毒血清混合物,每种病毒血清混合物做两个复孔,然后置于37℃孵育2h,孵育2h后每孔加入2mL的病毒维持液(含2%(质量百分数)胎牛血清的MEM液体培养基),继续置于37℃孵育7天;
Sd”、孵育结束后,去除培养基,固定细胞,并用考马斯蓝溶液(按照质量百分比计算,0.5%的考马斯蓝、45%的甲醇以及10%的乙酸,余量为去离子水)染色10min,然后用蒸馏水洗涤平板,对斑点计数,取使空斑数减少50%的血清稀释度的倒数作为RSV中和抗体效价。
实验结果如表5所示:
表5实验组1至实验组8以及阴性对照组的小鼠血清中抗RSV中和抗体的几何平均滴度一览表
/>
由表5可知,实验组1至实验组8的小鼠血清中抗RSV中和抗体的几何平均滴度均在116以上,可达159,由此说明:无论是使用preF作为免疫原,还是使用preF(v2)作为免疫原,两者均可诱导机体产生针对RSV的特异性中和抗体,并且preF(v2)作为免疫原诱导机体产生针对RSV的特异性中和抗体的水平高于preF作为免疫原。
综合实验例1至实验例3可知,本申请实施例的重组病毒具有预防RSV的功效,并且采用本申请实施例的重组病毒制成的疫苗无需添加佐剂,从而极大地降低了反应原性,具有安全性高、副作用小、适用人群广泛的优点。本申请实施例的重组病毒能够引起中和抗体应答以及广泛的特异性T细胞免疫反应,具有理想的免疫效果。
以上对本发明所提供的一种基于呼吸道合胞病毒融合前F蛋白的突变体、核酸分子、重组表达载体以及药物组合物,进行了详细介绍。本文中应用了具体个例对本申请的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本申请的技术方案及其核心思想;本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请实施例的技术方案的范围。
- 呼吸道合胞病毒全长融合前融合糖蛋白核苷酸序列、重组腺病毒载体及其应用产品
- 呼吸道合胞病毒全长融合前融合糖蛋白核苷酸序列、重组腺病毒载体及其应用产品
