滑膜肌成纤维细胞的细胞膜在制备骨关节炎药物的用途
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及生物医药领域;具体涉及滑膜肌成纤维细胞的细胞膜在制备骨关节炎药物的用途。
背景技术
骨关节炎(OA)是最常见的关节炎形式,影响全球超过5亿人(约占全球人口的7%),在高龄人群(>65岁)中患病率特别高。作为一种复杂的疾病,其特征是所有关节组织的病理改变,包括软骨、软骨下骨、韧带、半月板、关节囊和滑膜 OA 是最常见的与疼痛和残疾相关的关节疾病。其主要临床症状为慢性疼痛、关节不稳、僵硬和放射学关节间隙狭窄。骨性关节炎主要与老龄化有关,其患病率将稳步上升,预计到2030年将成为普通人群中最大的单一致残原因。这不仅会影响个人的生活质量,而且会给全球卫生保健系统带来沉重负担。然而,目前的镇痛疗法在疗效和明显的毒性方面是有限的,并且没有获得许可的疾病修饰药物。
滑膜是一种特殊的结缔组织,排列在膝关节周围,包围着肌腱,形成滑囊和脂肪垫的衬里。在滑膜关节中,滑膜密封滑膜腔和周围组织的液体。滑膜负责维持滑膜液的体积和成分,主要是通过产生润滑素和透明质酸。由于关节软骨没有固有的血管或淋巴供应,通过滑液,滑膜也有助于软骨细胞的营养。而滑膜炎是一种骨关节炎发生发展过程中的一种最常见的病理改变,它可以出现在骨关节炎的早期阶段,当还未出现明显的软骨退变时,就可以通过超声,磁共振等检测出来,并且滑膜炎被认为与骨关节炎的严重程度密切相关。在骨关节炎患者的滑膜液中发现了多种炎症介质,所有这些成分能诱导软骨细胞以及滑膜细胞分泌基质金属蛋白水解酶,导致软骨基质的降解,软骨失去稳定的生存环境,最终导致软骨的损伤。因此,靶向OA早期滑膜细胞,是延缓OA进展的有效途径。
前期的单细胞转录组测序结果显示,在OA的进展过程中,尤其是在进展早期阶段,滑膜组织中一种由成纤维样滑膜细胞衍变而来的滑膜肌成纤维细胞群大量增加,并特异性高表达α-SMA。因此将药物精准递送至滑膜肌成纤维细胞,进而调控其炎性反应对于缓解OA滑膜炎症并进一步调控OA进展有望成为新的治疗途径。
而具有临床价值的药物通常会被关节快速清除,无法到达组织深部,使骨关节炎的临床管理变得更加复杂。基于纳米材料构建的纳米载药体系虽然一定程度地缓解了单纯药物在体内的代谢及摄取缺点,但不可避免地遭遇到面临的难题:1)药物稳定性问题:某些药物在纳米载体中可能存在稳定性问题,例如药物从载体中泄漏、药物与载体相互作用导致药物失活等;2)生物相容性问题:虽然许多纳米材料在体内表现出良好的生物相容性,但仍有部分纳米材料可能引起免疫反应或产生毒性,从而对机体造成损害;3)体内分布和靶向问题:纳米载药递送体系在体内的分布和靶向效果可能难以预测和控制。尽管可以通过各种表面修饰和靶向配体来改善其靶向性,但仍可能出现一些意外情况,如药物非特异性聚集或被体内的巨噬细胞清除等;4) 易被关节非靶向组织摄取,造成药物脱靶效应。
发明内容
滑膜炎与OA的严重程度密切相关。其分泌的滑膜液包含多种炎症介质,加剧炎性免疫细胞招募,诱导软骨基质的降解与损伤,从而加重OA进展。因此,靶向OA早期滑膜细胞,是延缓OA进展的有效途径。本发明基于骨关节炎关节滑膜单细胞测序发现一种由成纤维样滑膜细胞分化而来的肌成纤维细胞亚型。目前如何通过将药物递送至OA早期增殖明显的肌成纤维细胞从而调控其炎症水平,最终缓解滑膜炎症是目前需要解决的重点和难点。
具体的,本发明通过提取完整膜受体的失活自体滑膜肌成纤维细胞构建仿生药物递送体系。一方面,内源性受体作为诱饵调节细胞因子的作用,从而识别、隔离和清除肌成纤维细胞活化因子,同时避免触发肌成纤维细胞内部信号激活,防止诱发加重滑膜炎性反应;其次,膜诱饵由聚乳酸-羟基乙酸(PLGA)基纳米颗粒核心支撑,以增强稳定性并便于将抗炎药物递送至同源肌成纤维细胞内部,达到同源仿生膜体系与肌成纤维细胞相互作用从而被其高效率摄取技术成为药物递送的强有力手段。
在阐述本发明的技术方案之前,定义本文中所使用的术语如下:
术语“ PLGA”是指:聚乳酸-羟基乙酸共聚物。
术语“ PVA”是指:聚乙烯醇。
术语“ TGF-β”是指:转化生长因子β。
术语“ PBS”是指:磷酸缓冲盐溶液。
术语“FLS”是指:成纤维样滑膜细胞。
术语“ Myo”是指:肌成纤维细胞。
术语“ M
术语“ M
术语“ PT”是指:PLGA核含trip的纳米颗粒。
术语“Trip”是指:雷公藤红素(Tripterin,Trip)。
术语“DMM”是指:内侧半月板失稳手术。
为实现上述目的,本发明的第一方面提取了人原代成纤维样滑膜细胞,利用TGF-β诱导其分化为肌成纤维细胞,并提取滑膜肌成纤维细胞来源的细胞膜。其中,TGF-β诱导细胞选自以下一种或多种:原代人滑膜组织成纤维样滑膜细胞(FLS),小鼠胚胎成纤维细胞(NIH/3T3细胞株),小鼠成纤维细胞(3T3-L1细胞株),人肺成纤维细胞(WI-38细胞株),人肺成纤维细胞(MRC-5细胞株);优选为人原代FLS细胞。 本发明的第二方面提供了一种能够靶向滑膜组织肌成纤维细胞的同源工程化肌成纤维仿生膜药物载体纳米递送系统,即骨关节炎药物,所述纳米系统为如第一方面所述的工程化生物膜作为纳米囊。 根据本发明第二方面的纳米递送系统,其中,所述纳米囊的材料选自以下一种或多种:PLGA、脂质体、有机金属框架、无机二氧化硅、壳聚糖、聚乳酸;优选为PLGA。 根据本发明第二方面的纳米递送系统,其中,所述纳米囊中,PLGA与示例抗炎药物Tripterin的质量比为5:1~100:1,优选为10:1~50:1,最优选为30:1。 根据本发明第二方面的纳米递送系统,其中,所述工程化生物膜、纳米囊与Trip的质量份数为:生物膜1.5~100份,纳米囊5~100份,Trip药物 0.5~5份;优选为生物膜20~60份,纳米囊5~40份,Trip 0.5~1份;最优选为生物膜31份,纳米囊30份,Trip药物 1份; 优选的,当纳米囊材料选自PLGA时,所述生物膜与所述载有药物的纳米囊的质量比为1:1。 本发明的第三方面提供了一种天然抗炎药物雷公藤红素,所述示例抗炎药物选自以下一种或多种:雷公藤红素(Tripterin,Trip)、甘草素、姜黄素、黄芩苷、曲安奈德;优选为Trip。 本发明的第三方面提供了第二方面所述的工程化仿生膜靶纳米靶向递送系统的制备方法,该制备方法可以包括以下步骤: (1)制备抗炎药物溶液; (2)将步骤(1)制备的药物溶液滴加入纳米囊材料的溶液中; (3)将步骤(2)所得混合溶液滴加入溶剂中,超声搅拌离心去上清,重悬所得沉淀; (4)将步骤(3)所得重悬液与生物膜混合,超声,得到所述纳米递送系统。 根据本发明第三方面的制备方法,其中,所述步骤(3)中,所述溶剂选自以下一种或多种:PVA水溶液、吐温20水溶液、吐温80水溶液;优选为PVA水溶液,更优选为1% -10%的PVA水溶液,最优选为3%PVA水溶液。 本发明的第四方面提供了第一方面所述的工程化滑膜成纤维细胞膜和第二方面所述的纳米递送系统在制备用于治疗骨关节炎的药物递送至滑膜肌成纤维细胞中的应用。 本发明旨在寻找一种基于靶向滑膜肌成纤维细胞工程化仿生膜伪装的高效药物递送体系,从而达到高效递送抗炎药物至肌成纤维细胞,从而抑制滑膜细胞炎性,缓解骨关节炎的治疗效果。 为达到目的,本发明采用以下技术方案:
本发明首先通过对行DMM法OA造模小鼠行单细胞测序证实OA急性期关节滑膜组织大量增殖肌成纤维细胞亚群。其次,基于单细胞测序结果提取了人原代成纤维样滑膜细胞,利用TGF-β诱导其分化为肌成纤维细胞,并提取滑膜肌成纤维细胞来源的细胞膜(M
1):基于骨关节炎关节滑膜单细胞测序在OA早期发现一种异常增生的滑膜肌成纤维细胞亚型。
2):针对性地弥补了单纯药物及传统纳米载药颗粒的以下劣势:单纯药物在关节腔内易被快速流动的关节液代谢;单纯药物和/或纳米载药颗粒被组织摄取缺乏高效性;所应用的载体为外来物,生物相容性差;易被循环系统内的血清或血浆蛋白等封闭表面使得内部药物不易释放;容易被网状内皮系统的单核、巨噬细胞等清除其效能降低。
3)相较于传统细胞膜极大的提高了滑膜肌成纤维细胞的靶向性,为后续针对滑膜炎的治疗提供了理论指导和后续的技术支持。 本发明所述方法具有较高的滑膜肌成纤维细胞靶向效果并能维持关节腔内长时间作用,对于缓解OA炎症具有较好的治疗效果。本发明适用于缓解OA炎症的药物精准靶向治疗,相信本发明的方法在膝骨关节炎,创面损伤修复等疾病等方面具有广泛的应用前景。
附图说明
为了清楚地展示本发明具体的实施方式以及在实验中采用的某些检测技术,下面将对实施方案及采用的技术进行描述,主要通过附图的形式进行介绍。
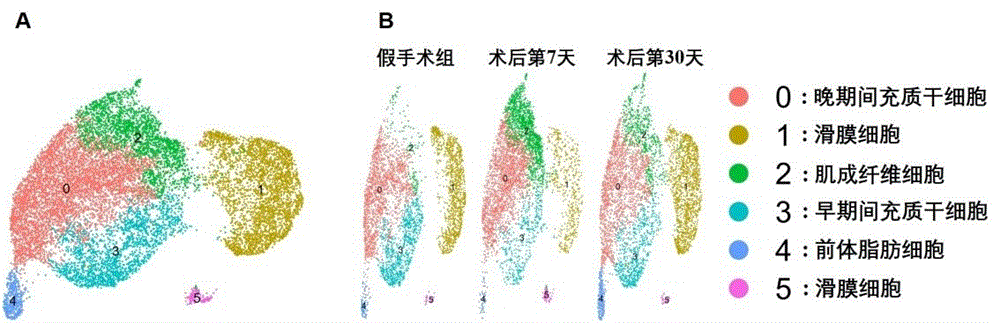
图1示出了通过10 X genomics 对小鼠正常(图1A)及行DMM法(图1B)OA造模增生滑膜组织进行单细胞测序,结果进行分析。将2批样品进行整合分析、预处理和质控,根据标志基因的表达,对巨噬细胞及间充质系细胞进行分析,得到晚期间充质干细胞(Latemesenchymal stem cell, cluster 0),滑膜细胞(synoviocyte,cluster 1, 5),肌成纤维细胞(Myofibroblast,cluster 2),早期间充质干细胞(Early mesenchymal stem cell,cluster 3)和成脂前体细胞(Pre-adipocyte,cluster4)。相比于正常组,OA组小鼠滑膜组织在早期OA阶段(术后第7天)肌成纤维细胞数量显著增加。
图2示出了通过构建Dpp4-CreER; Tdtomato小鼠并行ACLT造模诱发OA模型。对Dpp4-CreER; Tdtomato行OA造模小鼠术后第7天膝关节组织切片染色,可在Dpp4标记(白色) 的滑膜组织中观察到明显高度富集的α-SMA阳性的细胞群(红色),即高度肌成纤维细胞群,伴有F4/80标记的巨噬细胞群(绿色)。
图3示出了靶向滑膜肌成纤维细胞的M
图4示出了实施例3中PT与M
图5示出了实施例3纳米囊对Trip的载药效率。图5A示出了PT纳米囊中,PLGA与Trip的质量比分别为5/1,10/1,20/1,30/1,40/1,50/1,60/1,70/1,80/1,90/1和100/1的载药率;图5B示出了膜蛋白质量与载有Trip的PLGA(PT)的质量比分别为0/1,0.05/1,0.1/1,0.25/1,0.5/1,0.75/1,1/1,1.25/1,1.5/1和2/1的粒径变化关系。
图6示出了试验例1不同组别体系的细胞毒性情况。
图7示出了试验例2中负载荧光药物纳米囊(PLGA-DID)与M
图8示出了试验例3中qRT-PCR检测不同组别材料体系给药后滑膜细胞炎症水平,检测指标包括IL1,IL6,IL8。
图9示出了试验例4中经DMM小鼠OA造模后予以关节腔不同处理组别关节组织切片番红O/快绿染色结果情况。
具体实施的方式
本发明具体的实施方式通过实施例来辅助解释,除检测所用的技术对本发明不做任何形式的限制外,描述的实施例中部分方案属发明的一部分实施例,在本领域的普通技术操作人员在没有创造性的成果获得的实施例,均属本发明的保护范围。
本部分对本发明试验中所使用到的材料以及试验方法进行一般性的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。本领域技术人员清楚,在上下文中,如果未特别说明,本发明所用材料和操作方法是本领域公知的。
以下实施例中使用的试剂和仪器如下:
重组人TGF-β1,购自PeproTech美国;
Tripterin,购自MedChem Express美国;
2型胶原酶,购自Thermo Fisher美国;
PLGA,购自广州斯佳有限公司;
二氯甲烷,购自广州化学试剂厂,中国;
乙酸乙酯,购自广州化学试剂厂,中国;
PVA,购自Sigma-Aldrich,美国;
PBS,购自Life technology ,美国;
微丝绿荧光探针(Actin-Tracker Green-488),购自碧云天,中国;
免疫染色通透液(Saponin),购自碧云天,中国;
BSA,购自Sigma-Aldrich,美国;
C57BL/6小鼠,购自广州市赛柏诺生物科技有限公司;
透射电镜,购自日本,型号JEM 1400PLUS。
激光共聚焦显微镜,购自Zeiss德国。
流式细胞仪,购自美国,型号BD, San Jose, CA。
实施例1
本实施例用于说明肌成纤维细胞在DMM术后滑膜组织中的发现
1)此项研究中进行的所有动物实验及相关工作都得到了暨南大学实验动物伦理委员会的批准。为了研究巨噬细胞在不同程度滑膜炎中的特点,申请人利用DMM手术构建小鼠创伤性骨关节炎模型。
2)收集正常小鼠以及术后7天小鼠膝关节滑膜组织样品进行苏木素/伊红染色,发现DMM手术引起滑膜组织的急性炎症反应,滑膜炎评分明显增加。
3)收集正常小鼠以及DMM术后7天小鼠膝关节滑膜组织样品,提取细胞进行单细胞转录组测序。
4)对单细胞测序结果进行分析。将2批样品进行整合分析、预处理和质控,根据标志基因的表达,对巨噬细胞及间充质系细胞进行分析,得到晚期间充质干细胞(Latemesenchymal stem cell, cluster 0),滑膜细胞(synoviocyte,cluster 1, 5),肌成纤维细胞(Myofibroblast,cluster 2),早期间充质干细胞(Early mesenchymal stem cell,cluster 3)和成脂前体细胞(Pre-adipocyte,cluster 4)。
5)将2批单细胞测序结果分开分析,发现相比于正常组,早期OA组滑膜肌成纤维细胞数量明显增加(图1A-B, cluster 2)。免疫荧光染色显示,在OA小鼠滑膜组织中,Dpp4+α-SMA+的滑膜细胞数量也明显增加(图2)。
其中,对于OA组小鼠滑膜组织的提取,本发明首先选择了8周龄雄性C57BL/6J小鼠并对它们的右膝进行了DMM手术以构建OA模型。 具体步骤如下:
1)使用三溴乙醇联合异氟烷麻醉小鼠,剃除膝关节附近的毛发并进行消毒。
2)使用无菌剪刀在髌韧带上方打开一个约5 mm长的切口,钝性分离皮肤和皮下组织。进而用纤维外科剪沿着髌韧带内侧缘打开膝关节,钝性分离髌下脂肪组织。
3)找到内侧半月板横韧带后,利用显微外科专用剪刀离断,通过观察是否有游离的半月板断端半判断手术是否成功。
4)最后,缝合关节囊和皮肤,并对手术切口进行消毒,待小鼠苏醒后将小鼠送回动物中心,并进行术后观察。收集正常组及行DMM造模组小鼠滑膜组织进行后续单细胞测序及组织包埋,切片染色等工作。
图1示出了通过10 X genomics 对小鼠正常及行DMM法OA造模增生滑膜组织进行单细胞测序,结果进行分析。将2批样品进行整合分析、预处理和质控,根据标志基因的表达,对巨噬细胞及间充质系细胞进行分析,得到晚期间充质干细胞(Late mesenchymalstem cell, cluster 0),滑膜细胞(synoviocyte,cluster 1, 5),肌成纤维细胞(Myofibroblast,cluster 2),早期间充质干细胞(Early mesenchymal stem cell,cluster 3)和成脂前体细胞(Pre-adipocyte,cluster4)。相比于正常组,OA组小鼠滑膜组织在早期OA阶段(术后第7天)肌成纤维细胞数量显著增加。
图2示出了通过构建Dpp4-CreER; Tdtomato小鼠并行ACLT造模诱发OA模型。对Dpp4-CreER; Tdtomato行OA造模小鼠术后第7天膝关节组织切片染色,可在Dpp4标记(白色) 的滑膜组织中观察到明显高度富集的α-SMA阳性的细胞群(红色),即高度肌成纤维细胞群,伴有F4/80标记的巨噬细胞群(绿色)。
实施例2
本实施例用于说明人工肌成纤维细胞的诱导及仿生细胞膜的提取
本研究中所使用的临床样品及动物实验均得到了暨南大学第一附属医院伦理委员会批准,并在手术前获得充分的书面同意。作为原代滑膜细胞提取来源的滑膜组织,均从接受关节镜前交叉韧带重建或半月板修复的年轻患者获得。
原代滑膜细胞提取:
1)标本采集:将外科手术切下的滑膜组织在手术台上请护士将标本放入低温生理盐水中,在手术完成时将标本放入PBS冰水液中并放入消毒的容器中带回实验室。
2)试剂准备:2mg/mL II 型胶原酶 (DMEM 配制),完全培养基(含10%的胎牛血清,100 单位/毫升青霉素和 100 克/毫升链霉素)。
3)器械准备:手术器械,包括剪刀及镊子。
4)将切下的组织在手术台上请护士将标本放入低温生理盐水中 (静止),在手术完成时将标本放入PBS冰水液中并放入消毒的容器中带回实验室。 在超净台中将标本放入培养皿中,加入DMEM洗涤。用剪刀仔细剔除脂肪组织后,将组织放置于5 mL离心管中用解剖剪锐性切碎组织至糊状。用5倍于滑膜组织体积的含有2 mg/mL II 型胶原酶的DMEM高糖培养基置于15 mL离心管中,在 37℃ 恒温摇床 110 rpm 孵育 120 分钟。
5)取出摇床中离心管,离心机中于 2000 rpm 离心 5 分钟后弃去上清,将沉淀用含 EDTA 胰酶重悬置于 37 度培养箱中静置 30 分钟后,置于离心机中常温,2000rpm 离心 5 分钟后弃上清, DMEM 培养基重悬后,用 70 μm 细胞滤网过滤后再次置于离心机中于 2000 rpm,离心 5 分钟。
6)重悬细胞沉淀后接种到培养瓶中培养,每 2-3 天换液一次。
2肌成纤维细胞的诱导与肌成纤维细胞膜的提取:
待细胞长至第2代密度成熟时,将其种板于10 cm细胞培养皿中,加入TGF-β诱导滑膜细胞分化为肌成纤维细胞。
肌成纤维细胞膜的提取。通过反复冻融法获得细胞膜(M
向细胞沉淀中加入细胞膜和胞浆蛋白质提取试剂盒A试剂和不含1× EDTA的蛋白酶抑制剂,在4℃裂解细胞30分钟,超声处理5分钟。
把样品在液氮和室温依次反复 冻融两次,然后取少量样品在显微镜下检测细胞破碎的程度直到细胞破碎的程度大于70%。
4ºC,700g离心10分钟,小心收集上清液至一新的离心管中,以保证吸取的上清液有较高的纯度。
4ºC,14000 g离心30分钟,PBS沉淀细胞膜碎片,将提取的细胞膜碎片储存在-80℃备用。
实施例3
本实施例用于说明本发明靶向滑膜肌成纤维细胞的药物载体(M
1)将M
2)使用Miniextruder (Avanti),将混合物与400 nm、200 nm、100 nm聚碳酸酯薄膜前后共挤15次,得到M
其中,PT的合成为:
1) 取10mg PLGA颗粒溶于700 uL二氯甲烷及300 uL乙酸乙酯混合有机溶剂中。
2) 在混有PLGA的有机溶剂中加入溶解在DMSO溶剂中的Trip药物。
3) 混合物于水浴超声5分钟后,将声探头置于配置好的3%聚乙烯醇(PVA)溶液中,功率设置为50w, 开3s, 关2s。在超声刺激下,将PLGA- Trip有机溶剂混合物逐滴PVA溶液中充分乳化5分钟,形成“水包油”混合体系。
4) 将充分乳化后的有机体系置于0.3%的PVA溶液中,磁力搅拌4小时,从而充分挥发有机溶剂。
5) 待充分搅拌后,将锥形瓶中的溶液倒入50 mL离心管中,配平离心12000 rpm,40分钟,第一次离心结束后,倒出溶液,PBS重悬沉淀,再次离心12000 rpm, 40分钟,此步骤重复2遍,待第二次PBS重悬离心后,倒出管中液体,用1mL PBS重悬沉淀后,置于4度冰箱保存。
图3示出了靶向滑膜肌成纤维细胞的M
图4示出了实施例3中PT与M
图5A示出了实施例3纳米囊对Trip的载药效率。PLGA与Trip的质量比分别为5/1,10/1,20/1,30/1,40/1,50/1,60/1,70/1,80/1,90/1和100/1的载药率。其中,PLGA与Trip的质量比为30/1;图5B示出了膜蛋白质量与载有Trip的PLGA(PT)的质量比分别为0/1,0.05/1,0.1/1,0.25/1,0.5/1,0.75/1,1/1,1.25/1,1.5/1和2/1的粒径变化关系。其中,M
试验例1
本试验例用于说明本发明的靶向纳米载药递送体系对炎性滑膜细胞生物活性影响的实验
1)如实施例2方法诱导肌成纤维细胞,即如实施例3方法合成M
2)将滑膜细胞种于六孔板中培养,每孔细胞含1×10
3)培养24小时后,弃去上述原培养基,利用无EDTA胰酶消化液消化细胞,弃上清,分别加入 Annexin V-FITC和碘化丙啶染色液轻轻混匀。
4) 室温避光孵育10-20分钟后,上机检测凋亡效果。凋亡率采用Annexin V-FITC/PI凋亡检测试剂盒检测定量。
如图6所示,本发明合成的M
试验例2
本试验例用于说明滑膜组织肌成纤维细胞对本发明的靶向纳米载药体系的摄取效果的实验。
如图7所示,为了研究细胞摄取,荧光染料DID代替Trip被加载到PLGA核(PLGA-DID)中,M
激光共聚焦显微镜观察细胞摄入。
1)为了研究细胞摄取,荧光染料DID代替Trip被加载到 PLGA 核(PLGA-DID)中,M
2)细胞首先接种于共聚焦皿中,密度为 1×10
3)用0.1%曲拉通破膜10 min,PBS洗两次。
4)用Actin-Tracker Green-488染色于细胞骨架,于37度恒温箱中避光孵育50分钟,并然后用DAPI染料复染细胞核15分钟后,PBS 反复洗涤。
5)在CLSM(LSM 880,蔡司)上进行细胞成像。
试验例3
本试验例用于说明本发明的靶向纳米载药递送体系对炎性滑膜细胞抑炎效果评估的实验
1)按实例3所述方法合成纳米颗粒M
2)按试验例1的方法将滑膜细胞种于六孔板中培养,每孔细胞含1×10
3)培养24小时后,弃去上述原培养基,用Trizol提取细胞RNA。 qRT-PCR检测炎症因子变化情况,如图8所示,本发明合成的M
试验例4
本试验例用于说明本发明的纳米颗粒治疗膝骨关节炎(OA)。
如实施例2方法合成M
小鼠膝骨关节炎模型治疗策略制备
1)取40只雄性C57BL/6小鼠(8周龄,体重在20g左右),随机均分成以上所述五组,小鼠OA造模后两周予以一次关节腔药物注射治疗后,待12周后处死小鼠,并对治疗侧小鼠膝关节进行番红O/快绿染色。
如图9所示。本发明合成的靶向滑膜肌成纤维细胞的纳米载体在小鼠体内相较于Trip单纯药物组及PT无靶向载药组具有更高的缓解OA导致的软骨基质降解的作用,而PT组别在关节腔内对软骨基质降解的缓解作用相比于具有滑膜肌成纤维细胞靶向效果的M
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 成纤维细胞激活蛋白作为药物靶点在治疗骨关节炎中的用途
- CircSS18在治疗骨关节炎药物中的用途及药物制备方法
