一种双歧杆菌溶胞物及其制备方法和应用
文献发布时间:2024-04-18 19:59:31
技术领域
本申请涉及微生物发酵领域,尤其涉及一种双歧杆菌溶胞物及其制备方法和应用。
背景技术
国家药监局发布《已使用化妆品原料目录(2021年版)》中的二裂酵母发酵产物滤液(Bifida ferment filtrate)、二裂酵母发酵产物溶胞产物(Bifida ferment lysate)、二裂酵母发酵产物提取物(Bifida ferment extract)。“二裂酵母”实际上并不是酵母菌(Saccharomyces),学名为双歧杆菌(Bifidobacterium),也称比菲德氏菌。双岐杆菌经培养、灭活获得的发酵产物富含氨基酸、维生素、多肽及矿物质等有多种活性成分,具有捕获自由基、抑制脂质过氧化等生物活性,在改善皮肤微生态与皮肤功能方面具有较好作用。长双歧杆菌(Bifidobacterium longum),是益生菌的一种,属于双歧杆菌,是对人体有益的一种菌种。一般用于食品类的双歧杆菌。具有调节肠道健康的功效。
燕麦是禾本科草本植物,是我国重要的农作物之一。燕麦具有良好的生物活性和药用价值,燕麦具有含量相对较高的蛋白质、不饱和脂类、维生素,还含有丰富的多酚、生物碱、β-葡聚糖、皂苷类等功能成分。燕麦中含有大量的抗氧化物,主要有多酚类物质、植酸甾醇和维生素等。目前已有采用双歧杆菌发酵燕麦的先例,如公开号为CN113018239A的中国专利文件,具体公开了采用双歧杆菌和酿酒酵母共同发酵获得具有抗氧化和抗衰老功效的燕麦发酵液。但该过程涉及多菌种发酵,发酵过程复杂,发酵条件涉及无氧和有氧发酵交替,对发酵设备要求高,大大的增加了制备成本。并且还存在应用效果较单一,产品特征气味市场反馈不好的问题。
目前,人们对于化妆品原料功效的要求日益多样化,单一的功效逐渐无法满足消费者对化妆品的期待。
综上,目前亟需一种安全、具有多种有益效果且制作过程简单的化妆品原料。
发明内容
双歧杆菌在维护皮肤稳态健康上发挥着积极作用,由于现行法规对微生物在化妆品中的使用进行了严格的限制,市场上的化妆品产品对于益生菌的应用仅限于使用益生元(prebiotics)或后生元(postbiotics)。
本发明的目的是提供一种安全性好,且兼顾修复、抗炎和抑菌多重功效的双歧杆菌溶胞物,为化妆品产品提供了一种具有复合功效的新原料,使得益生菌的后生元成分能够在护肤品中得以应用。
一方面,本申请提供了一种双歧杆菌溶胞物的制备方法,所述方法包括:
步骤一、将长双歧杆菌(Bifidobacterium longum)BNCC186627接种至发酵培养基中,进行厌氧发酵,获得发酵液;
步骤二、将发酵液离心沉降,获得上清液,破碎处理,获得双歧杆菌胞溶物。
进一步的,所述发酵培养基包括:燕麦;优选的,以质量百分比计,所述发酵培养基包括1%-10%燕麦;更优选的,所述发酵培养基包括5%燕麦;更优选的,所述发酵培养基还包括:酵母浸粉、蛋白胨、磷酸氢二铵中的一种或多种;更优选的,所述发酵培养基的制备方法包括:将100目-200目的燕麦粉与水混合,90℃-110℃糊化1-10min,降温至80℃-90℃,加入高温淀粉酶液化20-40min,加入葡聚糖酶酶解1-3h,与酵母浸粉、蛋白胨、磷酸氢二铵混合。
其中,高温淀粉酶能够分解燕麦中的淀粉为多糖和单糖。而葡聚糖酶则能够进一步分解燕麦中的葡聚糖,提升发酵过程的碳源利用率,同时,提升了发酵液中可溶性燕麦葡聚糖的含量。高温淀粉酶和葡聚糖酶复合处理获得的燕麦发酵液作为发酵培养基适用于后续的长双歧杆菌(Bifidobacterium longum)BNCC186627发酵过程,进而获得有效成分丰富、且安全性高的双歧杆菌溶胞物。
在一种优选的实施方式中,所述发酵培养基的制备方法包括:
将100目-200目的燕麦粉与水混合,100℃糊化5min,降温至85℃,加入高温淀粉酶300U/L,液化30min,加入葡聚糖酶390KU/L,酶解2h,与酵母浸粉、蛋白胨、磷酸氢二铵混合,获得发酵培养基。
发酵培养基配方:以质量百分比计,燕麦粉5%、酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
其中,燕麦粉与水混合的体积可为1:1或1:2或1:3,能够起到将燕麦粉分散的目的即可,对本申请技术效果无明显影响,因此,此处不再进行详细限定。
本领域技术人员可以理解的是,在上述100目-200目范围内,燕麦粉的物理和化学性质均类似,对本申请技术效果无明显影响,因此,此处不再针对目数具体数值进行限定。
燕麦中含有的淀粉、多糖、蛋白质、维生素等可以为长双歧杆菌(Bifidobacteriumlongum)BNCC186627发酵提供营养。
长双歧杆菌的发酵过程中能够产生有机酸、氨基酸、维生素、多肽及矿物质等成分。以燕麦酶解液作为底物进行发酵,长双歧杆菌能够将燕麦葡聚糖有效分解成小分子,且其分泌的蛋白酶还能够水解燕麦中的大分子蛋白使其成为寡肽。
因此,本申请所述的双歧杆菌胞溶物终产物中除双歧杆菌裂解溶胞物和分泌物外,还含有燕麦的分解物,这些功效组分互相作用,提高了最终产物的功效性能,使其能够作为多种化妆品类型的原料。且本申请中证明了,采用该长双歧杆菌(Bifidobacteriumlongum)BNCC186627和上述发酵培养基发酵制备的双歧杆菌胞溶物,还具有修复、抗炎和抑菌多重功效。
进一步的,所述厌氧发酵的条件包括:培养温度35℃-39℃,转速100-200rpm,厌氧培养24h-48h,OD
优选的,所述厌氧发酵的条件包括:培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
在一种优选的实施方式中,双歧杆菌溶胞物的制备方法包括如下步骤:
步骤一、将长双歧杆菌(Bifidobacterium longum)BNCC186627进行二级活化,OD
步骤二、将所述二级种子液以1%-10%的接种量接种至发酵培养基中,进行厌氧发酵,厌氧发酵的条件为培养温度35℃-39℃、转速100-200rpm、厌氧培养24h-48h、OD
步骤三、将发酵液离心沉降,获得上清液,破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌胞溶物。
在一种优选的实施方式中,所述二级活化包括:
S1:将保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627按照1%的接种量接种到长双歧杆菌种子培养基中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
S2:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基中,氮气保护下厌氧培养,培养温度37℃,转速150rpm,厌氧培养36-48h,OD
另一方面,本申请还提供了如上述方法制备的双歧杆菌溶胞物。
另一方面,本申请还提供了含有如上述双歧杆菌溶胞物的产品。
优选的,所述产品的剂型可选自丸剂、片剂、胶囊剂、颗粒剂、散剂、锭剂、糖浆剂、乳剂、混悬剂中的一种。
本申请还可以添加辅料,所述辅料可以是适当的溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、pH值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂等。
进一步的,以体积百分比计,所述双歧杆菌胞溶物的含量为0.1%-20%;优选的,0.1%-5%。
更优选的,5%。
另一方面,本申请还提供了如上述的双歧杆菌胞溶物或如上述的产品在非治疗目的的修复皮肤损伤、抗炎和/或祛痘中的应用。
进一步的,所述抗炎为降低炎症因子;优选的,所述炎症因子选自白细胞介素-6、肿瘤坏死因子α、白细胞介素-1β中的一种或多种。
另一方面,本申请还提供了如上述的双歧杆菌胞溶物或如上述的产品在抑制细菌和/或真菌中的应用。
进一步的,所述细菌包括金黄色葡萄球菌、痤疮丙酸杆菌。
本发明具有如下有益效果:
1、本申请中首次采用长双歧杆菌(Bifidobacterium longum)BNCC186627发酵制备双歧杆菌胞溶物,为双歧杆菌胞溶物的生产提供了一种新的工程菌;
2、本申请采用燕麦酶解液作为发酵培养基成分培养长双歧杆菌BNCC186627,优化了长双歧杆菌的发酵培养基,提升了菌体生物量得率,并使其特定功效成分含量升高,制备出了富含氨基酸、有机酸、小分子糖、葡聚糖、燕麦生物碱等多种功效组分的双歧杆菌溶胞物,提供了先进的双歧杆菌发酵及溶胞物制备工艺技术,并且本申请工艺采用单菌厌氧发酵,制备工艺简单,成本低,适用于推广生产;
3、本申请所述方法制备的双歧杆菌胞溶物应用于护肤品中的有抗炎、修复、调节皮肤表面微生物的作用,且安全性好,为化妆品行业提供了一种新的功效性原材料,具有广阔的应用前景。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
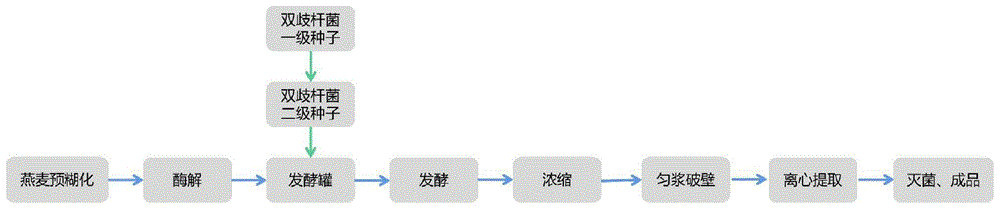
图1双歧杆菌溶胞产物制备过程流程图。
具体实施方式
为了更清楚的阐释本申请的整体构思,下面结合说明书附图以实施例的方式进行详细说明。在下文的描述中,给出了大量具体的细节以便提供对本发明更为彻底的理解。然而,对于本领域技术人员来说显而易见的是,本发明可以无需一个或多个这些细节而得以实施。在其他的例子中,为了避免与本发明发生混淆,对于本领域公知的一些技术特征未进行描述。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。
如未特殊说明,在以下实施方式中,所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
其中,长双歧杆菌(Bifidobacterium longum),菌株编号:BNCC186627,购买自河南省工业微生物菌种工程技术研究中心。高温淀粉酶购自山东隆科特酶制剂有限公司、中温淀粉酶、葡聚糖酶购自宁夏夏盛实业集团有限公司。
长双歧杆菌种子培养基(MRS培养基):蛋白胨1%、酵母浸粉0.4%、牛肉膏1%、葡萄糖2%、磷酸氢二钾0.2%、柠檬酸三铵0.2%、乙酸钠0.5%、硫酸镁0.02%、硫酸锰0.004%、半胱氨酸0.1%、吐温0.1%,121℃灭菌30min处理。
仪器:上海百伦生物科技有限公司10L-100L自动发酵罐;厌氧培养箱;日本岛津高效液相色谱仪;722型紫外-可见分光光度计;湘仪高速离心机。
pH、DO
温度:铂温度电极在线测定。
进气和尾气中氧和二氧化碳的测定:采用美国Extrel过程质谱MAX300-LG对发酵过程中的进气和尾气进行实时在线采集分析。
氧消耗速率OUR和二氧化碳生成速率CER测定:OUR和CER的计算通过对发酵尾气的分析数据计算得到。以进气和尾气中惰性气体N
实施例1双歧杆菌溶胞物的制备
本实施例中双歧杆菌溶胞产物制备过程如图1所示,主体过程包括:长双歧杆菌种子的活化及制备(燕麦酶解液培养基的灭菌(厌氧发酵(浓缩(匀浆破壁(离心提取(双歧杆菌溶胞物。最终得到的离心液即为双歧杆菌溶胞物。
双歧杆菌溶胞物的制备方法
试验例1:
发酵培养基:燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,再加入葡聚糖酶390KU/L,酶解2h,获得燕麦酶解液,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例2:
本试验例与试验例1的区别仅在于厌氧发酵过程中采用MRS培养基替代发酵培养基。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含长双歧杆菌种子培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例3
本试验例与试验例1的区别仅在于发酵培养基中含燕麦粉粒径不同。
发酵培养基:燕麦粉5%(燕麦粉的目数控制在50目-100目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,再加入葡聚糖酶390KU/L,酶解2h,获得燕麦酶解液,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例4
本试验例与试验例1的区别仅在于发酵培养基中不采用酶解处理。
发酵培养基:燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例5
本试验例与试验例1的区别仅在于发酵培养基中不采用葡聚糖酶处理。
发酵培养基:燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,获得燕麦酶解液,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例6
本试验例与试验例1的区别仅在于发酵培养基中采用中温淀粉酶替代葡聚糖酶。
发酵培养基:燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,再加入中温淀粉酶390KU/L,酶解2h,获得燕麦酶解液,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏的长双歧杆菌(Bifidobacterium longum)BNCC186627的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含长双歧杆菌种子培养基的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
试验例7
本试验例与试验例1的区别仅在于采用双歧杆菌HLXZ006替代长双歧杆菌(Bifidobacterium longum)BNCC186627。
发酵培养基:燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,再加入葡聚糖酶390KU/L,酶解2h,获得燕麦酶解液,并配以辅料酵母浸粉0.5%、蛋白胨1%、磷酸氢二铵0.2%,121℃灭菌30min处理。
1、厌氧种子培养阶段
一级种子培养:保藏有双歧杆菌HLXZ006的甘油管种子按照1%的接种量接种到装有150mL长双歧杆菌种子培养基的种子培养瓶中,培养温度37℃,厌氧培养箱中厌氧培养36-48h,OD
二级种子罐(10L)培养:将一级种子液以3.0%的接种量接种到含的种子罐中,氮气保护下厌氧培养,培养温度37℃,转速150rpm。厌氧培养36-48h,OD
2、厌氧发酵培养阶段
三级发酵罐(100L)培养:将二级种子液以5%的接种量接种到含发酵培养基的发酵罐中,氮气保护下厌氧培养(溶氧电极显示值到0.6%以下),培养温度37℃,转速150rpm,厌氧培养24h-48h,OD
培养过程中,用10%NaOH水溶液间歇式调控pH值到5.5(降到4.5开始调控)。葡萄糖流加速率:当糖浓度降到0.4g/L,开始补糖,控制补糖速率为0.2g/L/h。
3、发酵后样本处理得到溶胞物
将发酵结束的发酵液离心沉降,除去燕麦残渣成分,将收集到的菌体上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破壁率90%以上,破碎过程中控制温度不高于30℃,获得双歧杆菌溶胞物。
燕麦酶解液的制备方法包括如下步骤:
燕麦粉5%(燕麦粉的目数控制在100目-200目),用常温纯化水溶解混合分散,100℃糊化5min左右,然后降温到85℃,加入高温淀粉酶300U/L,液化30min,再加入葡聚糖酶390KU/L,酶解2h,获得燕麦酶解液。将酶解液离心沉降,除去燕麦残渣成分,将收集到的上清液通过高压匀浆机进行破碎处理,匀浆压力1400-1500MPa,2-4个循环,破碎过程中控制温度不高于30℃,获得燕麦酶解液试验用样品。
生物量测定实验
生物量测定方法为:离线测定采用湿体积法,将发酵液稀释一定倍数后,在分光光度仪上测定吸光度,得到OD
测量菌体在发酵48h后的OD
表1
由表1结果可见,采用本申请优化后的发酵培养基,能够提高长双歧杆菌(Bifidobacterium longum)BNCC186627的发酵效果。
双歧杆菌溶胞物组分分析
测定双歧杆菌胞溶物中的组成成分,其中,采用生化分析仪酶膜检测法检测还原糖含量。代谢物测定方法为:离心后清液留样检测,利用凯氏定氮仪进行含氮量测定,利用苯胺蓝显色法测定β-葡聚糖含量,利用特征显色比色法测定N-乙酰葡聚糖胺含量,利用高效液相色谱法测定燕麦生物碱的成分含量。
本实施例中利用检测仪器对上述得到的双歧杆菌溶胞物进行组分分析,测定结果见下表2。
表2
表2数据显示采用本申请优化后的发酵培养基发酵长双歧杆菌(Bifidobacteriumlongum)BNCC186627得到的菌体经破碎后,溶胞物中小分子量β-葡聚糖的含量为2.2g/L,含氮量达到0.2%,N-乙酰葡聚糖胺含量达到1.1mg/L;另外还含有0.13g/L燕麦生物碱。该发酵模式得到的双歧杆菌发酵溶胞物丰富了作为化妆品原料的组分内涵。
实施例2双歧杆菌溶胞物的细胞毒性实验
本实施例中依据SN/T 2328-2009,采用角质细胞实验测试对试验例1所得双歧杆菌溶胞物的急性毒性。测试结果如表3和表4所示。
表3不同浓度双歧杆菌溶胞物对于Hacat细胞的毒性
表4不同浓度双歧杆菌溶胞物对于RAW264.7细胞的毒性
根据表3和表4结果可见,双歧杆菌溶胞物在5%浓度范围内,对HaCaT细胞、RAW264.7细胞无毒性。
实施例3双歧杆菌溶胞物的修复效果实验
本实施例中对试验例1所得双歧杆菌溶胞物进行修复效果试验。
具体为:通过酶联免疫吸附实验(ELISA,Enzyme linked immunosorbent assay)定量检测HaCaT细胞(人永生化角质形成细胞)结构蛋白丝聚合蛋白(FLG,Filaggrin)和兜甲蛋白(LOR,Loricrin)含量的上调程度,具体加样方式如表5所示,测试结果如表6和表7所示。
测试依据:Chenxu Jing,Jiling Guo,Zhenzhuo Li,et al.Screening andResearch on SkinBarrier Damage Protective Efficacy of DifferentMannosylerythritolLipids[J].Molecules.2022;27(14):4648.
表5测试方案
表6兜甲蛋白检测结果
表7丝聚合蛋白检测结果
根据表6和表7结果可见,双歧杆菌溶胞物在5%(v/v)剂量下屏障相关蛋白FLG和LOR表达明显上调,与空白组相比,上调率分别为135.92%和147.31%。说明双歧杆菌溶胞物具有促进FLG、LOR蛋白表达作用,在5%(v/v)剂量下具备修护功效。
实施例4双歧杆菌溶胞物的抗炎效果实验
本实施例中通过酶联免疫吸附实验定量检测RAW264.7(小鼠巨噬细胞)分泌IL-6、TNF-α和IL-1β的量来评价试验例1所得双歧杆菌溶胞物的抗炎功效。具体加样方式如表8所示,测试结果如表9-11所示。
测试依据:TSHRH033-2020化妆品舒缓功效测试-体外TNF-α炎症因子含量测定脂多糖诱导巨噬细胞RAW264.7测试方法。
表8测试方案
/>
表9IL-6检测结果
表10TNF-α检测结果
表11IL-1β检测结果
如表9-11所示,试验例1所得双歧杆菌溶胞物在5%(v/v)剂量下,IL-6、TNF-α和IL-1β的分泌量明显下降,与模型组相比,抑制率分别为56.28%、42.35%和52.57%。说明双歧杆菌溶胞物具备抑制炎症因子IL-6TNF-a和IL-1B分泌的作用,在5%(v/v)剂量下具备抗炎功效。
实施例5双歧杆菌溶胞物的抑菌效果实验
本实施例中根据QB/T2738-2012标准对试验例1所得双歧杆菌溶胞物进行抑菌效果验证实验,试验结果如表12所示。
表12
由表12结果可见,双歧杆菌溶胞物对于金黄色葡萄球菌、痤疮丙酸杆菌都有一定的抑制作用,作用30min时有较强的抑制作用。
以上所述仅为本申请的实施例而已,并不用于限制本申请。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的权利要求范围之内。
