DNA甲基化转化方法、甲基化酶转化试剂盒及其使用方法
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及DNA甲基化领域,具体涉及一种DNA甲基化转化方法、甲基化酶转化试剂盒及其使用方法。
背景技术
DNA甲基化是DNA化学修饰的一种形式,能够在不改变DNA序列的前提下,改变遗传表现,是最重要的表观遗传调控方式之一。
简单地说,DNA甲基化是指在DNA甲基化转移酶(DNMT)的作用下,在基因组CpG二核苷酸的胞嘧啶5号碳位共价键结合一个甲基基团。大量研究表明,DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。DNA甲基化修饰在维持正常细胞的功能、雌性个体X染色体失活、寄生DNA序列的抑制、基因组结构稳定、遗传印记、胚胎发育、及肿瘤和疾病的发生、发展紧密相关,具有至关重要的作用,是目前及未来很长一段时间的研究热点之一。
目前,关于DNA甲基化的分析方法主要有:甲基化敏感性限制性内切酶-PCR/Southern法、重亚硫酸盐测序法、甲基化特异性的PCR、甲基化荧光法、焦磷酸测序、甲基化DNA免疫共沉淀、以及结合重亚硫酸盐的限制性内切酶法等。
其中全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,长期以来一直是甲基化图谱分析的金标准。其原理主要是,用亚硫酸氢盐处理DNA可将胞嘧啶残基(C)转化为尿嘧啶(U),但5-甲基胞嘧啶残基(简称:5-mC)对其有抗性,并不会发生转变。其中,5-羟甲基胞嘧啶简称:5-hmC。
因此,亚硫酸氢盐处理引入了依赖于单个C残基甲基化状态的DNA序列的特定变化,从而产生有关DNA片段甲基化状态的单核苷酸分辨率信息。
然而,重亚硫酸氢缓冲液转化时会给样本DNA带来较大损伤,高GC区域未发生甲基化修饰的位点容易发生断裂,发生甲基化修饰的位点容易形成发夹结构,导致DNA片段转化不完,从而导致序列多样性较差,目标富集偏差以及较高的测序误差;
同时,柱纯化亚硫酸氢盐转化法流程繁琐、操作复杂,对实验人员的要求更高。
上述缺点,限制了全基因组重亚硫酸盐甲基化测序在低起始量样本单细胞、FFPRDNA、cfDNA、古DNA等分析中的应用。
发明内容
本发明的目的是为了解决现有技术中的不足,提供一种转化效率高,有效降低DNA的损伤,从而降低核酸样品中DNA的投入量要求的DNA甲基化转化方法、甲基化酶转化试剂盒及其使用方法。
为解决上述技术问题,本发明采用的技术方法是:本发明公开了一种一种DNA甲基化转化方法,包括如下步骤:
S1.对样本DNA,使用人甲基胞嘧啶双加氧酶2进行酶反应,实现由5-甲基胞嘧啶到5-羟甲基胞嘧啶到5-甲酰胞嘧啶最后到5-羧基胞嘧啶的催化过程;
S2.使用T4噬菌体β-葡糖基转移酶完整地将尿苷二磷酸葡萄糖的葡萄糖基团转移至双链DNA中的5-羟甲基胞嘧啶基团上,形成β-葡糖基-5-羟甲基胞嘧啶;
S3.进行脱氨反应,使用胞嘧啶脱氨酶,在不影响5-羧基胞嘧啶和β-葡糖基-5-羟甲基胞嘧啶的情况下,将单链DNA中的胞嘧啶去氨基变为尿嘧啶,实现将原始序列中的胞嘧啶与5-甲基胞嘧啶、5-羟甲基胞嘧啶区分开,进而实现单碱基分辨率识别DNA甲基化位点。
进一步的,将脱去氨基的单链DNA进行聚合酶链式反应扩增,修饰的5-羧基胞嘧啶和β-葡糖基-5-羟甲基胞嘧啶依然为胞嘧啶,而尿嘧啶转化为胸腺嘧啶,从而识别出甲基化位点C→C与非甲基化位点C→T。
本发明还公开了一种甲基化酶转化试剂盒,包括第一氧化反应液、为所述第一氧化反应液提供离子条件的第二氧化反应液、终止反应液、用于将DNA双链变为单链的变性反应液、第一脱氨反应液、为所述第一脱氨反应液提供离子条件的第二脱氨反应液、纯化反应液和无核酶水;
所述第一氧化反应液包括无核酶水、人甲基胞嘧啶双加氧酶2、T4噬菌体β-葡糖基转移酶、10mM三羟甲基氨基甲烷、20mM磷酸钾、200mM氯化钠、0.25mM二硫苏糖醇、0.1mM乙二胺四乙酸、50%甘油;
所述第一脱氨反应液包括胞嘧啶脱氨酶、20mM三羟甲基氨基甲烷盐酸盐、50mM氯化钠、1mM二硫苏糖醇、0.1mM乙二胺四乙酸、50%甘油、无核酶水;
进一步的,所述第二氧化反应液包括无核酶水、100mM三羟甲基氨基甲烷盐酸盐、500mM氯化钠、10mMα-酮戊二酸;10mM L-抗坏血酸、10mM三磷酸腺苷、5mM二硫苏糖醇、0.1mM尿苷二磷酸葡萄糖和20mM亚铁盐化合物;
所述第二脱氨反应液包括50mM醋酸钾,20mM三羟甲基氨基甲烷醋酸盐,10mM乙酸镁,1mM二硫苏糖醇,1%BSA、无核酶水。
进一步的,所述终止反应液包括200mg/mL蛋白酶K、20mM三羟甲基氨基甲烷盐酸盐、1mM氯化钙、50%甘油、无核酶水;
所述变性反应液包括无核酶水、甲酰胺;
所述结合缓冲液包括30%PEG 8000、1M NaCl和0.2M Tris-HCl,pH 8.0、无核酶水。
进一步的,所述纯化反应液包括磁珠和磁珠结合缓冲液,所述磁珠选用1μmMagBeads50mg/mL。
本发明还公开了一种甲基化酶转化试剂盒使用方法,基于上述甲基化酶转化试剂盒,还包括如下步骤,
Sa1.含DNA分子的样品溶液与第一氧化反应液、第二氧化反应液混匀,37℃孵育1小时进行氧化反应;
Sa2.待氧化反应结束后,在反应体系中加入终止反应液,50℃孵育15min以消化第一氧化反应液中剩余的酶来终止反应;
Sa3.步骤中Sa2完成后,加入变性反应液,将样品在85℃下变性10分钟,使DNA分子从双链结构变为单链结构,然后立即转移到在冰上;再加入预冷配制好的第一脱氨反应液和第二脱氨反应液,37℃孵育3小时进行脱氨反应;
Sa4.纯化回收DNA。
进一步的,在所述步骤Sa2中,还包括在终止反应后,纯化回收DNA。
进一步的,在所述步骤Sa1中,含DNA分子的样品溶液与第一氧化反应液、第二氧化反应液的比例为:15:2:8。
进一步的,在所述步骤Sa3中,含DNA分子的样品溶液、第一脱氨反应液、第二脱氨反应液与无核酶水的比例为20:1:11:68。
有益效果:
1、本发明方案的酶法转化与亚硫酸氢盐转化的结果相似,因此并不会对下游应用产生影响,也可采用原先的数据分析工具。但与WGBS相比,本发明可以在较少的PCR循环内获得更高的文库产量,包含更少的测序重复,产生更多可用的序列,增加了基因组的有效覆盖度,GC偏好性更标准,数据质量更高。
2、本发明中的甲基化酶转化试剂盒,能够特异性地识别并转换5-mC和5hmC,后期衔接甲基化建库试剂盒,可完成甲基化测序文库的构建,以单碱基分辨率有效识别DNA甲基化。相比重亚硫酸盐转化法而言,转化效率更高、反应条件更加温和,有效降低DNA的损伤,从而降低核酸样品中DNA的投入量要求,DNA投入量可低至1ng甚至更低,更加适于包括单细胞、cfDNA、FFPE DNA、古DNA等在内的微量样本甲基化研究。
3、本发明提供的试剂盒采用磁珠纯化方案,相比之前的柱纯化方案而言,纯化效率更高,对实验室设备的要求更低,并且有望实现自动化应用方案。
附图说明
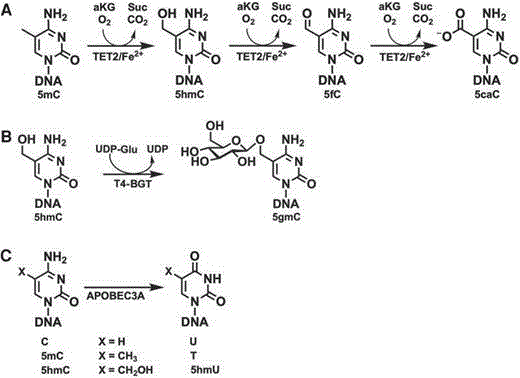
图1为本发明中DNA甲基化转化方法的原理示意图;
图2为本发明实施例2中甲基化酶法转化和盐法转化的回收效率对比图;
图3为本发明实施例2中甲基化酶法转化和盐法转化的转化效率对比图;
图4为本发明实施例3中甲基化酶法转化和盐法转化的文库扩增循环数与文库产量的对比图;
图5为本发明实施例3中甲基化酶法转化和盐法转化后,高通量测序GC覆盖度分析图。
具体实施方式
下面结合附图说明和具体实施方式对本发明作进一步详细的描述。
如图1所示,本发明公开了一种DNA甲基化转化方法,在图1A中,第一步氧化反应中,人甲基胞嘧啶双加氧酶2(TET2)高效地催化完成5-甲基胞嘧啶(5-mC)→5-羟甲基胞嘧啶(5-hmC)→5-甲酰胞嘧啶(5-fC)→5-羧基胞嘧啶(5-caC)的过程;
图1B中,T4噬菌体β-葡糖基转移酶(T4-BGT)可以快速完整地将尿苷二磷酸葡萄糖(UDP-葡萄糖)的葡萄糖基团转移至双链DNA中的5-羟甲基胞嘧啶(5-hmC)基团上,形成β-葡糖基-5-羟甲基胞嘧啶(5-ghmC);
这些反应保护5-mC和5hmC免受下游脱氨作用。
如图1C,使用胞嘧啶脱氨酶,可将单链DNA中的胞嘧啶(C)、5-甲基胞嘧啶(5-mC)和5-羟甲基胞嘧啶(5hmC)脱去氨基变为尿嘧啶(U)。
经过变性,在第二步的脱氨反应中,胞嘧啶脱氨酶(APOBEC3A)对胞嘧啶、5-mC、并在较小程度上对5hmC进行脱氨(不影响5-caC和5-ghmC),将单链DNA中的胞嘧啶去氨基变为尿嘧啶,实现将原始序列中的胞嘧啶与5-甲基胞嘧啶、5-羟甲基胞嘧啶区分开,进而实现单碱基分辨率识别DNA甲基化位点。
随后经过下游的聚合酶链式反应(PCR)扩增后,修饰的5-caC和5-ghmC依然为胞嘧啶,而尿嘧啶(U)则会转化为胸腺嘧啶(T),从而识别出甲基化位点(C→C)与非甲基化位点(C→T)。
酶法转化与亚硫酸氢盐转化的结果相似,因此并不会对下游应用产生影响,也可采用原先的数据分析工具。
但酶转过程更加温和,对DNA损伤小,与传统的亚硫酸氢盐转化相比可保留较完整的DNA片段,在特定指标,如覆盖度,重复性,灵敏度等,均优于亚硫酸氢盐文库,并且可以搭配磁珠纯化方式,有望实现自动化操作。
当DNA起始量为低至1ng甚至更低时,依然可以正常建库并保持优势,为甲基化的研究和临床应用开辟了新的途径。
本发明还公开了一种甲基化酶转化试剂盒,包含以下组分:第一氧化反应液、第二氧化反应液、终止反应液、变性反应液、第一脱氨反应液、第二脱氨反应液、纯化反应液、无核酶水。
第一氧化反应液包括无核酶水、TET2、T4-BGT、10mM三羟甲基氨基甲烷、20mM磷酸钾、200mM氯化钠、0.25mM二硫苏糖醇、0.1mM乙二胺四乙酸、50%甘油。
第二氧化反应液包括无核酶水、100mM三羟甲基氨基甲烷盐酸盐,500mM氯化钠,10mMα-酮戊二酸;10mM L-抗坏血酸,10mM三磷酸腺苷,5mM二硫苏糖醇、0.1mM尿苷二磷酸葡萄糖和20mM亚铁盐化合物。
其中,第一氧化反应液作用是提供氧化反应需要的酶,第二氧化反应液作用是提供氧化反应需要的离子条件;终止反应液包括200mg/mL蛋白酶K、20mM三羟甲基氨基甲烷盐酸盐、1mM氯化钙、50%甘油、无核酶水。
变性反应液包括无核酶水、甲酰胺。
第一脱氨反应液包括胞嘧啶脱氨酶、20mM三羟甲基氨基甲烷盐酸盐,50mM氯化钠,1mM二硫苏糖醇,0.1mM乙二胺四乙酸,50%甘油、无核酶水。
第二脱氨反应液包括50mM醋酸钾,20mM三羟甲基氨基甲烷醋酸盐,10mM乙酸镁,1mM二硫苏糖醇,1%BSA、无核酶水。
其中,第一脱氨反应液作用是提供脱氨反应需要的酶,第二脱氨反应液作用是提供脱氨反应需要的离子条件。
纯化反应液包括磁珠和磁珠结合缓冲液,磁珠优选1μm MagBeads 50mg/mL;结合缓冲液包括30%PEG 8000、1M NaCl和0.2M Tris-HCl,pH 8.0、无核酶水。
本发明涉及一种温和的甲基化酶转化试剂盒的使用方法,包括如下步骤:
氧化反应:将含DNA分子的样品溶液与第一氧化反应液、第二氧化反应液混匀,37℃孵育1小时进行氧化反应;
氧化反应结束后,在反应体系中加入终止反应液,50℃孵育15min以消化剩余的酶来终止反应;
然后纯化回收DNA;
回收方式指磁珠法回收、柱法回收或抽提沉淀法回收,其中本发明中采用磁珠法纯化,操作简单,纯化效果最优。
脱氨反应:在上一步的反应体系中加入变性反应液,将待测样品在85℃下变性10分钟,然后立即转移到在冰上;再加入预冷配制好的第一脱氨反应液和第二脱氨反应液,37℃孵育3小时进行脱氨反应,反应结束后纯化回收DNA,即可进行下游实验。
实施例--甲基化酶转化试剂盒的使用方法
1.氧化反应
(1)在冰上,配制如下氧化反应体系:
(2)36℃反应1小时后,再加入1μL终止反应液,37℃孵育15分钟以终止氧化反应。
2.纯化反应
(1)涡旋纯化反应液以重悬其中的磁珠。
(2)取90μl重悬的纯化反应液加入样本中,用移液器上下吹吸10次以上混匀体系。
(3)将混合样本在室温孵育5分钟后,将离心管放置在合适的磁力架上。
(4)等待5分钟或者溶液变得清亮后,小心地吸取并去除上清。
(5)保持离心管放在磁力架上,在离心管中加入200μl的新鲜配制的80%的酒精,室温孵育30秒,小心地吸取并去除上清。
(6)重复操作步骤(5)一次,一共漂洗两次。
(7)将离心管微离心,重新置于磁力架上,用10μl枪头小心吸弃残余上清以去除残留的乙醇。
(8)保持离心管放在磁力架上,打开离心管盖,室温下晾干1-2分钟。
(9)将离心管从磁力架上取下,加入17μl的无核酶水。
(10)用移液器上下吹吸10次以上混匀体系,室温孵育1-2分钟。
(11)将离心管放在磁力架上,等待3分钟或者溶液变得清亮,将16μl上清转移到一个新的PCR管中。
3.脱氨反应
(1)取4μl变性反应液加入纯化后的样品中,85℃孵育10分钟。
(2)结束后马上放在冰上,让样品完全冷却备用。
(3)在冰上,配制如下脱氨反应体系:
(4)37℃反应3小时。
其中,冰上,即离心管放在冰块上。
4.纯化反应
(1)涡旋纯化反应液以重悬其中的磁珠。
(2)取180μl重悬的纯化反应液加入样本中,用移液器上下吹吸10次以上混匀体系。
(3)将混合样本在室温孵育5分钟后,将离心管放置在合适的磁力架上。
(4)等待5分钟或者溶液变得清亮后,小心地吸取并去除上清。
(5)保持离心管放在磁力架上,在离心管中加入200μl的新鲜配制的80%的酒精,室温孵育30秒,小心地吸取并去除上清。
(6)重复操作步骤(5)一次,一共漂洗两次。
(7)将离心管微离心,重新置于磁力架上,用10μl枪头小心吸弃残余上清以去除残留的乙醇。
(8)保持离心管放在磁力架上,打开离心管盖,室温下晾干1-2分钟。
(9)将离心管从磁力架上取下,加入17μl的无核酶水。
(10)用移液器上下吹吸10次以上混匀体系,室温孵育1-2分钟。
(11)将离心管放在磁力架上,等待3分钟或者溶液变得清亮,将16μl上清转移到一个新的PCR管中。
得到的即是酶法转化后的DNA样本,可以直接用于下游的二代测序建库或者Q-PCR实验,进行甲基化转化效果验证。
实施例2
分别使用200ng的末甲基化Lambda DNA和CpG甲基化pUC19 DNA分别通过酶转化和盐转化后,其中酶法转化使用本发明中的试剂盒,而盐法转化使用Zymo Research EZ DNAMethylation-Gold试剂盒,转化后均构建二代测序文库进行高通量测序。
见图2和图3,与盐转法相比,酶转法对末甲基化Lambda DNA(酶转化法1)、CpG甲基化pUC19 DNA(酶转化法2)的回收效率和转化效率更高。
实施例3
分别使用10、50和200ng的NA12878基因组DNA分别通过酶法转化和盐法转化后,构建二代测序文库进行高通量测序。
如图4及5所示,与盐转法相比,酶转法可以在较少的PCR循环内获得更高的文库产量,并能显著提高GC覆盖度的均一性,既无AT过度测序,也无GC测序不足。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
