一种高盐水体中烷烃和多环芳烃的降解菌剂及其应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于微生物技术领域,具体涉及一种高盐水体中烷烃和多环芳烃的降解菌剂及其应用。
背景技术
烷烃和多环芳烃是常见的有毒有害且难降解的有机污染物,严重危害人类健康和生态环境健康。如汽油、煤和石油等化石燃料的不完全燃烧,石油泄漏,农田污水灌溉,大气沉降等,均是其主要来源。
现有关于烷烃和多环芳烃的降解修复方法,多为物理化学方法,如隔离法、化学氧化法、光催化法、热力学修复法等,可以对烷烃和多环芳烃进行处理而实现修复效果。但是现有的这些方法一方面效果有限,另一方面费用较高且容易造成二次污染,限制了应用。
微生物修复法越来越多的显示出优势,如发明专利《一种烷烃和多环芳烃降解复合菌剂及其制备方法》提供了一种以台式戈登氏菌、施氏假单胞菌制备的复合菌剂,能够降解烷烃和多环芳烃。再如Sun W et al.(2019)等人提供了一种对淡水中石油烃具有降解功能的苏云金芽孢杆菌(Bacillus thuringiensis)CQ8-1菌株[Sun W et al.,2019.Isolation,identification,and characterization of diesel-oil-degradingbacterial strains indigenous to Changqing oil field,China.Journal of BasicMicrobiology,59:723-734],但该菌株对石油烃的最高降解率仅为66%,且该菌株只能在淡水条件下生存,无法应用于高盐水体污染的清除。
另外,由于微生物菌株的活性难以长期保持、甚至还会发生退化,因此,探寻更多的微生物菌株,尤其是能够用于降解高盐水体中烷烃和多环芳烃的微生物菌株,并探索其菌剂产品的生产工艺,对于被烷烃和多环芳烃污染的高盐水体的修复具有重要意义。
发明内容
本发明针对现有技术中富含烷烃和/或多环芳烃等污染物的修复技术不足,旨在提供一种高盐水体中烷烃和多环芳烃的降解菌剂及其应用,实现对诸如海洋石油污染等环境的微生物修复。
本发明的首要目的是提供一种苏云金芽孢杆菌NH26菌剂。
本发明的又一目的是提供上述苏云金芽孢杆菌NH26菌剂在降解烷烃和/或多环芳烃中的应用,或在清除烷烃和/或多环芳烃污染中的应用,或在修复被烷烃和/或多环芳烃污染的环境中的应用。
本发明的又一目的是提供上述菌剂在降解富含烷烃和/或多环芳烃的污染物中的应用,或在清除富含烷烃和/或多环芳烃的污染物污染中的应用,或在修复被富含烷烃和/或多环芳烃的污染物污染的环境中的应用。
本发明通过以下技术方案实现上述发明目的:
本发明建立了苏云金芽孢杆菌NH26菌剂的制备方法,并对苏云金芽孢杆菌NH26菌剂制备工艺进行了优化。
本发明制备的苏云金芽孢杆菌NH26菌剂在天然海水中对浓度为20g/L的精制柴油中正十二烷~正二十七烷各种组分的降解率均达88.4%以上,总降解率为90.2%;在天然海水中对浓度为50g/L的精制柴油中正十二烷~正二十七烷各种组分的降解率均达88%以上,总降解率为84.8%;在天然海水中对浓度均为50mg/L的蒽、芘和菲的去除率分别为43.54%、44.82%和68.56%;在天然海水中对浓度均为100mg/L的蒽、芘和菲的去除率分别为39.02%、41.69%和63.47%。
因此,以下技术方案均应在本发明的保护范围之内:
本发明提供了一种苏云金芽孢杆菌NH26菌剂,包含苏云金芽孢杆菌NH26(Bacillus thuringiensis NH26)菌株;所述苏云金芽孢杆菌NH26菌株于2022年7月21日保藏于中国典型培养物保藏中心(CCTCC),保藏编号为CCTCC NO:M20221149,保藏地址为中国.武汉.武汉大学。
优选地,所述降解菌剂由包含苏云金芽孢杆菌NH26菌株的发酵菌发酵制备得到。
优选地,所述发酵制备的方法为:苏云金芽孢杆菌NH26菌株经活化、发酵培养、菌体收集、悬浮液配制、冻干。
优选地,所述活化的时间为6~10小时。最优选为8小时。
优选地,所述活化的温度为25~35℃。最优选为30℃。
优选地,所述活化在转速为150~210转/分钟的条件下进行。最优选为180转/分钟。
优选地,所述活化使用的培养基成分为葡萄糖15~25g/L、酵母膏4~15g/L、硫酸铵2~8g/L、KH
优选地,所述活化使用的培养基的pH值调至6.5~7.5。最优选地,pH值调至7.0。
优选地,所述发酵培养的培养基包括以下成分:可溶性淀粉37.5~62.5g/L、酵母膏2.5~7.5g/L、MnSO
优选地,所述发酵培养的培养基的pH值调至6.5~7.5。最优选地,pH值调至7.0。
优选地,所述发酵培养的温度为25~35℃。最优选为30℃。
优选地,所述发酵培养的转速为150~180转/分钟。最优选为160转/分钟。
优选地,所述发酵培养的接种量为1~15%。最优选为5%。
优选地,所述发酵培养的时间为14~18小时。最优选为16小时。
优选地,所述菌体收集的方法为离心、洗涤、再离心。
更优选地,所述离心的条件为:3000~8000×g、0~10℃条件下离心15~25分钟。最优选为:5000×g、4℃条件下离心10分钟。
更优选地,所述洗涤用生理盐水洗涤。
更优选地,所述洗涤用无菌生理盐水洗涤。
更优选地,所述洗涤的次数为2~4次。最优选为3次。
优选地,所述悬浮液配制为将收集的菌体与保护剂溶液混合。
更优选地,所述保护剂溶液包括以下质量百分浓度组分:脱脂奶粉10~20%、蔗糖15~25%、聚乙烯吡咯烷酮-K30 5~9%和谷胱甘肽为1.0~2.0%。最优选为脱脂奶粉为15%、蔗糖为20%、聚乙烯吡咯烷酮-K30为7%和谷胱甘肽为1.3%。
更优选地,所述保护剂溶液的pH值为6.5~7.5。最优选为7.0。
更优选地,所述悬浮液配制时复合保护剂的加入量为发酵液体积的1~2倍。最优选为1.5倍。
优选地,所述冻干时的预冻条件为-196~-60℃冷冻0.20~2小时。最优选为-196℃冷冻15分钟。
优选地,所述冻干时的冻干厚度为0.4~0.6厘米。最优选为0.5厘米。
优选地,所述冻干时的冷阱温度为-80~-40℃。最优选为-60℃。
优选地,所述冻干时的真空度为0.1~0.2Mbar。最优选为0.15Mbar。
优选地,所述冻干的时间为24~48小时。最优选为36小时。
本发明还提供了所述的降解菌剂在降解烷烃和/或多环芳烃中的应用,或在清除烷烃和/或多环芳烃污染中的应用,或在修复被烷烃和/或多环芳烃污染的环境中的应用。
本发明还提供了所述的降解菌剂在降解富含烷烃和/或多环芳烃的污染物中的应用,或在清除富含烷烃和/或多环芳烃的污染物污染中的应用,或在修复被富含烷烃和/或多环芳烃的污染物污染的环境中的应用。
更优选地,所述烷烃包括但不限于正十二烷~正二十七烷。
更优选地,所述多环芳烃包括但不限于蒽、菲和芘。
本发明的技术方案具有以下有益效果:
本发明提供了一种苏云金芽孢杆菌NH26菌剂,并给出菌剂制备的最佳条件。本发明制备的苏云金芽孢杆菌NH26菌剂对烷烃和多环芳烃具有优异的降解能力,因此对富含烷烃和多环芳烃的污染物具有优异的清除效果。比如对海水中的石油烃具有优异的降解能力,当石油烃浓度为20g/L时对各种石油烃分子的降解率均达88.4%以上,总降解率为90.2%;当石油烃浓度为50g/L时对各种石油烃分子的降解率均达88%以上,总降解率为84.8%。此外,本发明的苏云金芽孢杆菌NH26菌剂对海水中的多环芳烃也具有强的降解能力,例如,对海水中菲的浓度为50mg/L时其去除率为68.56%;对海水中菲的浓度为100mg/L时其去除率为63.47%。
附图说明
图1为在条件优化前苏云金芽胞杆菌NH26菌株的生长曲线。
图2为在条件优化前苏云金芽胞杆菌NH26菌株的发酵曲线。
图3为在条件优化后苏云金芽胞杆菌NH26菌株200mL体系的发酵曲线。
图4为在条件优化后苏云金芽胞杆菌NH26菌株5L体系的发酵曲线。
图5为在条件优化后苏云金芽胞杆菌NH26菌株30L体系的发酵曲线。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
本发明所用的苏云金芽孢杆菌NH26为苏云金芽孢杆菌NH26(Bacillusthuringiensis NH26)菌株,该菌株分离自广东惠州遭受原油污染的海岸带湿地表层土壤/沉积物,于2022年7月21日保藏于中国典型培养物保藏中心(CCTCC),保藏编号为CCTCC NO:M20221149,保藏地址为中国.武汉.武汉大学。
以下实施例中所有培养基,均经121℃灭菌20分钟后再使用。
实施例1制备苏云金芽孢杆菌NH26菌剂的活化、发酵工艺参数优化
本实施例对制备苏云金芽孢杆菌NH26菌剂过程中的活化、发酵工艺进行优化。
一、活化条件优化
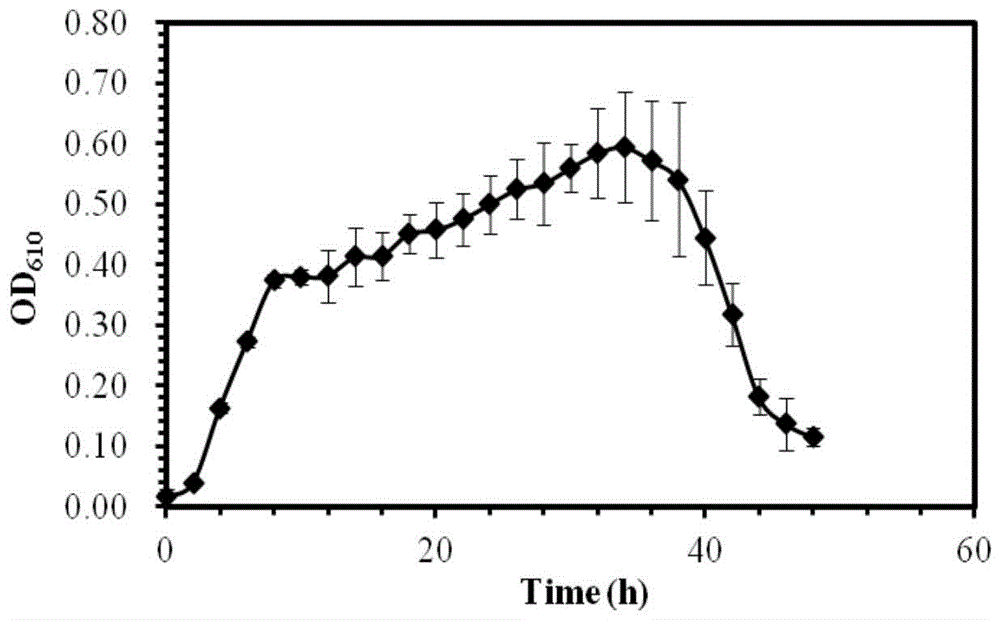
(1)活化时间优化(苏云金芽孢杆菌NH26菌株的生长曲线)
将培养于Luria-Bertani(LB)琼脂培养基(其成分为:蛋白胨10g/L、酵母膏5g/L、NaCl 10g/L和琼脂20g/L)中的苏云金芽孢杆菌NH26菌株接种至种子培养基(其组成为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
生长曲线测定结果如图1所示。从图1看出,苏云金芽孢杆菌NH26菌株的对数生长期为2-10小时,随后进入稳定生长期,34小时后菌体开始衰亡,反映出苏云金芽孢杆菌NH26菌株在种子培养基中易培养、生长快。
根据实验结果选取6-10小时(最佳为8小时)作为种子培养基活化苏云金芽孢杆菌NH26菌株的培养时间。
二、发酵条件优化
1、发酵条件优化前苏云金芽孢杆菌NH26菌株的发酵曲线
将苏云金芽孢杆菌NH26菌株的种子培养液(在种子培养基中培养8小时)按10%的接种量转接至200mL液体发酵培养基(其成分为:豆油20g/L、酵母膏5g/L、KH
发酵曲线测定结果如图2所示。从图2看出,经12小时发酵,苏云金芽孢杆菌NH26菌株的生物量达到最大,40小时后生物量趋于平稳,反映出苏云金芽孢杆菌NH26菌株在液体发酵培养基中易培养、生长快。菌体进入稳定期其在结构和生理上均发生很大变化,包括应激蛋白、膜组成和细胞壁结构的表达水平,从而使菌体抗性增加。故在发酵条件优化前,40小时为最适的菌剂发酵时间。
2、发酵培养基优化
(1)碳源对苏云金芽孢杆菌NH26菌株的影响
碳源和氮源是苏云金芽孢杆菌NH26菌株生长最重要的营养成分。
在原液体发酵培养基配方的基础上,以碳源为单一变量,研究碳源对苏云金芽孢杆菌NH26菌株的影响。分别用20g/L的葡萄糖、可溶性淀粉、豆油、椰子油、棕榈油或山茶油为苏云金芽孢杆菌NH26菌株发酵培养基的唯一碳源,在30℃、180转/分钟条件下培养苏云金芽孢杆菌NH26菌株。以培养前后发酵液的表面张力、乳化率和生物量为指标,综合评估苏云金芽孢杆菌NH26菌株的碳源利用率,结果表明苏云金芽孢杆菌NH26菌株对碳源利用的先后顺序为:可溶性淀粉>葡萄糖>棕榈油>豆油>山茶油>椰子油。可溶性淀粉为最佳碳源。
(2)氮源对苏云金芽孢杆菌NH26菌株的影响
在原液体发酵培养基配方的基础上,选用可溶性淀粉为最佳碳源,分别以5g/L酵母膏、(NH
(3)碳源与氮源的质量比对苏云金芽孢杆菌NH26菌株的影响
在得到最佳碳源和氮源后,再以碳源与氮源质量比为20:1、20:2、20:3、20:4、20:5、20:10配制液体发酵培养基。以培养前后发酵液的表面张力、乳化率和生物量为指标,综合评估碳源与氮源质量比对菌株NH26的影响,结果表明碳源与氮源的质量比优选为:可溶性淀粉/酵母膏=20:1~3,菌株NH26的最适碳源与氮源质量比为:可溶性淀粉/酵母膏=20:2。
(4)微量元素铁和锰对苏云金芽孢杆菌NH26菌株的影响
用最适的碳源、氮源及碳源与氮源质量比配制液体发酵培养基,以培养前后发酵液的表面张力、乳化率和生物量为指标,综合评估微量元素铁和锰的浓度对苏云金芽孢杆菌NH26菌株的影响,结果表明微量元素铁和锰的浓度优选为:FeSO
(5)NaCl浓度对苏云金芽孢杆菌NH26菌株的影响
用最适的碳源、氮源、碳源与氮源质量比及微量元素浓度配制发酵培养基,以培养前后发酵液的表面张力、乳化率和生物量为指标,综合评估NaCl浓度对菌株NH26的影响,结果表明NaCl浓度优选为1.0~3.0g/L,最适NaCl浓度为2.0g/L。
(6)谷氨酸钠浓度对苏云金芽孢杆菌NH26菌株的影响
以谷氨酸钠浓度作为液体发酵培养基成分中的单一变量,设置1、2、5、10、15和20g/L六种浓度。以培养前后发酵液的表面张力、乳化率和生物量为指标,综合评估谷氨酸钠对苏云金芽孢杆菌NH26菌株的影响,结果表明谷氨酸钠浓度优选为5~15g/L,最适谷氨酸钠浓度为10g/L。
综上,苏云金芽孢杆菌NH26的发酵培养基优选配方为:
可溶性淀粉37.5~62.5g/L、酵母膏2.5~7.5g/L、MnSO
最优选择为:
可溶性淀粉50g/L、酵母膏5g/L、MnSO
3、培养条件优化
培养条件对苏云金芽孢杆菌NH26菌株的影响
苏云金芽孢杆菌NH26菌株用上述优化后的发酵培养基配方(培养基成分为:可溶性淀粉50g/L、酵母膏5g/L、MnSO
在上述单因素试验的基础上,选择培养温度、转速、培养基pH值和接种量四个培养条件为变量(表1),设置L
表1培养条件变量
表2L
4、发酵规模对菌株发酵时间的影响
在优化后的发酵培养基、发酵培养条件下(按5%的接种量,培养基成分为:可溶性淀粉50g/L、酵母膏5g/L、MnSO
结果表明,对于200mL摇瓶体系,在16~24小时出现高生物量(图3);对于5L发酵罐体系,在15~25小时出现高生物量(图4);对于30L发酵体系,在12~16小时出现高生物量(图5)。因此,在实际工作中,对于低于30L的发酵规模,选择发酵时间16~24小时;对于大于等于30L的发酵规模,选择发酵时间12~16小时即可。因此,对于任意发酵规模而言,可综合选择14~18小时为优选发酵时间(最佳选择为16小时)。
实施例2制备苏云金芽孢杆菌NH26菌剂的冻干工艺参数优化
1、实验过程中,苏云金芽孢杆菌NH26活菌数和冻干存活因子的测定方法如下:
用上述平板计数法分别测定冻干前菌液样品和冻干菌剂复水后的样品的活菌数,计算菌体的冻干存活因子。冻干前活菌数为菌液中的活菌数;冻干后的活菌数为冻干菌剂悬浮于10%的蔗糖溶液中、于30℃复水30分钟、恢复活性后的活菌数。
活菌数的测定方法为:将冻干前苏云金芽孢杆菌NH26菌液样品及冻干菌剂复水后的样品进行10倍梯度稀释,取10
冻干存活因子=[1-(lg冻干前活菌数-lg冻干后活菌数)/lg冻干前活菌数]
冻干前活菌数(CFU)=冻干前菌浓(CFU/mL)×v
冻干后活菌数(CFU)=冻干后菌浓(CFU/g)×m
式中v代表冻干前菌液体积(mL);m代表冻干后菌粉质量(g)。
2、优化前苏云金芽孢杆菌NH26菌剂冻干工艺及参数为:
在优化冻干条件之前,通常从大分子保护剂、糖类、聚合物类或抗氧化剂中选择一种用蒸馏水溶解,搅拌均匀,于121℃下灭菌15分钟后,配置单一成分的冻干保护剂溶液,置于4℃冰箱中保存备用。
在5000×g、4℃条件下离心10分钟菌液,收集由苏云金芽孢杆菌NH26菌株发酵产生的菌体沉淀;按菌悬液(未离心前体积)与保护剂(v/v)为1:1的比例将冻干保护剂加至菌悬液中;计算初始细胞活菌数后,将其放置-80℃冰箱中预冻2小时;待完全冻结后将菌悬液样品放入冷阱温度为-50℃,真空度为0.20Mbar的真空冷冻干燥机内冷冻干燥24小时;最后将冻干后的样品置于-20℃冰箱中保存。
3、以下为冻干工艺的参数优化试验:
(1)冻干保护剂类型的优化
选择大分子类(脱脂奶粉、酵母粉、可溶性淀粉和麦芽糊精)、糖类(海藻糖、蔗糖和乳糖)、聚合物类(明胶和聚乙烯吡咯烷酮-K30)、抗氧化剂类(微生素C和谷胱甘肽)材料开展单因素冻干保护剂优化试验。
(a)冻干保护剂类型的选择
分别选用以下保护剂与菌体充分混匀,观察菌体的存活情况:
大分子保护剂:分别选用脱脂奶粉、酵母粉、可溶性淀粉和麦芽糊精进行试验,浓度均为10%。糖类保护剂:分别选用海藻糖、蔗糖和乳糖进行试验,浓度均为10%。聚合物类保护剂:分别选用聚乙烯吡咯烷酮-K30和明胶进行试验,浓度均为5%。抗氧化剂类保护剂:分别选用维生素C和谷胱甘肽进行试验,浓度均为1%。
将上述保护剂按浓度用蒸馏水溶解,搅拌均匀,于121℃下灭菌15分钟,置于4℃冰箱中保存备用;微生素C和谷胱甘肽采用0.22μm的滤膜过滤除菌。以菌体存活因子为指标评估冻干保护剂的保护效果,优选出冻干保护剂的类型。
试验表明,脱脂奶粉的保护效果最好,显著高于酵母粉、可溶性淀粉和麦芽糊精的保护作用。故选择脱脂奶粉为大分子保护剂;糖类也能显著提高菌体的存活因子,其中蔗糖保护效果最优;在聚合物类保护剂中,聚乙烯吡咯烷酮-K30的保护效果较好;在抗氧化剂类保护剂中,谷胱甘肽的保护效果较好。
(b)冻干保护剂浓度的选择
根据(a)试验结果,以冻干菌粉的菌体存活因子为指标,选择脱脂奶粉、蔗糖、聚乙烯吡咯烷酮-K30、谷胱甘肽为保护剂,并分别设置不同的浓度梯度进行试验,以确定其加入的最适浓度。其中脱脂奶粉和蔗糖设置的浓度梯度为:0%、5%、10%、15%、20%;聚乙烯吡咯烷酮-K30设置的浓度梯度为:0%、1%、3%、5%、7%、9%;谷胱甘肽设置的浓度梯度为:0%、0.4%、0.7%、1.0%、1.3%、1.6%。
单因素试验综合评估表明,脱脂奶粉的浓度优选为10~20%,最佳为15%;蔗糖的浓度优选为15~25%,最佳为15%;聚乙烯吡咯烷酮-K30的浓度优选为5~9%,最佳为7%;谷胱甘肽的浓度优选为1.0~2.0,最佳为1.0%。
(c)复合冻干保护剂质量百分浓度的优化
以上述单因子试验结果为依据,以存菌株活因子为指标,开展复合冻干保护剂的正交试验。通过正交试验L
结果表明,保护效果最好的保护剂组合为:脱脂奶粉15%,蔗糖20%,聚乙烯吡咯烷酮-K30 7%,谷胱甘肽1.3%。
表3冻干保护剂的正交因素水平
表4冻干保护剂正交试验结果
(3)冻干燥保护剂的pH值优化
将筛选出来的复合保护剂用灭菌后的乙酸或氨水将pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5,在30℃下与菌体平衡20分钟后进行真空冷冻干燥,计算出菌体的存活因子。优化试验表明,优选pH值为6.5~7.5,最佳为7.0。
(4)菌液和保护剂比例的确定
以菌体存活因子为指标,评估菌液与保护剂的最佳比例为。按菌液/保护剂1:1、1:1.5、1:2、1:2.5、1:3(v/v)的比例开展冻干试验,结果表明,菌液与保护剂比例优选为1:1~2,最佳为1:1.5。
(5)冻干厚度优选
将菌体与保护剂振荡混匀后,以不同的厚度(0.3、0.4、0.5、0.6、0.7cm)装入玻璃平皿中,置于真空冷冻干燥机内冻干。以菌体存活因子为指标,评估最佳冻干厚度。优化试验表明,冻干厚度优选为0.4~0.6,最佳为0.5。
(6)预冻方式优选
将菌体分别置于-20℃下冷冻2小时、-80℃下冷冻2小时,-196℃(液氮)下冷冻15分钟,然后真空冷冻干燥24小时,测菌体的存活因子。试验结果表明,预冻方式优选为-196℃~-80℃下冷冻0.20~2小时,最佳为-196℃(液氮)下冷冻15分钟。
综上,优化的苏云金芽孢杆菌NH26菌剂的制备方法(即包括菌株的发酵方法及冻干工艺)见实施例3。
实施例3制备苏云金芽孢杆菌NH26菌剂的方法
(1)苏云金芽孢杆菌NH26菌株的活化
根据实施例1的优化结果,确定苏云金芽孢杆菌NH26菌株的活化方法为:
将苏云金芽孢杆菌NH26菌株接种至种子培养基,在25~35℃、150~210转/分钟的条件下培养6~10小时(优选30℃、180转/分钟的条件下培养8小时),得种子培养液;
所述种子培养基的组成为:葡萄糖15~25g/L、酵母膏4~15g/L、硫酸铵2~8g/L、KH
最佳的种子培养基的组成为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
(2)苏云金芽孢杆菌NH26菌株的发酵培养
将活化获得的苏云金芽孢杆菌NH26菌株种子培养液按1~15%接种量(优选5%接种量)转接至液体发酵培养基,在25~35℃、150~180转/分钟(优选30℃、160转/分钟)的条件下发酵培养14~18(优选16小时)后,得发酵菌液;
所述液体发酵培养基成分为:可溶性淀粉37.5~62.5g/L、酵母膏2.5~7.5g/L、MnSO
(3)收集苏云金芽孢杆菌NH26菌株菌体
将发酵培养好的发酵菌液置于离心机中,3000~8000×g、0~10℃条件下离心15~25分钟(优选5000×g、4℃条件下离心10分钟),弃上清液;用无菌生理盐水洗涤菌体2~4次(优选3次)后,再以上述相同的条件离心后即可得到苏云金芽孢杆菌NH26菌体沉淀。
(4)苏云金芽孢杆菌NH26菌体悬浮液的配制
将苏云金芽孢杆菌NH26菌体沉淀按菌液(离心前的菌液体积)与保护剂比例(v/v)1:1.0~2.0(优选为1:1.5)加入复合保护剂溶液,配制成苏云金芽孢杆菌NH26菌体悬浮液;
所述复合保护剂溶液的组成(质量百分数)为脱脂奶粉10~20%、蔗糖15~25%、聚乙烯吡咯烷酮-K30 5~9%和谷胱甘肽为1.0~2.0%(优选为脱脂奶粉为15%、蔗糖为20%、聚乙烯吡咯烷酮-K30为7%和谷胱甘肽为1.3%;pH值7.0)。
(5)苏云金芽孢杆菌NH26菌体的冷冻干燥
计算苏云金芽孢杆菌NH26菌体悬浮液初始细胞活菌数后分装在-196~-60℃下冷冻0.20~2小时(优选在-196℃预冻15分钟);冻结完全后将预冻好的样品(冻干厚度为0.4~0.6cm,优选为0.5cm)放入冷阱温度为-80~-40℃、真空度为0.1~0.2Mbar的真空冷冻干燥机内冻干24~48小时(优选为-60℃、真空度为0.15Mbar、冻干36小时)。冻干后即得苏云金芽孢杆菌NH26冻干菌剂。
采用如实施例2所述的方法测定苏云金芽孢杆菌NH26菌株冻干前的活菌数和冻干菌剂中的活菌数,计算存活因子。
检测结果表明,采用上述方法制备的NH26冻干菌剂,其存活因子为0.993~0.997±0.02),活菌数为(2.14~3.23±0.03)×10
以下实施例4~5是以实施例3中最佳条件制备的苏云金芽孢杆菌NH26菌剂进行降解实验。
实施例4苏云金芽孢杆菌NH26菌剂对海水中烷烃的降解
一、苏云金芽孢杆菌NH26菌剂在海水精制柴油浓度为20g/L时对十二烷~二十七烷各组分的降解能力
将1g苏云金芽孢杆菌NH26菌剂冻干粉加至种子培养液(其成分为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
经苏云金芽孢杆菌NH26菌剂降解后,先用二氯甲烷对培养基中的残留烷烃进行萃取,再用气相色谱-质谱仪(GC-MS)对烷烃组成进行分析,并与降解实验前的精制柴油组分进行对比。通过比较降解实验前后各种烷烃组分的分峰面积,计算十二烷~二十七烷各种组分的降解率。结果如表5所示。
表5苏云金芽孢杆菌NH26菌剂在海水精制柴油浓度为20g/L时对十二烷~二十七烷各种组分的降解率
从表5中看出,NH26菌剂对十二烷~二十七烷各种组分的降解率均达88.4%以上,总降解率为90.2%,表明由NH26菌剂在海水中对十二烷~二十七烷各种组分具有优异的降解能力。
二、苏云金芽孢杆菌NH26菌剂在海水精制柴油浓度为50g/L时对十二烷~二十七烷各种组分的降解能力
将1g苏云金芽孢杆菌NH26菌剂冻干粉加至种子培养液(其成分为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
经NH26菌剂降解后,先用二氯甲烷对培养基中的残留烷烃进行萃取,再用GC-MS对烷烃组成进行分析,并与降解实验前的精制柴油组分进行对比。通过比较降解实验前后各种烷烃组分的分峰面积,计算十二烷~二十七烷各种组分的降解率,结果如表6所示。
表6苏云金芽孢杆菌NH26菌剂在海水精制柴油浓度为50g/L时对十二烷~二十七烷各种组分的降解率
从表6中看出,NH26菌剂对十二烷~二十七烷各种组分的降解率均达88%以上,总降解率为84.8%,表明NH26菌剂在高浓度(50g/L)精制柴油的天然海水中对十二烷~二十七烷仍保持良好的降解能力。
实施例5苏云金芽孢杆菌NH26菌剂对海水中多环芳烃的降解
一、苏云金芽孢杆菌NH26菌剂在海水中蒽、菲和芘浓度均为50mg/L时对三者的降解率
将1g苏云金芽孢杆菌NH26菌剂冻干粉加至种子培养液(其成分为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
表7苏云金芽孢杆菌NH26菌剂在海水中蒽、菲和芘浓度均为50mg/L时对三者的降解率
从表7看出,随着时间的延长,苏云金芽孢杆菌NH26菌剂对蒽、菲和芘的去除率均呈上升趋势;经30天的降解,苏云金芽孢杆菌NH26菌剂对浓度为50mg/L的蒽、芘和菲的去除率分别为43.54%、44.82%和68.56%。
二、苏云金芽孢杆菌NH26菌剂在海水中蒽、菲和芘浓度均为100mg/L时对三者的降解率
将1g苏云金芽孢杆菌NH26菌剂冻干粉加至种子培养液(其成分为:葡萄糖20g/L、酵母膏10g/L、硫酸铵5g/L、KH
表8苏云金芽孢杆菌NH26菌剂在海水中蒽、菲和芘浓度均为100mg/L时对三者的降解率
从表8看出,随着时间的延长,苏云金芽孢杆菌NH26菌剂对蒽、菲和芘的去除率均呈上升趋势;经30天的降解,苏云金芽孢杆菌NH26菌剂对浓度为100mg/L的蒽、芘和菲的去除率分别为39.02%、41.69%和63.47%。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 一种高效降解多环芳烃的复合菌剂及其应用
- 一种降解多环芳烃污染物的大肠杆菌工程菌及其构建方法和应用
- 一株耐盐多环芳烃降解菌Tzymx及其在海洋污染环境中的应用
- 一株耐盐多环芳烃降解菌Tzyjm及其在海洋污染环境中的应用
