犬冠状病毒S1蛋白特异性小分子抗体Fab及其制备方法
文献发布时间:2024-04-18 19:44:28
技术领域
本发明属于生物技术领域,具体涉及犬冠状病毒S1蛋白特异性小分子抗体Fab及其制备方法。
背景技术
犬冠状病毒病是由犬冠状病毒(Canine coronavirus,CCV)感染引起的一种以沉郁、厌食、呕吐、腹泻、咳嗽为临床表现的传染性疾病。犬冠状病毒属于套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronaviurs)、冠状病毒Ⅰ群。目前,犬冠状病毒除了已知的CCV-Ⅰ和CCV-Ⅱ两种基因型外,还出现了新的重组CCV变异株。近期,Vlasova A N等人在住院肺炎患者鼻咽拭子中发现了犬冠状病毒的RNA,并首次在人类肺炎患者中分离出了犬猫重组冠状病毒,可见该病毒可能会引起人畜共患病,危害较大。CCV主要编码四种结构蛋白即M、E、S、N和其他几个具有潜在未知功能的非结构蛋白,S蛋白是Ⅰ型跨膜融合蛋白,是冠状病毒表面的重要糖蛋白,它与宿主细胞膜上的病毒受体结合并诱导产生抗体,且与病毒的组织嗜性密切相关。乔军等对犬冠状病毒S蛋白主要抗原区基因片段的表达及免疫原性做了研究,表明其具有一定的免疫原性。故CCV S蛋白是免疫诊断制剂、亚单位疫苗和治疗性抗体开发的理想对象。乔军等人扩增CCV DXMV株S1基因片段(2415bp),利用酵母表达系统表达了S1蛋白(106 ku),且是可溶性表达,可见低等的真核细胞——酵母菌株在表达长片段方面比原核系统更有优势。但目前的文献表明,尚无利用原核表达系统表达S1蛋白全长的报道,因此推测可能是因为S1在原核表达系统中难以实现全长表达。
针对犬冠状病毒病,市面上主要销售CCV灭活苗和弱毒疫苗,但鉴于灭活苗诱导宿主肠道黏膜产生免疫的效果不佳,弱毒疫苗又受限于母源抗体,故二者均不能对CCV的感染起到完全的保护预防作用。且目前的CCV疫苗对犬感染后排毒和阻断病毒传播的效果不佳。余春等利用毒蜂胶佐剂,通过静水压高压灭活制备CCV灭活苗使其免疫效果得到了优化。孙秋艳等利用水煮醇沉淀法分离提取浒苔多糖,并利用其增强了CCV灭活疫苗的免疫作用。
卵黄抗体(IgY)是一种免疫球蛋白,属于γ球蛋白,由重链(分子质量约67-70 ku)和轻链(分子质量约25 ku)组成,具有耐酸碱、在常温下更稳定、特异性强等优点。IgY技术在动物腹泻等疾病诊断、预防和治疗中有广泛应用,且IgY效价高、成本低,适宜于大规模生产应用。目前,国内尚无CCV卵黄抗体制备的文献报道,专利文献中也仅KR20140112766A报道了预防和治疗宠物犬病毒感染性疾病的复合蛋黄抗体组合物及其制备方法,其抗原是犬细小病毒( CPV),犬瘟热病毒(CDV),犬冠状病毒(CCV),犬传染性肝炎,狂犬病,制备得到的,通过将多种病毒抗原接种到产蛋鸡中,然后通过使用该抗体制备液体注射形式的抗体组合物来制备的。特异性小分子Fab片段(Fragment of antigen binding),是IgY的抗原结合片段,是抗体结构中与抗原结合的区域。Fab抗体片段分子质量小、组织穿透能力较高、结合力高,由于缺少 Fc 段,其免疫原性较低,可广泛用于诊断治疗及基础研究。目前,国内尚无CCV S1蛋白卵黄抗体及特异性小分子抗体Fab制备的文献报道。鉴于CCV疫苗效果不十分理想、无特效药可用,CCV的卵黄抗体及特异性小分子抗体Fab的应用前景广阔,将为CCV 新型治疗制剂的研发提供技术支持。
发明内容
为了解决现有技术的不足,丰富CCV的治疗手段,本发明旨在提供一种犬冠状病毒卵黄抗体及其制备方法,通过创造性地涉及,将S蛋白切分为两个可原核表达的片段,且经密码子优化使得其在原核表达系统中可以高效表达,免疫蛋鸡后制备得到卵黄抗体,而后经蛋白酶酶解制备得到犬冠状病毒S1蛋白特异性小分子抗体Fab,与CCV呈特异性的反应可以用于制备用于预防或治疗犬冠状病毒感染所导致的疾病的药物,为进一步开展CCV的诊断和防治技术研究奠定了基础。
为了解决以上技术问题,本发明采用如下技术方案。
一种犬冠状病毒S1蛋白特异性小分子抗体Fab的制备方法,其特征在于,所述犬冠状病毒S1蛋白特异性小分子抗体Fab是由卵黄抗体经酶解制备得到,所述卵黄抗体是以CCVS1-a蛋白和CCV S1-b蛋白为免疫原,免疫蛋鸡后制备得到的,其中编码CCV S1-a蛋白的核苷酸序列为SEQ ID NO.2,编码CCVS1-b蛋白的核苷酸序列为SEQ ID NO.3。
优选地,所述
优选地,所述免疫原的制备方法包括对重组菌株Rosetta (DE3)-pGEX4T-CCV
所述免疫原还包括佐剂,所述佐剂为ISA71AVG或ISA201VG。
优选地,所述蛋白酶为胃蛋白酶。
优选地,所述酶解的条件为卵黄抗体与胃蛋白酶混合质量比20:1、pH 4.1、37 ℃、酶切8 h。
所述犬冠状病毒卵黄抗体的制备方法还包括卵黄抗体的提取,利用聚乙二醇沉淀法提取卵黄抗体IgY,去除卵黄中的非水溶成份得到卵黄抗体。
本发明还请求保护基于以上方法制备得到的犬冠状病毒S1蛋白特异性小分子抗体Fab,所述犬冠状病毒S1蛋白特异性小分子抗体Fab与CCV呈特异性的反应。
本发明还请求保护基于以上方法制备得到的犬冠状病毒S1蛋白特异性小分子抗体Fab在制备用于预防或治疗犬冠状病毒感染所导致的疾病的药物中的应用。
基于以上技术方案,本发明具有如下优点和有益效果:
本发明通过将犬冠状病毒S1蛋白进行分段表达分别获得了两个蛋白片段,克服了犬冠状病毒S1蛋白不能原核表达的问题,同时,将以获得的两个蛋白片段作为免疫原,对蛋鸡进行免疫制备得到卵黄抗体,本发明进一步采用胃蛋白酶对卵黄抗体进行酶解,并对酶解的条件进行了优化,结果表明,最佳酶切条件为IgY与胃蛋白酶混合质量比20:1、pH 4.1、37 ℃、酶切8 h,在此条件下约每毫升卵黄可得到0.07-0.1 mg左右的Fab片段。通过对小分子Fab与病毒的反应活性的检测,阻断试验表明,小分子Fab与病毒共孵育后,可显著降低CCV的感染性,说明该Fab具有较好的中和活性,这为后续开发犬冠状病毒新型防治产品提供了高质量的原材料。
附图说明
图1. CCV S1基因全长和截短片段的PCR扩增产物:M:DL5 000 Marker;1:CCV S1基因PCR产物;2:CCV S1-a基因PCR产物;3:CCV S1-b基因PCR产物。
图2. 重组表达菌株BL21(DE3)-pGEX4T-CCV S1、Rosetta (DE3)-pGEX4T-CCV S1的质粒双酶切鉴定:A. 重组菌株BL21(DE3)-pGEX4T-CCV
图3. 重组表达菌株Rosetta (DE3)-pET28a-CCV
图4. 重组表达菌株Rosetta (DE3)-pGEX4T-CCV S1-a and Rosetta (DE3)-pGEX4T-CCV S1-b的SDS-PAGE检测:A. 重组菌株Rosetta (DE3)-pGEX4T-CCV S1-a的SDS-PAGE检测;B. 重组菌株Rosetta (DE3)-pGEX4T-CCV S1-b的SDS-PAGE检测。M:蛋白Marker;1:诱导表达的 pGEX4T-CCV S1-a沉淀;2:诱导表达的pGEX4T-CCV S1-a第一次超声破碎的上清;3:诱导表达的pGEX4T-CCV S1-a第二超声破碎的上清;4:未诱导表达的pGEX4T-CCVS1-a沉淀;5:未诱导表达的 pGEX4T-CCV S1-a上清;6:诱导表达的pGEX4T-1沉淀;7:诱导表达的 pGEX4T-1上清;8:未诱导表达的 pGEX4T-1沉淀;9:未诱导表达的 pGEX4T-1上清;10:诱导表达的 pGEX4T-CCV S1-b沉淀;11:未诱导表达的pGEX4T-CCV S1-b沉淀;12:诱导表达的pGEX4T-1沉淀;13:未诱导表达的pGEX4T-1沉淀;14:诱导表达的 pGEX4T-CCV S1-b第一次超声破碎的上清;15:诱导表达的 pGEX4T-CCV S1-b第二次超声破碎的上清;16:诱导表达的 pGEX4T-1上清;17:未诱导表达的 pGEX4T-1上清。
图5. 重组蛋白Rosetta (DE3)-pGEX4T-CCV S1-a 和Rosetta(DE3)-pGEX4T-CCVS1-b鉴定:
A. Rosetta (DE3)-pGEX4T-CCV S1-a 蛋白的Western Bolt鉴定;B. Rosetta(DE3)-pGEX4T-CCV S1-b蛋白的Western Bolt鉴定。M:蛋白Marker;1:诱导表达的 pGEX4T-CCV S1-a沉淀;2:诱导表达的pGEX4T-CCV S1-a第一次超声的上清;3:诱导表达的pGEX4T-CCV S1-a第二次超声的上清;4:未诱导表达的pGEX4T-CCV S1-a沉淀;5:未诱导表达的pGEX4T-CCV S1-a上清;6:诱导表达的pGEX4T-1沉淀;7:诱导表达的 pGEX4T-1上清;8:未诱导表达的 pGEX4T-1沉淀;9:未诱导表达的 pGEX4T-1上清;10:诱导表达的 pGEX4T-CCVS1-b沉淀;11:未诱导表达的pGEX4T-CCV S1-b沉淀;12:诱导表达的pGEX4T-1沉淀;13:未诱导表达的pGEX4T-1沉淀;14:诱导表达的 pGEX4T-CCV S1-b上清;15:未诱导表达的pGEX4T-CCV S1-b上清;16:诱导表达的 pGEX4T-1上清;17:未诱导表达的 pGEX4T-1上清。
图6. 重组表达菌株Rosetta (DE3)-pGEX4T-CCV
图7. CCV S1-ab蛋白卵黄抗体透析前后对比图:M:蛋白Marker;1,3,5:透析前卵黄抗体;2,4,6:透析后卵黄抗体。
图8. CCV S1-ab蛋白卵黄抗体免疫活性的Western blot鉴定:M:蛋白Marker;1-6依次为稀释4 000,8 000,16 000,32 000,64 000,128 000倍的血清。
图9. 卵黄抗体与CCV反应活性的IPMA鉴定:A:所制备的特异性的IgY与CCV反应;B:阴性IgY与CCV反应。
图10. 卵黄抗体与胃蛋白酶不同混合质量比和不同时间梯度酶切正交实验SDS-PAGE检测。A. 不同质量浓度胃蛋白酶溶液稀释成100μL体系SDS-PAGE检测;B-F. 依次为IgY与胃蛋白酶混合质量比为5:1、10:1、20:1、40:1、80:1酶切SDS-PAGE检测结果;M:蛋白Marker;1-5依次为6.4 mg·mL
图11.不同pH乙酸钠缓冲液溶解卵黄抗体检测结果. M:蛋白Marker;1-13依次为pH为2.0、2.5、3.0、3.5、3.8、4.1、4.4、4.7、5.0、5.5、6.0、6.5、7.0 乙酸钠缓冲液溶解的卵黄抗体液.
图12. 不同pH条件下的酶切产物SDS-PAGE检测结果(卵黄抗体与胃蛋白酶混合质量比20:1、24 h、37 ℃)。
图13. 不同酶切pH与不同酶切时间的正交实验SDS-PAGE检测。M:蛋白Marker;1-13依次为pH为2.0、2.5、3.0、3.5、3.8、4.1、4.4、4.7、5.0、5.5、6.0、6.5、7.0 下酶切产物。A.pH为2.0时不同酶切时间的产物SDS-PAGE检测结果;B-E. 依次为pH 2.5、3.0、3.5、3.8时不同酶切时间的产物SDS-PAGE检测结果;F-I. 依次为pH 4.1、4.4、4.7、 5.0时不同酶切时间的产物SDS-PAGE检测结果,M:蛋白Marker ;1-8依次为酶切5 min、10 min、20 min、0.5 h、1h、2 h、4 h、8 h酶切结果;9:pH 2.0的IgY原液;10:对应pH的IgY原液;11-18依次为酶切5min、10 min、20 min、0.5 h、1 h、2 h、4 h、8 h酶切结果;19:对应pH的IgY原液;20-27依次为酶切10 min、30 min、1 h、2 h、4 h、8 h、12 h、24 h酶切结果。
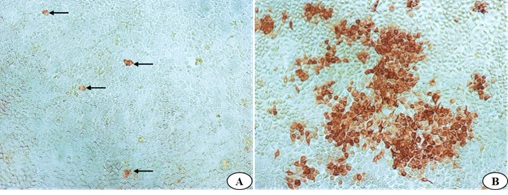
图14. 小分子抗体Fab对病毒感染性的阻断的活性IPMA鉴定。A.特异性小分子Fab孵育CCV感染CRFK细胞;B.阴性小分子Fab孵育CCV感染CRFK细胞。
具体实施方式
实施例1:抗原蛋白的制备
1.1 重组CCV
通过DNAStar7.0软件及http://genomes.urv.es/OPTIMIZER/网站对CCV(GenBank: JQ404409)的
1.2 CCV S1全长及截短片段基因的PCR扩增
将JM109-pMD19T-CCV S1菌液进行培养。次日,收集菌液,通过试剂盒进行质粒提取。将质粒稀释100倍作为模板进行PCR扩增,如表1为引物序列。配置反应液,进行PCR扩增,反应程序:94 ℃预变性2 min;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 2 min 30 s,35个循环;68℃ 10 min,4 ℃保存。
表1引物序列
注:CCV S1-a-F和CCV S1-a-R扩增的为
结果如图1所示,在3 000 bp、1 500 bp及1 000 bp左右各有一特异性条带,表明第1泳道扩增片段与引物设计预期全长CCV S1的PCR产物2 586 bp大小相符合,第2和3泳道扩增片段分别与该基因截短片段CCV S1-a的PCR产物1 470 bp和CCV S1-b的PCR产物1 110bp大小相符。
1.3 CCV
PCR扩增的
1.4 CCV
将纯化浓缩的目的基因
涂有BL21(DE3)-pET28a-CCV S1、Rosetta(DE3)-pET28a-CCV S1-b菌株的平板未生长出单菌落,其他菌株的平板均生长出单菌落,可进行后续实验。
如图2所示,在第2、8、10、12泳道约5 000 bp处有载体条带,3 000 bp处有基因条带,同CCV S1基因2 639 bp大小相当,而第14、16空载体对照组在此处无条带,表明重组菌株BL21(DE3)-pGEX4T-CCV S1的第2、8泳道和重组表达菌株Rosetta (DE3)-pGEX4T-CCV S1的第10、12泳道为阳性质粒,而剩余泳道为阴性质粒。
如图3在第4、6泳道约1 500 bp处有明显条带,同CCV S1-a基因1 470 bp大小相当,如图3在第9、10、11、12泳道约1 000 bp处有目的条带,与1 169 bp的 CCV S1-b基因大小相当,表明重组菌株Rosetta(DE3)-pET28a-CCV S1-a、Rosetta(DE3)-pGEX4T-CCV S1-a和Rosetta (DE3)- pGEX4T-CCV S1-b具有阳性质粒。
1.5 重组蛋白的诱导表达及SDS-PAGE和Western blot检测
取阳性重组表达菌株和相应空载体对照菌株各10 μL分别接种于2 mL含有卡那霉素或氨苄青霉素(终浓度为100 µg·mL
筛选得到的阳性单克隆菌株BL21(DE3)-pGEX4T-CCV S1、Rosetta(DE3)-pGEX4T-CCV S1和Rosetta(DE3)-pET28a-CCV S1-a经诱导后均未成功表达蛋白。
如图4-A结果显示在约79 ku处有目的蛋白,图4-B电泳显示约68 ku处有目的蛋白,初步判定重组表达菌株Rosetta (DE3)-pGEX4T-CCV S1-a和Rosetta (DE3)-pGEX4T-CCV S1-b成功表达目的蛋白。
如图5 Western Blot结果显示,用虚线框标识重组目的蛋白条带,图5A所示,70~95 ku之间,泳道1和泳道2有特异性的条带、其分别为目的蛋白S1-a的包涵体形式和可溶性形式(与预期分子量79ku相近),未诱导的重组菌对照(泳道4和泳道5)无对应的条带,空载体pGEX4T-1菌株诱导后在26ku处有GST标签蛋白的表达(泳道6和泳道7),未诱导的空载体pGEX4T-1菌株在26ku处也有少量GST标签蛋白的表达(泳道8和泳道9),说明该载体在未加IPTG的情况下载体有一定的背景表达。图5B所示,泳道10(重组表达菌)在约70 ku处(与预期分子量68 ku相近)有一特异性的条带、为诱导的S1-b的包涵体形式,且泳道14也有相应的一条特异性条带、为可溶性的形式,未诱导的重组菌包涵体(泳道12)及其上清(泳道15)在70ku左右均无特异性条带,空载体pGEX4T-1菌株诱导与未诱导所表达的标签蛋白GST与图A中的情况相似。这些结果表明,重组蛋白CCV S1-a和CCV S1-b均成功表达,且以包涵体和可溶性两种形式存在。
实施例2:IgY抗体的制备
2.1 CCV
对重组菌株CCV
表2佐剂配伍表
注:CCV
取160日龄左右的蛋鸡分为三组。第一组免疫用ISA71AVG佐剂为乳化剂制备的免疫原,第二组免疫鸡采用ISA201VG佐剂为乳化剂制备的免疫原,分两次免疫,间隔21天,1mL/羽,采用胸部肌肉注射。首次免疫当天和首次免疫后第21天、第35天采集血清样品,每日收集鸡蛋,同时设立第三组为不免疫鸡作为阴性对照。
2.2 IgY抗体的提取和免疫活性鉴定
利用聚乙二醇沉淀法(PEG沉淀法)提取IgY,去除卵黄中的非水溶成份(WIF)得到卵黄抗体。将1.2.5中得到的抗原蛋白经SDS-PAGE电泳分离后,转移到PVDF膜上,封闭,漂洗,稀释提取的IgY样品作为一抗孵育,漂洗,HRP-Goat Anti-Chicken IgG (H+L) (1:1 0000倍稀释)孵育,漂洗,用DAB显色试剂盒显色。IgY按初始浓度1:1 000稀释,然后在此基础上进行2倍比稀释直到1:128 000,反应结果为阳性的最大稀释度即为IgY抗体滴度。
采用免疫过氧化物酶单层细胞染色法(IPMA)检测IgY与病毒的反应活性,将CRFK细胞接种96孔细胞培养板,密度为90%时,更换为无血清DMEM按培养基接种CCV-HY17毒株,感染24 h后弃培养基,用33%丙酮-PBS固定30 min,真空干燥后加入IgY抗体(1:1 000稀释),设立阴性卵黄抗体作为对照组,37 ℃孵育1 h,PBS洗涤3次,加入HRP-Goat Anti-Chicken IgG (H+L) pAb(1:3 000稀释),37 ℃孵育1 h,PBS洗涤3次,每孔加入AEC显色液100 μL,37 ℃孵育30 min,弃去显色液加入去离子水终止反应,于倒置显微镜下观察、判定结果。
如图7所示,提取、透析后的卵黄抗体SDS-PAGE检测结果表明所提取的卵黄抗体在67-70 ku和25 ku处有明显的重链和轻链条带,所提取的卵黄抗体杂蛋白较少,纯度较高,透析后将小分子质量的杂蛋白以及残留的PEG去除,使其纯度达到更高水平。卵黄抗体质量浓度测定结果表明透析前最高质量浓度约3.8217 mg·mL
实施例3:小分子抗体Fab的制备及条件优化
利用胃蛋白酶水解卵黄抗体制备小分子抗体Fab片段,设计IgY与胃蛋白酶混合质量比为5:1、10:1、20:1、40:1、80:1五组梯度并结合10 min、0.5 h、1 h、2 h、4h、8 h、12 h、24 h八个水解时间梯度进行正交实验。随后,检测卵黄抗体溶解在不同pH乙酸钠溶液中的稳定性,并对酶切pH进行优化,设计2.0、2.5、3.0、3.5、3.8、4.1、4.4、4.7、5.0、5.5、6.0、6.5、7.0十三个pH梯度,酶切12 h进行预实验,通过结果挑选适宜的酶切pH,进一步结合不同酶切时间(pH 2.0-3.8采用5min、10min、20 min、0.5 h、1 h、2 h、4 h、8 h八个酶切时间梯度,pH 4.1-5.0采用10 min、0.5 h、1 h、2 h、4h、8 h、12 h、24 h八个酶切时间梯度)进行正交实验。在其他条件相同且适宜的条件下进行酶切,达到优化酶切条件的目的。
将不同质量浓度的胃蛋白酶液取样进行SDS-PAGE检测,结果表明胃蛋白酶含量较低时,在蛋白电泳胶上无任何条带,对于观察酶切产物SDS-PAGE结果无影响(图10-A)。
IgY与胃蛋白酶混合质量比和不同时间梯度酶切正交实验SDS-PAGE结果表明,IgY与胃蛋白酶混合质量比为5:1、10:1和80:1时,在约40 ku和26 ku处一直有条带,混合质量比为80:1时在约40 ku和26 ku处的条带清晰,混合质量比5:1时在2h后26 ku处条带被消化,混合质量比10:1时在4 h后26 ku处条带被消化,可知这三组实验酶切产物纯度不高(图10-B、10-C、10-F);IgY与胃蛋白酶混合质量比为20:1和40:1时,随时间增加40 ku处的条带逐渐被消化,且26 ku处的条带逐渐清晰,混合质量比为20:1在12 h和24 h时以及混合质量比为40:1在24 h时可得到纯度较高的产物(图10-D、10-E);检测得到混合质量比为20:1酶切12 h和24 h以及混合质量比为40:1酶切24 h产物的蛋白质量浓度分别为0.8718 mg·mL
如图11表明,卵黄抗体在不同pH的乙酸钠缓冲液中较为稳定,由此可以排除其对后续不同pH条件下酶切实验的影响。在不同pH条件下酶切卵黄抗体24 h结果表明,pH较低和较高酶切效果都不佳,在酶切pH为3.8-5.0时的酶切效果相对而言较好,鉴于pH 2.0-3.5可能是由于酶切速度较快,导致目的条带被消化,故本研究采用了pH为2.0~5.0之间的八个pH梯度与不同时间进行正交实验(图12)。
酶切pH与酶切时间正交实验结果表明,随着pH的增加酶切的速率呈现出越来越慢的趋势。pH 2.0、2.5时,结果显示无任何条带(图13-A、13-B);pH 3.0、3.5时,分别在第11-13和第11-17号泳道26 ku处出现较浅条带,但可推测此时目的蛋白受到了损失,酶切效果不佳(图13-C、13-D);pH 5.0时,结果显示26 ku上方存在明显杂带,产物纯度不够(图13-I);pH 3.8时,酶切4 h和8 h出现较纯的目的条带,经检测其质量浓度依次为0.2413 mg·mL
制备小分子抗体Fab最佳酶切条件为卵黄抗体与胃蛋白酶混合质量比20:1、pH4.1、37 ℃、酶切8 h。完整的IgY可以与CCV呈特异性反应,胃蛋白酶处理后所制备的分子抗体Fab可以有效阻断CCV的感染性。
实施例4:小分子抗体Fab对病毒的阻断的活性检测
利用抗体中和病毒的特性测定小分子抗体Fab的活性,先将CCV与小分子抗体Fab按照体积比1:1混合均匀,37 ℃孵育1 h,设立阴性Fab分子对照。将两种Fab分子与病毒孵育的混合液分别接种CRFK细胞(密度约90%、),37 ℃孵育4 h,弃上清,PBS缓冲液洗涤3次,加入无血清DMEM培养,37 ℃,5%CO
阻断试验表明,特异性小分子Fab孵育CCV感染的CRFK细胞阳性细胞数量(图14A)显著少于阴性小分子Fab孵育CCV感染的CRFK细胞的阳性细胞数量(图14B),说明通过胃蛋白酶将IgY分子的Fc段消化后制备的Fab段,具有较好的中和活性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 乙肝病毒前S1蛋白特异性抗体的制备方法及其应用
- 一种应用于检测犬冠状病毒抗体的重组M蛋白及其制备方法与应用
