一种来源于氨氧化假诺卡氏单胞菌的R-转氨酶及其合成方法
文献发布时间:2023-06-19 10:19:37
技术领域
本发明涉及生物催化领域,主要涉及一种来源于氨氧化假诺卡氏单胞菌Psendonocardia ammonioxydans的R-转氨酶的制备方法及其在生产手性胺和非天然氨基酸方面的应用。
背景技术
非天然氨基酸和手性胺是许多精细化学品和药物合成中的关键中间体或关键手性模块,例如:西他列汀、紫杉醇、顺铂、草铵膦;此外,含有非天然氨基酸的多肽比天然肽更稳定,并且在蛋白酶存在的情况下仍然保持其生物学活性,因此在高度稳定且不会被人体排斥的新药、抗体和人工蛋白质的研发中,非天然氨基酸将发挥不可替代的作用。但是,非天然氨基酸与天然氨基酸不同的是,现有手性胺和非天然氨基酸均采用有机合成,存在高压高温以及高能耗的缺陷,且有机合成难以获得光学纯的产物,并且不能通过发酵工业化生产,和现在绿色可持续发展理念相悖。
转氨酶属于转移酶类,通常用于催化氨基,由氨基供体化合物转移至氨基受体化合物,转氨酶普遍存在于动物、植物组织和微生物中。转氨酶根据其底物氨基的位置,可以分为α-转氨酶和ω-转氨酶:α-转氨酶较为常见,只能催化α-氨基酸的转移,ω-转氨酶比较罕见,除了能催化α氨基的转移,也能催化非α位氨基的转移,具有更为宽广的底物谱和严格的立体选择性,能够在温和条件下拆分胺消旋体,或者催化前手性底物羰基上的不对称加氨来生产手性胺以及非天然氨基酸。转氨酶还参与许多的代谢途径,包括维生素合成,碳氮吸收,次生代谢等,转氨酶是属于辅酶5’-磷酸吡哆醛(PLP)依赖型酶,即IV型转氨酶,其催化反应时可逆的,在催化过程中PLP与5’-磷酸吡多胺(PMP)相互转换。总之,用R-转氨酶来生产光学纯的手性胺和非天然氨基酸,可以避免传统化学工艺中的高温压、高能耗、高污染的问题,因此本发明公开一种来源于氨氧化假诺卡氏单胞菌的R-转氨酶及其在生产手性胺和非天然氨基酸的应用,该R-转氨酶命名为PamAT,是一种具有(R)立体选择性的IV型转氨酶,本发明获得的特定立体选择性的酶,是区别于化学催化剂的关键,符合绿色生产理念,利于后续研究改造和工业应用的推广。
发明内容
本发明公开了一种来源于氨氧化假诺卡氏单胞菌Psendonocardiaammonioxydans的R-转氨酶及其催化生产手性胺和非天然氨基酸中的应用。
为了实现上述目的,本发明提供了一种来源于氨氧化假诺卡氏单胞菌Psendonocardia ammonioxydans的R-转氨酶,命名该酶为PamAT,或其修饰物、功能等同物、功能片段或变体,其特征在于,所述R-R-转氨酶的氨基酸序列包含选自如下序列之一的序列:(1)如SEQ NO.2所示的氨基酸序列;(2)所示的氨基酸序列具有至少90%同一性且具有高度立体选择性R构型催化活性的转氨酶活性的氨基酸序列;(3)在SEQ NO.2中所示的氨基酸序列经过取代、缺失或添加一个或多个氨基酸而由SEQ NO.2衍生而来且具有高度立体选择性-R构型催化活性的转氨酶活性的蛋白质;其中,高度立体选择性是指其中一个立体异构体的含量是另一个的至少1.1倍。
进一步的,核苷酸的序列包含选自如下序列之一:(1)如SEQ NO.1所示的核苷酸序列;(2)与SEQ NO.1所示的核苷酸序列具有至少90%同一性且编码具有高度立体选择性R构型催化活性的转氨酶的核苷酸序列;(3)在高严谨条件下与SEQ NO.1所示的核苷酸序列杂交且编码具有高度立体选择性R构型催化活性的转氨酶的核苷酸序列;其中,高度立体选择性是指其中一个立体异构体的含量是另一个的至少1.1倍。
本发明提供了一种重组载体,重组载体中有效连接有上述任意一种核苷酸。
进一步的,重组载体为pET28b-PamAT。
本发明提供了一种宿主细胞,该宿主细胞转化或转染有上述任意一种的重组载体。
本发明提供了一种来源于氨氧化假诺卡氏单胞菌Psendonocardiaammonioxydans的R-转氨酶的合成方法,该方法包括如下步骤:使酮类化合物、R-转氨酶或其修饰物、功能等同物、功能片段或变体,磷酸吡哆醛和氨基供体在反应体系中反应,由此获得R-手性胺。
进一步的,上述酮类化合物为
进一步的,上述反应体系中还含有促溶剂,所述促溶剂为二甲基亚砜。
进一步的,上述C1~C8烷基C1~C8直链烷基,所述氨基供体为异丙胺或D-丙氨酸。
与现有技术相比,本发明具有的有益效果如下:
本发明通过利用具有高度立体选择性的R-转氨酶或其修饰物、功能等同物、功能片段或变体,可以高效地合成手性纯度较高的R构型的手性胺,适合用于手性胺的工业化生产;R-转氨酶是比S-转氨酶更稀有的一类ω-转氨酶,在手性胺和非天然氨基酸的生物制造中具有特殊意义;本发明公布的新R-转氨酶HFO具有严格的(R)立体选择性,并且具有宽广的底物谱,在手性胺和非天然氨基酸的绿色生产中显示出工业应用前景,本发明通过PCR技术在氨氧化假诺卡氏菌中扩增得到新R-转氨酶的基因,并且通过NCBI BlAST碱基序列比对证明该R-转氨酶基因碱基序列确实属于氨氧化假诺卡氏菌属的R-转氨酶基因序列,通过基因工程技术得到表达R-转氨酶蛋白的E.coli DE3-pET-28b-PamAT重组菌株,诱导表达得到R-转氨酶PamAT,制备方法简单,容易操作,PamAT能够耐受40%的DMSO,仍有90%以上的活力,具有较好的活性,同时本发明基于高度立体选择性的PamAT,同时以酮类化合物、氨基化合物和磷酸吡哆醛为原料制备获得手性胺或者非天然氨基酸,反应条件温和,符合绿色化学的理念,为研究改造和工业应用提供重要基础,利于工业规模化推广,大大提高了经济价值和社会价值。
附图说明
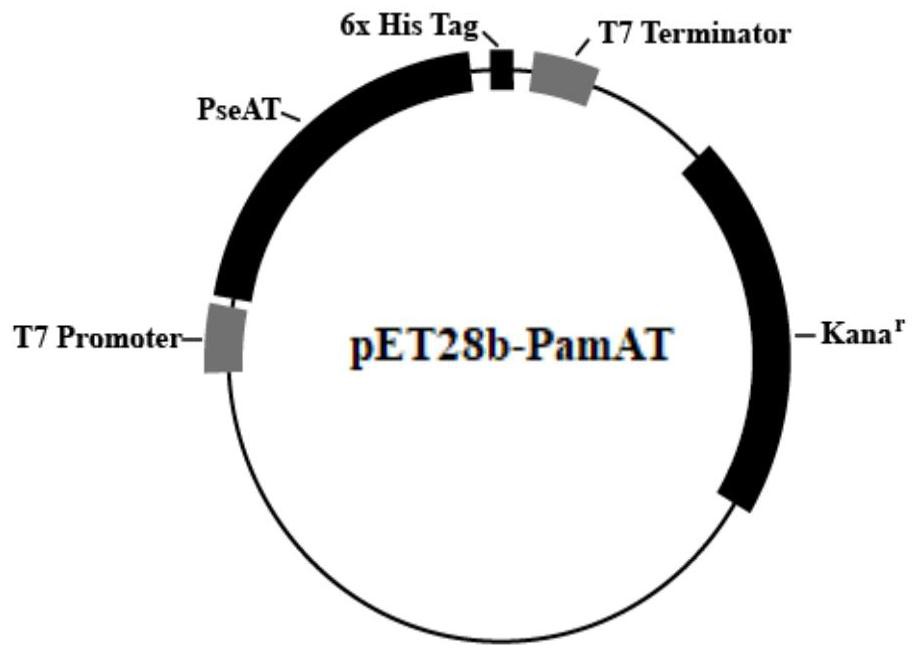
图1为本发明R-转氨酶构建的质粒图谱。
图2为本发明R-转氨酶的目的基因的扩增结果。
图3为本发明R-转氨酶的重组表达的蛋白纯化结果。
图4为本发明R-转氨酶的酶学性质表征。
图5为本发明R-转氨酶催化产物的HPLC分析结果。
图6为本发明R-转氨酶催化产物的质谱结果。
图7为本发明R-转氨酶催化产物的手性分析。
具体实施方式
下面将结合实施例以及参考图进一步说明本发明的部分内容,以便于本领域的技术人员进一步理解本发明,但不应理解为对本发明的限制。基于本发明中的实施例,在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
为了满足制备手性胺化合物的需求,如图1-7所示,本发明开发了一种来源于氨氧化假诺卡氏单胞菌Psendonocardia ammonioxydans的具有高度R构型立体选择性的R-转氨酶的制备方法,该转氨酶命名为PamAT,上述转氨酶是本发明采用分子生物学技术获得的,在不改变氨基酸序列的前提下,对来源于氨氧化假诺卡氏单胞菌的转氨酶基因的核苷酸序列进行优化改造后获得的,所述PamAT基因核苷酸序列SEQ NO.1所示,氨基酸序列如SEQNO.2所示。
实施例一:制备R-转氨酶:
(1)来源于氨氧化假诺卡氏单胞菌的R-转氨酶PamAT载体的构建:
本发明R-转氨酶PamAT基因序列来源于GeneBank数据库wp-093355841.1,在不改变氨基酸序列的前提下,首先将氨氧化假诺卡氏单胞菌来源的转氨酶基因密码子进行优化,利用限制性内切酶Nco I和Hind III连接(生工生物工程(上海)有限公司)至pET-28b载体中,质粒图谱如图1所示,R-转氨酶核酸序列如SEQ NO.1所示,氨基酸序列如SEQ NO.2所示,将pET-28b载体转化到大肠杆菌DH5α菌株的感受态细胞中,经摇床复苏后涂布于含kana终浓度为50μg/ml的LB培养皿中,37℃培养箱培养过夜。挑取上述培养皿上的单菌落接种于含kana终浓度为50μg/ml的LB液体培养基中,37℃,220r/min振荡培养过夜,提取质粒,经PCR鉴定,上游引物为AAAATGGGCAGCAGCCATATGACCCTGGCGGAC,下游引物为TGCGGCCGCAAGCTTACGATCAACGTC,鉴定结果见图2,PCR扩增产物的大小与预计的1038bp接近,说明PamAT载体构建成功。
图2显示的是R-转氨酶目的基因的PCR扩增的凝胶电泳图,其中,条带1和条带2是扩增的R-转氨酶目的基因,条带3是DNA Marker。根据目的片段理论上大小为1108bp,可判断所扩增的产物大小符合预期。
(2)R-转氨酶蛋白PamAT的表达和纯化:
将上述步骤(1)中得到的重组质粒pET-28b-PamAT采用热激的方法转化至大肠杆菌表达菌株BL21(DE3)的感受态菌体中。接种BL21(DE3)-pET28b-PamAT于100ml LB培养基中,37℃过夜培养获取大量菌株。将获得的表达菌株按照1%接种量接种至含kana终浓度为50μg/ml的LB液体培养基中扩大培养,37℃,220r/min,至OD
图3显示的是重组表达R-转氨酶的Ni亲和层析的SDS-PAGE图,图中所示条带从左往右依次是R-转氨酶PamAT(DE3)诱导前菌液、诱导后发酵液、破碎上清、破碎沉淀、流穿液、20mmol/L咪唑的蛋白洗脱液、200mmol/L咪唑的蛋白洗脱液、400mmol/L咪唑的蛋白洗脱液以及洗脱结束后的基质样品。
(3)R-转氨酶PamAT的酶学性质表征:
酶活定义:R-转氨酶在一定的温度和条件下,每分钟催化生成1μmol产物所消耗的酶量定义为1U。
转氨反应液的配制:配制50mmol/L的苯乙胺和50mmol/L的丙酮酸反应液,PLP终浓度2mmol/L,反应液的pH 7.5;反应产物的衍生:硼酸衍生液pH 9.0:0.05mol/L硼砂溶液与0.2mol/L硼酸溶液按照体积比4:1混合得到衍生缓冲溶液;磷酸平衡缓冲液pH 7.0:称取1.7g磷酸二氢钾,300ml超纯水溶解,移取0.1mol/L氢氧化钠溶液72.75ml;混匀,加水定容得至500ml;1%DNFB使用乙腈定容;衍生步骤:氨基酸标准品或者样品取5ml,pH9.0硼酸衍生缓冲液5ml,1%DNFB衍生液5ml,混匀密封,避光,60℃水浴反应60min,待降至室温之后用pH7.0磷酸平衡缓冲液定容50ml,静置15min,过滤取续滤液。
R-转氨酶PamAT最适pH值检测:以50mmol/L苯乙胺、50mmol/L丙酮酸、2mmol/LPLP、去离子水为原料配制9组转氨反应液,用KOH将反应液的pH调至6、6.5、7、7.5、8、8.5、9、9.5、10,分别取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下反应5h,将反应后的混合物按照上述(3)中的方法来测定产物D-丙氨酸的生成量,计算不同pH条件下的相对活性,结果如附图4所示,结果表明,R-转氨酶PamAT最适pH为7.5。
R-转氨酶PamAT最适温度测定:以50mmol/L苯乙胺、50mmol/L丙酮酸、2mmol/LPLP、去离子水为原料;配制pH7.5转氨反应液,取490μl的转氨反应液,加入10μl的PamAT酶液,在4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、60℃等不同温度条件下,反应5h,将反应后的混合物按照上述(4)中方法来测定产物D-丙氨酸的生成量,计算不同温度条件下的相对活性,结果如附图4所示,转氨酶PamAT最适反应温度为30-35℃。
R-转氨酶动力学曲线的绘制:固定供体苯乙胺的含量50mmol/L,2mmol/L PLP,受体丙酮酸浓度设置10mM、20mM、40mM、80mM、120mM、160mM、200mM、240mM,用KOH调节pH至7.5,固定受体丙酮酸的含量50mmol/L,2mmol/L PLP,供体异丙胺盐酸盐浓度设置10mM、20mM、40mM、80mM、120mM、160mM、200mM、240mM,用KOH调节pH至7.5,各取取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(4)中的方法来测定产物D-丙氨酸的生成量,计算不同底物浓度条件下的相对活性,利用GraphPad中Michaeli-Menten算法自动拟合动力学曲线。
R-转氨酶有机溶剂耐受性检测:以50mmol/L苯乙胺、50mmol/L丙酮酸、2mmol/LPLP、去离子水为原料配制转氨反应液,分别加入DMSO、甲醇和乙腈,每种有机溶剂浓度梯度为20%、40%,并KOH调节pH值为7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(4)中的方法来测定产物D-丙氨酸的生成量,计算有机溶剂含量下的相对活性,结果如附图4所示,转氨酶PamAT能够耐受40%的DMSO,但是甲醇和乙腈对PamAT酶活抑制强烈。
R-转氨酶金属离子耐受性的检测:以50mmol/L苯乙胺、50mmol/L丙酮酸、2mmol/LPLP、去离子水为原料配制转氨反应液,分别添加Na
(4)R-转氨酶PamAT氨基供体底物谱鉴定
反应简式:
反应条件:反应体系1ml,加入50mmol/L氨基供体、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h。
活力的计算:将反应后的混合物按照上述(3)方法来测定产物D-丙氨酸的生成量来计算各底物的相对活力。
实施例二:PamAT催化供体D-丝氨酸与受体丙酮酸生成D-丙氨酸和3-羟基丙酮酸:
以50mmol/L D-丝氨酸、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)方法来测定产物D-丙氨酸的生成量。
实施例三:PamAT催化供体D-丙氨酸与受体3-羟基丙酮酸生成D-丝氨酸:
以50mmol/L D-丙氨酸、50mmol/L3-羟基丙酮酸、2mmol/L PLP、去离子水为原料配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中方法来测定产物D-丝氨酸的生成量。
实施例四:PamAT催化供体异丙胺与受体丙酮酸生成D-丙氨酸和副产物丙酮:
以50mmol/L异丙胺、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中方法来测定产物D-丙氨酸的生成量。
实施例五:PamAT催化供体R-苯乙胺与受体丙酮酸生成苯乙酮和异丙胺:
以50mmol/LR-苯乙酮、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,由于苯乙酮在245nm条件下有强烈的吸收峰,所以将反应后的混合物利用酶标仪在245nm波长下进行检测,根据测定的OD
实施例六:PamAT催化供体仲丁胺与受体丙酮酸生成D-丙氨酸和副产物丁酮:
以50mmol/L仲丁胺、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中的方法测定产物D-丙氨酸的生成量。
实施例七:PamAT催化供体2-戊胺与受体丙酮酸生成D-丙氨酸和副产物2-戊酮:
以50mmol/L 2-戊胺、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中方法测定产物D-丙氨酸的生成量。
(5)R-转氨酶PamAT氨基受体底物谱鉴定
反应简式:
反应条件:反应体系1ml,加入50mmol/L氨基受体、50mmol/L R-苯乙胺、2mmol/LPLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h。
活力的计算:将反应后的混合物按照下述方法测定产物的生成量来计算各底物的相对活力。
实施例八:PamAT催化供体R-苯乙胺与受体2-戊酮生成2-戊胺和副产物苯乙酮:
以50mmol/L R-苯乙胺、50mmol/L 2-戊酮、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,由于苯乙酮在245nm条件下有强烈的吸收峰,所以将反应后的混合物利用酶标仪在245nm波长下进行检测,根据测定的OD
实施例九:PamAT催化供体R-苯乙胺与受体丙酮酸生成D-丙氨酸和副产物苯乙酮:
以50mmol/L R-苯乙胺、50mmol/L丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中方法来测定产物D-丙氨酸的生成量。
实施例十:PamAT催化供体R-苯乙胺与受体3-羟基丙酮酸生成D-丙氨酸和副产物苯乙酮:
以50mmol/L R-苯乙胺、50mmol/L3-羟基丙酮酸、2mmol/L PLP、去离子水为原料,配制转氨反应液,pH调至7.5,取490μl的转氨反应液,加入10μl的PamAT酶液,在30℃条件下,反应5h,将反应后的混合物按照上述(3)中方法来测定产物D-丙氨酸的生成量。
为了确定R-转氨酶的催化产物是D-丙氨酸,将反应混合物分别进行HPLC、质谱以及手性色谱的检测。理论产物丙氨酸的检测需要柱前衍生化,再进行HPLC分析,同时也制备丙氨酸标准品的衍生物作为阳性对照。结果如图5所示,(a)图中箭头所指的是丙氨酸标准品衍生物的峰,(b)图中箭头所指的是衍生后的反应产物的峰,其保留时间与丙氨酸标准品衍生物的保留时间一致,推测PamAT的反应产物可能有丙氨酸。
但是,为了能直接确定所生成的产物为丙氨酸,需要准确测出其相对分子质量。因此需要对衍生后产物进行提纯后,送第三方进行质谱检测,结果如图6所示,衍生后的丙氨酸分子质量是255.1,与图中检测到的分子质量254.1相符。另外质谱分析测定分子质量为509.2的化合物,其实是衍生后丙氨酸的二聚体。因此,可以确定转氨酶PamAT能够催化丙氨酸的生成,但是质谱无法分析手性。
为了确定生成的产物丙氨酸是D型还是L型,需要对其进行手性柱色谱分析。经过转氨反应生成的产物进行衍生后提纯,同时对L-丙氨酸标准品、D-丙氨酸标准品进行衍生后提纯,将三个处理完毕的样品交于第三方进行手性柱检测。检测结果如图7所示,(a)图箭头所指的是L-丙氨酸标准品衍生物的峰,其对应的保留时间为9.677min;(b)图箭头所指的是D-丙氨酸标准品衍生物的峰,其对应的保留时间为13.016min;(c)图两个箭头所指的都是衍生后反应产物的峰,其中左边箭头所指峰的对应的保留时间9.723min,表示该成分为L-丙氨酸衍生物,右边箭头所指峰的对应的保留时间为13.092min,表示该成分为D-丙氨酸衍生物,经计算,反应产物中D-丙氨酸的ee值为78%。转氨酶PamAT能够以苯乙胺作为氨基供体、丙酮酸作为氨基受体,催化生成D-丙氨酸,因此,转氨酶PamAT是R-选择性转氨酶(R-ATA)。
本发明能够以D-氨基酸以及R-胺为氨基供体,采用对手性羰基化合物加氨的不对称合成法,生成手性胺和非天然氨基酸,R-转氨酶PamAT对其有催化活力的D-氨基酸或者R-胺:其中,催化活性较好的有D-丙氨酸、D-丝氨酸、异丙胺、R-苯乙胺、2-氨基戊烷、3-氨基戊胺、丙酮酸,3-羟基丙酮酸,丙酮等。
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本发明公开的新型转氨酶催化了氨基供体中的氨基转移给前手性酮或醛类,从而产生相应R构型的手性胺,利用本发明的新型转氨酶进行合成胺的制备,不仅可以对更多的底物进行转化,而得到R构型手性胺的纯度高,稳定在98%以上。所述合成方法采用的原料易得,方法简单,化学反应条件温和,收率和对映体的纯度均很高,整个生产过程中,操作简单,是可行的、污染较低的合成工艺,为制备手性胺提供了一种新的途径和方法。
具体PamAT活性测定参见以下表1-表2:
表1转氨酶PamAT对氨基供体的活性测定
表2转氨酶PamAT对受体酮类的活性测定
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
序列表
<110> 江苏海洋大学
<120> 一种来源于氨氧化假诺卡氏单胞菌的R-转氨酶及其合成方法
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1038
<212> DNA
<213> Psendonocardia ammonioxydans
<400> 1
atgaccctcg ccgattccgg aaccgacttc tcgaccagca acctcgtcgc ggtcgagccc 60
ggggcgatcc gtgaggacac gccgcccggc tccgtgatcc agtacagcga ctacgagctc 120
gacacctcca gcccctacgc cggaggcgcg gcgtggatcg aaggcgagta cgtcccggcg 180
tcggaggccc ggatctccat cttcgacacc ggcttcggcc actccgacct gacctacacc 240
gtcgcccacg tctggcacgg caacatcttc cggctggccg accacatcga acgcctcctc 300
gacggagccc ggaagctgcg gctcgcctcg ccgtacgacg agaccgagat cgccgagatc 360
gcgaaacgct gtgtcggtct gtcccaattg cgcgaggcct atgtgaacat cacgctcacc 420
cgcggctacg gcaagcggaa gggcgagaag gatctgagca agctcacctc gcagatctac 480
gtctacgcga tcccgtacct gtgggcgttc cctccgtacg aacagatctt cgggacctcc 540
gcggtcgtac cccgccacgt gcaacgcgcc gggcgcaaca ccatcgatcc gacgatcaag 600
aactatcagt ggggggacct gaccgccgcg agcttcgagg ccaaggaccg cggtgcccgc 660
accggcatcc tgctggacgc cgacggatgt gttgccgagg gaccagggtt caacgtcgtc 720
gtggtcaagg acggcgcgct ggcgtccccg tcccggaacg cgctacccgg gatcacccgc 780
aagaccgtct tcgagatcgc ccacgcgcga gggatctcgg ccgagttgcg cgacgtcacg 840
agccgggagc tctacgacgc cgacgagttg atggccgtca cgacggcggg cggagtcacc 900
ccgatcacct cgctcgacgg cgccgctgtc ggcgacggcg agccgggccc gatcacggtg 960
gcgatccggg accggttctg ggcgctcatg gacgagccgt cggacttgat cgacacgatc 1020
aggtacgacg tggatcgc 1038
<210> 2
<211> 346
<212> PRT
<213> Psendonocardia ammonioxydans
<400> 2
Met Thr Leu Ala Asp Ser Gly Thr Asp Phe Ser Thr Ser Asn Leu Val
1 5 10 15
Ala Val Glu Pro Gly Ala Ile Arg Glu Asp Thr Pro Pro Gly Ser Val
20 25 30
Ile Gln Tyr Ser Asp Tyr Glu Leu Asp Thr Ser Ser Pro Tyr Ala Gly
35 40 45
Gly Ala Ala Trp Ile Glu Gly Glu Tyr Val Pro Ala Ser Glu Ala Arg
50 55 60
Ile Ser Ile Phe Asp Thr Gly Phe Gly His Ser Asp Leu Thr Tyr Thr
65 70 75 80
Val Ala His Val Trp His Gly Asn Ile Phe Arg Leu Ala Asp His Ile
85 90 95
Glu Arg Leu Leu Asp Gly Ala Arg Lys Leu Arg Leu Ala Ser Pro Tyr
100 105 110
Asp Glu Thr Glu Ile Ala Glu Ile Ala Lys Arg Cys Val Gly Leu Ser
115 120 125
Gln Leu Arg Glu Ala Tyr Val Asn Ile Thr Leu Thr Arg Gly Tyr Gly
130 135 140
Lys Arg Lys Gly Glu Lys Asp Leu Ser Lys Leu Thr Ser Gln Ile Tyr
145 150 155 160
Val Tyr Ala Ile Pro Tyr Leu Trp Ala Phe Pro Pro Tyr Glu Gln Ile
165 170 175
Phe Gly Thr Ser Ala Val Val Pro Arg His Val Gln Arg Ala Gly Arg
180 185 190
Asn Thr Ile Asp Pro Thr Ile Lys Asn Tyr Gln Trp Gly Asp Leu Thr
195 200 205
Ala Ala Ser Phe Glu Ala Lys Asp Arg Gly Ala Arg Thr Gly Ile Leu
210 215 220
Leu Asp Ala Asp Gly Cys Val Ala Glu Gly Pro Gly Phe Asn Val Val
225 230 235 240
Val Val Lys Asp Gly Ala Leu Ala Ser Pro Ser Arg Asn Ala Leu Pro
245 250 255
Gly Ile Thr Arg Lys Thr Val Phe Glu Ile Ala His Ala Arg Gly Ile
260 265 270
Ser Ala Glu Leu Arg Asp Val Thr Ser Arg Glu Leu Tyr Asp Ala Asp
275 280 285
Glu Leu Met Ala Val Thr Thr Ala Gly Gly Val Thr Pro Ile Thr Ser
290 295 300
Leu Asp Gly Ala Ala Val Gly Asp Gly Glu Pro Gly Pro Ile Thr Val
305 310 315 320
Ala Ile Arg Asp Arg Phe Trp Ala Leu Met Asp Glu Pro Ser Asp Leu
325 330 335
Ile Asp Thr Ile Arg Tyr Asp Val Asp Arg
340 345
- 一种来源于氨氧化假诺卡氏单胞菌的R-转氨酶及其合成方法
- 一种假诺卡氏菌及其应用
