重楼皂苷Ⅰ在检测溶酶体中的应用
文献发布时间:2023-06-19 11:50:46
技术领域
本发明属于生物检测领域,特别涉及重楼皂苷Ⅰ在检测溶酶体中的应用。
背景技术
溶酶体(lysosomes)是单层膜包被的囊状结构,直径约0.025~0.8微米,内含多种水解酶,是生物细胞内具有一定形态结构和重要生理功能的细胞器,专为分解各种外源和内源的大分子物质。自1955年比利时学者Cristian de Duve等人在鼠肝细胞中发现溶酶体以来,人们对溶酶体的研究涉及方方面面,并发现溶酶体与许多疾病如代谢性疾病、炎症、肿瘤和免疫等的发生有着密切的关系。因此,开发能够准确标记并可视化溶酶体的探针具有重要的意义。
Cy3染料是一种氨基反应染料,分子量668.86可用于免疫细胞化学应用、标记核酸等。Cy3荧光染料用532nm波段激发,发出明亮的橙红色光,因肉眼无法区分,一般描述为红色光。
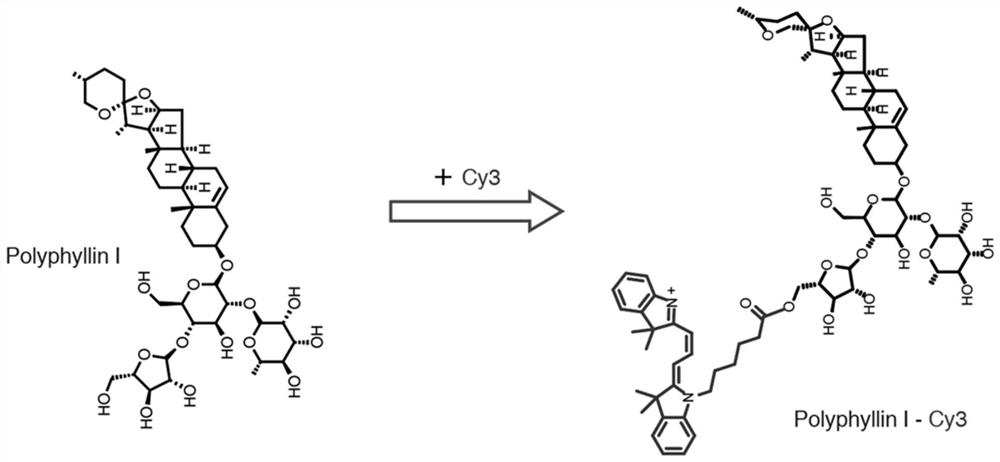
重楼皂苷Ⅰ(Polyphyllin I,PD)是一种小分子单体,分子量855.02,提取自百合科植物云南重楼Paris yunnanensis Franch的根茎,其结构式如式(I)所示:
早先有报道重楼皂苷Ⅰ具有潜在抗肿瘤活性,但是到目前为止,尚未有重楼皂苷Ⅰ能够靶向溶酶体的报道。
发明内容
本发明的首要目的在于克服现有技术的缺点与不足,提供重楼皂苷Ⅰ在检测溶酶体中的应用。
本发明的另一目的在于提供重楼皂苷Ⅰ在制备检测溶酶体的荧光探针中的应用。
本发明的又一目的在于提供一种靶向溶酶体的红色荧光探针。
本发明的再一目的在于提供所述的靶向溶酶体的红色荧光探针在检测溶酶体中的应用。
本发明的目的通过下述技术方案实现:
重楼皂苷Ⅰ在检测溶酶体中的应用。
所述的重楼皂苷Ⅰ结构式如式(I)所示:
所述的溶酶体为活细胞中的溶酶体;优选为体外活细胞中的溶酶体。
所述的细胞优选为肝癌细胞;更优选为HepG2细胞。
重楼皂苷Ⅰ在制备检测溶酶体的荧光探针中的应用。
所述的重楼皂苷Ⅰ具有特异性靶向溶酶体的作用,为了方便观察(如利用流式细胞仪、共聚焦显微镜、或荧光酶标仪等设备),可以进一步将重楼皂苷Ⅰ与荧光染料合成具有荧光特性的探针。
所述的荧光染料为红色荧光染料;优选为Cy3荧光染料;更优选为Cy3-COOH。
一种靶向溶酶体的红色荧光探针,名称为Polyphyllin I-CY3,其结构式如式(II)所示:
所述的靶向溶酶体的红色荧光探针的合成方法,包括如下步骤:
将重楼皂苷Ⅰ溶于二甲基甲酰胺(DMF)中,加入Cy3-COOH、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和4-二甲氨基吡啶(DMAP),在50±5℃下搅拌反应,待反应结束后减压旋蒸去除溶剂,洗涤、重结晶、干燥,得到所述靶向溶酶体的红色荧光探针(Polyphyllin I-Cy3)。
所述的重楼皂苷Ⅰ、Cy3-COOH、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和4-二甲氨基吡啶(DMAP)的摩尔比为1:1.2:1.2:0.1。
所述的二甲基甲酰胺的用量为按每毫克(mg)重楼皂苷Ⅰ配比0.1~0.2mL二甲基甲酰胺计算。
所述的搅拌反应的时间为5~8h;优选为6h。
所述的减压旋蒸去除溶剂的条件为:温度40℃、转速120r/min。
所述的洗涤为采用丙酮进行洗涤;优选为采用丙酮洗涤3次以上。
所述的重结晶为采用乙醇进行重结晶。
所述的干燥为真空干燥。
所述的靶向溶酶体的红色荧光探针在检测溶酶体中的应用。
所述的应用为非疾病诊断治疗目的。
所述的溶酶体为活细胞中的溶酶体;优选为体外活细胞中的溶酶体。
所述的细胞优选为肝癌细胞;更优选为HepG2细胞。
所述的红色荧光探针的安全浓度范围为1000nmol/L以下;优选为10~1000nmol/L;进一步优选为10~100nmol/L;更优选为50nmol/L。
所述的靶向溶酶体的红色荧光探针在制备溶酶体特异性荧光探针中的应用。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明合成Polyphyllin I-CY3红色荧光探针是一种新的溶酶体的特异性荧光标记探针,能通透细胞膜,可以用于活细胞溶酶体特异性荧光染色。
(2)本发明合成的Polyphyllin I-Cy3探针,能够高度选择靶向溶酶体和在纳摩尔浓度有效标记活细胞。
(3)本发明合成的Polyphyllin I-Cy3探针具有靶向性好、检测速度快、重复性好、使用方便、无细胞毒性等优点,在低浓度下实现对溶酶体荧光标记,可通过流式,共聚焦等检测。
附图说明
图1是Polyphyllin I-Cy3的合成路线图。
图2是Polyphyllin I与Cy3反应0h时的HPLC峰图。
图3是Polyphyllin I与Cy3反应6h时的HPLC峰图(图中:12分35秒左右出现的峰即为Polyphyllin I-Cy3产物峰)。
图4是Polyphyllin I-CY3的激发光谱和发射光谱图。
图5是Polyphyllin I-CY3在细胞中与溶酶体共定位效果图(溶酶体染色采用商业化溶酶体探针Lyso-Tracker Green,溶酶体呈现绿色荧光;PolyphyllinI-CY3染色HepG2细胞的溶酶体,呈现红色荧光)。
图6是Polyphyllin I-Cy3在细胞中与线粒体及自噬体无共定位效果图(商业化Mito-Tracker Green染色HepG2细胞的溶酶体,呈现绿色荧光;自噬体使用LC3-GFP绿色荧光蛋白来标记,呈现绿色荧光;Polyphyllin I-Cy3染色细胞的溶酶体,呈现红色荧光)。
图7是Polyphyllin I-Cy3处理细胞活性检测结果图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
实施例1Polyphyllin I-Cy3的合成
1.1实验步骤
Polyphyllin I-Cy3的合成步骤:称取5mg重楼皂苷Ⅰ(Polyphyllin I)溶于0.5mL二甲基甲酰胺(DMF,上海泰坦科技股份有限公司)中,加入3.45mgCy3-COOH(瑞禧生物)、1.34mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,毕得医药)和71.47μg4-二甲氨基吡啶(DMAP,阿达玛斯试剂有限公司)溶解完全(重楼皂苷Ⅰ:Cy3-COOH:EDC:DMAP=1:1.2:1.2:0.1(摩尔比)。于50℃下搅拌反应6h,通过旋转蒸发仪(号型YRE2000E,巩义市予华仪器责任有限公司)在40℃、120r/min条件下减压旋蒸除去溶剂,然后用丙酮洗涤3次,乙醇重结晶,真空干燥得到产物。利用高效液相色谱法(HPLC,杭州新乔生物科技有限公司)验证合成产物。其中,HPLC检测方法如下:
所用仪器为液质谱联用仪Agilent 1100HPLC&1946D MS,色谱柱为Waters XTerraMS C18(3.0×100mm,3.5μm);
液相条件:流动相为乙腈-水(含10mM乙酸铵),以70:30(体积比)等度洗脱,流速0.5mL/min,柱温25℃,进样体积10μL;
质谱条件:ESI离子源,正离子模式,干燥气温度350℃,干燥气流速10L/min,雾化气压力40psi。
1.2结果与结论
由于Polyphyllin I本身不带荧光,不方便利用流式细胞仪、共聚焦显微镜、或者荧光酶标仪等设备检测,因此,我们首先引入CY3红色荧光,合成Polyphyllin I-Cy3红色荧光探针(图1),具体合成步骤见上述实验步骤。得到合成产物后,采用HPLC技术检测合成效果,对比反应起始0h的HPLC峰(图2),经过6h反应HPLC峰图在中12分35秒左右出现Polyphyllin I-Cy3产物峰(图3),证明Polyphyllin I-Cy3合成成功。Polyphyllin I-Cy3,分子量1505.86,激发光谱和发射光谱见图4,可以使用532nm的激光谱线,发射波长为577nm。
实施例2Polyphyllin I-Cy3靶向溶酶体
2.1实验步骤:
2.1.1细胞培养
肝癌HepG2细胞购于美国模式培养物集存库(ATCC)。在37℃、5%CO
2.1.2质粒构建与转染
指示自噬体的LC3-GFP绿色荧光蛋白,由pEGFP-LC3b质粒(购自淼灵生物)转染肝癌HepG2细胞表达获得。具体转染步骤如下:将HepG2细胞以50%的密度接种到培养皿(中皿)中,培养12h;将pEGFP-LC3b质粒(0.5μg)与阳离子转染试剂Lipo3000(2μL,Invitrogen公司)、P3000(2μL,Invitrogen公司)加入到200μL Opti-MEM培养基中(Invitrogen公司)混匀,静置20min;将HepG2细胞的培养基换成Opti-MEM培养基,并加入上述混合好的Opti-MEM培养基,置于培养箱中培养6h;换新鲜的含有10%(v/v)胎牛血清、1%(w/v)青霉素/链霉素的DMEM培养基培养48h,将转染后的细胞消化下来,以50%的密度接种到共聚焦培养皿中用于后续实验观察。
2.1.3探针染色
①Polyphyllin I-Cy3染色:将Polyphyllin I-Cy3加入到含有10%(v/v)胎牛血清、1%(w/v)青霉素/链霉素的DMEM培养基中,配制成50nM工作液,于37℃预温育。将2.1.2转染获得的细胞(用于观察Polyphyllin I-Cy3和线粒体共定位情况)和HepG2细胞(用于观察Polyphyllin I-Cy3和溶酶体和自噬体共定位情况)去除细胞培养液,加入上述配制好的并37℃预温育的PolyphyllinI-Cy3染色工作液,与细胞37℃共孵育5~20分钟(本实验共孵育15min)。
②Lyso-Tracker Green(购自碧云天)染色:将Lyso-Tracker Green按照1:13333~1:20000的比例加入到含有10%(v/v)胎牛血清、1%(w/v)青霉素/链霉素的DMEM培养基中,使最终浓度为50~75nM。混匀后在37℃预温育。将HepG2细胞去除细胞培养液,加入上述配制好的并37℃预温育的Lyso-Tracker Green染色工作液,与细胞37℃共孵育5~60分钟(本实验共孵育15min)。
③Mito-Tracker Green(购自碧云天)染色:取少量1mM Mito-Tracker Green储存液按照1:5000~1:50000的比例加入到含有10%(v/v)胎牛血清、1%(w/v)青霉素/链霉素的DMEM培养基中,使最终浓度为20~200nM,混匀后即为Mito-TrackerGreen工作液,使用前需37℃预温育。将2.1.2转染获得的细胞去除细胞培养液,加入37℃预温育的Mito-TrackerGreen染色工作液,与细胞37℃共孵育15~45分钟(本实验共孵育15min)。
2.1.4激光共聚焦观察
去除上述染色工作液,加入新鲜的细胞培养液,随后通过激光共聚焦显微镜(蔡司公司)进行观察。
2.1.5 WST-1检测细胞活性
作为一种MTT的类似物,当WST-1与电子耦合试剂混合时,可以被线粒体中的某些脱氢酶还原,生成橙黄色的formazan化合物。一般地细胞增殖得越多越快那么检测试剂颜色也越深。具体操作如下:将状态良好的HepG2细胞用胰酶消化下来,收集计数,按照每孔3000个细胞的量铺到96孔板中,置于培养箱中培养过夜;向贴壁的细胞中加入PolyphyllinI-Cy3使其终浓度分别为0、10、100、1000nM,分别培养24和48h;首先按照说明书配置WST-1溶液(碧云天),将WST-1溶液和培养基的比例为1:10,即10μL的WST-1溶液和100μL的培养基配置成WST-1混合溶液;细胞经过Polyphyllin I-Cy3处理后,先去掉原先的培养基,每孔加入100μL配好的WST-1混合溶液。在同一块板的空白孔中还需添加一个加了相应量的WST-1混合溶液但没有细胞的空白对照;37℃培养箱放置2h,用酶标仪检测450nm下的吸光度值,最后对数据进行分析。
2.2实验结果与结论:
Polyphyllin I-Cy3能够特异性靶向溶酶体,具有优异的选择性,可用于活细胞内溶酶体的标记和示踪。成像前用Polyphyllin I-Cy3探针孵育细胞,探针具体使用浓度和孵育时间可根据自身实验条件和具体细胞种类来进行摸索以达到满意的染色效果。Polyphyllin I-Cy3在活细胞HepG2中染色效果如图5和图6所示。在终浓度为50nM,作用时间15min的条件下,通过共聚焦实验观察到,Polyphyllin I-Cy3与商业化Lyso-TrackerGreen探针(碧云天)所标记的溶酶体,存在很好共定位现象(图5)。此外,我们通过共聚焦也可以观察到PolyphyllinI-Cy3与其他细胞器,例如线粒体和自噬体,并不存在共定位现象(图6)。以上结果表明,本发明所合成的Polyphyllin I-Cy3探针的确能够特异性靶向溶酶体。
为了评价Polyphyllin I-Cy3探针的安全性,我们通过WST-1(碧云天)实验,评价不同浓度的Polyphyllin I-Cy3对HepG2细胞活性的影响。如图7所示,1000nM PolyphyllinI-Cy3处理细胞48h,对细胞活性没有明显影响。以上结果证明,本探针推荐使用的浓度50nM为安全浓度,对细胞生长无明显影响。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 重楼皂苷Ⅰ在检测溶酶体中的应用
- 重楼皂苷在作为溶酶体靶向抑制剂的应用
