一种化合物、药物组合物、药物及其在制备抗菌产品中的应用
文献发布时间:2023-06-19 11:54:11
技术领域
本发明属于抗菌活性化合物技术领域,具体涉及一种9-芳烷基-10-甲基吖啶季铵盐类衍生物、包含所述9-芳烷基-10-甲基吖啶季铵盐类衍生物的药物组合物、药物及其在制备抗菌产品中的应用。
背景技术
所述背景技术部分的信息不必然被视为承认或以任何形式暗示该信息构成现有技术。
抗菌药的发现是药物发现史上的里程碑,临床上使用的抗生素多具有高效和广谱的特点,能够有效地治疗由多种常见的革兰氏阳性菌及阴性菌感染引起的各类疾病。但是,由抗生素的泛用及滥用引起的耐药菌感染也严重威胁了全球的公共健康,特别是耐甲氧西林金黄色葡萄球菌、多药耐药和广泛耐药的大肠杆菌菌株、克雷伯氏菌及铜绿假单胞菌等。这使得细菌产生耐药性的时间大大缩短,传统的发现新抗生素的途径,已经跟不上细菌耐药性产生的速度,细菌对现有药物的抵抗以及新药的匮乏甚至导致了超级细菌的产生。除了对现有传统抗生素进行结构修饰以外,寻求新型抗菌靶点开发新的化学实体以解决日益严峻的细菌耐药问题也引起了越来越多研究者的关注。
细丝温度敏感蛋白Z(FtsZ),是一种具有GTP酶活性的重要的细胞分裂蛋白,在细胞分裂过程中,GTP结合到FtsZ单体上时,FtsZ单体头尾相连形成FtsZ原丝,许多的FtsZ原丝通过横向的相互作用形成原丝束并最终在细胞中央形成一个高度动态的Z环。Z环结构作为用于组装多蛋白复合物的细胞生存所必需的支架,Z环形成后招募并协调一系列的辅助蛋白形成分裂体,招募完成后,Z环收缩,隔膜关闭,完成细胞分裂。干预FtsZ的正常生物学功能将导致细菌细胞异常分裂,持续的增长使它们不断变大,并且对其环境物理性质的变化更敏感,细胞最终会裂解死亡。由于FtsZ分布的广泛性和高保守性及尚未作为抗菌药物靶点被充分地开发的特点,并且FtsZ与人类细胞微管蛋白序列差异明显,因此可以设计作用于FtsZ靶点而不干扰宿主细胞的新型抗菌药物。
目前已报道的多种FtsZ抑制剂显示出了优良的抗菌活性,生物碱类化合物血根碱对革兰氏阴性菌及革兰氏阳性菌均有中等程度的抑制作用,抗菌活性广谱,但是其对真核细胞中的微管蛋白也有轻微的抑制作用。由于微管蛋白在保持细胞形状、运动、胞内物质运输等方面都发挥着不可或缺的作用,上述化合物在发挥抑菌作用的同时可能会对机体造成严重的不良影响。因此,进一步筛选和开发抑菌活性高并且副作用较小化合物具有重要的意义。
发明内容
小檗碱是一种与血根碱结构相似的生物碱,能够抑制GTP酶的活性并减少FtsZ聚合,但抗菌活性较弱。本发明通过结构简化,截取小檗碱中的有效片段,设计FtsZ抗菌抑制剂,以期望获得分子量小、活性高并且抑菌特异性良好的活性化合物。基于上述技术目的,本发明提供以下技术方案:
本发明第一方面,提供一种化合物,所述化合物选自式(Ia)所示化合物或其药学上可接受的盐或酯或溶剂化物、互变异构体、内消旋体、外消旋体、立体异构体、代谢产物或前药;所述式(Ia)如下:
其中,R为苯环上的取代基,所述取代基的数量可以为一个或多个,每个取代基各自独立的选自氢、C
优选的,式Ia所示化合物中,当连接键L处不具有基团时,表示吖啶结构中,N对位的C与苯环通过“C-C”键连接,即所述化合物结构如下式I所示:
其中,R
具体的实施方式中,式I所示化合物的具体结构如下:
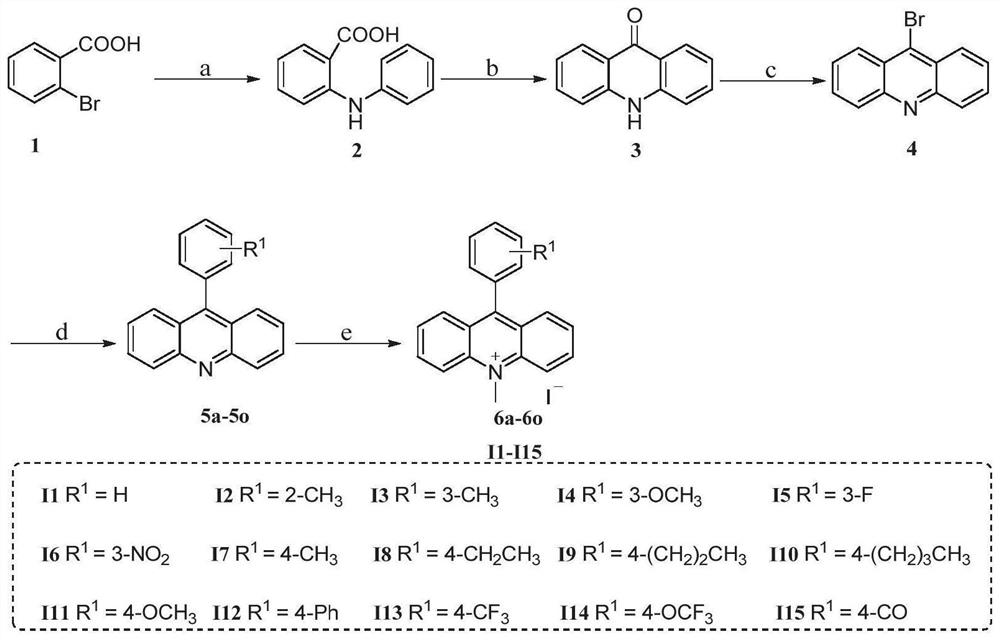
另外,本发明还提供一种式I化合物的合成路线,具体如下式所示:
优选的,上述合成路线中,所述步骤a操作方式如下:将化合物1加入碱性醇溶液中,在铜离子的催化作用下反应得到所述中间体2。进一步的,其中,所述碱性醇溶液优选采用乙醇,并加入无机碱进行制备;所述催化作用通过加入催化剂实现,所述催化剂可以为铜粉或氯化亚铜或醋酸铜或硫酸铜中一种或其组合;所述催化反应的温度为70~80℃,反应时间为12~24小时。
优选的,所述步骤b操作方式如下:将中间体2溶于浓硫酸中,在隔绝氧气的条件下加热反应得到中间体3。进一步的,所述加热温度为80~100℃,反应时间为4~8小时。
优选的,所述步骤c操作方式如下:中间体3与三溴化磷加热反应生成中间体4,所述加热温度为110~125℃,反应时间为18~24小时。
优选的,所述步骤d操作方式如下:所述中间体4溶于二氧六环-水或甲苯-水混合溶剂,在零价钯催化剂及碱性环境中进行加热反应,得到中间体5a-5o。进一步的,所述加热温度为85~120℃,所述反应时间为4~8小时。
优选的,所述步骤e操作方式如下:将中间体5a-5o溶于极性非质子性溶剂中,加入过量含碘试剂,反应一段时间后得到式I的化合物。进一步的,所述反应温度优选42~80℃,反应时间为15~24小时。具体的,所述含碘试剂为碘甲烷。
优选的,式Ia所示化合物中,当连接键L为“C=C”键时,即所述化合物结构如下式II所示:
其中,R
具体的实施方式中,式II所示化合物的具体结构如下:
本发明还提供式II所示化合物的一种合成方式,所述合成方式路线如下:
优选的,上述式II所示化合物的合成路线中,步骤a的操作方式如下:将化合物7溶于冰醋酸中,在氯化锌催化的条件下加热反应生成中间体8。进一步的,所述加热温度为180~220℃,反应时间为4~8小时。
优选的,式II所示化合物的合成路线中,步骤b的操作方式如下:中间体8溶于四氯化碳或者氯仿中,在偶氮二异丁腈引发的条件下,加入N-溴代琥珀酰亚胺反应生成中间体9。进一步的,所述反应温度为60~80℃,所述反应时间为4~8小时。
优选的,式II所示化合物的合成路线中,步骤c的操作方式如下:将中间体9溶于亚磷酸三乙酯中,加热反应生成中间体10。进一步的,所述加热反应时间为120~150℃,反应时间为2~6小时。
优选的,所述式II所示化合物的合成路线中,步骤d的操作方式如下:将中间体9溶于四氢呋喃中,在无机碱存在的条件下,加入醛类反应生成中间体11a-11m。进一步的,所述反应加热温度为25~40℃,反应时间为8~12小时。
优选的,所述式II所示化合物的合成路线中,步骤e的操作方式如下:将11a-11m溶于极性非质子性溶剂中,加入过量碘甲烷,于42~80℃反应15~24小时,生成通式II的化合物。
优选的,式Ia所示化合物中,当连接键L为炔基时,即所述化合物结构如下式I所示:
其中,R
另外,本发明还提供一种式III所示化合物的合成路线,如下式所示:
优选的,所述式III所示化合物的合成路线中,步骤a的操作方式如下:将上述中间体4溶于有机碱,在钯催化剂和铜催化剂存在的条件下加热反应得到生成中间体13a-13j。进一步的,所述反应温度为80~90℃,反应时间为8~12小时。
优选的,所述式III所示化合物的合成路线中,步骤b的操作方式如下:将中间体13a-13j溶于极性非质子性溶剂中,加入过量碘甲烷,于42~80℃反应15~24小时,生成通式III的化合物。
上述制备方法的方案中,所述中间体、反应产物均可通过常规的柱层析、重结晶等分离手段即可得到各步反应的纯品产物。
另外,第一方面所述技术方案中,所述化合物药学上可接受的盐,根据本领域通常的理解,表示所述化合物与无机盐如盐酸、硫酸、硝酸或氢溴酸形成的盐,以及与有机酸,例如甲磺酸、甲苯磺酸或三氟乙酸形成的盐。
本发明第二方面,提供一种药物组合物,所述药物组合包括第一方面所述化合物及药学上所必需的载体。
本发明所述的“药物组合物”,或称“组合物”,其可用于在受试者特别是哺乳动物中实现治疗或预防本发明所述疾病。所述药物组合物中,第一方面所述化合物作为活性成分,其应当是增效有效剂量的,所述药物剂量属于本领域技术可通过常规技术手段进行确定的技术内容。
另外,所述药物组合物的活性成分中,除第一方面所述化合物之外,还可能包括其他具有抗菌或辅助抗菌作用的成分。
如本文所述的,术语“药学可接受的”或者与其可互换使用的“可药用的”,例如在描述“药学可接受的盐”时,表示该盐其不但是受试者生理学上可接受,而且还可指在药学上有使用价值的合成物质,例如在为进行手性拆分时所形成的作为中间体的盐,虽然这种中间体的盐并不能直接给予受试者,但该盐可在为获得本发明终产物中起作用。
本发明化合物的药物组合物,可以通过以下任意方式施与:口服、喷雾吸入、直肠给药、鼻腔给药、阴道给药、局部给药、非肠道给药如皮下、静脉、肌内、腹膜内、鞘内、心室内、胸骨内或颅内注射或输入,或借助一种外植的储器用药,其中优选口服、肌注、腹膜内或静脉内用药方式。具体的,所述药物组合物的剂型可以是液体剂型、固体剂型。液体剂型可以是真溶液类、胶体类、微粒剂型、乳剂剂型、混悬剂型。其他剂型例如片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、栓剂、冻干粉针剂、包合物、填埋剂、贴剂、擦剂等。
本发明的药物组合物中还可以含有常用的载体,这里所述可药用载体包括但不局限于:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白如人血清蛋白,缓冲物质如磷酸盐,甘油,山梨酯,山梨酸钾,饱和植物脂肪酸的部分甘油酯混合物,水,盐或电解质,如硫酸鱼精蛋白,磷酸氢二钠,磷酸氢钾,氯化钠,锌盐,胶态氧化硅,三硅酸镁,聚乙烯吡咯烷酮,纤维素物质,聚乙二醇,羧甲基纤维素钠,聚丙烯酸酯,蜂蜡,羊毛酯等。载体在药物组合物中的含量可以是1重量%-98重量%,通常大约占到80重量%。为方便起见,局部麻醉剂,防腐剂,缓冲剂等可直接溶于载体中。
本发明第三方面,提供一种药物,所述药物包括第一方面所述化合物和/或第二方面所述药物组合物。
本发明第四方面,提供第一方面所述化合物、第二方面所述药物组合物和/或第三方面所述药物在制备抗菌产品中的应用。
优选的,所述抗菌产品为包括但不限于药物、洗护用品、医疗器械、厨具、食品防腐剂或餐饮器具中的一种或其他。其中,所述洗护用品的实例如果蔬清洗剂、洗发露、香皂、沐浴露、洗衣液、洗手液、洁厕灵或洗面奶。
所述抗菌产品用于预防、缓解及治疗细菌引发的疾病,所述细菌优选为革兰氏阳性菌;更确切的,本发明提供的化合物、药物组合物及药物对枯草芽孢杆菌、短小芽孢杆菌、金黄色葡萄球菌及耐药金黄色葡萄球菌具有更好的抑制效果,属于广谱抗菌活性成分。其中,金黄色葡萄球菌是常见的食源性致病菌,广泛存在于自然环境中,在适当的条件下,能够产生肠毒素,引起食物中毒。本发明所述化合物被证实在体外能够对金黄色葡萄球菌及耐药型金黄色葡萄球菌具有抑制作用,可应用于抑制金黄色葡萄球菌或耐药型金黄色葡萄球菌抗菌产品的开发,如抗菌药物、果蔬清洗剂、洗手液、餐具及厨具清洗剂等。具体的上述产品中,所述化合物I1、I2、I3、I4、I5、I6、I7、I8、I9、I10、I11、I12、I13、I14被证实对金黄色葡萄球菌具有更好的抑制作用,更加适用于抑制金黄色葡萄球菌产品的开发;而所述化合物II1、II2、II3、II4、II5、II6、II7、II8、II9、II10、II11、II12、II13、III1、III2、III3、III4、III5、III6、III7、III8、III9及III10被证实对金黄色葡萄球菌及耐药型金黄色葡萄球菌均具有良好的抑制作用,特别是化合物II4、II5、II6、II7、II11、II12、II13、III1、III4、III5,上述化合物体外抑制效果显著,最小抑菌浓度可低至0.25-2μg/mL,超过现有抗菌药物的效果。具体的,所述耐药型金黄色葡萄球菌包括耐甲氧西林金黄色葡萄球菌、耐青霉素金黄色葡萄球菌。
本发明第五方面,提供一种抑制革兰氏阳性菌的方法,所述方法为向有需要的个体施用第一方面所述化合物、第二方面所述药物组合物和/或第三方面所述药物。
本发明第六方面,提供一种预防和/或治疗可通过抑制病原菌中FtsZ蛋白来预防和/或治疗疾病的方法,其包括向有需要的个体施用第一方面所述的化合物、第二方面所述药物组合物和/或第三方面所述药物。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为本发明中通式I的化合物的合成路线;
图2为本发明中通式II的化合物的合成路线;
图3为本发明中通式III的化合物的合成路线;
图4为本发明实施例10中化合物II6(通式II)的时间杀菌曲线考察结果;
图5为本发明实施例11中化合物II6(通式II)对FtsZ蛋白聚合活性的考察结果。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,现有研究表明FtsZ抑制剂优良的抗菌活性,现有生物碱类化合物显示出了对细菌的抑制作用,但同时伴有一定的副作用。本发明基于现有生物碱活性成分,从天然化合物中筛选抑菌有效片段,提供了一系列9-芳烷基-10-甲基吖啶季铵盐类衍生物及其在制备抗菌产品中的应用。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1:2-(苯氨基)苯甲酸(2)的制备
称取原料2-溴苯甲酸(2.0g,10mmol)、苯胺(1.85g,20mmol)、碳酸钾(1.37g,10mmol)和催化量的铜粉(0.2-0.3微米,4.97mmol)溶于80mL的乙醇中。反应液在回流状态下加热12h,通过TLC监测反应完全后,将冷却后的反应液倒入热水中,通过硅藻土热过滤除去不溶物,然后用稀释的盐酸溶液将滤液酸化调pH至5–6,析出大量沉淀,所得沉淀产物经乙醇重结晶纯化,得到纯灰色固体产物1.65g,即中间体2,收率78%。
实施例2:9(10H)-吖啶酮(3)的制备
上述实施例1中制备的中间体2-(苯氨基)苯甲酸(2.0g,9.4mmol)加入100mL的圆底烧瓶中,向其中加入10mL浓硫酸。将混合物在100℃氮气保护下搅拌6小时,通过TLC监测反应完全后,冷却至室温,后将冷却后的反应液倒入大量冰水中搅拌、析出固体后经减压抽滤收集,用饱和的碳酸氢钠溶液洗涤固体若干次,真空干燥,得到黄色固体产物1.5g,即中间体3,收率82%。
实施例3:9-溴吖啶(4)的制备
称取上述实施例2中制备的中间体9(10H)-吖啶酮(4.0g,20.5mmol)置于250mL圆底烧瓶中。于冰浴0℃氮气保护的条件下,注射滴加三溴化磷(19.5mL,205mmol)。滴加完毕后反应液移至110℃,并在此温度下搅拌24小时。通过TLC监测反应完全后,将反应液冷却至室温,后缓慢加至水中淬灭反应。然后用氢氧化钠溶液将滤液调pH至14,转入分液漏斗中,用二氯甲烷萃取三次,合并的有机相用盐水洗涤两次,经无水硫酸钠干燥,抽滤,减压下浓缩以获得黄色固体产物3.81g,即中间体4,收率72%。
实施例4:9-苯基吖啶(5a)的制备
称取上述实施例3中制备的中间体9-溴吖啶(150mg,0.58mmol)、苯硼酸(0.11g,0.87mmol)、碳酸钾(0.24g,17.4mmol)溶于二氧六环和水(5:1)中的溶液中。在氮气保护的条件下加入催化量的四三苯基膦钯(0.005mmol),并将反应液加热至100℃。通过TLC监测反应完全后,用二氯甲烷萃取三次,合并的有机相用盐水洗涤两次,经无水硫酸钠干燥,抽滤,减压下浓缩得粗品。再经硅胶柱层析(石油醚/乙酸乙酯=8:1)分离得到白色固体0.13g,即中间体5a,收率89%。
实施例5:10-甲基-9-苯基吖啶碘盐(I1)的制备
将上述实施例4中制备的中间体9-苯基吖啶(100mg,0.39mmol)溶解在密封管内,加入过量的碘甲烷(0.25mL,3.9mmol)。将混合物在85℃下加热24小时,通过TLC监测反应完全后,加入异丙醚(50mL)以分离出暗红色固体。粗产物经硅胶柱层析(二氯甲烷/甲醇=10:1)纯化,得到相应的通式I目标产物80mg,即I1,收率76%。
化合物I2-I15依上述方法制备。
通式I的目标产物,即I1-I15的相关表征信息如表1中所示。
表1
实施例6:9-甲基吖啶(8)的制备
称取原料N,N-二苯胺(3.0g,17.7mmol)、氯化锌(12.0g,88.6mmol),将冰醋酸(3.2g,53.2mmol)加入其中。升温至180℃时,通过蒸馏从反应混合物中去除多余的冰醋酸,然后继续升温,在220℃下继续加热5小时。通过TLC监测反应完全后,将反应液降至室温,后加入氨水溶液,通过过滤获得黄色沉淀物。随后将固体溶解在二氯甲烷中,用碳酸氢钠水溶液和饱和食盐水洗涤,后经无水硫酸钠干燥,过滤,减压浓缩得粗品。再经硅胶柱层析(石油醚/乙酸乙酯=5:1)分离得到淡黄色固体2.77g,即中间体8,收率81%。
实施例7:9-(溴甲基)吖啶(9)的制备
称取上述实施例6中制备的中间体9-甲基吖啶(2.0g,10.4mmol),向其中加入100mL四氯化碳作溶剂,升温至60℃。后向溶液中加入偶氮二异丁腈(0.17g,1.0mmol)做引发剂,在此温度下搅拌30min。然后加入N-溴代琥珀酰亚胺(0.17g,11.4mmol),并升温至回流状态,继续加热4h。通过TLC监测反应完全后,加入二氯甲烷稀释。分离有机相,后经无水硫酸钠干燥,过滤,减压浓缩得粗品。再经硅胶柱层析(石油醚/乙酸乙酯=5:1)分离得到中间体9 2.45g,收率87%。
实施例8:(吖啶-9-甲基)膦酸二乙酯(10)的制备
称取上述实施例7中制备的中间体9-(溴甲基)吖啶(1.0g,3.7mmol),溶于4mL亚磷酸三乙酯中,将反应液加热至回流状态,反应4h。通过TLC监测反应完全后,将反应液冷却至室温,减压浓缩除去多余的亚磷酸三乙酯,得到油状物1.1g,即中间体10,收率92%。
实施例9:(E)-9-苯乙烯基吖啶(11a)的制备
称取上述实施例8中制备的中间体(吖啶-9-甲基)膦酸二乙酯(0.15g,0.45mmol)和苯甲醛(0.05g,0.45mmol)溶于干燥四氢呋喃(25mL)中的,于冰浴0℃的条件下小心地加入钠氢(65%,33.5mg,0.9mmol)并搅拌15min,后将反应液移至室温并搅拌过夜。通过TLC监测反应完全后,用水淬灭后,所得混合物用乙酸乙酯萃取3次,用饱和食盐水洗涤合并的有机相,经无水硫酸钠干燥,抽滤,减压下浓缩得粗品。再经硅胶柱层析(二氯甲烷/甲醇=60:1)分离得到固体85m g,即中间体11a,收率67%。
实施例10:(E)-10-甲基-9-苯乙烯基吖啶碘盐(II1)的制备
将上述实施例9中制备的中间体(E)-9-苯乙烯基吖啶(85mg,0.3mmol)溶解在密封管内,加入过量的碘甲烷(0.43g,3.0mmol)。将混合物在85℃下加热24小时,通过TLC监测反应完全后,加入异丙醚(50mL)以分离出棕色固体。粗产物经硅胶柱层析(二氯甲烷/甲醇=10:1)纯化,得到相应的通式II目标产物66mg,即II1,收率74%。
化合物II2-II13依上述方法制备。
通式II的目标产物,即II1-II13的相关表征信息如表2中所示。
表2
实施例11:9-(苯乙炔基)吖啶(13a)的制备
将上述实施例3中制备的中间体9-溴吖啶(0.15g,0.58mmol)加至100mL圆底烧瓶中,后添加催化量的双三苯基磷二氯化钯(8.1mg,0.01mmol)和溴化亚铜(3.3mg,0.02mmol)。加入10mL三乙胺作为溶剂,在氮气保护下室温搅拌10min。后加入苯乙炔(65mg,0.64mmol),升温至85℃回流反应24h。通过TLC监测反应完全后,将溶液冷却至室温,通过硅藻土过滤,滤液减压下浓缩得粗品。再经硅胶柱层析(石油醚/乙酸乙酯=3:1)分离得到黄色固体0.12g,即中间体13a,收率76%。
实施例12:10-甲基-9-(苯乙炔基)吖啶碘盐(III1)的制备
将上述实施例11中制备的中间体9-(苯乙炔基)吖啶(0.1g,0.36mmol)溶解在密封管内,加入过量的碘甲烷(0.51g,3.6mmol)。将混合物在85℃下加热24小时,通过TLC监测反应完全后,加入异丙醚(50mL)以分离出棕色固体。粗产物经硅胶柱层析(二氯甲烷/甲醇=10:1)纯化,得到相应的通式III目标产物71.6mg,即III1,收率68%。
化合物III2-III10依上述方法制备。
通式III的目标产物,即III1-III10的相关表征信息如表3中所示。
表3
实施例13:9-芳烷基-10-甲基吖啶季铵盐类衍生物的抗菌活性测定
本实施例中,选取化合物I1-I15、II1-II13和III1-III10对革兰氏阳性菌的抑制活性进行检测。所述革兰氏阳性菌包括枯草芽孢杆菌(B.subtilis ATCC9372)、短小芽孢杆菌(B.pumilus CMCC63202)、金黄色葡萄球菌(S.aureus ATCC25923)、耐甲氧西林金黄色葡萄球菌(S.aureus ATCC43300)、耐青霉素金黄色葡萄球菌(S.aureus PR和S.aureus CI)。除S.aureus CI由齐鲁医院提供,其他菌株购自南京便诊生物科技有限公司。本实施例中,以最低抑菌浓度(MIC)表征本发明化合物的抗菌作用强度。
采用连续微孔二倍稀释法确定本申请各个9-芳烷基-10-甲基吖啶季铵盐类衍生物(即本发明的化合物I1-I15、II1-II13和III1-III10)及血根碱(San)、小檗碱(Ber)、利奈唑胺(Lin)、环丙沙星(Cip)的MIC,根据MIC的结果,筛选出具有较强抗菌作用的化合物。对照品血根碱、小檗碱、利奈唑胺、环丙沙星购自安耐吉化学。
表4.本申请化合物体外抗菌活性考察结果
由上述实验结果可知,本发明的9-芳烷基-10-甲基吖啶季铵盐类衍生物对革兰氏阳性菌包括枯草芽孢杆菌比如B.subtilis ATCC9372、短小芽孢杆菌比如B.pumilusCMCC63202、金黄色葡萄球菌比如S.aureus ATCC25923、耐甲氧西林金黄色葡萄球菌比如S.aureus ATCC43300、耐青霉素金黄色葡萄球菌比如S.aureus PR和S.aureus CI均具有良好的抗菌活性,尤其本发明的化合物I9、I10、I12、II1、II2、II3、II4、II7、II9、II11、II12、II13、III4、III5,特别尤其化合物II6对上述革兰氏阳性菌的抑菌活性显著优于血根碱、小檗碱、环丙沙星和利奈唑胺,化合物I10、I12、II1、II3、II4、II7、II9、II11、II12、II13、III4、III5对金黄色葡萄球菌、耐药金黄色葡萄球菌包括耐甲氧西林金黄色葡萄球菌S.aureus ATCC43300、耐青霉素金黄色葡萄球菌S.aureus PR和S.aureus CI的抑菌活性显著优于血根碱、小檗碱、环丙沙星和利奈唑胺。
实施例14:9-芳烷基-10-甲基吖啶季铵盐类衍生物的时间-杀菌曲线测定
本实施例对9-芳烷基-10-甲基吖啶季铵盐类衍生物(本发明的化合物I1-I15、II1-II13和III1-III10)的杀菌动力学特性进行了评价。其中,以活性较好的化合物II6对S.aureus ATCC25923的杀菌动力学特性进行详细说明。图4所示的杀菌曲线反应了不同浓度的II6(即图4中的化合物15f)随时间变化的杀菌效果,发现II6从3小时后表现出对细菌生长抑制作用,菌量开始显著降低。溶剂对照组(DMSO)在0至12小时菌量不断增长,而II6在2和1μg/mL下,分别在6和24小时后将细菌数量杀灭至检测限之下。化合物II6杀菌能力呈浓度依赖性,相对于空白对照能够显著抑制细菌的生长。而抑菌药物利奈唑胺(Linezolid)在32μg/mL的浓度下,只能使菌量保持不增加的状态。
实施例15:9-芳烷基-10-甲基吖啶季铵盐类衍生物对FtsZ蛋白活性的测定。
本实施例通过验证了本发明的9-芳烷基-10-甲基吖啶季铵盐类衍生物(本发明的化合物I1-I15、II1-II13和III1-III10)对FtsZ蛋白的作用,对FtsZ蛋白的直接作用通过体外聚合实验被表征,荧光分光光度计测定FtsZ聚合溶液的光散射强度值,从而反映蛋白的聚合动力学特征。FtsZ蛋白由山东大学药学院生化教研室提供。
以化合物II6为例进行说明,如图5所示。图5中光散射强度的变化显示,化合物II6(即图5中的化合物15f)以一种浓度依赖的方式,明显促进了FtsZ的聚合,表现为其光散射强度随浓度的提高(2.5ug/mL、5ug/mL、10ug/mL)而不断上升,表明化合物II6作用于细菌FtsZ蛋白,与此相对的,DMS0空白对照下的FtsZ几乎无明显聚合变化;作用于细菌核糖体的利奈唑胺,在10ug/mL时对FtsZ的聚合也不产生明显作用。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种化合物、药物组合物、药物及其在制备抗菌产品中的应用
- 一种化合物、制备方法、药物组合物及在制备预防/治疗肿瘤产品中的应用
