用作半胱氨酸蛋白酶的探针的氧化锍叶立德衍生物
文献发布时间:2023-06-19 12:02:28
技术领域
本发明涉及可用作半胱氨酸蛋白酶诸如组织蛋白酶X的基于活性的探针和/或抑制剂的化合物,检测半胱氨酸蛋白酶活性的方法,以及相关的诊断和治疗方法及用途。
背景技术
根据Lechtenberg等人,ACS Chem.Biol.2015,10,945-951,“proteases arecentral mediators of a large variety of physiological processes”。蛋白水解裂解事件是蛋白质降解、酶活化和蛋白质成熟的基础,并且调节从细胞死亡、迁移和增殖、炎症和免疫应答到血凝固的广泛途径(Rawlings,N.D.和Salvesen,G.(2012)Handbook ofProteolytic Enzymes,第三版,Academic Press,Waltham,MA)。另一方面,异常的蛋白水解常常与严重的障碍有关。此外,蛋白酶通常在细胞中表达,或者作为需要经由如蛋白水解裂解或二聚化的过程活化的无活性酶原分泌。蛋白酶的活化是严格的时间和空间调节的基础,并因此蛋白酶的位置一般不是蛋白酶功能的理想标记。相反,给定蛋白酶的活性形式的空间和时间位置对于理解其功能是必要的。为此目的,已经针对各种蛋白酶开发了基于活性的探针(Deu,E.,Verdoes,M.和Bogyo,M.(2012),New approaches for dissectingprotease functions to improve probe development and drug discovery.Nat.Struct.Mol.Biol.19,9-16.)。这些探针被设计成类似于活性位点反应性蛋白酶抑制剂,以特异性标记活性蛋白酶,并因此是研究和诊断的强有力工具。此外,这些探针还为开发出用于潜在治疗应用的选定蛋白酶的有效抑制剂铺平了道路(Deu等人2012,Nat.Struct.Mol.Biol.19,9-16)。
感兴趣的目标酶是半胱氨酸蛋白酶,包括半胱氨酸组织蛋白酶,特别是组织蛋白酶X。
半胱氨酸组织蛋白酶是溶酶体蛋白酶的家族,其通常在各种人类癌症中上调,并且涉及不同的肿瘤发生过程,诸如血管新生、增殖、细胞凋亡和侵入。半胱氨酸组织蛋白酶家族构成了最大的组织蛋白酶家族,在人类中有11种蛋白酶(称为clan CA,C I a家族):组织蛋白酶B、C(也称为组织蛋白酶J和二肽基肽酶1)、F、H、K(也称为组织蛋白酶02)、L、O、S、W、V(也称为组织蛋白酶L2),以及Z(也称为组织蛋白酶X和组织蛋白酶P)。组织蛋白酶作为肿瘤进展的主要参与者出现,使得它们成为广泛的人类癌症的潜在药物靶标。
组织蛋白酶X(也称为组织蛋白酶Z/P)是一种半胱氨酸组织蛋白酶,在其家族成员之中较为独特,因为其表现出严格的羧肽酶活性。组织蛋白酶X被认为是许多人类疾病的原因。其表达与若干癌症类型和神经变性疾病相关联,尽管其在正常生理学状态期间的作用尚知之甚少。由于缺乏可特异性测量组织蛋白酶X的蛋白水解活性的可用工具,我们对其功能理解的进展受到了阻碍。
组织蛋白酶X有助于巨噬细胞和树突状细胞的粘附和成熟(Obermajer等人,2008),并且通过裂解谱抑制网格蛋白依赖性吞噬作用(Pecar Fonovic和Kos,2015)。组织蛋白酶X调节激素信号传导,其中其对缓激肽、血管舒张素或血管紧张素的裂解导致了对它们同源受体的特异性的改变以及不同的下游信号传导(
与大多数组织蛋白酶一样,组织蛋白酶X作为酶原合成,在内溶酶体的酸性环境中被活化。一旦被活化,其还可能受到内源性抑制剂的负调节,尽管可能不是胱抑素C或stefinA(Duivenvoorden等人,2017;
为此,努力主要集中于开发出用于组织蛋白酶X的基于活性的荧光探针(ABP)。荧光ABP是含有亲电子部分(弹头)、赋予选择性的识别序列以及用于检测的荧光团的小分子(Edgington和Bogyo,2013;Edgington等人,2011;Sanman和Bogyo,2014)。当呈活性时,蛋白酶引发对弹头的亲核攻击,从而导致共价不可逆键的形成。然后,通过SDS-PAGE(胶内荧光)、荧光显微镜术、流式细胞计数法或者整个组织或生物体的光学成像,可使用探针标记的评估来定量蛋白酶活性。重要的是,探针结合的共价性质允许通过用特异性抗体免疫沉淀或亲和纯化继之以蛋白质组学分析来进行靶标确认。
以前尚未报道过对组织蛋白酶X具有绝对特异性的探针。BMV109,即具有四氟苯氧基甲基酮弹头的荧光淬灭的ABP,是靶向X、B、S和L的泛组织蛋白酶探针(Verdoes等人,2013;Edgington-Mitchell等人,2015)。因为组织蛋白酶X与组织蛋白酶B(即最丰富和遍在表达的组织蛋白酶之一)的尺寸类似,可能难以通过SDS-PAGE明显地分辨这两种蛋白酶。这妨碍了通过胶内荧光进行准确定量。MGP140是基于环氧化物的基于活性的探针,其表现出比BMV109更高的对组织蛋白酶X的特异性,但也与组织蛋白酶B有效地反应(Paulick和Bogyo,2011)。如果在注射MGP140之前用组织蛋白酶B、S和L的抑制剂GB11-NH
Shaw公开了肽基锍盐的合成及其对半胱氨酰蛋白酶木瓜蛋白酶和组织蛋白酶B的抑制作用(Shaw,1988)。
Gordon等人,US 5,223,486公开了肽基重氮甲基酮和肽基锍盐作为癌促凝物质(半胱氨酸蛋白酶)的抑制剂。
Paulick等人描述了几种基于活性的荧光探针的合成和表征,所述探针带有酰氧基甲基酮(AOMK)或环氧化物弹头并且旨在靶向组织蛋白酶X。据发现基于环氧化物的探针标记组织蛋白酶X,而AOMK探针却不能一致地标记该蛋白酶(Paulick和Bogyo,2011)。
概括地说,仍然需要用作半胱氨酸蛋白酶诸如半胱氨酸组织蛋白酶,更特别地组织蛋白酶X的基于活性的探针(或抑制剂)的化合物。此类化合物可用于研究相应的半胱氨酸蛋白酶对正常生理学状态和疾病的贡献。另外,此类化合物可用于诊断和/或治疗与相应的半胱氨酸蛋白酶活性相关的疾病。
本发明人试图探索针对半胱氨酸蛋白酶的新潜在弹头,并且令人惊奇地发现如下所述的带有作为弹头的氧化锍叶立德部分的化合物可以充当半胱氨酸蛋白酶诸如半胱氨酸组织蛋白酶,更特别地组织蛋白酶X的基于活性的探针,与先前报道的探针(诸如BMV109和MGP140)相比具有改善的效力和选择性。
发明内容
本发明的某些实施方案的目的在于提供允许检测生物样品诸如细胞裂解物或组织裂解物中的半胱氨酸蛋白酶活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供允许检测活细胞中的半胱氨酸蛋白酶活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供允许在体内检测半胱氨酸蛋白酶活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供允许检测生物样品诸如细胞裂解物或组织裂解物中的组织蛋白酶X活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供允许检测活细胞中的组织蛋白酶X活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供允许在体内检测组织蛋白酶X活性的基于活性的探针化合物。
本发明的某些实施方案的目的在于提供基于活性的探针化合物,该基于活性的探针化合物允许检测半胱氨酸蛋白酶活性,并且其与基于活性的探针BMV109和MGP140相比具有改善的选择性。
本发明的某些实施方案的目的在于提供基于活性的探针化合物,该基于活性的探针化合物允许检测组织蛋白酶X活性,并且其与基于活性的探针BMV109和MGP140相比具有改善的选择性。
本发明的某些实施方案的目的在于提供基于活性的探针化合物,该基于活性的探针化合物允许检测组织蛋白酶X活性,并且对组织蛋白酶X具有高效力,诸如与基于活性的探针BMV109和MGP140相比,其对组织蛋白酶X具有改善的效力。
本发明的某些实施方案的目的在于提供基于活性的探针化合物,该基于活性的探针化合物允许检测组织蛋白酶X活性(例如,在细胞裂解物、组织裂解物、活细胞中和体内),并且表现出与组织蛋白酶B和/或组织蛋白酶L无交叉反应性。
本发明的某些实施方案的目的在于提供半胱氨酸蛋白酶的抑制剂。
本发明的某些实施方案的目的在于提供组织蛋白酶X的抑制剂。
本发明的某些实施方案的目的在于提供表现出与组织蛋白酶B和/或组织蛋白酶L无交叉反应性的组织蛋白酶X的抑制剂。
本发明的某些实施方案的目的在于提供可用于诊断与半胱氨酸蛋白酶活性相关的疾病的化合物。
本发明的某些实施方案的目的在于提供可用于诊断与组织蛋白酶X活性相关的疾病的化合物。
本发明的某些实施方案的目的在于提供可用于诊断选自癌症、炎性疾病和神经变性疾病的疾病的化合物。
本发明的某些实施方案的目的在于提供可用于治疗与半胱氨酸蛋白酶活性相关的疾病的化合物。
本发明的某些实施方案的目的在于提供可用于治疗与组织蛋白酶X活性相关的疾病的化合物。
本发明的某些实施方案的目的在于提供可用于治疗选自癌症、炎性疾病和神经变性疾病的疾病的化合物。
上述目的应理解为还涉及相应的方法以及在相应的方法中使用的化合物/组合物。
在某些实施方案中,本发明涉及一种式I的化合物或其盐,
[化学式.1]
其中
R
R
R
R
R
X是
(i)键;或
(ii)经由氨基与R
[化学式.2]
其中
R
R
R
R
n是1、2、3或4。
在某些实施方案中,本发明涉及一种具有选自以下式的(式I的)化合物:
[化学式.3]
[化学式.4]
[化学式.5]
[化学式.6]
[化学式.7]
[化学式.8]
[化学式.9]
或它们的盐。
在某些实施方案中,本发明涉及一种具有下式的(式I的)化合物:
[化学式.10]
或其盐。
在某些实施方案中,本发明涉及一种包含如本文所述的式I的化合物或其盐以及赋形剂的组合物。
在某些实施方案中,本发明涉及一种包含如本文所述的式I的化合物或其盐以及赋形剂的组合物,其中化合物包含至少一个可检测元件。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使半胱氨酸蛋白酶与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对半胱氨酸蛋白酶进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的体外方法,该方法包括:
(1)使生物样品与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使生物样品在体外与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使半胱氨酸蛋白酶与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对半胱氨酸蛋白酶进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的体外方法,该方法包括:
(1)使生物样品与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)向受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,该方法包括:
(1)向受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些实施方案中,本发明涉及一种抑制半胱氨酸蛋白酶的方法,该方法包括使半胱氨酸蛋白酶与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。
在某些实施方案中,本发明涉及一种抑制半胱氨酸蛋白酶的体外方法,该方法包括使生物样品与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。
在某些实施方案中,本发明涉及一种抑制获自受试者的生物样品中的半胱氨酸蛋白酶的方法,该方法包括使生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。
在某些实施方案中,本发明涉及一种抑制受试者中的半胱氨酸蛋白酶的体内方法,该方法包括向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物。
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括:
(1)使获自受试者的生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种如本文所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的组合物。
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐,以及
(2)随后检查受试者,包括测量可检测信号。
在某些实施方案中,本发明涉及一种如本文所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些实施方案中,本发明涉及一种治疗与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括向有此需要的患者施用治疗有效量的如本文所述的式I的化合物或其盐,或者治疗有效量的如本文所述的组合物。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物或其盐,其在治疗与半胱氨酸蛋白酶活性相关的疾病中使用。
在某些实施方案中,本发明涉及一种用于治疗与半胱氨酸蛋白酶活性相关的疾病的组合物,该组合物包含如本文所述的式I的化合物或其盐以及药学可接受的赋形剂。
在某些实施方案中,本发明涉及如本文所述的式I的化合物或其盐在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
在某些实施方案中,本发明涉及如本文所述的组合物在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
在某些实施方案中,本发明涉及一种用于制备带有氯甲基酮部分的化合物的方法,该方法包括使带有氧化锍叶立德部分的化合物反应,以产生带有氯甲基酮部分的化合物。
在某些实施方案中,本发明涉及一种用于制备带有作为弹头的酰氧基甲基酮部分的基于活性的探针化合物的方法,该方法包括
(i)通过使带有氧化锍叶立德部分的化合物反应以产生带有氯甲基酮部分的化合物,制备带有氯甲基酮部分的中间体化合物,以及
(ii)进一步处理带有氯甲基酮部分的化合物,以产生所述基于活性的探针化合物。
附图说明
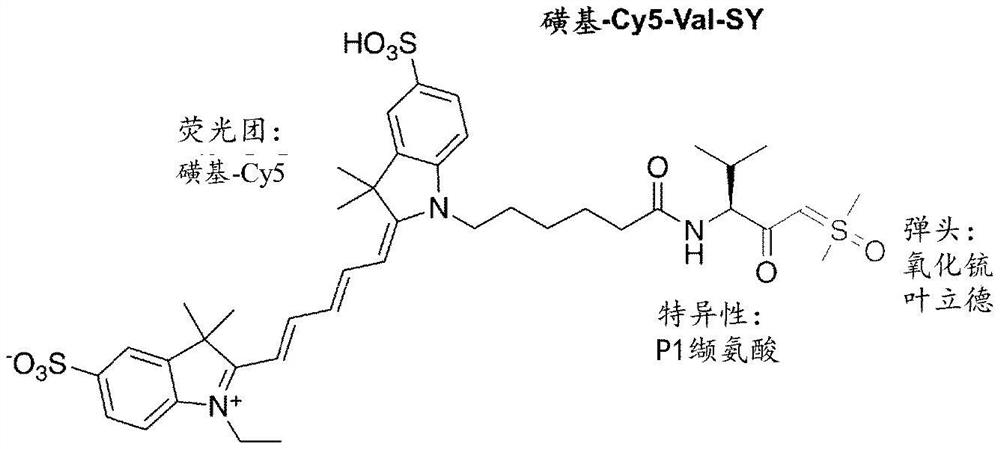
图1A示出sCy5-Val-SY探针的结构。
图1B示出了所提出的sCy5-Val-SY探针与半胱氨酸蛋白酶结合的机制。
图2A示出实施例3的结果(用sCy5-Val-SY(以1μM进行20分钟)或BMV109(以1μM进行20分钟)标记RAW264.7裂解物——单独地或在用10μM MDV-590(组织蛋白酶S抑制剂)或JPM-OEt(泛半胱氨酸组织蛋白酶抑制剂)预处理之后)。
图2A-1示出实施例3的结果(用指定浓度的sCy5-Val-SY标记RAW264.7裂解物20分钟,如由胶内荧光所分析)。
图2A-2示出实施例3的结果(用1μM sCy5-Val-SY标记RAW264.7裂解物,保持指定的时间,如由胶内荧光所分析)。
图2B示出实施例3的结果(用组织蛋白酶X特异性抗体免疫沉淀sCy5-Val-SY-标记的样品(以1μM标记20分钟))。
图2C示出实施例4的结果(用sCy5-Val-SY或BMV109标记野生型或组织蛋白酶X缺陷小鼠的脾裂解物)。
图2D示出实施例5的结果(用递增剂量的sCy5-Val-SY或BMV109标记活RAW264.7细胞两小时)。
图2D-1示出实施例5的结果(用1μM sCy5-Val-SY标记活(完整)RAW264.7细胞指定的时间,通过胶内荧光分析)。
图2E示出实施例5的结果(用组织蛋白酶X特异性抗体免疫沉淀sCy5-Val-SY-标记的样品(在1μM下标记活细胞2小时))。
图2F示出实施例5的结果(在采用和不采用10μM MDV-590预处理过夜的情况下,用sCy5-Val-SY或BMV109标记活RAW264.7细胞(1μM,两小时))。
图3A示出实施例6的结果(用指定氧化锍叶立德探针或BMV109(以0.01、0.05、0.1、0.5、1、5μM的递增浓度添加的探针,如由厚度渐增的箭头所指示)标记RAW264.7裂解物)。
图3B示出实施例7的结果(用指定氧化锍叶立德探针或BMV109(以0.1、0.5、1、5μM的递增浓度添加的探针,如由厚度渐增的箭头所指示)标记肾裂解物)。
图3C示出实施例8的结果(用指定氧化锍叶立德探针或BMV109(以0.1、0.5、1、5μM的递增浓度添加的探针,如由厚度渐增的箭头所指示)标记活RAW264.7细胞)。
图3D示出实施例9的结果(用指定氧化锍叶立德探针或BMV109(以0.1、0.5、1、5μM的递增浓度添加的探针,如由厚度渐增的箭头所指示)标记活MDA-MB-231
图4A示出实施例10的结果(得自未接受探针(NP)、接受sCy5-Nle-SY或BMV109的小鼠的组织的SDS-PAGE和胶内荧光)。从相同的凝胶切下BMV109标记的样品,并且以与相应组织中的其他样品相同的增益设定呈现。单独地设定各组织的增益以显示组织蛋白酶X标记的最佳对比度。在无探针对照中观察到自体荧光带。
图4B示出实施例10的结果(用组织蛋白酶X特异性抗体免疫沉淀肝和肾样本)。
图5示出实施例10的结果(用sCy5-Nle-SY在肾中标记组织蛋白酶X的共聚焦显微分析)。分析得自sCy5-Nle-SY-注射的小鼠或无探针对照的肾切片的sCy5荧光或组织蛋白酶X免疫反应性。
图6A示出实施例11的结果(用指定的AOMK和氧化锍叶立德探针(在0.1、0.5、1和5μM的递增浓度下,如由厚度渐增的箭头所指示)标记活RAW264.7细胞,如由胶内荧光所分析)。在上图中,增益设定对于所有样品是相等的。在下图中,将增益设定单独地设定,以显示AOMK探针的最佳对比度。
图6B示出实施例12的结果(用sCy5-Nle-AOMK探针体内标记结肠,顶部条带是无探针对照中呈现的自体荧光蛋白)。
图7示出与探针标记的蛋白酶的鉴定相关的实验结果。(A,C-G):用组织蛋白酶特异性抗体免疫沉淀探针标记的裂解物(RAW264.7细胞或肾,具有施用给如所指定的活细胞或裂解物的指定探针)。(B)在采用和不采用组织蛋白酶S抑制剂MDV590(10μM)或Z-FL(20μM)预处理过夜的情况下,用sCy5-Nle-SY(1μM,两小时)标记活RAW264.7细胞。
图8A示出实施例13的结果(用sCy5-Nle-SY标记由人口腔鳞状细胞癌组织或患者匹配的正常口腔粘膜制备的裂解物(在5μM下温育20分钟),并通过样品的胶内荧光以及免疫印迹进行分析)。
图8B示出实施例13的结果(用组织蛋白酶X特异性抗体免疫沉淀Cy5-Nle-SY-标记的人口腔癌症组织裂解物)。
图9示出实施例14的结果(用sCy5-Val-SY标记经Boc-Val-SY(0、10或100μM)预处理过夜的RAW264.7细胞,并且通过胶内荧光分析裂解的细胞)。
具体实施方式
在描述本发明时,下列术语将如下所示使用。
如本文所用,单数形式“一个”、“一种”和“所述”包括复数指代,除非上下文另外明确指出。
除非另有定义,否则本文使用的所有技术术语和科学术语都具有与本领域的普通技术人员通常理解的相同的含义。
术语“基于活性的探针”旨在具有与本领域的普通技术人员通常理解的相同的含义。基于活性的探针(ABP)是以活性依赖性方式(即,标记反应需要酶活性)共价结合至一种酶(诸如蛋白酶)或一组酶的活性位点的小分子。ABP通常包括三个要素:(i)称为“弹头”的亲电子部分,(ii)接头或识别序列,以及(iii)用于检测的可检测元件或“报告部分”。酶攻击亲电子弹头,从而导致形成了能够随后直接地(例如,如果可检测元件是荧光标记)或通过两步标记(例如,连接处理物的后标记修饰)检测的共价加合物。
术语“可检测元件”或“报告基团/部分”是指可使用包括但不限于光学方法(例如荧光或UV-VIS吸光度的测量)、放射线照相术、生化法(例如使用免疫化学试剂,诸如抗体)等的技术来检测的化合物(基于活性的探针)中的官能团。术语“可检测元件”包括可“直接地”(例如在运行SDS-PAGE之后通过荧光测量)检测的官能团,以及可在进行次级标记步骤和后续次级标记检测之后检测的官能团。此类基团的实例是生物素标记,其可例如在用荧光标记的链霉亲和素进行次级标记和后续的荧光测量之后检测。此类基团的另一个实例是点击化学标记(生物正交连接手柄(bioorthogonal ligation handle)),其可例如在利用点击化学(生物正交)反应用荧光标记进行次级标记和后续的荧光测量之后检测。
“生物正交连接手柄”因此是在初始探针标记步骤(使蛋白酶/生物样品/受试者与本发明化合物在体内或离体接触)中存在于本发明化合物中的官能团,其允许后续在次级标记步骤中利用例如在体外进行的点击化学(生物正交)反应连接次级标记(对应于实际检测的标记)。
点击化学标记和用于次级标记(即实际检测的标记的连接)的相应的点击化学反应描述于例如Martell等人,Applications of Copper-Catalyzed Click Chemistry inActivity-Based Protein Profiling,Molecules 2014,19,1378-1393以及Willems等人,Bioorthogonal chemistry:Applications in activity-based protein profiling,Acc.Chem.Res.2011,44,718-729。
术语“半胱氨酸蛋白酶活性”是指半胱氨酸蛋白酶的蛋白水解活性。
在组织蛋白酶X的情况下,术语“半胱氨酸蛋白酶活性”或“组织蛋白酶X活性”是指蛋白水解活性即羧肽酶活性。
组织蛋白酶X、S、B和L各自属于半胱氨酸蛋白酶家族。术语“组织蛋白酶X”表示由CTSZ基因座产生的蛋白质。“组织蛋白酶X”也称为“组织蛋白酶Z”或“组织蛋白酶P”。术语“组织蛋白酶S”表示由CTSS基因座产生的蛋白质。术语“组织蛋白酶B”表示由CTSB基因座产生的蛋白质。术语“组织蛋白酶L”表示由CTSL基因座产生的蛋白质。
术语“患者”意指受试者,尤其是人,其已经表现出建议需要治疗的一种或多种特定症状的临床表现,其针对病症进行预防性或预防性地治疗,或其已经被诊断患有待治疗的病症。
术语“受试者”意在包括哺乳动物受试者,特别是人类受试者,并且包括术语“患者”的定义,且不排除在所有方面或关于特定病症完全正常的个体。
如本文所用,术语“治疗有效的”是指产生期望治疗结果所需的药物的量或给药速率。
如本文所用,术语如“施用”或“给予”包括各种施用途径,诸如静脉内、皮下、肌内、口服、鼻、舌下或局部。
术语“组织样本”或“活体组织切片”是指从受试者获得的生物组织的样本,诸如通过切除、针抽吸、活检钳或拭子获得的样本。组织样本还包括粘膜活体组织切片和粪便样本。取样的组织可为活的、死亡的、健康的或病变的,并且包含细胞类型和胞外因子的异源混合物。
“粘膜活体组织切片”通常通过擦拭积聚在另一组织(例如粘膜或肠道上皮)表面上的粘液获得。粘膜活体组织切片包含脱落细胞以及来自其上积聚有粘液的组织的细胞排泄物。
术语“痰液样本”是指从呼吸道咳出的唾液和粘液的混合物的样本。可以侵入性或非侵入性地获得“痰液样本”。侵入性方法涉及在对受试者插管时口咽或气管内抽吸,并将所获得的内容物收集在唾液捕集器中。非侵入性方法收集受试者咳嗽时(有时在用盐水雾化吸入后使分泌物松脱)产生的内容物。
术语“粪便样本”或“大便样本”是指从受试者的粪便收集的样本。粪便样本包含从胃肠道脱落的细胞以及来自受试者的胃肠道的细胞排泄物。
术语“组织样本裂解物”是指通过使组织样本的细胞裂解而获得的溶液。术语“裂解”或“溶解”是指细胞膜的解体或破裂,从而导致细胞内容物的释放和/或细胞的后续死亡。裂解可例如通过细胞膜的机械、酶或渗透破坏来实现。
如本文所用,术语“与半胱氨酸蛋白酶活性相关的疾病”表示其中半胱氨酸蛋白酶活性与疾病的发病机制有关的疾病。在“与半胱氨酸蛋白酶活性相关的疾病”中,在身体的患病状态或患病区域(例如身体部分、器官、包括肿瘤组织在内的病理组织)中的半胱氨酸蛋白酶活性的水平偏离于在身体的无病理状态或相应的无病理区域中发现的半胱氨酸蛋白酶活性的相应水平。在某些实施方案中,与在身体的无病理状态或相应的无病理区域中发现的半胱氨酸蛋白酶活性的相应水平相比,在身体的患病状态或患病区域中的半胱氨酸蛋白酶活性的水平有所提高。例如,在无病理状态或区域中,半胱氨酸蛋白酶活性的水平可低于检出限,而在患病状态或区域中,半胱氨酸蛋白酶活性的水平高于检出限。与半胱氨酸蛋白酶活性相关的疾病包括乳糜泻、胃肠蠕动紊乱、疼痛、瘙痒、皮肤病(诸如特应性皮炎)、饮食诱导的肥胖、代谢障碍(包括但不限于非酒精性脂肪肝炎(NASH)、肝和胰腺疾病)、哮喘、类风湿性关节炎、牙周炎、炎性疾病(诸如炎性GI障碍,特别是炎性肠道病)、功能性GI障碍(诸如肠易激综合征、功能性胸痛、功能性消化不良、恶心和呕吐障碍、功能性便秘、功能性腹泻、大便失禁、功能性肛门直肠痛和功能性排便障碍)、癌症、纤维化疾病、代谢功能异常、神经疾病和神经变性疾病。在某些实施方案中,“与半胱氨酸蛋白酶活性相关的疾病”是“与组织蛋白酶X活性相关的疾病”。
如本文所用,术语“炎性肠胃疾病”、“炎性肠胃障碍”、“炎性GI障碍”或“炎性GI疾病”表示肠胃疾病,即涉及胃肠道的疾病,即口腔、食道、胃、小肠、大肠(结肠)和直肠,以及附属消化器官(例如,舌、唾腺、胰腺、肝和胆囊),其中存在GI道的一个或多个部分的炎症。炎性GI疾病包括例如炎性肠道病、传染性腹泻、肠系膜缺血、憩室炎和坏死性小肠结肠炎(NEC)。
术语“炎性肠道病”或“IBD”是指以胃肠道中的慢性和复发性炎症为特征的疾病的集合。IBD最显著地包括溃疡性结肠炎(UC)和克罗恩氏病(CD),这两者均与腹泻、直肠出血、尿急增加和疼痛相关,但也包括不太普遍的疾病,诸如急性结肠炎、免疫肿瘤学结肠炎、化疗/放射性结肠炎、移植物抗宿主病(GvHD)结肠炎、胶原性结肠炎、淋巴细胞结肠炎、微小性结肠炎、改道性结肠炎、贝赛特氏症、以及未确定型结肠炎和囊炎。
如本文所用,术语“功能性胃肠道障碍”、“功能性GI障碍”或“功能性GI疾病”表示肠-脑相互作用的障碍。它是通过与以下的任何组合相关的GI症状进行分类的一类障碍:动力障碍、内脏过敏症、改变的粘膜和免疫功能、改变的肠道菌群,以及改变的中枢神经系统(CNS)处理。术语“功能性”通常应用于从肠运动、肠神经的敏感性或大脑控制这些功能中某些的方式的角度而言身体的正常活动受损的障碍。然而,不存在可以通过内窥镜检查、x射线或血液测试观察到的结构异常。因此,这些障碍主要通过症状的特征来鉴定。功能性GI障碍包括肠易激综合征、功能性胸痛、功能性消化不良、恶心和呕吐障碍、功能性便秘、功能性腹泻、大便失禁、功能性肛门直肠痛和功能性排便障碍。
术语“感染”是指这样的过程或状态,其中致病原(诸如,例如,致病细菌、真菌、原生动物、病毒、朊病毒、类病毒、线虫和蠕虫)在被感染受试者的身体组织中侵入和繁殖。
术语“癌症”是指以不受控制的异常细胞生长为特征且具有侵入或扩散至身体其他部分的潜能的疾病的集合。癌症可影响任何组织,并以起源组织命名。术语“口腔癌”是指口腔的癌症,即位于受试者口腔中的任何癌组织生长。口腔癌的示例性组织学类型是畸胎瘤、衍生自大或小唾液腺的腺癌、来自扁桃体或其他淋巴组织的淋巴瘤,或来自口腔粘膜的色素生成细胞的黑素瘤。最常见类型的口腔癌是起源于衬于口腔和唇部里面的组织的鳞状细胞癌,较不常见的类型包括卡波济氏肉瘤。口腔癌最通常涉及舌,但也可发生在口腔底、颊内壁、牙龈、嘴唇或腭上。术语“乳腺癌”是指乳房的癌症。示例性乳腺癌是导管原位癌(DCIS)、小叶原位癌(LCIS)、浸润性导管癌(IDC)、浸润性小叶癌(ILC)、乳头佩吉特病、叶状肿瘤和血管肉瘤。术语“前列腺癌”是指前列腺的癌症。示例性前列腺癌包括前列腺腺癌。术语“结肠直肠癌”是指结肠和/或直肠的癌症。示例性结肠直肠癌是腺癌、类癌瘤、胃肠间质瘤(GIST)、淋巴瘤和起源于结肠或直肠的肉瘤。
术语“α氨基酸”意在包括天然和非天然α氨基酸。
术语“天然氨基酸”意在包括蛋白原性和非蛋白原性氨基酸。
关于α氨基酸的侧链,术语“结构类似物”是指其中CH
关于α氨基酸的侧链,术语“同系物”是指经一个CH
术语“(C
如本文所用,术语“烷基”表示直链或支链烷基。烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、2-丁基、异丁基、叔丁基、正戊基、1-甲基丁基、2-甲基丁基、3-甲基丁基和2,2-二甲基丙基。
如本文所用,术语“卤代烷基”表示其中该基团的氢原子部分或全部地被卤素原子替代的直链或支链烷基。卤代烷基的实例包括氟甲基、二氟甲基、三氟甲基、1-氟乙基、2-氟乙基、2,2-二氟乙基、2,2,2-三氟乙基等。在一个实施方案中,1至3个氢原子被卤素原子替代。
如本文所用,术语“羟烷基”表示其中该基团的至少一个氢原子被羟基替代的直链或支链烷基。在某些实施方案中,一个或两个氢原子被羟基替代。在某些实施方案中,一个氢原子被羟基替代。
如本文所用,术语“环烷基”表示饱和单环烃基。环烷基的实例包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基和环癸基。
如本文所用,术语“烯基”表示至少单不饱和的直链或支链烃基,即具有至少一个碳-碳双键的直链或支链烃基。烯基的实例包括例如乙烯基、烯丙基(2-丙烯-1-基)、1-丙烯-1-基、2-丙烯-2-基、甲代烯丙基(2-甲基丙-2-烯-1-基)、2-丁烯-1-基、3-丁烯-1-基、2-戊烯-1-基、3-戊烯-1-基、4-戊烯-1-基、1-甲基丁-2-烯-1-基、2-乙基丙-2-烯-1-基等。
如本文所用,术语“炔基”表示具有至少一个碳-碳三键的直链或支链烃基。炔基的实例包括乙炔基、炔丙基(2-丙炔-1-基,也称为丙-2-炔-1-基)、1-丙炔-1-基(也称为丙-1-炔-1-基)、1-甲基丙-2-炔-1-基、2-丁炔-1-基、3-丁炔-1-基、1-戊炔-1-基、3-戊炔-1-基、4-戊炔-1-基、1-甲基丁-2-炔-1-基、1-乙基丙-2-炔-1-基等。
如本文所用,术语“芳基”表示通过从环碳原子上移除氢原子而衍生自单环或多环芳香烃的基团。芳基的实例包括苯基和萘基。
如本文所用,术语“杂芳基”表示通过从任何环原子上移除氢原子而衍生自杂芳烃的基团。杂芳基的实例包括衍生自吡咯、呋喃、噻吩、咪唑、噁唑、噻唑、吡唑、吡啶、吡嗪、哒嗪、嘧啶、吲哚等的基团。杂芳烃的典型杂原子是氮、氧和硫。
如本文所用,术语“卤代”或“卤素”表示氟、溴、氯或碘,特别是氟或氯。
如本文所用,术语“烷氧基”表示经由氧基团与该分子的其余部分键合的直链或支链烷基。烷氧基的实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、2-丁氧基、异丁氧基、叔丁氧基等。
术语“烷基羰基”是指经由羰基(C=O)的碳原子与该分子的其余部分键合的直链或支链烷基。
术语“胺保护基”是指使得氨基不反应但也可移除以恢复氨基的化学部分。胺保护基的实例包括苄氧羰基(Cbz)、9-芴基甲氧基羰基(Fmoc)、叔丁氧羰基(Boc)、烯丙氧羰基(Alloc)、对甲苯磺酰基(Tos)、2,2,5,7,8-五甲基色满-6-磺酰基(Pmc)、2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-磺酰基(Pbf)、均三甲苯基-2-磺酰基(Mts)、4-甲氧基-2,3,6-三甲基苯基磺酰基(Mtr)、乙酰胺基、邻苯二甲酰亚氨基等。其他胺保护基是本领域的技术人员已知的,包括例如Green和Wuts(Protective Groups in Organic Synthesis,第4版2007,Wiley-Interscience,New York)和P.Kocienski(Thieme,2005)所述的那些。
如本文所用,术语“(C
如本文所用,术语“(C
如本文所用,术语“磺基”是本领域公认的,并且是指基团-SO
表示带正电荷或负电荷的原子或基团(诸如N
出于本发明的目的,术语“盐”包括无机酸盐,诸如盐酸盐、氢溴酸盐、硫酸盐、磷酸盐等;以及有机酸盐,诸如肉豆蔻酸盐、甲酸盐、乙酸盐、三氟乙酸盐、马来酸盐、酒石酸盐、酒石酸氢盐等;磺酸盐,诸如甲磺酸盐、苯磺酸盐、对甲苯磺酸盐等;以及氨基酸盐,诸如精氨酸盐、天冬酰胺盐、谷氨酸盐等。术语“盐”包括相应盐的溶剂化物,诸如水合物。
在某些实施方案中,如本文所用,术语“盐”意指诊断上和/或药学上可接受的盐。在将化合物施用给或旨在施用给受试者的本发明的某些实施方案中,术语“盐”表示药学上可接受的盐,或诊断上和药学上可接受的盐。
如本文所用,术语“药学上可接受的盐”意指本发明化合物的盐,其对于哺乳动物的局部或全身使用是安全而有效的并且具有期望的生物活性。抗衡离子适用于预期用途、无毒,并且其不干扰化合物的期望生物作用。在本发明的上下文中,药学上可接受的盐包括在IUPAC Handbook of Pharmaceutically Acceptable Salts(Wermuth,C.G.和Stahl,P.H.,Pharmaceutical Salts:Properties,Selection and Use-AHandbook,VerlagHelvetica Chimica Acta(2002))中综述的盐。
如本文所用,术语“诊断上可接受的盐”是指对期望的诊断方法有用且有效的本发明化合物的盐。其抗衡离子不干扰检测靶蛋白所必需的反应或检测方法。
在某些实施方案中,例如在包含三氟乙酸(TFA)的洗脱溶剂中进行HPLC纯化之后,本发明的化合物作为三氟乙酸盐存在。
在某些实施方案中,“赋形剂”意指诊断上和/或药学上可接受的赋形剂。在将组合物施用给或旨在施用给受试者的本发明的某些实施方案中,术语“赋形剂”表示药学上可接受的赋形剂,或诊断上和药学上可接受的赋形剂。
在示出卷曲的线的式中,卷曲的线表示或指示与分子的其余部分的连接点。
式(I)的化合物(以及任选地如由式II和III进一步所定义)可以含有一个或多个不对称中心,并因此可以形成对映体、非对映体和其他立体异构形式。除非另外明确指明,否则本公开涵盖具有所有此类可能形式以及它们的外消旋和拆分形式,或它们的任何混合物的化合物。当式(I)的化合物含有烯属双键或其他几何不对称中心时,并且除非另外明确指明,其旨在包括所有“几何异构体”,例如E和Z几何异构体两者。除非另外明确指明,否则所有“互变异构体”,例如酮-烯醇、酰胺-亚胺酸、内酰胺-内酰亚胺、烯胺-亚胺、胺-亚胺和烯胺-烯亚胺互变异构体旨在也被本公开涵盖。
如本文所用,术语“立体异构体”、“立体异构形式”等是用于仅在其原子空间取向上不同的各分子的所有异构体的通用术语。其包括对映体和具有不止一个手性中心并且彼此不为镜像的化合物的异构体(非对映体)。
术语“手性中心”是指连接有四个不同基团的碳原子。
术语“对映体”或“对映体的”是指在其镜像上不能重叠并因此具有光学活性的分子,其中对映体以一个方向旋转偏振光面而其镜像以相反方向旋转偏振光面。
术语“外消旋”是指等份对映异构体的混合物,其是非旋光性的。
术语“拆分”是指对分子的两种对映体形式中的一种的分离、浓缩或消耗。式(I)的化合物的光学异构体可通过已知技术获得,诸如手性色谱法或由光学活性酸或碱形成非对映体盐。
光学纯度能够以对映体过量(%ee)表示,其通过下式确定:
在一个实施方案中,本发明涉及具有如由式IA(并且如任选地由式IIA和IIIA进一步所定义)表示的绝对立体化学的化合物。
本发明的化合物可使用标准合成化学技术进行合成,例如使用以下实施例部分中描述的方法。其他可用的合成技术描述于例如March's Advanced Organic Chemistry:Reactions,Mechanisms,and Structure,第7版,(Wiley,2013);Carey和Sundberg,Advanced Organic Chemistry第4版,第A和B卷(Plenum2000,2001);Fiesers'Reagentsfor Organic Synthesis,第1-27卷(Wiley,2013);Rodd's Chemistry of CarbonCompounds,第1-5卷和增补刊(Elsevier Science Publishers,1989);OrganicReactions,第1-81卷(Wiley,2013);以及Larock's Comprehensive OrganicTransformations(VCH Publishers Inc.,1989)(所有这些文献全文以引用方式并入)。化合物通常使用一般可从商业来源获得或使用本领域技术人员公知的方法容易地制备的原料进行合成。参见例如Fiesers'Reagents for Organic Synthesis,第1-27卷(Wiley,2013),或Beilsteins Handbuch der organischen Chemie,第4版次,Springer-Verlag,Berlin,包括增补刊。
化合物
在某些实施方案中,本发明涉及一种式I的化合物或其盐,
[化学式.11]
其中
R
R
R
R
R
X是
(i)键;或
(ii)经由氨基与R
[化学式.12]
其中
R
R
R
R
n是1、2、3或4。
在某些实施方案中,式I的化合物的特征在于R
R
在某些其他实施方案中,R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
在某些实施方案中,R
R
在某些实施方案中,R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
在某些实施方案中,R
其中所述侧链或其结构异构体或同系物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
在某些实施方案中,式I的化合物的特征在于R
R
R
在某些此类实施方案中,如果X是键,则R
在其他此类实施方案中,R
在某些实施方案中,R
在某些实施方案中,式I的化合物的特征在于R
在某些实施方案中,式I的化合物的特征在于R
R
R
在某些实施方案中,R
在某些实施方案中,R
在某些实施方案中,R
在某些实施方案中,R
在某些实施方案中,R
(i)天然α氨基酸的侧链,或
(ii)蛋白原性α氨基酸的侧链,或
(iii)选自甘氨酸、丙氨酸、α-氨基丁酸、缬氨酸、正缬氨酸、亮氨酸、异亮氨酸、正亮氨酸、高正亮氨酸、甲硫氨酸、乙硫氨酸、苯丙氨酸、酪氨酸、左旋多巴、色氨酸、半胱氨酸、高半胱氨酸、硒代半胱氨酸、硒代高半胱氨酸、硒代甲硫氨酸、硒代乙硫氨酸、赖氨酸、组氨酸、精氨酸、鸟氨酸、天冬氨酸、谷氨酸、丝氨酸、高丝氨酸、O-甲基-高丝氨酸、O-乙基-高丝氨酸、苏氨酸、天冬酰胺和谷氨酰胺的α氨基酸的侧链,或
(iv)苯丙氨酸的侧链,
或所述侧链的结构异构体、同系物和/或结构类似物,
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
在某些实施方案中,R
在某些实施方案中,R
(i)天然α氨基酸的侧链,或
(ii)蛋白原性α氨基酸的侧链,或
(iii)选自甘氨酸、丙氨酸、α-氨基丁酸、缬氨酸、正缬氨酸、亮氨酸、异亮氨酸、正亮氨酸、高正亮氨酸、甲硫氨酸、乙硫氨酸、苯丙氨酸、酪氨酸、左旋多巴、色氨酸、半胱氨酸、高半胱氨酸、硒代半胱氨酸、硒代高半胱氨酸、硒代甲硫氨酸、硒代乙硫氨酸、赖氨酸、组氨酸、精氨酸、鸟氨酸、天冬氨酸、谷氨酸、丝氨酸、高丝氨酸、O-甲基-高丝氨酸、O-乙基-高丝氨酸、苏氨酸、天冬酰胺和谷氨酰胺的α氨基酸的侧链,或
(iv)苯丙氨酸的侧链,
或所述侧链的结构异构体、同系物和/或结构类似物,
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
在某些实施方案中,R
在某些实施方案中,R
在取代基是胺保护基的某些实施方案中,胺保护基可选自苄氧羰基(Cbz)、9-芴基甲氧基羰基(Fmoc)、叔丁氧羰基(Boc)、烯丙氧羰基(Alloc)、对甲苯磺酰基(Tos)、2,2,5,7,8-五甲基色满-6-磺酰基(Pmc)、2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-磺酰基(Pbf)、均三甲苯基-2-磺酰基(Mts)、4-甲氧基-2,3,6-三甲基苯基磺酰基(Mtr)、乙酰胺基和邻苯二甲酰亚氨基。在某些此类实施方案中,胺保护基是苄氧羰基。
在某些上述实施方案中,式I的化合物表现出根据式IA的绝对立体化学:
[化学式.13]
在某些此类实施方案中,在式I或IA的化合物中,X是(i)键,或(ii)分别表现出根据式IIA和IIIA的绝对立体化学的式II或III的双基部分:
[化学式.14]
在某些实施方案中,X是键。
在某些其他实施方案中,X是式II的双基部分。在某些此类实施方案中,X是式IIA的双基部分。
在某些其他实施方案中,X是式III的双基部分。在某些此类实施方案中,X是式IIIA的双基部分。在某些此类实施方案中,n是1。
在某些实施方案中,可检测元件选自荧光标记、生物素标记、放射性标记、螯合剂(例如用于放射性标记)和生物正交连接手柄。
可检测元件,诸如荧光标记、生物素标记、放射性标记、螯合剂或生物正交连接手柄可以包括用于引入到本发明化合物中(即用于将可检测元件或标记连接到分子的其余部分)的接头。合适的接头是本领域的技术人员已知的。可用于本发明化合物的接头的实例描述于WO 2012/118715 A2(参见第18页第9-18行),其内容据此包括在本公开中。接头还可包括用于连接至分子的其余部分的聚乙二醇(PEG)部分,诸如PEG-4、PEG-6或PEG-8。
术语“放射性标记”的定义和可用于本发明化合物的放射性标记的实例描述于WO2009/124265 A1(参见第11页第25行至第13页第3行),其内容据此包括在本公开中。
术语“螯合剂”的定义和可用于本发明化合物的螯合剂的实例描述于WO 2009/124265 A1(参见第10页第26行至第11页第14行),其内容据此包括在本公开中。
术语“生物正交连接手柄”的定义和可用于本发明化合物的生物正交连接手柄的实例以及相应的“点击”反应描述于例如Martell等人,Applications of Copper-Catalyzed Click Chemistry in Activity-Based Protein Profiling,Molecules 2014,19,1378-1393,其以引用方式并入本文。对这些方法修改以生成或改性本权利要求书的化合物在本领域的技术范围之内。
用于连接次级标记的生物正交或点击反应包括:
A.使叠氮化物与三芳基膦偶联以生成酰胺键的无痕施陶丁格连接(tracelessStaudinger Ligaition),
B.利用1,2,4,5-四嗪和应变二烯(反式-环辛烯)的四嗪环加成,
C.叠氮化物与末端炔烃之间的铜(I)催化的叠氮化物-炔烃环加成(CuAAC)反应以生成1,4-二取代的1,2,3-三唑,以及
D.利用应变炔烃以加速反应的叠氮化物-炔烃环加成的无铜变型形式。
就这一点而言,特别参考Martell等人,Molecules 2014,19,1378-1393的图1B和图2,其内容据此包括在本公开中。
因此,在某些实施方案中,生物正交连接手柄包含选自叠氮化物、1,2,4,5-四嗪和炔烃(诸如末端炔烃)的官能团。这些官能团允许使用上述生物正交反应(A)至(D)之一来连接次级标记。
在某些实施方案中,可检测元件是荧光标记。如本领域技术人员已知的,当被吸收的入射电磁辐射激发时,荧光标记发射电磁辐射,优选地可见光。各种各种的荧光标记,包括具有可用于将标记偶联至例如反应性基团(诸如氨基、硫醇基等)的反应性部分的标记是可商购获得的。参见例如The Molecular
可用于本发明化合物的荧光标记的实例描述于WO 2018/119476 A1(参见段落[0084]至[0095])和WO 2012/118715 A2(参见第15页第18行至第17页第12行,以及第18页第19行至第21页第1行),其内容据此包括在本公开中。此类荧光标记可包括用于引入本发明化合物中的接头,例如,如描述于WO 2012/118715 A2(参见第18页第9-18行),其内容据此包括在本公开中。
在某些实施方案中,可检测元件是荧光标记。在某些此类实施方案中,荧光标记选自荧光素、俄勒冈绿(荧光素的氟化衍生物)、硼杂-二氮杂-引达省染料、罗丹明染料(诸如四甲基罗丹明和羧基四甲基罗丹明)、苯并吡喃鎓染料、香豆素染料、花菁标记或苯并吲哚标记(诸如吲哚菁绿)。
此类染料的市售实例包括
在某些实施方案中,荧光标记是花菁标记。在某些此类实施方案中,荧光标记是选自Cy2、Cy3、Cy3.5、Cy5、Cy5.5、Cy7、Cy7.5、sCy3、sCy5和sCy7的花菁标记。在某些此类实施方案中,荧光标记是Cy5或sCy5。在某些实施方案中,荧光标记是sCy5。
在某些实施方案中,荧光标记是具有选自下式的组的式的花菁标记:
[化学式.15]
其中在以上各式中,
A选自CH
R
其中
p是2、3、4、5、6、7或8;
q是2、3、4、5、6、7或8;
r是2、3、4、5、6、7或8;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,
A选自CH
R
其中
p是2、3、4、5或6;
q是2、3、4、5或6;
r是2、3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,
A是C(CH
R
其中
p是2、3、4、5或6;
q是2、3、4、5或6;
r是2、3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,
A是C(CH
R
其中
p是4、5或6;
q是4、5或6;
r是3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,
A是C(CH
R
p是4、5或6;并且
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,
A是C(CH
R
其中
q是4、5或6;
r是3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,R
在某些实施方案中,荧光标记是具有选自下式的组的式的花菁标记:
[化学式.16]
[化学式.17]
[化学式.18]
其中在以上各式中,
卷曲的线表示与分子的其余部分的连接点;
并且R
在某些实施方案中,荧光标记是具有下式的花菁标记:
[化学式.19]
其中卷曲的线表示与分子的其余部分的连接点;并且R
在某些实施方案中,其中荧光标记是具有上式之一的花菁标记,R
在某些实施方案中,式I(或IA)的化合物包含至少一个可检测元件,诸如一个、两个或三个可检测元件。在某些此类实施方案中,如上所定义的式I(或IA)的化合物包含一个可检测元件。
在某些实施方案中,R
在某些实施方案中,R
在某些实施方案中,其中R
在某些实施方案中,X是式II或IIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
在某些实施方案中,X是式III或IIIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
在某些实施方案中,X是式III或IIIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
在某些实施方案中,式I的化合物是具有下式之一的化合物(具有如所示的绝对立体化学):
[化学式.20]
[化学式.21]
[化学式.22]
[化学式.23]
[化学式.24]
[化学式.25]
[化学式.26]
[化学式.27]
或它们的盐。
在某些优选的实施方案中,式I的化合物是具有下式的化合物(具有如所示的绝对立体化学):
[化学式.28]
或其盐。
组合物
在某些实施方案中,本发明涉及一种包含上述式I(或IA)的化合物或其盐以及赋形剂(例如药学上和/或诊断上可接受的赋形剂)的组合物。
可用于本发明的组合物的药学上可接受的赋形剂是技术人员已知的。此类药学上可接受的赋形剂的实例包括例如WO 2018/119476的段落[0114]至[0118]中所述的那些,其内容据此引入本公开中。
在某些实施方案中,组合物是包含例如水、生理缓冲盐水或缓冲溶液作为药学上可接受的赋形剂的水溶液。此类组合物可例如用于静脉内注射。
检测半胱氨酸蛋白酶活性的方法
在根据本发明的检测半胱氨酸蛋白酶活性的方法中,仅检测到相应半胱氨酸蛋白酶的蛋白水解活性形式。
在基于活性的探针化合物与半胱氨酸蛋白酶之间的反应发生(其导致形成共价键)之后,对可检测信号进行测量。所测量的可检测信号由标记的酶发射,即由共价连接至半胱氨酸蛋白酶的基于活性的探针化合物的可检测元件发射。在某些实施方案中,在使标记的酶经受次级标记步骤之后,对可检测信号进行测量。
使用基于活性的探针检测酶活性的概念以及相应的检测方法和潜在实验方案是技术人员已知的(参见例如Edgington和Bogyo,2013;Edgington-Mitchell,L.E.和Bogyo,M.(2016).Detection of Active Caspases During Apoptosis Using FluorescentActivity-Based Probes.Methods Mol Biol.1419,27-39;以及Edgington-Mitchell,L.E.,Bogyo,M.和Verdoes,M.(2017).Live Cell Imaging and Profiling of CysteineCathepsin Activity Using a Quenched Activity-Based Probe.Methods MolBiol.1491,145-159;其内容据此全文以引用方式并入)。技术人员知道如何适当地调整这些方法/方案以用于本发明的方法。
体外检测方法
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使半胱氨酸蛋白酶与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对半胱氨酸蛋白酶进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法是体外方法。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的体外方法,该方法包括:
(1)使生物样品与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使生物样品在体外与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在上述方法的某些实施方案中,基于活性的探针化合物包含具有式(IV)的氧化锍叶立德部分:
[化学式.29]
其中
R
R
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使半胱氨酸蛋白酶与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对半胱氨酸蛋白酶进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法是体外方法。
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的体外方法,该方法包括:
(1)使生物样品与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些实施方案中,本发明涉及一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,该方法包括:
(1)使生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在上述方法中每者的某些实施方案中,步骤(2)包括进行至少一种选自以下的分析方法:凝胶电泳和后续的胶内荧光、凝胶电泳和后续的放射线照相术、凝胶电泳和后续的免疫印迹、荧光显微镜术、流式细胞计数法、离体光学成像、放射线照相术、亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。
在上述方法中每者的某些实施方案中,可检测信号通过荧光测量法来测量。在某些此类实施方案中,至少一种分析方法选自凝胶电泳和后续的胶内荧光、荧光显微镜术和流式细胞计数法。在某些此类实施方案中,至少一种分析方法选自凝胶电泳和后续的胶内荧光,以及荧光显微镜术。在某些此类实施方案中,所述化合物包含荧光标记(例如,如本文所述)形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,通过点击化学施加荧光标记进行次级标记。在某些其他实施方案中,所述化合物包含生物素形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,用荧光标记的链霉亲和素进行次级标记或者用荧光标记的生物素特异性抗体进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自放射线照相术,以及凝胶电泳和后续的放射线照相术。在某些此类实施方案中,所述化合物包含放射性标记形式的可检测元件。在某些其他实施方案中,所述化合物包含用于放射性标记的螯合剂形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,通过点击化学施加放射性标记或用于放射性标记的螯合剂进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。在某些此类实施方案中,所述化合物包含生物素标记形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,通过点击化学施加生物素标记进行次级标记。在生物素标记的情况下,亲和纯化可使用例如链霉亲和素包被的珠或生物素特异性抗体包被的珠进行。
在某些实施方案中,亲和纯化可使用对某些标记物特异性的抗体包被的珠来进行。在某些此类实施方案中,所述化合物包括所述标记物作为可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(2)包括在进行亲和纯化之前,通过点击化学施加所述标记物进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自凝胶电泳和后续的免疫印迹。在某些此类实施方案中,所述化合物包含生物素标记形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,用例如HRP标记的链霉亲和素进行次级标记。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(2)包括在进行至少一种分析方法之前,通过点击化学施加生物素标记进行次级标记以及用例如HRP标记的链霉亲和素进行后续标记。
在某些实施方案中,凝胶电泳是一维或二维凝胶电泳(诸如SDS-Page或初始PAGE)。在某些实施方案中,凝胶电泳是SDS-PAGE。
在先给药给受试者情况下的体外检测方法
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)向受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,基于活性的探针化合物经静脉内施用。在该方法的某些实施方案中,基于活性的探针化合物包含具有式(IV)的氧化锍叶立德部分:
[化学式.30]
其中
R
R
在某些实施方案中,本发明涉及一种检测半胱氨酸蛋白酶活性的方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,化合物或其盐或组合物经静脉内施用。
在上述方法中每者的某些实施方案中,步骤(3)包括进行至少一种选自以下的分析方法:凝胶电泳和后续的胶内荧光、凝胶电泳和后续的放射线照相术、凝胶电泳和后续的免疫印迹、荧光显微镜术、流式细胞计数法、离体光学成像、放射线照相术、亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。
在上述方法中每者的某些实施方案中,可检测信号通过荧光测量法来测量。在某些此类实施方案中,至少一种分析方法选自凝胶电泳和后续的胶内荧光、荧光显微镜术和流式细胞计数法。在某些此类实施方案中,至少一种分析方法选自凝胶电泳和后续的胶内荧光,以及荧光显微镜术。在某些此类实施方案中,所述化合物包含荧光标记(例如,如本文所述)形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,通过点击化学施加荧光标记进行次级标记。在某些其他实施方案中,所述化合物包含生物素形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,用荧光标记的链霉亲和素进行次级标记或者用荧光标记的生物素特异性抗体进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自放射线照相术,以及凝胶电泳和后续的放射线照相术。在某些此类实施方案中,所述化合物包含放射性标记形式的可检测元件。在某些其他实施方案中,所述化合物包含用于放射性标记的螯合剂形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,通过点击化学施加放射性标记或用于放射性标记的螯合剂进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。在某些此类实施方案中,所述化合物包含生物素标记形式的可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,通过点击化学施加生物素标记进行次级标记。在生物素标记的情况下,亲和纯化可使用例如链霉亲和素包被的珠或生物素特异性抗体包被的珠进行。
在某些实施方案中,亲和纯化可使用对某些标记物(tag)特异性的抗体包被的珠来进行。在某些此类实施方案中,所述化合物包括所述标记物作为可检测元件。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(3)包括在进行亲和纯化之前,通过点击化学施加所述标记物进行次级标记。
在上述方法中每者的某些实施方案中,至少一种分析方法选自凝胶电泳和后续的免疫印迹。在某些此类实施方案中,所述化合物包含生物素标记形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,用例如HRP标记的链霉亲和素进行次级标记。在某些其他实施方案中,所述化合物包含生物正交连接手柄形式的可检测元件,并且步骤(3)包括在进行至少一种分析方法之前,通过点击化学施加生物素标记进行次级标记以及用例如HRP标记的链霉亲和素进行后续标记。
在某些实施方案中,凝胶电泳是一维或二维凝胶电泳(诸如SDS-Page或初始(native)PAGE)。在某些实施方案中,凝胶电泳是SDS-PAGE。在某些实施方案中,受试者是人类受试者。
体内检测方法
在某些实施方案中,本发明涉及一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,该方法包括:
(1)向受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些此类实施方案中,基于活性的探针化合物经静脉内施用。在该方法的某些实施方案中,基于活性的探针化合物包含具有式(IV)的氧化锍叶立德部分:
[化学式.31]
其中
R
R
在某些实施方案中,本发明涉及一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些此类实施方案中,化合物或其盐或组合物经静脉内施用。
在上述(体内)方法中每者的某些实施方案中,可检测信号通过体内光学成像、放射线照相术或正电子发射断层摄影来测量。在某些此类实施方案中,可检测信号通过放射线照相术或正电子发射断层摄影来测量。在某些此类实施方案中,所述化合物包含放射性标记形式的可检测元件。在某些其他实施方案中,所述化合物包含用于放射性标记的螯合剂形式的可检测元件。在某些实施方案中,受试者是人类受试者。
抑制半胱氨酸蛋白酶的方法
在某些实施方案中,本发明涉及一种抑制半胱氨酸蛋白酶的方法,该方法包括使半胱氨酸蛋白酶与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。在某些此类实施方案中,该方法是体外方法。
在某些实施方案中,本发明涉及一种抑制半胱氨酸蛋白酶的体外方法,该方法包括使生物样品与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。
在某些实施方案中,本发明涉及一种抑制获自受试者的生物样品中的半胱氨酸蛋白酶的方法,该方法包括使生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触。
在某些实施方案中,本发明涉及一种抑制受试者中的半胱氨酸蛋白酶的体内方法,该方法包括向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物。在某些此类实施方案中,化合物或其盐或组合物经静脉内施用。
在如本文所述的抑制半胱氨酸蛋白酶的方法的某些实施方案中,如本文所述的式I的化合物不包含可检测元件,诸如荧光标记、生物素标记、放射性标记、螯合剂和生物正交连接手柄。
半胱氨酸蛋白酶
在如本文所述的检测半胱氨酸蛋白酶活性的方法中,以及在如本文所述的抑制半胱氨酸蛋白酶的方法中,半胱氨酸蛋白酶可例如为哺乳动物半胱氨酸蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是人半胱氨酸蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是哺乳动物半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是人半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是组织蛋白酶S和/或组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是哺乳动物组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是人组织蛋白酶X。
在如本文所述的检测半胱氨酸蛋白酶活性的方法的某些实施方案中,检测到组织蛋白酶X活性,并且未检测到组织蛋白酶B活性和/或组织蛋白酶L活性。在某些实施方案中,检测到组织蛋白酶X活性和组织蛋白酶S活性,并且未检测到组织蛋白酶B活性和/或组织蛋白酶L活性。
在如本文所述的抑制半胱氨酸蛋白酶的方法的某些实施方案中,组织蛋白酶X受到抑制,并且组织蛋白酶B和/或组织蛋白酶L未受到抑制。在某些实施方案中,组织蛋白酶X和组织蛋白酶S受到抑制,并且组织蛋白酶B和/或组织蛋白酶L未受到抑制。
在如本文所述的检测半胱氨酸蛋白酶活性的体外方法中,可以例如通过使等分试样的探针标记的样品经受免疫沉淀测试(例如,采用对相应半胱氨酸蛋白酶(例如组织蛋白酶X)特异性的抗体进行拉式沉淀(pulldown))来验证标记的蛋白质的身份。
诊断方法和用于诊断的相应化合物/组合物
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括:
(1)使获自受试者的生物样品在体外与如本文所述的式I的化合物或其盐或者与如本文所述的组合物接触,以及
(2)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“(体外)检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“在先给药给受试者情况下的(体外)检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法,该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐或者如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“体内检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐,
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“在先给药给受试者情况下的(体外)检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种如本文所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的组合物。
(2)随后从受试者获得生物样品;以及
(3)随后对生物样品进行分析,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“在先给药给受试者情况下的(体外)检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的式I的化合物或其盐,以及
(2)随后检查受试者,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“体内检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
在某些实施方案中,本发明涉及一种如本文所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中该方法包括:
(1)向受试者施用如本文所述的组合物,以及
(2)随后检查受试者,包括测量可检测信号。
在某些此类实施方案中,该方法包括根据本文的“体内检测方法”部分中所述的任何方法来检测半胱氨酸蛋白酶活性。
生物样品
在某些实施方案中,生物样品选自细胞、细胞裂解物、组织样本、组织裂解物和体液。在某些实施方案中,生物样品是细胞裂解物或组织裂解物,诸如澄清细胞裂解物或澄清组织裂解物。在某些实施方案中,生物样品是活细胞。在如上所述的检测方法的某些实施方案中,分别在步骤(1)与步骤(2)之间,以及步骤(2)与(3)之间使活细胞裂解并且澄清。在某些实施方案中,生物样品获自人类受试者。
在某些实施方案中,生物样品获自受试者的口腔(诸如口腔粘膜)、肺、脑、脊髓、胰腺、胃、前列腺、肝、骨髓、结肠(诸如末端结肠或近侧结肠)、直肠、乳腺、皮肤、粘膜或粘液,或获自受试者(诸如哺乳动物,并且更特别地人类受试者)的粪便或痰液。生物样品可为获自受试者的口腔、肺、脑、脊髓、胰腺、胃、前列腺、肝、骨髓、结肠(诸如末端结肠或近侧结肠)、直肠、乳腺、皮肤、或粘膜或粘液的肿瘤组织。
在某些此类实施方案中,生物样品获自受试者的口腔(诸如口腔粘膜)。在某些此类实施方案中,生物样品是细胞裂解物或组织裂解物。在某些实施方案中,生物样品是口腔活体组织切片。在某些实施方案中,生物样品是口腔粘膜活体组织切片。
在某些实施方案中,生物样品获自受试者的胃肠道。在某些此类实施方案中,生物样品是细胞裂解物或组织裂解物。在某些此类实施方案中,生物样品是口腔活体组织切片、食道样本、胃样本、小肠样本、结肠样本、近侧结肠样本、末端结肠样本、直肠样本、粪便样本或粘膜活体组织切片。在生物样品获自受试者的胃肠道的某些实施方案中,生物样品是选自口腔粘膜活体组织切片、食道粘膜活体组织切片、小肠粘膜活体组织切片、结肠粘膜活体组织切片或直肠粘膜活体组织切片的粘膜活体组织切片。
在某些实施方案中,生物样品获自受试者的结肠(诸如末端结肠或近侧结肠)。在某些此类实施方案中,生物样品是细胞裂解物或组织裂解物。在某些实施方案中,生物样品是结肠活体组织切片。在某些实施方案中,生物样品是结肠粘膜活体组织切片。在生物样品获自结肠的某些实施方案中,生物样品是粪便样本。
在某些实施方案中,生物样品获自受试者的前列腺。在某些此类实施方案中,生物样品是细胞裂解物或组织裂解物。在某些实施方案中,生物样品是前列腺活体组织切片。
在某些实施方案中,生物样品可为获自女性受试者(特别是女性人类受试者)的乳房的细胞、细胞裂解物、组织样本和组织裂解物。
在某些实施方案中,生物样品是选自口腔活体组织切片、肺样本、脑样本、脊髓样本、胰腺样本、胃样本、前列腺样本、肝样本、骨髓样本、结肠样本(诸如末端结肠样本和近侧结肠样本)、直肠样本、乳房样本、皮肤样本、粘膜活体组织切片、粪便样本、痰液样品和肿瘤样本的组织裂解物。
治疗方法和用于治疗的相应化合物/组合物
在某些实施方案中,本发明涉及一种治疗与半胱氨酸蛋白酶活性相关的疾病的方法,该方法包括向有此需要的患者施用治疗有效量的如本文所述的式I的化合物,或者治疗有效量的如本文所述的组合物。
在某些实施方案中,本发明涉及一种如本文所述的式I的化合物,其在治疗与半胱氨酸蛋白酶活性相关的疾病中使用。
在某些实施方案中,本发明涉及一种用于治疗与半胱氨酸蛋白酶活性相关的疾病的组合物,该组合物包含如本文所述的式I的化合物和载体。
在某些实施方案中,本发明涉及如本文所述的式I的化合物在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
在某些实施方案中,本发明涉及如本文所述的组合物在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
在某些上述实施方案中,如本文所述的式I的化合物在治疗疾病中施用或使用(或用于治疗疾病)时不包含可检测元件,诸如荧光标记、生物素标记、放射性标记、螯合剂和生物正交连接手柄。
疾病
在某些实施方案中,与半胱氨酸蛋白酶活性相关的疾病(待诊断或待治疗)选自乳糜泻、胃肠蠕动紊乱、疼痛、瘙痒、皮肤病(诸如特应性皮炎)、饮食诱导的肥胖、代谢障碍(包括但不限于非酒精性脂肪肝炎(NASH)、肝和胰腺疾病)、哮喘、类风湿性关节炎、牙周炎、炎性疾病(包括炎性GI障碍,诸如炎性肠道病)、功能性GI障碍(诸如肠易激综合征、功能性胸痛、功能性消化不良、恶心和呕吐障碍、功能性便秘、功能性腹泻、大便失禁、功能性肛门直肠痛和功能性排便障碍)、癌症、纤维化疾病、代谢功能异常、神经疾病和神经变性疾病。
在某些实施方案中,与半胱氨酸蛋白酶活性相关的疾病(待诊断或待治疗)选自癌症、炎性疾病和神经变性疾病。
在某些实施方案中,疾病(待诊断或待治疗)是选自乳腺癌、脑癌(脑胶质瘤)、骨髓癌、胰腺癌、肺癌、前列腺癌、肝癌(肝细胞癌)、口腔癌、结肠直肠癌和胃癌的癌症。
在某些实施方案中,疾病(待诊断或待治疗)是选自炎性GI障碍、胰腺炎和感染的炎性疾病。在某些此类实施方案中,炎性GI障碍选自炎性肠道病、传染性腹泻、肠系膜缺血、憩室炎和坏死性小肠结肠炎(NEC)。在某些实施方案中,炎性GI障碍是炎性肠道病。在某些实施方案中,炎性肠道病选自溃疡性结肠炎、克罗恩氏病、改道性结肠炎、未确定型结肠炎和囊炎、微小性结肠炎、免疫肿瘤学结肠炎、化疗/放射性结肠炎、移植物抗宿主病(GvHD)结肠炎、急性结肠炎、贝赛特氏症、胶原性结肠炎、淋巴细胞结肠炎。在某些实施方案中,炎性GI障碍选自溃疡性结肠炎和克罗恩氏病。
在某些实施方案中,疾病(待诊断或待治疗)是选自溃疡性结肠炎、克罗恩氏病、改道性结肠炎、未确定型结肠炎和囊炎、微小性结肠炎、免疫肿瘤学结肠炎、化疗/放射性结肠炎、移植物抗宿主病(GvHD)结肠炎、急性结肠炎、贝赛特氏症、胶原性结肠炎、淋巴细胞结肠炎、传染性腹泻、肠系膜缺血、憩室炎和坏死性小肠结肠炎(NEC)、胰腺炎和感染的炎性疾病。
在某些实施方案中,疾病(待诊断或待治疗)是选自炎性肠道病的炎性疾病。在某些此类实施方案中,炎性肠道病是溃疡性结肠炎或克罗恩氏病。
在某些实施方案中,疾病(待诊断或待治疗)是选自阿尔茨海默病、多发性硬化症和神经性疼痛的神经变性疾病。
在涉及诊断疾病的某些实施方案中,其中疾病是乳腺癌,生物样品是如上所述从受试者的乳房(例如从位于乳房中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是脑癌,生物样品是如上所述从受试者的脑(例如从位于脑中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是骨髓癌,生物样品是如上所述从受试者的骨髓(例如从位于骨髓中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是胰腺癌,生物样品是如上所述从受试者的胰腺(例如从位于胰腺中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是肺癌,生物样品是如上所述从受试者的肺(例如从位于肺中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是前列腺癌,生物样品是如上所述从受试者的前列腺(例如从位于前列腺中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是肝癌,生物样品是如上所述从受试者的肝(例如从位于肝中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是口腔癌,生物样品是如上所述从受试者的口腔(例如从位于口腔中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是结肠直肠癌,生物样品是如上所述从受试者的结肠或直肠(例如从位于结肠或直肠中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是胃癌,生物样品是如上所述从受试者的胃(例如从位于胃中的肿瘤组织)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是炎性GI障碍或功能性GI障碍,生物样品是如上所述从受试者的胃肠道(诸如结肠)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是炎性肠道病,生物样品是如上所述从受试者的胃肠道(诸如结肠)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是溃疡性结肠炎、克罗恩氏病、改道性结肠炎、未确定型结肠炎和囊炎、微小性结肠炎、免疫肿瘤学结肠炎、化疗/放射性结肠炎、移植物抗宿主病(GvHD)结肠炎、急性结肠炎、贝赛特氏症、胶原性结肠炎、淋巴细胞结肠炎、传染性腹泻、肠系膜缺血、憩室炎或坏死性小肠结肠炎(NEC),生物样品是如上所述从受试者的胃肠道(诸如结肠)获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是胰腺炎,生物样品是如上所述从受试者的胰腺获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是感染,生物样品是如上所述从受试者的感染区域或身体部分获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是阿尔茨海默病,生物样品是如上所述从受试者的脑获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是多发性硬化症,生物样品是如上所述从受试者的脑获得的样品。
在涉及诊断疾病的某些实施方案中,其中疾病是神经性疼痛,生物样品是如上所述从受试者的脊髓获得的样品。
在某些实施方案中,生物样品包括获自受试者的病理组织(例如肿瘤组织、炎症组织和/或感染组织)的样品。在某些实施方案中,生物样品包括获自受试者的病理组织的样品,以及获自同一受试者的正常(非病理)组织的样品作为对照。
在某些实施方案中,疾病(待诊断或待治疗)是口腔癌。在某些此类实施方案中,口腔癌是口腔鳞状细胞癌。为了诊断口腔癌诸如口腔鳞状细胞癌,生物样品可为获自受试者的口腔,例如位于口腔中的肿瘤组织的组织样本(组织裂解物)。在某些此类实施方案中,生物样品是获自受试者的口腔粘膜活体组织切片(例如,包括来自同一受试者的肿瘤组织和正常(非病理)组织的活体组织切片)。
在某些实施方案中,与半胱氨酸蛋白酶活性相关的疾病是其中半胱氨酸蛋白酶为哺乳动物半胱氨酸蛋白酶的与半胱氨酸蛋白酶活性相关的疾病。在某些实施方案中,半胱氨酸蛋白酶是人半胱氨酸蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是哺乳动物半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是人半胱氨酸组织蛋白酶。在某些实施方案中,半胱氨酸蛋白酶是组织蛋白酶S和/或组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是哺乳动物组织蛋白酶X。在某些实施方案中,半胱氨酸蛋白酶是人组织蛋白酶X。
在某些实施方案中,与半胱氨酸蛋白酶活性相关的疾病是与组织蛋白酶X活性相关的疾病。
经由氧化锍叶立德中间体合成氯甲基酮
许多报道的针对半胱氨酸蛋白酶的基于活性的探针引入了酰氧基甲基酮(AOMK)或苯氧基甲基酮(PMK)弹头(Edgington等人,2009;2012;2013;Oresic Bender等人,2015;Verdoes等人,2013;2012)。这些亲电体的合成需要生成氯甲基酮中间体,这是历史上已通过生成重氮甲烷(极具爆炸性的黄色气体)实现的过程。本发明人现在已发现了经由氧化锍叶立德中间体获得氯甲基酮的新合成路线(方案2),其不需要生成重氮甲烷,由此避免了该潜在危险反应并因此提供了比先前使用的方法更安全的备选方案。该方法还规避了对N-甲基-N-亚硝基-对甲苯磺酰胺
因此,在某些实施方案中,本发明涉及一种用于制备带有氯甲基酮部分的化合物的方法,该方法包括使带有氧化锍叶立德部分的化合物反应,以产生带有氯甲基酮部分的化合物。
在某些实施方案中,本发明涉及一种用于制备带有作为弹头的酰氧基甲基酮部分或苯氧基甲基酮部分的基于活性的探针化合物的方法,该方法包括(i)通过使带有氧化锍叶立德部分的化合物反应以产生带有氯甲基酮部分的化合物,从而制备带有氯甲基酮部分的中间体化合物,以及
(ii)进一步处理带有氯甲基酮部分的化合物,以产生所述基于活性的探针化合物。
在某些上述实施方案中,该方法包括使带有氧化锍叶立德部分的化合物与盐酸反应,以产生带有氯甲基酮部分的化合物。在某些此类实施方案中,使带有氧化锍叶立德部分的化合物与盐酸在升高的温度下反应。在某些此类实施方案中,使带有氧化锍叶立德部分的化合物与盐酸在有机溶剂中在升高的温度下反应。在某些此类实施方案中,有机溶剂包括醚诸如四氢呋喃。
在某些实施方案中,氧化锍叶立德部分具有式(IV)
[化学式.32]
其中
R
R
使用上述改进的方法,已经成功地生成了带有Lys、Phe和Nle的三种AOMK探针,这表明该方法可广泛地应用于各种ABP的合成。所合成的AOMK探针与带有相同识别序列的氧化锍叶立德探针的比较显示出,相应的氧化锍叶立德探针比酰氧基甲基酮类似物更有效且更具特异性,这进一步验证了新氧化锍叶立德弹头的实用性。因此,氧化锍叶立德探针代表了可用于研究半胱氨酸蛋白酶诸如组织蛋白酶X的功能的工具的明显进步。
在另一方面,本发明涉及一种具有选自由以下式的组的式的化合物:
[化学式.33]
[化学式.34]
[化学式.35]
或它们的盐。
优选实施方案的具体实施方式
现在参考所附的实施例更全面地描述本发明。然而,应当理解,以下描述仅是说明性的,而不应以任何方式视为对本发明的限制。
实施例
化合物的合成和表征
一般信息
所有试剂均购自商业供应商且不经进一步纯化即进行使用。
磺基-Cy5(游离羧酸形式)购自W&J Pharmachem。
使用的所有溶剂均为HPLC级。所有水敏性反应在无水溶剂中氩气气氛下进行。
利用结合有Waters 486UV检测器的Waters 600半制备型HPLC,在PhenomenexLuna C-8柱(
使用与BACS 60样品自动更换器联接的Bruker Avance III Nanobay光谱仪获得核磁共振(NMR)光谱。光谱仪配备有5mm PABBO BB-1H/D Z-GRD探针。
碳核磁共振(
液相色谱质谱(LCMS)在Agilent UHPLC/MS 1260仪器(泵:1200系列G1311A四元泵,自动采样器:1200系列G1329A恒温自动采样器,检测器:1200系列G1314B可变波长检测器)上进行。洗脱特征为5-100%B的线性梯度,在2.5min内,流速为0.5mL/min。溶剂A:水0.1%甲酸,溶剂B:乙腈0.1%甲酸。液相色谱条件;反相HPLC分析,柱:Poroshell 120EC-C183.0×50mm2.7-微米,柱温:35℃,进样体积:1uL,检测:254nm和214nm下监测。质谱条件离子源:四极,离子模式:API-ES,干燥气体温度:350℃。主离子峰(m/z)以括号中基峰的强度报告。
高分辨质谱(HRMS)在与Agilent 1290Infinity(Agilent,Palo Alto,CA)联接的Agilent 6224TOF LC/MS质谱仪上进行。获得所有数据,并且基准质量经由双喷雾电喷雾离子化(ESI)源校正。质谱仪条件:离子化模式:电喷雾离子化干燥气体流速:11L/min,溶剂A=0.1%甲酸水溶液,溶剂B=乙腈/0.1%甲酸。记录实测和理论离子峰(m/z)。
所有分析型HPLC分析在与1260脱气器联接的Agilent 1260Infinity分析型HPLC上进行:G1322A,1260二元泵:G1312B,1260HiP ALS自动采样器:G1367E,1260TCC:G1316A以及1260DAD检测器:G4212B。所用的柱是Zorbax Eclipse Plus C18 Rapid Resolution 4.6×100mm3.5-微米。样品进样体积为2μL,其在含0.1%TFA的乙腈中以5-100%的梯度在10min内按1mL/min的流速运行。检测方法采用214nm和254nm。
实施例1:氧化锍叶立德化合物的合成
具有氧化锍叶立德弹头的化合物(sCy5-AA-SY探针)根据方案1并根据以下所述的通用方法A、B和E进行合成。
[化学式.36]
方案1.sCy5-AA-SY探针的合成.i)氯甲酸4-硝基苯基酯、Et
通用方法A:硝基苯酯的制备.
将三乙胺(1.2当量)添加到Boc保护的氨基酸(1当量)的CH
通用方法B:氧化锍叶立德的制备
使碘化三甲基氧化锍(4当量)悬浮于无水THF(5mL)中并且添加KO
通用方法E:氧化锍叶立德的磺基-花菁5标记.
将boc保护的氧化锍叶立德(1当量)用TFA和CH
(叔丁氧羰基)-L-缬氨酸4-硝基苯基酯(SJM-724-20)
[化学式.37]
将冰冷的无水DMF(20mL)缓慢地添加到氯甲酸4-硝基苯基酯(2.27g,11.2mmol)中并在氮气气氛下搅拌10min。然后使混合物逐渐温热至环境温度。滴加boc-L-缬氨酸(2.02g,9.30mmol)的DMF(7mL)溶液,继之以三乙胺(1.50mL,10.8mmol)。继续搅拌1h。将反应混合物用EtOAc(50mL)稀释并用H
(叔丁氧羰基)-L-异亮氨酸4-硝基苯基酯(SJM-724-64)
[化学式.38]
标题化合物经由方法A由boc-L-异亮氨酸(200mg,0.86mmol)、氯甲酸4-硝基苯基酯(209mg,1.04mmol)、DMAP(11mg,0.09mmol)和Et
(叔丁氧羰基)-L-亮氨酸4-硝基苯基酯(SJM-724-76)
[化学式.39]
标题化合物经由方法A由boc-L-亮氨酸(200mg,0.86mmol)、氯甲酸4-硝基苯基酯(209mg,1.04mmol)、DMAP(11mg,0.09mmol)和Et
(S)-2-((叔丁氧羰基)氨基)己酸4-硝基苯基酯(SJM-724-116)
[化学式.40]
标题化合物经由方法A由boc-L-正亮氨酸(200mg,0.86mmol)、氯甲酸4-硝基苯基酯(209mg,1.04mmol)、DMAP(11mg,0.09mmol)和Et
(叔丁氧羰基)-L-苯丙氨酸4-硝基苯基酯(SJM-724-68)
[化学式.41]
标题化合物经由方法A由boc-L-苯丙氨酸(200mg,0.75mmol)、氯甲酸4-硝基苯基酯(182mg,0.90mmol)、DMAP(9mg,0.08mmol)和Et
(叔丁氧羰基)-L-色氨酸4-硝基苯基酯(SJM-724-112)
[化学式42]
标题化合物经由方法A由boc-L-色氨酸(200mg,0.66mmol)、氯甲酸4-硝基苯基酯(159mg,0.79mmol)、DMAP(8mg,0.07mmol)和Et
N
[化学式43]
将冰冷的无水DMF(20mL)缓慢地添加到氯甲酸4-硝基苯基酯(1.27g,6.31mmol)中并在氮气气氛下搅拌10min。然后使混合物逐渐温热至环境温度。滴加N
(叔丁氧羰基)-L-苯丙氨酰-L-缬氨酸(MS-4-178)
[化学式44]
使Fmoc-Val-OH(679mg,2.0mmol)溶解于DCM和三乙胺(842μL,6.0mmol)的溶液中并添加到2-氯三苯甲基树脂(1.0g,1mmol)(1毫当量/g)中。将混合物在环境温度下振荡1h。用DCM(3×5mL)洗涤树脂。将MeOH(1mL)在DCM(5mL)和三乙胺(0.5mL)中的溶液添加到树脂,并且在环境温度下振荡30min。Fmoc脱保护通过用含20%哌啶的DMF处理10分钟、然后用DMF(3×5mL)洗涤来进行。使Boc-Phe-OH(531mg,2.0mmol)和PyBOP(1.04g,2.0mmol)溶解于DCM和三乙胺(842μL,6.0mmol)的溶液中并且添加到树脂中。将混合物在环境温度下振荡1h,然后排水,用DCM(3×5mL)洗涤并真空干燥。通过用包含1%TIPS的溶于DCM的20%HFIP处理2h,使二肽从树脂上裂解下来。过滤树脂,使滤液在真空下减少,以得到粗产物(180mg)。
4-硝基苯基(叔丁氧羰基)-L-苯丙氨酰-L-缬氨酸酯(MS-4-182)
[化学式45]
在0℃下,向氯甲酸4-硝基苯基酯(116mg,0.58mmol)的无水THF(1mL)溶液中添加无水DMF(150μL)。将反应在氮气气氛下搅拌10min,然后逐渐温热至环境温度。将(叔丁氧羰基)-L-苯丙氨酰-L-缬氨酸(175mg,0.48mmol)在THF(1mL)和三乙胺(80μL)中的溶液滴加到以上悬浮液中。继续搅拌20min。将反应混合物用EtOAc稀释并用H
实施例1.2.氧化锍叶立德化合物的合成和表征
(S)-(1-(二甲基(氧代)-λ
[化学式.46]
标题化合物经由方法B由(叔丁氧羰基)-L-缬氨酸4-硝基苯基酯(SJM-724-20)(100mg,0.30mmol)制备。将所得的粗产物通过柱色谱(SiO
((3S,4S)-1-(二甲基(氧代)-λ
[化学式.47]
标题化合物经由方法B由(叔丁氧羰基)-L-异亮氨酸4-硝基苯基酯(SJM-724-64)(200mg,0.57mmol)制备。将所得的粗产物通过柱色谱(SiO
(S)-(1-(二甲基(氧代)-λ
[化学式.48]
标题化合物经由方法B由(叔丁氧羰基)-L-亮氨酸4-硝基苯基酯(SJM-724-76)(170mg,0.48mmol)制备。将所得的粗产物通过柱色谱(SiO
(S)-(1-(二甲基(氧代)-λ
(SJM-724-124)
[化学式.49]
标题化合物经由方法B由(S)-2-((叔丁氧羰基)氨基)己酸4-硝基苯基酯(SJM-724-116)(170mg,0.48mmol)制备。将所得的粗产物通过柱色谱(SiO
(S)-(4-(二甲基(氧代)-λ
[化学式.50]
标题化合物经由方法B由(叔丁氧羰基)-L-苯丙氨酸4-硝基苯基酯(SJM-724-68)(200mg,0.75mmol)制备。将所得的粗产物通过柱色谱(SiO
(S)-(4-(二甲基(氧代)-λ
[化学式.51]
标题化合物经由方法B由(叔丁氧羰基)-L-色氨酸4-硝基苯基酯(SJM-724-112)(170mg,0.40mmol)制备。将所得的粗产物通过柱色谱(SiO
(7-(二甲基(氧代)-λ
[化学式.52]
标题化合物经由方法B由N
((S)-1-(((S)-1-(二甲基(氧代)-λ
[化学式.53]
标题化合物经由方法B由(叔丁氧羰基)-L-苯丙氨酰-L-缬氨酸4-硝基苯基酯(MS-4-182)(200mg,0.41mmol)制备。将所得的粗产物通过柱色谱(SiO
实施例1.3:氧化锍叶立德探针的合成和表征
sCy5-Val-SY(SJM-724-28)
[化学式.54]
标题化合物经由方法E由(S)-(1-(二甲基(氧代)-λ
sCy5-Ile-SY(SJM-724-104)
[化学式.55]
标题化合物经由方法E由((3S,4S)-1-(二甲基(氧代)-λ
sCy5-Leu-SY(SJM-724-128)
[化学式.56]
标题化合物经由方法E由(S)-(1-(二甲基(氧代)-λ
sCy5-Nle-SY(SJM-724-132)
[化学式.57]
标题化合物经由方法E由(S)-(1-(二甲基(氧代)-λ
sCy5-Phe-SY(SJM-724-80)
[化学式.58]
标题化合物经由方法E由(S)-(4-(二甲基(氧代)-λ
sCy5-Trp-SY(SJM-724-80)
[化学式.59]
标题化合物经由方法E由(S)-(4-(二甲基(氧代)-λ
Cbz-Lys(sCy5)-SY(SJM-724-100)
[化学式.60]
标题化合物经由方法E由(7-(二甲基(氧代)-λ
sCy5-Phe-Val-SY(MS-4-191)
[化学式.61]
标题化合物经由方法E由((S)-1-(((S)-1-(二甲基(氧代)-λ
实施例2:酰氧基甲基酮(AOMK)的合成
具有酰氧基甲基酮(AOMK)弹头的化合物(sCy5-AA-AOMK探针)根据方案2并根据以下所述的通用方法C、D和E进行合成。
[化学式.62]
方案2.经由氧化锍叶立德中间体合成sCy5-AA-AOMK探针.i)4M HCl的二氧杂环己烷中、THF,回流,4h。ii)2,6-二甲基苯甲酸、KF、DMF,室温,18h。iii)TFA/CH
通用方法C:氯甲基酮的制备.
向氧化锍叶立德(1当量)的无水THF(5mL)溶液中添加含4M HCl的二氧杂环己烷(1.15当量)。将溶液回流搅拌4h。真空移除溶剂,并将残余物用EtOAc(20mL)处理并用H
通用方法D:酰氧基甲基酮(AOMK)的制备.
使氟化钾(3当量)悬浮于DMF(1mL)中并且超声波处理1min。将2,6-二甲基苯甲酸(1.1当量)添加到悬浮液中并在环境温度下搅拌5min。添加氯甲基酮(1当量)并将混合物在环境温度下搅拌18h。真空移除DMF,并且将所得的残余物用EtOAc(20mL)处理并用饱和NaHCO
通用方法E:酰氧基甲基酮(AOMK)的磺基-花菁5标记.
将boc保护的酰氧基甲基酮(AOMK)(1当量)用TFA和CH
实施例2.1:中间体氯甲基酮的合成和表征
(S)-(1-氯-2-氧代庚-3-基)氨基甲酸叔丁酯(SJM-724-148)
[化学式.63]
标题化合物经由方法C由(S)-(1-(二甲基(氧代)-λ
(S)-(4-氯-3-氧代-1-苯基丁-2-基)氨基甲酸叔丁酯(SJM-724-152)
[化学式.64]
标题化合物经由方法C由(S)-(4-(二甲基(氧代)-λ
(7-氯-6-氧代庚烷-1,5-二基)(S)-二氨基甲酸苄基·叔丁酯(SJM-724-52)
[化学式.65]
标题化合物经由方法C由(7-(二甲基(氧代)-λ
实施例2.2:酰氧基甲基酮(AOMK)的合成和表征
2,6-二甲基苯甲酸(S)-3-((叔丁氧羰基)氨基)-2-氧代庚基酯(SJM-724-156)
[化学式.66]
标题化合物经由方法D由(S)-(1-氯-2-氧代庚-3-基)氨基甲酸叔丁酯(SJM-724-148)(20mg,76μmol)制备。将所得的粗产物通过柱色谱(SiO
2,6-二甲基苯甲酸(S)-3-((叔丁氧羰基)氨基)-2-氧代-4-苯基丁基酯(SJM-724-172)
[化学式.67]
标题化合物经由方法D由(S)-(4-氯-3-氧代-1-苯基丁-2-基)氨基甲酸叔丁酯(SJM-724-152)(25mg,84μmol)制备。将所得的粗产物通过柱色谱(SiO
2,6-二甲基苯甲酸(S)-3-(((苄氧基)羰基)氨基)-7-((叔丁氧羰基)氨基)-2-氧代庚基酯(SJM-724-176)
[化学式.68]
标题化合物经由方法D由(7-氯-6-氧代庚烷-1,5-二基)(S)-二氨基甲酸苄基·叔丁酯(SJM-724-52)(50mg,121μmol)制备。将所得的粗产物通过柱色谱(SiO
实施例2.3:酰氧基甲基酮(AOMK)探针的合成和表征
sCy5-Nle-AOMK(SJM-724-160)
[化学式.69]
标题化合物经由方法E由(S)-3-((叔丁氧羰基)氨基)-2-氧代庚基2,6-二甲基苯甲酸酯(SJM-724-156)(8mg,21μmol)制备。将所得的粗产物通过RP-HPLC纯化并冻干,以得到呈蓝色固体的产物(13.9mg,72%)。HRMS(ESI
sCy5-Phe-AOMK(SJM-724-180)
[化学式.70]
标题化合物经由方法E由(S)-3-((叔丁氧羰基)氨基)-2-氧代-4-苯基丁基2,6-二甲基苯甲酸酯(SJM-724-172)(5mg,12μmol)制备。将所得的粗产物通过RP-HPLC纯化并冻干,以得到呈蓝色固体的产物(6.5mg,56%)。HRMS(ESI
Cbz-Lys(sCy5)-AOMK(SJM-724-184)
[化学式.71]
标题化合物经由方法E由(S)-3-(((苄氧基)羰基)氨基)-7-((叔丁氧羰基)氨基)-2-氧代庚基2,6-二甲基苯甲酸酯(SJM-724-176)(5mg,9μmol)制备。将所得的粗产物通过RP-HPLC纯化并冻干,以得到呈蓝色固体的产物(6.5mg,64%)。HRMS(ESI
探针的测试
一般信息
方法
[表1]
关键资源表
实验模型和受试者细节
细胞培养物
使RAW264.7或MDA-MB-231
动物
所有涉及动物的实验均由莫纳什大学动物伦理委员会(Monash UniversityAnimal Ethics Committee)批准。雄性C57BL/6J小鼠获自莫纳什动物研究平台(MonashAnimal Research Platform),并在8-10周龄时使用。根据卡尔加里大学动物护理和使用委员会(University of Calgary Animal Care and Use Committee),从卡尔加里大学获得野生型和组织蛋白酶X敲除小鼠的速冻脾,如(Sevenich等人,2010)中所述。
方法细节
细胞裂解物标记和SDS-PAGE分析
通过刮取收获细胞,用PBS洗涤一次,重悬于包含50mM柠檬酸盐[pH 5.5]、0.5%CHAPS、0.1%Triton X-100和4mM DTT的裂解缓冲液中。在间歇涡旋下,使细胞在冰上孵育至少10分钟,然后离心(21g,在4℃下,5分钟内)。然后将澄清的上清液转移至新管中,并且通过BCA测定蛋白浓度。将总蛋白(50μg)等分到管中,最终体积为20μl裂解缓冲液。在指定的情况下,添加来自100x DMSO储备液的JPM-OEt或MDV-590,并且在添加探针之前在37℃下温育20分钟。添加来自100x DMSO储备液的指示浓度的探针。标记在37℃下进行20分钟(除非另外指明),并且通过添加5x样品缓冲液(200mM Tris-Cl[pH 6.8]、8%SDS、0.04%溴酚蓝、5%β-巯基乙醇和40%甘油)淬灭反应。然后将样品煮沸五分钟,并且使蛋白质在15%SDS-PAGE凝胶上进行解析。在Typhoon 5平板激光扫描仪上以633/670nm激发/发射扫描凝胶,以检测sCy5荧光。
活细胞标记
将RAW细胞或MDA-MB-231
组织分析
从健康小鼠收获组织并速冻。在分析的时候,以10x体积:重量添加裂解缓冲液,并在冰上超声处理组织。用指定的探针标记澄清裂解液,并如上进行分析。
对于体内标记的组织,首先经由尾静脉对小鼠经静脉内注射sCy5-Nle-SY、BMV109或sCy5-Nle-AOMK(50nmol,在100μl 10%DMSO/PBS或载体对照中)。除了不进一步添加探针之外,如上收获组织并分析。
免疫沉淀测定
将来自以上的探针标记的裂解物(在样品缓冲液中)分为输入或下拉式(各~50μg总蛋白)。将输入样品储存于-20℃。将下拉式沉淀样品在500μlIP缓冲液(PBS[pH 7.4]、0.5%NP-40、1mM EDTA)中稀释。将山羊抗组织蛋白酶X抗体(10μL)与40μl预洗涤的蛋白A/G琼脂糖珠的浆液一起加入。使样品在4℃旋转过夜。然后用IP缓冲液洗涤小珠四次,接着在0.9%NaCl中最终洗涤。然后使小珠重悬于2x样品缓冲液中并煮沸。将下拉式沉淀上清液与输入样品通过如上荧光SDS-PAGE进行分析。
共聚焦显微镜
使得自接受上述sCy5-Nle-SY(或载体对照)的小鼠的肾组织在含4%低聚甲醛的PBS中固定过夜,然后在30%蔗糖中冷冻保护过夜。将组织包埋在OCT中,在干冰上冷冻,并以10μm切片。组织蛋白酶X的免疫染色根据标准方案进行。简而言之,将切片空气干燥,在冷丙酮中固定10分钟,再次空气干燥,然后在PBS中再水化。在含有3%正常马血清和0.1%Triton X-100的PBS中封闭切片。将山羊抗组织蛋白酶X以1:100添加在封闭缓冲液中,在4℃下过夜。然后将切片洗涤,并在室温下以1:500添加二抗即驴抗山羊-AlexaFluor594保持1小时。将切片用DAPI染色5分钟,洗涤,并用ProLong Diamond固定。染色使用Leica SP8倒置共聚焦显微镜进行分析。
实施例3——用sCy5-Val-SY在细胞裂解物中标记
在实施例3中,将氧化锍叶立德探针sCy5-Val-SY与由RAW264.7细胞(即包含高水平的活性半胱氨酸组织蛋白酶的永生化小鼠巨噬细胞系)制备的蛋白裂解物一起温育(Verdoes等人,2013)。使细胞在柠檬酸盐缓冲液(pH5.5)中裂解,以提供组织蛋白酶活化的最佳条件,并如下添加探针:
-以1μM进行20分钟,
-在各种浓度(0μM、0.01μM、0.05μM、0.1μM、0.5μM或1μM)下进行20分钟;或
-在1μM下进行不同的时间(0、1、2、5、10、20和30分钟)。
然后,通过SDS-PAGE解析裂解物,并使用平板激光扫描仪扫描凝胶的sCy5荧光。观察到~35-KDa蛋白酶的专有的浓度和时间依赖性标记(图2A、图2A-1和图2A-2)。该标记通过用泛半胱氨酸组织蛋白酶抑制剂JPM-OEt预处理裂解物而被阻止,证实了该蛋白酶是半胱氨酸组织蛋白酶家族的成员(图2A)。相比之下,MDV-590——组织蛋白酶S的特异性抑制剂——不竞争sCy5-Val-SY的结合。
通过使用以1μM添加20分钟的BMV109作为探针重复以上实验,将sCy5-Val-SY的标记特征与泛组织蛋白酶探针BMV109进行比较。据发现sCy5-Val-SY标记的蛋白酶与BMV109标记的组织蛋白酶X具有相同的分子量(Verdoes等人,2013)。据证实,通过用组织蛋白酶X特异性抗体免疫沉淀sCy5-Val-SY标记的裂解物(以1μM添加sCy5-Val-SY保持20分钟),该蛋白酶实际是组织蛋白酶X(图2B)。
实施例4——用sCy5-Val-SY在组织裂解物中标记
在实施例4中,测试了sCy5-Val-SY标记小鼠脾裂解物(来自野生型小鼠或组织蛋白酶X缺陷小鼠)中的组织蛋白酶X的能力(以1μM添加探针保持20分钟)。如在巨噬细胞裂解物中所观察,该探针表现出与得自野生型小鼠的脾裂解物中的组织蛋白酶X的专一反应性,并且该标记在由组织蛋白酶X缺陷小鼠的脾制备的裂解物中不存在(图2C)。相比之下,BMV109(以1μM添加保持20分钟)较强地标记组织蛋白酶B并且较小程度地标记组织蛋白酶S和L(图2C)。
因此,实施例3和4的结果表明sCy5-Val-SY在细胞和组织裂解物中的专一特异性。
实施例5——用sCy5-Val-SY在活细胞中标记
在实施例5中,评价了sCy5-Val-SY探针的渗透性及其在活RAW264.7细胞中的特异性特征,并与BMV109探针进行比较。在探针(在1μM下)与活细胞一起孵育递增的时间长度(0、1、5、10、15、25、35、45、55、65、90和120分钟)或探针以递增的探针浓度(0μM、0.01μM、0.05μM、0.1μM、0.5μM和1μM各2小时)与活细胞一起孵育之后,如上通过胶内荧光分析裂解物。在此,观察到两种蛋白酶的时间和浓度依赖性标记(图2D、图2D-1)。通过免疫沉淀(图2E)以及与MDV-590(图2F)的竞争,刚提及的两者分别被鉴定为组织蛋白酶X和S。
令人惊奇地观察到活细胞中的组织蛋白酶S标记,鉴于其缺乏与细胞裂解物中sCy5-Val-SY的结合,在该细胞裂解物中高水平的组织蛋白酶S活性已用BMV109探针得到证实。这表明组织蛋白酶S与氧化锍叶立德探针的反应性取决于标记条件。试图通过使细胞在可能模拟组织蛋白酶S的内体环境的各种缓冲液中裂解来探索这一点,但是裂解物中组织蛋白酶S的标记不能得到改善(结果未示出)。
尽管如此,与BMV109相比,氧化锍叶立德探针在裂解物和活细胞中以显著提高的选择性表现出组织蛋白酶X的明显标记(图2D、F)。据我们所知,氧化锍叶立德探针是也不与组织蛋白酶B或L结合的针对组织蛋白酶X的第一共价ABP。如在图2A、图2C、图2D和图2F中所观察,由于两种蛋白酶在尺寸上的相似性,在BMV109的情况下难以区分组织蛋白酶X标记与组织蛋白酶B标记。然而,sCy5-Val-SY允许明确地描绘组织蛋白酶X活性。
实施例6——用氧化锍叶立德探针在细胞裂解物中标记
在实施例6中,在RAW264.7裂解物中测试如根据实施例1制备的在Pl位具有不同氨基酸的氧化锍叶立德探针的小型库,并与BMV109进行比较。各探针以0.01μM、0.05μM、0.1μM、0.5μM、1μM和5μM的递增探针浓度添加,保持20分钟。
[表2]
在RAW264.7裂解物中,带有Ile、Leu、Nle和Phe的探针均示出与sCy5-Val-SY相似的对组织蛋白酶X的特异性,其中sCy5-Nle-SY是最有效的(图3A)。带有Cbz-Lys(其中sCy5经由赖氨酸侧链连接)的探针表现出特异性丧失,有利于组织蛋白酶S而非X和B。其中引入P2 Phe残基的sCy5-Phe-Val-SY也表现出特异性丧失(图3A、图7)。该探针的标记特征与BMV109相似,但其对组织蛋白酶X和S的效力相比于BMV109有所提高。
实施例7——用氧化锍叶立德探针在肾裂解物中标记
在实施例7中,在肾裂解物中测试如根据实施例1制备的氧化锍叶立德探针,并将结果与BMV109进行比较。氧化锍叶立德探针(以及BMV109)各自以0.1μM、0.5μM、1μM和5μM的递增探针浓度添加,保持20分钟。
[表3]
在肾裂解物中,Leu和Nle赋予了对组织蛋白酶X的最大效力和特异性,其中Cbz-Lys、Phe和Phe-Val产生更广泛的反应性,并且Val和Ile表现出较弱的标记(图3B、图7)。
实施例8——用氧化锍叶立德探针在活RAW264.7细胞中标记
在实施例8中,将如根据实施例1制备的氧化锍叶立德探针施用于活RAW264.7细胞,持续两小时,从而检查氧化锍叶立德探针系列在活细胞中的效力和渗透性,并将结果与BMV109进行比较。
氧化锍叶立德探针(以及BMV109)各自以0.1μM、0.5μM、1μM和5μM的递增探针浓度添加,保持2小时。
[表4]
带有Trp、Val、Ile、Leu、Nle和Phe的探针以相似的程度和相似的效力标记组织蛋白酶X和S,而Cbz-Lys表现出对组织蛋白酶S的偏好,并且除了组织蛋白酶X和S之外,Phe-Val还标记组织蛋白酶B和L(图3C、图7)。
实施例9——用氧化锍叶立德探针在活MDA-MB-231
在实施例9中,测试了氧化锍叶立德探针对已知表达极低水平的组织蛋白酶S的人乳腺癌系MDA-MB-231
氧化锍叶立德探针(以及BMV109)各自以0.1μM、0.5μM、1μM和5μM的递增探针浓度添加。
[表5]
当探针与MDA-MB-231细胞一起孵育较短的时间段时,观察到非常少的组织蛋白酶X标记(结果未示出)。然而,孵育过夜后观察到明显的标记(图3D)。这可能反映了巨噬细胞与肿瘤细胞之间的内吞率差异,并且表明探针可以被直接地摄入到内溶酶体途径而非通过膜扩散。氧化锍叶立德探针系列通常示出这些细胞中组织蛋白酶X的特异性标记,其中最小的交叉反应性仅在5μM下发生。sCy5-Lys-SY,特别是sCy5-Phe-Val-SY表现出与组织蛋白酶B和L的最大交叉反应性。
实施例10——sCy5-Nle-SY的体内表征
考虑到来自细胞和组织裂解物以及活小鼠巨噬细胞和人癌细胞的所有数据,氧化锍叶立德探针sCy5-Nle-SY呈现为对组织蛋白酶X示出最高效力和选择性的探针。因此,该探针被选择用于体内研究。
在实施例10中,将探针sCy5-Nle-SY、载体对照/无探针(NP)或BMV109经静脉内注射到小鼠中。在循环两小时之后,收获组织,裂解,并通过荧光SDS-PAGE分析探针标记。在肝、肾、结肠、胃和脾中观察到组织蛋白酶X的标记(图4A),并且这通过用组织蛋白酶X抗体免疫沉淀得到证实(图4B)。虽然也观察到了组织蛋白酶S的一些标记,但与还较强地标记组织蛋白酶B和L的BMV109相比,总体特异性特征得到明显地改善。
另外,在体内探针施用之后,制备得自sCy5-Nle-SY注射的小鼠或无探针对照的肾冷冻切片,并通过共聚焦显微镜分析sCy5荧光(红色)或组织蛋白酶X免疫反应性(绿色)以及使细胞核可视化的DAPI(蓝色)。结果示于图5中。观察到让人联想起内溶酶体染色的强斑点sCy5荧光,并且该信号在很大程度上与免疫反应性组织蛋白酶X重叠(图5)。因此,sCy5-Nle-SY可用于在体内施用后相对于组织中的总组织蛋白酶X来区分活性组织蛋白酶X。
实施例11——AOMK和氧化锍叶立德探针的表征
在实施例11中,采用活RAW264.7细胞中的标记实验,将根据实施例2制备的新AOMK探针的反应性与根据实施例1制备的相应氧化锍叶立德探针进行比较。
[表6]
将探针以递增浓度(0.1、0.5、1、5μM)添加保持两小时,并通过胶内荧光分析标记。结果示于图6A中。
AOMK探针比叶立德探针的效力低得多,表明反应性较低。这些探针标记组织蛋白酶B和S,但不标记X(图6A),这与先前的数据一致,表明组织蛋白酶X与AOMK弹头的反应性受限(Paulick和Bogyo,2011)。
实施例12——sCy5-Nle-AOMK的体内表征
在实施例12中,在体内测试AOMK探针sCy5-Nle-AOMK并分析其在组织中的标记。将探针经静脉内注射到小鼠中。在循环两小时之后,收获组织,裂解,并通过荧光SDS-PAGE分析探针标记。组织蛋白酶B和S的较弱标记仅在结肠中观察到,而在检查的其他组织中却没有(图6B)。
实施例13——用sCy5-Nle-SY在人组织中标记
为了研究sCy5-Nle-SY标记人组织中的组织蛋白酶X的能力,使用从患有口腔鳞状细胞癌的患者获得的活体组织切片。将从同一患者的舌对侧活检的正常口腔粘膜组织用作对照。
根据纽约大学口腔癌中心的机构审查委员会(Institutional Review Board atthe New York University Oral Cancer Centre)批准的方案,对人口腔鳞状细胞癌或患者匹配的正常口腔粘膜进行活检。将活体组织切片立即速冻并储存于-80℃。通过在柠檬酸盐缓冲液中超声处理来裂解组织,并且通过离心使上清液澄清。通过BCA测定评估总蛋白浓度,并且80μg用Cy5-Nle-SY标记:将由口腔鳞状细胞癌组织或患者匹配的正常口腔粘膜制备的裂解物与sCy5-Nle-SY(5μM,20分钟)一起温育,并且通过胶内荧光(荧光SDS-PAGE)分析标记。另外对样品进行免疫印迹以测定总组织蛋白酶X表达(n=10)。另外,用组织蛋白酶X特异性抗体使sCy5-Nle-SY标记的癌裂解物免疫沉淀以验证标记的蛋白质的身份。
结果示于图8A和8B中。在检查的所有癌症样品中,观察到组织蛋白酶X的明显和选择性标记,如通过用组织蛋白酶X特异性抗体的免疫沉淀所证实。与正常舌组织相比,组织蛋白酶X活性在癌活组织切片中显著地提高,并且这通过总组织蛋白酶X的增加来确证,如由免疫印迹所测量。这些数据表明sCy5-Nle-SY可成功地检测到人组织中的组织蛋白酶X的活化,并且首次显示出组织蛋白酶X在口腔鳞状细胞癌中显著地上调。
概括地说,所实施的实验的结果表明,测试的新二甲基氧化锍叶立德弹头对细胞裂解物、活细胞、体内(诸如小鼠中)和组织裂解物(小鼠和人)中的半胱氨酸组织蛋白酶表现出独特的选择性。所测试的氧化锍叶立德的最佳探针sCy5-Nle-SY是迄今对组织蛋白酶X的最有效和最具选择性的探针,显示出在细胞裂解物和表达低水平组织蛋白酶S的细胞中的专一特异性。虽然该探针与活巨噬细胞和体内的组织蛋白酶S发生交叉反应,但其不标记组织蛋白酶B或L,其相对于靶向组织蛋白酶X的其他探针(BMV109、MGP140)有明显的改善。sCy5-Nle-SY的使用允许通过SDS-PAGE明确地测量组织蛋白酶X的活性,而由于组织蛋白酶B标记的混淆水平,这对于先前的探针是困难的。此外,确立了氧化锍叶立德弹头对于组织蛋白酶X的体内检测是足够稳定的,并且sCy5-Nle-SY信号对于通过共聚焦显微镜检测是足够明亮的。
实施例14——作为组织蛋白酶X抑制剂的Boc-Val-SY
为了测试氧化锍叶立德化合物充当组织蛋白酶抑制剂的能力,使用Val-SY的未标记的boc保护形式,即(S)-(1-(二甲基(氧代)-λ
结果示于图9中。与对照相比,用100μM Boc-Val-SY处理的细胞表现出组织蛋白酶X和组织蛋白酶S分别下降71%和51%。这些数据表明Boc-Val-SY与sCy5-Val-SY竞争标记并因此充当组织蛋白酶抑制剂的能力。
本发明实施例、方法、过程、具体化合物和分子意在举例说明和例示本发明,而绝不应视为限制本发明的范围,本发明的范围由所附权利要求书的字面和等同范围限定。本说明书中提及的任何专利或出版物指示本专利所属领域的技术人员的水平,并且旨在传达可能未明确陈述但将由本领域的工作人员理解的本发明的细节。此类专利或出版物据此以引用方式并入,其程度如同每个专利或出版物具体地和单独地以引用方式并入并且用于描述和实现所提及的方法或材料的目的。
参考文献
Akkari,L.,Gocheva,V.,Kester,J.C.,Hunter,K.E.,Quick,M.L.,Sevenich,L.,Wang,H.-W.,Peters,C.,Tang,L.H.,Klimstra,D.S.,Reinheckel,T.和Joyce,J.A.(2014).Distinct functions of macrophage-derived and cancer cell-derived cathepsinZcombine to promote tumor malignancy via interactions with the extracellularmatrix.Genes Dev.28,2134–2150.
Allan,E.R.O.,Campden,R.I.,Ewanchuk,B.W.,Tailor,P.,Balce,D.R.,McKenna,N.T.,Greene,C.J.,Warren,A.L.,Reinheckel,T.和Yates,R.M.(2017).A role forcathepsinZ inneuroinflammation provides mechanistic support for an epigeneticrisk factor in multiple sclerosis.J Neuroinflammation 14,1–11.
Bernhardt,A.,Kuester,D.,Roessner,A.,Reinheckel,T.和Krueger,S.(2010).CathepsinX-deficient Gastric Epithelial Cells inCo-culture with Macrophages:Characterization of cytokine response and migration capability afterHelicobacter pylori infection.J.Biol.Chem.285,33691-33700.
Chang,X.-Z.,Li,D.-Q.,Hou,Y.-F.,Wu,J.,Lu,J.-S.,Di,G.-H.,Jin,W.,Ou,Z.-L.,Shen,Z.-Z.和Shao,Z.-M.(2007).Identification of the functional role of AF1Qinthe progression of breast cancer.Breast Cancer Res.Treat.111,65-78.
Duivenvoorden,H.M.,Rautela,J.,Edgington-Mitchell,L.E.,Spurling,A.,Greening,D.W.,Nowell,C.J.,Molloy,T.J.,Robbins,E.,Brockwell,N.K.,Lee,C.S.,Chen,M.,Holliday,A.,Selinger,C.I.,Hu,M.,Britt,K.L.,Stroud,D.A.,Bogyo,M.,
Edgington,L.E.,Berger,A.B.,Blum,G.,Albrow,V.E.,Paulick,M.G.,Lineberry,N.和Bogyo,M.(2009).Noninvasive optical imaging of apoptosis bycaspase-targeted activity-based probes.Nat.Med.15,967-973.
Edgington,L.E.和Bogyo,M.(2013).In vivo imaging and biochemicalcharacterization of protease function using fluorescent activity-basedprobes.Curr.Protoc.Chem.Biol.5,25-44.
Edgington,L.E.,van Raam,B.J.,Verdoes,M.,Wierschem,C.,Salvesen,G.S.和Bogyo,M.(2012).An Optimized Activity-Based Probe for the Study of Caspase-6Activation.Chem.Biol.19,340-352.
Edgington,L.E.,Verdoes,M.和Bogyo,M.(2011).Functional imaging ofproteases:recent advances inthe designand application of substrate-based andactivity-based probes.Curr.Op.Chem.Biol.15,798-805.
Edgington,L.E.,Verdoes,M.,Ortega,A.,Withana,N.P.,Lee,J.,Syed,S.,Bachmann,M.H.,Blum,G.和Bogyo,M.(2013).Functional Imaging of Legumain inCancer Using a New Quenched Activity-Based Probe.J.Am.Chem.Soc.135,174-182.
Edgington-Mitchell,L.E.,Rautela,J.,Duivenvoorden,H.M.,Jayatilleke,K.M.,van der Linden,W.A.,Verdoes,M.,Bogyo,M.和Parker,B.S.(2015).Cysteinecathepsin activity suppresses osteoclastogenesis of myeloid-derivedsuppressor cells in breast cancer.Oncotarget 6,27008–27022.
Hafner,A.,Glavan,G.,Obermajer,N.,
Huynh,J.L.,Garg,P.,Thin,T.H.,Yoo,S.,Dutta,R.,Trapp,B.D.,Haroutunian,V.,Zhu,J.,Donovan,M.J.,Sharp,A.J.和Casaccia,P.(2013).Epigenome-widedifferences in pathology-free regions of multiple sclerosis–affectedbrains.Nat.Neurosci.17,121-130.
Krueger,S.,Kalinski,T.,Hundertmark,T.,Wex,T.,Küster,D.,Peitz,U.,Ebert,M.,
Leichsenring,A.,
Meara,J.P.和Rich,D.H.(1996).Mechanistic studies on the inactivationof papain by epoxysuccinyl inhibitors.J.Med.Chem.39,3357-3366.
Obermajer,N.,Doljak,B.,Jamnik,P.,
Obermajer,N.,
Oresic Bender,K.,Ofori,L.,van der Linden,W.A.,Mock,E.D.,Datta,G.K.,Chowdhury,S.,Li,H.,Segal,E.,Sanchez Lopez,M.,Ellman,J.A.,Figdor,C.G.,Bogyo,M.和Verdoes,M.(2015).Design of a Highly Selective Quenched Activity-Based Probeand Its Application in Dual Color Imaging Studies of CathepsinS ActivityLocalization.J.Am.Chem.Soc.137,4771-4777.
Orlowski,G.M.,Colbert,J.D.,Sharma,S.,Bogyo,M.,Robertson,S.A.和Rock,K.L.(2015).Multiple Cathepsins Promote Pro–IL-1βSynthesis and NLRP3-MediatedIL-1βActivation.J.Immunol.195,1685-1697.
Paulick,M.G.和Bogyo,M.(2011).Development of Activity-Based Probes forCathepsin X.ACS Chem.Biol.6,563-572.
Sanman,L.E.和Bogyo,M.(2014).Activity-Based Profiling ofProteases.Annu.Rev.Biochem.83,249-273.
Sevenich,L.,Schurigt,U.,Sachse,K.,Gajda,M.,Werner,F.,Muller,S.,Vasiljeva,O.,Schwinde,A.,Klemm,N.,Deussing,J.,Peters,C.和Reinheckel,T.(2010).Synergistic antitumor effects of combined cathepsinB and cathepsin Zdeficiencies on breast cancer progression and metastasisinmice.Proc.Nat.Acad.Sci.107,2497-2502.
Shaw,E.(1988).Peptidyl sulfonium salts.A new class of proteaseinhibitors.J.Biol.Chem.263,2768-2772.
Verdoes,M.,Edgington,L.E.,Scheeren,F.A.,Leyva,M.,Blum,G.,Weiskopf,K.,Bachmann,M.H.,Ellman,J.A.和Bogyo,M.(2012).A Nonpeptidic Cathepsin S Activity-Based Probe for Noninvasive Optical Imaging of Tumor-AssociatedMacrophages.Chem.Biol.19,619-628.
Verdoes,M.,Oresic Bender,K.,Segal,E.,van der Linden,W.A.,Syed,S.,Withana,N.P.,Sanman,L.E.和Bogyo,M.(2013).Improved Quenched Fluorescent Probefor Imaging of Cysteine Cathepsin Activity.J.Am.Chem.Soc.135,14726-14730.
Wendt,W.,Zhu,X.-R.,Lübbert,H.和Stichel,C.C.(2007).Differentialexpression of cathepsin X in aging and pathological central nervous system ofmice.Exp.Neurol.204,525-540.
本发明的其它实施方案涉及:
1.一种式I的化合物
[化学式.72]
或其盐,
其中
R
R
R
R
R
X是
(i)键;或
(ii)经由氨基与R
[化学式.73]
其中
R
R
R
R
n是1、2、3或4。
2.根据项目1所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
3.根据项目1所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
4.根据项目1所述的化合物,其中R
其中所述侧链或其结构异构体或同系物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
5.根据项目1所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
6.根据项目1所述的化合物,其中R
其中所述侧链或其结构异构体或同系物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
7.根据项目6所述的化合物,其中所述α氨基酸选自甘氨酸、丙氨酸、α-氨基丁酸、缬氨酸、正缬氨酸、亮氨酸、异亮氨酸、正亮氨酸、高正亮氨酸、甲硫氨酸、乙硫氨酸、苯丙氨酸、酪氨酸、左旋多巴、色氨酸、半胱氨酸、高半胱氨酸、硒代半胱氨酸、硒代高半胱氨酸、硒代甲硫氨酸和硒代乙硫氨酸。
8.根据项目6所述的化合物,其中所述α氨基酸选自丙氨酸、α-氨基丁酸、缬氨酸、正缬氨酸、亮氨酸、异亮氨酸、正亮氨酸、高正亮氨酸、苯丙氨酸和色氨酸。
9.根据项目6所述的化合物,其中所述α氨基酸选自缬氨酸、正缬氨酸、亮氨酸、异亮氨酸、正亮氨酸和高正亮氨酸。
10.根据项目6所述的化合物,其中所述α氨基酸选自缬氨酸、亮氨酸、异亮氨酸和正亮氨酸。
11.根据项目6所述的化合物,其中所述α氨基酸是亮氨酸或正亮氨酸。
12.根据项目6所述的化合物,其中所述α氨基酸是正亮氨酸。
13.根据项目1所述的化合物,其中R
R
R
14.根据项目13所述的化合物,其中R
15.根据项目13所述的化合物,其中R
16.根据项目13所述的化合物,其中R
17.根据项目13所述的化合物,其中R
18.根据项目13所述的化合物,其中R
19.根据项目13至18中任一项所述的化合物,其中如果X是键,则R
20.根据项目13至18中任一项所述的化合物,其中R
21.根据项目13至18中任一项所述的化合物,其中如果X是键,则R
22.根据项目1所述的化合物,其中R
23.根据项目22所述的化合物,其中R
24.根据项目22所述的化合物,其中R
25.根据项目22所述的化合物,其中R
26.根据项目22所述的化合物,其中R
27.根据项目22所述的化合物,其中R
28.根据项目22所述的化合物,其中R
29.根据项目22所述的化合物,其中R
30.根据项目1所述的化合物,其中R
R
R
31.根据项目30所述的化合物,其中如果X是键,则R
32.根据项目13至18和30中任一项所述的化合物,其中R
33.根据项目13至18和30中任一项所述的化合物,其中R
34.根据项目13至18和30中任一项所述的化合物,其中R
35.根据项目13至20和30至34中任一项所述的化合物,其中R
36.根据项目1至35中任一项所述的化合物,其中R
37.根据项目1至36中任一项所述的化合物,其中R
38.根据项目1至37中任一项所述的化合物,其中R
39.根据项目1至38中任一项所述的化合物,其中R
40.根据项目1至39中任一项所述的化合物,其中R
41.根据项目1至40中任一项所述的化合物,其中R
42.根据项目1至41中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
43.根据项目1至41中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
44.根据项目1至41中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
45.根据项目44所述的化合物,其中所述α氨基酸是苯丙氨酸。
46.根据项目1至41中任一项所述的化合物,其中R
47.根据项目1至41中任一项所述的化合物,其中R
48.根据项目1至47中任一项所述的化合物,其中R
49.根据项目1至48中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
50.根据项目1至48中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
R
51.根据项目1至48中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物任选地被胺保护基或可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
52.根据项目1至51中任一项所述的化合物,其中R
53.根据项目1至52中任一项所述的化合物,其中所述胺保护基选自苄氧羰基(Cbz)、9-芴基甲氧基羰基(Fmoc)、叔丁氧羰基(Boc)、烯丙氧羰基(Alloc)、对甲苯磺酰基(Tos)、2,2,5,7,8-五甲基色满-6-磺酰基(Pmc)、2,2,4,6,7-五甲基-2,3-二氢苯并呋喃-5-磺酰基(Pbf)、均三甲苯基-2-磺酰基(Mts)、4-甲氧基-2,3,6-三甲基苯基磺酰基(Mtr)、乙酰胺基和邻苯二甲酰亚氨基。
54.根据项目1至53中任一项所述的化合物,其中所述胺保护基是苄氧羰基。
55.根据项目1至54中任一项所述的化合物,其具有式IA:
[化学式.74]
56.根据项目1至55中任一项所述的化合物,其中所述双基部分具有式IIA或IIIA
[化学式.75]
57.根据项目1至55中任一项所述的化合物,其中X是键。
58.根据项目1至55中任一项所述的化合物,其中X是式II的双基部分。
59.根据项目1至55中任一项所述的化合物,其中X是式III的双基部分。
60.根据项目56所述的化合物,其中X是式IIA的双基部分。
61.根据项目56所述的化合物,其中X是式IIIA的双基部分。
62.根据项目1至61中任一项所述的化合物,其中n是1。
63.根据项目1至62中任一项所述的化合物,其中所述可检测元件选自荧光标记、生物素标记、放射性标记、螯合剂和生物正交连接手柄。
64.根据项目1至63中任一项所述的化合物,其中所述可检测元件是荧光标记。
65.根据项目64所述的化合物,其中所述荧光标记选自荧光素、俄勒冈绿、硼杂-二氮杂-引达省染料、罗丹明染料、苯并吡喃鎓染料、香豆素染料、花菁标记或苯并吲哚标记。
66.根据项目64所述的化合物,其中所述荧光标记是花菁标记。
67.根据项目64所述的化合物,其中所述荧光标记是具有选自下式的组的式的花菁标记:
[化学式.76]
其中在以上各式中,
A选自CH
R
其中
p是2、3、4、5、6、7或8;
q是2、3、4、5、6、7或8;
r是2、3、4、5、6、7或8;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
68.根据项目67所述的化合物,其中
A选自CH
R
其中
p是2、3、4、5或6;
q是2、3、4、5或6;
r是2、3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
69.根据项目67所述的化合物,其中
A是C(CH
R
其中
p是2、3、4、5或6;
q是2、3、4、5或6;
r是2、3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
70.根据项目67所述的化合物,其中
A是C(CH
R
其中
p是4、5或6;
q是4、5或6;
r是3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
71.根据项目67所述的化合物,其中
A是C(CH
R
p是4、5或6;并且
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
72.根据项目67所述的化合物,其中
A是C(CH
R
其中
q是4、5或6;
r是3、4、5或6;
$表示与花菁部分的氮原子的连接点;并且&表示与分子的其余部分的连接点;
R
R
73.根据项目67至72中任一项所述的化合物,其中p是5,q是5,并且r是4。
74.根据项目64所述的化合物,其中所述荧光标记是具有选自下式的组的式的花菁标记:
[化学式.77]
[化学式.78]
[化学式.79]
其中在以上各式中,
卷曲的线表示与分子的其余部分的连接点;
并且R
75.根据项目74所述的化合物,其中R
76.根据项目74所述的化合物,其中R
77.根据项目64所述的化合物,其中所述荧光标记是具有下式的花菁标记:
[化学式.80]
其中卷曲的线表示与分子的其余部分的连接点;并且R
78.根据项目1至77中任一项所述的化合物,其中所述化合物包含至少一个可检测元件。
79.根据项目1至77中任一项所述的化合物,其中所述化合物包含一个、两个或三个可检测元件。
80.根据项目1至77中任一项所述的化合物,其中所述化合物包含一个可检测元件。
81.根据项目1至80中任一项所述的化合物,其中R
82.根据项目1至81中任一项所述的化合物,其中R
83.根据项目1至82中任一项所述的化合物,其中R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
84.根据项目1至82中任一项所述的化合物,
其中R
R
R
85.根据项目82至84中任一项所述的化合物,其中R
86.根据项目82至84中任一项所述的化合物,其中R
87.根据项目1至86中任一项所述的化合物,其中X是式II或IIA的双基部分,并且R
88.根据项目1至87中任一项所述的化合物,其中X是式II或IIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
89.根据项目1至86中任一项所述的化合物,其中X是式III或IIIA的双基部分,并且R
90.根据项目1至86和89中任一项所述的化合物,其中X是式III或IIIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代,并且任选地进一步被一个或多个相同或不同的取代基R
91.根据项目1至86和89至90中任一项所述的化合物,其中X是式III或IIIA的双基部分,并且R
92.根据项目1至86和89至91中任一项所述的化合物,其中X是式III或IIIA的双基部分,并且R
其中所述侧链或其结构异构体、同系物和/或结构类似物被可检测元件取代并且任选地进一步被一个或多个相同或不同的取代基R
93.一种化合物,其选自:
[化学式.81]
[化学式.82]
[化学式.83]
[化学式.84]
[化学式.85]
[化学式.86]
[化学式.87]
[化学式.88]
或它们的盐。
94.一种下式的化合物:
[化学式.89]
或其盐。
95.一种组合物,其包含根据项目1至94中任一项所述的化合物或其盐以及赋形剂。
96.根据项目95所述的组合物,其中所述组合物包含根据项目78至94中任一项所述的化合物或其盐以及赋形剂。
97.一种检测半胱氨酸蛋白酶活性的方法,其包括:
(1)使所述半胱氨酸蛋白酶与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对所述半胱氨酸蛋白酶进行分析,包括测量可检测信号。
98.根据项目97所述的方法,其中所述方法是体外方法。
99.一种检测半胱氨酸蛋白酶活性的体外方法,其包括:
(1)使生物样品与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对所述生物样品进行分析,包括测量可检测信号。
100.一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,其包括:
(1)使所述生物样品在体外与包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物接触,以及
(2)随后对所述生物样品进行分析,包括测量可检测信号。
101.根据项目97至100中任一项所述的方法,其中所述氧化锍叶立德部分具有式(IV)
[化学式.90]
其中
R
R
102.根据项目101所述的方法,其中R
103.根据项目101所述的方法,其中R
104.一种检测半胱氨酸蛋白酶活性的方法,其包括:
(1)使所述半胱氨酸蛋白酶与根据项目78至94中任一项所述的化合物或其盐或者与根据项目96所述的组合物接触,以及
(2)随后对所述半胱氨酸蛋白酶进行分析,包括测量可检测信号。
105.根据项目104所述的方法,其中所述方法是体外方法。
106.一种检测半胱氨酸蛋白酶活性的体外方法,其包括:
(1)使生物样品与根据项目78至94中任一项所述的化合物或其盐或者与根据项目96所述的组合物接触,以及
(2)随后对所述生物样品进行分析,包括测量可检测信号。
107.一种检测获自受试者的生物样品中的半胱氨酸蛋白酶活性的方法,其包括:
(1)使所述生物样品在体外与根据项目78至94中任一项所述的化合物或其盐或者与根据项目96所述的组合物接触,以及
(2)随后对所述生物样品进行分析,包括测量可检测信号。
108.根据项目97至107中任一项所述的方法,其中步骤(2)包括进行至少一种选自以下的分析方法:凝胶电泳和后续的胶内荧光、凝胶电泳和后续的放射线照相术、凝胶电泳和后续的免疫印迹、荧光显微镜术、流式细胞计数法、离体光学成像、放射线照相术、亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。
109.根据项目97至108中任一项所述的方法,其中所述可检测信号通过荧光测量法来测量。
110.根据项目108或109所述的方法,其中所述至少一种分析方法选自凝胶电泳和后续的胶内荧光、荧光显微镜术和流式细胞计数法。
111.根据项目108或109所述的方法,其中所述至少一种分析方法选自凝胶电泳和后续的胶内荧光,以及荧光显微镜术。
112.根据项目97至111中任一项所述的方法,其中所述化合物包含荧光标记形式的可检测元件。
113.根据项目109至111中任一项所述的方法,其中所述化合物包含生物正交连接手柄形式的可检测元件,并且其中步骤(2)包括在进行所述至少一种分析方法之前,通过点击化学施加荧光标记进行次级标记。
114.根据项目109至111中任一项所述的方法,其中所述化合物包含生物素形式的可检测元件,并且其中步骤(2)包括在进行所述至少一种分析方法之前,用荧光标记的链霉亲和素进行次级标记或者用荧光标记的生物素特异性抗体进行次级标记。
115.根据项目108至114中任一项所述的方法,其中所述凝胶电泳是一维或二维凝胶电泳。
116.根据项目108至115中任一项所述的方法,其中所述凝胶电泳是SDS-PAGE。
117.根据项目99至103和106至116中任一项所述的方法,其中所述生物样品选自细胞、细胞裂解物、组织样本、组织裂解物和体液。
118.根据项目117所述的方法,其中所述生物样品是细胞裂解物或组织裂解物。
119.根据项目117所述的方法,其中所述生物样品是澄清细胞裂解物或澄清组织裂解物。
120.根据项目117所述的方法,其中所述生物样品是活细胞。
121.根据项目120所述的方法,其中在步骤(1)与步骤(2)之间使所述活细胞裂解并且澄清。
122.根据项目99至103和106至121中任一项所述的方法,其中所述生物样品获自人类受试者。
123.一种检测半胱氨酸蛋白酶活性的方法,其包括:
(1)向受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,
(2)随后从所述受试者获得生物样品;以及
(3)随后对所述生物样品进行分析,包括测量可检测信号。
124.根据项目123所述的方法,其中所述基于活性的探针化合物经静脉内施用。
125.根据项目123或124所述的方法,其中所述氧化锍叶立德部分具有式(IV)
[化学式.91]
其中
R
R
126.根据项目125所述的方法,其中R
127.根据项目125所述的方法,其中R
128.一种检测半胱氨酸蛋白酶活性的方法,其包括:
(1)向受试者施用根据项目78至94中任一项所述的化合物或其盐或者根据项目96所述的组合物,
(2)随后从所述受试者获得生物样品;以及
(3)随后对所述生物样品进行分析,包括测量可检测信号。
129.根据项目128所述的方法,其中所述化合物或其盐或所述组合物经静脉内施用。
130.根据项目123至129中任一项所述的方法,其中步骤(3)包括进行至少一种选自以下的分析方法:凝胶电泳和后续的胶内荧光、凝胶电泳和后续的放射线照相术、凝胶电泳和后续的免疫印迹、荧光显微镜术、流式细胞计数法、离体光学成像、放射线照相术、亲和纯化和后续的质谱,以及亲和纯化和后续的蛋白质组学。
131.根据项目123至130中任一项所述的方法,其中所述可检测信号通过荧光测量法来测量。
132.根据项目130或131所述的方法,其中所述至少一种分析方法选自凝胶电泳和后续的胶内荧光、荧光显微镜术和流式细胞计数法。
133.根据项目130或131所述的方法,其中所述至少一种分析方法选自凝胶电泳和后续的胶内荧光,以及荧光显微镜术。
134.根据项目123至133中任一项所述的方法,其中所述化合物包含荧光标记形式的可检测元件。
135.根据项目131至133中任一项所述的方法,其中所述化合物包含生物正交连接手柄形式的可检测元件,并且其中步骤(3)包括在进行所述至少一种分析方法之前,通过点击化学施加荧光标记进行次级标记。
136.根据项目131至133中任一项所述的方法,其中所述化合物包含生物素形式的可检测元件,并且其中步骤(3)包括在进行所述至少一种分析方法之前,用荧光标记的链霉亲和素进行次级标记或者用荧光标记的生物素特异性抗体进行次级标记。
137.根据项目130至136中任一项所述的方法,其中所述凝胶电泳是一维或二维凝胶电泳。
138.根据项目130至137中任一项所述的方法,其中所述凝胶电泳是SDS-PAGE。
139.根据项目123至138中任一项所述的方法,其中所述生物样品选自细胞、细胞裂解物、组织样本、组织裂解物和体液。
140.根据项目139所述的方法,其中所述生物样品是细胞裂解物或组织裂解物。
141.根据项目139所述的方法,其中所述生物样品是澄清细胞裂解物或澄清组织裂解物。
142.根据项目123至141中任一项所述的方法,其中所述受试者是人类受试者。
143.一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,其包括:
(1)向所述受试者施用包含作为弹头的氧化锍叶立德部分的基于活性的探针化合物,以及
(2)随后检查所述受试者,包括测量可检测信号。
144.根据项目143所述的方法,其中所述基于活性的探针化合物经静脉内施用。
145.根据项目143或144所述的方法,其中所述氧化锍叶立德部分具有式(IV)
[化学式.92]
其中
R
R
146.根据项目145所述的方法,其中R
147.根据项目145所述的方法,其中R
148.一种检测受试者中的半胱氨酸蛋白酶活性的体内方法,其包括:
(1)向所述受试者施用根据项目78至94中任一项所述的化合物或其盐或者根据项目96所述的组合物,以及
(2)随后检查所述受试者,包括测量可检测信号。
149.根据项目148所述的方法,其中所述化合物或其盐或所述组合物经静脉内施用。
150.根据项目143至149中任一项所述的方法,其中所述可检测信号通过体内光学成像、放射线照相术或正电子发射断层摄影来测量。
151.根据项目143至150中任一项所述的方法,其中所述受试者是人类受试者。
152.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物半胱氨酸蛋白酶。
153.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是人半胱氨酸蛋白酶。
154.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是半胱氨酸组织蛋白酶。
155.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物半胱氨酸组织蛋白酶。
156.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是人半胱氨酸组织蛋白酶。
157.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是组织蛋白酶X。
158.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物组织蛋白酶X。
159.根据项目97至151中任一项所述的方法,其中所述半胱氨酸蛋白酶是人组织蛋白酶X。
160.根据项目97至159中任一项所述的方法,其中检测到组织蛋白酶X活性,并且未检测到组织蛋白酶B活性和/或组织蛋白酶L活性。
161.根据项目97至159中任一项所述的方法,其中检测到组织蛋白酶X活性和组织蛋白酶S活性,并且未检测到组织蛋白酶B活性和/或组织蛋白酶L活性。
162.一种抑制半胱氨酸蛋白酶的方法,其包括使所述半胱氨酸蛋白酶与根据项目1至94中任一项所述的化合物或其盐或者与根据项目95所述的组合物接触。
163.根据项目162所述的方法,其中所述方法是体外方法。
164.一种抑制半胱氨酸蛋白酶的体外方法,其包括使生物样品与根据项目1至94中任一项所述的化合物或其盐或者与根据项目95所述的组合物接触。
165.一种抑制获自受试者的生物样品中的半胱氨酸蛋白酶的方法,其包括使所述生物样品在体外与根据项目1至94中任一项所述的化合物或其盐或者与根据项目95所述的组合物接触。
166.根据项目164或165所述的方法,其中所述生物样品选自细胞、细胞裂解物、组织样本、组织裂解物和体液。
167.一种抑制受试者中的半胱氨酸蛋白酶的体内方法,其包括向所述受试者施用根据项目1至94中任一项所述的化合物或其盐或者根据项目95所述的组合物。
168.根据项目167所述的方法,其中所述化合物或其盐或所述组合物经静脉内施用。
169.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物半胱氨酸蛋白酶。
170.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是人半胱氨酸蛋白酶。
171.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是半胱氨酸组织蛋白酶。
172.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物半胱氨酸组织蛋白酶。
173.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是人半胱氨酸组织蛋白酶。
174.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是组织蛋白酶X。
175.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是哺乳动物组织蛋白酶X。
176.根据项目162至168中任一项所述的方法,其中所述半胱氨酸蛋白酶是人组织蛋白酶X。
177.根据项目162至176中任一项所述的方法,其中组织蛋白酶X受到抑制,并且组织蛋白酶B和/或组织蛋白酶L未受到抑制。
178.根据项目162至176中任一项所述的方法,其中组织蛋白酶X和组织蛋白酶S受到抑制,并且组织蛋白酶B和/或组织蛋白酶L未受到抑制。
179.一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,其包括:
(1)使获自所述受试者的生物样品在体外与根据项目78至94中任一项所述的化合物或其盐或者与根据项目96所述的组合物接触,以及
(2)随后对所述生物样品进行分析,包括测量可检测信号。
180.根据项目179所述的方法,其中所述方法包括根据项目107至122和152至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
181.一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法,其包括:
(1)向所述受试者施用根据项目78至94中任一项所述的化合物或其盐或者根据项目96所述的组合物,
(2)随后从所述受试者获得生物样品;以及
(3)随后对所述生物样品进行分析,包括测量可检测信号。
182.根据项目181所述的方法,其中所述方法包括根据项目128至142和152至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
183.一种诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法,其包括:
(1)向所述受试者施用根据项目78至94中任一项所述的化合物或其盐或者根据项目96所述的组合物,以及
(2)随后检查所述受试者,包括测量可检测信号。
184.根据项目183所述的方法,其中所述方法包括根据项目148至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
185.根据项目78至94中任一项所述的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中所述方法包括:
(1)向所述受试者施用根据项目78至94中任一项所述的化合物或其盐,
(2)随后从所述受试者获得生物样品;以及
(3)随后对所述生物样品进行分析,包括测量可检测信号。
186.根据项目185所述的使用的化合物,其中所述方法包括根据项目128至142和152至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
187.根据项目96所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的方法中使用,其中所述方法包括:
(1)向所述受试者施用根据项目96所述的组合物,
(2)随后从所述受试者获得生物样品;以及
(3)随后对所述生物样品进行分析,包括测量可检测信号。
188.根据项目187所述的使用的组合物,其中所述方法包括根据项目128至142和152至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
189.根据项目78至94中任一项所述的化合物或其盐,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中所述方法包括:
(1)向所述受试者施用根据项目78至94中任一项所述的化合物或其盐,以及
(2)随后检查所述受试者,包括测量可检测信号。
190.根据项目189所述的使用的化合物,其中所述方法包括根据项目148至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
191.根据项目96所述的组合物,其在诊断受试者中与半胱氨酸蛋白酶活性相关的疾病的体内方法中使用,其中所述方法包括:
(1)向所述受试者施用根据项目96所述的组合物,以及
(2)随后检查所述受试者,包括测量可检测信号。
192.根据项目191所述的使用的组合物,其中所述方法包括根据项目148至161中任一项所述的方法检测半胱氨酸蛋白酶活性。
193.一种治疗与半胱氨酸蛋白酶活性相关的疾病的方法,其包括向有此需要的患者施用治疗有效量的根据项目1至94中任一项所述的化合物或其盐或者治疗有效量的根据项目95所述的组合物。
194.根据项目1至94中任一项所述的化合物或其盐,其在治疗与半胱氨酸蛋白酶活性相关的疾病中使用。
195.一种组合物,其在治疗与半胱氨酸蛋白酶活性相关的疾病中使用,其包含根据项目1至94中任一项所述的化合物或其盐以及药学可接受的赋形剂。
196.根据项目1至94中任一项所述的化合物或其盐在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
197.根据项目95所述的组合物在制备用于治疗与半胱氨酸蛋白酶活性相关的疾病的药物中的用途。
198.根据项目179至197中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病选自乳糜泻、胃肠蠕动紊乱、疼痛、瘙痒、皮肤病、饮食诱导的肥胖、代谢障碍、哮喘、类风湿性关节炎、牙周炎、炎性疾病、功能性GI障碍、癌症、纤维化疾病、代谢功能异常、神经疾病和神经变性疾病。
199.根据项目198所述的方法、用途、使用的化合物或使用的组合物,其中所述功能性GI障碍选自肠易激综合征、功能性胸痛、功能性消化不良、恶心和呕吐障碍、功能性便秘、功能性腹泻、大便失禁、功能性肛门直肠痛和功能性排便障碍。
200.根据项目199所述的方法、用途、使用的化合物或使用的组合物,其中所述功能性GI障碍是肠易激惹综合征。
201.根据项目179至198中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病选自癌症、炎性疾病和神经变性疾病。
202.根据项目179至198中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病是选自乳腺癌、脑癌、骨髓癌、胰腺癌、肺癌、前列腺癌、肝癌、口腔癌、结肠直肠癌和胃癌的癌症。
203.根据项目179至198中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病是选自炎性GI障碍、胰腺炎和感染的炎性疾病。
204.根据项目203所述的方法、用途、使用的化合物或使用的组合物,其中所述炎性GI障碍选自炎性肠道病、传染性腹泻、肠系膜缺血、憩室炎和坏死性小肠结肠炎(NEC)。
205.根据项目204所述的方法、用途、使用的化合物或使用的组合物,其中所述炎性肠道病选自溃疡性结肠炎、克罗恩氏病、改道性结肠炎、未确定型结肠炎和囊炎、微小性结肠炎、免疫肿瘤学结肠炎、化疗/放射性结肠炎、移植物抗宿主病(GvHD)结肠炎、急性结肠炎、贝赛特氏症、胶原性结肠炎和淋巴细胞结肠炎。
206.根据项目204所述的方法、用途、使用的化合物或使用的组合物,其中所述炎性肠道病是溃疡性结肠炎或克罗恩氏病。
207.根据项目179至198中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病是选自阿尔茨海默病、多发性硬化症和神经性疼痛的神经变性疾病。
208.根据项目179至207中任一项所述的方法、用途、使用的化合物或使用的组合物,其中所述疾病是与组织蛋白酶X活性相关的疾病。
209.一种用于制备带有氯甲基酮部分的化合物的方法,其包括使带有氧化锍叶立德部分的化合物反应,以产生所述带有氯甲基酮部分的化合物。
210.一种用于制备带有作为弹头的酰氧基甲基酮部分或苯氧基甲基酮部分的基于活性的探针化合物的方法,其包括:
(i)通过使带有氧化锍叶立德部分的化合物反应以产生带有氯甲基酮部分的化合物,制备带有氯甲基酮部分的中间体化合物,以及
(ii)进一步处理所述带有氯甲基酮部分的化合物,以产生所述基于活性的探针化合物。
211.根据项目209或210所述的方法,其中使所述带有氧化锍叶立德部分的化合物与盐酸反应,以产生带有氯甲基酮部分的化合物。
212.根据项目209至211中任一项所述的方法,其中所述氧化锍叶立德部分具有式(IV)
[化学式.93]
其中
R
R
213.根据项目212所述的方法,其中R
214.根据项目212所述的方法,其中R
215.一种化合物,其选自:
[化学式.94]
[化学式.95]
[化学式.96]
或它们的盐。
- 用作半胱氨酸蛋白酶的探针的氧化锍叶立德衍生物
- 含有1,3-二硫-2-叶立德烯共轭单元的萘二酰亚胺衍生物、制备方法和应用
