一种用于治疗肾纤维化的细胞制剂及制备方法和应用
文献发布时间:2023-06-19 12:10:19
技术领域
本发明涉及生物医药领域,特别是涉及一种用于治疗肾纤维化的细胞制剂及制备方法和应用。
背景技术
肾脏间质纤维化(Tubular interstitial fibrosis,TIF)是慢性肾脏病(Chronickidney disease,CKD)发展到终末期肾脏病的共同通路和共同病理改变,在CKD的致死原因中,肾脏纤维化疾病占总死因的45%。TIF主要表现为肾单位正常结构被破坏,肾固有细胞丢失及细胞外基质(ECM)沉积。损伤肾小管上皮细胞诱导大量成纤维细胞及肌成纤维细胞增生,胶原纤维、纤粘连蛋白(FN)等基质通过上皮间质转化(EMT)增生和堆积,最终导致肾脏间质纤维化和CKD的发生。因此,EMT是肾脏损伤和肾间质纤维化的重要标志和作用机制,抑制EMT过程在纤维化的治疗中具有重要作用。
目前,唯一用于临床治疗CKD的药物为肾素-血管紧张素系统(RAS)阻断剂类,如血管紧张素转化酶抑制剂(ACEI)和血管紧张素Ⅱ受体阻断剂(ARB),然而该类药物都不是直接作用于肾脏纤维化的有效治疗手段。在体外实验和动物实验的研究中,已报道具有抗肾脏纤维化作用的药物包括抗肾小管上皮细胞凋亡的药物(如吡非尼酮、替米沙坦和曲尼司特)、抗EMT的药物(如促红细胞生成素和骨形成蛋白-7)及抗氧化应激的药物(如地尔硫卓和二十碳五烯酸)。
在现有的对于肾脏纤维化的治疗方案和治疗药物中,细胞治疗显示出独特优势,疗效显著、副作用小等被相继报道,具有广阔应用前景。
发明内容
本发明的主要目的在于提出一种用于治疗肾纤维化的细胞制剂及制备方法和应用。
本发明的技术问题通过以下的技术方案予以解决:
一种用于治疗肾纤维化的细胞制剂的制备方法,包括如下步骤:
(1)分离并培养血管内皮祖细胞;
(2)将脐带间充质干细胞和血管内皮祖细胞进行非接触性共培养,在共培养中,所述脐带间充质干细胞分泌细胞因子以促进血管内皮祖细胞分化成血管内皮细胞;
(3)收集步骤(2)培养后的细胞,制成所述细胞制剂。
优选地,所述步骤(1)中所用的EPCs专用培养基由如下步骤制得:在100ml不含血清不含任何生长因子的EGM-2培养基中,分别加入1/5体积EGM-2培养基套装中的hEGF、Hydrocortisone、R3-IGF-1、GA-1000、Heparin、h FGF-B、VEGF,再加入1ml青链霉素混合液,摇匀。
优选地,所述步骤(1)分离并培养血管内皮祖细胞,包括如下步骤:利用所述EPCs专用培养基重悬细胞,之后均匀接种于预先包被有人纤维连接蛋白的60mm无菌细胞培养皿中,置于37℃、5%CO
优选地,所述步骤(2)中所用的细胞培养液中添加有5%的EBM-2基础培养基。
优选地,所述步骤(2)中,将脐带间充质干细胞和血管内皮祖细胞按照细胞数量1:1进行非接触性共培养;所述非接触共培养时间为48h。
优选地,所述步骤(2)中,将5×10
优选地,所述步骤(3)是将收集的所述步骤(2)培养后的所有细胞和生理盐水进行混合,制成所述细胞制剂。
一种用于治疗肾纤维化的细胞制剂,由所述的制备方法制得。
优选地,所述细胞制剂为注射制剂。
一种所述的用于治疗肾纤维化的细胞制剂在制备用于治疗人肾纤维化的药物中的用途。
本发明的有益效果包括:本发明实施例采用脐带间充质干细胞和血管内皮祖细胞非接触共培养的方式使脐带间充质干细胞促进血管内皮祖细胞分化成ECs,将非接触共培养后收集的细胞制成治疗肾纤维化的细胞制剂,能修复肾纤维化的肾脏组织细胞,达到临床治疗的目的。本发明实施例采用单侧输尿管结扎法构建UUO小鼠模型,通过H&E染色观察本发明的细胞制剂(表示为EPCs+MSCs,下同)对小鼠肾损伤的改善作用,Masson’s染色观察EPCs+MSCs对小鼠肾间质纤维化改善作用,通过Western blot分子生物学方法,检测EPCs+MSCs对小鼠肾脏促纤维化蛋白表达的影响。本发明体内实验证明EPCs+MSCs对肾纤维化的抑制作用,能够增强抗肾纤维化活性,为开发新型抗肾纤维化药物提供了理论基础与实验依据。
附图说明
图1是本发明实施例的培养实验中倒置光学显微镜下观察的细胞形态学的变化图;
图2是本发明实施例的小鼠肾脏组织H&E染色结果示意图
图3是本发明实施例的小鼠肾脏组织Masson’s染色结果示意图;
图4是本发明实施例的EPCs+MSCs对UUO小鼠肾脏组织中Collagen I、Fibronectin、α-SMA、E-cadherin表达的影响;
图5是本发明实施例的定量分析显示EPCs+MSCs对UUO小鼠肾脏组织中CollagenI、Fibronectin、α-SMA、E-cadherin表达的影响;
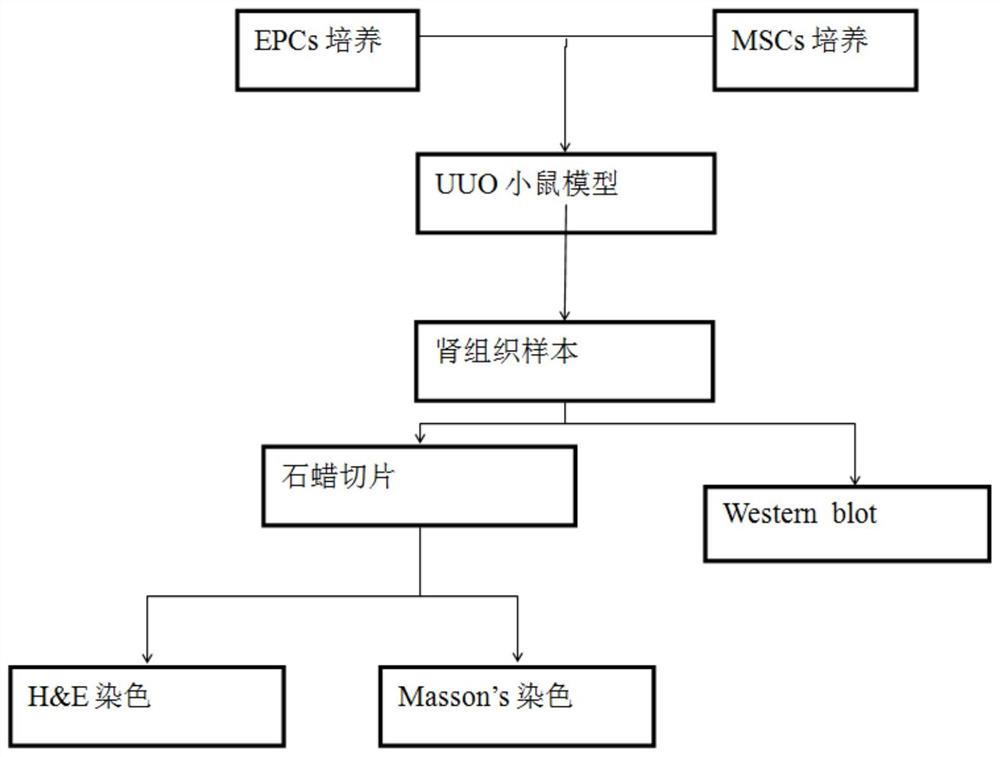
图6为本发明实施例的用于治疗肾纤维化的细胞制剂的技术路线图。
具体实施方式
下面对照附图并结合优选的实施方式对本发明作进一步说明。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。
本发明实施例提供一种用于治疗肾纤维化的细胞制剂的制备方法,包括如下步骤:
(1)分离并培养血管内皮祖细胞;
(2)将脐带间充质干细胞和血管内皮祖细胞进行非接触性共培养,在共培养中,所述脐带间充质干细胞分泌细胞因子以促进血管内皮祖细胞分化成血管内皮细胞;
(3)收集步骤(2)培养后的细胞,制成所述细胞制剂。
在优选的实施例中,所述步骤(1)中所用的EPCs专用培养基由如下步骤制得:在100ml不含血清不含任何生长因子的EGM-2培养基中,分别加入1/5体积EGM-2培养基套装中的hEGF、Hydrocortisone、R3-IGF-1、GA-1000、Heparin、h FGF-B、VEGF,再加入1ml青链霉素混合液,摇匀。
在优选的实施例中,所述步骤(1)分离并培养血管内皮祖细胞,包括如下步骤:利用所述EPCs专用培养基重悬细胞,之后均匀接种于预先包被有人纤维连接蛋白的60mm无菌细胞培养皿中,置于37℃、5%CO
在优选的实施例中,所述步骤(2)中所用的细胞培养液中添加有5%的EBM-2基础培养基。
在优选的实施例中,所述步骤(2)中,将脐带间充质干细胞和血管内皮祖细胞按照细胞数量1:1进行非接触性共培养;所述非接触共培养时间为48h。
在优选的实施例中,所述步骤(2)中,将5×10
在优选的实施例中,所述步骤(3)是将收集的所述步骤(2)培养后的所有细胞和生理盐水进行混合,制成所述细胞制剂。
本发明实施例还提供一种用于治疗肾纤维化的细胞制剂,由所述的制备方法制得。
在优选的实施例中,所述细胞制剂为注射制剂。
本发明实施例又提供一种所述的用于治疗肾纤维化的细胞制剂在制备用于治疗人肾纤维化的药物中的用途。
以下对本发明进行详细说明(下文中的百分比浓度,如无特别说明,%是指的体积百分比vol%)。
一、血管内皮祖细胞(Endothelial progenitor cells,EPCs)培养基的配制
取出洁净无菌的100ml离心管,用50ml无菌注射器取不含血清不含任何生长因子的EGM-2培养基100ml至上述离心管中,再用移液枪分别取1/5体积EGM-2培养基套装中的hEGF、Hydrocortisone、R3-IGF-1、GA-1000、Heparin、h FGF-B、VEGF于上述离心管中,最后用移液枪取1ml青链霉素混合液于上述配好的培养基中,之后摇匀即可使用,4℃保存,时间不超过1周。
二、制作细胞制剂
1、EPCs的分离和培养
本实施例的EPCs来自肾脏组织,由哈佛大学附属医院布莱根妇女医院肾内科提供,用上述配好的EPCs专用培养基EGM-2重悬细胞,之后均匀接种于预先包被有人纤维连接蛋白的60mm无菌细胞培养皿中,置于37℃、5%CO
2、非接触性共培养实验
本实施例所用的MSCs(脐带间充质干细胞,Umbilical cord mesenchymal stemcells,也可缩写为UC-MSCs)来源于深圳市第二人民医院妇产科,按照组织块贴壁培养方法制备得到。MSCs与EPCs进行非接触性共培养,具体为:将5×10
本实施例采用了非接触性共培养的方式对MSCs与EPCs进行了共培养,以便更好的区分两种细胞,同时也更好的观察EPCs形态学的变化。我们于共培养48h后在倒置的光学显微镜下观察了EPCs单独培养组以及MSCs与EPCs共培养组中EPCs形态学的变化,结果显示:EPCs单独培养组中的细胞呈细小的点状、不规则生长,而培养组中细胞呈鹅卵石样生长,说明MSCs分泌细胞因子可促进EPCs分化成ECs,证明MSCs+EPCs注射入体内后,可促进肾纤维化肾组织的局部ECs(Endothelial cells;血管内皮细胞)的生成,以修复肾纤维化的肾脏组织细胞,达到临床治疗的目的。
图1是倒置光学显微镜下观察的细胞形态学的变化图,其中,左图是EPCs单独培养的倒置光学显微镜下观察的细胞形态图,右图是EPCs和MSCs共培养的倒置光学显微镜下观察的细胞形态图。
3、将共培养后的上室和下室的细胞收集后,加入生理盐水制成所述细胞制剂(本发明实施例中表示为“EPCs+MSCs”),具体的是加入1mL生理盐水制成所述细胞制剂。
三、UUO小鼠模型的制备
单侧输尿管结扎(Unilateral ureteral occlusion,UUO)模型是目前研究肾间质纤维化最常用的动物模型之一。结扎单侧输尿管导致肾脏引流系统的阻塞,进而引起肾脏结构的慢性损伤,肾功能退化,以此模拟类似于人的肾间质纤维化相关疾病。
本实验中所用的清洁健康雄性BALB/c小鼠(6~8周龄,体重18~22g)来源于西安交通大学实验动物中心,合格证号:SCXK-(陕)2018-001。实验动物及实验条件符合国家科技委员会颁布的《实验动物管理条例》。
BALB/c小鼠的饲养和使用严格按照动物实验使用规范及伦理要求进行。饲养环境保持清洁,每笼不超过5只,保证充足的食物和水,严格控制温度(20~25℃)、湿度(40%~70%),光照12h昼夜交替。
造模步骤如下:
(1)麻醉:术前BALB/c小鼠禁食不禁水12h,使用3%戊巴比妥钠10mL/kg腹腔注射麻醉小鼠,右侧卧位固定小鼠,局部剃毛;
(2)切口:手术部位用常规碘伏消毒,75%酒精除碘,取左侧肋腰点周围为手术切口,长约1cm,逐层剪开皮肤、肌肉和腹壁;
(3)分离:暴露左肾脏和肾蒂,钝性分离左侧输尿管;
(4)结扎:用4-0号线在左侧输尿管上下进行两次结扎,切断两道结扎点之间的输尿管,将输尿管断端置于原位;
(5)缝合:逐层缝合,缝合处给予适量青霉素;
(6)复苏:在动物孵箱27~36℃保温30~60min,至苏醒后移至动物笼中。
Sham组小鼠仅将左侧输尿管游离至肾盂连接处,不进行其他处理。
四、实验动物分组及给药
采用UUO小鼠模型将小鼠随机分为以下3组:
1)假手术组(Sham,n=6);
2)UUO组(模型组)(n=6);
3)给药组:EPCs+MSCs给药(EPCs+MSCs,n=6)。
其中,给药组是以1ml的EPCs+MSCs连续尾静脉注射给药7d(每天一次)。Sham组和模型组以等量生理盐水尾静脉注射7d(每天一次)。
五、肾组织样本收集
Sham组、模型组和给药组均于第7d处死。麻醉小鼠并将其固定,沿腹壁正中线剪开腹腔、胸腔,暴露心脏和肾脏。腹主动脉抽血,用预冷的PBS灌注腹主动脉,至肾脏苍白色。切除小鼠左肾,快速去除外周脂肪组织及肾包膜,放出肾脏内积水。手术刀片沿中间切开,部分肾组织置于10%中性福尔马林组织固定液中,常温固定24~48h后进行石蜡包埋,切片。其余肾组织保存于EP管中置于液氮中冷冻保存,用于蛋白印记检测。
六、石蜡切片
(1)脱水:肾组织从固定液中取出,自来水冲洗30min;置于摇床,分别用30%、50%、70%、80%、90%、95%及100%乙醇溶液脱水25min;
(2)透明浸蜡:将肾组织分别置于50%的二甲苯乙醇溶液、二甲苯Ⅰ及二甲苯Ⅱ中,脱水透明20min后放入溶解的石蜡Ⅰ、石蜡Ⅱ中65℃下各1h;
(3)包埋:将肾组织置于包埋盒中央,缓慢倒入热的石蜡待其凝固;
(4)切片:切片前将肾组织放于-20℃冰箱静置1h,设置切片厚度为4μm,捞片,60℃下烤片6h。
七、结果分析
通过HE染色及Masson’s染色,说明EPCs+MSCs可以改善UUO小鼠肾脏纤维化。
1、苏木素-伊红(H&E)染色
(1)切片常规脱蜡:置二甲苯Ⅰ、二甲苯Ⅱ中各浸泡10min,依次用100%、95%、85%及75%乙醇溶液脱水5min,冲洗3次,每次3min;
(2)加入苏木素染液(按标准方案已配制好的)染色5min后,流水冲洗3min;
(3)加入1%盐酸乙醇溶液分化5s,流水下冲洗10~20min;
(4)加入1%伊红溶液(按标准方案已配制好的)染色3min,继续冲洗3min;
(5)依次放入75%、85%、95%和100%乙醇溶液中脱水,每次3min;
(6)置于二甲苯Ⅰ、二甲苯Ⅱ中透明,各10min,风干后用树胶封片,于光学显微镜(×400倍)下观察标本形态。
UUO手术7d后,Sham组小鼠肾脏无明显病理改变,UUO模型组结扎侧肾脏体积增大,肾盂明显扩张,肾实质变薄。如图2所示,为小鼠肾脏组织H&E染色结果示意图,其中左图是Sham组,中图是模型组,右图是给药组(EPCs+MSCs)。H&E染色结果显示Sham组肾组织形态未见明显变化,肾小管上皮细胞胞质丰富,肾小管之间背靠背,肾间质中未见明显炎细胞浸润;模型组肾小管上皮细胞萎缩,肾小管腔扩张,肾间质增宽及炎细胞浸润,肾间质组织中出现成纤维细胞增生和肾间质纤维化。EPCs+MSCs给药对UUO小鼠肾脏病理改变类似于模型组的改变,病变程度明显轻于模型组。
2、Masson’s染色
(1)切片常规脱蜡至水化:置二甲苯Ⅰ、二甲苯Ⅱ中各浸泡10min,依次用100%、95%、85%及75%乙醇溶液脱水5min,冲洗3次,每次3min;
(2)加入100μL的Masson复合染液染色5min后,流水冲洗3min;
(3)加入100μL的磷钼酸溶液染色5min,甩干;
(4)加入100μL苯胺蓝溶液,染色5min,蒸馏水冲洗;
(5)加入100μL分化液分化50s,依次放入75%、85%、95%和100%乙醇溶液中梯度脱水,二甲苯透明,树胶封片。
图3是小鼠肾脏组织Masson’s染色结果示意图,其中左图是Sham组,中图是模型组,右图是给药组(EPCs+MSCs)。Masson’s染色显示Sham组未见明显病理改变,UUO模型组出现严重的间质胶原沉积,局部纤维化。EPCs+MSCs给药能显著地改善UUO导致的肾间质纤维化。
3、Western blot测定肾组织蛋白表达
按照常规Western blot方法进行操作。
如图4所示,为EPCs+MSCs对UUO小鼠肾脏组织中Collagen I、Fibronectin、α-SMA、E-cadherin表达的影响。如图5所示为定量分析显示EPCs+MSCs对UUO小鼠肾脏组织中Collagen I、Fibronectin、α-SMA、E-cadherin表达的影响,其中,##表示与Sham组相比较P<0.01,*表示与UUO组相比较P<0.05,**表示与UUO组相比较P<0.01。
Western blot结果显示UUO导致肾组织中促纤维化蛋白α-SMA、Collagen Ⅰ及Fibronectin显著的上调,同时显著的下调E-cadherin的表达(图4)。EPCs+MSCs干预能显著的抑制UUO模型中上调的α-SMA、CollagenⅠ及Fibronectin的表达,同时显著的上调E-cadherin的表达,定量分析(图5)。这些研究证明EPCs+MSCs对肾间质纤维化有较好的改善作用。
本发明实施例采用单侧输尿管结扎(Unilateral ureteral occlusion,UUO)法构建UUO小鼠模型,通过H&E染色观察本发明的细胞制剂(EPCs+MSCs)对小鼠肾损伤的改善作用,Masson’s染色观察EPCs+MSCs对小鼠肾间质纤维化改善作用,通过Western blot分子生物学方法,检测EPCs+MSCs对小鼠肾脏促纤维化蛋白表达的影响。体内实验证明EPCs+MSCs对肾纤维化的抑制作用,能够增强抗肾纤维化活性,为开发新型抗肾纤维化药物提供了理论基础与实验依据。
本发明的背景部分可以包含关于本发明的问题或环境的背景信息,而不一定是描述现有技术。因此,在背景技术部分中包含的内容并不是申请人对现有技术的承认。
以上内容是结合具体/优选的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其还可以对这些已描述的实施方式做出若干替代或变型,而这些替代或变型方式都应当视为属于本发明的保护范围。在本说明书的描述中,参考术语“一种实施例”、“一些实施例”、“优选实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管已经详细描述了本发明的实施例及其优点,但应当理解,在不脱离专利申请的保护范围的情况下,可以在本文中进行各种改变、替换和变更。
- 一种用于治疗肾纤维化的细胞制剂及制备方法和应用
- 一种用于治疗心肌梗死的混合细胞制剂及制备方法与应用
