CFTR调节剂及其使用方法
文献发布时间:2023-06-19 18:35:48
本申请是2016年12月23日提交的发明名称为“CFTR调节剂及其使用方法”的第201680082483.1号中国专利申请的分案申请。
相关申请的交叉引用
本申请要求2015年12月24日提交的美国临时申请号62/387,590的优先权和权益,其全部内容出于所有目的整体援引加入本文。
关于在联邦政府资助的研究和开发下做出的发明的权利的声明
本发明是在国家卫生研究院授予的批准号TR000004、EY023981、EY013574、EB000415、 DK035124、DK072517和DK101373下由政府支持完成的。政府对本发明具有某些权利。
发明背景
便秘是成人和儿童中常见的临床疾病,其对生活质量产生负面影响。据估计,美国人口中慢性便秘的患病率是15%,医疗费用估计每年约70亿美元,泻药的花费超过5亿美元。主要的便秘治疗包括泻药,其中许多是可获得的非处方药(可溶性纤维、聚乙二醇、益生菌等)。有两种FDA批准的氯通道激活剂(鲁比前列酮和利那洛肽)用于治疗便秘,但临床试验表明这两种药物的疗效可变且不显著。尽管有广泛的治疗选择,但仍然需要安全有效的药物来治疗便秘。
干眼症是一种异质性泪膜障碍,其导致眼不适、视觉障碍和眼表面病理学,并且因可获得的有效治疗选择有限而在眼部疾病中仍然存在未满足的需求。干眼症是老龄人口中的主要公共健康问题,影响多达全球人口的三分之一,其中包括500万50岁及以上的美国人。非处方人工泪液和可植入的泪点塞经常用于症状缓解。治疗方法涉及减少眼表炎症或增加泪液/黏蛋白分泌。目前唯一批准用于干眼症的药物是局部用环孢菌素,一种在大多数干眼症患者中并未消除所有症状的抗炎药。因此,中度至重度干眼症需要额外的治疗。本文描述的尤其是本领域中这些和其他问题的解决方案。
发明概述
本文提供具有下式的化合物:
在式I的化合物中,X是键、-O-、-N(R
本文还提供药物组合物。在一方面是包括本文描述的化合物或其药学上可接受的盐(例如式I的化合物)的药物组合物。
本文还提供激活囊性纤维化穿膜传导调节蛋白(CFTR)的方法。所述方法包括使CFTR与有效量的本文描述的化合物接触,由此激活CFTR。
本文还提供治疗有需要的个体的疾病或障碍的方法,其通过向所述个体给药有效量的本文描述的化合物(例如式I的化合物)。
本文还提供通过向所述个体给药有效量的如本文所述的化合物(例如式I的化合物)治疗有需要的个体的疾病或障碍的方法。在一方面,是治疗有需要的个体的便秘的方法,所述方法包括向所述个体给药有效量的如本文所述的化合物(例如式I的化合物)。在另一方面,是治疗有需要的个体的干眼症障碍的方法,所述方法包括向个体给药有效量的如本文所述的化合物(例如式I的化合物)。在又另一方面,是增加有需要的个体的流泪的方法,所述方法包括向个体给药有效量的如本文所述的化合物(例如式I的化合物)。
在一方面,提供治疗有需要的个体的淤胆型肝病的方法,其包括向所述个体给药有效量的如本文所述的化合物(例如式I的化合物)。在另一方面,提供治疗有需要的个体的肺部疾病或障碍的方法,其包括向所述个体给药有效量的如本文所述的化合物(例如式I的化合物)。在实施方案中,所述肺部疾病或障碍是慢性阻塞性肺疾病(例如支气管炎、哮喘、香烟烟雾诱导的肺功能障碍)。
附图简述
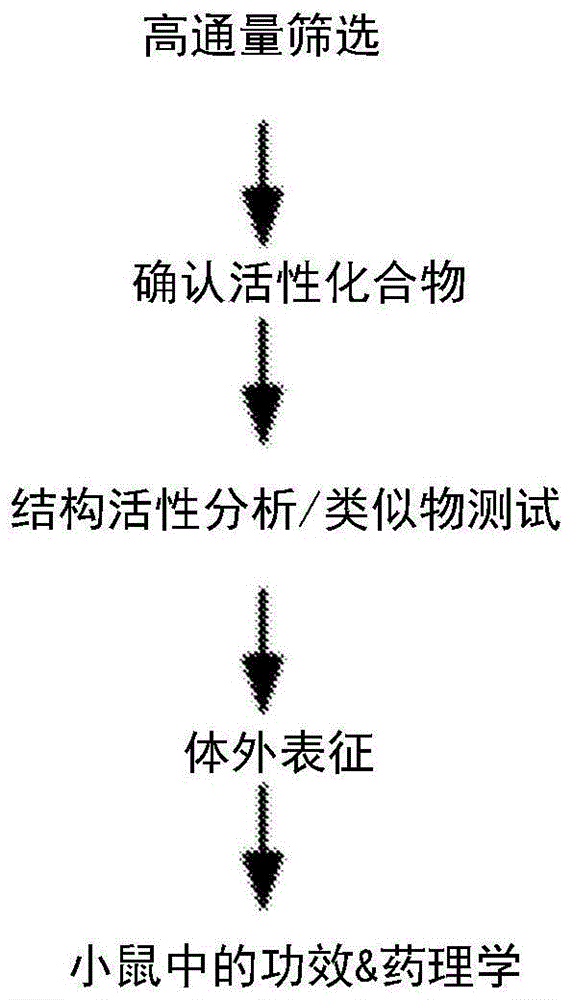
图1.用于干眼症疗法的CFTR激活剂的临床前开发策略。通过高通量筛选鉴定的人野生型 CFTR激活剂的激活剂通过电生理学和生物化学测定确认和表征,然后通过测量电位差和泪液分泌在活小鼠中测试眼表活性。然后在干眼症啮齿动物模型中测试最佳化合物的药代动力学性质和功效。
图2A-2D.CFTR激活剂的体外表征。图2A)(上)化学结构。(下)在表达野生型CFTR的Fischer 大鼠甲状腺(FRT)细胞中测量的代表性短路电流(I
图3A-3E.活小鼠中CFTR激活剂在眼表的电位差(PD)测量。图3A)(左)麻醉小鼠的照片,其显示眼表灌注用于PD测量。连接到测量电极的灌注导管垂直于眼表定向。交叉夹紧钳缩回上眼睑以暴露角膜和延髓/睑结膜以进行灌注。参比电极通过皮下蝴蝶针接地。(右)用于测试CFTR活动的典型实验的PD追踪示意图,如结果中所述。图3B)野生型小鼠中代表性的眼表PD测量。溶液组合物详见参考文献22。浓度:阿米洛利,100μM;福司可林和CFTR
图4A-4D.在活小鼠中CFTR激活剂的泪液分泌测量。图4A)在单剂量局部施用载体(PBS, 0.5%聚山梨醇酯,0.5%DMSO)、霍乱毒素(0.1μg/mL)、福司可林(20μM)或福司可林+IBMX(250 μM)之前和之后的指定时间测量泪液。在用4%利多卡因预先麻醉眼表面以抑制刺激和反射性泪液分泌后测量霍乱毒素的作用(平均值±SEM,每种条件6-10只眼)。图4B)局部递送所示化合物后泪液分泌的时间过程。浓度:CFTR
图5A-5C.化合物药理学。图5A)在单剂量(0.1nmol)给药后的指定时间,泪液中CFTR
图6A-6C.在LGE后,局部CFTR
图7.针对CFTR筛选的化合物的EC
图8A-8D.小分子CFTR激活剂的鉴定。图8A.项目概况。图8B.CFTR激活剂筛选使用共表达人野生型CFTR和YFP碘化物感应蛋白的FRT细胞。在添加碘化物之前,在室温下在福司可林(125 nM)存在下加入10μM的测试化合物,持续10分钟。来自96孔板的单个孔的数据的实例显示 CFTR
图9A-9E.CFTR
图10A-10D.在洛哌丁胺处理的小鼠中CFTR
图11A-11C.在洛哌丁胺处理的小鼠中,口服给药CFTR
图12A-12D.CFTR
图13A-13E.图13A.在孵育特定时间后,在小鼠肝微粒体中测定的CFTR
图14A-14B.氨基苯基-1,3,5-三嗪CFTR激活剂的结构-活性分析。图14A.CFTR
图15A-15B.6k和12激活CFTR的短路电流测量。图15A.在表达人野生型CFTR的FRT细胞中进行的测量显示对指定浓度的福司可林,6k或12和10μM CFTR抑制剂CFTR
图16A-16E.6k和12的表征。图16A.用10μM 6k或12,不含或含90nM福司可林(fsk),以及单独使用福司可林(90nM和20μM)和福司可林(20μM)+IBMX(100μM)孵育10分钟后, FRT细胞中的细胞cAMP(平均值±S.E.M.,n=4)。图16B.通过Fluo-4荧光测量细胞质钙。FRT细胞用10μM 6k或12(或对照)预处理5分钟,如所示加入100μM ATP作为钙激动剂。图16C.在表达YFP的FRT细胞中测量的TMEM16A活性显示没有被10μM 6k或12抑制(左,添加碘化物 +ATP)或激活(右,添加碘化物)。图16D.在表达YFP的HT-29细胞中测量的CaCC活性显示没有被10μM 6k或12激活(添加碘化物)或抑制(添加碘化物+ATP)。图16E.(左)响应于靶向关键离子转运过程的激动剂和抑制剂的人支气管上皮细胞的原代培养物中的短路电流:20μM阿米洛利(ami);20μM福司可林(fsk);10μM CFTR
图17A-17B.化合物药理学。图17A.细胞毒性通过阿尔玛蓝测定法在用10μM 6k或12孵育8 小时的FRT细胞中测量,用33%DMSO作为阳性对照(平均值±S.E.M.,n=8)。图17B.体外代谢稳定性。将5μM化合物在NADPH存在下与1mg/ml肝微粒体孵育指定的时间,并通过LC/MS测定母体化合物(平均值±S.E.M.,n=3)。右侧显示12的LC/MS曲线,x轴上为针对0、15和60分钟的孵育时间的洗脱时间。
图18A-18C.在眼部递送1或12后小鼠的泪液体积。图18A.在单次眼部递送载体,2.5μL体积的1(250pmol)或12(250pmol)之前以及之后的指定时间测量泪液体积。图18B.如A中的研究但是在缺乏功能性CFTR的CF小鼠中进行。图18C.如A中的单剂量研究,使用不同量的12。数据报告为平均值±S.E.M.,5只小鼠,每种条件10只眼,与载体对照相比,*p<0.05,**p<0.01。
发明详述
本文所用的缩写具有其在化学和生物学领域中的常规含义。本文阐述的化学结构和化学式根据化学领域已知的化学价标准规则构造。
取代基团用其常规化学式指定,从左到右书写时,其同样涵盖从右到左书写结构会产生的化学上相同的取代基,例如,-CH
除非另有规定,否则术语“烷基”,本身或作为另一取代基的一部分,意指直链(即,未分支)或分支碳链(或碳),或其组合,其可为完全饱和、单或多不饱和并且可包括单价、二价或多价基,具有指定碳原子数(即,C
除非另有规定,否则术语“亚烷基”,本身或作为另一取代基的一部分,意指源自烷基的二价基,例如但不限于-CH
除非另有规定,否则术语“杂烷基”,本身或与另一术语组合,意指稳定的直链或支链,或其组合,包括至少一个碳原子和至少一个杂原子(例如,选自O、N、P、Si和S),并且其中氮和硫原子可任选地被氧化,并且氮杂原子可任选地被季铵化。杂原子(例如,O、N、P、S、B、As和Si)可位于杂烷基的任一内部位置或烷基连接到分子其余部分的位置。杂烷基为未环化链。实例包括但不限于: -CH
类似地,除非另有规定,否则术语“亚杂烷基”,本身或作为另一取代基的一部分,意指源自杂烷基的二价基,例如但不限于-CH
除非另有规定,否则术语“环烷基”和“杂环烷基”,本身或与其它术语组合,分别意指“烷基”和“杂烷基”的环状形式。环烷基和杂烷基不是芳香族。另外,对于杂环烷基而言,杂原子可占据杂环连接到分子其余部分的位置。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、1-环己烯基、 3-环己烯基、环庚基等。杂环烷基的实例包括但不限于1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、 3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、 1-哌嗪基、2-哌嗪基等。“亚环烷基”和“亚杂环烷基”,单独地或作为另一取代基的一部分,分别意指源自环烷基和杂环烷基的二价基。
除非另有规定,否则术语“卤代”或“卤素”,本身或作为另一取代基的一部分,意指氟、氯、溴或碘原子。另外,术语如“卤代烷基”意在包括单卤代烷基和多卤代烷基。例如,术语“卤代(C
除非另有规定,否则术语“酰基”意指-C(O)R,其中R为被取代的或未被取代的烷基、被取代的或未被取代的环烷基、被取代的或未被取代的杂烷基、被取代的或未被取代的杂环烷基、被取代的或未被取代的芳基或者被取代的或未被取代的杂芳基。
除非另有规定,否则术语“芳基”意指多不饱和、芳香族、烃取代基,其可以是单环或稠合在一起 (即,稠环芳基)或共价连接的多个环(优选1至3个环)。稠环芳基是指稠合在一起的多个环,其中至少一个稠环为芳基环。术语“杂芳基”是指含有至少一个杂原子如N、O或S的芳基(或环),其中氮和硫原子任选地被氧化,并且氮原子任选地被季铵化。因此,术语“杂芳基”包括稠环杂芳基(即,稠合在一起的多个环,其中至少一个稠环为芳杂环)。5,6-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有5元且另一个环具有6元,且并且其中至少一个环为杂芳基环。同样,6,6-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有6元且另一个环具有6元,并且其中至少一个环为杂芳基环。并且6,5-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有6元且另一个环具有5元,并且其中至少一个环为杂芳基环。杂芳基可通过碳或杂原子连接到分子其余部分。芳基和杂芳基的非限制性实例包括苯基、萘基、吡咯基、吡唑基、哒嗪基、三嗪基、嘧啶基、咪唑基、吡嗪基、嘌呤基、噁唑基、异噁唑基、噻唑基、呋喃基、噻吩基(thienyl)、吡啶基、嘧啶基、苯并噻唑基、苯并噁唑基、苯并咪唑基、苯并呋喃基、异苯并呋喃基、吲哚基、异吲哚基、苯并噻吩基(benzothiophenyl)、异喹啉基、喹喔啉基、喹啉基、1-萘基、2-萘基、4-联苯基、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-噁唑基、4-噁唑基、2-苯基-4-噁唑基、5-噁唑基、3-异噁唑基、 4-异噁唑基、5-异噁唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、 5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喔啉基、5-喹喔啉基、3-喹啉基和6-喹啉基。上面提到的每个芳基和杂芳基环系的取代基选自下面描述的可接受的取代基。“亚芳基”和“亚杂芳基”,单独地或作为另一取代基的一部分,分别意指源自芳基和杂芳基的二价基。杂芳基取代基可以是-O-键合至环杂原子氮上。
“稠环芳基-杂环烷基”是与杂环烷基稠合的芳基。“稠环杂芳基-杂环烷基”是与杂环烷基稠合的杂芳基。“稠环杂环烷基-环烷基”是与环烷基稠合的杂环烷基。“稠环杂环烷基-杂环烷基”是与另一个杂环烷基稠合的杂环烷基。“稠环芳基-杂环烷基、稠环杂芳基-杂环烷基、稠环杂环烷基-环烷基或稠环杂环烷基-杂环烷基”可以各自独立地为未被取代的或者被一个或多个本文描述的取代基取代。稠环芳基-杂环烷基、稠环杂芳基-杂环烷基、稠环杂环烷基-环烷基或稠环杂环烷基-杂环烷基可以各自独立地根据稠环的每个的大小进行命名。因此,例如,6,5芳基-杂环烷基稠环描述6元芳基部分与5元杂环烷基稠合。螺环是两个或更多个环,其中相邻环通过单个原子连接。螺环内的单个环可以相同或不同。螺环内的单个环可以是被取代的或未被取代的并且可具有不同于一组螺环内其它单个环的取代基。螺环内单个环的可能取代基,在不是螺环的一部分时,是相同环的可能取代基(例如,环烷基或杂环烷基环的取代基)。螺环可以是被取代的或未被取代的环烷基、被取代的或未被取代的亚环烷基、被取代的或未被取代的杂环烷基或者被取代的或未被取代的亚杂环烷基并且螺环基团内的单个环可以是前一列表中的任一种,包括具有一种类型的所有环(例如,所有环均为被取代的亚杂环烷基,其中每个环可以是相同或不同的被取代的亚杂环烷基)。当提到螺环环系时,杂环螺环意指其中至少一个环为杂环并且其中每个环可以是不同环的螺环。当提到螺环环系时,被取代的螺环意指至少一个环被取代并且每个取代基可以任选地不同。
如本文中所用,术语“氧代”意指与碳原子双键键合的氧。
以上每个术语(例如,“烷基”、“杂烷基”、“芳基”和“杂芳基”)包括指定基团的被取代和未被取代形式两种。下面提供了每种类型的基团的优选取代基。
烷基和杂烷基(包括常常称为亚烷基、烯基、亚杂烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的那些基团)的取代基可以是选自但不限于以下的各种基团中的一种或多种:-OR'、=O、=NR'、=N-OR'、-NR'R”、-SR'、-卤素、-SiR'R”R”'、-OC(O)R'、-C(O)R'、-CO
与针对烷基描述的取代基类似,芳基和杂芳基的取代基是变化的并且选自,例如:-OR'、-NR'R”、 -SR'、-卤素、-SiR'R”R”'、-OC(O)R'、-C(O)R'、-CO
环(例如环烷基、杂环烷基、芳基、杂芳基、亚环烷基、亚杂环烷基、亚芳基或亚杂芳基)的取代基可描述为环上,而不是环的特定原子上的取代基(通常称为浮动取代基)。在这种情况下,取代基可连接到任一环原子(遵照化学价规则)并且在稠环或螺环的情况下,描述为与稠环或螺环的一个成员相关的取代基(单环上的浮动取代基),可以是任一稠环或螺环上的取代基(多个环上的浮动取代基)。当取代基连接到环上,而不是特定原子上(浮动取代基),并且取代基的下标是大于一的整数时,多个取代基可以在相同原子、相同环、不同原子、不同稠环、不同螺环上,并且每个取代基可任选地不同。环与分子其余部分的连接点不限于单个原子时(浮动取代基),连接点可以是环的任一原子并且在稠环或螺环的情况下,任一稠环或螺环的任一原子同时遵照化学价规则。环,稠环或螺环含有一个或多个环杂原子并且显示该环,稠环或螺环具有一个或多个浮动取代基(包括但不限于,与分子其余部分的连接点)时,浮动取代基可与杂原子键合。当具有浮动取代基的结构或式中显示环杂原子与一个或多个氢结合时(例如,环氮具有两个至环原子的键和至氢的第三键),当杂原子与浮动取代基键合时,取代基会被理解为置换氢,同时遵照化学价规则。
两个或更多个取代基可任选地连接形成芳基、杂芳基、环烷基或杂环烷基。此类所谓的成环取代基,不一定但通常,发现与环状基础结构连接。在一个实施方案中,成环取代基与基础结构的相邻成员连接。例如,与环状基础结构的相邻成员连接的两个成环取代基产生稠环结构。在另一个实施方案中,成环取代基与基础结构的单个成员连接。例如,与环状基础结构的单个成员连接的两个成环取代基产生螺环结构。再一个实施方案中,成环取代基与基础结构的非相邻成员连接。
芳基或杂芳基环的相邻原子上的两个取代基可任选地形成式-T-C(O)-(CRR')
如本文中所用,术语“杂原子”或“环杂原子”意在包括氧(O)、氮(N)、硫(S)、磷(P)、硼(B)、砷(As) 和硅(Si)。
如本文中所用,“取代基”意指选自以下部分的基团:
(A)氧代、卤素、-CF
(B)烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基,其被选自以下的至少一个取代基取代:
(i)氧代、卤素、-CF
(ii)烷基、杂烷基、环烷基、杂环烷基、芳基和杂芳基,其被选自以下的至少一个取代基取代:
(a)氧代、卤素、-CF
(b)烷基、杂烷基、环烷基、杂环烷基、芳基或杂芳基,其被选自以下的至少一个取代基取代:氧代、卤素、-CF
如本文中所用,“大小受限的取代基”或“大小受限的取代基基团”意指选自以上针对“取代基基团”所描述的所有取代基的基团,其中每个被取代的或未被取代的烷基是被取代的或未被取代的C
如本文中所用,“低级取代基”或“低级取代基基团”,意指选自以上针对“取代基基团”所描述的所有取代基的基团,其中每个被取代的或未被取代的烷基是被取代的或未被取代的C
在一些实施方案中,在本文化合物中描述的每个被取代的基团是被至少一个取代基基团取代。更具体地,在一些实施方案中,在本文化合物中描述的每个被取代的烷基、被取代的杂烷基、被取代的环烷基、被取代的杂环烷基、被取代的芳基、被取代的杂芳基、被取代的亚烷基、被取代的亚杂烷基、被取代的亚环烷基、被取代的亚杂环烷基、被取代的亚芳基和/或被取代的亚杂芳基是被至少一个取代基基团取代。在其它实施方案中,这些基团中的至少一个或全部被至少一个大小受限的取代基基团取代。在其它实施方案中,这些基团中的至少一个或全部被至少一个低级取代基基团取代。
在本文化合物的其它实施方案中,每个被取代的或未被取代的烷基可以是被取代的或未被取代的C
在一些实施方案中,每个被取代的或未被取代的烷基是被取代的或未被取代的C
本文描述的某些化合物具有不对称碳原子(光学或手性中心)或双键;依据绝对立体化学,对于氨基酸和单个异构体而言可以定义为(R)-或(S)-,或(D)-或(L)-的对映异构体、外消旋物、非对映异构体、互变异构体、几何异构体、立体异构体形式涵盖在本发明的范围内。本发明的化合物不包括本领域中已知太不稳定而无法合成和/或分离的那些。本发明意在包括呈外消旋和光学纯形式的化合物。光学活性的(R)-和(S)-或者(D)-和(L)-异构体可以使用手性合成子或手性试剂制备,或使用常规技术分解。当本文描述的化合物含有烯键或其它几何不对称中心,并且除非另有说明时,意图是所述化合物包括E和Z几何异构体两种。
如本文中所用,术语“异构体”是指具有相同数量和种类的原子,并因此具有相同分子量,但是关于原子的结构排列或构型不同的化合物。
如本文中所用,术语“互变异构体”是指平衡存在并且易于从一种异构体形式转化为另一种的两种或更多种结构异构体中的一种。
本领域的技术人员会显而易见的是,本发明的某些化合物可呈互变异构体形式存在,化合物的所有此类互变异构体形式均在本发明范围内。
除非另有规定,否则本文描述的结构也意在包括该结构的所有立体化学形式;即,每个不对称中心的(R)和(S)构型。因此,本化合物的单个立体化学异构体以及对映异构体和非对映异构体混合物 (本领域技术人员通常认为是稳定的)在本发明的范围内。
除非另有规定,否则本文描述的结构也意在包括仅在一个或多个富含同位素的原子的存在上不同的化合物。例如,除了氢被氘或氚置换,氟被
本发明的化合物也可在构成此类化合物的一个或多个原子处含有非天然比例的原子同位素。例如,化合物可用放射性同位素,例如氚(
符号
当一个部分被R取代基取代时,该基团可以称为“被R取代”。当一个部分被R取代时,该部分是被至少一个R取代基取代并且每个R取代基任选地不同。在化学种类的描述(如式(I)或式I)中存在特定R基团时,可以使用罗马小数符号来区分该特定R基团的每种外观。例如,存在多个R
对本发明化合物的描述受本领域技术人员已知的化学键合原理限制。因此,基团可以被许多取代基中的一种或多种取代时,选择此类取代基以便遵从化学键合原理并产生并非本来就不稳定和/或会为本领域普通技术人员已知很可能在环境条件下(例如含水、中性和几种已知的生理条件下)不稳定的化合物。例如,杂环烷基或杂芳基依照本领域技术人员已知的化学键合原理通过环杂原子与分子其余部分连接,从而避免有本来就不稳定的化合物。
“类似物”根据其在化学和生物学中的简单普通含义使用并且是指在结构上与另一种化合物(即,所谓的“参考”化合物)类似,但在组成上不同,例如一个原子被不同元素的原子置换,或在特定官能团的存在上,或一个官能团被另一个官能团置换,或参考化合物的一个或多个手性中心的绝对立体化学上不同的化学化合物。因此,类似物是在功能和外观上而不是在结构或来源上与参考化合物相似或类似的化合物。
术语“囊性纤维化穿膜传导调节蛋白”和“CFTR”在本文可互换使用,并根据它们通常的普通含义,是指相同或相似名称的蛋白和其功能片段和同源物。该术语包括保持CFTR活性的任何重组的或天然存在的形式或其变体(例如,相比于CFTR在至少30%、40%、50%、60%、70%、80%、90%、95%或100%活性内)。
术语“药学上可接受的盐”意在包括根据本文描述的化合物上发现的特定取代基而定,用相对无毒的酸或碱制备的活性化合物的盐。当本发明化合物含有相对酸性的官能团时,可以通过使中性形式的此类化合物与足量的所需碱(纯的或在合适的惰性溶剂中)接触而获得碱加成盐。药学上可接受的碱加成盐的实例包括钠、钾、钙、铵、有机氨基或镁盐或类似的盐。当本发明化合物含有相对碱性的官能团时,可以通过使中性形式的此类化合物与足量的所需酸(纯的或在合适的惰性溶剂中)接触而获得酸加成盐。药学上可接受的酸加成盐的实例包括源自无机酸的那些盐,所述无机酸如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等,以及源自相对无毒的有机酸的盐,所述有机酸如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、枸橼酸、酒石酸、草酸、甲磺酸等。还包括氨基酸的盐如精氨酸盐等,以及有机酸如葡糖醛酸或半乳糖醛酸等的盐(参见,例如Berge等人,“Pharmaceutical Salts”,Journal of Pharmaceutical Science,1977,66,1-19)。本发明的某些特定化合物含有碱性及酸性官能团两者,这允许化合物转变为碱或酸加成盐。
因此,本发明的化合物可作为如用药学上可接受的酸形成的盐存在。本发明包括此类盐。此类盐的实例包括盐酸盐、氢溴酸盐、硫酸盐、甲磺酸盐、硝酸盐、马来酸盐、乙酸盐、枸橼酸盐、富马酸盐、酒石酸盐(例如(+)-酒石酸盐、(-)-酒石酸盐或其混合物,包括外消旋混合物)、琥珀酸盐、苯甲酸盐以及用氨基酸如谷氨酸形成的盐。这些盐可以通过本领域技术人员已知的方法来制备。
中性形式的化合物优选通过使盐与碱或酸接触并且以常规方式分离母体化合物而再生。母体形式的化合物在某些物理特性上,例如在极性溶剂中的溶解度上不同于各种盐形式。
除盐形式以外,本发明还提供呈前药形式的化合物。本文描述的化合物的前药包括易于在生理条件下发生化学或酶的变化以提供本发明化合物的那些化合物。另外,前药可通过化学或生物化学方法在离体环境中转化为本发明的化合物。例如,当与合适的酶或化学试剂放置在透皮贴剂贮库中时,前药可缓慢转化为本发明的化合物。
本发明的某些化合物可以呈非溶剂化形式以及溶剂化形式(包括水合形式)存在。一般而言,溶剂化形式与非溶剂化形式等效并且涵盖在本发明的范围内。本发明的某些化合物可以呈多晶或无定形形式存在。一般而言,所有物理形式对于本发明所涵盖的用途是等效的并且旨在属于本发明的范围之内。
如本文所用,术语“盐”是指在本发明的方法中使用的化合物的酸盐或碱盐。可接受的盐的说明性实例为无机酸(盐酸、氢溴酸、磷酸等)盐、有机酸(乙酸、丙酸、谷氨酸、柠檬酸等)盐、季铵(甲基碘化物、乙基碘化物等)盐。
术语“治疗”是指成功治疗或改善损伤、疾病、病理或病状的任何标记,包括任何客观或主观参数,如症状的减轻;缓解;减少或者使得损伤、病理或病状更为患者所耐受;退化或衰退速率减缓;使得退化终点衰弱程度较小;或改善患者的身体或精神健康。症状的治疗或改善可以基于客观或主观参数,包括身体检查、神经精神检查和/或精神病学评价的结果。术语“治疗”及其变形包括预防损伤、病理、病状或疾病。
“有效量”是足以实现规定目的(例如达到其给药的效果,治疗疾病,降低酶活性,增加酶活性,减轻疾病或病状的一种或多种症状)的量。“有效量”的实例是足以促进疾病的一种或多种症状的治疗、预防或减轻的量,也可称为“治疗有效量”。一种或多种症状的“减轻”(以及该短语的语法同等词)意指降低症状的严重程度或频率,或消除症状。药物的“预防有效量”是药物向个体给药时会具有预期的预防效果的量,所述预防效果例如预防或延迟损伤、疾病、病理或病状的发作(或复发),或降低损伤、疾病、病理或病状或其症状发作(或复发)的可能性。完全的预防效果不一定通过给药一个剂量而出现,并且可能只有在给药一系列剂量之后出现。因此,预防有效量可以是在一次或多次给药的过程中给药的。确切的量会取决于治疗目的,并且会由本领域技术人员使用已知技术确定(参见,例如,Lieberman,Pharmaceutical Dosage Forms(第1-3卷,1992);Lloyd,The Art,Science andTechnology of Pharmaceutical Compounding(1999);Pickar,Dosage Calculations(1999);及Remington:The Science and Practice of Pharmacy,第20版,2003,Gennaro,Ed.,Lippincott,Williams&Wilkins)。
对于本文所述的任何化合物,治疗有效量可以首先从细胞培养测定中确定。目标浓度会是一种或多种活性化合物的能够实现本文所述方法的那些浓度,如使用本文所述或本领域已知的方法所测得的。
如本领域中所公知的,在人体中使用的治疗有效量也可以从动物模型确定。例如,用于人体的剂量可以配制成达到已在动物中发现有效的浓度。如上所述,可以通过监测化合物有效性并向上或向下调整剂量来调整人体中的剂量。基于上述方法和其他方法来调整剂量以达到在人体中的最大功效,这完全在普通技术人员的能力范围内。
剂量可以根据患者的需求和所用的化合物而变化。在本发明的情况中,给药至患者的剂量应当足以随时间在患者体内实现有益的治疗反应。剂量的大小还会由任何不良副作用的存在、性质和程度来确定。确定特定情形的适当剂量在从业者的技术范围内。一般来讲,治疗以小于化合物最佳剂量的较小剂量开始。随后,剂量小幅增加,直到达到在情况下的最佳效果为止。
剂量和间隔可以单独调整,以提供对正在治疗的特定临床适应症有效的所给药化合物的水平。这会提供与个体疾病状态的严重程度相称的治疗方案。
利用本文所提供的教导内容,可以计划有效的预防性或治疗性治疗方案,该方案不会引起显著的毒性,但对于治疗特定患者所表现的临床症状是有效的。该计划应当涉及通过考虑诸如化合物效力、相对生物利用度、患者体重、不良副作用的存在及其严重性、优选的给药方式和所选剂的毒性特征的因素来仔细地选择活性化合物。
“对照”或“对照实验”根据其简单普通含义使用并且是指除了省略实验步骤、试剂或变量外,如同在平行实验中那样处理实验的个体或试剂的实验。在一些情况下,对照作为比较标准用于评价实验效果。在实施方案中,对照是在本文所述化合物(包括实施方案和实施例)不存在的情况下,对蛋白质活性的测量。
“接触”根据其简单普通含义使用并且是指使至少两种不同的物类(例如化学化合物,包括生物分子或细胞)变得足够接近以便反应、相互作用或物理性触碰的过程。然而,应认识到,所得反应产物可直接由所加试剂之间的反应生成或由反应混合物中可生成的来自一种或多种所加试剂的中间产物生成。
术语“接触”可包括使两种物类反应、相互作用或物理性接碰,其中两种物类可以是本文描述的化合物和蛋白质或酶。接触可包括使本文描述的化合物与信号传导途径中所涉及的蛋白质或酶相互作用。
如本文所定义,关于蛋白质-激活剂相互作用的术语“激活”、“活化”等意指,相对于不存在该激活剂时该蛋白质的活性或功能,正面影响(例如提高)该蛋白质的活性或功能。激活可指减少疾病或疾病的症状。激活可指特定蛋白质或核酸靶标的活性增加。该蛋白质可以是囊性纤维化穿膜传导调节蛋白。因此,激活至少部分地包括部分或完全增大刺激,增强、促进或加快激活,或者激活、敏化或上调信号转导或酶活性或蛋白质的量。
术语“调节剂(modulator)”是指提高或降低靶分子水平,或者靶分子功能,或者分子靶标的物理状态的组合物。
术语“调节(modulate)”根据其简单普通含义使用并且是指变化或改变一种或多种性质的行为。“调节(Modulation)”是指变化或改变一种或多种性质的过程。例如,靶蛋白的调节剂通过增加或降低靶分子的性质或功能或靶分子的量来变化。疾病的调节剂减少靶疾病的症状、病因或特征。
化合物的“选择(Selective)”或“选择性(selectivity)”等是指化合物区分分子靶标的能力。化合物的“特异的(Specific)”、“特异地(specifically)”、“特异性(specificity)”等是指化合物对特定分子靶标产生特定作用(诸如抑制)而对细胞内其他蛋白作用很小或没有作用的能力。
“药学上可接受的赋形剂”和“药学上可接受的载体”是指有助于向个体给药活性剂并被个体吸收,并且可以包括在本发明的组合物中,而不会对患者引起显著不良毒性作用的物质。药学上可接受的赋形剂的非限制性实例包括水、NaCl、生理盐水溶液、乳酸林格氏液(lactated Ringer’s)、普通蔗糖、普通葡萄糖、粘合剂、填充剂、崩解剂、润滑剂、包衣、甜味剂、调味剂、盐溶液(如林格氏液)、醇、油、明胶、碳水化合物(如乳糖、直链淀粉或淀粉)、脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷酮和色素等。此类制剂可灭菌,并且若需要,可与不会与本发明的化合物发生有害反应的助剂如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、用于影响渗透压的盐、缓冲剂、着色和/或芳香物质等混合。本领域的技术人员会认识到药物赋形剂在本发明中有用。
术语“制剂(preparation)”旨在包括活性化合物与作为载体提供胶囊的封装材料的制剂,在胶囊中有或无其它载体的活性组分被载体包围,因此载体与之缔合。类似地,包括扁囊剂和锭剂。片剂、散剂、胶囊、丸剂、扁囊剂和锭剂可作为适于口服给药的固体剂型使用。
如本文中所用,术语“给药”意指口服给药、作为栓剂给药、局部接触、静脉内、肠胃外、腹膜内、肌内、病灶内、鞘内、鼻内或皮下给药,或向个体植入缓释装置,例如微量渗透泵。通过任何途径给药,包括肠胃外和经粘膜(例如,口腔、舌下、腭、齿龈、鼻部、阴道、直肠或透皮)。肠胃外给药包括,例如静脉内、肌内、小动脉内、皮内、皮下、腹膜内、心室内和颅内。其它递送模式包括但不限于使用脂质体制剂、静脉输注、透皮贴剂等。
本文公开的组合物可以通过局部途径透皮递送,可以配制成涂抹棒、溶液剂、混悬剂、乳剂、凝胶剂、霜剂、软膏剂、糊剂、胶冻剂、涂布剂、散剂和气雾剂。口服制剂包括适合患者摄取的片剂、丸剂、散剂、糖衣丸、胶囊剂、液体、锭剂、扁囊剂、凝胶剂、糖浆剂、浆液、混悬剂等。固体形式制剂包括散剂、片剂、丸剂、胶囊剂、扁囊剂、栓剂和分散性颗粒剂。液体形式制剂包括溶液剂、混悬剂和乳剂,例如水溶液剂或水/丙二醇溶液剂。本发明的组合物可以另外包含提供持续释放和/或舒适性的组分。此类组分包括高分子量的阴离子类粘液状(mucomimetic)聚合物、胶凝多糖和细碎的药物载体基质。这些组分在美国专利No.4,911,920、5,403,841、5,212,162和4,861,760中有更详细的讨论。这些专利的全部内容整体援引加入本文,用于所有目的。本文公开的组合物也可以作为微球体递送,以便在体内缓慢释放。例如,微球体可以通过皮内注射在皮下缓慢释放的含药微球体而给药(参见Rao,J.Biomater Sci.Polym.第7版,623-645,1995;可以作为可生物降解和可注射的凝胶制剂而给药(参见例如Gao Pharm.Res.12:857-863,1995);或者作为用于口服给药的微球体而给药(参见例如Eyles,J.Pharm.Pharmacol.49:669-674,1997)。在另一个实施方案中,本发明组合物的制剂可以通过使用与细胞膜融合或被细胞内吞的脂质体来递送,即,通过采用与脂质体连接的受体配体来递送,这些受体配体结合到细胞的表面膜蛋白受体,从而引起细胞内吞作用。通过使用脂质体,特别是在脂质体表面携带了特别针对靶细胞或者说是优先涉及特定器官的受体配体的情况下,可以集中地将本发明的组合物递送到体内的靶细胞中。(参见例如,Al-Muhammed,J.Microencapsul.13:293- 306,1996;Chonn,Curr.Opin.Biotechnol.6:698-708,1995;Ostro,Am.J.Hosp.Pharm.46:1576-1587,1989)。组合物也可以作为纳米粒递送。
药物组合物可包括其中以治疗有效量,即以有效实现它的预定目的的量含有活性成分(例如本文所述的化合物,包括实施方案或实施例)的组合物。对特定应用有效的实际量会尤其取决于正在治疗的病状。当在治疗疾病的方法中给药时,此类组合物会包含有效获得所需结果的量的活性成分,例如调节靶分子的活性,和/或减少、消除或减缓疾病症状的进展。
向哺乳动物给药的剂量和频率(单剂量或多剂量)可以根据多种因素而变化,例如哺乳动物是否患有另一种疾病及其给药途径;接受者的大小、年龄、性别、健康、体重、体质指数和饮食;所治疗疾病症状的性质和程度、同时治疗的种类、所治疗疾病的并发症或其他与健康有关的问题。其他治疗方案或剂可以联合申请人的发明的方法和化合物使用。对已建立的剂量(例如,频率和持续时间)的调整和操作完全在本领域技术人员的能力范围内。
本文描述的化合物可相互组合,与已知在治疗疾病(例如抗便秘、抗干眼症、抗肺部疾病、抗肝疾病或抗肺病)中有用的其它活性药物组合,或与可能单独无效但可有助于活性剂的功效的辅助剂组合使用。因此,本文描述的化合物可彼此联合给药或与已知在治疗疾病中有用的其他活性药物联合给药。
用“联合给药”意指在给药一种或多种附加疗法的同时、就在之前或就在之后给药本文描述的化合物,所述附加疗法例如本文所述的抗便秘或抗干眼症剂。本文描述的化合物可以单独给药或可以向患者联合给药。联合给药意在包括化合物单独地或组合地(一种以上化合物或剂)同时或依次给药。因此,需要时,也可将制剂与其它活性物质组合(例如抗便秘或抗干眼症剂)。
联合给药包括在第二活性剂(例如,抗便秘或抗干眼症剂)0.5、1、2、4、6、8、10、12、16、20 或24小时内给药一种活性剂(例如,本文描述的复合物)。本文还涵盖实施方案,其中联合给药包括在第二活性剂0.5、1、2、4、6、8、10、12、16、20或24小时内给药一种活性剂。联合给药包括同时、大约同时(例如,在彼此约1、5、10、15、20或30分钟内)或以任何顺序依次给药两种活性剂。联合给药可通过共同配制实现,即制备包括两种活性剂的单一药物组合物。在其它实施方案中,活性剂可单独配制。活性剂和/或辅助剂可相互连接或偶联。本文描述的化合物可与用于便秘或干眼症障碍的治疗联合。
在与疾病相关的物质或物质活性或功能的背景下,术语“相关”或“与……相关”意指该疾病由(完全或部分)所述物质或物质活性或功能引起,该疾病的症状由(完全或部分)所述物质或物质活性或功能引起,或该化合物的副作用(例如,毒性)由(完全或部分)所述物质或物质活性或功能引起。
“患者”、“个体”、“有需要的患者”和“有需要的个体”本文可互换使用,是指患有或易患可通过给药本文所提供的药物组合物来治疗的疾病或病状的活生物体。非限制性实例包括人、其它哺乳动物、牛、大鼠、小鼠、狗、猴子、山羊、绵羊、奶牛、鹿和其它非哺乳类动物。在一些实施方案中,患者是人。
“疾病”或“病状”是指患者或个体的能够用本文提供的化合物或方法治疗的生存状态或健康状况。如本文所用的疾病可指便秘或干眼症障碍。
抗便秘剂的实例包括但不限于二苯基甲烷、副干酪乳杆菌(Lactobacillusparacasei)、利那洛肽和鲁比前列酮。抗干眼症剂的实例包括但不限于局部用环孢菌素、P321(ENaC抑制剂)和地夸磷索 (Diquafosol)。
I.组合物
本文提供具有下式的化合物:
在式I的化合物中,X是键、-O-、-N(R
在实施方案中,n1是0。在实施方案中,n1是1。在实施方案中,n1是2。在实施方案中,n1 是3。在实施方案中,n1是4。在实施方案中,n2是0。在实施方案中,n2是1。在实施方案中,n2 是2。在实施方案中,n2是3。在实施方案中,n2是4。在实施方案中,n6是0。在实施方案中,n6 是1。在实施方案中,n6是2。在实施方案中,n6是3。在实施方案中,n6是4。在实施方案中,n7 是0。在实施方案中,n7是1。在实施方案中,n7是2。在实施方案中,n7是3。在实施方案中,n7 是4。在实施方案中,n8是0。在实施方案中,n8是1。在实施方案中,n8是2。在实施方案中,n8 是3。在实施方案中,n8是4。在实施方案中,n9是0。在实施方案中,n9是1。在实施方案中,n9 是2。在实施方案中,n9是3。在实施方案中,n9是4。在实施方案中,m1是1。在实施方案中, m1是2。在实施方案中,m6是1。在实施方案中,m6是2。在实施方案中,m7是1。在实施方案中,m7是2。在实施方案中,m8是1。在实施方案中,m8是2。在实施方案中,m9是1。在实施方案中,m9是2。在实施方案中,v1是1。在实施方案中,v1是2。在实施方案中,v6是1。在实施方案中,v6是2。在实施方案中,v7是1。在实施方案中,v7是2。在实施方案中,v8是1。在实施方案中,v8是2。在实施方案中,v9是1。在实施方案中,v9是2。
在实施方案中,当X是-O-;R
在实施方案中,当X是-O-;R
在实施方案中,当X是-O-;R
在实施方案中,当X是-O-,且R
在实施方案中,X是-O-、-NH-或-S-。在实施方案中,X是-O-或-S-。在实施方案中,X是-NH-。在实施方案中,X是-O-。
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,X是-O-;R
在实施方案中,X是-O-;R
在实施方案中,R
在实施方案中,所述化合物具有式IA:
R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
在实施方案中,R
R
在一些实施方案中,如本文所述的化合物可包括R
在实施方案中,R
在实施方案中,R
在实施方案中,所述化合物由式IB1A、IC1A、IB1A′、IC1A′、ID1A或IE1A表示:
在实施方案中,R
在实施方案中,所述化合物由式IB2A、IC2A、IB2A′、IC2A′、ID2A或IE2A表示:
在实施方案中,R
在实施方案中,所述化合物由式IB3A、IC3A、IB3A′、IC3A′、ID3A或IE3A表示:
在实施方案中,R
在实施方案中,所述化合物由式IB4A、IC4A、IB4A′、IC4A′、ID4或IE4表示:
R
在实施方案中,所述化合物不是
在实施方案中,所述化合物是:
在实施方案中,所述化合物是式I,
在实施方案中,化合物是本文描述的化合物(例如,在一方面、实施方案、实施例、表、图、路线、附录或权利要求书)。
Ⅱ.药物组合物
本文还提供药物制剂。在实施方案中,药物制剂包括上述化合物(包括其所有实施方案)(例如式I、IA、IB1、IC1、ID1、IE1、IB1A、IC1A、IB1A′、IC1A′、ID1A、IE1A、IB2、IC2、ID2、IE2、 IB2A、IC2A、B2A′、IC2A′、ID2A、IE2A、IB3A、IC3A、IB3A′、IC3A′、ID3A、IE3A、IB4A、IC4A、 IB4A′、IC4A′、ID4A和IE4A)和药学上可接受的赋形剂。在一方面是药物组合物,其包含本文所述的化合物和药学上可接受的赋形剂。
在实施方案中,所述药物组合物包含药学上可接受的赋形剂和式I的化合物:
X、R
在实施方案中,X是-O-或-S-。在实施方案中,X是NH。在实施方案中,X是-O-。
在实施方案中,R
在实施方案中,所述化合物是式IA:
在实施方案中,R
在实施方案中,R
在实施方案中,所述药物组合物包含选自以下的化合物:
在药物组合物的实施方案中,化合物或其药学上可接受的盐以治疗有效量被包含。
1.制剂
药物组合物可以以多种剂量制剂制备和给药。所述化合物可以口服给药、直肠给药或通过注射给药(例如静脉内、肌内、皮内、皮下、十二指肠内或腹膜内)。
为了由本文所述的化合物制备药物组合物,药学上可接受的载体可以是固体或液体。固体形式的制剂包括散剂、片剂、丸剂、胶囊、扁囊剂、栓剂和可分散的颗粒。固体载体可以是一种或多种物质,其也可以用作稀释剂、调味剂、粘合剂、防腐剂、片剂崩解剂或包封材料。
在散剂中,载体可以是与细碎活性组分混合的细碎固体。在片剂中,活性组分可以与具有必要粘合性能的载体以合适的比例混合,并被压制成所需的形状和大小。
散剂和片剂优选地含有5%至70%的活性化合物。合适的载体是碳酸镁、硬脂酸镁、滑石、糖、乳糖、果胶、糊精、淀粉、明胶、黄芪胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可脂等。术语“制剂”旨在包括具有包封材料作为载体的活性化合物的制剂,提供胶囊,其中具有或不具有其他载体的活性组分被载体包围,因此与其缔合。同样,包括扁囊剂和锭剂。片剂、散剂、胶囊、丸剂、扁囊剂和锭剂可用作适于口服给药的固体剂型。
为了制备栓剂,首先熔化低熔点蜡,如脂肪酸甘油酯或可可脂的混合物,并通过搅拌将活性组分均匀地分散在其中。然后将熔化的均匀混合物倒入适宜大小的模具中,使其冷却,从而固化。
液体形式制剂包括溶液、混悬剂和乳剂,例如水或水/丙二醇溶液。对于肠胃外注射,可以将液体制剂在聚乙二醇水溶液中配制成溶液。
适于口服的水溶液可以通过将活性组分溶解在水中并根据需要加入合适的着色剂、调味剂、稳定剂和增稠剂来制备。适于口服的含水混悬剂可以通过将细碎的活性组分与粘性材料例如天然或合成树胶、树脂、甲基纤维素、羧甲基纤维素钠和其他公知的助悬剂分散在水中来制备。
还包括固体形式的制剂,其用以在使用前不久转化为用于口服给药的液体形式制剂。这种液体形式包括溶液、混悬剂和乳剂。除活性组分外,这些制剂还可含有着色剂、调味剂、稳定剂、缓冲剂、人造和天然甜味剂、分散剂、增稠剂、增溶剂等。
在实施方案中,包含本文所述的化合物的液体形式制剂或固体形式制剂在制剂中可不包括 DMSO。在实施方案中,所述液体形式制剂可不包括溶解剂如DMSO,且制剂中包括的化合物可含有相同或基本上相同量的溶解的或悬浮的化合物,例如,超过约50wt%、55wt%、60wt%、65wt%、 70wt%、75wt%、80wt%、85wt%、90wt%、95wt%或99wt%的被制备在包括DMSO的液体形式制剂中溶解的或悬浮的化合物。在实施方案中,不包括DMSO的所述液体形式制剂或固体形式制剂可表现相同或基本相同的化合物穿透黏液、黏膜或皮肤,例如,当局部、经黏膜或经皮给药时,超过约50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%的被制备在包括 DMSO的制剂中的化合物穿透。
药物制剂优选地为单位剂型。在这种形式中,制剂被细分为含有适量活性组分的单位剂量。单位剂型可以是包装的制剂,该包装含有离散量的制剂,如包装的片剂、胶囊和小瓶或安瓿中的散剂。此外,单位剂型可以是胶囊、片剂、扁囊剂或锭剂本身,或者它可以是适当数量的这些包装形式中的任一种。
根据具体应用和活性组分的效力,单位剂量制剂中活性组分的量可以从0.1mg至10000mg变化或调节。如果需要,该组合物还可含有其它相容的治疗剂。
一些化合物可能在水中具有有限的溶解度,因此在组合物中可能需要表面活性剂或其他合适的助溶剂。这样的助溶剂包括:聚山梨醇酯20、60和80;Pluronic F-68、F-84和P-103;环糊精;和聚氧乙烯35蓖麻油。这样的助溶剂通常以约0.01重量%至约2重量%使用。粘度大于简单水溶液的粘度可能是期望的,以降低分配制剂的变化性,减少制剂混悬剂或乳剂组分的物理分离,和/或以其他方式改善制剂。这样的粘度构建剂包括例如聚乙烯醇、聚乙烯吡咯烷酮、甲基纤维素、羟丙基甲基纤维素、羟乙基纤维素、羧甲基纤维素、羟丙基纤维素、硫酸软骨素及其盐、透明质酸及其盐以及前述的组合。这样的剂通常以约0.01重量%至约2重量%使用。
药物组合物可额外包含提供持续释放和/或舒适的组分。这样的组分包括高分子量的阴离子类粘液状聚合物、胶凝多糖和细碎的药物载体基质。这些组分在美国专利号4,911,920;5,403,841;5,212,162 和4,861,760中有更详细的讨论。出于所有目的,这些专利的全部内容整体援引加入本文。
药物组合物可用于静脉内使用。药学上可接受的赋形剂可包括用以将pH调节至静脉内使用期望的范围的缓冲剂。包括无机酸盐例如磷酸盐、硼酸盐和硫酸盐的许多缓冲剂是已知的。
2.有效剂量
药物组合物可包括组合物,其中活性成分以治疗有效量(即以有效实现其预期目的的量)被包含。对特定应用有效的实际量尤其取决于正在治疗的病状。
所给药的化合物的剂量和频率(单剂量或多剂量)可以根据多种因素而变化,包括给药途径;接受者的大小、年龄、性别、健康、体重、体质指数和饮食;所治疗疾病症状的性质和程度;存在其他疾病或其他与健康有关的问题;同时治疗的种类;以及任何疾病或治疗方案的并发症。其他治疗方案或剂可以与本文公开的方法和化合物结合使用。
用于人的治疗有效量可以从动物模型确定。例如,可以配制用于人的剂量以达到已经发现在动物中有效的浓度。如上所述,人体剂量可以通过监测便秘或干眼症对治疗的反应并向上或向下调节剂量来调节。
剂量可以根据个体的需求和所用的化合物而变化。在本文提供的药物组合物的情况中,给药个体的剂量应足以随时间在个体中实现有益的治疗反应。剂量的大小还会由任何不良副作用的存在、性质和程度来决定。一般来讲,治疗以小于化合物的最佳剂量的较小剂量开始。随后,剂量小幅增加,直到达到在情况下的最佳效果为止。
剂量和间隔可以单独调整,以提供对正在治疗的特定临床适应症有效的所给药化合物的水平。这会提供与个体疾病状态的严重程度相称的治疗方案。
利用本文所提供的教导内容,可以计划有效的预防性或治疗性治疗方案,该方案不会引起显著地毒性,但对于治疗特定患者所表现的临床症状是完全有效的。该计划应涉及通过考虑诸如化合物效力、相对生物利用度、患者体重、不良副作用的存在及其严重性、优选的给药方式和所选剂的毒性特征的因素来仔细选择活性化合物。
3.毒性
特定化合物的毒性与治疗效果之间的比率是其治疗指数,并且可以表示为LD
当需要或期望肠胃外给药时,包含在药物组合物中的化合物的特别合适的混合物可以是可注射的、无菌溶液、含油的或含水的溶液、以及混悬剂、乳剂或植入物,包括栓剂。特别地,用于肠胃外给药的载体包括葡萄糖(dextrose)的水溶液、盐水、纯水、乙醇、甘油、丙二醇、花生油、芝麻油、聚氧乙烯嵌段聚合物等。安瓿是方便的单位剂量。适用于本文提供的药物组合物的药物混合物可包括例如Pharmaceutical Sciences(第17版,MackPub.Co.,Easton,PA)和WO 96/05309中所述的那些,它们的教导援引加入本文。
Ⅲ.激活方法
本文还提供激活囊性纤维化穿膜传导调节蛋白(CFTR)的方法。所述方法包括使CFTR与有效量的本文描述的化合物接触,由此激活CFTR。在一方面,该方法包括使CFTR与有效量的式I的化合物:
或其药学上可接受的盐接触。X、R
在实施方案中,所述方法包括使CFTR与有效量的本文所述的化合物接触,由此激活CFTR。接触可以在体外进行。接触可以在体内进行。
Ⅳ.治疗方法
本文还提供通过向所述个体给药有效量的本文所述的化合物(如式I的化合物):
或其药学上可接受的盐来治疗有需要的个体的疾病或障碍的方法。X、R
在一方面是治疗有需要的个体的便秘的方法,该方法包括向个体给药有效量的如本文所述的化合物(如式I的化合物)。在另一方面是治疗有需要的个体的干眼症障碍的方法,该方法包括向个体给药有效量的如本文所述的化合物(如式I的化合物)。在又另一方面是增加有需要的个体的流泪的方法,该方法包括向个体给药有效量的如本文所述的化合物(如式I的化合物)。
在一方面,提供治疗有需要的个体的淤胆型肝病的方法,其包括向个体给药有效量的如本文所述的化合物(如式I的化合物)。在另一方面,提供治疗有需要的个体的肺部疾病或障碍的方法,其包括向个体给药有效量的如本文所述的化合物(如式I的化合物)。在实施方案中,肺部疾病或障碍是慢性阻塞性肺疾病(例如支气管炎、哮喘、香烟烟雾诱导的肺功能障碍)。
其他方面
在另一方面,本文提供治疗疾病的组合物和方法。以下定义和实施方案仅适用于式(pI)的化合物、本部分(即部分V)和本文列出的实施方案P1至P28。
出于本部分的目的,术语“烷基”是指并包括直链或支链的一价烃结构及其组合,其可以是完全饱和的、单或多不饱和的,具有指定的碳原子数(即,C
烷基可以被一个或多个取代基取代(即,一个或多个氢原子被一价或二价基团置换),如本文所述的基团,例如氟、氯、溴、碘、羟基、烷氧基、硫代、氨基、酰氨基、烷氧基羰基酰氨基、羧基、酰基、烷氧基羰基、磺酰基、环烷基、芳基、杂环基和杂芳基以及本领域已知的其他官能团。“全氟烷基”是指其中每个氢原子被氟原子置换的烷基。饱和C
出于本部分的目的,术语“环烷基”是指并包括环状单价烃结构,其可以是完全饱和的、单或多不饱和的,具有指定的碳原子数(即,C
出于本部分的目的,术语“杂环”或“杂环基”是指饱和或不饱和的非芳族基团,其具有1至10个环碳原子和1至4个环杂原子,如氮、硫或氧等,其中氮和硫原子任选地被氧化,并且氮原子任选地被季铵化。杂环基可以具有单环或多个稠环,但不包括杂芳基。包含多于一个环的杂环可以是稠合的、螺环化的或桥接的或其任何组合。在稠环系统中,一个或多个稠环可以是芳基或杂芳基。杂环基的实例包括但不限于四氢吡喃基、二氢吡喃基、哌啶基、哌嗪基、吡咯烷基、噻唑啉基、噻唑烷基、四氢呋喃基、四氢噻吩基、2,3-二氢苯并[b]噻吩-2-基、4-氨基-2-氧代嘧啶-1(2H)-基等。
出于本部分的目的,术语“芳基”是指并包括多不饱和芳烃取代基。芳基可含有额外的稠环(例如,1至3个环),包括额外稠合的芳基、杂芳基、环烷基和/或杂环基环。在一个变体中,芳基含有 6至14个环碳原子。芳基的实例包括但不限于苯基、萘基、联苯基等。
出于本部分的目的,术语“杂芳基”是指并包括不饱和芳族环状基团,其具有1至10个环碳原子和至少一个环杂原子,包括但不限于如氮、氧和硫的杂原子,其中氮和硫原子任选地被氧化,且氮原子任选地被季铵化。杂芳基可以在环碳或环杂原子上连接到分子的其余部分。杂芳基可含有额外的稠环(例如,1至3个环),包括额外的稠合的芳基、杂芳基、环烷基和/或杂环基环。杂芳基的实例包括但不限于吡啶基、嘧啶基、噻吩基(thiophenyl)、呋喃基、噻唑基等。
本部分中提及的环烷基、芳基、杂环基和杂芳基还可以被一个或多个取代基取代,如本文详述的基团,例如氟、氯、溴、碘、羟基、烷氧基、硫代、氨基、酰氨基、烷氧基羰基酰氨基、羧基、酰基、烷氧基羰基、磺酰基、烷基、环烷基、芳基、杂环基和杂芳基,以及本领域已知的其他官能团。
出于本部分的目的,术语“药学上可接受的载体”是指药物制剂中除活性成分外的对个体无毒的成分。药学上可接受的载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂,如本领域已知的那些,例如Remington’s Pharmaceutical Sciences第16版,Osol,A.Ed.(1980)中所述。
如本部分中所用,“治疗(treatment)”或“治疗(treating)”是用于获得有益或期望结果(包括并优选临床结果)的方法。例如,有益或期望的临床结果包括但不限于以下中的一种或多种:减少由疾病引起的症状,提高患有该疾病的人的生活质量,减少治疗疾病、延缓疾病的进展和/或延长个体生存所需的其他药物的剂量。
如本部分中所用,短语“延缓疾病的发展”意指推迟、阻碍、减缓、延缓、稳定和/或推迟疾病的发展(如便秘、干眼症、肺部疾病或病状、肺病或肝病)。该延缓可以具有不同的时间长度,这取决于疾病史和/或所治疗的个体。对于本领域技术人员显而易见的是,足够或显著的延缓实际上可以包括预防,这样个体不会发展疾病。
如本部分中所用,药物、化合物或药物组合物的“有效剂量”或“有效量”是足以产生有益或期望结果的量。对于预防性用途,有益或期望的结果包括如消除或降低风险、减轻严重性或延缓疾病(包括疾病的生化、组织学和/或行为症状,其并发症和在疾病的发展过程中呈现的中间病理表型)发作的结果。对于治疗用途,有益或期望的结果包括如减少由疾病引起的一种或多种症状、提高患有该疾病的人的生活质量、减少治疗疾病所需的其他药物的剂量、如通过靶向增强另一种药物的效果、延缓疾病的进展和/或延长存活的临床结果。有效剂量可以分一次或多次给药加以给药。出于本部分的目的,药物、化合物或药物组合物的有效剂量是足以直接或间接完成预防性或治疗性治疗的量。如在临床情况中所理解的,药物、化合物或药物组合物的有效剂量可以或可以不与另一种药物、化合物或药物组合物结合实现。因此,在给药一种或多种治疗剂的情况下可以考虑“有效剂量”,并且如果与一种或多种其他剂结合可以实现或实现了期望结果,可以考虑以有效量给予单一剂。
如本部分中所用,“与...结合”是指除了给药另一种治疗方式之外还给药一种治疗方式。因此,“与...结合”是指在向个体给药其他治疗方式之前、期间或之后给药一种治疗方式。
除非另有明确说明,否则为了本部分的目的,本文所用的术语“个体”是指哺乳动物,包括但不限于牛、马、猫、兔、犬、啮齿动物或灵长类动物(例如,人)。在一些实施方案中,个体是人。在一些实施方案中,个体是非人灵长类动物,如黑猩猩和其他猿和猴物种。在一些实施方案中,个体是农场动物,如牛、马、绵羊、山羊和猪;宠物,如兔、狗和猫;实验室动物包括啮齿动物,如大鼠、小鼠和豚鼠等。本部分中描述的方面可用于人类医学和兽医领域。
如本部分和所附实施方案P1-P25中所用,单数形式“一(a)”、“一(an)”和“所述”包括复数指代物,除非上下文另有明确说明。
应理解,本部分中所描述方面中的方面和变化包括“由方面和变化组成”和/或“基本上由方面和变化组成”。
便秘疗法包括增加粪便体积的泻药,如可溶性纤维;产生渗透负荷的泻药,如聚乙二醇;或刺激肠道收缩的泻药,如二苯基甲烷。也有软化粪便的表面泻药,如多库酯钠和益生菌,如副干酪乳杆菌[3]。FDA批准的药物利那洛肽是鸟苷酸环化酶C受体的肽激动剂,通过抑制内脏疼痛、刺激肠道运动和增加肠道分泌来起作用[4,5]。第二种批准的药物鲁比前列酮是前列腺素E类似物,被认为激活推定的肠细胞ClC-2通道[6],但机制数据不太清楚。尽管有广泛的治疗选择,但仍然需要安全有效的药物来治疗便秘。
不希望受理论束缚,在该部分的实施方案中,囊性纤维化穿膜调节蛋白(CFTR)氯通道的激活驱动肠中的液体分泌,其维持腔内容物的润滑。假设CFTR的直接激活可引起液体分泌并逆转便秘中发现的粪便过度脱水。
肠液分泌涉及通过基底外侧膜Na
由于这些考虑因素以及对便秘的安全有效药物治疗的持续需求,本文报道了对在肠中具有促分泌作用以及在便秘中具有功效的纳摩尔效能的CFTR靶向小分子激活剂的鉴定和表征。
通过高通量筛选纳摩尔亲和力的小分子CFTR激活剂CFTR
CFTR靶向激活增加了抗便秘治疗的各种作用机制。值得注意的是,纯CFTR激活能够在肠中产生强烈的Cl
CFTRact-J027比VX-770(依伐卡托)更有效地激活野生型CFTR,VX-770是用于治疗由某些 CFTR门控突变引起的囊性纤维化(CF)的FDA批准的药物。在表达野生型CFTR的FRT细胞中,短路电流测量显示CFTR
据报道,取代的喹喔啉酮是膜外排转运蛋白多药耐药蛋白1的选择性拮抗剂[20]。也据报道,喹喔啉酮通过刺激胰腺INS-1细胞中的胰岛素分泌显示出抗糖尿病活性[21],以及对血栓形成性障碍的潜在治疗具有抑制丝氨酸蛋白酶的活性[22]。最近,据报道,喹喔啉酮可抑制醛糖还原酶[23]。这些报道表明喹喔啉酮支架具有类似药物的特性。合成上,喹喔啉酮可以由市售的起始原料以一步至四步制备[24],这样可以便于合成靶向类似物。
除了化合物特异性脱靶作用之外,CFTR激活剂的潜在副作用特征可包括气道/肺和各种腺和其他上皮细胞中的促分泌活性。便秘治疗的脱靶效应可通过口服给药具有有限肠吸收和/或快速全身清除的CFTR激活剂以使全身暴露最小化来加以限制。CFTR
总之,本文提供的数据证明了CFTR激活剂在小鼠肠中的促分泌作用,其用于治疗各种类型的便秘,其可包括阿片样物质诱导的便秘、慢性特发性便秘和便秘型肠易激综合征。
包括干燥综合征(
94%的调查眼科医生认为中度至重度干眼症需要额外的治疗(7)。
眼表面是解剖学上连续的上皮和腺组织的集合,其在功能上连接以维持泪膜(8)。虽然流泪有助于大量反射性流泪,但角膜和结膜调节基础泪液的体积和组成。水在眼表面上移动成泪膜的主要决定因素包括通过cAMP-和钙(Ca
关于用于干眼症疗法的促分泌候选物,ENaC抑制剂P321最近已进入1/2期研究(9)。地夸磷索是一种靶向表面上皮P2Y
囊性纤维化穿膜传导调节蛋白(CFTR)是在一些分泌性上皮细胞中表达的cAMP激活的Cl
对作为干眼症的潜在局部治疗的通过高通量筛选鉴定的野生型CFTR的新型小分子激活剂进行评估,以证明新鉴定的CFTR激活剂在干眼症的小鼠模型中的功效。
研究了CFTR的小分子激活剂用于干眼症疗法的潜在效用。在几次先前的发展失败之后,干眼症仍然是眼部疾病的未满足需求。据推测,CFTR靶向的促分泌化合物可以使干眼症中的泪膜体积和眼表特性正常化(21,22)。在干眼症障碍中,泪膜高渗透压性刺激促炎信号传导、细胞因子和金属蛋白酶的分泌、以及角膜上皮细胞完整性的破坏(35-38)。通过最小化泪膜高渗透压性,预测CFTR 激活以防止这些下游眼表面变化。
通过高通量筛选鉴定小分子CFTR激活剂,其通过涉及直接CFTR激活而非上游cAMP信号传导的机制,在眼表面上产生持续的Cl
发现CFTR
已经考虑了靶向不同眼表离子通道的替代性促分泌疗法。唯一经FDA批准的CFTR激活剂VX- 770是通过纠正某些CFTR突变的通道门控来治疗CF而开发的“增效剂”(44)。然而,VX-770在细胞培养物和小鼠体内中对野生型CFTR显示出相对较小的活性。慢性应用VX-770还可以减少CFTR 功能表达(24)并引起白内障(参见幼年大鼠;参考文献42),这可能是脱靶效应,因为CFTR不在晶状体中表达。
Ca
本文提供的数据显示单独的CFTR激活促进持续向外的Cl
CFTR
本文的实施例提供关于本部分的方面和实施方案的进一步公开
尽管为了清楚理解的目的已经通过说明和实例详细地描述了前述部分,但是对于本领域技术人员显而易见的是,会根据上述教导实施某些微小的变化和修改。因此,说明书和实施例不应被解释为限制本文描述的任何发明的范围。
本文引用的所有参考文献,包括专利申请和公开,整体援引加入本文。
本文涵盖的实施方案包括以下实施方案P1至P28。
实施方案P1.药物组合物,其包含药学上可接受的赋形剂和式I的化合物:
实施方案P2.实施方案P1的药物组合物,其中:X是O;R
实施方案P3.实施方案P1的药物组合物,其中:X是O;R
实施方案P4.实施方案P1的药物组合物,其中:X是O;R
实施方案P5.实施方案P4的药物组合物,其中R
实施方案P6.药物组合物,其包含药学上可接受的赋形剂和式IA的化合物:
实施方案P7.实施方案P6的药物组合物,其中R
实施方案P8.实施方案P7的药物组合物,其中:R
实施方案P9.实施方案P6的药物组合物,其中R
实施方案P10.实施方案P9的药物组合物,其中:R
实施方案P11.实施方案P6的药物组合物,其中R
实施方案P12.实施方案P11的药物组合物,其中:R
实施方案P13.实施方案P6的药物组合物,其中R
实施方案P14.实施方案P13的药物组合物,其中:R
实施方案P15.实施方案P14的药物组合物,其中:R
实施方案P16.实施方案P15的药物组合物,其中R
实施方案P17.实施方案P16的药物组合物,其中R
实施方案P18.实施方案P17的药物组合物,其中R
实施方案P19.实施方案P17的药物组合物,其中R
实施方案P20.治疗便秘的方法,其包括向有需要的个体给药治疗有效量的结构式(I)的化合物:
实施方案P21.实施方案P20的方法,其还包括向所述个体给药抗便秘剂。
实施方案P22.实施方案P20的方法,其中所述化合物口服给药。
实施方案P23.实施方案P20的方法,其中所述便秘是阿片样物质诱导的便秘、慢性特发性便秘或便秘型肠易激综合征。
实施方案P24.治疗干眼症障碍的方法,其包括向有需要的个体给药治疗有效量的结构式(I)的化合物:
实施方案P25.实施方案P24的方法,其中所述干眼症障碍是泪腺障碍。
实施方案P26.实施方案P24的方法,其还包括向所述个体给药抗干眼症剂。
实施方案P27.增加流泪的方法,其包括向有需要的个体给药治疗有效量的结构式(I)的化合物:
实施方案P28.激活囊性纤维化穿膜传导调节蛋白(CFTR)的方法,其包括使所述CFTR与结构式(I)的化合物:
本文涵盖的进一步的实施方案包括以下实施方案1至69。
实施方案1.式I的化合物:
实施方案2.实施方案1的化合物,其中R
实施方案3.实施方案1或2的化合物,其中R
实施方案4.实施方案1、2或3的化合物,其中:R
实施方案5.实施方案4的化合物,其中R
实施方案6.实施方案1的化合物或其药学上可接受的盐,其中所述化合物由式IA表示:
实施方案7.实施方案6的化合物,其中R
实施方案8.实施方案6或7的化合物,其中R
实施方案9.实施方案6、7或8的化合物,其中:R
实施方案10.实施方案9的化合物,其中R
实施方案11.实施方案6或7的化合物,其中:R
实施方案12.实施方案11的化合物,其中:R
实施方案13.实施方案6或7的化合物,其中R
实施方案14.实施方案4的化合物,其中R
实施方案15.实施方案6、7或14的化合物,其中R
实施方案16.实施方案6或7的化合物,其中R
实施方案17.实施方案16的化合物,其中R
实施方案18.实施方案16的化合物,其中所述化合物由式IB、IC、ID或IE表示:
实施方案19.实施方案18的化合物,其中R
实施方案20.实施方案14、15、16、18或19的化合物,其中R
实施方案21.实施方案1的化合物,其中所述化合物选自:
实施方案22.式I的化合物:
实施方案23.实施方案22的化合物,其中R
实施方案24.药物组合物,其包含药学上可接受的赋形剂和式I的化合物:
实施方案25.实施方案24的药物组合物,其中R
实施方案26.实施方案24或25的药物组合物,其中R
实施方案27.实施方案24、25或26的药物组合物,其中:R
实施方案28.实施方案27的药物组合物,其中R
实施方案29.实施方案24的药物组合物,其中所述化合物由式IA表示:
实施方案30.实施方案29的药物组合物,其中R
实施方案31.实施方案29或30的药物组合物,其中R
实施方案32.实施方案29、30或31的药物组合物,其中:R
实施方案33.实施方案32的药物组合物,其中R
实施方案34.实施方案29或30的药物组合物,其中:R
实施方案35.实施方案34的药物组合物,其中:R
实施方案36.实施方案29或30的药物组合物,其中R
实施方案37.实施方案36的药物组合物,其中R
实施方案38.实施方案37的药物组合物,其中R
实施方案39.实施方案29或30的药物组合物,其中:R
实施方案40.实施方案39的药物组合物,其中所述化合物由式IB、IC、ID或IE表示:
实施方案41.实施方案40的药物组合物,其中R
实施方案44.药物组合物,其包含药学上可接受的赋形剂和式I的化合物:
实施方案45.实施方案44的药物组合物,其中R
实施方案46.治疗有需要的个体的便秘的方法,其包括向所述个体给药有效量的式I的化合物:
实施方案47.实施方案46的方法,其还包括向所述个体给药抗便秘剂。
实施方案48.实施方案46或47的方法,其中所述化合物口服给药。
实施方案49.实施方案46、47或48的方法,其中所述便秘是阿片样物质诱导的便秘、慢性特发性便秘或便秘型肠易激综合征。
实施方案50.治疗有需要的个体的干眼症障碍的方法,其包括向所述个体给药有效量的式I的化合物:
实施方案51.实施方案50的方法,其中所述干眼症障碍是泪腺障碍。
实施方案52.实施方案50或51的方法,其还包括向所述个体给药抗干眼症剂。
实施方案53.增加有需要的个体的流泪的方法,其包括向所述个体给药有效量的式I的化合物:
实施方案54.激活囊性纤维化穿膜传导调节蛋白(CFTR)的方法,其包括使所述CFTR与有效量的式I的化合物:
实施方案55.治疗有需要的个体的淤胆型肝病的方法,所述方法包括向所述个体给药有效量的式I的化合物:
实施方案56.治疗有需要的个体的肺部疾病或障碍的方法,所述方法包括向所述个体给药有效量的式I的化合物:
实施方案57.实施方案56的方法,其中所述肺部疾病或障碍是慢性阻塞性肺疾病、支气管炎、哮喘和香烟烟雾诱导的肺功能障碍。
实施方案58.治疗便秘的方法,其包括向有需要的个体给药治疗有效量的实施方案1至23中任一项的化合物。
实施方案59.实施方案58的方法,其还包括向所述个体给药抗便秘剂。
实施方案60.实施方案58或59的方法,其中所述化合物口服给药。
实施方案61.实施方案58、59或60的方法,其中所述便秘是阿片样物质诱导的便秘、慢性特发性便秘或便秘型肠易激综合征。
实施方案62.治疗干眼症障碍的方法,其包括向有需要的个体给药治疗有效量的实施方案1至 23中任一项的化合物。
实施方案63.实施方案62的方法,其中所述干眼症障碍是泪腺障碍。
实施方案64.实施方案62或63的方法,其还包括向所述个体给药抗干眼症剂。
实施方案65.增加流泪的方法,其包括向有需要的个体给药实施方案1至23中任一项的化合物。
实施方案66.激活囊性纤维化穿膜传导调节蛋白(CFTR)的方法,其包括使CFTR与实施方案1 至23中任一项的化合物接触。
实施方案67.治疗有需要的个体的淤胆型肝病的方法,所述方法包括向所述个体给药有效量的实施方案1至23中任一项的化合物。
实施方案68.治疗有需要的个体的肺部疾病或障碍的方法,所述方法包括向所述个体给药有效量的实施方案1至23中任一项的化合物。
实施方案69.实施方案68的方法,其中所述肺部疾病或障碍是慢性阻塞性肺疾病、支气管炎、哮喘和香烟烟雾诱导的肺功能障碍。
V.
便秘
1.
对120,000种药物样合成小分子进行基于细胞的高通量筛选。对活性化合物的作用机制进行了表征,并在洛哌丁胺诱导的小鼠便秘模型中测试了一种先导化合物。
鉴定了几类新的CFTR激活剂,其中一种是苯基喹喔啉酮CFTRact-J027,以约200nM的EC
CFTR
使用从ChemDiv Inc.(圣地牙哥,加利福尼亚州,USA)和Asinex(温斯顿-塞勒姆,北卡罗来纳州,USA)获得的120,000种药物样合成化合物的各种集合进行高通量筛选。对于结构活性分析,测试了在初步筛选中鉴定的活性化合物的600种市售类似物(ChemDivInc.)。除非另有说明,否则其他化学品购自Sigma-Aldrich(圣路易斯,密苏里州,USA)。
CFTR
向邻苯二胺(1g,9.24mmol)在DMF(30mL)中的溶液中加入碳酸钾(2.5g,18.4mmol)和苄基溴(0.73mL,6.2mmol),然后在环境温度下搅拌过夜。将反应混合物用CH
细胞培养
如前所述[12],产生稳定共表达人野生型CFTR和卤化物敏感性黄色荧光蛋白(YFP)-H148Q 的Fischer大鼠甲状腺(FRT)细胞。将细胞在补充有10%胎牛血清、2mM L-谷氨酰胺、100单位/ml 青霉素和100μg/ml链霉素的Coon氏-改性的Ham氏F12培养基中在塑料上培养。对于高通量筛选,将细胞以每孔20,000个细胞的密度铺板在黑色96孔微量培养板(Corning-Costar Corp.,康宁,纽约, USA)中。在铺板后24-48小时进行筛选。
高通量筛选
使用配备有液体处理系统和两个FLUOstar荧光板读取器(BMG Labtechnologies,达勒姆,北卡罗来纳州,USA)的Beckman Coulter集成系统进行筛选,每个读取器配备有双注射泵和500±10nm 激发和535±15nm发射滤波器(详细见参考文献12)。将表达CFTR和YFP的FRT细胞在铺板后在 37℃/5%CO
短路电流测量
如[12]所述,在多孔过滤器上培养的稳定地表达野生型人CFTR的FRT细胞中测量短路电流。基底外侧溶液含有130mM NaCl、2.7mM KCl、1.5mM KH
cAMP测定
使用GloSensor发光测定法(Promega Corp.,麦迪逊,威斯康星州,USA)测量细胞内cAMP活性。FRT裸细胞用pGloSensor cAMP质粒稳定地转染,并铺板在白色96孔微量培养板上并生长至汇合。细胞用PBS洗涤三次,并在不存在和存在100nM福司可林下用5μMCFTR
药代动力学
所有动物实验均由UCSF机构动物护理和使用委员会批准。雌性CD1小鼠经腹膜内(ip)或口服用10mg/kg CFTR
体外代谢稳定性
如[13]所述,将CFTR
小鼠便秘模型
向雌性CD1小鼠(8-10周龄)给药洛哌丁胺(0.3mg/kg,腹膜内,Sigma-Aldrich)以产生便秘。同时(对于腹膜内给药)或在洛哌丁胺前1小时(对于口服给药)给药各种量的CFTR
体内肠道通过和离体肠道收缩
使用口服给药的标记物(200μL,5%伊文思蓝,5%阿拉伯树胶)并测量其在粪便中出现的时间来测定整个肠的通过时间。小鼠在零时间腹膜内给药洛哌丁胺和CFTR
体内肠道分泌和吸收
在实验前24小时,使小鼠(野生型或CF)获得5%葡萄糖水但不获得固体食物。小鼠用异氟烷麻醉,并使用加热垫使体温在手术期间保持在36-38℃。做出小的腹部切口以暴露小肠,并通过缝线分离闭合的中部空肠环(长2-3cm)。向环注射单独的100μL载体或含100μgCFTR
长期给药和毒性研究
每天一次向小鼠口服给药10mg/kg CFTR
统计分析
两组实验使用学生t-检验分析,当有3组或更多分析时,用单因素方差分析和事后Newman- Keuls多重比较检验进行。P<0.05被认为具有统计学显著性。
2.
小分子CFTR激活剂的鉴定和体外表征
目标是鉴定在肠中具有促分泌活性的有效的CFTR靶向激活剂,以便在便秘的小鼠模型中测试其功效。这里评估的化合物包括在先前的CFTR激活剂/增效剂筛选[14]中鉴定的小分子和来自先前未测试的合成小分子的新筛选的小分子。基于作用研究的最初机制(cAMP升高的测定)、体外毒性、小鼠肠中的促分泌作用和在便秘的小鼠模型中的功效优先排序筛选出来的最有活性的化合物以及市售的化学类似物。CFTR激活剂增加荧光猝灭曲线的初始斜率。
基于上面列出的标准,我们关注对CFTR
表达CFTR的FRT细胞中的短路电流测量显示在EC
CFTR
在公认的洛哌丁胺诱导的便秘小鼠模型中研究CFTR
在洛哌丁胺给药前1小时口服给药10mg/kg CFTR
CFTR
分别在体内和分离的肠条中测量CFTR
为了直接研究CFTR
CFTR
通过在NADPH存在下用小鼠肝微粒体孵育来测量CFTR
在快速腹膜内或口服给药10mg/kg CFTR
在细胞培养物和小鼠中进行CFTR
最后,为了确定长期给药的CFTR
表1.每天口服一次10mg/kg CFTR
干眼症
3.
小鼠
将CD1遗传背景中的野生型(WT)和CF(纯合ΔF508-CFTR突变体)小鼠在加利福尼亚大学旧金山分校(UCSF)动物设施中繁殖。使用8至12周龄(25至35g)的小鼠。雌性BALB/c小鼠 (7-8周龄)购自Harlan Laboratory(Livermore,CA,USA)。动物方案经UCSF机构动物护理和使用委员会批准,并符合ARVO眼科和视力研究中动物使用的声明。
短路电流
将稳定表达野生型人CFTR的Fischer大鼠甲状腺(FRT)细胞在Snapwell插入物(Corning Costar, Corning NY,USA)上培养,用于短路电流(I
cAMP和细胞毒性测定
使用GloSensor发光测定法(Promega Corp.,麦迪逊,WI,USA)测量细胞内cAMP活性。将用pGloSensor cAMP质粒(Promega Corp.)稳定转染的FRT细胞在白色96孔微量培养板(Corning Costar)中培养过夜。然后用PBS洗涤细胞三次,并在不存在和存在100nM福司可林的情况下用5 μM测试化合物孵育10分钟。为了测定细胞毒性,将FRT细胞在黑色96孔Costar微量培养板孔中培养过夜,并用高达100μM(在PBS中的最大溶解度)的测试化合物孵育1或24小时。根据制造商的说明书(Invitrogen,卡尔斯巴德,CA,USA),通过Alamar Blue测定法测量细胞毒性。
眼表电位差测量
如(21)所述,响应于不同溶液在眼表面上的连续灌注,在麻醉小鼠中连续测量开路跨上皮PD。用Avertin(2,2,2-三溴乙醇,125mg/kg腹膜内,Sigma-Aldrich,圣路易斯,MO,USA)麻醉小鼠,并使用加热垫将核心温度维持在37℃。将眼定向为角膜和结膜朝上并通过用交叉作用钳缩回眼睑来暴露。溶液是等渗的(320±10mOsM;参考文献21中提供的组合物)并含有10μM吲哚美辛以防止 CFTR被前列腺素激活。使用多储存器重力夹阀系统(ALAScientific,韦斯特伯里,NY,USA)和可变流量蠕动泵(中等流量模型;Fisher Scientific,费尔劳恩,NJ,USA),通过塑料管以6mL/min 灌注眼表面。使用微定位器将探针导管固定在角膜上方1mm处,并将抽吸套管定位在距离眼眶3 mm处。将测量电极与灌注导管接触并连接到高阻抗电压表(IsoMilivolt Meter;WPI)上。参比电极经由填充有等渗盐水的翼状21号针接地,并经皮下插入腹部。测量和参比电极由Ag/AgCl和3M KCl琼脂桥组成。
泪液分泌
为了测量未受刺激的泪液产生,使用jewelers钳将酚红线(Zone-Quick,OasisMedical,格伦多拉,CA,USA)置于异氟烷麻醉的小鼠的外眦中10秒。如在解剖显微镜下所观察的,泪液体积以线润湿的长度测量。与载体相比,在施用2-μL化合物制剂液滴(50-100μM化合物的含有0.5%聚山梨醇酯和0.5%DMSO的PBS)后,使用连续测量来评价化合物药效学。
丽丝胺绿染色
为了评估角膜上皮破坏,将5μL丽丝胺绿(LG)染料(1%)应用于异氟烷麻醉的小鼠的眼表面。使用适用于Olympus变焦立体显微镜(Olympus,森特瓦利,PA,USA)的Nikon数码照相机拍摄眼的照片。每个角膜象限由一名不知情的训练有素的观察者按3点等级评分,每个象限的染色程度分类为:0,无染色;1,散发(涉及总表面的<25%)染色;2级,弥漫性点状染色(25-75%);以及3级,聚结点状染色(≥75%)。总等级报告为所有四个象限的分数总和,范围从0到12。
药代动力学和组织分布
为了确定CFTR激活剂在眼前小鼠泪膜中的停留时间,在单剂量眼递送后回收化合物用于液相色谱/质谱(LC/MS)。在手动眼睑眨眼后,用5-μL微毛细管(DrummondScientific Co.,Broomhall,PA, USA)从外眦和内眦回收三次洗眼液(每次3μL PBS)(9)。合并的洗液用含有0.1%甲酸的乙腈/水 (1:1)稀释,并使用连接至Waters 2695HPLC溶剂输送系统的Xterra MS C18柱(2.1mm x 100 mm,3.5-μm粒径)和具有正电喷雾电离的Waters Micromass ZQ质谱仪通过LC/MS分析。
为了研究化合物在全身组织中的积聚,在每天三次局部给药(0.1nmol,2μL,50μM)14天后,分析小鼠血液、脑、肾和肝。将血液样品从左心室收集到K3 EDTA微型管(Greiner,Kremsmunster,奥地利)中并离心(28)。用等体积的乙酸乙酯萃取上清液,用空气流干燥萃取物。在用肝素化PBS (10单位/mL)进行心室灌注后,取出来自治疗和对照小鼠的器官,称重,与乙酸和水(100μL/g组织)混合,并均质化(29)。加入乙酸乙酯(10mL/g组织),涡旋样品并离心(3000rpm,15分钟),蒸发含乙酸乙酯的上清液。然后如上所述,重构并通过LC/MS分析从血清和器官匀浆的有机萃取物获得的残留物。
通过泪腺切除产生的干眼症小鼠模型
水缺乏性干眼症的泪腺切除(LGE)模型由报道的方法(30)修改。通过3-mm线性皮肤切口将野生型雌性BALB/c小鼠(7-8周龄)的每侧的眶外泪腺暴露。将泪管烧灼,双侧去除整个腺体,避开面部血管和神经。每个切口用单根中断的6-0丝线闭合。眼眶泪腺组织保持功能性。在LGE的1 天内由神经营养性角膜溃疡鉴定出角膜感觉减少的眼(<5%的研究小鼠)被排除在外。将小鼠随机化以接受CFTR
统计学
数据表示为平均值±平均值的标准误差(SEM)。对于两个平均值之间的直接比较,使用双侧学生t检验。对于干眼症预防研究中泪液分泌和LG分数的纵向测量,使用线性混合效应回归,调整对同一只眼和同一动物的双眼进行的测量的非独立性。使用包lme4和robustlmm在Mac的R v.3.2(R Foundation for Statistical Computing,维也纳,奥地利)中进行分析。
小分子CFTR激活剂的表征
对120,000种化合物(10μM)的基于细胞的功能性高通量筛选鉴定了20个化学类别的野生型 CFTR的小分子激活剂,其产生>95%的最大CFTR激活。筛选在96孔板中的共表达人野生型CFTR 和细胞质YFP卤化物传感器的FRT上皮细胞中完成(26,31,32)。二级筛选涉及用次最大福司可林(50nM)预处理的表达CFTR的FRT细胞中的I
来自四个最有活性的化学类别的激活剂的结构示于图2A中,以及来自I
寻求直接靶向CFTR而不引起细胞cAMP升高的化合物以使潜在的脱靶效应最小化(图2D)。可能通过磷酸二酯酶抑制产生细胞内cAMP升高的化合物(来自O类、Q类和R类)被排除在进一步考虑之外。选择不增加cAMP的来自B类、J类和K类的纳摩尔效力化合物用于在活小鼠中进一步表征。
CFTR激活剂增加眼表氯化物和体内液体分泌
在我们的实验室中开发的开路电位差(PD)方法用于评估化合物在眼表面的体内活性,如图3A 所示(21)。通过在用一系列溶液连续灌注眼表面期间测量PD来量化Cl
图3B显示暴露于CFTR
接下来测试CFTR激活剂在增加小鼠泪液产生方面的功效。初步实验确定了标准眼科制剂(0.5%聚山梨醇酯),其增加了化合物的溶解度和作用持续时间。在单次局部剂量后,间接CFTR激活剂霍乱毒素、福司可林和3-异丁基-1-甲基黄嘌呤(IBMX)在30分钟时基本上增加基础泪液分泌,但这些效应是短暂的并且在2小时后检测不到(图4A)。然而,此处鉴定的直接CFTR激活剂、CFTR
毒性和药代动力学
泪液收集方法通过证明滴注后直至6小时从眼表面可重复回收四甲基罗丹明葡聚糖(3kDa)来验证。通过回收的泪液洗液的LC/MS测定CFTR
在每天三次给药两周后,CFTR
CFTR激活剂预防小鼠泪腺切除模型中的干眼症
基于其有利的泪膜药代动力学,选择CFTR
实施例4-便秘II
摘要.背景与目的:便秘是一种常见的临床问题,会对生活质量产生负面影响,并与大量的医疗保健成本相关。囊性纤维化穿膜调节蛋白(CFTR)氯通道的激活是驱动肠中液体分泌的主要途径,其维持管腔内容物的润滑。我们假设CFTR的直接激活会导致液体分泌并逆转便秘中所见的粪便过度脱水。方法:对120,000种药物样合成小分子进行基于细胞的高通量筛选。对活性化合物的作用机制进行了表征,并在洛哌丁胺诱导的小鼠便秘模型中测试了一种先导化合物。结果:鉴定了几类新的CFTR激活剂,其中一种是苯基喹喔啉酮CFTR
引言.
便秘是成人和儿童中常见的临床疾病,其对生活质量产生负面影响。据估计,美国人口中慢性便秘的患病率是15%,每年医疗费用估计约70亿美元,而泻药的花费超过8亿美元[1,2]。主要的便秘疗法包括增加粪便体积的泻药,如可溶性纤维;产生渗透负荷的泻药,如聚乙二醇;或刺激肠道收缩的泻药,如二苯基甲烷。也有软化粪便的表面泻药,如多库酯钠和益生菌,如副干酪乳杆菌 [3]。FDA批准的药物利那洛肽是鸟苷酸环化酶C受体的肽激动剂,通过抑制内脏疼痛、刺激肠道运动和增加肠道分泌来起作用[4,5]。第二种批准的药物鲁比前列酮是前列腺素E类似物,被认为激活推定的肠细胞ClC-2通道[6],但机制数据不太清楚。尽管有广泛的治疗选择,但仍然需要安全有效的药物来治疗便秘。
肠液分泌涉及通过基底外侧膜Na
由于这些考虑因素以及对便秘的安全有效药物治疗的持续需求,本文报道了对纳摩尔效能的 CFTR靶向小分子激活剂的鉴定和表征,以及提供了其在肠中的促分泌作用以及在便秘中的功效的概念证据。
方法.
材料.使用从ChemDiv Inc.(圣地牙哥,加利福尼亚州,USA)和Asinex(温斯顿-塞勒姆,北卡罗来纳州,USA)获得的120,000种药物样合成化合物的各种集合进行高通量筛选。对于结构活性分析,测试了在初步筛选中鉴定的活性化合物的600种市售类似物(ChemDiv Inc.)。除非另有说明,否则其他化学品购自Sigma-Aldrich(圣路易斯,密苏里州,USA)。
CFTR
细胞培养.如前所述[12],产生稳定共表达人野生型CFTR和卤化物敏感性黄色荧光蛋白(YFP) -H148Q的Fischer大鼠甲状腺(FRT)细胞。将细胞在补充有10%胎牛血清、2mML-谷氨酰胺、100 单位/ml青霉素和100μg/ml链霉素的Coon氏-改性的Ham氏F12培养基中在塑料上培养。对于高通量筛选,将细胞以每孔20,000个细胞的密度铺板在黑色96孔微量培养板(Corning-Costar Corp.,康宁,纽约,USA)中。在铺板后24-48小时进行筛选。
高通量筛选.使用配备有液体处理系统和两个FLUOstar荧光板读取器(BMGLabtechnologies,达勒姆,北卡罗来纳州,USA)的Beckman Coulter集成系统进行筛选,每个读取器配备有双注射泵和500±10nm激发和535±15nm发射滤波器(详细见参考文献12)。将表达CFTR和YFP的FRT细胞在铺板后在37℃/5%CO
短路电流测量.如[12]所述,在多孔过滤器上培养的稳定地表达野生型人CFTR的FRT细胞中测量短路电流。基底外侧溶液含有130mM NaCl、2.7mM KCl、1.5mM KH
cAMP测定.使用GloSensor发光测定法(Promega Corp.,麦迪逊,威斯康星州,USA)测量细胞内cAMP活性。FRT裸细胞用pGloSensor cAMP质粒稳定地转染,并铺板在白色96孔微量培养板上并生长至汇合。细胞用PBS洗涤三次,并在不存在和存在100nM福司可林下用5μM CFTR
药代动力学.所有动物实验均由UCSF机构动物护理和使用委员会批准。雌性CD1小鼠经腹膜内(ip)或口服用10mg/kg CFTR
体外代谢稳定性.如[13]所述,将CFTR
小鼠便秘模型.向雌性CD1小鼠(8-10周龄)给药洛哌丁胺(0.3mg/kg,腹膜内,Sigma-Aldrich) 以产生便秘。同时(对于腹膜内给药)或在洛哌丁胺前1小时(对于口服给药)给药各种量的CFTR
体内肠道通过和离体肠道收缩.使用口服给药的标记物(200μL,5%伊文思蓝,5%阿拉伯树胶) 并测量其在粪便中出现的时间来测定整个肠的通过时间。小鼠在零时间腹膜内给药洛哌丁胺和 CFTR
体内肠道分泌和吸收.在实验前24小时,使小鼠(野生型或CF)获得5%葡萄糖水但不获得固体食物。小鼠用异氟烷麻醉,并使用加热垫使体温在手术期间保持在36-38℃。做出小的腹部切口以暴露小肠,并通过缝线分离闭合的中部空肠环(长2-3cm)。向环注射单独的100μL载体或含100 μg CFTR
长期给药和毒性研究.每天一次向小鼠口服给药10mg/kg CFTR
统计分析.两组实验使用学生t-检验分析,当有3组或更多分析时,用单因素方差分析和事后 Newman-Keuls多重比较检验进行。P<0.05被认为具有统计学显著性。
结果.
小分子CFTR激活剂的鉴定和体外表征.目标是鉴定在肠中具有促分泌活性的有效的CFTR靶向激活剂,以便在便秘的小鼠模型中测试其功效。图8A总结了方案策略。这里评估的化合物包括在先前的CFTR激活剂/增效剂筛选[14]中鉴定的小分子和来自先前未测试的合成小分子的新筛选的小分子。基于作用研究的最初机制(cAMP升高的测定)、体外毒性、小鼠肠中的促分泌作用和在便秘的小鼠模型中的功效优先排序筛选出来的最有活性的化合物以及市售的化学类似物。图8B显示了基于细胞的平板读取器筛选方法,其中在添加细胞外碘化物后,在稳定表达人野生型CFTR和YFP 荧光卤化物传感器的FRT细胞中测量碘化物流入的初始速率。CFTR激活剂增加荧光猝灭曲线的初始斜率。
图8C显示了从筛选中鉴定的六类CFTR候选激活剂的化学结构。基于上面列出的标准,我们关注对CFTR
表达CFTR的FRT细胞中的短路电流测量显示在EC
CFTR
在洛哌丁胺给药前1小时口服给药10mg/kg CFTR
CFTR
为了直接研究CFTR
CFTR
在快速腹膜内或口服给药10mg/kg CFTR
在细胞培养物和小鼠中进行CFTR
最后,为了确定长期给药的CFTR
讨论.
我们通过高通量筛选纳摩尔亲和力的小分子CFTR激活剂CFTR
CFTR靶向激活增加了抗便秘治疗的各种作用机制。值得注意的是,纯CFTR激活能够在肠中产生强烈的Cl
CFTR
据报道,取代的喹喔啉酮是膜外排转运蛋白多药耐药蛋白1的选择性拮抗剂[20]。也据报道,喹喔啉酮通过刺激胰腺INS-1细胞中的胰岛素分泌显示出抗糖尿病活性[21],以及对血栓形成性障碍的潜在治疗具有抑制丝氨酸蛋白酶的活性[22]。最近,据报道,喹喔啉酮可抑制醛糖还原酶[23]。这些报道表明喹喔啉酮支架具有类似药物的特性。合成上,喹喔啉酮可以由市售的起始原料以一步至四步制备[24],这样可以便于合成靶向类似物。
除了化合物特异性脱靶作用之外,CFTR激活剂的潜在副作用特征可包括气道/肺和各种腺和其他上皮细胞中的促分泌活性。便秘治疗的脱靶效应可通过口服给药具有有限肠吸收和/或快速全身清除的CFTR激活剂以使全身暴露最小化来加以限制。CFTR
总之,不希望受理论束缚,据信本文的数据提供了CFTR激活剂在小鼠肠道中的促分泌作用的证据和其用于治疗各种类型便秘的概念证据,其可以包括阿片样物质诱导的便秘、慢性特发性便秘或便秘型肠易激综合征。
参考文献(实施例4).
[1].Pinto Sanchez MI,Bercik P.Epidemiology and burden of chronicconstipation.Canadian Journal of Gastroenterology 2011,25(Suppl B):11B-15B;[2].Mugie SM,Di Lorenzo C,Benninga MA. Constipation in childhood.NatureReviews Gastroenterology and Hepatology 2011,8(9):502-511;[3]. Menees S,SaadR,Chey WD.Agents that act luminally to treat diarrhoea andconstipation.Nature Reviews Gastroenterology and Hepatology 2012,9(11):661-674;[4].Castro J,Harrington AM,Hughes PA et al. Linaclotide inhibits colonicnociceptors and relieves abdominal pain via guanylate cyclase-C andextracellular cyclic guanosine 3′,5′-monophosphate.Gastroenterology 2013,145(6):1334-1346;[5].Busby RW,Bryant AP,Bartolini WP et al.Linaclotide,throughactivation of guanylate cyclase C,acts locally in the gastrointestinal tractto elicit enhanced intestinal secretion and transit.European Journal ofPharmacology 2010,649(1-3):328-335;[6].Fei G,Raehal K,Liu S etal.Lubiprostone reverses the inhibitory action of morphine on intestinalsecretion in Guinea pig and mouse.Journal of Pharmacology and ExperimentalTherapeutics 2010,334(1):333-340;[7].Thiagarajah JR,Donowitz M,VerkmanAS.Secretory diarrhoea: mechanisms and emerging therapies.Nature ReviewsGastroenterology and Hepatology 2015,12(8):446- 457;[8].Field M,Fromm D,Al-Awqati Q et al.Effect of cholera enterotoxin on ion transport across isolatedileal mucosa.The Journal of Clinical Investigation 1972,51(4):796-804;[9].RaoMC,Guandalini S,Smith PL et al.Mode of action of heat-stable Escherichia colienterotoxin Tissue and subcellular specificities and role of cyclicGMP.Biochimica et Biophysica Acta(BBA)-General Subjects 1980, 632(1):35-46;[10].Subramanya SB,Rajendran VM,Srinivasan P et al.Differential regulation ofcholera toxin-inhibited Na-H exchange isoforms by butyrate in ratileum.American Journal of Physiology- Gastrointestinal and Liver Physiology2007,293(4):G857-G863;[11].Hecht G,Hodges K,Gill RK et al. Differentialregulation of Na
实施例5-干眼症-II
缩写:CFTR,囊性纤维化穿膜传导调节蛋白;cAMP,环腺苷一磷酸;ENaC,上皮钠通道;YFP,黄色荧光蛋白;CF,囊性纤维化;FRT细胞,Fischer大鼠甲状腺细胞;I
摘要.包括干燥综合征的干眼症障碍在老年人群中构成常见问题,可获得的有效治疗选择是有限的。cAMP激活的Cl
引言.
干眼症是异质性疾病组,具有减少的泪液体积和泪液高渗透性的共同特征,其导致眼表面的炎症。包括眼不适和视力障碍的临床结果代表了老龄人口中的一个主要公共健康问题。干眼症影响全球人口的三分之一(1),包括500万50岁及以上的美国人(2,3)。干眼症的经济负担是巨大的,美国每年直接医疗保健费用估计为38.4亿美元(4)。
94%的调查眼科医生认为中度至重度干眼症需要额外的治疗(7)。
眼表面是解剖学上连续的上皮和腺组织的集合,其在功能上连接以维持泪膜(8)。虽然流泪有助于大量反射性流泪,但角膜和结膜调节基础泪液的体积和组成。水在眼表面上移动成泪膜的主要决定因素包括通过cAMP-和钙(Ca
囊性纤维化穿膜传导调节蛋白(CFTR)是在一些分泌性上皮细胞中表达的cAMP激活的Cl
在此,我们评估并优先考虑通过高通量筛选鉴定的野生型CFTR的新型小分子激活剂作为干眼症的潜在局部治疗,研究策略总结于图1中。目标是改进我们之前鉴定的CFTR激活剂(26),这些激活剂缺乏合适的效力和化学特性以推进临床开发,并证明新鉴定的CFTR激活剂在干眼症小鼠模型中的功效。
材料和方法.
小鼠.将CD1遗传背景中的野生型(WT)和CF(纯合ΔF508-CFTR突变体)小鼠在加利福尼亚大学旧金山分校(UCSF)动物设施中繁殖。使用8至12周龄(25至35g)的小鼠。雌性BALB/c 小鼠(7-8周龄)购自Harlan Laboratory(Livermore,CA,USA)。动物方案经UCSF机构动物护理和使用委员会批准,并符合ARVO眼科和视力研究中动物使用的声明。
短路电流.将稳定表达野生型人CFTR的Fischer大鼠甲状腺(FRT)细胞在Snapwell插入物 (Corning Costar,Corning NY,USA)上培养,用于短路电流(I
cAMP和细胞毒性测定.使用GloSensor发光测定法(Promega Corp.,麦迪逊,WI,USA)测量细胞内cAMP活性。将用pGloSensor cAMP质粒(Promega Corp.)稳定转染的FRT细胞在白色96 孔微量培养板(Corning Costar)中培养过夜。然后用PBS洗涤细胞三次,并在不存在和存在100nM 福司可林的情况下用5μM测试化合物孵育10分钟。为了测定细胞毒性,将FRT细胞在黑色96孔 Costar微量培养板孔中培养过夜,并用高达100μM(在PBS中的最大溶解度)的测试化合物孵育1 或24小时。根据制造商的说明书(Invitrogen,卡尔斯巴德,CA,USA),通过Alamar Blue测定法测量细胞毒性。
眼表电位差测量.如(21)所述,响应于不同溶液在眼表面上的连续灌注,在麻醉小鼠中连续测量开路跨上皮PD。用Avertin(2,2,2-三溴乙醇,125mg/kg腹膜内,Sigma-Aldrich,圣路易斯,MO, USA)麻醉小鼠,并使用加热垫将核心温度维持在37℃。将眼定向为角膜和结膜朝上并通过用交叉作用钳缩回眼睑来暴露。溶液是等渗的(320±10mOsM;参考文献21中提供的组合物)并含有10 μM吲哚美辛以防止CFTR被前列腺素激活。使用多储存器重力夹阀系统(ALA Scientific,韦斯特伯里,NY,USA)和可变流量蠕动泵(中等流量模型;Fisher Scientific,费尔劳恩,NJ,USA),通过塑料管以6mL/min灌注眼表面。使用微定位器将探针导管固定在角膜上方1mm处,并将抽吸套管定位在距离眼眶3mm处。将测量电极与灌注导管接触并连接到高阻抗电压表(IsoMilivolt Meter; WPI)上。参比电极经由填充有等渗盐水的翼状21号针接地,并经皮下插入腹部。测量和参比电极由Ag/AgCl和3M KCl琼脂桥组成。
泪液分泌.为了测量未受刺激的泪液产生,使用jewelers钳将酚红线(Zone-Quick,Oasis Medical,格伦多拉,CA,USA)置于异氟烷麻醉的小鼠的外眦中10秒。如在解剖显微镜下所观察的,泪液体积以线润湿的长度测量。与载体相比,在施用2-μL化合物制剂液滴(50-100μM化合物的含有0.5%聚山梨醇酯和0.5%DMSO的PBS)后,使用连续测量来评价化合物药效学。
丽丝胺绿染色.为了评估角膜上皮破坏,将5μL丽丝胺绿(LG)染料(1%)应用于异氟烷麻醉的小鼠的眼表面。使用适用于Olympus变焦立体显微镜(Olympus,森特瓦利,PA,USA)的Nikon 数码照相机拍摄眼的照片。每个角膜象限由一名不知情的训练有素的观察者按3点等级评分,每个象限的染色程度分类为:0,无染色;1,散发(涉及总表面的<25%)染色;2级,弥漫性点状染色 (25-75%);以及3级,聚结点状染色(≥75%)。总等级报告为所有四个象限的分数总和,范围从0 到12。
药代动力学和组织分布.为了确定CFTR激活剂在眼前小鼠泪膜中的停留时间,在单剂量眼递送后回收化合物用于液相色谱/质谱(LC/MS)。在手动眼睑眨眼后,用5-μL微毛细管(Drummond Scientific Co.,Broomhall,PA,USA)从外眦和内眦回收三次洗眼液(每次3μL PBS)(9)。合并的洗液用含有0.1%甲酸的乙腈/水(1:1)稀释,并使用连接至Waters2695HPLC溶剂输送系统的Xterra MS C18柱(2.1mm x 100mm,3.5-μm粒径)和具有正电喷雾电离的Waters Micromass ZQ质谱仪通过LC/MS分析。
为了研究化合物在全身组织中的积聚,在每天三次局部给药(0.1nmol,2μL,50μM)14天后,分析小鼠血液、脑、肾和肝。将血液样品从左心室收集到K3 EDTA微型管(Greiner,Kremsmunster,奥地利)中并离心(28)。用等体积的乙酸乙酯萃取上清液,用空气流干燥萃取物。在用肝素化PBS (10单位/mL)进行心室灌注后,取出来自治疗和对照小鼠的器官,称重,与乙酸和水(100μL/g组织)混合,并均质化(29)。加入乙酸乙酯(10mL/g组织),涡旋样品并离心(3000rpm,15分钟),蒸发含乙酸乙酯的上清液。然后如上所述,重构并通过LC/MS分析从血清和器官匀浆的有机萃取物获得的残留物。
通过泪腺切除产生的干眼症小鼠模型.水缺乏性干眼症的泪腺切除(LGE)模型由报道的方法 (30)修改。通过3-mm线性皮肤切口将野生型雌性BALB/c小鼠(7-8周龄)的每侧的眶外泪腺暴露。将泪管烧灼,双侧去除整个腺体,避开面部血管和神经。每个切口用单根中断的6-0丝线闭合。眼眶泪腺组织保持功能性。在LGE的1天内由神经营养性角膜溃疡鉴定出角膜感觉减少的眼(<5%的研究小鼠)被排除在外。将小鼠随机化以接受CFTR
统计学.数据表示为平均值±平均值的标准误差(SEM)。对于两个平均值之间的直接比较,使用双侧学生t检验。对于干眼症预防研究中泪液分泌和LG分数的纵向测量,使用线性混合效应回归,调整对同一只眼和同一动物的双眼进行的测量的非独立性。使用包lme4和robustlmm在Mac的R v.3.2(R Foundation for Statistical Computing,维也纳,奥地利)中进行分析。
结果.
小分子CFTR激活剂的表征.对120,000种化合物(10μM)的基于细胞的功能性高通量筛选鉴定了20个化学类别的野生型CFTR的小分子激活剂,其产生>95%的最大CFTR激活。筛选在96孔板中的共表达人野生型CFTR和细胞质YFP卤化物传感器的FRT上皮细胞中完成(26,31,32)。二级筛选涉及用次最大福司可林(50nM)预处理的表达CFTR的FRT细胞中的I
来自四个最有活性的化学类别的激活剂的结构示于图2A中,以及来自I
寻求直接靶向CFTR而不引起细胞cAMP升高的化合物以使潜在的脱靶效应最小化(图2D)。可能通过磷酸二酯酶抑制产生细胞内cAMP升高的化合物(来自O类、Q类和R类)被排除在进一步考虑之外。选择不增加cAMP的来自B类、J类和K类的纳摩尔效力化合物用于在活小鼠中进一步表征。
CFTR激活剂增加眼表氯化物和体内液体分泌.在我们的实验室中开发的开路电位差(PD)方法用于评估化合物在眼表面的体内活性,如图3A所示(21)。通过在用一系列溶液连续灌注眼表面期间测量PD来量化Cl
图3B显示暴露于CFTR
接下来测试CFTR激活剂在增加小鼠泪液产生方面的功效。初步实验确定了标准眼科制剂(0.5%聚山梨醇酯),其增加了化合物的溶解度和作用持续时间。在单次局部剂量后,间接CFTR激活剂霍乱毒素、福司可林和3-异丁基-1-甲基黄嘌呤(IBMX)在30分钟时基本上增加基础泪液分泌,但这些效应是短暂的并且在2小时后检测不到(图4A)。然而,此处鉴定的直接CFTR激活剂、CFTR
毒性和药代动力学.泪液收集方法通过证明滴注后直至6小时从眼表面可重复回收四甲基罗丹明葡聚糖(3kDa)来验证。通过回收的泪液洗液的LC/MS测定CFTR
在每天三次给药两周后,CFTR
CFTR激活剂预防小鼠泪腺切除模型中的干眼症.基于其有利的泪膜药代动力学,选择CFTR
讨论.
本研究的目的是研究CFTR的小分子激活剂用于干眼症疗法的潜在效用。在几次先前的发展失败之后,干眼症仍然是眼部疾病的未满足需求。在干眼症障碍中,泪膜高渗透压性刺激促炎信号传导、细胞因子和金属蛋白酶的分泌、以及角膜上皮细胞完整性的破坏(35-38)。通过最小化泪膜高渗透压性,预测CFTR激活以防止这些下游眼表面变化。
我们通过高通量筛选鉴定小分子CFTR激活剂,其通过涉及直接CFTR激活而非上游cAMP信号传导的机制,在眼表面上产生持续的Cl
我们发现CFTR
已经考虑了靶向不同眼表离子通道的替代性促分泌疗法。唯一经FDA批准的CFTR激活剂VX- 770是通过纠正某些CFTR突变的通道门控来治疗CF而开发的“增效剂”(44)。然而,VX-770在细胞培养物和小鼠体内中对野生型CFTR显示出相对较小的活性。慢性应用VX-770还可以减少CFTR 功能表达(24)并引起白内障(参见幼年大鼠;参考文献42),这可能是脱靶效应,因为CFTR不在晶状体中表达。
CFTR
总之,不希望受理论束缚,据信CFTR
参考文献(实施例5).
[1].The definition and definition of dry eye disease:report of theDefinition and Classification Subcommittee of the International Dry EyeWorkShop 2007(DEWS)(2007).Ocul.Surf.5,65-204;[2]. Schaumberg,D.A.,Dana,R.,Buring,J.E.,and Sullivan,D.A.(2009).Prevalence of dry eye disease among USmen:estimates from the Physicians’Health Studies.Arch.Ophthalmol.127,763-768;[3].Schaumberg, D.A.,Sullivan,D.A.,Buring,J.E.,and Dana,M.R.(2003).Prevalenceof dry eye syndrome among US women.Am.J.Ophthalmol.136,318-326;[4].Yu,J.,Asche,C.V.,and Fairchild,C.J.(2011).The economic burden of dry eye disease inthe United States:a decision tree analysis.Cornea 30,379-387;[5]. Alves,M.,Foseca,E.C.,Alves,M.F.,Malki,L.T.,Arruda,G.V.,Reinach,P.S.,and Rocha,E.M.(2013).Dry eye disease treatment:a systematic review of published trials andcritical appraisal of therapeutic strategies. Ocul.Surf.11,181-192;[6].Sheppard,J.D.,Torkildsen,G.L.,Lonsdale,J.D.,D'Ambrosio Jr.,F.A., McLaurin,E.B.,Eiferman,R.A.,Kennedy,K.S.and Semba,C.P.;OPUS-1Study Group(2014).Lifitegrast ophthalmic solution 5.0%for treatment of dry eye disease:results of the OPUS-1phase 3study. Ophthalmology 121,475-483;[7].Asbell P.A.,and Spiegel S.(2010).Ophthalmologist perceptions regarding treatment ofmoderate-to-severe dry eye:results of a physician survey.Eye Contact Lens 36,33- 38;[8].The epidemiology of dry eye disease:report of the EpidemiologySubcommittee of the International Dry Eye WorkShop 2007(DEWS)(2007).Ocul.Surf.5,65-204;[9].Thelin,W.R.,Johnson,M.R.,Hirsh, A.J.,Kublin,C.L.andZoukhri,D.J.(2012).Effect of topically applied epithelial sodium channelinhibitors on tear production in normal mice and in mice with induced aqueoustear deficiency.Ocul.Pharmacol.Ther. 28,433-438;[10].Nichols,K.K.,Yerxa,B.andKellerman,D.J.(2004).Diquafosol tetrasodium:a novel dry eye therapy.Expert.Opin.Investig.Drugs 13,47-54;[11].Koh,S.,Ikeda,C.,Takai,Y.,Watanabe,H., Maeda,N.,and Nishida,K.(2013).Long-term results of treatment with diquafosolophthalmic solution for aqueous-deficient dry eye.Jpn.J.Ophthalmol.57,440-446;[12].Takamura,E.,Tsubota,K.,Watanabe,H., and Ohashi,Y.;DiquafosolOphthalmic Solution Phase 3Study Group(2012).A randomised,double-maskedcomparison study of diquafosol versus sodium hyaluronate ophthalmic solutionsin dry eye patients.Br.J. Ophthalmol.96,1310-1315;[13].Tauber,J.,Davitt,W.F.,Bokosky,J.E.,Nichols,K.K.,Yerxa,B.R., Schaberg,A.E.,LaVange,L.M.,Mills-Wilson,M.C.,and Kellerman,D.J.(2004).Double-masked placebo- controlled safetyand efficacy trial of diquafosol tetrasodium(INS365)ophthalmic solution forthe treatment of dry eye.Cornea 23,784-792;[14].Al-Nakkash,L.,and Reinach,P.S.(2001).Activation of a CFTR- mediated chloride current in a rabbitcorneal epithelial cell line.Invest.Ophthalmol.Vis.Sci.42,2353-2370; [15].Shiue,M.H.,Gukasyan,H.J,Kim,K.J.,Loo,D.D.,and Lee,V.H(2002).Characterizationof cyclic AMP-regulated chloride conductance in the pigmented rabbitconjunctival epithelial cells.Can.J.Physiol. Pharmacol.80,533-540;[16].Turner,H.C.,Bernstein,A.,and Candia,O.A.(2002).Presence of CFTR in theconjunctival epithelium.Curr.Eye Res.24,182-187;[17].Ansari,E.A.,Sahni,K.,Etherington,C., Morton,A.,Conway,S.P.,Moya,E.,and Littlewood,J.M.(1999).Ocular signs and symptoms and vitamin A status in patients with cysticfibrosis treated with daily vitamin A supplements.Br.J.Ophthalmol.83,688-691;[18].Botelho,S.Y.,Goldstein,A.M.,and Rosenlund,M.L.(1973).Tear sodium,potassium,chloride, and calcium at various flow rates:children with cysticfibrosis and unaffected siblings with and without cornealstaining.J.Pediatr.83,601-606;[19].Morkeberg,J.C.,Edmund,C.,Prause,J.U.,Lanng,S.,Koch, C.,and Michaelsen,K.F.(1995).Ocular findings in cysticfibrosis patients receiving vitamin A supplementation.GraefesArch.Clin.Exp.Ophthalmol.233,709-713;[20].Mrugacz,M.,Kaczmarski,M.,Bakunowicz-Lazarczyk,A.,Zelazowska,B.,Wysocka,J.,and Minarowska,A.(2006).IL-8and IFN-gamma in tear fluid of patients with cystic fibrosis.J.InterferonCytokine Res.26,71-75;[21].Levin,M.H.and Verkman,A.S.(2005).CFTR-regulatedchloride transport at the ocular surface in living mice measured by potentialdifferences.Invest.Ophthalmol.Vis.Sci.46,1428-1434;[22].Levin,M.H.,Kim,J.K.,Hu,J., and Verkman A.S.(2006).Potential difference measurements of ocularsurface Na+absorption analyzed using an electrokinetic model.Invest.Ophthalmol.Vis.Sci.47,306-316;[23].Yu,D.,Thelin,W.R.,Rogers, T.D.,Stutts,M.J.,Randell,S.H.,Grubb,B.R.,and Boucher,R.C.(2012).Regional differences in ratconjunctival ion transport activities.Am.J.Physiol.Cell Physiol.303,C767-780;[24].Cholon,D.M., Quinney,N.L.,Fulcher,M.L.,Esther Jr.,C.R.,Das,J.,Dokholyan,N.V.,Randell,S.H.,Boucher,R.C.,and Gentzsch,M.(2014).Potentiator ivacaftorabrogates pharmacological correction ofΔF508 CFTR in cysticfibrosis.Sci.Transl.Med.6,246-296;[25].Ramsey,B.W.,Davies,J.,McElvaney,N.G.,Tullis,E.,Bell, S.C.,
实施例6.用于干眼症疾病的促分泌治疗的纳摩尔效力的氨基苯基-1,3,5-三嗪CFTR氯通道激活剂。
实施例6中的化合物编号和取代基编号仅针对于实施例6。
摘要.干眼症障碍是重要的健康问题,对此可获得的治疗选择是有限的。CFTR(囊性纤维化穿膜传导调节蛋白)是眼表面的主要促分泌氯通道。我们之前通过高通量筛选鉴定了氨基苯基-1,3,5-三嗪CFTR
引言.CFTR(囊性纤维化穿膜传导调节蛋白)是cAMP门控氯通道,在气道、胃肠器官、睾丸和外分泌腺中具有促分泌活性[1-4]。CFTR中的功能丧失突变导致囊性纤维化,并且CFTR的不适当激活引起某些分泌性腹泻,如霍乱[5-7]。CFTR是重要的药物靶标,其在囊性纤维化中突变体CFTR 的增效剂和校正剂的开发方面取得了重大进展,两种药物已获得FDA批准[8]。野生型CFTR的激活剂具有潜在的临床适应症,用于便秘和干眼症障碍的促分泌治疗,并可能用于肝脏、胰腺和气道障碍[9-12],并且CFTR抑制剂正在开发用于某些分泌性腹泻和多囊肾病[13,14]。
我们之前通过高通量筛选鉴定了通过直接激活机制起作用的野生型CFTR的小分子激活剂[12- 15]。一类苯基喹喔啉酮CFTR激活剂在实验性便秘小鼠模型中口服给药后显示出功效[9,10]。第二类CFTR激活剂,其包括氨基苯基-1,3,5-三嗪CFTR
在此,我们报道了氨基苯基-1,3,5-三嗪CFTR激活剂的结构-活性关系研究,重点是干眼症应用。干眼症是与泪液体积减少和泪液高渗透性相关的一组异质性障碍,其导致眼表炎症、眼部不适和视力障碍。干眼症是老龄人口中的主要健康问题,包括500万50岁及以上的美国人[16,17]。唯一批准的干眼症药物,局部环孢菌素和立他司特(lifitegrast),通过抗炎机制起作用[18,19]。CFTR激活剂会是首创一类新药干眼症治疗剂,其通过促分泌机制起作用。氨基苯基-1,3,5-三嗪的合成和表征在此产生与1相比具有显著改善的效力和体内促分泌功效的潜在的先导候选物,以及具有更高代谢稳定性的化合物用于非眼部病状的潜在治疗。
化学.
氨基苯基-1,3,5-三嗪类似物的一般合成。氨基苯基-1,3,5-三嗪类似物的合成使用氟化醇盐、二乙胺和苯胺通过连续取代三聚氯氰来完成(路线1)。用1,1,1,3,3,3-六氟异丙醇或2,2,3,3-四氟-1-丙醇取代三聚氯氰,分别得到2和3。用二乙胺胺化2和3,得到中间体4和5。将4和5与苯胺回流,分别得到1和7a。将m-或p-F、Cl、NO
路线1.N,N-二乙基-1,3,5-三嗪类似物的合成。(a)(CF
如路线2所示合成N-甲胺-1,3,5-三嗪类似物11和12。将甲胺用三聚氯氰取代,得到N-甲基-4,6- 二氯-1,3,5-三嗪-2-胺8,产率72%。借助8,用1,1,1,3,3,3-六氟-2-丙醇或2,2,3,3-四氟-1-丙醇取代分别得到9和10。9和10上的苯胺取代分别得到N-甲基氨基-N'-苯基氨基-1,3,5-三嗪类似物11和12。
路线2.N-甲基氨基-N'-苯基氨基-1,3,5-三嗪类似物的合成。(a)DIPEA,THF,0℃,75%。(b) (CF
一般合成操作.所有溶剂和化学品均购买使用,无需进一步纯化。使用乙酸乙酯/正己烷作为溶剂系统,在Merck预涂硅胶板(有254nm荧光)上监测所有反应的过程。用Fluka硅胶60(230-400 目ASTM)和指定的溶剂混合物进行柱色谱。使用CDCl
N,N-二乙基-N'-苯基-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(6a)。通过快速色谱(1:10 EtOAc/Hex)纯化,得到6a,呈白色粉末(100mg,38%)。
3-{[4-(二乙基氨基)-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2-基]氨基}苯甲酸(6b)。通过快速色谱(1:5 EtOAc/Hex)纯化,得到6b,呈白色粉末(60%)。
N,N-二乙基-N'-(3-氟苯基)-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(6c)。通过快速色谱(1:10 EtOAc/Hex)纯化,得到6c,呈白色粉末(40%)。
N'-(3-氯苯基)-N,N-二乙基-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(6d)。通过快速色谱(1:10 EtOAc/Hex)纯化,得到6d,呈白色粉末(81%)。
N,N-二乙基-N'-(3-硝基苯基)-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(6e)。通过快速色谱 (1:10EtOAc/Hex)纯化,得到6e,呈淡黄色粉末(61%)。
4-({4-(二乙基氨基)-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2-基}氨基)苯甲酸(6f)。通过快速色谱(1:10EtOAc/Hex)纯化,得到6f,呈白色粉末(37%)。
N,N-二乙基-N'-(4-氟苯基)-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(6g)。通过快速色谱(1:10 EtOAc/Hex)纯化,得到6g,呈白色粉末(45%)。
3-({4-(二乙基氨基)-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2-基}氨基)苯甲酸(7a)。通过快速色谱(1:6EtOAc/Hex)纯化,得到7a,呈白色粉末(55%)。
N,N-二乙基-N'-(3-氟苯基)-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2,4-二胺(7b)。通过快速色谱(1:8EtOAc/Hex)纯化,得到7b,呈白色粉末(45%)。
N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-N'-(3-硝基苯基)-1,3,5-三嗪-2,4-二胺(7d)。淡黄色粉末,62%产率。
4-({4-(二乙基氨基)-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2-基}氨基)苯甲酸(7e)。通过快速色谱(1:10EtOAc/Hex)纯化,得到7e,呈白色粉末(56%)。
N,N-二乙基-N'-(4-氟苯基)-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2,4-二胺(7f)。通过快速色谱(1:10EtOAc/Hex)纯化,得到7f,呈白色粉末(35%)。
N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-N'-(4-硝基苯基)-1,3,5-三嗪-2,4-二胺(7g)。通过快速色谱(1:10EtOAc/Hex)纯化,得到7g,呈淡黄色粉末(75%)。
N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-N'-(1H-吲唑-5-基)-1,3,5-三嗪-2,4-二胺(7h)。通过快速色谱(1:6EtOAc/Hex)纯化,得到7h,呈灰白色粉末(28%)。
N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-N'-(1H-吲唑-6-基)-1,3,5-三嗪-2,4-二胺(7i)。通过快速色谱(1:6EtOAc/Hex)纯化,得到7i,呈灰白色粉末(28%)。
N'-(1,3-苯并恶唑-6-基)-N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2,4-二胺(7j)。通过快速色谱(1:8EtOAc/Hex)纯化,得到7j,呈紫色粉末(25%)。
N'-(1,3-苯并噻唑-6-基)-N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2,4-二胺(7k)。通过快速色谱(1:7EtOAc/Hex)纯化,得到7k,呈灰白色粉末(40%)。
结果
市售类似物的初步结构-活性分析。使用CFTR功能的基于细胞的平板读取器测定进行化合物活性的初始评估。图14B总结了对1的91种市售类似物的功能测定的初步SAR分析(表2中提供所有市售化合物的数据)。这里测试的市售1,3,5-三嗪类似物在2-、4-、6-位被各种取代基三取代,取代基包括醇盐、苯胺(氨基-苯基)和伯胺或仲胺。SAR分析显示其三个取代基含有氟化醇盐(R
表2.CFTR激活的化学结构和数据。
%市售类似物的激活。
对于>80%激活的化合物,从全剂量反应测定法测量EC
因为来自市售类似物的初始SAR数据受到R
被取代的苯胺和氟化醇盐的修饰。由于氟化醇盐(R
表3.N,N-二乙基-N'-芳基-1,3,5-三嗪二胺类似物的结构及其EC
双环苯胺的修饰。为了进一步研究苯胺取代基,在R
表4.双环苯胺的取代及其活性。
用N-甲胺修饰。最后,R
表5.N-甲基-N'-苯基-1,3,5-三嗪二胺类似物及其活性。
生物学
氨基-苯基-1,3,5-三嗪的体外表征。使用跨上皮氯梯度并在细胞基底外侧膜透化后对表达CFTR 的FRT细胞进行短路电流测量,使得短路电流大小提供CFTR氯传导的定量线性测量。图15A中6k 和12的代表性数据显示了添加低浓度福司可林后电流的小幅增加,随后是添加化合物后电流的浓度依赖性增加。化合物产生完全的CFTR激活,因为在最大浓度的福司可林后,电流几乎没有进一步增加。对于6k,EC
研究了对细胞信号传导和相关的非CFTR离子通道的可能的脱靶效应。10μM的6k和12不会升高细胞cAMP(图16A),增加细胞质钙,或抑制ATP刺激的细胞质钙升高(图16B)。而且,10 μM的6k和12在表达TMEM16A的FRT细胞(图16C)或HT-29细胞(图16D)中既没有抑制也没有激活钙激活的氯通道。为了进一步研究特异性,通过短路电流研究人支气管上皮(HBE)细胞中的主要离子转运途径。HBE细胞依次用阿米洛利处理以抑制上皮钠通道(ENaC),用福司可林处理以激活CFTR,用CFTR
药理学性质和体内功效
进一步研究化合物的溶液和代谢稳定性以及细胞毒性。图17A显示6k和12用33%DMSO作为阳性对照使用阿尔玛蓝测定未产生显著毒性。当以100μM溶于含有0.3%CMC的Ringer溶液的眼科载体中时,12通过LC/MS测定在40℃下保持化学稳定24小时(数据未显示)。为了评估代谢稳定性,将5μM化合物在NADPH存在下与大鼠肝微粒体孵育。图17B显示化合物代谢的动力学,和12的LC/MS曲线。含有未被取代的苯胺的1和12快速代谢,在15分钟时<40%的原始化合物保留,而含有双环苯胺的6j和6k缓慢代谢,在60分钟时约60%的原始化合物保留。含有苯并恶唑的类似物6j显示出比苯并噻唑类似物6k更高的代谢稳定性,这可能是由于苯并噻唑中硫化物相对于苯并恶唑中的氧的相对不稳定性。低代谢稳定性对于干眼症治疗剂是期望的,以使潜在吸收后的全身暴露最小化,而高代谢稳定性对于需要全身暴露和器官积聚的CFTR激活剂的肝和肺施用是期望的。
在测试化合物的2.5μL眼科载体或仅用载体作为对照的单次眼科给药后,进行泪液体积的测量。在6小时对化合物功效的初步测试后选择化合物12。在100μM(250pmol)下,12使泪液体积持续增加8小时,经12-24小时恢复到基线,与1相比具有改善的动力学(图18A)。作为化合物特异性的证据,12没有增加缺乏功能性CFTR的CF小鼠的泪液体积(图18B)。进行剂量-反应研究以确定产生持续泪液分泌的12的最小量。图18C显示在低至25pmol的剂量下12的类似活性,在1-3 小时具有最大泪液体积并且持续效果至8小时。
讨论
此处的结构-活性研究鉴定出具有显著更高的CFTR激活效力的1的类似物,其中最有效的化合物12在小鼠中具有约30nM的EC
已经报道了1,3,5-三嗪支架的各种生物活性。阿特拉津是有两个烷基胺取代基的氯三嗪,是广泛使用的除草剂
CFTR是干眼症治疗的一个引人注目的靶标,因为它在眼表面的角膜和结膜上皮中表达[23-26],其中它起到促分泌氯通道的作用[27,28]。虽然CFTR在基础条件下大体上无活性,但是当被激活时,它具有驱动泪液分泌到眼表面上的能力。通过类比,CFTR在基础条件下在肠中大体上无活性,但是当被霍乱中的细菌肠毒素激活时,它可以促进液体大量分泌到肠腔中。由于局部递送的CFTR激活剂在眼表面上皮细胞上起主要作用,因此预测它们在由多种病因产生的干眼症中是有效的,包括靶向泪腺的障碍,如干燥综合征。然而,应注意的是,纯粹的促分泌治疗主要代替泪膜的含水隔室,其还含有脂质和黏蛋白组分。这种潜在的限制也适用于靶向ENaC钠通道的开发中的抗吸收治疗[29]。尽管存在这种潜在的限制,但在啮齿动物模型中的功效证明[30]以及泪膜高渗透压产生下游病理的干眼症的已知发病机制[31,32]支持CFTR激活剂治疗在人类干眼症中的效用。
总之,预测CFTR激活剂治疗具有广泛的临床适应症,用于由多种病因引起的干眼症的促分泌治疗,包括“特发性”干眼症。由于其独特的作用机制,CFTR激活剂可与获批准的免疫抑制剂和可能的未来的治疗剂如ENaC抑制剂组合。与免疫抑制药物相比,CFTR激活剂治疗以病因不可知的方式挽救干眼症发病的早期起始事件。本文合成和测试的氨基苯基-1,3,5-三嗪是用于进一步临床前开发的候选先导化合物。
实验细节和数据
合成操作
一般操作。所有溶剂和化学品均购买使用,无需进一步纯化。使用乙酸乙酯/正己烷作为溶剂系统,在Merck预涂硅胶板(有254nm荧光)上监测反应过程。用Fluka硅胶60(230-400目)进行柱色谱。使用CDCl
2,4-二氯-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪(2)。在-80℃下将碳酸钾(3.0g,21.74mmol) 加入三聚氯氰(2g,10.84mmol)在THF(50ml)中的溶液中。然后经30分钟逐滴添加1,1,1,3,3,3- 六氟-2-丙醇(1.36ml,10.30mmol)在THF(20ml)中的溶液。将混合物在-80℃下再搅拌30分钟并用水淬灭。将反应混合物用EtOAc稀释并用1N HCl溶液洗涤。将有机层用盐水洗涤并用MgSO
2,4-二氯-6-[(2,2,3,3-四氟丙)氧基]-1,3,5-三嗪(3)。在-80℃下将碳酸钾(3g,21.74mmol)加入三聚氯氰(2g,10.84mmol)在THF(50ml)中的溶液中。然后经30分钟逐滴添加2,2,3,3-四氟丙醇(1.2ml,10.3mmol)在THF(20ml)中的溶液。将混合物在-80℃下再搅拌30分钟并用水淬灭。将反应混合物用EtOAc稀释,将有机层用盐水洗涤并用MgSO
4-氯-N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-1,3,5-三嗪-2-胺(4)。在0℃下将二异丙基乙胺(1.06ml,6.08mmol)和二乙胺(0.5ml,5.0mmol)加入2(1.6g,5.06mmol)在THF(40ml) 中的溶液中。将混合物在0℃下搅拌1小时,然后用水淬灭。将反应混合物用EtOAc萃取,用水和盐水洗涤,并用MgSO
4-氯-N,N-二乙基-6-[(2,2,3,3,-四氟丙)氧基]-1,3,5-三嗪-2-胺(5)。在0℃下将二异丙基乙胺(1ml, 6mmol)和二乙胺(0.5ml,5.0mmol)加入3(1.3g,5mmol)在THF(30ml)中的溶液中。将混合物在0℃下搅拌1小时,然后用水淬灭。将反应混合物用EtOAc萃取,用水和盐水洗涤,并用 MgSO
类似物6a-6k和7a-7g如针对1所述制备,使用各种被取代的苯胺和4或5。
N,N-二乙基-6-[(1,1,1,3,3,3-六氟丙-2-基)氧基]-N'-苯基-1,3,5-三嗪-2,4-二胺(1)。将二异丙基乙胺 (0.49ml,2.83mmol)和苯胺(0.15ml,1.7mmol)加入4(500mg,1.42mmol)在THF(30ml) 中的溶液中。将混合物回流16小时。冷却至室温后,将反应混合物用EtOAc萃取,用盐水洗涤并用 MgSO
4,6-二氯-N-甲基-1,3,5-三嗪-2-胺(8)。在0℃下,经30分钟将甲胺(13.7ml,THF中2M)逐滴加入三聚氯氰(5g,27.3mmol)在丙酮(30ml)中的溶液中。将混合物在0℃下搅拌1小时,然后加入碎冰。过滤所得沉淀物并用水洗涤,得到8,呈白色固体(3.7g,75.7%),将其不经纯化用于进一步反应。
4-氯-6-((1,1,1,3,3,3-六氟丙-2-基)氧基)-N-甲基-1,3,5-三嗪-2-胺(9)。在0℃下将碳酸钾(11.56g, 83.8mmol)和1,1,1,3,3,3-六氟-2-丙醇(1.4ml,13.4mmol)加入8(2g,11.17mmol)在THF(40 ml)中的溶液中。将混合物在环境温度下搅拌过夜。将反应混合物用EtOAc稀释,然后将有机层用盐水洗涤并用MgSO
4-氯-6-[(2,2,3,3-四氟丙)氧基]N-甲基-1,3,5-三嗪-2-胺(10)。在0℃下将碳酸钾(970mg,7.04mmol) 加入8(630mg,3.52mmol)在THF(30ml)中的溶液中。经30分钟逐滴加入2,2,3,3-四氟丙醇 (0.31ml,3.52mmol)在THF(20ml)中的溶液。将混合物在0℃下再搅拌30分钟,然后用水淬灭。将反应混合物用EtOAc稀释,并将有机层用盐水洗涤并用MgSO
N-甲基-N'-苯基-6-(2,2,3,3-四氟丙氧基)-1,3,5-三嗪-2,4-二胺(12)。将二异丙基乙胺(0.09ml,0.51 mmol)和苯胺(0.03ml,0.31mmol)加入10(70mg,0.26mmol)在THF(3ml)中的溶液中。将混合物回流16小时。冷却至室温后,将反应混合物用EtOAc萃取,用盐水洗涤并用MgSO
小鼠.将CD1遗传背景中的野生型和CF(纯合ΔF508-CFTR突变体)小鼠在加利福尼亚大学旧金山分校(UCSF)动物设施中繁殖。使用8至12周龄(25至35g)的小鼠。动物方案经UCSF机构动物护理和使用委员会批准,并符合ARVO眼科和视力研究中动物使用的声明。
细胞培养.如[15,33]所述,培养稳定共表达人野生型CFTR或TMEM16A和卤化物敏感性黄色荧光蛋白(YFP)-H148Q的Fischer大鼠甲状腺(FRT)细胞。如[34]所述,培养表达YFP的HT-29。如前[35]所述,人支气管上皮(HBE)细胞的原代培养物保持在气-液界面处。
氯通道功能的平板读取器测定.如[15]所述,测定CFTR活性。共表达YFP和野生型CFTR的 FRT细胞用磷酸盐缓冲盐水(PBS)洗涤,然后与含有125nM福司可林的PBS中的测试化合物一起孵育10分钟。I
短路电流测量.如[9]所述,进行短路电流测量。简言之,将含有表达CFTR的FRT细胞或人支气管上皮细胞的Snapwell(Corning Costar,Corning,NY)插入物安装在Ussing室(Physiological Instruments,圣地亚哥,CA)中。对于FRT细胞,半室填充有5ml HCO
cAMP和Ca
细胞毒性.将FRT细胞在黑色96孔Costar微量培养板中培养过夜,并与至多10μM(PBS中的最大溶解度)的测试化合物孵育8小时。通过阿尔玛蓝测定法(Invitrogen,卡尔斯巴德,CA)测量细胞毒性。
泪液体积.如[36]所述,使用酚红线(Zone-Quick,Oasis Medical,格伦多拉,CA)测量泪液体积。使用jewelers钳将线置于异氟烷麻醉的小鼠的外眦中10秒。如在解剖显微镜下所观察的,泪液体积以线润湿的长度测量。局部施用在含有0.3%羧甲基纤维素(高粘度,VWR,Radnor,PA)、0.015%苯扎氯铵防腐剂和1%DMSO的Ringer溶液中含有0-100μM 1或12的2.5μL单滴眼用制剂后,进行连续测量以评估化合物药效学。每只小鼠的双眼接受相同的治疗以控制给定治疗的潜在对侧效应。
体外代谢稳定性.如所述
统计学.使用Prism 5GraphPad软件包(圣地亚哥,CA)进行统计学分析。通过双因素方差分析和Dunnett事后分析来分析连续泪液体积测量值。数据表示为平均值±平均值的标准误差(S.E.M.),统计学显著性设定为p<0.01(*)。
缩写.CFTR,囊性纤维化穿膜传导调节蛋白;cAMP,环腺苷一磷酸;YFP,黄色荧光蛋白;CF,囊性纤维化;FRT细胞,Fischer大鼠甲状腺细胞;LC/MS,液相色谱/质谱;fsk,福司可林;SAR,结构-活动关系。
参考文献(实施例6).
[1]Verkman,A.S.;Galietta,L.J.Chloride channels as drugtargets.Nat.Rev.Drug Disc.2009,8, 153-171;[2]Schmidt,B.Z.;Haaf,J.B.;Leal,T.;Noel,S.Cystic fibrosis transmembrane conductance regulator modulators incystic fibrosis:current perspectives.Clin.Pharmacol.2016,21,127-140;[3]Thiajarajah,J.R.;Donowitz,M.;Verkman,A.S.Secretory diarrhea:mechanisms andemerging therapies. Nature Rev.Gastroenterol.Hepatol.2015,12,446-457;[4]Ong,T.;Ramsey,B.W.New rherapeutic approaches to modulate and correct cysticfibrosis transmembrane conductance regulator.Pediatr.Clin. North.Am.2016,63,751-764;[5]Chao,A.C.;de Sauvage,F.J.;Dong,Y.J.;Wagner,J.A,;Goeddel,D. V.;Gardner,P.Activation of intestinal CFTR Cl-channel by heat-stable enterotoxinand guanylin via cAMP- dependent protein kinase.EMBO J.1994,13,1065-1072;[6]Moon,C.;Zhang,W.;Sundaram,N.; Yarlagadda,S.;Reddy,V.S.;Arora,K.;Helmrath,M.A.;Naren,A.P.Drug-induced secretory diarrhea:A role forCFTR.Pharmacol.Res.2015,102,107-112;[7]Field,M.;Mechanisms of action ofcholera and Escherichia coli enterotoxins.Am.J.Clin.Nutr.1979,32,189-196;[8]Solomon G.M.;Marshall,S. G.;Ramsey,B.W.;Rowe,S.M.Breakthrough therapies:Cystic fibrosis(CF)potentiators and correctors. Pediatr.Pulmonol.2015,50,S3-S13;[9]Cil,O.;Phuan,P.W.;Lee,S.;Tan,J.;Haggie,P.M.;Levin,M. H.;Sun,L.;Thiagarajah,J.R.;Ma,T.;Verkman,A.S.CFTR activator increases intestinal fluidsecretion and normalizes stool output in a mouse model of constipation.Cell.Mol.Gastroentrol.Hepatol.2016,2,317- 327;[10]Cil,O.;Phuan,P.W.;Son,J.H.;Zhu,J.S.;Ku,C.K.;Tabib,N.A.;Teuthorn,A.P.;Ferrera, L.;Zachos,N.C.;Lin,R.;Galietta,L.J.;Donowitz,M.;Kurth,M.J.;Verkman,A.S.Phenylquinoxalinone CFTRactivator as potential prosecretory therapy for constipation.Transl.Res.2016,(出版中);[11] Solomon,G.M.;Raju,S.V.;Dransfield,M.T.;Rowe,S.M.Therapeuticapproaches to acquired cystic fibrosis transmembrane conductance regulatordysfunction in chronic bronchitis.Ann.Am.Thorac.Soc.2016, 13,Suppl 2:S169-S176;[12]Flores,A.M.;Casey,S.D.;Felix,C.M.;Phuan,P.W.;Verkman,A.S.; Levin,M.H.Small-molecule CFTR activators increase tear secretion and preventexperimental dry eye disease.FASEB J.2016,30,1789-1797;[13]Cil,O.;Phuan,P.W.;Gillespie,A.M.;Lee,S.;Tradtrantip, L.;Yin,J.;Tse,M.;Zachos,N.C.;Lin,R.;Donowitz,M.;Verkman,A.S.Benzopyrimido-pyrrolo-oxazine- dione CFTR inhibitor(R)-BPO-27for antisecretory therapy of diarrheas caused by bacterialenterotoxins.FASEB J.2016(出版中);[14]Snyder,D.S.;Tradtrantip,L.;Yao,C.;Kurth,M.J.; Verkman,A.S.Potent,metabolically stable benzopyrimido-pyrrolo-oxazine-dione(BPO)CFTR inhibitors for polycystic kidneydisease.J.Med.Chem.2011,54,5468-5477;[15]Ma,T.;Vetrivel,L.;Yang,H.;Pedemonte,N.;Zegarra-Moran,O.;Galietta,L.J.;Verkman,A.S.High-affinityactivators of CFTR chloride conductance identified by high-throughputscreening.J.Biol.Chem.2002,277,37235-37241;[16] Schaumberg,D.A.;Dana,R.,Buring,J.E.;Sullivan,D.A.Prevalence of dry eye disease among US men:estimates from the Physicians’Health Studies.Arch.Ophthalmol.2009,127,763-768;[17]Schaumberg, D.A.;Sullivan,D.A.;Buring,J.E.;Dana,M.R.Prevalence of dryeye syndrome among US women.Am.J. Ophthalmol.2003,136,318-326;[18]Alves,M.;Foseca,E.C.;Alves,M.F.;Malki,L.T.;Arruda,G.V.; Reinach,P.S.;Rocha,E.M.Dry eyedisease treatment:a systematic review of published trials and criticalappraisal of therapeutic strategies.Ocul.Surf.2013,11,181-192;[19]Sheppard,J.D.;Torkildsen,G.L.; Lonsdale,J.D.;D'Ambrosio Jr.F.A.;McLaurin,E.B.;Eiferman,R.A.;Kennedy,K.S.;Semba,C.P.; OPUS-1Study Group.Lifitegrastophthalmic solution 5.0%for treatment of dry eye disease:results of theOPUS-1phase 3study.Ophthalmology 2014,121,475-483;[20]Jowa,L.;Howd,R.Shouldatrazine and related chlorotriazines be considered carcinogenic for humanhealth risk assessment?J.Environ.Sci.Health C Environ.Carcinog.EcotoxicolRev.2011,29,91-144;[21]Moon,H.-S.;Jacobson,E.M.;Khersonsky, S.M.;Luzung,M.R.;Walsh,D.P.;Xiong,W.;Lee J.W.;Parikh,P.B.;Lam,J.C.;Kang,T.-W.;Rosania,G. R.;Schier,A.F.;Chang,Y.-T.A novel microtubule destabilizing entity fromorthogonal synthesis of triazine library and zebrafish embryoscreening.J.Am.Chem.Soc.2002,124,11608-11609;[22]Plebanek,E.; Chevrier,F.;Roy,V.;Garnne,T.;Lecaille,F.;Warszycki,D.;Bojarski,A.J.;Lalmanach,G.;Agrofoglio,L. A.Straightforward synthesis of 2,4,6-trisubstituted 1,3,5-triazine compounds targeting cysteine cathepsins K and S.Eur.J.Med.Chem.2016,121,12-20;[23]Kompella,U.B.;Kim,K.J.;Lee,V.H.Active chloride transport in thepigmented rabbit conjunctiva.Curr.Eye Res.1993,12,1041-1048;[24]Turner, H.C.;Bernstein,A.;Candia,O.A.Presence of CFTR in the conjunctivalepithelium.Curr.Eye Res.2002, 24,182-187;[25]Al-Nakkash,L.;Reinach,P.S.Activation of a CFTR-mediated chloride current in a rabbit cornealepithelial cell line.Invest.Ophthalmol.Vis.Sci.2001,42,2353-2370;[26]Shiue,M.H.; Gukasyan,H.J;Kim,K.J.;Loo,D.D.;Lee,V.H.Characterization of cyclic AMP-regulated chloride conductance in the pigmented rabbit conjunctivalepithelial cells.Can.J.Physiol.Pharmacol.2002,80,533- 540;[27]Levin,M.H.;Verkman,A.S.CFTR-regulated chloride transport at the ocular surface in livingmice measured by potential differences.Invest.Ophthalmol.Vis.Sci.2005,46,1428-1434;[28]Levin,M. H.;Kim,J.K.;Hu,J.;Verkman A.S.Potential differencemeasurements of ocular surface Na
