IL8-BPI融合蛋白及其用途
文献发布时间:2023-06-19 19:28:50
发明领域
本发明涉及生物医药领域。具体地,本发明涉及一种可用于治疗革兰氏阴性菌感染的IL8-BPI融合蛋白及其编码核酸、表达制备方法,和用于制备治疗革兰氏阴性菌感染的药物组合物的用途。所述IL8-BPI融合蛋白包含人ELR+CXC趋化因子IL-8和人BPI N端结构域功能片段,兼备IL-8和BPI双重功能,具有结合LPS、直接杀伤革兰氏阴性菌和趋化细胞迁移的功能,还具有促进吞噬细胞导向结合与吞噬革兰氏阴性菌的功能,其作用机制能克服革兰氏阴性菌耐药。
发明背景
趋化因子(Chemokines)是一类对细胞(尤其是白细胞)具有趋化作用的小分子量细胞因子家族;趋化因子受体(Chemokine Receptors,CKRs)是一类介导趋化因子行使功能的G蛋白偶联受体超家族(GPCRs)。趋化因子能介导免疫细胞迁移至感染和炎症部位、激活免疫细胞参与免疫应答和炎症反应。高等动物的粒细胞、单核细胞/巨噬细胞等吞噬细胞具有吞噬杀菌功能,是机体非特异性免疫功能的重要组成部分。趋化因子和吞噬细胞在机体抗细菌感染免疫中发挥着重要作用,但不具有类似特异性IgG抗体调理作用(Oposonization)促进吞噬细菌的特异性作用机制特点。趋化因子根据其靠近N端两个半胱氨酸的排列变化分为CC、CXC、CX3C和C四个亚族,其中CXC亚族根据其第一个Cys前是否有ELR(Glu-Leu-Arg)基序结构(Motif)分为ELR+CXC趋化因子和非ELR+CXC趋化因子。1986年至二十世纪九十年代初先后发现了白细胞介素-8(Interleukin-8,以下简称IL-8或IL8,又称为CXCL8)、CXCR1和CXCR2(也称为IL-8RA和IL-8RB)及其ELR+CXC趋化因子配体(Ligands),CXCR1和CXCR2为主要在中性粒细胞、单核细胞/巨噬细胞和内皮细胞等细胞上表达的G蛋白偶联受体(GPCR),CXCR1和CXCR2的配体组成ELR+CXC趋化因子家族,其主要功能是为主趋化中性粒细胞(对单核细胞/巨噬细胞也有趋化作用)和促进血管生成。IL-8是CXC亚族已知人七种ELR+CXC趋化因子的代表成员,其主要功能是趋化和激活中性粒细胞、促进中性粒细胞的吞噬作用,对单核细胞/巨噬细胞也有一定的趋化和激活作用,其生物学功能无种属特异性。人IL-8基因编码的前体蛋白含有99个氨基酸,而不同细胞及不同蛋白酶在N端的差异切割产生多种IL-8变体,这些包括79、77、72、71、70和69个氨基酸形式;其中72个氨基酸形式是单核细胞产生的成熟IL-8的主要形式,显示比其余变体更优的生物活性。参见例如,[Hughes,et al.,FEBS J.(2018)285(16):2944][Bacon,et al.,J.Interferon Cytokine Res.(2002)22(10):1067][韩忠燕等,中国微生态学杂志(2013)25(8):975][Hébert,et al.,Interleukin-8:AReview.Cancer Invest.(1993)11(6):743][Baggiolini et al.,Adv Immunol.(1993)55:97]。
杀菌/渗透增强蛋白(Bactericidal/permeability-increasing protein,BPI)是1978年Weiss等首次在人多形核中性粒细胞中发现的一种由456个氨基酸残基组成、分子量约为55KD的阳离子抗菌蛋白,该蛋白结构由N端结构域和C端结构域通过连接体连接组成;研究证实,其N端功能片段BPI
革兰氏阴性菌是引起感染性疾病的最主要病原之一,对临床常用抗生素有很强的耐药性,是当前最受关注的耐药病原菌;2017年2月WHO首次公布对人类健康构成最大威胁的12种耐药细菌名单中有9种为革兰氏阴性菌。细菌感染患者中约半数以上为G-菌感染,其中G-菌重症感染会发展为败血症引发内毒素中毒性休克死亡,目前仍无有效治疗办法。
因此,本发明的目的在于利用ELR+CXC趋化因子IL-8和BPI的生物学功能特性,提供一种IL8-BPI融合蛋白,可用于治疗革兰氏阴性菌感染,并且其作用机制能克服革兰氏阴性菌耐药。
发明概述
本发明的目的在于提供一种包含人ELR+CXC趋化因子和BPI的融合蛋白,其中所述人ELR+CXC趋化因子优选IL-8,兼备ELR+CXC趋化因子和BPI双重功能,具有结合LPS、直接杀伤革兰氏阴性菌和趋化细胞迁移的功能,还具有促进吞噬细胞导向结合与吞噬革兰氏阴性菌的功能(具有特异性作用机制特点),其作用机制能克服革兰氏阴性菌耐药,可用于治疗革兰氏阴性菌感染和制备治疗革兰氏阴性菌感染的药物组合物。
本发明的一个方面,提供了一种可用于治疗革兰氏阴性菌感染的包含人ELR+CXC趋化因子和BPI的融合蛋白及其编码核酸,任选地,其中所述编码核酸为编码DNA。
具体地,本发明中人ELR+CXC趋化因子优选IL-8、BPI优选人BPI N端结构域功能片段,提供了一种IL8-BPI融合蛋白,包含人IL-8和人BPI N端结构域功能片段。
本发明的另一个方面,提供了所述的IL8-BPI融合蛋白的编码核酸,以及其高效表达载体、稳转表达宿主细胞及其提取制备方法,任选地,其中所述编码核酸为编码DNA。
本发明的再一个方面,提供了IL8-BPI融合蛋白用于治疗革兰氏阴性菌感染的用途,和/或用于制备治疗革兰氏阴性菌感染的药物组合物的用途。
发明详述
下面就本发明的目的和实施做进一步阐述,本领域技术人员对本发明的所涉及的范围、内容和优点是显而易见的。尽管本发明提供了优选的实施方案,本领域技术人员将认识到各种修改和变化也在本发明的范围内。因此,附加权利要求和将来的任何修正和变化均在所述范围内。
趋化因子能介导免疫细胞迁移至感染和炎症部位、激活免疫细胞参与免疫应答和炎症反应;高等动物的粒细胞、单核细胞/巨噬细胞等吞噬细胞具有吞噬杀菌功能,是机体非特异性免疫功能的重要组成部分。趋化因子和吞噬细胞在机体抗细菌感染免疫中发挥着重要作用,但不具有类似特异性IgG抗体调理作用促进吞噬细菌的特异性作用机制特点。
CXCR1和CXCR2为主要在中性粒细胞、单核细胞/巨噬细胞和内皮细胞等细胞上表达的G蛋白偶联受体(GPCR),CXCR1和CXCR2的配体组成ELR+CXC趋化因子家族,其主要功能是为主趋化中性粒细胞(对单核细胞/巨噬细胞也有趋化作用)和促进血管生成。IL-8是CXC亚族已知人七种ELR+CXC趋化因子的代表成员,其主要功能是趋化和激活中性粒细胞、促进中性粒细胞的吞噬作用,对单核细胞/巨噬细胞也有一定的趋化和激活作用,其生物学功能无种属特异性。
人BPI N端结构域功能片段具有与人天然BPI同等的高亲和力结合革兰氏阴性菌GNB的脂多糖LPS和类脂A、中和内毒素(Endotoxin)和增加易感GNB的包膜通透性而直接杀伤GNB的作用。但因单独BPI杀菌需持续较长时间维持较高浓度,难以在体内持续维持有效治疗浓度等因素,而难以取得临床成功。
为此,本发明的一个方面,提供了一种包含人ELR+CXC趋化因子和BPI的融合蛋白;具体地,人ELR+CXC趋化因子优选能通过在中性粒细胞、单核细胞/巨噬细胞和内皮细胞上表达的CXCR1和CXCR2介导而行使功能的人ELR+CXC趋化因子IL-8,BPI优选人BPI N端结构域功能片段,提供了一种IL8-BPI融合蛋白,包含人IL-8和人BPI N端结构域功能片段。人IL-8选自其79、77、72、71、70和69个氨基酸形式变体,人BPI N端结构域功能片段选自N端结构域的BPI
本发明的另一个方面,提供了所述的IL8-BPI融合蛋白的编码DNA序列,以及其高效表达载体、稳转表达宿主细胞及其提取制备方法。具体地,本发明设计优化了IL8-BPI融合蛋白的编码DNA序列,其从5’端到3’端依次包含由5’端衔接头(adapter)(含EcoR I酶切位点)序列、信号肽编码序列、IL-8编码序列、接头(Linker)编码序列、BPI
本发明证实:IL8-BPI融合蛋白兼备IL-8和BPI双重功能,具有结合LPS、直接杀伤革兰氏阴性菌和趋化细胞迁移的功能,还具有促进吞噬细胞导向结合与吞噬革兰氏阴性菌的功能(具有特异性作用机制特点),其作用机制能克服革兰氏阴性菌耐药;并且,IL8-BPI融合蛋白在外周血和腹腔吞噬细胞中具有显著的杀菌效果,对革兰氏阴性菌感染小鼠具有显著的保护效果。因此,本发明的再一个方面,IL8-BPI融合蛋白可用于治疗革兰氏阴性菌感染和制备治疗革兰氏阴性菌感染的药物组合物。
革兰氏阴性菌是引起感染性疾病的最主要病原之一,对临床常用抗生素有很强的耐药性,是当前最受关注的耐药病原菌;2017年2月WHO首次公布对人类健康构成最大威胁的12种耐药细菌名单中9种为革兰氏阴性菌。细菌感染患者中约半数以上为G-菌感染,其中G-菌重症感染会发展为败血症引发内毒素中毒性休克死亡,目前仍无有效治疗办法。本发明所述的IL8-BPI融合蛋白,用于治疗革兰氏阴性菌感染,具有巨大的临床需求和应用前景。
因此,在一个方面,本发明提供一种IL8-BPI融合蛋白,其包含人IL-8和人BPI N端结构域功能片段。
在一个实施方案中,所述融合蛋白中的所述人IL-8选自人IL-8的79、77、72、71、70和69个氨基酸形式的变体,任选地,其中人IL-8包含SEQ ID NO:1所示的序列。
在另一个实施方案中,所述融合蛋白中的所述人BPI N端结构域功能片段选自人BPI
在又一个实施方案中,所述人IL-8作为融合蛋白的N端结构域,所述人BPI N端结构域功能片段作为融合蛋白的C端结构域,二者任选地通过接头连接,并进一步任选地,所述接头为GPPSGSGGGSGGG(SEQ ID NO:2)。
在另一个方面,本发明提供一种核酸,其编码本发明的IL8-BPI融合蛋白。
在一个实施方案中,所述核酸从5’端到3’端依次包含5’端衔接头序列、信号肽编码序列、人IL-8编码序列、接头编码序列、人BPI N端结构域功能片段编码序列和3’端衔接头序列,任选地,其中人IL-8编码序列包含SEQ ID NO:6所示的序列,人BPI N端结构域功能片段编码序列包含SEQ ID NO:8所示的序列。
在又一个方面,本发明提供本发明的IL8-BPI融合蛋白用于治疗革兰氏阴性菌感染的用途,和/或用于制备治疗革兰氏阴性菌感染的药物组合物的用途。
在另一个方面,本发明提供一种表达载体,其用于表达本发明的IL8-BPI融合蛋白,任选地,所述表达载体包含编码本发明的IL8-BPI融合蛋白的核酸。
在一个实施方案中,所述表达载体为高效表达载体pSCm-IL8-BPI,其于2022年9月15日保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC,中国北京市朝阳区北辰西路1号院3号),保藏号为CGMCC NO.:25726。
在又一个方面,本发明提供一种药物组合物,其包含本发明的IL8-BPI融合蛋白以及药学上可接受的载体。
在另一个方面,本发明提供一种宿主细胞,其包含表达载体,所述表达载体稳定转染或转化包含编码本发明的IL8-BPI融合蛋白的核酸。
在又一个方面,本发明提供一种制备本发明的IL8-BPI融合蛋白的方法,包括在适合IL8-BPI融合蛋白表达的条件下培养本发明的宿主细胞,收获表达的IL8-BPI融合蛋白,以及任选地进一步纯化表达的IL8-BPI融合蛋白。
在另一个方面,本发明提供一种治疗革兰氏阴性菌感染的方法,包括:将治疗有效量的本发明的IL8-BPI融合蛋白或药物组合物施用于患有革兰氏阴性菌感染的受试者。
在一个实施方案中,本发明的治疗革兰氏阴性菌感染的方法进一步包括在施用治疗有效量的本发明的IL8-BPI融合蛋白或药物组合物之前、同时或之后将抗生素类化合物施用于患有革兰氏阴性菌感染的受试者。
附图简要说明
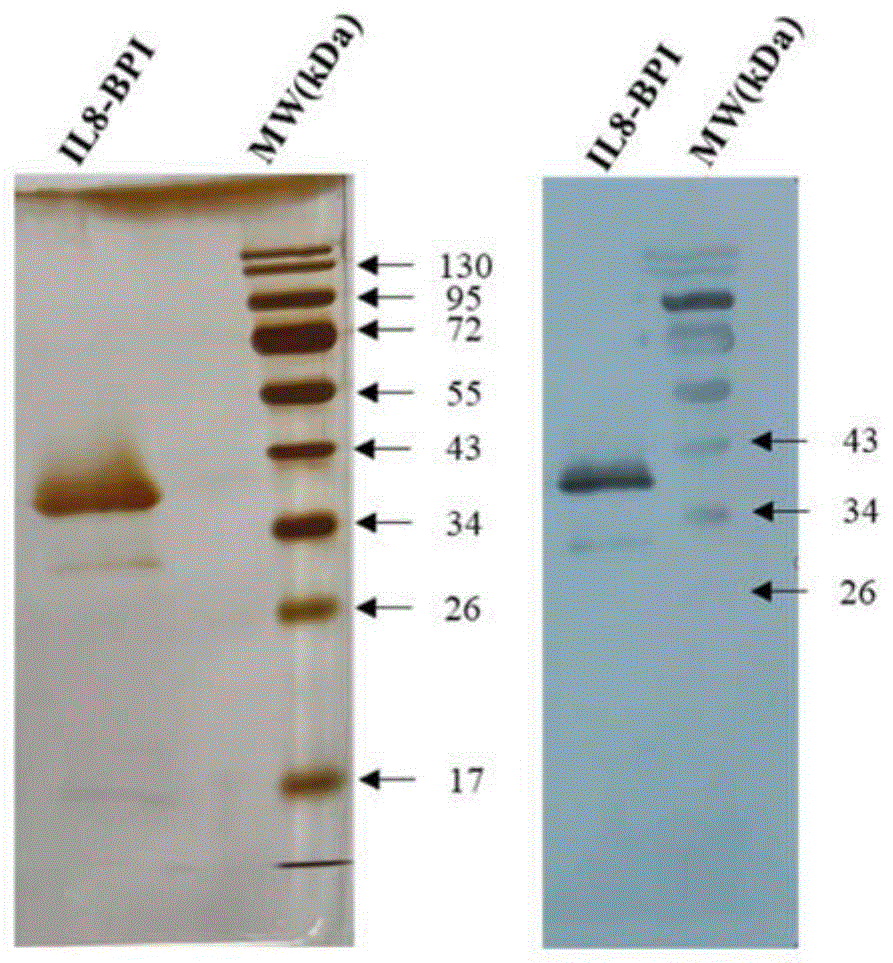
图1.IL8-BPI融合蛋白的提取制备。其中:A、SP
图2.IL8-BPI融合蛋白结合内毒素。
图3.IL8-BPI融合蛋白直接杀伤革兰氏阴性菌。
图4.IL8-BPI融合蛋白趋化细胞迁移。其中:A/B、人HL-60细胞;C、小鼠骨髓中性粒细胞;D、小鼠腹腔细胞。
图5.IL8-BPI融合蛋白促进吞噬细胞导向结合与吞噬革兰氏阴性菌。其中:A、人HL-60细胞;B、人外周血白细胞;C、小鼠外周血白细胞;D、小鼠腹腔吞噬细胞。
图6.IL8-BPI融合蛋白在人/小鼠外周血中的杀菌作用。
图7.IL8-BPI融合蛋白在小鼠外周血中的杀菌作用。
图8.IL8-BPI融合蛋白在小鼠腹腔吞噬细胞中的杀菌作用。
图9.IL8-BPI融合蛋白对革兰氏阴性菌感染小鼠的保护效果。A、小鼠感染模型(剂量);B、血清;C、肝脏;D、脾脏。
生物保藏信息
本发明涉及2022年9月15日保藏在中国微生物菌种保藏管理委员会普通微生物中心、保藏号为CGMCC NO.:25726、名称为pSCm-IL8-BPI(in E.coli JM108)的大肠埃希氏菌(Escherichia coli),保藏单位地址为:北京市朝阳区北辰西路1号院3号。
下面结合实施例和附图进一步说明本发明的技术方案,但不限于本实施例。更具体地说,实施例一涉及IL8-BPI融合蛋白及其编码DNA序列以及表达制备;实施例二涉及IL8-BPI融合蛋白的生物学功能,具有结合LPS、直接杀伤革兰氏阴性菌和趋化细胞迁移的功能,还具有促进吞噬细胞导向结合与吞噬革兰氏阴性菌的功能;实施例三涉及IL8-BPI融合蛋白在外周血和腹腔吞噬细胞中的杀菌效果;实施例四涉及IL8-BPI融合蛋白对革兰氏阴性菌感染小鼠的保护效果。本实施例所涉及的范围、内容和优点是显而易见的,各种修改和变化也在本说明的范围内;其中,包括但不限于IL8-BPI融合蛋白及其编码DNA序列以及各组成元件之其它等同物、亚型、变体及其类似物(equivalents,isoforms,variants andanalogues)。
实施例一:IL8-BPI融合蛋白及其编码DNA序列以及表达制备
1.IL8-BPI融合蛋白及其编码DNA序列
本发明设计构建了IL8-BPI融合蛋白,从N端到C端依次包含由IL-8、接头(Linker)、BPI
表1、IL8-BPI融合蛋白组成
表2、IL8-BPI融合蛋白的编码DNA序列组成
其中,IL8-BPI融合蛋白的序列如下所示:
SAKELRCQCIKTYSKPFHPKFIKELRVIESGPHCANTEIIVKLSDGRELCLDPKENWVQRVVEKFLKRAEGPPSGSGGGSGGGVNPGVVVRISQKGLDYASQQGTAALQKELKRIKIPDYSDSFKIKHLGKGHYSFYSMDIREFQLPSSQISMVPNVGLKFSISNANIKISGKWKAQKRFLKMSGNFDLSIEGMSISADLKLGSNPTSGKPTITASSCSSHINSVHVHISKSKVGWLIQLFHKKIESALRNKMNSQVCEKVTNSVSSELQPYFQTLPVMTKIDSVAGINYGLVAPPATTAETLDVQMKGEFYSENH(SEQ ID NO:10)。
2.IL8-BPI融合蛋白高效表达载体
由基因合成商业服务(南京金斯瑞)全基因合成设计优化的IL8-BPI融合蛋白的编码DNA序列,并按常规分子克隆实验技术构建于pSCm-GS真核表达载体(本发明人构建并保存)的EcoR I/Sal I双酶切位点上(转化于E.coli JM108),经鉴定正确构建得到IL8-BPI高效表达载体pSCm-IL8-BPI。
所述的高效表达载体pSCm-IL8-BPI(转化于E.coli JM108)已于2022年9月15日保藏在中国微生物菌种保藏管理委员会普通微生物中心(CGMCC,中国北京市朝阳区北辰西路1号院3号),保藏号为CGMCC NO.:25726。
3.IL8-BPI融合蛋白稳转高效表达以及提取制备
用CHO
将上述获得的IL8-BPI融合蛋白高效表达细胞按3×10
提纯IL8-BPI融合蛋白SDS-PAGE电泳和蛋白质印迹结果显示:如图1B所示,IL8-BPI融合蛋白条带清晰(纯度高),并且位置与预期分子量相符。
实施例二:IL8-BPI融合蛋白的生物学功能
1.结合内毒素
取120μL不同浓度IL8-BPI融合蛋白(无内毒素PBS稀释,设空白对照)与120μL内毒素(2EU/mL,内毒素检查用水稀释),加入除内毒素玻璃管中,涡旋混匀30s,37℃水浴1h;再涡旋30s后,取100μL/孔混合物于无内毒素的96孔板中,按照微板定量显色基质法说明书方法操作(厦门鲎试剂生物科技股份有限公司,EC64405)。
结果显示:如图2所示,IL8-BPI融合蛋白能中和(结合)LPS,并呈剂量正相关。
2.直接杀伤革兰氏阴性菌
取50μLE.coli BL21(DE3)/pBR322(amp
结果显示:如图3所示,IL8-BPI融合蛋白能直接杀伤革兰氏阴性菌,并呈剂量正相关。
3.趋化细胞迁移
3.1趋化人HL-60细胞
Transwell(Corning,3422)下室中添加600μL/孔不同浓度IL8-BPI融合蛋白(IMDM稀释),上室添加1.0×10
结果显示:如图4A所示,IL8-BPI融合蛋白具有显著趋化未经DMSO诱导分化的人HL-60细胞(早幼粒细胞)迁移功能,并呈剂量正相关;进一步地,如图4B所示,IL8-BPI融合蛋白具有显著趋化经DMSO诱导分化的人HL-60细胞(类中性粒细胞)迁移功能。
3.2趋化小鼠骨髓中性粒细胞
小鼠脱椎处死,75%乙醇浸泡5~10min;分离胫股骨,置于5mL PBS中洗涤并进一步剔除肌肉组织;剪掉胫股骨两端,暴露骨髓腔;于8mL PBS中冲洗骨髓腔,充分打散后,70μm尼龙网筛过滤;3000rpm离心4min收集细胞,以3mL IMDM重悬细胞,并采用Percoll梯度密度离心分离制备中性粒细胞,1.3mL IMDM重悬细胞备用;后同HL-60细胞趋化的实验方法进行,区别在于37℃、8%CO
结果显示:如图4C所示,IL8-BPI融合蛋白具有显著趋化小鼠骨髓中性粒细胞功能,并呈剂量正相关。
3.3趋化小鼠腹腔细胞
小鼠脱椎处死,75%乙醇浸泡5min;剪开腹部表面皮毛,保持腹膜完整;取4~5mLIMDM/只注射入小鼠腹腔,轻轻按摩5min,抽取腹液至50mL离心管中,重复该操作1次;300g离心5min,弃上清,以1.3mL IMDM重悬小鼠腹腔细胞(含大量吞噬细胞)备用;后同HL-60细胞趋化的实验方法进行,区别在于37℃、8%CO
结果显示:如图4D所示,IL8-BPI融合蛋白具有显著趋化小鼠腹腔细胞功能,并呈剂量正相关。
4.促进吞噬细胞导向结合与吞噬革兰氏阴性菌
4.1人HL-60细胞
HL-60细胞(经1.25%DMSO诱导分化为类中性粒细胞)DiI(Beyotime,C1036)膜染20min,HBSS洗涤2次,用IMDM重悬至5×10
结果显示:如图5A所示,IL8-BPI融合蛋白显著促进人HL-60细胞(类中性粒细胞)导向结合与吞噬革兰氏阴性菌,并呈剂量正相关。
4.2人外周血白细胞
取人外周血,0.4%柠檬酸钠抗凝,用红细胞裂解液(Solarbio,R1010)裂解红细胞,DiI膜染45min后按实验分组设计均分(约1×10
结果显示:如图5B所示,IL8-BPI融合蛋白显著促进人外周血吞噬细胞(中性粒细胞为主,单核细胞次之)导向结合与吞噬革兰氏阴性菌,并呈剂量正相关。
4.3小鼠外周血白细胞
小鼠眼眶取血,参照4.2人外周血白细胞的实验方法并用25μg/mL IL8-BPI融合蛋白进行实验。
结果显示:如图5C所示,IL8-BPI融合蛋白显著促进小鼠外周血吞噬细胞(中性粒细胞为主,单核细胞次之)导向结合与吞噬革兰氏阴性菌。
4.4小鼠腹腔吞噬细胞
参照3.3的实验方法制备小鼠腹腔细胞,适量DMEM-H重悬后按100μL/孔接种于24孔板爬片上,37℃、8%CO
结果显示:如图5D所示,IL8-BPI融合蛋白显著促进小鼠腹腔吞噬细胞(含巨噬细胞和中性粒细胞)导向结合与吞噬革兰氏阴性菌,并呈剂量正相关。
实施例三:IL8-BPI融合蛋白在外周血和腹腔吞噬细胞中的杀菌效果
鉴于(健康志愿者)人外周血对E.coli BL21(DE3)产生强抵抗(如血清型反应和吞噬清除),本实施例中人外周血杀菌实验选用鲍曼不动杆菌,而小鼠外周血和小鼠腹腔吞噬细胞杀菌实验可以选用鲍曼不动杆菌和E.coli BL21(DE3)。
1.人/小鼠外周血杀菌实验
取100μL鲍曼不动杆菌(ATCC BAA-1605,多重耐药)菌悬液(2×10
结果显示:如图6A/6B所示,在相对低浓度范围内,IL8-BPI融合蛋白在人/小鼠外周血中的杀菌效果均显著高于热处理人/小鼠外周血对照组,并且该差异与浓度呈负相关(即浓度越低该差异越显著),提示其促进外周血吞噬细胞导向结合与吞噬革兰氏阴性菌的作用。
2.小鼠外周血杀菌实验
参照上述1的实验方法进行,取100μL E.coli BL21(DE3)/pBR322菌悬液(1×10
结果显示:如图7所示,IL8-BPI融合蛋白在小鼠外周血中具有显著的杀菌效果,并呈剂量正相关。
3.小鼠腹腔吞噬细胞杀菌实验
参照实施例二3.3的实验方法制备小鼠腹腔细胞,取适量IMDM重悬,100μL/孔铺到96孔板中,37℃、8%CO
结果显示:如图8A和8B所示,在相对低浓度范围内,IL8-BPI融合蛋白在小鼠腹腔吞噬细胞(Mouse Peritoneal Phagocytes,简称为MPPs)中的杀菌效果均显著高于无细胞对照组和CHO-DG44细胞对照组,并且该差异与浓度呈负相关(即浓度越低该差异越显著),显示其促进腹腔吞噬细胞导向结合与吞噬革兰氏阴性菌的作用。
实施例四:IL8-BPI融合蛋白对革兰氏阴性菌感染小鼠的保护效果
1.革兰氏阴性菌感染小鼠模型
小鼠感染模型(剂量):用PBS将E.coli BL21(DE3)/pBR322稀释成不同浓度菌悬液,对随机分组(每组5只)的6~8周龄小鼠分别腹腔注射菌悬液(0.25mL/只)。于3、6、9、12和24h每组各取一只小鼠,进行眼球采血,静置40min,1000rpm离心10min,取血清以生理盐水稀释10倍,各取50μL进行倾注法计数(重复2皿,下同)。统计观察不同腹腔注射菌量条件下的血清菌量的动态变化,同时观察记录毛色、活动、腹泻等状态的动态变化,将小鼠出现适合观察的血清菌量、并同时呈现明显感染症状的注射菌量确定为后续体内实验剂量。
结果显示(如图9A),1×10
2.IL8-BPI融合蛋白对革兰氏阴性菌感染小鼠的保护效果
对随机分组的6~8周龄小鼠(BALB/c)腹腔注射1×10
结果显示:如图9B、C、D和表3所示,IL8-BPI融合蛋白对体内感染小鼠的保护效果显著,实验组小鼠血清和脏器(肝脏和脾脏)中菌量显著低于对照组,同时实验组小鼠状态(显著较好、基本无明显腹泻现象)显著好于对照组(于4~8小时活动严重减少、炸毛且多数伴随腹泻,这些症状多数于10小时后才得以缓解)。
表3、IL8-BPI对E.coli BL21(DE3)/pBR322感染小鼠的保护效果
/>
- 免疫调节性IL2R融合蛋白及其用途
- 融合蛋白E-钙粘素-Fc、VE-钙粘素-Fc和VEGF-Fc的用途
- 鞘氨醇激酶1及其融合蛋白及其用途
- OprJ-N-M融合基因及其融合蛋白、融合蛋白制备方法以及用途
- OprJ-N-M融合基因及其融合蛋白、融合蛋白制备方法以及用途
