一种长效的嵌合抗原受体、载体及其构建方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及基因工程和免疫治疗技术领域,具体来说,涉及一种长效的CAR、载体及其构建方法和应用。
背景技术
随着肿瘤免疫学理论和技术的发展,免疫细胞治疗在肿瘤治疗中的作用日益受到重视。研究发现,T淋巴细胞是肿瘤细胞的天敌,在肿瘤免疫应答中起主要作用,对肿瘤细胞有极强的杀伤作用。
CAR-NK细胞和CAR-T细胞免疫疗法作为一种免疫治疗策略,在肿瘤治疗中受到广泛的重视和应用。它是基于免疫系统识别与活化理论,通过基因工程技术,将特异识别肿瘤抗原(单链抗体scFv)、启动免疫活性的元件整合成一个基因,并在体外通过病毒等方法将其转导入患者自身NK细胞或T淋巴细胞中并扩增,之后输回患者体内,使患者重新获得特异性识别肿瘤细胞,有针对性地攻击并杀伤所识别的肿瘤细胞的能力。这种肿瘤治疗技术,在临床上已经显示其强大的对B淋巴性白血病的肿瘤治疗效果,能达到80%治愈B淋巴性白血病的效果。
CAR-NK细胞或CAR-T细胞的持续扩增离不开细胞因子的作用,如IL-2、IL-12、IL-15、IL-18等,这些细胞因子的作用是通过结合到NK细胞或T细胞表面的细胞因子受体而激活细胞内下游转导信号。例如IL-15先与IL-15膜受体的α亚基结合,再与效应NK细胞或T细胞上的IL2R-γc/IL-15Rβ形成免疫突触,激活细胞内的JAK1/JAK3和STAT3/STAT5途径等,进而促进NK细胞或T细胞的分化和增殖。目前已有研究者将CAR设计成在激活扩增NK细胞和T细胞的同时分泌细胞因子,可以有效地阻止CAR-NK/CAR-T在体内的耗竭。但是,这种分泌型细胞因子不会仅对自身的CAR细胞起作用,也会游离到体液中,引起体内其它免疫细胞的剧烈反应,带来不可预知的副作用,甚至导致死亡。
发明内容
发明目的:针对现有CAR-NK细胞和CAR-T细胞技术的问题,本发明所要解决的技术问题是提供了一种CAR-NK和CAR-T治疗载体及其构建方法和应用,增强CAR-NK和CAR-T在体内的持久疗效。
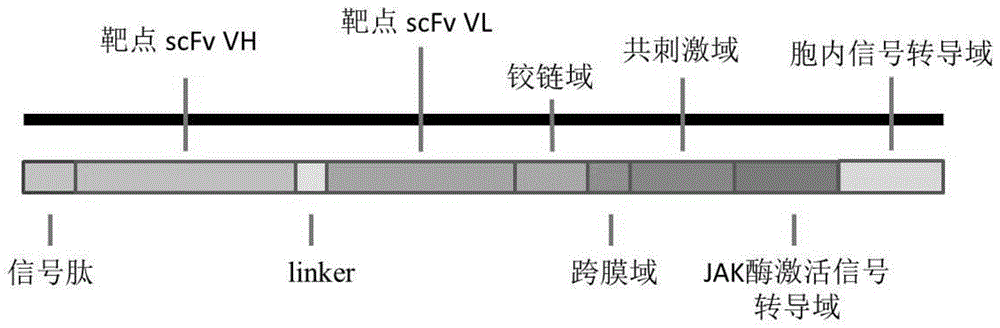
为实现上述技术目的,本发明的技术方案是这样实现的:本发明提供了一种长效的嵌合抗原受体,所述长效的嵌合抗原受体包括信号肽、靶点的scFv、铰链结构域、跨膜结构域、胞内共刺激结构域、JAK酶激活信号结构域和胞内信号转导域,所述JAK酶激活信号转导域能够捕获JAK酶并激活,所述JAK酶包括JAK1、JAK2、JAK3或Tyk2,所述JAK1的Gene ID为3716,JAK2的Gene ID为3717,JAK3的Gene ID为3718,Tyk2的Gene ID为7297。
其中,所述JAK酶激活信号结构域通过招募JAK激酶并在其催化下发生酪氨酸残基的磷酸化,后续激活STAT信号,进而引发胞内的基因转录和表达,因此,起到与细胞因子异曲同工的作用,一旦能够捕获JAK1、JAK2、JAK3或Tyk2中的任何酶的序列均属于本发明的保护范围之内。
其中,作为优选,所述JAK酶为JAK1酶,所述JAK1酶激活信号转导结构域,其90-99%同一性的氨基酸序列选自以下一个或者其中两个以上叠加:SEQ ID No.1(JAKAcS1)、SEQ ID No.2(JAKAcS2)、SEQ ID No.3(JAKAcS3)、SEQ ID No.4(JAKAcS4)、SEQ ID No.5(JAKAcS5)、SEQ ID No.6(JAKAcS6)、SEQ ID No.7(JAKAcS7)、SEQ ID No.8(JAKAcS8)、SEQID No.9(JAKAcS9)、SEQ ID No.10(JAKAcS10),以上序列均包括JAK1激酶的结合位点和激活信号;以上序列能够捕获JAK1激酶并能够催化其发生氨酸残基的磷酸化激活STAT信号,引发胞内基因转录和表达。
其中,作为优选,所述JAK1酶激活信号转导结构域的核苷酸序列如下:SEQ IDNo.11(JAKAcS1)、SEQ ID No.12(JAKAcS2)、SEQ ID No.13(JAKAcS3)、SEQ ID No.14(JAKAcS4)、SEQ ID No.15(JAKAcS5)、SEQ ID No.16(JAKAcS6)、SEQ ID No.17(JAKAcS7)、SEQ ID No.18(JAKAcS8)、SEQ ID No.19(JAKAcS9)、SEQ ID No.20(JAKAcS10)。
其中,作为优选,所述JAK酶为JAK3酶,同样能够激活JAK3酶的结构域也在本发明的保护范围之内。
其中,信号肽可引导抗原识别区及铰链区转移到胞外,任意合适的信号肽或信号肽的组合均可实现本发明的目的。所述第一信号肽和第二信号肽包括T细胞受体的α链及β链、CD3、CD4、CD5、CD8、CD28、CD33、CD45、CD80、CD86、CD134、CD137、ICOS、GM-CSF、免疫球蛋白重链或免疫球蛋白轻链的信号肽。作为优选,信号肽选取CD8α中如SEQ ID No.21所示的信号肽。
其中,所述靶点的scFv为胞外区包含肿瘤细胞表面高表达的靶点的单链抗体核苷酸序列,所述靶点包含B7H3、NKG2D、GPC3、Claudin18.2、PD-L1、MUC1、Mesothelin、Her2、EGFR、PSMA、CEA、GD2、EpCAM、EGFRvIII、CD70、CD20、CD133、CD177、AFP、AXL、CD171、CD117、C-MET、FAP、MUC16、NY-ESO-1、PSCA、VEGFR-2、Lewis-Y、Gp100、FAP、EPHA2中任意一个或几个组合,作为优选,所述靶点为B7H3,其核苷酸序列如SEQ ID No.22所示。
其中,本发明所述靶点结合结构域通过铰链区与其编码的所述跨膜区连接,任意合适的铰链区序列均可实现本发明的目的。所述铰链结构域包括以下分子的铰链区:IgG、CD8α、CD28、IL-2受体,例如所述铰链结构域为CD8α,其核苷酸序列如SEQ ID No.23所示。
其中,所述跨膜结构域为选自以下蛋白质的跨膜结构域或与所述蛋白质具有90-99%同一性的氨基酸序列:T细胞受体的α、β或ζ链、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD8O、CD86、CD134、CD137或CD154,作为优选,所述跨膜结构域为CD8的跨膜区,其核苷酸序列如SEQ ID No.24所示。
其中,所述胞内共刺激结构域通过选自以下蛋白质或与所述蛋白质具有90-99%,同一性的氨基酸序列获得的功能性信号结构域的一种或几种:MHC I类分子、TNF受体蛋白、免疫球蛋白样蛋白质、细胞因子受体、整联蛋白、淋巴细胞活化信号分子、活化NK细胞受体、BTLA、Toll配体受体、OX40、CD2、CD7、CD27、CD28、CD30、CD40、CD137、CDS、ICAM-1、LFA-1、CLAUDIN、CD278或GITR中的一种或几种,作为优选,所述胞内共刺激结构域选自CD137,其核苷酸序列如SEQ ID No.25所示。
其中,所述胞内信号转导域包括以下分子的胞内信号转导结构域:CD3ζ、CD3γ、CD3δ、CD3ε、CD5、CD22、CD40L、CD45、CD66d、CD79、CD80、CD86、CD278、DAP10、DAP12、FcγR或Zap70,优选地,所述胞内信号转导域为CD3ζ信号转导结构域或与其具有90-99%同一性的氨基酸序列信号转导域,包含的核苷酸序列如SEQ ID No.26所示。
另外,在上述抗原识别区、铰链区、跨膜区以及胞内信号区之间合适的位置可插入任意肽链作为间隔区,所述肽链可以为寡肽或多肽。
在本发明的一个实施方式中,发明人采用化学合成方法获得靶点的结合结构域。
本发明内容还包括一种核酸分子,所述核酸分子编码所述的嵌合抗原受体。
对于上述核酸分子的制备方法,可基于上述两个靶点识别区、铰链区、跨膜区以及胞内信号区等结构域的碱基序列,通过化学合成或PCR扩增等已知技术制备。通常,可以对编码上述结构域的氨基酸的密码子进行优化,以优化其在宿主细胞中的表达。
本发明内容还包括一种载体或包含其的重组病毒,所述载体包含所述的核酸分子。
在本发明中,上述载体可以为直链载体,也可以为环状载体。可以为质粒等非病毒载体,也可以为病毒载体,还可以为利用转座子的载体。所述载体中可含有启动子、终止子等调控序列,以及耐药基因、报告基因等标记序列。作为上述病毒载体,可以为逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体等。在本发明的一个实施方式中,使用的是慢病毒表达载体。
本发明还包括所述载体或其重组病毒的构建方法,所述方法是将所述的嵌合抗原受体的基因合成后导入质粒载体中,通过含有同源臂的PCR引物,扩增嵌合抗原受体编码序列,并通过同源重组的方法将嵌合抗原受体编码序列插入病毒载体即得,所述病毒载体选自DNA、RNA、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、其他基因转移系统的一种或多种组合,一种优选慢病毒载体为Plvx-EF1α-MCS-(PGK-puro)。
一种重组细胞,所述重组细胞表达所述的嵌合抗原受体,所述的核酸分子或所述的载体或包含其的重组病毒,所述重组细胞包括经修饰的NK细胞。所述NK细胞可以来自外周血、骨髓等,也可以来自脾脏、胸腺、淋巴等组织,经分离、纯化后得到。
一种应用,所述应用包括以下任一项:所述的嵌合抗原受体、所述的核酸分子,所述的重组载体或重组病毒、所述的重组细胞在制备治疗实体瘤的药物中的应用。
其中,所述实体瘤包括肝癌、肺癌、骨癌、脑癌、胃癌、食道癌、结直肠癌、黑色素瘤、肝内胆管癌、卵巢癌、肾癌、胶质瘤、头颈部细胞癌、胰腺癌、乳腺癌、恶性间皮瘤、甲状腺癌、宫颈癌、神经膀胱癌、前列腺癌。
一种药物组合物,所述药物组合物包括所述的嵌合抗原受体、所述的核酸分子,所述的重组载体或重组病毒,以及药学上接受的载体。
其中,本发明药物组合物除包含上述成分以外,还可包含任意药学上允许的添加剂,例如,生理盐水、细胞培养基、葡萄糖、注射用水、甘油、乙醇、稳定剂、表面活性剂、防腐剂、等渗剂中的一种或几种。
同样,本发明药物组合物也可以和其他合适的抗癌剂联合应用,例如,长春新碱、柔红霉素、门冬酞胺酶、环磷酞胺或泼尼松中的一种或几种。
本发明的另一个方面,是提供了一种上述药物组合物在制备抗靶点蛋白的阳性表达的实体肿瘤药物中的应用。
作为本发明的一个具体实施例,本发明通过化学合成法合成靶点的scFv编码序列,并通过融合PCR和同源重组的方法将信号肽-靶点scFv-CD8α铰链区-CD8跨膜区-CD137-JAK酶激活信号转导结构域-CD3ζ的编码基因克隆至慢病毒载体。利用慢病毒感染NK细胞,使NK细胞表达该嵌合抗原受体。通过流式细胞术、脱颗粒分析实验、以及ELISA检测NK细胞分泌的细胞因子,证明该嵌合抗原受体修饰的NK细胞对肿瘤细胞有持久的杀伤肿瘤作用。
有益效果:与现有技术相比,本发明CAR设计的优势是直接通过CAR的结构设计使CAR的胞内区富集CAR-NK细胞内或CAR-T细胞内的JAK酶激活信号转导结构域的结合元件,当CAR-NK或CAR-T胞外区scFv结合到肿瘤细胞上的抗原后激活CAR-NK或CAR-T细胞内的细胞因子胞内信号转导途径等,促进NK或T细胞的分化和增殖,从而阻止CAR-NK或CAR-T细胞的耗竭。比已有类似设计的好处在于:首先,CAR在发挥了细胞因子作用的前提下并没有细胞因子的分泌,不会引起其它免疫细胞的过度激活,避免副作用。其次,只有CAR-NK或CAR-T细胞的scFv与肿瘤细胞的抗原结合才能激起CAR-NK或CAR-T细胞的扩增,使CAR-NK或CAR-T细胞扩增只集中在肿瘤细胞附近,不仅加强了杀伤肿瘤细胞的作用,而且一旦肿瘤细胞被清除完,CAR-NK或CAR-T细胞即停止扩增,提高了体内安全性。
附图说明
图1CAR的结构设计。
图2CAR-NK细胞生长第七天的CAR阳性表达量。
图3CAR-NK细胞的生长扩增曲线。
图4CAR-NK细胞与靶细胞共培养24h后TNFα释放的ELISA检测结果。
图5本发明设计的pCAR-NK细胞、常规的无JAK酶激活信号结构域的CAR-NK细胞(即靶点B7H3 scFv-CD28-CD137-CD3ζ)、未做修饰的NK细胞对相同剂量(10
图6为pCAR-T细胞用流式检测pCAR-T细胞生长第七天的CAR阳性表达量。
图7为B7H3 CAR-T细胞与靶细胞共培养24h后IL-2和IFN-γ释放的ELISA检测结果。
图8本发明设计的pCAR-T细胞、常规的JAK酶激活信号转导结构域的CAR-T细胞(即靶点为B7H3的CAR结构scFv-CD28-CD137-CD3ζ)、未做修饰的T细胞对相同剂量(10
具体实施方式
本发明公开了一种CAR的构建及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明,并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内容进行改动或适当变更与组合,来实现和应用本发明技术。
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。
为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实施例对本发明作进一步的详细说明。
实施例1:靶点选择B7H3,B7H3 CAR(信号肽-anti-B7H3 scFv-CD8αhinge-CD8 TM-CD137-JAKAcS1-CD3ζ)载体的构建。
委托金斯瑞合成编码上述CAR的核酸序列,序列为SEQ ID No.27。
通过BamHI-MluI双酶切Plvx-EF1α-IRES-ZsGreen1,B7H3 CAR实现载体和片段线性化。酶切体系如下:
通过T4 DNA酶将含有粘性末端的嵌合抗原受体编码片段和线性化的Plvx-EF1α-IRES-ZsGreen1载体进行连接和转化。
连接Plvx-EF1α-IRES-ZsGreen1,B7H3 CAR体系如下:
连接重组产物的转化步骤如下:
1)将50μL感受态细胞XL1-Blue在冰上解冻5-10min。
2)取2μL重组产物加入到50μL的感受态细胞中,轻弹管壁混匀,冰上静置30min。
3)42℃准确热应激45s,立即置于冰上2min。
4)加入500μL的无抗生素的LB培养基,室温摇菌1h(270rpm)。
5)将氨苄抗性的LB固体培养基事先在37℃的温箱中预热30min。
6)5000rpm离心3min,倒掉上清,用剩余约30μL的LB培养基重悬菌体,用无菌涂布棒在含有卡那抗性的平板上轻轻涂匀。
7)37℃培养箱中倒置培养12-16h。
实施例2:CAR的慢病毒包装
采用EndoFree Plasmid Mid质粒抽提试剂盒(omega公司)对实施例1得到重组菌挑取单菌落培养得到的菌液进行抽提获得CAR表达质粒、和包装质粒pSPAX、pMD2.G以用4∶3∶1比例用磷酸钙法转染HEK293T细胞。转染后12小时更换新鲜培养液,之后24小时、48小时分别收取病毒上清,于4℃,3,000rpm,离心15分钟,经0.45μm滤器过滤后,采用100,000g,4℃,1.5h超速离心后浓缩病毒液。
实施例3:慢病毒感染NK细胞及感染后NK细胞的培养
取来自于东南大学中大医院血液科健康捐献者的新鲜人外周血100ml,采用Dynabeads
流式细胞术检测CAR修饰NK细胞的阳性率:收集细胞,标记兔抗鼠IgG-F(ab’)2抗体,流式细胞术分析NK细胞F(ab’)2和GFP的表达。结果如图2所示,由图中可以看出,pCAR-NK的阳性率为15.7%。pCAR-NK细胞的生长扩增曲线如图3所示。
实施例4:长效pCAR-NK细胞对肿瘤细胞的杀伤作用
SKOV3细胞系购自美国ATCC,其表面高表达B7H3。将SKOV3细胞按照10^5个每孔接种于48孔板中,分别按照效靶比1∶1、5∶1、10∶1接种CAR-NK细胞或NK细胞,进行共培养。分别于12h、24h、48h通过荧光显微镜观察靶细胞形态,并通过流式检测共培养系统中不同细胞的数量比例。结果显示CAR-NK与SKOV3共培养12h后,即可见SKOV3的表面积显著减小,贴壁现象减弱,表明细胞生长状态变差。24h后,流式检测共培养细胞群内的不同亚群的细胞比例,发现靶细胞SKOV3占总细胞随时间推移逐渐减少,以效靶比1∶1共培养系统为例,0h、12h、24h、48h、72h后靶细胞占总细胞数比例分别为:45%、56%、38%、20%、5%;而NK细胞与SKOV3共培养组,0h、12h、24h、48h、72h后SKOV3占总细胞数比例分别为:51%、54%、52%、41%、36%,与NK细胞相比,pCAR-NK细胞对B7H3阳性的肿瘤细胞具有显著的杀伤作用。
12h后取培养液上清,对共培养上清进行检测(具体操作步骤按照ELISA检测试剂盒说明书进行)。结果如图4所示,结果表明,SKOV3与pCAR-NK共培养上清中TNFα水平均较SKOV3与NK细胞共培养组有显著性升高(P<0.001)。
将本发明的pCAR-NK细胞与常规的未加JAK酶激活信号转导结构域的CAR-NK细胞(即靶点B7H3 scFv-CD28-CD137-CD3ζ,序列如SEQ ID No.28所示)分别对相同剂量(10
实施例5:T细胞的制备
取来自于东南大学中大医院血液科健康捐献者的新鲜人外周血20ml,采用Ficoll-Paque PLUS(GE HealthCare公司)分离PBMC(具体步骤按照说明书)。按细胞:磁珠1∶1比例加入抗CD3/CD28磁珠(GibCo公司),培养24小时即为转染前的T细胞。
实施例6慢病毒感染T细胞及感染后T细胞的培养
从-80℃中取出病毒上清,室温下融化,病毒滴度为7.6*10
流式细胞术检测CAR-T细胞的阳性率:收集细胞,标记兔抗鼠IgG-F(ab’)2抗体,流式细胞术分析T细胞F(ab’)2和GFP的表达。结果如图6所示,由图中可以看出,CAR-T细胞的阳性率为40.8%。
实施例7CAR-T细胞对肿瘤细胞的杀伤作用
SKOV3细胞系购自美国ATCC,其表面高表达B7H3。将SKOV3细胞按照每孔10
将本发明CAR-T细胞与未加JAK酶激活信号转导结构域的CAR-T细胞(即靶点B7H3scFv-CD28-CD137-CD3ζ)对相同剂量(10
实施例8
将实施例1中的序列SEQ ID No.27中的JAKAcS1分别替换JAKAcS2、JAKAcS3、JAKAcS4、JAKAcS5、JAKAcS6、JAKAcS7、JAKAcS8、JAKAcS9、JAKAcS10得到对应的核苷酸序列,然后将其合成并按照以上具体的步骤操作获得对应的重组菌株。按照实施例2-7的具体的实验方法,重复以上的实验过程,得到对应的pCAR-NK细胞和对应的CART细胞。对以上的pCAR-NK细胞和对应的CART细胞的阳性率进行检测,其阳性率达到30-50%,且同时具有持久的杀伤靶细胞能力。
- 一种新型可调控的双嵌合抗原受体T细胞及其构建方法和应用
- 一种HLA-G嵌合抗原受体、编码序列和表达载体以及应用
- 一种嵌合抗原受体、以及快速构建嵌合抗原受体的方法及应用
- 一种增强向肿瘤部位迁移的嵌合抗原受体载体构建方法与应用
