一种微囊藻的固定化保存方法及恢复培养方法
文献发布时间:2024-04-18 19:52:40
技术领域
本申请涉及微藻生物技术领域,更具体地说,它涉及一种微囊藻的固定化保存方法及恢复培养方法。
背景技术
在微藻的培养和应用中,保种技术是微藻培养和进一步应用的基础和关键环节。由于藻种极易受污染,分离培养方法比较复杂而且耗时较长,因此在微藻保种工作中要尽量减少接种次数,避免藻种被杂藻、细菌或原生动物污染。既能达到长期贮藏种质的目的,又能维持藻种的活性,是微藻科研工作者努力的方向之一。
目前微藻保存技术主要包括:继代保存法、超低温保存法以及固定化保存法等。继代保存法简单易行、设备简单,可适用于所有藻种的保存,但是保存时间短,通常只有2-3周的保存时间,并且需要频繁继代,耗时耗力且增加了污染藻种的概率。超低温保存法可长期保存藻种,最大限度地减少染菌的可能性,但是该方法需要引入防冻剂等化学助剂,并且需要用到冷冻机等设备,使其因保存成本等原因而受到限制。固定化保存法是将游离细胞包埋在多糖或多聚化合物形成的网状结构中,在无菌环境下培养,因固定载体的存在,藻种的代谢过程受到束缚,从而减缓了细胞生长分裂的速度,导致微藻生长速度缓慢。
固定化保存法可以在常温或者中低温下实现对藻种的中期保存,且对仪器设备的要求比较低,能在一般的微藻实验室进行。但是许多相关资料显示,并非所有的微藻都适合固定化保存,并且某种固定化方法只适用一定种类的微藻,对同一种固定化方法,不同种类的微藻会有不同的反应,每种微藻对固定化后的生产速率都不同;例如马志珍和张继红对12种海洋微藻固定化保种培养试验的结果表明,微型小球藻、朱氏四片藻等藻种的存活时间超过1年;蓝藻门的聚球藻红色品系生长缓慢,存活时间低于3个月;而红胞藻固定化不能生长。因此,对于不同种类的微藻的保存方法,需要进行更为深入、广泛的研究。
发明内容
为了解决上述技术问题,本申请提供一种微囊藻的固定化保存方法及恢复培养方法。
第一方面,本申请提供一种微囊藻的固定化保存方法,采用如下的技术方案:
一种微囊藻的固定化保存方法,包括如下步骤:
固定化凝胶的制备:将水溶性高分子固定剂溶于水中,加入氯化钠后,搅拌均匀,得到固定化凝胶备用;
微囊藻浓缩液的制备:将微囊藻藻液经过浓缩后,得到微囊藻浓缩液;
胶-藻混合液的制备:将微囊藻浓缩液与固定化凝胶以1:5-10的体积比混合均匀,得到胶-藻混合液;
固定化胶珠的制备:将胶-藻混合液挤入钙离子的水溶液中,得到固定化胶珠;将固定化胶珠经过洗涤后,低温保存即可。
通过采用上述技术方案,本申请的胶-藻混合液是采用微囊藻浓缩液与固定化凝胶混合制得,相较于直接使用微囊藻藻液,采用微囊藻浓缩液制备获得的胶珠中的藻细胞密度高,可以延长胶珠的保存时间,缩短恢复再培养的周期;并且,还可以降低胶-藻混合液中微囊藻浓缩液的用量,使用少量的微囊藻浓缩液即可获得更多份的胶珠,从而降低了生产成本。
可选的,所述水溶性高分子固定剂、氯化钠以及水的重量比为2-5:1-3:100。
可选的,所述水溶性高分子固定剂包括藻酸盐、琼脂、琼脂糖、角叉藻聚糖、明胶、聚丙烯酰胺中的一种。
优选的,所述水溶性高分子固定剂为海藻酸钠。
可选的,所述微囊藻藻液采用如下方法进行浓缩处理:将微囊藻藻液在4000-6000r/min的速度下离心10-20min,弃去上清液,得到微囊藻浓缩液。
通过采用上述技术方案,本申请使用离心的方式进行浓缩藻液,不需要使用絮凝剂等添加剂,也不需要使用渗析膜、透析膜等昂贵的材料,可以大大降低生产成本。
可选的,所述微囊藻藻液采用如下方法制备:将微囊藻接种于BG11
培养基中,在温度为23-25℃、光照为60-70μmol·m
可选的,所述微囊藻与BG11培养基的体积比为1:8-12。
可选的,所述钙离子的水溶液为浓度为2wt%的氯化钙的水溶液。
第二方面,本申请提供一种微囊藻固定化胶珠的恢复培养方法,采用如下的技术方案:
一种微囊藻固定化胶珠的恢复培养方法,包括如下步骤:
将固定化胶珠与柠檬酸盐的水溶液混合,完全溶解后,加入BG11培养基,离心后,对藻液进行洗涤;
将洗涤后的藻液加入BG11培养基中静置,使藻液澄清;取澄清后的上清藻液,可进行再培养。
可选的,所述固定化胶珠(质量g)与柠檬酸盐的水溶液(体积mL)的用量比为1:15-25。
可选的,所述柠檬酸盐的水溶液的浓度为3-5wt%。
综上所述,本申请具有以下有益效果:
1.本申请的胶-藻混合液是采用微囊藻浓缩液与固定化凝胶混合制得,相较于直接使用微囊藻藻液,采用微囊藻浓缩液制备获得的胶珠中的藻细胞密度高,可以延长胶珠的保存时间,缩短恢复再培养的周期;并且,还可以降低胶-藻混合液中微囊藻浓缩液的用量,使用少量的微囊藻浓缩液即可获得更多份的胶珠,从而降低了生产成本。
2.采用本申请的方法制备的微囊藻胶珠的可保存6个月以上,在解除固定化后的微囊藻的活化复苏快,在恢复再培养的3-5天内就能进行快速生长阶段,并且对于产毒微囊藻来说,在其固定化保存前后,其代谢产生的毒素种类及含量变化较小,说明本申请的固定化保存方法可以较好的保持微囊藻的活性。
附图说明
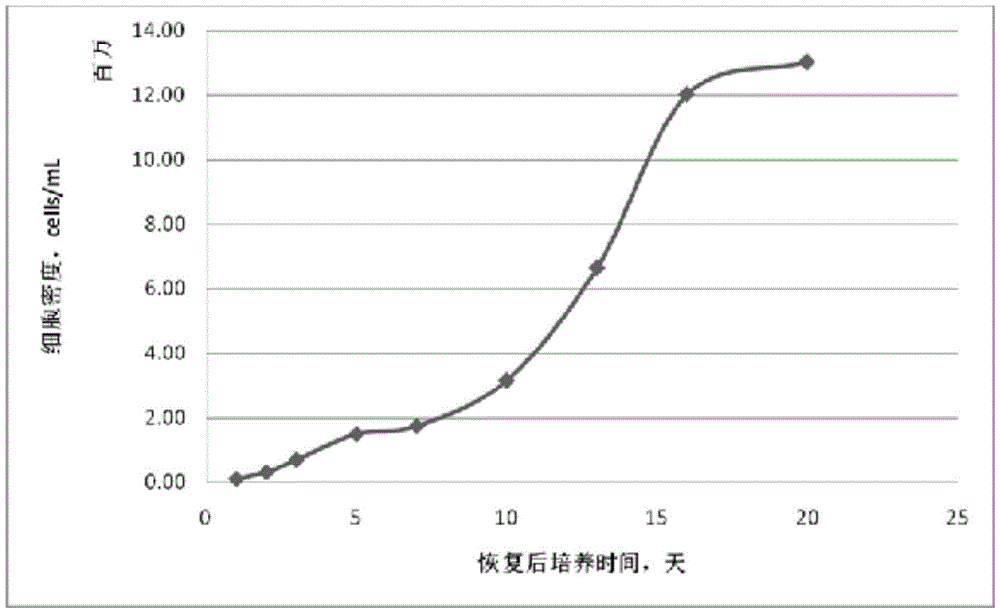
图1是实验组2的微囊藻恢复生长后的藻细胞密度曲线图。
图2是实验组4的微囊藻恢复生长后的藻细胞密度曲线图。
具体实施方式
下面结合附图和实施例对本申请作进一步的描述。
实施例
实施例1:
实施例中所用的部分实验材料如下所示,除特别说明的实验材料,均可通过时候获得。
1.实验材料:
1.1微囊藻:微囊藻购自中国科学院淡水藻种库(Freshwater Algae CultureCollection at the Institute of Hydrobiology,FACHB),型号为微囊藻911。
1.2BG11培养基:BG11培养基的配方如表1所示。
表1BG11培养基的配方表(单位:mg/L)
使用方法为:取1.6gBG11培养基,溶解于1000mL蒸馏水中,用1M盐酸调节pH为7.0,然后在121℃的温度下高压灭菌15min,冷却至室温后备用。
1.3微囊藻藻液:将微囊藻以1:10的比例接入BG11培养基中,在温度为25℃、光照为65μmol·m
1.4高分子固定剂:高分子固定剂可以选择藻酸盐、琼脂、琼脂糖、角叉藻聚糖、明胶、聚丙烯酰胺中的一种,本实施例中的高分子固定剂选择海藻酸钠。
2.微囊藻采用如下方法进行固定化保存:
(1)固定化凝胶的制备:称取2.5g海藻酸钠,溶于100mL蒸馏水中,加入2g氯化钠后,升温至60℃,搅拌加热20min,121℃的温度下高压灭菌15min后,得到均匀粘稠的胶体,放置过夜后,得到海藻酸钠凝胶备用;
(2)微囊藻浓缩液的制备:取1L微囊藻藻液,将其置于离心瓶中,以5000rpm的速度离心15min后,弃去上清液,灭菌后,得到浓缩比例为100倍的微囊藻浓缩液;
(3)胶-藻混合液的制备:将微囊藻浓缩液与海藻酸钠凝胶以1:5的体积比混合均匀,得到胶-藻混合液;
(4)固定化胶珠的制备:称取2g氯化钙,溶于100mL蒸馏水中,灭菌后,得到氯化钙的水溶液;将无菌吸管吸取10mL胶-藻混合液,以6mL/min的速度匀速挤入氯化钙的水溶液中,30min后,得到固定化胶珠;将固定化胶珠用灭菌后的BG11培养基冲洗2次后,转移至无菌离心管(具透气膜)中,在4℃的温度下低温保存即可。
3.微囊藻的恢复培养方法:
(1)固定化解除:称取4g柠檬酸钠,溶于100mL蒸馏水中,灭菌后,得到柠檬酸钠的水溶液;将固定化胶珠(质量g)与柠檬酸钠的水溶液(体积mL)按照1:20的比例混合,完全溶解后,加入BG11培养基,然后以5000rpm的速度离心5min后,用BG11培养基对藻液洗涤2次;
(2)恢复再培养:将洗涤后的藻液加入灭菌后的BG11培养基中静置1h,使藻液澄清,取澄清后的上清藻液,按照上述方法进行再培养。
性能测试
为了验证本申请的固定化保存方法对微囊藻性能的影响,设计下列实验。
1.微囊藻浓缩液与海藻酸钠凝胶的比例对胶珠稳定性以及微囊藻生长性能的影响:采用微囊藻浓缩液与海藻酸钠凝胶的比例不同的单一变量设置实验组1-5,采用实施例1的方法制备微囊藻固定化胶珠;分别在微囊藻固定化胶珠保存的第1个月、第3个月以及第6个月取20个胶珠样品,观察胶珠是否出现融解或者藻细胞溢出的现象,统计并计算出现胶珠融解或藻细胞溢出的比例;将未出现融解或者藻细胞溢出的胶珠进行固定化解除,统计并记录微囊藻在其恢复培养的第5天是否正常生长。将测试结果记录于表2。
表2不同比例的微囊藻浓缩液与海藻酸钠凝胶对微囊藻性能的影响
根据表2数据可以看出,在胶珠固定化保存1个月时,采用不同比例的微囊藻浓缩液与海藻酸钠凝胶制得的胶珠的稳定性影响不大,所统计的样品中均未出现胶珠融解或者藻细胞溢出等异常胶珠,并且解除固定化保存的胶珠均可正常生长。在胶珠固定化保存3个月时,同样未出现异常的胶珠,但是实验组5的微囊藻在解除固定化后,在恢复再培养的第5天仍然没有正常生长,这可能是因为微囊藻浓缩液的占比太低,导致胶珠中藻细胞的密度太低,从而影响到微囊藻后期的生长。在胶珠固定化保存6个月时,实验组1出现较多的异常胶珠,可能是因为微囊藻浓缩液的占比过高,导致凝胶对微囊藻的包埋效果不好,随着胶珠保存时间的延长,藻细胞很容易从胶珠中溢出,导致胶珠的保存时间降低。
2.复苏时间以及生长性能:对固定化保存6个月的未出现藻细胞溢出或者融解等异常现象的胶珠进行恢复培养;在恢复培养期间,采用平板计数的方法测定活性藻细胞数,每次取3个样品,计算3个样品的平均藻细胞数,将测试结果记录于表3。
表3固定化解除后的微囊藻的生长性能数据表
根据表3数据以及图1可以看出,实验组2的微囊藻固定化胶珠在固定化解除进行恢复再培养时,在经过第1-3天的缓慢增长期后,在第5-15天进入快速生长期,在培养的第20天藻细胞密度达到峰值。
根据表3数据以及图2可以看出,实验组4的微囊藻固定化胶珠在固定化解除进行恢复再培养时,其生长状态也是先缓慢增长后进入快速生长期,而后达到峰值;与实验组2不同的是,实验组4的微囊藻在第1-5天处于缓慢增长期,在第7-第20天处于快速生长期,在第25-30天处于缓慢增长期,并在培养的第30天藻细胞密度达到峰值。
通过实验组2与实验组4比较可知,不同实验组的微囊藻在经过固定化保存后,其恢复后的生长性能均比较好。当微囊藻浓缩液的占比越低时,所得到的固定化胶珠的数量越多,可以降低生长成本;当微囊藻浓缩液的占比增高时,其恢复再培养的周期越短;但是根据表2数据可以看出,当
微囊藻浓缩液的占比过高,则所得到的胶珠的包埋效果不好,比较容易出5现胶珠融解或藻细胞溢出的现象。综合从微囊藻的生长性能、胶珠保存时
间以及成本考虑,当微囊藻浓缩液与海藻酸钠凝胶的比例为1:5时,可以在保持较低成本的情况下获得生长性比较好的微囊藻。
3.产毒性能:本申请所用的微囊藻为产毒微囊藻,其次生代谢产物主
要有微囊藻毒素RR、微囊藻毒素YR以及微囊藻毒素WR;为了验证微囊0藻固定化保存对为产毒性能的影响,在微囊藻固定化前后分别对微囊藻产
生的毒素种类以及毒素占比进行检测,以验证固定化保存是否对微囊藻的产毒性能产生影响;微囊藻毒素的检测方法参考SN/T 4319-2015《出口水产品中微囊藻毒素的检测液相色谱-质谱/质谱法》。
实验组6采用实施例1的方法制备微囊藻固定化胶珠,与实施例1不5同之处在于所用的藻种为微囊藻939。分别测定实验组2(实施例1)以及
实验组6的胶珠在固定化保存前后的毒素种类以及占比,固定化保存后的样品取固定化保存3个月且经过恢复培养的第20天的代谢物,将测试结果记录于表4。
表4不同藻株在固定化保存前后的产毒种类以及占比数据表
根据表4数据可以看出,实验组2以及实验组6的微囊藻藻株在固定化保存前后的产毒种类以及各种毒素的占比有小幅度变化,说明本申请的保存方法对微囊藻的生长及代谢状况的影响比较小,可以较好的保持微囊藻的活性。
综上所述,采用本申请的方法制备的微囊藻胶珠可以保存较长的时间,并且在解除固定化保存后,微囊藻可以快速复苏,且复苏后的微囊藻还可以保持和固定化保存之前较为一致的生物活性。
本具体实施例仅仅是对本申请的解释,其并不是对本申请的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本申请的权利要求范围内都受到专利法的保护。
- 一种高效液相荧光色谱法检测水中微囊藻毒素-LR的方法
- 一种单细胞微囊藻絮凝方法
- 一种通过固定化微生物共培养利用蔗糖异养培养微藻的方法
- 一种通过与固定化微生物共培养利用淀粉异养培养微藻的方法
