一种核酸药物解离方法及应用
文献发布时间:2024-04-18 19:58:21
技术领域
本申请涉及核酸药物技术领域,特别是涉及一种核酸药物解离方法及应用。
背景技术
核酸药物又称核苷酸类药物,是各种具有不同功能的寡聚核糖核苷酸(RNA)或寡聚脱氧核糖核苷酸(DNA)。由于核酸是携带负电荷的生物大分子,很难通过细胞膜的表面带负电荷的脂质双分子膜层,且RNA容易被体内的RNase酶降解;一般采用聚乙烯亚胺(PEI)等阳离子聚合物作为递送系统,与核酸DNA或RNA通过电荷作用以特定的方式结合,将核酸包裹制备成一种纳米颗粒制剂,即核酸纳米颗粒。
核酸纳米颗粒制剂的质量研究中,核酸含量和包封率是其关键质量属性。其中,核酸总量或者被包封核酸量的测定,都需要通过适当的样品前处理方法将PEI和核酸的聚合体解离后进行进一步的测定。
目前文献报道的核酸药物解离方法主要为十二烷基磺酸钠(SDS)解离和肝素钠解离,解离后一般采用荧光法或者凝胶法进一步分析核酸含量。但是,荧光法和凝胶法定量分析核酸的准确性有待提高。
有研究显示,可以采用液相色谱分析准确的检测核酸含量;但是,对于核酸纳米颗粒制剂而言,SDS解离和肝素钠解离后进行液相色谱分析时,难以得到较为正常的峰型,给液相色谱分析带来了一定的困扰。
因此,如何解决核酸药物解离后液相色谱分析难以获得正常峰型的问题,是核酸药物技术领域亟待解决的问题。
发明内容
本申请的目的是提供一种改进的核酸药物解离方法及应用。
为了实现上述目的,本申请采用了以下技术方案:
本申请的第一方面公开了一种核酸药物解离方法,其中,核酸药物为阳离子聚合物与核酸复合成的核酸纳米颗粒,该核酸药物解离方法包括在核酸纳米颗粒溶液中加入硫酸葡聚糖钠,利用硫酸葡聚糖钠进行核酸解离。
需要说明的是,本申请的核酸药物解离是指,将核酸从核酸纳米颗粒中释放出来,即通过前处理方法将阳离子聚合物和核酸的聚合体解离。本申请的核酸药物解离方法,简单快捷;其中使用的硫酸葡聚糖钠,相比肝素钠和SDS,具有更高的磺酸化程度,分子的电负性更强,硫酸葡聚糖钠的磺酸基、羧基等能更好的与核酸竞争性结合阳离子聚合物,从而完全释放出核酸,达到阳离子聚合物载体与核酸解离的目的。
还需要说明的是,本申请的核酸药物解离方法,采用的解离试剂,即硫酸葡聚糖钠,对后续的液相色谱分析无干扰,解离处理后的样品在液相色谱中峰型良好,解离完全,解决了核酸药物解离后液相色谱分析难以获得正常峰型的问题。本申请的核酸药物解离方法,为核酸纳米颗粒制剂的质量表征提供了一种简单有效的样品前处理方案。
本申请的一种实现方式中,硫酸葡聚糖钠在核酸纳米颗粒溶液中的工作浓度为1-2.5mg/mL。
优选的,硫酸葡聚糖钠在核酸纳米颗粒溶液中的工作浓度为2.5mg/mL。
需要说明的是,本申请的关键在于,研究发现硫酸葡聚糖钠能够解离核酸药物,完全释放出核酸,并且解离处理后的样品能够进行液相色谱分析;至于硫酸葡聚糖钠的具体的工作浓度,可以根据实际情况进行相应的调整,例如可以是1mg/mL、1.5mg/mL、2mg/mL或2.5mg/mL。可以理解,硫酸葡聚糖钠解离核酸药物的原理是,硫酸葡聚糖钠的磺酸基、羧基与核酸竞争性结合阳离子聚合物,从而完全释放出核酸;因此,如果核酸药物中的核酸量越大或者核酸的分子量越大,相应的需要的硫酸葡聚糖钠就越多,即所需要的硫酸葡聚糖钠的工作浓度就越高。
还需要说明的是,本申请限定的硫酸葡聚糖钠在核酸纳米颗粒溶液中的工作浓度为1-2.5mg/mL,能够满足一般的核酸药物的解离需求;其中,一般的核酸药物,例如核酸的碱基数为30-544。但是,不排除在一些特殊情况下,例如核酸量特别小、或者核酸碱基数特别小、或者不需要完全解离等,可以采用更低的硫酸葡聚糖钠工作浓度;又例如,核酸量特别大或者核酸碱基数特别大等,则可能需要采用更高的硫酸葡聚糖钠工作浓度。
可以理解,硫酸葡聚糖钠的工作浓度一般为1-2.5mg/mL即可满足一般的核酸药物解离需求,工作浓度太低,例如低于1mg/mL,可能无法完全、有效的解离核酸;工作浓度太高,例如高于2.5mg/mL,影响并不会太大,可能会出现小的色谱峰,同时可能会占据较多的色谱柱上的结合位点,导致核酸在色谱柱上的结合变少,不利于检测。
本申请一种实现方式中,硫酸葡聚糖钠的重均分子量为5000Da-500000Da。
需要说明的是,本申请的关键在于,研究发现硫酸葡聚糖钠能够与核酸竞争性结合阳离子聚合物,从而完全释放出核酸。至于硫酸葡聚糖钠的重均分子量,一般来说,不同分子量的硫酸葡聚糖钠都可以起到解离作用,例如重均分子量为5000Da、10000Da、15000Da、20000Da、25000Da、30000Da、35000Da、50000Da、100000Da、200000Da、300000Da、400000Da或500000Da的硫酸葡聚糖钠。
本申请的一种实现方式中,利用硫酸葡聚糖钠进行核酸解离,具体包括,将硫酸葡聚糖钠加入核酸纳米颗粒溶液后,室温搅拌至少1min,即完成核酸解离。
本申请的一种实现方式中,将硫酸葡聚糖钠加入核酸纳米颗粒溶液,具体包括,将硫酸葡聚糖钠溶于无菌无酶水中制成硫酸葡聚糖钠溶液,将硫酸葡聚糖钠溶液加入核酸纳米颗粒溶液中。
需要说明的是,本申请的核酸药物解离方法,只需要在室温搅拌1min即可,例如室温涡旋1min,操作简便快捷。
本申请的第二方面公开了一种核酸药物分析方法,包括采用本申请的核酸药物解离方法进行核酸解离,对解离产物进行液相色谱分析。
需要说明的是,本申请的核酸药物分析方法,由于采用本申请的核酸药物解离方法,不仅能够完全、有效的解离核酸;而且,解离处理的样品能够直接用于液相色谱分析,且核酸峰型良好,解决了核酸药物解离后液相色谱分析难以获得正常峰型的问题。可以理解,本申请的核酸药物解离方法中,阳离子聚合物没有紫外吸收,不干扰目标峰,同时此阳离子聚合物的极性较大,在反相色谱柱上很容易被洗脱,对色谱柱也不产生影响;硫酸葡聚糖钠对核酸的分析也没有干扰;因此,解离后可以直接进行色谱分析。
本申请的第三方面公开了硫酸葡聚糖钠在制备核酸药物解离试剂中的应用。
需要说明的是,本申请的关键在于,研究发现硫酸葡聚糖钠能够解离核酸药物,并且解离处理的样品能够适用于液相色谱分析;因此,本申请创造性的提出了硫酸葡聚糖钠的一种新的用途,即用于制备核酸药物解离试剂。可以理解,虽然本申请的硫酸葡聚糖钠优选用于阳离子聚合物与核酸复合成的核酸纳米颗粒的核酸药物的解离;但是,根据本申请的解离原理,只要硫酸葡聚糖钠能够与核酸竞争性结合核酸载体,即可释放出核酸。因此,本申请的核酸药物包括但不仅限于阳离子聚合物与核酸复合成的核酸纳米颗粒。至于硫酸葡聚糖钠的重均分子量,一般的重均分子量5000Da-500000Da的硫酸葡聚糖钠都能够用于本申请的核酸药物解离,包括但不仅限于重均分子量为5000Da、10000Da、15000Da、20000Da、25000Da、30000Da、35000Da、50000Da、100000Da、200000Da、300000Da、400000Da或500000Da的硫酸葡聚糖钠。
由于采用以上技术方案,本申请的有益效果在于:
本申请的核酸药物解离方法和核酸药物分析方法,采用硫酸葡聚糖钠进行核酸解离,不仅具有良好的解离效果,而且解离的样品能够直接用于液相色谱分析,核酸峰型良好;解决了核酸药物解离后液相色谱分析难以获得正常峰型的问题;为核酸药物的质量表征提供了一种简单有效的方案。
附图说明
图1是本申请实施例中核酸原液的色谱图;
图2是本申请实施例中10%的SDS解离PEI核酸纳米颗粒制剂的色谱图;
图3是本申请实施例中10mg/mL肝素钠解离PEI核酸纳米颗粒制剂色谱图;
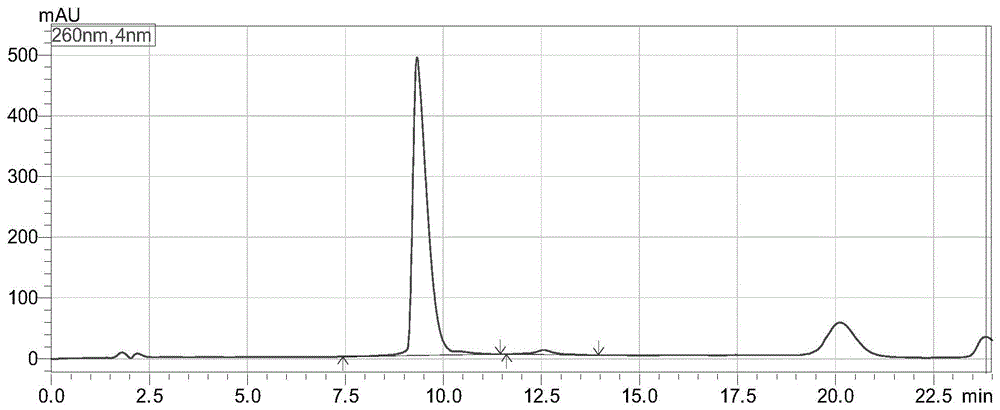
图4是本申请实施例中10mg/mL的硫酸葡聚糖钠解离PEI核酸纳米颗粒制剂的色谱图;
图5是本申请实施例中硫酸葡聚糖钠溶液的色谱图。
具体实施方式
本申请研究发现,核酸药物解离除了常规使用的SDS和肝素钠以外,还可以采用硫酸葡聚糖钠,并且,硫酸葡聚糖钠不仅能够完全、有效的释放核酸,而且解离后的样品可以进行液相色谱分析,获得良好的核酸峰型。
基于以上研究和认识,本申请创造性的提出了一种改进的核酸药物解离方法,包括在核酸纳米颗粒溶液中加入硫酸葡聚糖钠,利用硫酸葡聚糖钠进行核酸解离。
本申请的核酸药物解离方法和核酸药物分析方法,能完全解离核酸与阳离子聚合物载体的结合,从而释放出核酸,同时解离试剂对后续的液相色谱分析无干扰,核酸峰型良好,这为核酸纳米颗粒制剂的质量表征提供了一种简单有效的方案。
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。在以下的实施方式中,很多细节描述是为了使得本申请能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下可以省略,或者可以由其他试剂盒、材料、方法所替代。在某些情况下,本申请相关的一些操作并没有在说明书中显示或者描述,这是为了避免本申请的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。以下实施例中,所用试剂或仪器未注明生产厂商者,均为可以通过市场购买获得的常规产品。
实施例一
本例分别制备了10mg/mL的硫酸葡聚糖钠(重均分子量为20000Da)无菌无酶水溶液、10%的SDS无菌无酶水溶液和10mg/mL的肝素钠无菌无酶水溶液,作为解离试剂,对核酸药物进行解离。
本例用于试验的核酸药物为聚乙烯亚胺(PEI)阳离子聚合物在海藻糖溶液中自组装封装核酸复合成PEI核酸纳米颗粒。具体制备方法以及核酸药物的特征参数如下:
①将RNA冻干粉、PEI粉末和海藻糖固体粉末用无酶无菌水分别配制成三种母液,RNA母液使用核酸定量仪检测真实浓度、In vivo-jet PEI母液浓度为4.3mg PEI/mL(100mM的N浓度)、海藻糖母液浓度为50wt%(0.5g/mL)。
RNA工作液:采用无酶无菌水配制,使RNA浓度为0.3mg/mL。
PEI工作液:采用无酶无菌水配制,使PEI浓度为0.43mg/mL。
②两种工作液准备好后,将两种工作液分别均分到两个注射器中,保持注射器中的液体量相同,将两个注射器,制备制剂。得到RNA浓度为150μg/mL,PEI浓度为215μg/mL的初始制剂。
③调节海藻糖浓度:采用50wt%海藻糖母液调节样品,使样品中海藻糖浓度为10wt%。将液体制剂分装于7mL西林瓶,每支体积2.5mL。
④置于-60℃环境约4h,快速转移至冻干机内,开启真空泵,设置0.1mbar压力,冻干约24小时,获得白色蓬松粉末。
⑤采用无酶无菌水复溶,采用粒度仪检测粒径、PdI和电位,测试结果如表1所示。
表1复溶后的测试结果
按照表2的量加入核酸纳米颗粒溶液和解离试剂,室温涡旋1min,即完成核酸纳米颗粒的解离。
表2核酸药物解离的解离试剂及用量
解离完成后,对解离产物直接进行液相色谱分析(HPLC-RPIP-UV),HPLC-RPIP-UV仪器设备采用HPLC:岛津LC-2030C 3D,检测器UV:260nm,色谱柱Xbridge BEH C18,流动相A为1% HFIP+0.1% DIPEA水溶液,流动相B为甲醇,流速0.3mL/min,柱温为50℃,进样量5μL。液相色谱分析的洗脱梯度如表3所示。
表3液相色谱条件
本例按照表3的液相色谱条件,分别采用HPLC-RPIP-UV方法进样分析核酸原液,以及分别采用10%的SDS、10mg/mL的肝素钠、10mg/mL的硫酸葡聚糖钠解离后的样品溶液,所得色谱图如图1、图2、图3、图4所示。图1为核酸原液作为对照品溶液的色谱图,图2为10%的SDS解离PEI核酸纳米颗粒制剂的色谱图,图3为10mg/mL的肝素钠解离PEI核酸纳米颗粒制剂的色谱图,图4为10mg/mL的硫酸葡聚糖钠解离PEI核酸纳米颗粒制剂的色谱图。其中,核酸原液为未做成制剂的核酸,即没有被PEI包覆的RNA溶液,本例用于分析的RNA溶液的浓度为100ng/μL。
图1至图4的结果显示,仅仅硫酸葡聚糖钠溶液解离PEI核酸纳米颗粒所得的色谱图峰型正常,且与核酸原液对照品溶液的峰型一致;SDS和肝素钠解离后都不能得到正常的峰型。同时硫酸葡聚糖钠溶液解离所得色谱图中核酸的响应远高于SDS溶液和肝素钠溶液;这表明硫酸葡聚糖钠用于解离PEI核酸纳米颗粒优于SDS溶液和肝素钠溶液。
实施例二
本例考察了加入不同量的硫酸葡聚糖钠对解离结果的影响,具体的,本例在实施例一的基础上,按表4中的制剂和解离试剂加量进行解离试验,解离条件与实施例一相同,解离完成后,按照实施例一相同的方法进行液相色谱分析。本例具体考察了添加不同硫酸葡聚糖钠用量,对液相色谱分析得到的核酸的峰面积的影响。
表4不同解离试剂比例及对应峰面积数据表
表4中,“制剂加量”即核酸纳米颗粒溶液的加入量,“硫酸葡聚糖钠加量”即“10mg/mL的硫酸葡聚糖钠”的加入量,“水加量”即无菌无酶水的加入量,“硫酸葡聚糖钠工作浓度”即最终配置的解离反应液中硫酸葡聚糖钠的浓度。
表4的结果显示,当硫酸葡聚糖钠的终浓度在1-2.5mg/mL时,解离得到的核酸峰面积达到稳定值,且核酸峰面积较大。为保证实验方法的耐用性,优选的,采用硫酸葡聚糖钠的终浓度为2.5mg/mL。
实施例三
本例对硫酸葡聚糖钠的解离完全程度进行考察,具体的,按照实施例一的制备方法,分别制备3批PEI核酸纳米颗粒制剂。按照下述方法制备得到解离反应液:取核酸纳米颗粒制剂溶液30μL,加入10mg/ml的硫酸葡聚糖钠水溶液10μL,室温涡旋1min,即得。按照实施例一的液相色谱方法对核酸含量进行测试。液相色谱条件与实施例一相同。本例用HPLC-RPIP-UV色谱方法,单点外标法进行解离处理后的样品中核酸结果定量计算,并与理论含量进行比较,对PEI核酸纳米颗粒解离完全程度进行分析。其中,理论含量是指理论上包封的核酸的量,本例使用的制剂为核酸和PEI载体及辅料混合后冻干制得,故可以通过投料量得到制剂中的核酸理论含量。测试结果如表5所示。
表5核酸纳米颗粒解离完全程度统计表
表5的结果显示,连续3批制剂通过硫酸葡聚糖钠解离后分析测得的核酸含量为理论含量的96%-102%,表明PEI核酸纳米颗粒基本上能够被硫酸葡聚糖钠完全解离。
实施例四
本例对核酸药物解离方法的专属性进行考察,具体的,专属性主要考察了色谱图中硫酸葡聚糖钠对核酸色谱峰是否产生干扰。按表3的色谱条件进样分析硫酸葡聚糖钠溶液,色谱图如图5所示。
对比分析图5和图1的结果可知,硫酸葡聚糖钠溶液在核酸主峰处未出峰,这表明硫酸葡聚糖钠对核酸的分析没有干扰。
实施例五
本例考察了核酸药物解离的重复性和准确度。本例在实施例一的基础上进行试验,具体的,取供试品溶液,加同一水平对照品溶液,平行制备6份样品进行分析,计算加标回收率,进行方法准确度考察。通过加标回收的6份平行样品浓度的RSD考察方法的重复性。具体如下:
核酸标准贮备液的制备:取1000ng/μL的核酸溶液60μL,加入无酶无菌水240μL,混匀,即得。
制剂未加标溶液制备:取PEI核酸纳米颗粒制剂溶液30μL,加入10mg/mL的硫酸葡聚糖钠溶液10μL,涡旋振摇1min,加入无菌无酶水40μL,混匀即得。
制剂加标回收溶液制备:取制剂30μL,加入10mg/mL的硫酸葡聚糖钠溶液10μL,涡旋振摇1min,加入200ng/μL的核酸标准贮备液40μL,混匀即得。平行制备6个加标回收溶液样品,分别标记为制剂加标-1至制剂加标-6。按表3色谱条件进样分析,结果如表6所示。
表6加标回收率计算表
表6中的理论加标浓度,即200ng/μL的核酸标准贮备液制成加标回收溶液后,核酸浓度被稀释了2倍,即为100ng/μL。RSD(%)是制剂加标-1至制剂加标-6的相对标准偏差。
表6的结果显示,加标回收率在104.0%-108.3%范围内,表明本例的核酸药物解离方法的准确度好。平行样结果的RSD分别为1.4%,结果的重复性好。通过准确度和重复性实验表明,用硫酸葡聚糖钠解离PEI核酸纳米制剂的样品前处理方法具有良好的重复性和可靠性。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。
- 一种酵母核酸的提取方法及其在生产富硒核酸中的应用
- 核酸-药物结合物、药物递送系统及其制备方法和应用
- 一种核酸解离液及其在核酸提取中的应用
- 一种用于解离药物/ADA复合物的解离液及其应用
