鉴定蛋白质或蛋白质组的存在和/或浓度和/或量的方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明涉及鉴定样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量的方法。
背景技术
蛋白质是包含氨基酸序列的生物聚合物。蛋白质组学是对蛋白质的大规模研究。它允许蛋白质的鉴定和定量。在蛋白质组学领域,有多种已建立的方法来鉴定样本内蛋白质的存在与否。鉴定样本中是否存在亚蛋白质组或蛋白质组是有挑战性的,因为这涉及其所有蛋白质的顺序鉴定。一些蛋白质组学方法允许定量样本内蛋白质的浓度或量。
鉴定样本中蛋白质存在的最常用方法是质谱。质谱测量样本中存在的离子的质荷比。样本的质谱是离子信号与质荷比的函数图。光谱用于确定样本的同位素特征和粒子的质量,其用于提供化学化合物的化学身份或结构。然而,质谱是劳动密集型的并且不是固有定量的,因为不同的肽被电离并且以不同的效率被检测。为了克服这一点,使用了诸如同位素编码的亲和标记(ICAT)的方法,但这仅允许对鉴定的蛋白质的一部分进行定量。大多数定量质谱方法仅允许确定样本中蛋白质浓度或量的相对变化,而不是样本的绝对定量。质谱蛋白质组学的覆盖范围也是有限的,特别是对于高等有机体。分析整个蛋白质的“自顶向下”质谱蛋白质组学仅允许对10%的所研究蛋白质进行蛋白质鉴定,并且分析已被消化成片段的蛋白质的“自底向上”质谱蛋白质组学允许对8至25%的所研究蛋白质进行蛋白质鉴定。由于所获得的质谱的复杂性,混合物和复杂样本必须分离成其组分,例如通过二维凝胶电泳或高效液相色谱法(HPLC),然后可以用质谱顺序分析它们。
鉴定蛋白质存在的替代方法是使用蛋白质微阵列。蛋白质微阵列将蛋白质阵列或探针阵列固定在支持物表面上,并且特别适用于多重检测。将标记的探针或标记的蛋白质添加到阵列中,并且检测蛋白质与探针之间的结合相互作用。然而,蛋白质微阵列是劳动密集型的并且缺乏再现性和准确性。检测需要表面附近的结合事件,并且因此,结合事件以及由此检测的准确性可能受到该表面的影响。此外,通过该方法只能鉴定已经具有对应探针的蛋白质,诸如特异性抗体。
几种方法已经旨在经由蛋白质的物理参数特性鉴定蛋白质,例如Zhang等人,“微流体平台上自顶向下的蛋白质组学(Top-down proteomics on a microfluidicplatform)”(2019),电子打印1910.11861arXiv physics.bio-ph。在该微流体方法中,使用蛋白质的流体动力学半径(RH),其为它在溶液中的大小,与来自蛋白质内Trp/Lvs和Tyr/Lys残基的荧光信号的比率用于蛋白质鉴定。赖氨酸(Lys)残基是荧光标记的,并且色氨酸(Trp)和酪氨酸(Tyr)残基是未标记的。对7种已知的蛋白质进行4次测量,并且当第四次测量蛋白质获得的值与另外三次测量蛋白质获得的值匹配时,鉴定蛋白质。虽然显示在一组实验条件下测量的值是已知蛋白质的特性,因为测量的蛋白质基于这些值是彼此可区分的,但是对于目的蛋白质,不能预测这些值。不能预测R
替代地,现有技术包括新开发的蛋白质测序方法,诸如Swaminathan,J等人《自然生物技术(Nat Biotechnology)》36,1076-1082(2018)。稀疏荧光测序对单个肽片段分子进行经典的埃德曼(Edman)降解测序,该单个肽片段分子在其固定到表面上之前已经在特定氨基酸上被荧光标记,并且当荧光标记的氨基酸从肽N-末端顺序裂解时观察到荧光从表面消失的模式。荧光减少的模式揭示了被读取的肽中标记的氨基酸的位置,并且提供了稀疏的肽序列。基于蛋白酶裂解特异性、表面附接化学、标记化学和标记的氨基酸在目的蛋白质的预测肽片段内的位置的信息丰富的约束,可以预测目的蛋白质的这些稀疏肽序列。实际上,这种劳动密集型和数据密集型方法易于从各种来源出错,并且对于单个纯化的肽,大约40%的时间观察到正确的读数。未评价该方法的定量。该方法依赖于与色谱分离方法如HPLC和/或质谱联用,以在进行测序之前首先验证每个肽片段中的所有氨基酸,诸如所有赖氨酸和所有半胱氨酸氨基酸被定量荧光标记。尽管鉴定了双组分混合物中的肽片段,但这需要经由表面附接在表面的不同位置将肽片段在空间上彼此分离,使得对于每种肽可以观察到不同的荧光消失痕迹。与传统的埃德曼测序一样,该方法缓慢,一个埃德曼循环需要1小时,不适于分析N-末端修饰的肽,并且不适于读取长度大于30个氨基酸的肽片段。公认的是,由于依赖于埃德曼测序,该方法更适于鉴定短肽而不是长蛋白质分子。人类蛋白质组中蛋白质分子的平均长度为558个氨基酸。使用该方法不可能分析蛋白质或蛋白质组的混合物。
已认识到需要开发基于质谱的蛋白质鉴定的简单和通用的备选方案,其允许将整个蛋白质鉴定为目的蛋白质。公认需要一种表征复杂蛋白质混合物,例如疾病相关的蛋白质混合物的有效方法。非常需要快速和通用的诊断任何感染的方法。优选地,这些方法能够进行蛋白质定量。因此,需要更高效、成本有效和通用的方法来鉴定样本内目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
发明内容
本发明基于以下发现:标记和测量样本中的两种或更多种氨基酸类型可以鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。这基于测量的标记、氨基酸浓度或样本中每种标记的氨基酸类型的氨基酸数目。
已经发现每种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有基于每种浓度的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的标记值、氨基酸浓度或两种或更多种氨基酸类型的氨基酸数目的独特特征。
蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型中的每一种的标记值或氨基酸浓度的特征对于每种浓度的每种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组是独特的。蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型中的每一种的氨基酸数目的特征对于每种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组也是独特的。
因此,可以将样本的特征与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的特征进行比较,以鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的已知标记值或氨基酸浓度的特征是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度的函数,并且对于每种浓度的每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组是独特的。因此,可以将样本中两种或更多种氨基酸类型的测量的标记或氨基酸浓度的值与样本中标记了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或亚蛋白质组的相同两种或更多种氨基酸类型的已知标记值或氨基酸浓度进行比较,以提供样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量的阳性鉴定。目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的氨基酸数目的特征对于每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组是独特的。因此,可以将样本中两种或更多种氨基酸类型中的每一种的氨基酸数目与样本中标记了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的氨基酸数目进行比较,以提供样本中存在的阳性鉴定。
在一些实施例中,这种比较可以使用n维空间来可视化,其中维度的数目等于在本发明的方法中标记和测量的n种氨基酸类型的数目。例如,两种标记的氨基酸类型在2维空间中可视化,并且三种标记的氨基酸类型在3维空间中可视化。随着在样本中标记和测量每种附加的氨基酸类型,该维度空间增加。两种或更多种氨基酸类型的标记的氨基酸浓度或值在n维空间中呈一条线。两种或更多种氨基酸类型各自的氨基酸数目在n维空间中呈一个点。样本中标记的n种氨基酸类型有n种维度。
已经发现,为了鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量,仅需要测量两种或更多种氨基酸类型的标记、氨基酸浓度或氨基酸数目。标记和测量两种或更多种氨基酸类型对本发明的方法是必需的,因为当标记和测量两种或更多种氨基酸类型时,这为每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组提供了独特的特征。需要标记和测量两种氨基酸类型,因为如果仅标记和测量一种氨基酸类型,则所有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组将具有相同的参考线。当样本点与p个目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的p条线比较时,同时确定样本中每个目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度、存在和/或浓度和/或量的函数。在该溶液相方法中,通过将样本中鉴定的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度乘以样本中溶液的体积来简单地确定样本中所含蛋白质的量。测量样本中每种氨基酸类型的标记、氨基酸浓度或氨基酸数目不是必需的或有效的。
目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组和蛋白质组都具有两种或更多种氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目的独特特征。不必知道或怀疑样本含有什么种类的分子(即蛋白质、肽、寡肽、多肽、蛋白质复合物、混合物、亚蛋白质组或蛋白质组)来确定样本中目的种类的成员的存在和/或浓度和/或量。例如,样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),测量的色氨酸(W)标记用于确定样本中色氨酸(W)的浓度,并且测量的赖氨酸(K)标记用于确定样本中赖氨酸(K)的浓度。样本含有10.9μM W和27.9μM K。针对目的蛋白质鸡蛋清溶菌酶和目的蛋白质组HIV鉴定样本。鸡蛋清溶菌酶每个蛋白序列具有6个W和6个K氨基酸,并且HIV每个蛋白序列具有10.9个W氨基酸和27.9个K氨基酸。鉴定样本中不存在鸡蛋清溶菌酶,因为没有鸡蛋清溶菌酶的蛋白质浓度,这将导致测量样本的特征。然而,样本的特征(10.9μM W和27.9μM K)与1μM蛋白质浓度的HIV的特征(10.9W和27.9K)相同,并且因此鉴定了样本中1μM HIV的存在。
分别与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目相比,样本中每种标记的氨基酸类型的标记、氨基酸浓度或数目是重要的,而不是与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中氨基酸的顺序相比样本中氨基酸的顺序。用于肽和蛋白质鉴定的其它现有技术方法需要确定样本的肽或蛋白质序列内的氨基酸顺序。
标记样本中的两种或更多种氨基酸类型。氨基酸类型由R基团定义,即侧链。R基团是每种氨基酸类型特有的。一种氨基酸类型的R基团与所有其它氨基酸类型的R基团不同。例如,色氨酸(W)的R基团是吲哚基团。每个W氨基酸具有吲哚基团。因此,W氨基酸类型由吲哚R基团定义。在另一实例中,赖氨酸(K)的R基团是ε-伯氨基团。每个K氨基酸具有该ε-伯氨基基团。因此,K氨基酸类型由ε-伯氨基R基团定义。在另一实例中,酪氨酸(Y)的R基团是苯酚基团。每个Y氨基酸具有苯酚基团。因此,Y氨基酸类型由苯酚R基团定义。氨基酸类型W的R基团可区别于氨基酸类型K的R基团和氨基酸类型Y的R基团。因此,氨基酸类型W可区别于氨基酸类型K和氨基酸类型Y,因为在这些氨基酸类型之间R基团不同。所有的氨基酸类型通过其特定的R基团彼此区分。在一些实施例中,氨基酸类型独立于其它氨基酸类型被标记。在一些实施例中,被标记的是氨基酸类型的每个氨基酸的R基团。在一些实施例中,每个R基团(即每种氨基酸类型)具有独特的标记,并且因此每个R基团(即每种氨基酸类型)独立于其它R基团(即其它氨基酸类型)被标记。在一些实施例中,两种或更多种R基团(即两种或更多种氨基酸类型)用相同的标记标记,但每个标记的R基团(即每个标记的氨基酸类型)与另一个标记的R基团(即另一个标记的氨基酸类型)检测不同。在一些实施例中,每个标记靶向氨基酸类型。在一些实施例中,每个标记对氨基酸类型是特定的。
在一些实施例中,两种或更多种氨基酸类型选自丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(S)、硒代半胱氨酸(O)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)或合成氨基酸。在一些实施例中,氨基酸类型包含修饰的氨基酸和/或未修饰的氨基酸。在一些实施例中,氨基酸类型包含修饰的氨基酸。在一些实施例中,氨基酸类型包含未修饰的氨基酸。在一些实施例中,氨基酸类型包含修饰的和未修饰的氨基酸。在一些实施例中,当修饰的和未修饰的氨基酸类型的氨基酸都被标记时,修饰的氨基酸首先被转换为未修饰的氨基酸。
在一些实施例中,样本中的蛋白质用其荧光仅在与目的氨基酸类型反应后“开启”的分子荧光标记。因此,不需要从未反应的染料中分离标记的氨基酸,因为未反应的染料不是荧光的并且不提供信号。在肽或蛋白质鉴定的其它现有技术方法中,在肽或蛋白质鉴定可能发生之前需要从未反应的染料中分离标记的氨基酸。
测量该样本中每种标记的氨基酸类型的标记。例如,如果样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则测量色氨酸(W)的标记,并且测量赖氨酸(K)的标记。
在一些实施例中,每种氨基酸类型的测量的标记用于计算样本中该标记的氨基酸类型的浓度和/或该标记的氨基酸类型的氨基酸数目。每种氨基酸类型的测量的标记可以与氨基酸类型的浓度、氨基酸类型的氨基酸数目和样本的浓度中的每一个线性相关。例如,如果样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则测量色氨酸(W)的标记,并且测量赖氨酸(K)的标记。测量的色氨酸(W)标记用于计算样本中色氨酸(W)的氨基酸浓度和/或色氨酸(W)氨基酸的数目和/或样本的浓度。测量的色氨酸标记与色氨酸氨基酸浓度、色氨酸氨基酸数目和样本浓度中的每一个线性相关。测量的赖氨酸(K)标记用于计算赖氨酸(K)的氨基酸浓度,和/或赖氨酸(K)氨基酸数目,和/或样本浓度。测量的赖氨酸标记与赖氨酸浓度、赖氨酸氨基酸数目和样本的蛋白质浓度中的每一个线性相关。
在一些实施例中,使用校准曲线或标准将测量的标记(例如信号)的值转换为样本中标记的两种或更多种氨基酸类型中的每一种的氨基酸浓度。校准曲线或标准示出仪器的响应如何随分析物的已知浓度变化。标准或校准曲线提供了每种氨基酸类型的一种或多种已知氨基酸浓度的标记值。这种转换可以应用于样本或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组。例如,校准曲线揭示了对于氨基酸类型色氨酸(W),为了确定在10μM W的氨基酸浓度下目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的已知标记值,将该氨基酸浓度乘以100AU/uM,因为这是校准曲线的斜率。由校准曲线或标准指示的计算被称为校准函数或校准因子。如果值乘以或除以标量,则使用校准因子,并且如果执行附加步骤,则使用校准函数。例如,100AU/uM是校准因子。不需要在每次测量样本时计算校准曲线或标准,而是可以将这些曲线或标准供应给仅需要测量其样本中两种或更多种标记的氨基酸类型的标记(例如,信号)的用户,并且可以提供每种氨基酸类型的校准函数或因子。在该实施例中,样本的存在和/或浓度和/或量的阳性鉴定基于样本的每种标记的氨基酸类型的氨基酸浓度。样本中每种标记的氨基酸类型的测量的标记可以与样本中该氨基酸类型的浓度、样本中该氨基酸类型的每个蛋白质的氨基酸数目和/或样本的蛋白质浓度线性相关。
在一些实施例中,通过将每种标记的氨基酸类型的氨基酸浓度除以样本的摩尔蛋白质浓度来计算样本中每种标记的氨基酸类型的氨基酸数目。因此,必须知道样本的摩尔蛋白质浓度,以便使用样本中氨基酸数目的值。在该实施例中,样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在的阳性鉴定可以基于样本中每种标记的氨基酸类型的氨基酸数目。
如果将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸浓度或n个氨基酸的已知标记值绘制为其浓度的函数,则这提供了n维空间中的线,由此可以使用该线的方程确定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度。在一些实施例中,该线起源于原点。在替代实施例中,该线包含对应于已知浓度范围内的浓度的氨基酸浓度或已知标记值。样本中标记的氨基酸类型的氨基酸浓度或测量的标记在n维空间中呈一个点。可以将样本的点与n维空间中的线进行比较,以鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
例如,如果存在4种目的蛋白质;蛋白质-A、蛋白质-B、蛋白质-C和蛋白质-D以2维空间表示,其中一维和二维分别是半胱氨酸(C)和色氨酸(W)的标记值。在样本中标记并且测量半胱氨酸(C)和色氨酸(W)氨基酸类型。图1将样本中标记为2维空间中的点的半胱氨酸(C)和色氨酸(W)氨基酸类型的测量的标记值相对于分别表示为4种目的蛋白质中每一种的2维空间中的线的半胱氨酸(C)和色氨酸(W)的已知标记值绘制。将半胱氨酸(C)和色氨酸(W)氨基酸类型的已知标记值绘制为目的蛋白质的蛋白质浓度的函数;蛋白质-A、蛋白质-B、蛋白质-C和蛋白质-D。对于四种目的蛋白质中的每一种,已知的标记值在2维空间中呈不同的线。
在一些实施例中,该线是参考线。在图1中,四种目的蛋白质中的每一种的参考线上的每个点对应于相应目的蛋白质的浓度。当目的蛋白质的蛋白质浓度增加时,由其参考线提供的每种氨基酸类型的已知标记值从其原点进一步移动。用阴影圆圈示出对应于1μM的每种目的蛋白质的浓度的点。测量样本中每个半胱氨酸(C)和色氨酸(W)氨基酸类型的标记值,并且用空心方块示出该点。在一些实施例中,计算样本点和每条参考线之间的最短距离。
在一些实施例中,样本点位于目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考线上。鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,以及目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度是这样的浓度,对于该浓度,样本中标记的两种或更多种氨基酸类型中的每一种的标记或氨基酸浓度的测量值等同于样本中标记的相同的两种或更多种氨基酸类型中的每一种的标记或氨基酸浓度的已知值。
在其它实施例中,样本点不在参考线上,并且计算样本点和参考线之间的距离。在一些实施例中,该距离是连接样本点和参考线的向量或线段到参考线的长度。样本点最接近目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考线上的单个点,对应于单个浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的n种氨基酸类型的标记的氨基酸浓度或已知值。
在一些实施例中,如果样本点与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考线上的该最近点之间的距离小于或等于误差容限,则在样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在。在一些实施例中,误差容限是距离阈值。如果在样本中鉴定了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,则它以样本点最接近的参考线上的点的蛋白质浓度存在。
在图1中,样本点和对应于四种目的蛋白质的四条参考线之间的最短距离是样本点和蛋白质-B的参考线之间的距离。鉴定样本中目的蛋白质-B的蛋白质的存在。目的蛋白质-B的蛋白质的参考线上的每个点示出了目的蛋白-B的蛋白质的不同蛋白质浓度的半胱氨酸(C)和色氨酸(W)氨基酸类型的标记值。样本被鉴定为提供最小距离的蛋白质-B参考线上的点的蛋白质浓度。此处,样本的蛋白质浓度为0.5μM。因此,可以对样本中的目的蛋白质-B的蛋白质进行阳性鉴定,并且同时确定样本中0.5μM的目的蛋白质B的蛋白质的浓度。
在一些实施例中,如果样本的摩尔蛋白质浓度是已知的并且因此样本中的两种或更多种氨基酸类型的氨基酸数目的值是可用的,则将相同的对应两种氨基酸类型的氨基酸数目绘制在n维空间中,从而为每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组提供点。每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组仅有一个点。因此,可以将样本的点与每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的点进行比较,并且如果样本的点与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的点相同,则在样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在。在一些实施例中,可以计算样本点与每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的点之间的距离,并且如果样本点与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的点之间的距离小于或等于误差容限,则在样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在。
在一些实施例中,如果样本中每种标记的氨基酸类型的测量的标记和/或浓度和/或氨基酸数量与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或亚蛋白质组中的样本中标记的相同氨基酸类型的已知标记值和/或浓度和/或氨基酸数目相等或在其误差容限内,则可以对样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量进行阳性鉴定。例如,如果样本中色氨酸(W)氨基酸的氨基酸浓度和赖氨酸(K)氨基酸的氨基酸浓度与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的色氨酸(W)氨基酸的氨基酸浓度和赖氨酸(K)氨基酸的氨基酸浓度相等或在其误差容限内,则可以对样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量进行阳性鉴定。
在一些实施例中,计算样本中标记的两种或更多种氨基酸类型的标记、氨基酸浓度或氨基酸数目的测量值与为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组提供的两种或更多种氨基酸类型的标记、氨基酸浓度或氨基酸数目的已知值之间的最小距离,并且将该距离与误差容限进行比较。
在一些实施例中,为一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种提供的两种或更多种氨基酸类型的已知标记值、氨基酸浓度和/或氨基酸数目是参考。在一些实施例中,参考是从数据库获得的。替代地,可以计算参考。
必须将样本中每种标记的氨基酸类型的单元(即测量的标记、氨基酸浓度和/或氨基酸数目)与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)中相同氨基酸类型的相同单元(即已知的标记值、氨基酸浓度和/或氨基酸数目)进行比较。例如,如果在样本中确定了W和Y的氨基酸数目,则必须将其与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)中的W和Y的氨基酸数目进行比较,以便将样本的单元(氨基酸数目)与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同单元(氨基酸数目)进行比较。如果确定样本中W和Y的氨基酸浓度,则必须将其与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)中W和Y的氨基酸浓度进行比较,从而将样本的单元(氨基酸浓度)与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同单元(氨基酸浓度)进行比较。如果样本中W和Y的测量的标记不用于确定样本中W和Y的氨基酸浓度或氨基酸数目,则必须将样本中W和Y的测量的标记与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)的W和Y的已知标记值进行比较,使得样本的单元(测量的标记)与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同单元(已知标记值)进行比较。例如,将样本中W和Y的测量荧光强度与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)中W和Y的已知荧光强度进行比较。
在一些实施例中,如果对样本测量的单元(即测量的标记、氨基酸浓度和/或氨基酸数目)不同于目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的单元(即已知的标记值、氨基酸浓度和/或氨基酸数目),则将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的单元转换为对样本测量的相同单元。在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的特定氨基酸类型的氨基酸数目乘以蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度,以提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种氨基酸类型的氨基酸浓度。例如,如果在样本中测量了W和Y的氨基酸浓度,则将一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的W和Y氨基酸的数目转换为每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的W和Y的对应氨基酸浓度。这允许样本的该单元与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同单元进行比较,即样本中W和Y的测量氨基酸浓度与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中W和Y的氨基酸浓度进行比较。
在一些实施例中,根据每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列和/或关于翻译后修饰的任何实验信息计算一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中对应氨基酸类型的已知标记值、氨基酸浓度和/或氨基酸数目。在一些实施例中,使用氨基酸序列和/或关于每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的翻译后修饰的任何实验信息来计算一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的样本中标记的每种氨基酸类型的氨基酸数目。例如,如果样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则根据目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个蛋白质序列计算目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中色氨酸(W)氨基酸的数目和赖氨酸(K)氨基酸的数目。例如,如果样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),并且样本中目的蛋白质是牛血清白蛋白,则根据牛血清白蛋白的氨基酸序列计算牛血清白蛋白氨基酸序列中色氨酸(W)和赖氨酸(K)氨基酸的数目为2W和59K。作为另一实例,如果经由本文所公开的方法已知目的蛋白质在赖氨酸(K)氨基酸上具有3个翻译后修饰,使得这些赖氨酸氨基酸不与标记反应,则将-3添加到该目的蛋白质的赖氨酸氨基酸数目中。
在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列是已知的(例如,从数据库获得)。在一些实施例中,使用本领域的标准技术(例如埃德曼降解或质谱)确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列。
在一些实施例中,使用本文所公开的方法确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种标记的氨基酸类型的氨基酸数目,即标记两种或更多种氨基酸类型、测量标记并且使用测量的标记确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种氨基酸类型的氨基酸数目,或含有每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中每种氨基酸类型的氨基酸浓度。以这种方式,可以确定其氨基酸序列未知或不完全已知的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
在一些实施例中,它是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型中的每一种的数目,而不是蛋白质序列中两种或更多种氨基酸类型中的每一种的顺序或蛋白质序列中两种或更多种氨基酸类型中的每一种的相对组成,其用于计算一种或多种浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的这些氨基酸类型的对应氨基酸浓度和/或已知标记值。
已经发现,每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的标记或氨基酸浓度的已知值的独特特征可以根据每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度的共同参数用向量函数或参数方程组来提供。在一些实施例中,该向量函数或参数方程组描述并且用于计算本文所公开的参考线,使得参考线可以定量地与样本点比较以鉴定样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。参数方程组将一组量描述为被称为参数的共同自变量的函数。参数方程组可以替代地表示为等效向量函数,其可以简化以后的计算。将样本中测量的两种或更多种标记的氨基酸类型的标记或氨基酸浓度的值与相同的两种或更多种氨基酸类型的标记或氨基酸浓度的已知值进行比较,该已知值作为每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的(未知)浓度的函数提供,允许鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组以及同时鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度和/或量。任选地,这可以通过创建描述任何目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的向量函数或参数方程组来实现。
在一些实施例中,参数方程组提供了在目的蛋白质、肽、寡肽、多肽或蛋白质复合物中对两种或更多种氨基酸类型测量的氨基酸浓度的特征。描述目的蛋白质、肽、寡肽、多肽或蛋白质复合物的参数方程的数目是样本中标记和测量的两种或更多种氨基酸类型的数目。参数方程描述了在目的蛋白质、肽、寡肽、多肽或蛋白质复合物的样本中标记和测量的两种或更多种氨基酸类型中的每一种的氨基酸浓度作为浓度t的函数。参数方程组1为:
其中p
替代地,参数方程组1可以被共同描述为描述相同参考线或参考曲线的向量函数。这些表示是可互换的。在该表示中,向量函数1为:
其中p
例如,存在2种目的蛋白质和1种目的蛋白质复合物。第一种目的蛋白质是BSA。在样本中标记并且测量K(a
鸡蛋清溶菌酶(LYZ)是第二种目的蛋白质。a
甲状腺素运载蛋白是目的蛋白质复合物。a
BSA的向量方程提供了n维空间(3维空间,因为在实验中标记和测量了3种类型的氨基酸)中BSA的参考线,LYZ的向量方程提供了n维空间中LYZ的参考线,以及TTR的向量方程提供了n维空间中TTR的参考线。这些向量方程和对应的参考线与样本点一起绘制在图2中。为了鉴定样本中这些目的蛋白质或蛋白质复合物中的一种的存在和/或浓度和/或量,计算并且比较样本点与为BSA、LYZ和TTR提供的参考线中的每一条之间的距离。
先前,没有可用于鉴定样本内整个蛋白质组或亚蛋白质组的方法。需要经由分离样本中包含蛋白质组或亚蛋白质组的蛋白质、肽、寡肽、多肽和蛋白质复合物,然后依次鉴定蛋白质组或亚蛋白质组中的每种蛋白质、肽、寡肽、多肽和蛋白质复合物来鉴定样本内的蛋白质组或亚蛋白质组。
已经发现,为了鉴定蛋白质组、亚蛋白质组或其它混合物并且确定蛋白质组、亚蛋白质组或其它混合物的浓度或量,不必分离样本内的蛋白质组、亚蛋白质组或其它蛋白质混合物。已经发现,为了鉴定和确定蛋白质组、亚蛋白质组或其它混合物的浓度或量,不必鉴定蛋白质组、亚蛋白质组或其它混合物中的每种蛋白质。相反,仅需对样本中所含的蛋白质组、亚蛋白质组或其它混合物的两种或更多种氨基酸类型的氨基酸浓度、标记值或氨基酸数目进行一次测量。
已经发现,样本内的蛋白质组或亚蛋白质组可以替代地被认为是平均蛋白质序列,其氨基酸数目是蛋白质组或亚蛋白质组中每种蛋白质、肽、寡肽、多肽或蛋白质复合物序列的氨基酸数目的加权平均值,并且其在样本中的浓度是包含蛋白质组或亚蛋白质组的所有蛋白质、肽、寡肽、多肽或蛋白质复合物的总摩尔蛋白质浓度。可以以这种方式鉴定和定量样本内的未分离的蛋白质组或亚蛋白质组,因为已经发现这些特征对于每种蛋白质组和亚蛋白质组是独特的。不计算该平均蛋白质序列内的氨基酸顺序,并且每个此类平均蛋白质序列内的两种或更多种氨基酸类型的氨基酸数目对于所有蛋白质组和亚蛋白质组是独特的。例如,每个平均蛋白质序列中两种或更多种氨基酸类型的氨基酸数目对于所有已知的细菌蛋白质组和所有已知的病毒蛋白质组是独特的(图3)。7581种已知的细菌参考蛋白质组和9377种已知的病毒参考蛋白质组证明了这一点。参考蛋白质组是完整的蛋白质组。因此,所有已知的细菌蛋白质组和所有已知的病毒蛋白质组具有不同的特征,使用本发明的方法可以容易地在样本内检测到该特征,而无需将包含蛋白质组的蛋白质、肽、寡肽、多肽或蛋白质复合物彼此分离。这是违反直觉的结果,因为尽管预期蛋白质组内的蛋白质、寡肽、多肽和蛋白质复合物的两种或更多种氨基酸类型的氨基酸数目将根据分布而变化,但预期每个蛋白质组的分布平均值将聚集在由生物功能决定的单个值周围。此外,蛋白质组中两种或更多种氨基酸类型的氨基酸的平均数不遵循趋势x=y=z,表明这种可变性不能由蛋白质、寡肽、多肽和蛋白质复合物序列在蛋白质组中的平均长度的差异来解释。
目前诊断感染诸如SARS-CoV-2感染的方法依赖于逆转录聚合酶链式反应(RT-PCR)来(通常定性)确定患者样本中的SARS-CoV-2RNA。然而,这些检验具有30%的假阴性率,这对患者护理、感染控制和建模具有显著的后果。
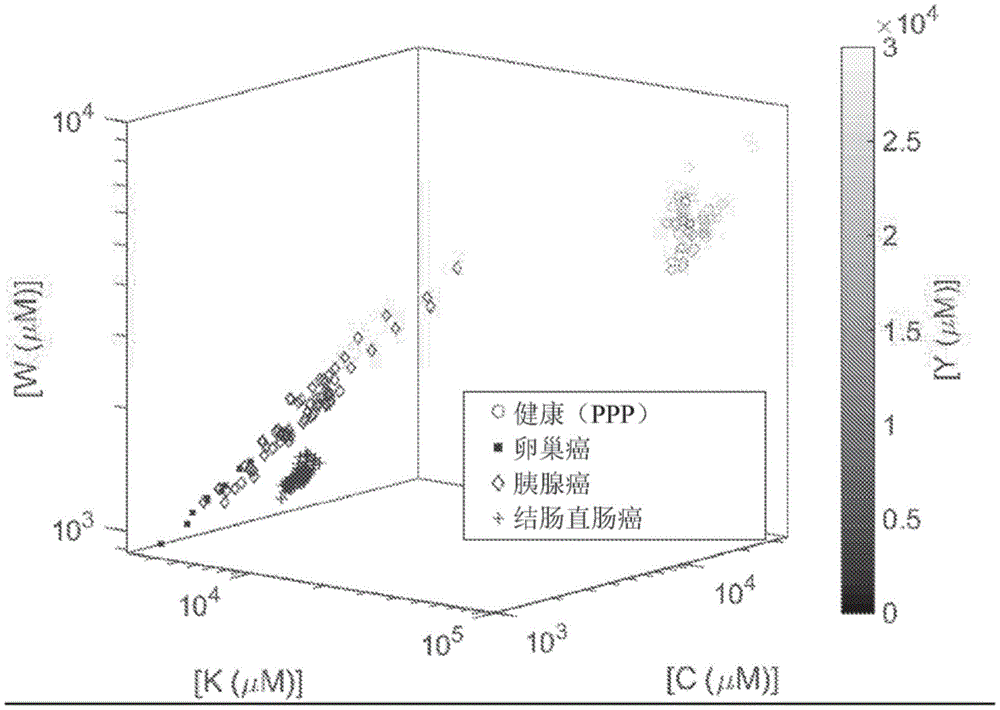
除了提供快速诊断任何感染的新方法外,本发明的方法还可以用于鉴定患者样本中疾病相关的目的亚蛋白质组的存在和/或浓度和/或量。例如,可以在唾液中鉴定和定量1型糖尿病的亚蛋白质组学特征。在一些实施例中,可以在血浆样本中鉴定和定量人卵巢癌、人胰腺癌、人前列腺癌或人结肠直肠癌的亚蛋白质组学特征。在一些实施例中,可以在尿样本中鉴定和定量人膀胱癌、人前列腺癌或人肾癌的亚蛋白质组学特征。
在一些实施例中,当一个或多个亚蛋白质组或蛋白质组是目的亚蛋白质组或蛋白质组时,则特定氨基酸类型的氨基酸数目是目的亚蛋白质组或蛋白质组中所有蛋白质中特定氨基酸类型的氨基酸的加权平均数。例如,如果样本中标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),并且样本中目的蛋白质组是SARS-CoV-2蛋白质组,则根据SARS-CoV-2蛋白质组的氨基酸序列计算SARS-CoV-2蛋白质组的所有蛋白质的平均氨基酸序列中色氨酸(W)的加权平均数和赖氨酸(K)氨基酸的加权平均数为11.3W和60.6K。
已经发现任何目的蛋白质组或亚蛋白质组可以通过参数方程组来描述。在一些实施例中,参数方程提供了对蛋白质组或亚蛋白质组中两种或更多种氨基酸类型测量的氨基酸浓度的特征。取决于浓度的共同参数的参数方程组是参数方程组2并且采取以下形式:
其中p
为目的蛋白质组或亚蛋白质组提供的氨基酸浓度的独特特征可以使用向量函数2等效地描述:
其中p
在一些实施例中,目的蛋白质组或亚蛋白质组中与样本中标记和测量的相同的两种或更多种氨基酸类型中的每一种的氨基酸平均数是与样本中标记和测量的相同的两种或更多种氨基酸类型中的每一种的氨基酸的加权平均数。在一些实施例中,加权平均值的权重由目的蛋白质组或亚蛋白质组中蛋白质序列总数内该蛋白质序列的比例提供。例如,每个蛋白质组的色氨酸(W)氨基酸的加权平均数等于每个蛋白质序列的色氨酸氨基酸的数目乘以包含目的蛋白质组或亚蛋白质组的所有蛋白质序列中该蛋白质序列的比例的线性组合,并且每个蛋白质组的赖氨酸(K)氨基酸的加权数目等于每个蛋白质序列的色氨酸氨基酸的数目乘以包含目的蛋白质组或亚蛋白质组的所有蛋白质序列中该蛋白质序列的比例的线性组合。
将对样本中两种或更多种标记的氨基酸类型测量的氨基酸浓度与对一种或多种目的蛋白质组或亚蛋白质组提供的相同的两种或更多种氨基酸类型的氨基酸浓度进行比较。这允许将样本鉴定为目的蛋白质组或亚蛋白质组中的一种,以及确定样本中存在的目的蛋白质组或亚蛋白质组的浓度或量。
在一些实施例中,两种或更多种氨基酸类型中的每一种的浓度是每种目的蛋白质、肽、寡肽、多肽或蛋白质复合物的标记的氨基酸类型的浓度。在一些实施例中,每种目的蛋白质组或亚蛋白质组的两种或更多种氨基酸类型中的每一种的浓度是在目的蛋白质组或亚蛋白质组中的蛋白质上标记的氨基酸类型的总浓度。这是因为氨基酸类型的浓度等于蛋白质组中每个序列的氨基酸平均数乘以蛋白质组的总蛋白质浓度。
通常,未知样本的摩尔蛋白质浓度是未知的,因为如果使用本领域的标准方法确定样本的吸收(A
在一些实施例中,样本的摩尔蛋白质浓度是已知的。使样本的已知摩尔蛋白质浓度为常数SC。因此,如果样本中存在目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p
其简化为n维空间中的点
这不再是参数方程组,因为它不是共同参数(自变量)的函数,因为变量t被替换为常数SC。在该实施例中,目的蛋白质的氨基酸浓度p
在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型中的每一种的氨基酸浓度用于用参数方程组确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型中的每一种的对应标记值。
这通过将校准函数或校准因子并入描述任何目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸浓度的参数方程中来实现,该校准函数或校准因子在每种氨基酸类型的测量的标记与每种氨基酸类型的氨基酸浓度之间转换。
在一些实施例中,参数方程经由参数方程组3将目的蛋白质、肽、寡肽、多肽或蛋白质复合物的标记值(例如标记的信号)的独特特征描述为其浓度t的函数:
其中p
构成参数方程组3的方程可以等效地共同描述为向量函数3:
其中p
在其它实施例中,描述任何浓度t下的目的蛋白质组或亚蛋白质组的标记值(例如标记的信号)的独特特征的参数方程是参数方程组4:
其中p
这个实施例中的参数方程组可以替代地使用向量函数4来共同地描述:
其中p
因此,已经发现,可以基于单独的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列,为任何目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组构建参数方程组或向量函数,描述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的标记值(例如信号)或氨基酸浓度的独特特征作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度的函数。例如,如果在样本中仅测量了W和Y的标记,并且未将其转换为样本中W和Y氨基酸类型的氨基酸浓度或数目,则将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中W和Y氨基酸的数目转换为W和Y的对应已知标记值,作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的未知浓度的函数。这允许将样本中W和Y的测量的标记与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中W和Y的已知标记值进行比较,并且确定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。在一些实施例中,不需要对样本测量的信号进行计算。
发现每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考线或参考曲线的向量形式允许直接计算目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度,其提供与样本中标记和测量的对应两种或更多种氨基酸类型最接近(即,样本点与参考线之间的距离最小化)的两种或更多种氨基酸类型的标记的已知值或氨基酸浓度。
这是通过求参考线的方向与样本点和参考线上的任何点之间的向量的点积,将点积设置为等于0,并且求解参考线的浓度来实现的,该浓度提供了样本点与参考线之间的垂直线。点积是表示两个向量A和B之间的角度关系的标量值,即
在一些实施例中,如果样本点小于或等于多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的误差容限或距离阈值,则在样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物。如果混合物中的组分占混合物的较大比例,则其特征对样本特征的影响将大于混合物中占较小比例的组分的特征。混合物中组分的比例也可使用本发明的方法获得。通过比较样本与鉴定为存在于样本中的每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组之间的距离来计算混合物中每种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的比例,其中较小距离指示混合物中该组分的较大比例。在一些实施例中,比较对于混合物的每个鉴定的组分,根据样本点到参考线计算的距离。发现混合物中每种组分的比例由混合物中各种鉴定的组分的归一化距离的倒数确定。计算所有鉴定的组分的最大距离,并且将其除以每个鉴定的组分的距离。在一些实施例中,通过用混合物内所有组分的逆归一化距离的总和除以其逆归一化距离来计算混合物内鉴定的组分的比例。
本发明的方法不需要为了鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量而确定氨基酸序列中氨基酸的顺序(即位置)。本发明的方法不需要为了鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量而确定样本中蛋白质内的氨基酸序列。
本发明的方法可以提供目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考,其使用本文所公开的式用代数方法描述。在参考中存在变量,该变量是蛋白质浓度。该参考提供了氨基酸浓度或荧光强度,其将用于测量目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的任何浓度。当鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组时,该特征使定量目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组成为可能。因此,本文所公开的方法提供了定量技术。
条款
代表性特征在以下条款中陈述,其独立于说明书的文本和/或附图中所公开的一个或多个特征或可以与说明书的文本和/或附图中所公开的一个或多个特征以任何组合来组合。
1a.一种鉴定样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1b.一种诊断样本中的细菌和/或病毒和/或寄生虫病的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的一种或多种目的细菌、病毒和/或寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与一种或多种目的病毒、细菌和/或寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较以鉴定所述样本中一种或多种目的细菌、病毒和/或寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量来鉴定所述样本中的细菌和/或病毒和/或寄生虫病。
1c.一种鉴定样本中一种或多种细菌蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记、氨基酸浓度或氨基酸数目与一种或多种浓度的一种或多种目的细菌蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的已知标记值或氨基酸浓度,或所述一种或多种目的细菌蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的氨基酸数目进行比较来鉴定所述样本中一种或多种细菌蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1d.一种鉴定样本中一种或多种病毒蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的一种或多种目的病毒蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的病毒蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中一种或多种目的病毒蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1e.一种鉴定样本中一种或多种寄生虫蛋白质、肽、寡肽、多肽、蛋白复合物、亚蛋白质组或蛋白质组的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的一种或多种目的寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中一种或多种目的寄生虫蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1f.一种鉴定样本中一种或多种人蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的一种或多种目的人蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的人蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中一种或多种目的人蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1g.一种检测感染或鉴定宿主响应感染的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的与感染或宿主响应感染有关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述与感染或宿主响应感染有关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中与感染或宿主响应感染有关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
1h.一种检测癌症的方法,所述方法包含:
a)标记所述样本内的两种或更多种氨基酸类型,其中氨基酸类型由氨基酸的R基团定义;
b)测量所述样本中每种标记的氨基酸类型的标记;
c)任选地根据测量的标记计算每种标记的氨基酸类型的氨基酸浓度;
d)任选地计算每种标记的氨基酸类型的氨基酸数目;以及
e)通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种浓度的与癌症有关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述与癌症有关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中与癌症有关的一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
2.根据条款1a至1h中任一项所述的方法,其中所述样本是体液样本。
3.根据条款2所述的方法,其中所述体液样本是全血样本、血清样本、血浆样本、唾液样本、痰样本、粪便样本、尿样本、精液样本、鼻拭子样本、鼻咽吸出物样本、咽拭子、下呼吸道样本、脑脊液(CSF)样本、母乳样本、性健康样本或组织样本或由病变产生的流体。
4.根据条款3所述的方法,其中所述性健康样本是尿道拭子、子宫颈拭子、阴道拭子或直肠拭子。
4a.根据条款2所述的方法,其中所述样本是血液样本或尿样本。
5.根据条款3所述的方法,其中所述下呼吸道样本是下呼吸道粘液吸出物样本。
6.根据条款3所述的方法,其中所述组织样本是组织的活组织检查。
7.根据条款6所述的方法,其中所述组织样本是固态肿瘤。
8.根据条款6所述的方法,其中所述组织是肉瘤、淋巴瘤、癌和黑素瘤。
9.根据条款1a至1h中任一项所述的方法,其中所述样本是兽医样本。
10.根据条款9所述的方法,其中所述兽医样本是猫样本、犬样本、牛样本、猪样本、马样本、驴样本、绵羊样本、山羊样本、鱼样本、蟹样本、海藻提取物(corraline)样本、龙虾肌碱(homarine)样本、贝壳(ostracine)样本、爬虫类动物样本、禽类样本、鸡精蛋白样本、吐绶鸡(meleagrine)样本、鸭样本、鹅样本、鹿样本、野兔样本、兔样本、夜光虫(noctilionine)样本、鼠样本、跳蚤(pulicine)样本、蜱螨样本、伊蚊样本、猴样本或鳞甲目样本。
11.根据条款1a至1h中任一项所述的方法,其中所述样本是土壤样本、环境样本、作物样本、食品样本、饮料样本或实验室样本。
12.根据条款11所述的方法,其中所述环境样本是水样本,诸如饮用水样本或废水样本;或疑似生物战的样本;或天体生物学样本。
13.根据条款11所述的方法,其中所述食品样本是功能性食品样本。
14.根据条款13所述的方法,其中所述功能性食品样本是婴儿配方食品样本或运动营养样本。
15.根据条款11所述的方法,其中所述食品样本是膳食补充剂样本。
16.根据条款11所述的方法,其中所述食品样本是发酵食品样本。
17.根据条款11所述的方法,其中所述食品样本是乳品样本、蛋样本、明胶样本、大豆样本、小麦样本、蔬菜样本、豆类样本、坚果样本或酿造的大豆产品样本。
18.根据条款11所述的方法,其中所述食品样本疑似含有过敏原或细菌或病毒或寄生虫。
19.根据条款18所述的方法,其中所述食品样本是肉样本,并且所述肉样本疑似含有大肠杆菌(Escherichia Coli)、沙n氏菌(Salmonela)、金黄色葡萄球菌(StaphylococcusAureus)、单核细胞增生李斯特菌(Listeria Monocytogenes)、小肠结肠炎耶尔森氏菌(Yersinia Enterocolitica)、肠炎沙n氏菌(Salmonella Enteritidis)、空肠弯曲杆菌(Campylobacter Jejuni)、产气荚膜梭菌(Clostridium perfringens)、产气荚膜梭菌(Clostridium perfringens)、诺如病毒(Norovirus)、刚地弓形虫(Toxoplasma gondii)、绦虫(tapeworm)、蛔虫(roundworm)或异尖线虫(anisakis)。
20.根据条款18所述的方法,其中所述过敏原是花生、谷蛋白、乳糖、贝类、鱼、芝麻籽、花粉、酪蛋白、脂质运载蛋白、c型溶菌酶、蛋白酶抑制剂、原肌球蛋白、小清蛋白,猫皮屑或狗皮屑。
21.根据条款11所述的方法,其中所述饮料样本是奶样本、水样本、果汁样本、开菲乳样本或红茶菌(kombucha)样本。
22.根据条款1a至1h中任一项所述的方法,其中所述样本是疫苗。
23.根据条款22所述的方法,其中所述样本是流感疫苗、SARS-CoV-2疫苗、6合1疫苗、肺炎球菌(Pneumococcal)疫苗、MenB疫苗、Hib/MenC疫苗、MMR疫苗、4合1学龄前加强疫苗、HPV疫苗、3合1青少年加强疫苗、破伤风疫苗、带状疱疹疫苗、BCG(TB)疫苗、B型肝炎疫苗或水痘疫苗。
24.根据条款1至23中任一项所述的方法,其中一种或多种目的蛋白质或肽选自由以下组成的组:α-突触核蛋白、溶菌酶、牛血清白蛋白、卵清蛋白、β-乳球蛋白、胰岛素、胰高血糖素、淀粉样蛋白β、血管紧张素转换酶2、血管紧张素转换酶、缓激肽、脊索蛋白样蛋白质1、肿瘤坏死因子β、骨调节蛋白前体、基质金属蛋白酶、多效生长因子、分泌粒蛋白-3、人生长激素、胰岛素样生长因子1、瘦蛋白、端粒酶、促甲状腺激素及其任何组合。
25.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种人蛋白质组。
26.根据条款25所述的方法,其中所述一种或多种人蛋白质组选自由以下组成的组:人血浆蛋白质组、人眼蛋白质组、视网膜、心脏、骨骼肌、平滑肌、肾上腺、甲状旁腺、甲状腺、垂体、肺、骨髓、淋巴组织、肝、胆囊、睾丸、附睾、前列腺、精囊、输精管、脂肪组织、脑、唾液腺、食道、舌、胃、肠、胰腺、肾、膀胱、乳房、阴道、子宫颈、子宫内膜、输卵管、卵巢、胎盘、皮肤或血液蛋白质组、人代谢蛋白质组、人分泌蛋白质组、干细胞蛋白质组、红细胞蛋白质组、嗜中性粒细胞蛋白质组、嗜酸性粒细胞蛋白质组、嗜碱性粒细胞蛋白质组、单核细胞蛋白质组、淋巴细胞蛋白质组、神经元蛋白质组,神经胶质蛋白质组、骨骼肌蛋白质组、心肌蛋白质组、平滑肌蛋白质组、软骨细胞蛋白质组、成骨细胞蛋白质组、破骨细胞蛋白质组、骨细胞蛋白质组、骨内膜细胞蛋白质组、角化细胞蛋白质组、黑素细胞蛋白质组、梅克尔细胞蛋白质组、朗格汉斯细胞蛋白质组、内皮细胞蛋白质组、上皮细胞蛋白质组、白色脂肪细胞蛋白质组、褐色脂肪细胞蛋白质组、上呼吸道细胞蛋白质组、精细胞蛋白质组或卵细胞蛋白质组,及其任何组合。
27.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种人癌亚蛋白质组和/或蛋白质组。
28.根据条款27所述的方法,其中一种或多种人癌蛋白质组和/或亚蛋白质组选自由以下组成的组:人胰腺癌蛋白质组、人神经胶质瘤蛋白质组、人头颈蛋白质组、人甲状腺蛋白质组、人肺蛋白质组、人肝蛋白质组、人睾丸蛋白质组、人前列腺蛋白质组、人胃蛋白质组、人结肠/直肠蛋白质组、人乳房蛋白质组、人子宫内膜蛋白质组、人卵巢蛋白质组、人子宫颈蛋白质组、人胰腺蛋白质组、人肾蛋白质组、人泌尿和膀胱蛋白质组、人黑素瘤蛋白质组、人I型糖尿病亚蛋白质组、人II型糖尿病亚蛋白质组、阿尔茨海默病亚蛋白质组、人帕金森氏病亚蛋白质组、人路易体痴呆亚蛋白质组、人痴呆亚蛋白质组、人代谢综合征亚蛋白质组、人肥胖亚蛋白质组、人心血管疾病亚蛋白质组、人唐氏综合征亚蛋白质组、人衰老亚蛋白质组、人细胞因子亚蛋白质组、人免疫亚蛋白质组、对细菌感染响应的人亚蛋白质组、对病毒感染响应的人亚蛋白质组、对冠状病毒感染响应的人亚蛋白质组、对SARS-CoV-2感染响应的人亚蛋白质组、对SARS-CoV-2感染响应的人亚蛋白质组,其包括IFN、IL-6、ILiRA、CCL2、CCL8CXCL2、CXCL8、CXCL9,和CXCL16及其任何组合。
28a.根据条款28所述的方法,其中一种或多种癌蛋白质组选自由以下组成的组:人卵巢癌蛋白质组、人胰腺癌蛋白质组、人结肠直肠癌蛋白质组、人膀胱癌蛋白质组、人前列腺癌蛋白质组、人肾癌蛋白质组。
28b.根据条款27所述的方法,其中在所述样本中检测到1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25个人癌蛋白质组,所述人癌蛋白质组选自由以下组成的组:胰腺癌、结肠直肠癌、人神经胶质瘤、头颈癌、甲状腺癌、肺癌、肝癌、睾丸癌、前列腺癌、胃癌、结肠/直肠癌、乳腺癌、子宫内膜癌、卵巢癌、宫颈癌、肾脏癌、肾癌、淋巴瘤、膀胱癌、人黑素瘤、脑癌、子宫内膜癌、白血病、泌尿道上皮癌及其任何组合。
28c.根据条款27、28a或28b所述的方法,其中所述方法确定所述样本中一种或多种癌蛋白质组的量,并且癌症的量是指所述样本中所述癌症的阶段或等级。
28d.根据条款28c所述的方法,其中所述阶段是阶段I、阶段II、阶段III或阶段IV,或TNM分期系统,诸如T1、T2、T3、T4、N0、N1、N2、N3、M0或M1。
28e.根据条款28c所述的方法,其中所述等级是I级、II级或III级。
28f.根据条款27、28a或28b所述的方法,其中所述癌症的存在是指所述癌症在患者体内的位置。
29.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种病毒蛋白质组。
30.根据条款29所述的方法,其中所述一种或多种病毒蛋白质组选自由以下组成的组:人乳头瘤病毒(HPV)蛋白质组、人免疫缺陷病毒(HIV)蛋白质组、正粘病毒科(Orthomyxoviridae)蛋白质组、爱泼斯坦巴尔(Epstein Barr)蛋白质组、埃博拉病毒(Ebolavirus)蛋白质组、狂犬病毒属(Rabies lyssavirus)蛋白质组、冠状病毒属(Coronovirus)蛋白质组、诺如病毒(Novovirus)蛋白质组、A型肝炎蛋白质组、B型肝炎蛋白质组、C型肝炎蛋白质组、E型肝炎蛋白质组、丁型肝炎蛋白质组、疱疹病毒蛋白质组、乳头瘤病毒蛋白质组、鼻病毒属蛋白质组、麻疹病毒蛋白质组、腮腺炎病毒蛋白质组、脊髓灰质炎病毒蛋白质组、狂犬病蛋白质组、轮状病毒蛋白质组、西尼罗病毒蛋白质组、黄热病病毒蛋白质组、寨卡病毒蛋白质组、有尾噬菌体目(Caudovirales)蛋白质组、线头病毒科(Nimaviridae)蛋白质组、核糖病毒域(Riboviria)蛋白质组、丝形病毒科(Inoviridae)蛋白质组、小纺锤形噬菌体科(Fuselloviridae)蛋白质组、疱疹病毒目(Herpesvirales)蛋白质组、非洲猪瘟病毒科(Asfarviridae)蛋白质组、双尾病毒科(Bicaudaviridae)蛋白质组、结核病蛋白质组、牛结核病蛋白质组及其任何组合。
31.根据条款30所述的方法,其中所述正粘病毒科蛋白质组是流感蛋白质组。
32.根据条款30所述的方法,其中所述流感蛋白质组是A型流感蛋白质组、A型流感亚型H1N1蛋白质组、B型流感蛋白质组、C型流感蛋白质组和/或D型流感蛋白质组,或其任何组合。
33.根据条款30所述的方法,其中所述冠状病毒蛋白质组是SARS-CoV-2蛋白质组、SARS-CoV蛋白质组,和/或MERS-CoV蛋白质组。
34.根据条款33所述的方法,其中所述冠状病毒蛋白质组是所述SARS-CoV-2蛋白质组及其任何突变。
35.根据条款1至34中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种细菌蛋白质组。
36.根据条款35所述的方法,其中所述一种或多种细菌蛋白质组选自由以下组成的组:大肠杆菌(Escherichia coli,E.coli)蛋白质组、铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)蛋白质组、沙n氏菌蛋白质组、金黄色葡萄球菌蛋白质组、鲍氏不动杆菌(Acinetobacter baumannii)蛋白质组、脆弱拟杆菌(Bacteroides fragilis)蛋白质组、洋葱伯克霍尔德菌(Burkholderia cepacia)蛋白质组、艰难梭菌(Clostridiumdifficile)蛋白质组、索氏梭菌(Clostridium sordellii)蛋白质组、肠杆菌科(Enterobacteriaceae)蛋白质组、粪肠球菌(Enterococcus faecalis)蛋白质组、肺炎克雷伯氏菌(Klebsiella pneumoniae)蛋白质组、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus)蛋白质组、摩氏摩根氏菌(Morganella morganii)蛋白质组、分枝杆菌(Mycobacterium)蛋白质组及其任何组合。
37.根据条款36所述的方法,其中所述分枝杆菌蛋白质组是结核分枝杆菌蛋白质组。
38.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种寄生虫蛋白质组。
39.根据条款38所述的方法,其中所述一种或多种寄生虫蛋白质组选自由以下组成的组:疟原虫(Plasmodium)蛋白质组、刚地弓形虫蛋白质组、阴道毛滴虫(Trichomonasvaginalis)蛋白质组、十二指肠贾第虫(Giardia duodena1is)蛋白质组、隐孢子虫(Cryptosporidium)蛋白质组或其任何组合。
40.根据条款39所述的方法,其中所述疟原虫蛋白质组是恶性疟原虫(Plasmodiumfalciparum)蛋白质组、诺氏疟原虫(Plasmodium knowlesi)蛋白质组、三日疟原虫(Plasmodium ma1ariae)蛋白质组、卵形疟原虫(Plasmodium ovale)蛋白质组和/或间日疟原虫(Plasmodium vivax)蛋白质组。
41.根据条款1a、1b、1e至1h所述的方法,其中一种或多种目的亚蛋白质组是所述宿主响应寄生虫蛋白质组。
42.根据条款1a、1g或1h所述的方法,其中所述一种或多种目的蛋白质组是古细菌蛋白质组。
43.根据条款1至41中任一项所述的方法,其中所述一种或多种目的蛋白质组是一种或多种细菌蛋白质组、一种或多种病毒蛋白质组和/或一种或多种寄生虫蛋白质组及其任何组合的混合物。
44.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是致病性蛋白质组。
45.根据条款44所述的方法,其中所述致病性蛋白质组是细菌蛋白质组和/或病毒蛋白质组。
46.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质是朊病毒。
47.根据条款46所述的方法,其中所述朊病毒引起克雅氏病(CJD)。
48.根据条款1至23中任一项所述的方法,其中所述一种或多种目的蛋白质组是任何目的细菌科内的蛋白质组。
49.根据条款1至23中任一项所述的方法,其中所述一种或多种目的亚蛋白质组是所述宿主响应细菌蛋白质组。
50.根据条款1至23中任一项所述的方法,其中在所述样本中检测细菌蛋白质组和宿主响应亚蛋白质组的存在。
51.根据条款29所述的方法,其中所述一种或多种目的病毒蛋白质组是兽医病毒蛋白质组。
52.根据条款51所述的方法,其中所述兽医病毒蛋白质组是弹状病毒属(Rhabdoviruse)蛋白质组、口蹄疫病毒蛋白质组、瘟病毒属蛋白质组、动脉炎病毒属(Arteriviruses)蛋白质组、冠状病毒蛋白质组、凸隆病毒(Toroviruse)蛋白质组、流感蛋白质组、蓝舌病病毒或圆环病毒属蛋白质组及其任何组合。
53.根据条款52所述的方法,其中所述流感蛋白质组是禽流感蛋白质组或猪流感蛋白质组。
54.根据条款52所述的方法,其中环状病毒蛋白质组是疱疹病毒蛋白质组、非洲猪瘟病毒蛋白质组、逆转录病毒蛋白质组、黄病毒蛋白质组、副粘病毒蛋白质组或帕洛病毒(Parlovirus)蛋白质组。
55.根据条款1至54中任一项所述的方法,其中所述两种或更多种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V),或合成氨基酸,其N-末端和C-末端,及其任何组合。
56.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
57.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自由以下组成的组:精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)及其任何组合。
58.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
59.根据条款55所述的方法,其中在所述样本内标记的所述两种或更多种氨基酸类型选自由以下组成的组:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)、赖氨酸(K)、精氨酸(R)、组氨酸(H)、脯氨酸(P)、天冬氨酸(D)、谷氨酸(E)、天冬酰胺(B)、谷氨酰胺(Q)、丝氨酸(S)或苏氨酸(T)及其任何组合。
60.根据条款55所述的方法,其中在所述样本内标记的所述两种或更多种氨基酸类型选自由以下组成的组:赖氨酸和色氨酸;半胱氨酸(C)和色氨酸(W);赖氨酸(K)和半胱氨酸(C);赖氨酸(K)和酪氨酸(Y);半胱氨酸(C)和酪氨酸(Y);色氨酸(W)和酪氨酸(Y);亮氨酸(L)和丝氨酸(S);亮氨酸(L)和赖氨酸(K);谷氨酸(E)和亮氨酸(L);甘氨酸(G)和亮氨酸(L);丙氨酸(A)和亮氨酸(L);天冬氨酸(D)和亮氨酸(L);亮氨酸(L)和丝氨酸(S);亮氨酸(L)和脯氨酸(P);亮氨酸(L)和缬氨酸(V);赖氨酸(K)和丝氨酸(S);谷氨酸(E)和亮氨酸(L);丙氨酸(A)和精氨酸(R);丙氨酸(A)和谷氨酸(E);丙氨酸(A)和甘氨酸(G);或丙氨酸(A)和异亮氨酸(I)。
61.根据条款55所述的方法,其中在所述样本内标记的所述两种或更多种氨基酸类型选自由以下组成的组:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)、赖氨酸(K)、精氨酸(R)、组氨酸(H)、脯氨酸(P)、天冬氨酸(D)、谷氨酸(E)、天冬酰胺(B)和/或谷氨酰胺(Q)及其任何组合。
62.根据条款55所述的方法,其中在所述样本内标记的所述两种或更多种氨基酸类型选自由以下组成的组:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)和/或赖氨酸(K)及其任何组合。
63.根据条款55所述的方法,其中两种或更多种氨基酸选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或天冬氨酸(D)及其任何组合。
64.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或谷氨酸(E)及其任何组合。
65.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或谷氨酰胺(Q)及其任何组合。
66.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、色氨酸(W)和/或天冬氨酸(D)及其任何组合。
67.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:赖氨酸(K)、精氨酸(R)、组氨酸(H)和/或天冬氨酸(D)及其任何组合。
68.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:赖氨酸(K)、色氨酸(W)、精氨酸(R)和/或谷氨酸(E)及其任何组合。
69.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和/或天冬氨酸(D)及其任何组合。
70.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和/或谷氨酸(E)及其任何组合。
71.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:脯氨酸(P)、半胱氨酸(C),精氨酸(R)和/或谷氨酸(E)及其任何组合。
72.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和/或天冬氨酸(D)及其任何组合。
73.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和/或天冬氨酸(D)及其任何组合。
74.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和/或谷氨酸(E)及其任何组合。
75.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:赖氨酸(K)、天冬酰胺(B)、色氨酸(W)和/或半胱氨酸(C)及其任何组合。
76.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、组氨酸(H)、脯氨酸(P)和/或天冬氨酸(D)及其任何组合。
77.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或天冬氨酸(D)及其任何组合。
78.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或谷氨酸(E)及其任何组合。
79.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或色氨酸(W)及其任何组合。
80.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或酪氨酸(Y)及其任何组合。
81.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或色氨酸(W)及其任何组合。
82.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或半胱氨酸(C)及其任何组合。
83.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或酪氨酸(Y)及其任何组合。
84.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、半胱氨酸(C)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。
85.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:精氨酸(R)、半胱氨酸(C)、色氨酸(W)和/或脯氨酸(P)及其任何组合。
86.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:色氨酸(W)、半胱氨酸(C)和/或赖氨酸(K)及其任何组合。
87.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:赖氨酸(K)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。
88.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:色氨酸(W)、酪氨酸(Y)和/或半胱氨酸(C)及其任何组合。
89.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:色氨酸(W)、酪氨酸(Y)和/或赖氨酸(K)及其任何组合。
90.根据条款55所述的方法,其中所述两种或更多种氨基酸类型选自:半胱氨酸(C)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。
91.根据条款1a至1h所述的方法,其中在样本内2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40种氨基酸类型被标记。
92.根据条款91所述的方法,其中2种氨基酸类型被标记。
93.根据条款92所述的方法,其中标记的2种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
94.根据条款92所述的方法,其中所述2种氨基酸类型是亮氨酸(L)和丝氨酸(S)。
95.根据条款92所述的方法,其中所述2种氨基酸类型是亮氨酸(L)和赖氨酸(K)。
96.根据条款92所述的方法,其中所述2种氨基酸类型是亮氨酸(L)和谷氨酸(E)。
97.根据条款92所述的方法,其中2种酸类型是甘氨酸(G)和亮氨酸(L)。
98.根据条款92所述的方法,其中所述2种氨基酸类型是丙氨酸(A)和亮氨酸(L)。
99.根据条款92所述的方法,其中所述2种氨基酸类型是天冬氨酸(D)和亮氨酸(L)。
100.根据条款92所述的方法,其中所述2种氨基酸类型是亮氨酸(L)和脯氨酸(P)。
101.根据条款92所述的方法,其中所述2种氨基酸类型是亮氨酸(L)和缬氨酸(V)。
102.根据条款92所述的方法,其中所述2种氨基酸类型是赖氨酸(K)和丝氨酸(S)。
103.根据条款92所述的方法,其中所述2种氨基酸类型是谷氨酸(E)和亮氨酸(L)。
104.根据条款92所述的方法,其中所述2种氨基酸类型是丙氨酸(A)和精氨酸(R)。
105.根据条款92所述的方法,其中2种氨基酸是丙氨酸(A)和谷氨酸(E)。
106.根据条款92所述的方法,其中所述2种氨基酸是丙氨酸(A)和甘氨酸(G)。
107.根据条款91所述的方法,其中3种氨基酸类型被标记。
108.根据条款107所述的方法,其中标记的3种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
109.根据条款107所述的方法,其中所述标记的3种氨基酸类型是色氨酸(W)、半胱氨酸(C)和酪氨酸(Y)。
110.根据条款107所述的方法,其中所述标记的3种氨基酸类型是半胱氨酸(C)、酪氨酸(Y)和赖氨酸(K)。
111.根据条款107所述的方法,其中所述3种氨基酸类型是色氨酸(W)、半胱氨酸(C)和赖氨酸(K)。
112.根据条款107所述的方法,其中所述3种氨基酸类型是赖氨酸(K)、色氨酸(W)和酪氨酸(Y)。
113.根据条款107所述的方法,其中所述3种氨基酸类型是色氨酸(W)、酪氨酸(Y)和半胱氨酸(C)。
114.根据条款107所述的方法,其中所述3种氨基酸类型是色氨酸(W)、酪氨酸(Y)和赖氨酸(K)。
115.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:半胱氨酸(C)、色氨酸(W)和酪氨酸(Y)。
116.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:天冬酰胺(R)、谷氨酸(E)和甘氨酸(G)。
117.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和丝氨酸(S)。
118.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:天冬酰胺(A)、谷氨酸(E)和亮氨酸(L)。
119.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、天冬氨酸(D)和亮氨酸(L)。
120.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和脯氨酸(P)。
121.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、谷氨酸(E)和亮氨酸(L)。
122.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:亮氨酸(L)、丝氨酸(S)和缬氨酸(S)。
123.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:谷氨酸(E)、异亮氨酸(I)和脯氨酸(P)。
124.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:谷氨酸(E)、甘氨酸(G)和缬氨酸(V)。
125.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:精氨酸(R)、丝氨酸(S)和缬氨酸(V)。
126.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和赖氨酸(K)。
127.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、精氨酸(R)和亮氨酸(L)。
128.根据条款107所述的方法,其中所述标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和缬氨酸(V)。
129.根据条款91所述的方法,其中4种氨基酸类型被标记。
130.根据条款129所述的方法,其中标记的4种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
131.根据条款129所述的方法,其中所述标记的4种氨基酸类型是色氨酸(W)、酪氨酸(Y)、赖氨酸(K)和半胱氨酸(C)。
132.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和天冬氨酸(D)。
133.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和谷氨酸(E)。
134.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和谷氨酰胺(Q)。
135.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、色氨酸(W)和天冬氨酸(D)。
136.根据条款129所述的方法,其中所述标记的4种氨基酸类型是赖氨酸(K)、精氨酸(R)、组氨酸(H)和天冬氨酸(D)。
137.根据条款129所述的方法,其中所述标记的4种氨基酸类型是赖氨酸(K)、色氨酸(W)、精氨酸(R)和谷氨酸(E)。
138.根据条款129所述的方法,其中所述标记的4种氨基酸类型是酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和天冬氨酸(D)。
139.根据条款129所述的方法,其中所述标记的4种氨基酸类型是酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和谷氨酸(E)。
140.根据条款129所述的方法,其中所述标记的4种氨基酸类型是脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和谷氨酸(E)。
141.根据条款129所述的方法,其中所述标记的4种氨基酸类型是脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和天冬氨酸(D)。
142.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和天冬氨酸(D)。
143.根据条款129所述的方法,其中所述标记的4种氨基酸类型是半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和谷氨酸(E)。
144.根据条款129所述的方法,其中所述标记的4种氨基酸类型是赖氨酸(K)、天冬酰胺(B)、色氨酸(W)和半胱氨酸(C)。
145.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、组氨酸(H)、脯氨酸(P)和天冬氨酸(D)。
146.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和天冬氨酸(D)。
147.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和谷氨酸(E)。
148.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和色氨酸(W)。
149.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和酪氨酸(Y)。
150.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和色氨酸(W)。
151.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和半胱氨酸(C)。
152.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和酪氨酸(Y)。
153.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、半胱氨酸(C)、色氨酸(W)和酪氨酸(Y)。
154.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、半胱氨酸(C)、色氨酸(W)和脯氨酸(P)。
155.根据条款129所述的方法,其中所述标记的4种氨基酸类型是谷氨酰胺(Q)、亮氨酸(L)、赖氨酸(K)和缬氨酸(V)。
156.根据条款129所述的方法,其中所述标记的4种氨基酸类型是精氨酸(R)、异亮氨酸(I)、亮氨酸(L)和丝氨酸(S)。
157.根据条款129所述的方法,其中所述标记的4种氨基酸类型是丙氨酸(A)、天冬酰胺(N)、谷氨酸(E)和丝氨酸(S)。
158.根据条款91所述的方法,其中5种氨基酸类型被标记。
159.根据条款158所述的方法,其中标记的5种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
160.根据条款158所述的方法,其中所述标记的5种氨基酸类型是精氨酸(R)、谷氨酸(E)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。
161.根据条款158所述的方法,其中所述标记的5种氨基酸类型是精氨酸(R)、天冬氨酸(D)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。
162.根据条款158所述的方法,其中所述标记的5种氨基酸类型是精氨酸(R)、甘氨酸(G)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。
163.根据条款158所述的方法,其中所述标记的5种氨基酸类型是丙氨酸(A)、天冬氨酸(D)、甘氨酸(G)、丝氨酸和精氨酸(R)。
164.根据条款158所述的方法,其中所述标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、甘氨酸(G)、丝氨酸和精氨酸(R)。
165.根据条款158所述的方法,其中所述标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、硒代半胱氨酸(U)、丝氨酸和精氨酸(R)。
166.根据条款158所述的方法,其中所述标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、硒代半胱氨酸(U)、赖氨酸和精氨酸(R)。
167.根据前述条款中任一项所述的方法,其中两种或更多种标记的氨基酸类型中的每一种包含氨基酸类型的修饰的氨基酸和/或未修饰的氨基酸。
168.根据条款167所述的方法,其中氨基酸类型的所述修饰的氨基酸是所述氨基酸类型的翻译后修饰的氨基酸。
169.根据条款167或168所述的方法,其中4种氨基酸类型被标记并且所述4种氨基酸类型是半胱氨酸(C)、酪氨酸(Y)和赖氨酸(K)以及色氨酸(W),其中未修饰的半胱氨酸(CR)氨基酸以及修饰的和未修饰的半胱氨酸氨基酸都被标记。
170.根据条款167或168所述的方法,其中半胱氨酸的所述修饰的氨基酸是二硫化物键合的半胱氨酸(C
171.根据条款167或168所述的方法,其中精氨酸的所述修饰的氨基酸是N-糖基化精氨酸(Rg)氨基酸。
172.根据条款167或168所述的方法,其中所述天冬酰胺的所述修饰的氨基酸是N-糖基化天冬酰胺(Ng)氨基酸。
173.根据条款167或168所述的方法,其中赖氨酸的所述修饰的氨基酸是N6-(磷酸吡哆醛)赖氨酸(Kp)氨基酸。
174.根据条款167或168所述的方法,其中脯氨酸的所述修饰的氨基酸是4-羟基脯氨酸(Ph)氨基酸。
175.根据条款167或168所述的方法,其中丝氨酸的所述修饰的氨基酸是磷酸丝氨酸(Sp)氨基酸。
176.根据条款167或168所述的方法,其中苏氨酸的所述修饰的氨基酸是磷酸苏氨酸(Tp)氨基酸。
177.根据条款167或168所述的方法,其中丙氨酸的所述修饰的氨基酸是N-乙酰化丙氨酸(An)氨基酸。
178.根据条款167或168所述的方法,其中精氨酸的所述修饰的氨基酸是甲基化精氨酸(Rm)氨基酸。
179.根据条款167或168所述的方法,其中精氨酸的所述修饰的氨基酸是脱亚胺精氨酸(Ri)氨基酸。
180.根据条款167或168所述的方法,其中天冬酰胺的所述修饰的氨基酸是脱酰胺天冬酰胺(Qa)氨基酸。
181.根据条款167或168所述的方法,其中氨基酸类型的所述修饰的氨基酸是已经经由磷酸化、甲基化、乙酰化、酰胺化、脱酰胺、脱酰胺、吡咯烷酮羧酸形成、异构化、羟基化、硫酸化、黄素结合、半胱氨酸氧化、环化、亚硝基化、酰化、甲酰化、烷基化、精氨酰化、酰胺键形成、丁酰化、γ-羧化、糖基化、O-连接的糖基化、丙二酰化、羟基化、碘化、异肽键形成、核苷酸加成、N-乙酰化、N-肉豆蔻酰化、磷酸化、腺苷酰化、尿苷酰化(uridylylation)、丙酰化、焦谷氨酸形成、S-谷胱甘肽化、氧化、亚磺酰化、磺酰化、琥珀酰化、硫酸化、SUMO化、肉豆蔻酰化、棕榈酰化、异戊二烯化、异戊烯化、泛素化和glipyation及其任何组合进行翻译后修饰的氨基酸。
182.根据条款167或168所述的方法,其中氨基酸类型的修饰的和未修饰的氨基酸均被标记。
183.根据条款182所述的方法,其中氨基酸类型半胱氨酸(C)的所述修饰的和未修饰的氨基酸均被标记。
184.根据条款182所述的方法,其中氨基酸类型色氨酸(W)的所述修饰的和未修饰的氨基酸均被标记。
185.根据条款182所述的方法,其中氨基酸类型酪氨酸(Y)的所述修饰的和未修饰的氨基酸均被标记。
186.根据条款182所述的方法,其中氨基酸类型甘氨酸(G)的所述修饰的和未修饰的氨基酸均被标记。
187.根据条款182所述的方法,其中氨基酸类型组氨酸(H)的所述修饰的和未修饰的氨基酸均被标记。
188.根据条款182所述的方法,其中氨基酸类型甲硫氨酸(M)的所述修饰的和未修饰的氨基酸均被标记。
189.根据条款1a至1h所述的方法,其中至少一种氨基酸类型是选自以下的合成氨基酸类型:含有以下官能团的氨基酸类型:叠氮化物、炔烃、烯烃、环辛炔、二烯、酰基、碘、硼酸、双吖丙啶、环辛烯、环氧化物、环丙烷、磺酸、亚磺酸、生物素、肟、硝酮、降冰片烯、四氮烯、四唑、四环烷、贫电子π体系、富电子π体系、卤素、NHS酯、马来酰亚胺、肼、腙和/或重氮基及其任何组合。
190.根据前述条款中任一项所述的方法,其中每种氨基酸类型的所有或一定比例的所述氨基酸被标记。
191.根据条款190所述的方法,其中每种氨基酸类型的所有氨基酸被标记。
192.根据条款190所述的方法,其中至少所有第一氨基酸类型被标记,并且至少一定比例的第二氨基酸类型被标记。
193.根据条款190所述的方法,其中在所述样本中三种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二和第三氨基酸类型的一定比例的所述氨基酸被标记。
194.根据条款190所述的方法,其中在所述样本中三种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三氨基酸类型的一定比例的所述氨基酸被标记。
195.根据条款190所述的方法,其中在所述样本中四种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三和第四氨基酸类型的一定比例的所述氨基酸被标记。
196.根据条款190所述的方法,其中在所述样本中四种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三和第四氨基酸类型的一定比例的所述氨基酸被标记。
197.根据条款190所述的方法,其中在所述样本中四种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四氨基酸类型的一定比例的所述氨基酸被标记。
198.根据条款190所述的方法,其中在所述样本中五种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记。
199.根据条款190所述的方法,其中在所述样本中五种氨基酸类型被标记,其中第一、第二、第三和第四氨基酸类型的所有所述氨基酸被标记,并且第五氨基酸类型的一定比例的所述氨基酸被标记。
200.根据条款190所述的方法,其中在所述样本中五种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记。
201.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,以及第四和第五氨基酸类型的一定比例的所述氨基酸,其中所述第一、第二和第三氨基酸类型的所述未修饰的氨基酸被标记并且所述第四和第五氨基酸类型的所述修饰的氨基酸被标记。
202.根据条款190所述的方法,当从属于条款167或168时,其中至少所有第一氨基酸类型被标记,并且至少一定比例的第二氨基酸类型被标记,其中所述第一氨基酸类型的所述未修饰的氨基酸被标记并且所述第二氨基酸类型的所述修饰的氨基酸被标记。
203.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中三种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二和第三氨基酸类型的一定比例的所述氨基酸被标记,其中第一氨基酸类型的所述未修饰的氨基酸被标记并且所述第二和第三氨基酸类型的所述修饰的氨基酸被标记。
204.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中三种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述未修饰的氨基酸被标记并且所述第三氨基酸类型的所述修饰的氨基酸被标记。
205.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三和第四氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一氨基酸类型的所述未修饰的氨基酸被标记并且所述第二、第三和第四氨基酸类型的所述修饰的氨基酸被标记。
206.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三和第四氨基酸类型的一定比例的所述氨基酸被标记,其中第一和第二氨基酸类型的所述未修饰的氨基酸被标记并且所述第三和第四氨基酸类型的所述修饰的氨基酸被标记。
207.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述未修饰的氨基酸被标记并且所述第四氨基酸类型的所述修饰的氨基酸被标记。
208.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中第一氨基酸类型的所述未修饰的氨基酸被标记并且所述第二、第三、第四和第五氨基酸类型的所述修饰的氨基酸被标记。
209.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二、第三和第四氨基酸类型的所有所述氨基酸被标记,并且第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二、第三和第四氨基酸类型的所述未修饰的氨基酸被标记并且所述第五氨基酸类型的所述修饰的氨基酸被标记。
210.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述未修饰的氨基酸被标记并且所述第三、第四和第五氨基酸类型的所述修饰的氨基酸被标记。
211.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述未修饰的氨基酸被标记并且所述第四和第五氨基酸类型的所述修饰的氨基酸被标记。
212.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述未修饰的氨基酸被标记并且所述第四和第五氨基酸类型的所述修饰的氨基酸被标记。
213.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的一定比例的所述氨基酸被标记,并且第四和第五氨基酸类型的所有所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述修饰的氨基酸被标记并且所述第四和第五氨基酸类型的所述未修饰的氨基酸被标记。
214.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中三种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二和第三氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一氨基酸类型的所述修饰的氨基酸被标记并且所述第二和第三氨基酸类型的所述未修饰的氨基酸被标记。
215.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中三种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述修饰的氨基酸被标记并且所述第三氨基酸类型的所述未修饰的氨基酸被标记。
216.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三和第四氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述修饰的氨基酸被标记并且所述第三和第四氨基酸类型的所述未修饰的氨基酸被标记。
217.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三和第四氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述修饰的氨基酸被标记并且所述第三和第四氨基酸类型的所述未修饰的氨基酸被标记。
218.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中四种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述修饰的氨基酸被标记并且所述第四氨基酸类型的所述未修饰的氨基酸被标记。
219.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一氨基酸类型的所有所述氨基酸被标记,并且第二、第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一氨基酸类型的所述修饰的氨基酸被标记并且所述第二、第三、第四和第五氨基酸类型的所述未修饰的氨基酸被标记。
220.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二、第三和第四氨基酸类型的所有所述氨基酸被标记,并且第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二、第三和第四氨基酸类型的所述修饰的氨基酸被标记并且所述第五氨基酸类型的所述未修饰的氨基酸被标记。
221.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一和第二氨基酸类型的所有所述氨基酸被标记,并且第三、第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一和第二氨基酸类型的所述修饰的氨基酸被标记并且所述第三、第四和第五氨基酸类型的所述未修饰的氨基酸被标记。
222.根据条款190所述的方法,当从属于条款167或168时,其中在所述样本中五种氨基酸类型被标记,其中第一、第二和第三氨基酸类型的所有所述氨基酸被标记,并且第四和第五氨基酸类型的一定比例的所述氨基酸被标记,其中所述第一、第二和第三氨基酸类型的所述修饰的氨基酸被标记并且所述第四和第五氨基酸类型的所述未修饰的氨基酸被标记。
223.根据条款190所述的方法,当从属于条款167或168时,其中至少第一氨基酸类型的所有所述修饰的氨基酸被标记,并且至少第二氨基酸类型的一定比例的所述未修饰的氨基酸被标记。
224.根据条款1a至1h所述的方法,其中步骤e)包含通过将所述样本中每种标记的氨基酸类型的所述测量的标记和/或氨基酸浓度与一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较来鉴定所述样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
225.根据条款1a至1h或条款224所述的方法,其中指示与在所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的所述已知标记值,和/或氨基酸浓度,和/或氨基酸数目的信息是参考以鉴定每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度。
226.根据条款225所述的方法,其中所述参考提供了与一种或多种蛋白质浓度的每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的所述标记的所述已知值或氨基酸浓度,或其中所述参考提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的所述氨基酸数目。
227.根据条款226所述的方法,其中所述参考提供了与在作为蛋白质浓度的函数下在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的所述标记的所述已知值或氨基酸浓度,或其中,其中所述参考提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的所述氨基酸数目。
228.根据条款225至227中任一项所述的方法,其中所述参考提供了每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考线或参考曲线。
229.根据条款228所述的方法,其中每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述参考线或参考曲线由连续的点组成,所述连续的点各自提供每种浓度的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述已知标记值或氨基酸浓度。
230.根据条款229所述的方法,其中每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述参考线或参考曲线由连续的点组成,所述连续的点各自提供每种蛋白质浓度的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述已知标记值或氨基酸浓度。
231.根据条款229或230所述的方法,其中所述参考线或参考曲线是使用浓度或蛋白质浓度的共同参数来参数化描述的。
232.根据条款229或230所述的方法,其中所述参考线或参考曲线使用浓度或蛋白质浓度的共同自变量以向量格式描述。
233.根据条款232所述的方法,其中所述参考线或参考曲线是向量。
234.根据条款228至233所述的方法,其中所述样本中标记的两种或更多种氨基酸类型的所述标记的测量值、氨基酸浓度或氨基酸数目提供了所述参考线或参考曲线上的点。
235.根据条款234所述的方法,其中计算样本点与所述参考或参考向量之间的最短距离。
236.根据条款235所述的方法,其中所述样本点与所述参考向量之间的所述最短距离是所述样本点与所述参考向量之间的垂直距离。
237.根据条款223、234或235所述的方法,其中确定从所述样本点到所述参考线的所述向量。
238.根据条款233、234、235或237所述的方法,其中确定从所述样本点到所述参考线的所述向量与所述参考线的方向之间的点积(-),并且从所述样本点到所述参考向量的所述垂直距离是所述样本点与所述参考向量上的特定点之间的距离,对于所述特定点,所述点积(-)等于0。
239.根据条款237所述的方法,其中求解方程以提供所述浓度或所述蛋白质浓度,所述浓度或所述蛋白质浓度鉴定所述参考线上的所述特定点,对于所述特定点,所述样本点与所述参考线之间的所述向量是垂直的。
240.根据条款239所述的方法,其中提供所述垂直距离的所述参考线上的所述特定点是通过将所鉴定的浓度或蛋白质浓度值输入到所述参考线的向量函数中来计算。
241.根据条款236和240所述的方法,其中计算所述样本点与提供所述垂直距离的所述参考线上的这个点之间的距离。
242.根据条款1a至1h和241所述的方法,其中将这个垂直距离与误差容限进行比较。
243.根据条款242所述的方法,其中如果所述样本点与其参考线之间的所述垂直距离小于或等于误差容限,则鉴定所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述存在和/或浓度和/或量,并且其中所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述浓度或蛋白质浓度是提供这个垂直距离的所述浓度或蛋白质浓度。
244.根据条款190或192至223中任一项所述的方法,其中氨基酸类型的一定比例的所述氨基酸被标记,并且其中所述比例是标记的氨基酸类型的所述氨基酸的约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%。
245.根据条款167或168所述的方法,其中氨基酸类型的所述修饰的氨基酸被标记为与氨基酸类型的所述未修饰的氨基酸不同。
246.根据条款182所述的方法,其中氨基酸类型的所述未修饰的氨基酸被标记为与所述修饰的和未修饰的氨基酸的总数不同。
247.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先将它们转换为所述氨基酸类型的未修饰的氨基酸来标记的。
248.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先通过化学转变将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
249.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先通过化学反应将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
250.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先通过还原步骤将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
251.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先通过PTM裂解步骤将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
252.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过首先通过水解步骤将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
253.根据条款245或246所述的方法,其中氨基酸类型的所述修饰的氨基酸是通过使用酶首先将它们转换为氨基酸类型的未修饰的氨基酸来标记的。
254.根据条款253所述的方法,其中在标记步骤之前将所述酶从所述样本中去除。
255.根据条款246所述的方法,其中半胱氨酸(C
256.根据前述条款中任一项所述的方法,其中所述氨基酸类型中的每一种的标记对所述氨基酸类型是特异性的。
257.根据前述条款中任一项所述的方法,其中氨基酸类型的所述氨基酸的R基团被标记。
258.根据条款257所述的方法,其中氨基酸类型的所述修饰的和/或未修饰的氨基酸的所述R基团被标记。
259.根据条款258所述的方法,其中针对未修饰的A氨基酸标记的所述R基团是甲基。
260.根据条款258所述的方法,其中针对未修饰的R氨基酸标记的所述R基团是脂肪族胍基基团。
261.根据条款260所述的方法,其中所述脂肪族胍基基团是部分伯胺特性和/或相等的伯胺特性。
262.根据条款258所述的方法,其中针对修饰的R氨基酸(Rg)标记的所述R基团是键合至胍基胺的碳水化合物糖苷。
263.根据条款258所述的方法,其中针对修饰的R氨基酸(Rm)标记的所述R基团是甲基化的胍基胺。
264.根据条款258所述的方法,其中针对修饰的R氨基酸(Rc)标记的所述R基团是瓜氨酸。
265.根据条款258所述的方法,其中针对修饰的A氨基酸(Aa)标记的所述R基团是在N-末端的N-乙酰化的丙氨酸。
266.根据条款258所述的方法,其中针对未修饰的N氨基酸标记的所述R基团是β-甲酰胺。
267.根据条款258所述的方法,其中针对修饰的N氨基酸(Ng)标记的所述R基团是键合至β-甲酰胺胺的碳水化合物糖苷。
268.根据条款258所述的方法,其中针对修饰的N氨基酸(Nd)标记的所述R基团是羧酸(天冬氨酸D或异天冬氨酸isoD)。
269.根据条款258所述的方法,其中针对修饰的D氨基酸(Di)标记的所述R基团是羧酸(异天冬氨酸)。
270.根据条款258所述的方法,其中针对修饰的和未修饰的C氨基酸标记的所述R基团是还原的硫醇。
271.根据条款258所述的方法,其中针对未修饰的C氨基酸(C
272.根据条款258所述的方法,其中针对修饰的C氨基酸(C
273.根据条款258所述的方法,其中针对修饰的C氨基酸(Cfe)标记的所述R基团是次磺酸。
274.根据条款258所述的方法,其中针对修饰的C氨基酸(Cfu)标记的所述R基团是磺酸。
275.根据条款258所述的方法,其中针对修饰的C氨基酸(Cp)标记的所述R基团是棕榈酰化的硫醇。
276.根据条款258所述的方法,其中针对修饰的C氨基酸(Cn)标记的所述R基团是在N-末端处的N-乙酰化的半胱氨酸。
277.根据条款258所述的方法,其中针对修饰的C氨基酸(Cno)标记的所述R基团是S-亚硝基硫醇。
278.根据条款258所述的方法,其中针对修饰的E氨基酸(Ep)标记的所述R基团是焦谷氨酸。
279.根据条款258所述的方法,其中针对修饰的E氨基酸(Ep)标记的所述R基团是在N-末端处的焦谷氨酸。
280.根据条款258所述的方法,其中针对修饰的E氨基酸(Ec)标记的所述R基团是γ-二羧酸。
281.根据条款258所述的方法,其中针对修饰的E氨基酸(Ec)标记的所述R基团是γ-二羧酸。
282.根据条款258所述的方法,其中针对修饰的Q氨基酸(Qp)标记的所述R基团是在N-末端处的焦谷氨酸。
283.根据条款258所述的方法,其中针对修饰的Q氨基酸(Qe)标记的所述R基团是γ-羧酸。
284.根据条款258所述的方法,其中针对修饰的Q氨基酸(Qip)标记的所述R基团是具有K氨基酸的异肽键。
285.根据条款258所述的方法,其中针对修饰的G氨基酸(Gm)标记的所述R基团是在N-末端处的N-肉豆蔻酰基。
286.根据条款258所述的方法,其中针对修饰的G氨基酸标记的所述R基团是在N-末端处的N-乙酰基。
287.根据条款258所述的方法,其中针对修饰的H氨基酸(Hp)标记的所述R基团是磷酸咪唑。
288.根据条款258所述的方法,其中针对修饰的K氨基酸(Ka)标记的所述R基团是具有乙酰基取代基的ε-仲氨基基团。
289.根据条款258所述的方法,其中针对修饰的K氨基酸(Ku)标记的所述R基团是具有泛素取代基的ε-仲氨基基团。
290.根据条款258所述的方法,其中针对修饰的K氨基酸(Ks)标记的所述R基团是ε-仲氨基基团SUMO基取代基。
291.根据条款258所述的方法,其中针对修饰的K氨基酸(Km)标记的所述R基团是具有甲基取代基的ε-仲氨基基团。
292.根据条款258所述的方法,其中针对修饰的K氨基酸(Ki)标记的所述R基团是具有键合至谷氨酰胺的异肽键的ε-仲氨基基团。
293.根据条款258所述的方法,其中针对修饰的K氨基酸(Kh)标记的所述R基团是具有羟基取代基的ε-仲氨基基团。
294.根据条款258所述的方法,其中针对修饰的M氨基酸(Ma)标记的所述R基团是在N-末端处的N-乙酰基。
295.根据条款258所述的方法,其中针对修饰的M氨基酸(Mu)标记的所述R基团是硫酯连接的泛素。
296.根据条款258所述的方法,其中针对修饰的M氨基酸(Msx)标记的所述R基团是亚砜。
297.根据条款258所述的方法,其中针对修饰的M氨基酸(Mso)标记的所述R基团是砜。
298.根据条款258所述的方法,其中针对修饰的P氨基酸(Ph)标记的所述R基团是羟基吡咯烷。
299.根据条款258所述的方法,其中针对修饰的S氨基酸(Sp)标记的所述R基团是羟甲基磷酸酯。
300.根据条款258所述的方法,其中针对修饰的S氨基酸(Sg)标记的所述R基团是羟甲基糖苷。
301.根据条款258所述的方法,其中针对修饰的S氨基酸(Sn)标记的所述R基团是在N-末端处的N-乙酰基。
302.根据条款258所述的方法,其中针对修饰的T氨基酸(Tp)标记的所述R基团是羟基磷酸酯。
303.根据条款258所述的方法,其中针对修饰的T氨基酸(Tg)标记的所述R基团是羟基糖苷。
304.根据条款258所述的方法,其中针对修饰的T氨基酸(Tn)标记的所述R基团是在N-末端处的N-乙酰基。
305.根据条款258所述的方法,其中针对修饰的W氨基酸(Wmo)标记的所述R基团是吲哚醇(indoleol)(单羟基吲哚)。
306.根据条款258所述的方法,其中针对修饰的W氨基酸(Wdo)标记的所述R基团是吲哚二醇(二羟基吲哚)。
307.根据条款258所述的方法,其中针对修饰的W氨基酸(Wk)标记的所述R基团是犬尿氨酸。
308.根据条款258所述的方法,其中针对修饰的Y氨基酸(Ys)标记的所述R基团是硫酸苯酯。
309.根据条款258所述的方法,其中针对修饰的Y氨基酸(Yp)标记的所述R基团是磷酸苯酯。
310.根据条款258所述的方法,其中针对修饰的V氨基酸(Vn)标记的所述R基团是在N-末端处的N-乙酰基。
311.根据条款258所述的方法,其中针对未修饰的E氨基酸标记的所述R基团是γ-羧酸。
312.根据条款258所述的方法,其中针对未修饰的Q氨基酸标记的所述R基团是γ-甲酰胺。
313.根据条款258所述的方法,其中针对未修饰的G氨基酸标记的所述R基团是氢作为取代基的α碳。
314.根据条款258所述的方法,其中针对未修饰的H氨基酸标记的所述R基团是咪唑。
315.根据条款258所述的方法,其中针对未修饰的I氨基酸标记的所述R基团是仲丁基。
316.根据条款258所述的方法,其中针对未修饰的L氨基酸标记的所述R基团是异丁基。
317.根据条款258所述的方法,其中针对未修饰的K氨基酸标记的所述R基团是ε-伯氨基基团。
318.根据条款258所述的方法,其中针对修饰的K氨基酸标记的所述R基团是磷酸吡哆醛醛亚胺(Pyridoxyal phosphate aldimine)。
319.根据条款258所述的方法,其中针对未修饰的M氨基酸标记的所述R基团是S-甲基硫醚。
320.根据条款258所述的方法,其中针对未修饰的F氨基酸标记的所述R基团是苄基。
321.根据条款258所述的方法,其中针对未修饰的P氨基酸标记的所述R基团是吡咯烷。
322.根据条款258所述的方法,其中针对修饰的P氨基酸(Ph4)标记的所述R基团是4-羟基吡咯烷。
323.根据条款258所述的方法,其中针对S的未修饰的氨基酸标记的所述R基团是羟甲基。
324.根据条款258所述的方法,其中针对修饰的S氨基酸(Sp)标记的所述R基团是磷酸甲酯。
325.根据条款258所述的方法,其中针对未修饰的T氨基酸标记的所述R基团是羟基。
326.根据条款258所述的方法,其中针对修饰的T氨基酸(Tp)标记的所述R基团是磷酸酯。
327.根据条款258所述的方法,其中针对未修饰的W氨基酸标记的所述R基团是吲哚。
328.根据条款258所述的方法,其中针对未修饰的Y氨基酸标记的所述R基团是苯酚。
329.根据条款258所述的方法,其中针对修饰的Y氨基酸(Yp)标记的所述R基团是磷酸苯酚(Phosphophenol)。
330.根据条款258所述的方法,其中针对未修饰的V氨基酸标记的所述R基团是异丙基。
331.根据条款258所述的方法,其中吡咯赖氨酸(O)的所述R基团是吡咯(N,2,3-三甲基-3,4-二氢-2H-吡咯-2-甲酰胺)。
332.根据条款258所述的方法,其中硒代半胱氨酸(U)的所述R基团是乙硒醇。
333.根据条款258所述的方法,其中修饰的和未修饰的W氨基酸的所述R基团是吲哚基团,其中单氧化的(修饰的)W氨基酸的所述R基团是羟基吲哚基团,并且二氧化的(修饰的)W氨基酸的所述R基团是二羟基吲哚基团。
334.根据条款258所述的方法,其中未修饰的K氨基酸的所述R基团是ε-伯氨基基团,其中乙酰化的(修饰的)K的所述R基团是乙酰化的ε-仲氨基,泛素化的(修饰的)K的所述R基团是泛素化的ε-仲氨基,SUMO化的(修饰的)K的所述R基团是SUMO化的ε-仲氨基,甲基化(修饰的)K的所述R基团是甲基化的(烷基化的)ε-仲氨基。
335.根据条款258所述的方法,其中修饰和未修饰的Y氨基酸的所述R基团是苯酚基团,其中硫酸化的(修饰的)Y氨基酸的所述R基团是硫酸苯酚基团,并且磷酸化的(修饰的)Y氨基酸的所述R基团是磷酸苯酚基团。
336.根据条款257至335中任一项所述的方法,其中每种氨基酸类型的所述R基团的所述标记对所述氨基酸类型是特异性的。
337.根据条款257至335中任一项所述的方法,其中每种未修饰的氨基酸类型的所述R基团的所述标记对于所述未修饰的氨基酸类型是特异性的。
338.根据条款257至335中任一项所述的方法,其中每种修饰的氨基酸类型的所述R基团的所述标记对所述氨基酸类型是特异性的。
339.根据条款257至335中任一项所述的方法,其中用相同取代基标记修饰的氨基酸类型的R基团是特异于所述R基团的取代基。
340.根据条款336所述的方法,其中标记含有磷酸基的R基团对于含有磷酸基的R基团是特异性的,从而允许检测所有磷酸化的氨基酸类型。
341.根据条款336所述的方法,其中标记含有糖苷的R基团对于含有糖苷的R基团是特异性的并且包含用TT/n-Bu4NN3或Ph3P:2,3-二氯-5,6-二氰基苯醌(DDQ):n-Bu4NN3选择性转换为叠氮化物,随后与F1-DIBO反应。
342.根据条款336所述的方法,其中标记含有脂肪酸的R基团对于含有脂肪酸的R基团是特异的,其包含用偶极3-甲氧基色酮标记,从而允许检测所有脂化氨基酸类型。
343.根据条款336所述的方法,其中标记含有磷酸基的R基团包含用羰二咪唑活化以提供离去基团,随后与半胱氨酸BODIPY染料反应,并且对于含有磷酸基的R基团是特异的,从而允许检测用磷酸基修饰的所有氨基酸类型。
344.根据前述条款中任一项所述的方法,其中在所述样本中所述氨基酸类型的标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
345.根据条款344所述的方法,其中在使用有机溶剂对所述样本中的所述氨基酸类型进行所述标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
346.根据条款344所述的方法,其中在使用表面活性剂对所述样本中的所述氨基酸类型进行所述标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
347.根据条款344所述的方法,其中在使用还原剂对所述样本中的所述氨基酸类型进行所述标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
348.根据条款344所述的方法,其中在使用高或低pH条件对所述样本中的所述氨基酸类型进行所述标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
349.根据条款344所述的方法,其中在使用有机溶剂、表面活性剂、还原剂或者高或低pH条件的任何组合对所述样本中的所述氨基酸类型进行所述标记反应期间或之前,使亚蛋白质组内的任何肽、寡肽、多肽、蛋白质、蛋白质复合物或蛋白质组内的任何肽、寡肽、多肽、蛋白质或蛋白质复合物变性。
350.根据条款1a至1h或2至256中任一项所述的方法,其中两种或更多种氨基酸类型用相同标记来标记,并且针对每种氨基酸类型独立地鉴定所述标记。
351.根据条款350所述的方法,其中用于检测所述标记的参数是不同的。
352.根据条款350所述的方法,其中所述标记反应是不同的。
353.根据条款350所述的方法,其中在与所述标记反应之前,一种氨基酸类型在与另一种氨基酸类型不同的条件下转换为反应性形式。
354.根据条款353所述的方法,其中在所述标记反应期间使用不同的催化剂。
355.根据条款353所述的方法,其中不同波长的光用于催化所述标记反应。
356.根据条款353所述的方法,其中在氨基酸类型上进行不同的化学反应以在与所述标记反应之前引入反应性基团。
357.根据条款349所述的方法,其中使用不同的反应时间。在实施例中,当一种氨基酸类型与所述标记的反应比另一种氨基酸类型更快。
358.根据条款350或351所述的方法,其中将针对一种氨基酸类型的所述测量的标记与针对第二种氨基酸类型的所述标记解卷积。
359.根据条款358所述的方法,其中使用仅含有所述标记的氨基酸类型中的一种的氨基酸的解卷积标准,将一种氨基酸类型的所述测量的标记与第二种氨基酸类型的所述标记解卷积。
360.根据条款358或359所述的方法,其中所述氨基酸类型色氨酸(W)和酪氨酸(Y)用相同的标记来标记,并且W氨基酸的所述测量的标记与Y氨基酸的所述标记解卷积。
361.根据条款358或359所述的方法,其中所述氨基酸类型色氨酸(W)和酪氨酸(Y)用相同的标记来标记,并且使用分开的激发波长,将W氨基酸的所述测量的标记与W和Y氨基酸的所述测量的标记分开检测。
362.根据条款358或359所述的方法,其中所述氨基酸类型色氨酸(W)和酪氨酸(Y)用相同的标记来标记,并且使用仅含有W氨基酸的解卷积标准计算在标记W和Y氨基酸两者的激发波长下W氨基酸的所述测量的标记,并且将其从W和Y氨基酸两者的标记的总值中减去以单独显示Y氨基酸的所述标记的值。
363.根据前述条款中任一项所述的方法,其中在整个样本中标记两种或更多种氨基酸类型。
364.根据条款1至363中任一项所述的方法,其中将所述样本分离成多个级分并且在每个级分中进行不同的标记反应,所述标记反应特异性地标记所述氨基酸类型的两种或更多种。
365.根据条款364所述的方法,其中所述级分具有相等体积。
366.根据条款364或365所述的方法,其中4种氨基酸类型被标记并且所述样本在标记之前被分离成两个级分,其中两种氨基酸类型在一个级分中被标记并且两种其它氨基酸类型在第二个级分中被标记。
367.根据条款366所述的方法,其中所述4种氨基酸类型W、K、Y和C被标记,并且在标记之前将所述样本分离成两个级分,其中在一个级分中标记W和K氨基酸,并且在第二个级分中标记Y和C。
368.根据条款366所述的方法,其中所述4种氨基酸类型W、K、Y和C被标记,并且在标记之前将所述样本分离成三个级分,其中在一个级分中标记W和Y氨基酸,并且在单独的级分中标记C和K氨基酸。
369.根据条款364或365所述的方法,其中4种氨基酸类型被标记并且在标记之前将所述样本分离成4个级分,其中在每个级分中标记一种氨基酸类型。
370.根据条款369所述的方法,其中所述氨基酸类型W、K、Y和C被标记并且在标记之前将所述样本分离成4个级分,其中在第一个级分中标记W,在第二个级分中标记K,在第三个级分中标记C,在第四个级分中标记Y。
371.根据条款364或365所述的方法,其中级分的数目等于所述样本中标记的氨基酸类型的数目。
372.根据条款364或365所述的方法,其中每个级分含有所有氨基酸类型,因为所述氨基酸类型包含在未经消化或水解的完整蛋白质或肽链上。
373.根据条款364或365所述的方法,其中所述级分的数目不等于所述样本中所述标记的氨基酸类型的数目,并且每级分标记多于一种氨基酸类型。
374.根据条款364或365所述的方法,其中两种或更多种氨基酸类型具有相同的标记并且它们在不同的级分中被标记。
375.根据前述条款中任一项所述的方法,其中所述标记反应在本体中而不是在微流体装置中进行。
376.根据前述条款中任一项所述的方法,其中所述样本的所述标记和/或所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组的所述已知标记值提供信号。
377.根据前述条款中任一项所述的方法,其中所述样本的所述标记是荧光团。
378.根据前述条款中任一项所述的方法,其中所述样本的所述标记是荧光团的反应性衍生物。
379.根据条款377或378所述的方法,其中所述样本的所述标记是荧光标记。
380.根据条款379所述的方法,其中所述荧光标记是荧光探针。
381.根据条款380所述的方法,其中所述荧光标记是荧光标签。
382.根据条款380所述的方法,其中所述荧光标记是荧光蛋白。
383.根据条款380所述的方法,其中所述荧光标记是荧光染料。
384.根据条款380所述的方法,其中所述荧光标记包括对氨基酸类型特异的反应性基团。
385.根据条款380所述的方法,其中所述荧光标记包括靶向氨基酸类型的反应性基团。
386.根据条款380所述的方法,其中所述荧光标记包括对氨基酸类型的所述R基团特异的反应性基团。
387.根据条款380所述的方法,其中所述荧光标记包括靶向氨基酸类型的所述R基团的反应性基团。
388.根据条款380所述的方法,其中所述荧光标记包括对所述蛋白质的N或C末端特异的反应性基团。
389.根据条款380所述的方法,其中所述荧光标记包括靶向所述蛋白质的所述N或C末端的反应性基团。
390.根据条款380所述的方法,其中所述荧光标记包括量子点。
391.根据前述条款中任一项所述的方法,其中所述样本的所述标记包括纳米颗粒。
392.根据条款379至390所述的方法,其中所述荧光标记包括荧光团。
393.根据条款392所述的方法,其中所述荧光团选自由以下组成的组:羟基香豆素、氨基香豆素、甲氧基香豆素、瀑布蓝(Cascade Blue)、太平洋蓝、太平洋橙、荧光黄、NBD、R-藻红蛋白(PE)、PE-Cy5共轭物、PE-Cy7共轭物、红613、PerCP、TruRed、FluorX、氟硼二吡咯-FL(BODIPY-FL)、G-染料100、G-染料200、G-染料300、G-染料400、Cy2、Cy3、Cy3B、Cy3.5、Cy5、Cy5.5、Cy7、TRITC、X-罗丹明(X-Rhodamine)、丽丝胺罗丹明B、德克萨斯红、别藻蓝蛋白(APC)、APC-Cy7共轭物、DAPI、赫斯特(Hoechst)33258、SYTOX蓝、色霉素A3、光神霉素、YOYO-1、ATTO 390、ATTO 425、ATTO 465、ATTO 488、ATTO 495、ATTO 514、ATTO 520、ATTO 532、ATTO Rho6G、ATTO 550、ATTO 565、ATTO Rho3B、ATTO Rho11、ATTO Rhol2、ATTO Thio12、ATTO Rho101、ATTO 590、ATTO Rho13、ATTO 594、ATTO 610、ATTO Rho14、ATTO 633、ATTO647、ATTO 647N、ATTO 655、ATTO Oxa12、ATTO 665、ATTO Oxa12、ATTO 665、ATTO 680、ATTO700、ATTO 725、ATTO 740、亮紫421、亮紫510、亮紫570、亮紫605、亮紫650、亮紫711、亮紫750、亮紫785、TM-BDP、KFL-1、KFL-2、KFL-3、KFL-4、超亮(Super Bright)436、超亮600、超亮645、超亮702、超亮780、Alexa Flour 350、Alexa Flour 405、Alexa Flour 488、AlexaFlour 532、Alexa Flour 546、Alexa Flour 555、Alexa Flour 568、Alexa Flour 594、Alexa Flour 647、Alexa Flour 680、Alexa Flour 850、香豆素、太平洋绿、俄勒冈绿(Oregon Green)、荧光素(FITC)、PE-青色素7、PerCP-青色素5.5、四甲基罗丹明(Tetramethylrhodamine,TRITC)、eFlour 450、eFlour506、eFlour660、PE-eFlour 610、PerCP-eFlour 710、APC-eFlour 780、超亮436、超亮600、超亮645、超亮702、超亮780、DAPI、SYTOX绿、SYTO 9、TO-PRO-3、Qdot 525、Qdot 565、Qdot 605、Qdot 655、Qdot 705、Qdot800、R-藻红素(R-PE)、CFP、GFP(emGFP)、RFP(tagRFP)、VioBlue、VioGreen、VioBright 515、Vio 515、VioBright FITC、PE、PE-Vio 615、PerCP、PerCP-Vio 700、PE-Vio 770、APC、APC-Vio 770、1,8-萘酰亚胺、吖啶橙、SYTOX绿、TOTO-1、TO-PRO-1、TO-PRO:青色素单体、噻唑橙、CyTRAK橙、碘化丙啶(PI)、LDS 751、7-AAD、SYTOX橙、TOTO-3、TO-PRO-3、DRAQ5、DRAQ7、Indo-1、Fluo-3、Fluo-4、DCFH、DHR或SNARF。
394.根据条款379至390中任一项所述的方法,其中所述荧光标记包括荧光蛋白。
395.根据条款394所述的方法,其中所述荧光蛋白是GFP(Y66H突变)、GFP(Y66F突变)、EBFP、EBFP2、蓝铜矿、GFPuv、T-天蓝色、蔚蓝色、mCFP、mTurquoise2、ECFP、CyPet、GFP(Y66W突变)、mKeima-红、TagCFP、AmCyan1、mTFP1、GFP(S65A突变)、Midoriishi青色、野生型GFP、GFP(S65C突变)、TurboGFP、TagGFP、GFP(S65L突变)、翠绿色、GFP(S65T突变)、EGFP、Azami绿、ZsGreen1、TagYFP、EYFP、Topaz、Venus、mCitrine、YPet、TurboYFP、ZsYellow1、Kusabira橙、亮橘色(mOrange)、别藻蓝素(APC)、mKO、TurboRFP、tdTomato、TagRFP、DsRed单体、DsRed2(“RFP”)、mStrawberry、TurboFP602、AsRed2、mRFP1、J-红、R-藻红蛋白(RPE)、B-藻红蛋白(BPE)、mCherry、HcRed1、Katusha、P3、多甲藻素叶绿素(PerCP)、mKate(TagFP635)、TurboFP635、mPlum或mRaspberry。
396.根据前述条款中任一项所述的方法,其中所述标记包括对氨基酸类型特异的反应性基团。
397.根据条款396所述的方法,其中所述标记包括对氨基酸类型的所述R基团特异的反应性基团。
398.根据条款377至391或392至395所述的方法,其中所述荧光标记包括对在标记步骤之前或期间对氨基酸类型进行的化学修饰特异的反应性基团。
399.根据条款398所述的方法,其中所述荧光标记包括在所述标记步骤之前或期间对氨基酸类型的所述R基团进行化学修饰特异的反应性基团。
400.根据条款398所述的方法,其中所述荧光标记包括对在所述标记步骤之前或期间对与氨基酸类型的R基团邻近的蛋白质主链进行的化学修饰是特异的反应性基团。
401.根据条款396至400所述的方法,其中所述反应性基团选自由以下组成的组:NHS-酯、马来酰亚胺、炔烃、叠氮化物、溴化物、氯化物、氟化物、碘化物、芳基溴化物、芳基氯化物、芳基氟化物、芳基碘化物、二烯、亲二烯体、烯烃、四嗪、环辛炔、生物素、链霉抗生物素蛋白、异硫氰酸酯、活性酯、磺酰氯、二醛、碘乙酰胺、乙二胺、氨基吖啶酮、酰肼、羧基或烷氧基胺。
402.根据条款379所述的方法,其中所述荧光标记是荧光染料。
403.根据条款402所述的方法,其中所述荧光染料是荧光染料、非荧光染料、在与氨基酸类型具有反应性时变成发荧光的分子,和/或将固有荧光氨基酸类型的荧光转移到光谱的可见区域中的分子。
404.根据条款402所述的方法,其中所述荧光染料是荧光染料、非荧光染料、在与氨基酸类型的所述R基团具有反应性时变成发荧光的分子,和/或将固有荧光氨基酸类型的所述R基团的荧光转移到所述光谱的所述可见区域中的分子。
405.根据条款403所述的方法,其中所述荧光染料、在与氨基类型具有反应性时变成发荧光的分子,或将固有荧光氨基酸类型的所述荧光转移到所述光谱的所述可见区域中的分子选自由以下组成的组:4-氟-7-氨磺酰基苯并呋喃(ABD-F)、2,2,2-三氯乙醇(TCE)和/或邻苯二甲醛(OPA),或其混合物。
406.根据条款403所述的方法,其中荧光染料、在与氨基类型具有反应性时变成发荧光的分子,或将固有荧光氨基酸类型的所述荧光转移到所述光谱的所述可见区域中的分子是卤代化合物。
407.根据条款406所述的方法,其中所述卤代化合物选自由以下组成的组:三氯乙酸、三氯甲烷、三氟乙醇、三氟乙酸、三氟甲烷、三溴乙醇、三溴乙酸、三溴甲烷、三碘乙醇、三碘乙酸或三碘甲烷。
408.根据条款407所述的方法,其中用三氯乙酸、三氯甲烷、三氟乙醇、三氟乙酸、三氟甲烷、三溴乙醇、三溴乙酸、三溴甲烷、三碘乙醇、三碘乙酸或三碘甲烷标记氨基酸类型色氨酸(W)和/或酪氨酸(Y)。
409.根据前述条款中任一项所述的方法,其中每种氨基酸类型的所述R基团被标记。
410.根据条款409所述的方法,其中标记的氨基酸类型的所述R基团是氨基酸类型的所述修饰的和/或未修饰的氨基酸的所述R基团。
411.根据条款410所述的方法,其中未修饰的A氨基酸的所述R基团经由钯催化的C(sp
412.根据条款410所述的方法,其中用多巴色素标记未修饰的R氨基酸的所述R基团。
413.根据条款410所述的方法,其中用4-氨基-3-甲酰基苯基硝酸酯标记未修饰的N氨基酸的所述R基团。
414.根据条款410所述的方法,其中用4-(二乙氨基)-2-(吡啶-2-基甲氧基)苯甲醛附加的氟硼二吡咯(BODIPY)基探针标记未修饰的D氨基酸的所述R基团。
415.根据条款410所述的方法,其中在用三(2-羧乙基)膦(TCEP)还原氧化的硫醇之后,用4-氨基磺酰基-7-氟-2,1,3-苯并二唑(ABD-F)标记修饰的和未修饰的C氨基酸的所述R基团。
416.根据条款410所述的方法,其中用4-氨基磺酰基-7-氟-2,1,3-苯并二唑(ABD-F)或邻马来酰亚胺氟硼二吡咯或(Z)-2-(6-(乙基((3-(三氟甲基)苯基)硒基)氨基)-3-(乙基亚氨基)-2,7-二甲基-3H-氧杂蒽-9-基)苯甲酸乙酯标记未修饰的C氨基酸(C
417.根据条款410所述的方法,其中用4-(二乙氨基)-2-(吡啶-2-基甲氧基)苯甲醛附加的氟硼二吡咯基探针标记未修饰的E氨基酸的所述R基团。
418.根据条款410所述的方法,其中用4-氨基-3-甲酰基苯基硝酸酯标记未修饰的Q氨基酸的所述R基团。
419.根据条款410所述的方法,其中经由经由在CuBr(1μM)和10μM的tBuOOH的DCM的存在下与H-炔基-Phe反应在羰基的α位进行C-H键官能化,随后与3-叠氮基-7-甲氧基-2H-色烯-2-酮进行CuAAc来标记未修饰的G氨基酸的所述R基团。
420.根据条款410所述的方法,其中用2-丁基-6-(4-((6-(((2-乙氧基乙基)氨基)甲基)吡啶-2-基)甲基)哌嗪-1-基)-1H-苯并[de]异喹啉-1,3(2H)-二酮-Cu
421.根据条款410所述的方法,其中用用于异亮氨酸的δ-C-H官能化的蓝光介导的霍夫曼-洛夫勒-弗赖塔格(Hoffman-Loffler-Freytag)反应标记未修饰的I氨基酸的所述R基团,随后与由蓝色LED催化的乙酸次溴酸酐反应以引入Br基团,随后通过SN
422.根据条款410所述的方法,其中用用于异亮氨酸的δ-C-H官能化的蓝光介导的霍夫曼-洛夫勒-弗赖塔格反应标记未修饰的L氨基酸的所述R基团,随后与由蓝色LED催化的乙酸次溴酸酐反应以引入Br基团,随后通过SN2与KN3反应以引入叠氮基团,然后与4-((7-乙炔基-2-氧代-2H-色烯-4-基)甲氧基)-4-氧代丁酸进行CuAAc。
423.根据条款410所述的方法,其中在β-巯基乙醇(BME)的存在下用邻苯二甲醛(OPA)标记未修饰的K氨基酸的所述R基团。
424.根据条款410所述的方法,其中用与携带甲硫氨酸选择性碘盐的炔进行反应,随后与CalFlour染料进行点击化学来标记未修饰的M氨基酸的所述R基团。
425.根据条款410所述的方法,其中经由与(溴乙炔基)三异丙基硅烷、1μM Pd(OAc)
426.根据条款410所述的方法,其中用两亲性偶极席夫碱Zn
427.根据条款410所述的方法,其中经由用TT/n-Bu
428.根据条款410所述的方法,其中经由用TT/n-Bu4NN3或Ph3P:2,3-二氯-5,6-二氰基苯醌(DDQ):n-Bu
429.根据条款410所述的方法,其中在Rh
430.根据条款410所述的方法,其中用三氯乙醇(TCE)标记修饰的W氨基酸的所述R基团。
431.根据条款410所述的方法,其中用三氯乙醇(TCE),或使用[RhCl(PPh
432.根据条款410所述的方法,其中经由使用[Ru(bpy)
433.根据条款410所述的方法,其中经由与氮杂邻苯二甲酰亚胺进行狄尔斯阿尔德反应标记未修饰的O氨基酸的所述R基团。
434.根据条款410所述的方法,其中在pH 7下用ABD-F标记未修饰的U氨基酸的所述R基团。
435.根据条款410所述的方法,其中用BO-IMI标记修饰的S氨基酸的所述R基团。
436.根据条款410所述的方法,其中用BO-IMI标记苏氨酸的修饰的T氨基酸的所述R基团。
437.根据条款410所述的方法,其中用BO-IMI标记修饰的Y氨基酸的所述R基团。
438.根据条款410所述的方法,其中用邻马来酰亚胺氟硼二吡咯标记修饰的R氨基酸。
439.根据条款410所述的方法,其中用具有炔取代基的硼酸甲苯磺酰基探针标记所述修饰的N氨基酸,所述硼酸甲苯磺酰基探针随后与CalFlour染料反应。
440.根据条款410所述的方法,其中用9-芴甲基氯甲酸酯标记所述修饰的K氨基酸。
441.根据条款379所述的方法,其中所述荧光标记是荧光蛋白或共轭抗体。
442.根据条款441所述的方法,其中所述荧光蛋白选自由以下组成的组:smURFP、GFP、EGFP、蔚蓝色、mTurquoise、TagBFP、mCherry、亮橘色、柠檬色、Dronpa、dsRed、eqFP611、Dendra、EosFP、IrisFP、TagRFP、FbFP。
443.根据条款441所述的方法,其中所述共轭抗体是翻译后修饰的单克隆抗体。
444.根据条款443所述的方法,其中所述翻译后修饰的单克隆抗体检测磷酸丝氨酸、磷酸苏氨酸、磷酸酪氨酸、磷酸化、赖氨酸甲基化、精氨酸甲基化、赖氨酸乙酰化、精氨酸乙酰化、酰胺化、吡咯烷酮羧酸形成、异构化、脯氨酸羟基化、赖氨酸羟基化、硫酸化、黄素结合、半胱氨酸氧化、亚硝基化、赖氨酸酰化、半胱氨酸酰化、N-末端酰化、赖氨酸甲酰化、赖氨酸烷基化、半胱氨酸烷基化、精氨酰化、酰胺键形成、丁酰化、γ-羧化、精氨酸糖基化、天冬酰胺糖基化、半胱氨酸糖基化、羟赖氨酸糖基化、丝氨酸糖基化、苏氨酸糖基化、酪氨酸糖基化、色氨酸糖基化、丙二酰化、脯氨酸羟基化、赖氨酸羟基化、酪氨酸碘化、核苷酸加成、磷酸化、腺苷酰化、尿苷酰化、丙酰化、焦谷氨酸形成、S-谷胱甘肽化、半胱氨酸亚磺酰化、半胱氨酸磺酰化、赖氨酸琥珀酰化、酪氨酸硫酸化、肉豆蔻酰化、棕榈酰化、异戊二烯化、异戊烯化或glipyation。
445.根据条款1至376所述的方法,其中所述标记是串联质谱标签。
446.根据条款445所述的方法,其中所述串联质谱标签选自由以下组成的组:TMTzero、TMTduplex、TMTsimplex、TMT 10-plex、TMTpro和TMTpro Zero。
447.根据条款1至376所述的方法,其中所述标记是同位素标记。
448.根据条款447所述的方法,其中所述同位素标记是非放射性同位素。
449.根据条款449所述的方法,其中所述非放射性同位素标记选自:2H、13C和/或15N。
450.根据条款350所述的方法,其中检测到的所述信号是化学发光信号或生物化学发光信号。
451.根据条款450所述的方法,其中化学发光标记是N-(4-氨基丁基)-N-乙基-异氨基苯二酰肼(ABEI)大环内酯。
452.根据条款377至451中任一项所述的方法,其中荧光标记、同位素标记、串联质谱标记和/或化学发光标记的组合用于标记两种或更多种氨基酸类型。
453.根据条款358所述的方法,其中氨基酸类型丝氨酸和苏氨酸的所述测量的标记彼此解卷积。
454.根据条款358所述的方法,其中氨基酸类型天冬酰胺和谷氨酰胺的所述测量的标记彼此解卷积。
455.根据条款358所述的方法,其中氨基酸类型谷氨酸和天冬氨酸的所述测量的标记彼此解卷积。
456.根据条款358所述的方法,其中氨基酸类型亮氨酸和异亮氨酸的所述测量的标记彼此解卷积。
457.根据前述条款中任一项所述的方法,其中所述样本在标记之前或在所述标记反应期间变性。
458.根据条款376所述的方法,其中测量所述标记的所述信号。
459.根据前述条款中任一项所述的方法,其中所述测量的标记是背景校正的。
459a.根据条款459所述的方法,其中所述样本的自体荧光被去除。
460.根据条款447至449所述的方法,其中所述同位素标记通过NMR和/或质谱测量。
461.根据条款445至446所述的方法,其中所述串联质谱标签通过质谱测量。
462.根据条款379至395或398至442所述的方法,其中所述荧光标记通过荧光显微法测量。
463.根据条款379至395或398至442所述的方法,其中所述荧光标记通过荧光计测量。
464.根据条款379至395或398至442所述的方法,其中所述荧光标记通过荧光板读取器测量。
465.根据条款379至395或398至442所述的方法,其中所述荧光标记经由平行或串联进行和/或读取若干荧光反应的仪器测量。
466.根据条款462所述的方法,其中用荧光标记来标记所述氨基酸类型Y,并且在约250nm至约380nm的激发波长和约370nm至约500nm的发射波长下测量所述荧光标记。
467.根据条款462所述的方法,其中用荧光标记标记所述氨基酸类型W并且在约270nm至约380nm的激发波长和约430nm至约600nm的发射波长下测量所述荧光标记。
468.根据条款462所述的方法,其中用荧光标记标记所述氨基酸类型K并且在约320nm至约415nm的激发波长和约400nm至约500nm的发射波长下测量所述荧光标记。
469.根据条款462所述的方法,其中用荧光标记标记所述氨基酸类型C并且在约330nm至约400nm的激发波长和约430nm至约580nm的发射波长下测量所述荧光标记。
470.根据条款462所述的方法,其中根据提供的所述激发波长和所述发射波长范围,对于在所述样本中标记的每种氨基酸类型的每个荧光标记,所述激发波长与所述发射波长分开约10nm至约20nm。
471.根据前述条款中任一项所述的方法,其中根据所述测量的标记计算每种标记的氨基酸类型的所述氨基酸浓度,并且使用校准曲线或标准根据所述测量的标记计算所述氨基酸浓度,所述校准曲线或标准在所述样本的所述测量的标记与所述样本中所述氨基酸类型的所述氨基酸浓度之间转换。
472.根据条款471所述的方法,其中根据一种或多种蛋白质或氨基酸的一种或多种已知氨基酸浓度的所述测量的标记计算所述校准曲线或标准。
473.根据条款471所述的方法,其中根据所述测量的标记计算每种标记的氨基酸类型的所述氨基酸浓度,并且使用校准曲线根据所述测量的标记计算所述氨基酸浓度,所述校准曲线在所述样本的所述测量的标记与所述样本中所述氨基酸类型的所述氨基酸浓度之间转换。
474.根据条款471所述的方法,其中根据所述测量的标记计算每种标记的氨基酸类型的所述氨基酸浓度,并且使用标准根据所述测量的标记计算所述氨基酸浓度,所述标准在所述样本的所述测量的标记与所述样本中所述氨基酸类型的所述氨基酸浓度之间转换。
475.根据条款473所述的方法,其中根据一种或多种蛋白质或氨基酸的多于一种已知氨基酸浓度的所述测量的标记计算所述校准曲线。
476.根据条款474所述的方法,其中根据一种蛋白质或氨基酸的一种已知氨基酸浓度的所述测量的标记计算所述标准。
477.根据条款471、474或476所述的方法,其中多于一个标准产生校准曲线。
478.根据条款471、472、473或476中任一项所述的方法,其中所述校准曲线是非线性的。
478a.根据条款478所述的方法,其中所述非线性拟合是多项式拟合。
478b.根据条款478所述的方法,其中所述非线性拟合是幂律拟合。
478c.根据条款478所述的方法,其中所述非线性拟合是指数拟合。
478d.根据条款478所述的方法,其中所述非线性拟合是S形拟合。
479.根据条款471、472、473或476中任一项所述的方法,其中所述校准曲线是线性的。
480.根据条款471、472、473或475中任一项所述的方法,其中对于所述校准曲线计算在所述测量的标记与所述氨基酸浓度之间转换的最佳拟合。
481.根据条款480所述的方法,其中对于所述校准曲线计算在所述测量的标记与所述氨基酸浓度之间转换的所述最佳拟合是线性拟合。
482.根据条款481所述的方法,其中使用线性回归计算最佳拟合线。
483.根据条款471、472、473或475所述的方法,其中使用非线性回归计算最佳拟合。
484.根据条款481所述的方法,其中所述标记是荧光标记并且使用方程5计算与所述校准曲线的所述最佳拟合线:
标记值
其中标记值
485.根据条款483所述的方法,其中使用所述校准曲线的倒数确定所述样本的每种标记的氨基酸类型的所述氨基酸浓度,其为方程6:
其中A.A.浓度
486.根据条款481所述的方法,其中所述标记是荧光标记,并且所述标记是背景校正的,并且使用方程7计算所述校准曲线的所述最佳拟合线:
标记值
其中标记值
487.根据条款485所述的方法,其中使用校准函数的倒数确定所述样本的每种标记的氨基酸类型的所述氨基酸浓度,其为方程8:
其中A.A.浓度
488.根据条款484或486中任一项所述的方法,其中对于氨基酸类型n,所述最佳拟合线的所述斜率m
489.根据条款485或487中任一项所述的方法,其中氨基酸类型n的所述校准因子的倒数
490.根据条款488或489所述的方法,其中使用来自一种标准的一种氨基酸浓度的数据确定所述样本中每种标记的氨基酸类型的所述校准因子。
491.根据条款490所述的方法,其中所述标准是蛋白质或氨基酸。
492.根据条款490所述的方法,其中氨基酸类型n的所述校准因子的所述倒数通过以下确定:
493.根据前述条款中任一项所述的方法,其中计算所述样本中每种标记的氨基酸类型的所述氨基酸数目,并且通过将所述氨基酸浓度除以所述样本的总摩尔蛋白质浓度来计算所述样本中每种标记的氨基酸类型的所述氨基酸数目。
494.根据条款493所述的方法,其中针对目的蛋白质组、亚蛋白质组或复杂混合物的存在鉴定所述样本,并且每种标记的氨基酸类型的所述氨基酸数目是目的蛋白质组、亚蛋白质组或复杂混合物的所有蛋白质中每种标记的氨基酸类型的氨基酸的平均数。
495.根据条款494所述的方法,其中所述氨基酸的平均数是目的蛋白质组、亚蛋白质组或混合物的所有所述蛋白质中每个标记的氨基酸的氨基酸的加权平均数,通过蛋白质组、亚蛋白质组或蛋白质混合物的每种蛋白质的比例加权。
496.根据条款494或495所述的方法,其中每种氨基酸类型的氨基酸的所述加权平均数是使用方程11确定的:
其中w
497.根据条款496所述的方法,其中
498.根据条款496或497所述的方法,其中q
499.根据条款498所述的方法,其中所述目的蛋白质组或亚蛋白质组中的目的i的表达水平由公开可获得的数据确定,包括质谱或免疫测定。
500.根据条款499所述的方法,其中所述公开可获得的数据是公用数据库,诸如人类蛋白质图谱(Human Protein Atlas)、人类肽图谱(Human Peptide Atlas)和/或ProteomeXchange。
501.根据条款496或497中任一项所述的方法,其中q是所述目的蛋白质组或亚蛋白质组内含有的所有蛋白质(蛋白质i至c)的总预测表达水平,其各自使用公开可获得的蛋白质表达数据进行评估。
502.根据条款501所述的方法,其中q是所述目的蛋白质组或亚蛋白质组的总蛋白质浓度。
503.根据条款502所述的方法,其中q是使用本领域中的标准方法计算的所述目的蛋白质组或亚蛋白质组的总蛋白质浓度。
504.根据条款501和502所述的方法,其中q
505.根据条款504所述的方法,其中q
506.根据条款496所述的方法,其中q
506a.根据条款496所述的方法,其中
其中int
506b.根据条款506a所述的方法,其中q
其中int
506c.根据条款506a或506b所述的方法,其中q=∑int
其中∑int
506d.根据条款506b所述的方法,其中
其中int是质谱数据库提供的样本内单个蛋白质的强度或丰度,并且mr是质谱数据库或提供蛋白质的分子量和氨基酸序列的数据库提供的样本内的单个蛋白质的分子量。
506e.根据条款506d所述的方法,其中int是归一化强度、原始强度、归一化丰度或原始丰度。
506f.根据条款506a至506e中任一项所述的方法,其中int使用无标记定量(LFQ)计算。
506g.根据条款506a至506d中任一项所述的方法,其中所述质谱数据库是Proteome Xchange数据库。
506h.根据条款506a至506g中任一项所述的方法,其中提供蛋白质的分子量和氨基酸序列的数据库是UniProt数据库。
506i.根据条款506a至506c中任一项所述的方法,其中
平均(∑int
其中∑摩尔蛋白质浓度是由摩尔浓度值的数据库提供的目的蛋白质组、亚蛋白质组或样本类型中的所有蛋白质的摩尔蛋白质浓度的总和,并且其中平均(∑int
506j.根据条款506i所述的方法,其中根据人类肽图谱数据库计算所述摩尔浓度值。
506k.根据条款506i所述的方法,其中使用基于免疫测定的技术诸如ELISA测定来计算所述数据库中每种蛋白质的摩尔蛋白质浓度值,或其中使用基于免疫测定的技术诸如ELISA测定来计算所述数据库中每种蛋白质的质量蛋白质浓度值,并且使用每种蛋白质的分子量数据库诸如从UniProt数据库获得的分子量数据库将所述质量蛋白质浓度值转变为摩尔蛋白质浓度值。
5061.据条款506i所述的方法,其中使用基于适体的技术诸如Somascan测定来计算所述数据库中每种蛋白质的摩尔蛋白质浓度值,或其中使用基于免疫测定的技术诸如ELISA测定来计算所述数据库中每种蛋白质的质量蛋白质浓度值,并且使用每种蛋白质的分子量数据库诸如从UniProt数据库获得的分子量数据库将所述质量蛋白质浓度值转变为摩尔蛋白质浓度值。
506m.根据条款506i至506l中任一项所述的方法,其中a是针对给定的样本集通过计算下式来计算的:
506n.根据条款506m所述的方法,其中平均(∑int
506o.根据条款496所述的方法,其中
其中int是质谱数据库提供的样本内单个蛋白质的强度,∑int是根据质谱数据库计算的样本内所有单个蛋白质的所述强度的总和,并且MSIF
506p.根据条款506o所述的方法,其中q
其中int是质谱数据库提供的样本内单个蛋白质的所述强度。
506q.根据条款506o或506p所述的方法,其中q=∑int
其中∑int是根据质谱数据库计算的样本内所有单个蛋白质的所述强度的总和。
506r.根据条款506o至506q中任一项所述的方法,其中int是归一化强度、原始强度、归一化丰度或原始丰度。
506s.根据条款506o至506r中任一项所述的方法,其中int使用无标记定量(LFQ)计算。
506t.根据条款506o和506p所述的方法,其中所述质谱数据库是ProteomeXchange数据库。
506u.根据条款506n所述的方法,其中
平均(∑int)=a∑质量蛋白质浓度
其中∑质量蛋白质浓度是由质量浓度值的数据库提供的目的蛋白质组、亚蛋白质组或样本类型中的所有蛋白质的质量蛋白质浓度的总和,并且其中平均(∑int)是所述数据库内的所有样本的∑int值的平均值。
506v.根据条款506u所述的方法,其中根据人类肽图谱数据库计算所述质量蛋白质浓度值。
506w.根据条款506t至506v中任一项所述的方法,其中使用基于免疫测定的技术诸如ELISA测定计算所述数据库中每种蛋白质的所述质量蛋白质浓度值。
506x.根据条款506t至506v中任一项所述的方法,其中使用基于适体的技术诸如Somascan测定计算所述数据库中每种蛋白质的所述质量蛋白质浓度值。
506y.根据条款506u至506x中任一项所述的方法,其中a是针对给定的样本集通过计算下式来计算的:
506z.根据条款506y所述的方法,其中平均(∑int)是所述数据库中所有样本的∑int值的平均值。
507.根据条款496所述的方法,其中目的蛋白质组是病毒,并且q
508.根据条款507所述的方法,其中冠状病毒纤突蛋白的数目根据冠状病毒病毒衣壳的模型计算。
509.根据条款495所述的方法,其中每种氨基酸类型的氨基酸的加权平均数用方程12确定:
其中w
510.根据条款509所述的方法,其中所述目的蛋白质组或亚蛋白质组内的所有蛋白质被认为在所述目的蛋白质组或亚蛋白质组内具有等效表达或比例,因此所述目的蛋白质组或亚蛋白质组内的每种目的蛋白质的权重相等。
511.根据条款496或509所述的方法,其中对于所述目的蛋白质组或亚蛋白质组中的所有蛋白质i至c进行线性组合。
512.根据条款494所述的方法,其中每种氨基酸类型的氨基酸的加权平均数使用方程6确定:
其中w
513.根据条款512所述的方法,其中在492至502中使用的任何所述方法用于计算
514.根据条款495所述的方法,其中每种氨基酸类型的氨基酸的加权平均数用方程12确定:
其中w
515.根据条款494、509和514所述的方法,其中蛋白质的复杂混合物是具有多于5、6、7、8、9或10种蛋白质的混合物。
516.根据条款494、509和514所述的方法,其中蛋白质组、亚蛋白质组或蛋白质组混合物的每种蛋白质的分数、比例或组成通过将所述蛋白质的表达水平的分数与蛋白质或蛋白质组混合物内的所有蛋白质的表达水平进行比较来确定。
517.根据前述条款中任一项所述的方法,其中一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度根据所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的所述氨基酸序列计算。
518.根据条款517所述的方法,其中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的所述氨基酸序列提供每种氨基酸类型的氨基酸数目。
519.根据条款518的方法,其中所述氨基酸数目包括氨基酸序列内氨基酸类型的未修饰氨基酸的数目,其中所述氨基酸类型的未修饰氨基酸的数目是所述氨基酸序列内所述氨基酸类型的出现的数目减去所述氨基酸类型的翻译后修饰的数目。
520.根据前述条款中任一项所述的方法,其中当计算目的蛋白质、肽、寡肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列内或包含在其内的两种或更多种氨基酸类型中的每一种的所述氨基酸数目时,通过考虑翻译后修饰(PTM)来调节目的蛋白质中每种氨基酸类型的所述氨基酸数目,所述翻译后修饰以使得其与用于氨基酸标记的所述标记化学不反应的方式影响氨基酸类型。
521.根据条款520所述的方法,其中当计算目的蛋白质、肽、寡肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列内或包含在其内的两种或更多种氨基酸类型中的每一种的所述氨基酸数目时,通过考虑翻译后修饰(PTM)来调节目的蛋白质中每种氨基酸类型的所述氨基酸数目,所述翻译后修饰以使得其与用于氨基酸标记的所述标记化学不反应的方式影响定义氨基酸类型的R基团。
522.根据条款519至521所述的方法,其中关于翻译后修饰的信息能够基于实验结果获得,或使用预测获得。
523.根据条款519至522所述的方法,其中应用表4中提供的规则。
524.根据条款523所述的方法,其中如果将-1添加到氨基酸序列内的氨基酸类型的数目中,则使用本文所公开的标记化学在所述样本内标记所述氨基酸类型的未修饰的氨基酸。
525.根据条款523所述的方法,其中如果将0添加到氨基酸序列内的氨基酸类型的数目中,则使用本文所公开的所述标记化学在所述样本内标记所有所述氨基酸类型(未修饰的和修饰的氨基酸两者)。
526.根据前述条款中任一项所述的方法,其中如果在所述标记反应之前或期间在所述样本内将氨基酸类型的修饰的氨基酸转换为氨基酸类型的未修饰的氨基酸,则不应用根据条款523所述的规则。
527.根据条款495所述的方法,其中使用公开可获得的全蛋白质组PTM统计来计算目的蛋白质组或亚蛋白质组的两种或更多种氨基酸类型中的每一种的氨基酸的加权平均数。
528.根据条款495所述的方法,其中通过使用公开可获得的全蛋白质组翻译后修饰统计来计算目的蛋白质组或亚蛋白质组的未修饰的或修饰的氨基酸的数目。
529.根据条款528所述的方法,其中过滤全蛋白质组翻译后修饰统计以提供对原核生物、真核生物和包括人的哺乳动物特异的翻译后修饰频率。
530.根据条款529所述的方法,其中将病毒视为不经历翻译后修饰,因为它们不含有编码进行翻译后修饰的酶的基因。
531.根据条款530所述的方法,其中将病毒视为经历翻译后修饰或翻译后修饰的子集,所述翻译后修饰或翻译后修饰的子集是由于病毒劫持其宿主细胞的蛋白质翻译机制而在其宿主内的蛋白质经历的。
532.根据条款528至531所述的方法,其中为了预测氨基酸类型的未修饰的氨基酸的数目,或预测氨基酸类型的修饰的氨基酸的数目,然后通过将影响所述氨基酸类型的所有翻译后修饰进行求和并除以Swiss Prot数据库中所述氨基酸类型中氨基酸的总数来确定所述氨基酸类型的修饰频率,其中影响氨基酸类型的所述翻译后修饰在条款523中提供。
533.根据条款532所述的方法,其中提供了每种氨基酸类型的修饰因子,所述修饰因子可以根据有机体的种类而不同。
534.根据前述条款中任一项所述的方法,其中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度从指示与具有一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目的信息中鉴定。
535.根据条款534所述的方法,其中从数据库获得将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息。
536.根据条款535所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个蛋白质序列。
537.根据条款534、535或536所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括关于每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个蛋白质序列的翻译后修饰的信息。
538.根据条款534至537中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的标识符。
539.根据条款534至538中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的名称。
540.根据条款534至539中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的谱系。
541.根据条款534至540中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的分类群。
542.根据条款534至541中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括目的样本类型内每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的已知蛋白质浓度范围。
543.根据条款534至542中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括目的组织类型内每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的已知蛋白质浓度范围。
544.根据条款534至543中任一项所述的方法,其中从数据库获得的将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息包括目的样本类型内每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的已知蛋白质表达数据。
545.根据条款534至544中任一项所述的方法,其中将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或蛋白质浓度相关的信息是参考。
545a.根据条款545所述的方法,其中将两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目与每种目的蛋白质组或亚蛋白质组的身份和/或蛋白质浓度相关的信息作为单一参考提供。
546.根据条款1a至1h所述的方法,其中相同的两种或更多种氨基酸类型的所述已知标记值和/或氨基酸浓度与在一种或多种蛋白质浓度的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的所述样本中已标记的所述氨基酸类型相同,和/或由所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述氨基酸序列确定与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的所述样本中已标记的所述氨基酸类型相同的两种或更多种氨基酸类型的氨基酸数目。
547.根据条款546所述的方法,其中所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的所述氨基酸序列使用蛋白质测序来确定。
548.根据前述条款中任一项所述的方法,其中从数据库获得所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目。
549.前述条款中任一项的方法,其中所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目是参考。
550.根据前述条款中任一项所述的方法,其中每个参考提供了每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度作为取决于蛋白质浓度的共同参数的参数方程组或向量值函数,或其中每个参考提供了每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述氨基酸数目。
551.根据前述条款中任一项所述的方法,其中一种或多种蛋白质浓度的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度是所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述蛋白质浓度的函数。
552.根据条款551所述的方法,其中一种或多种蛋白质浓度的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度是所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述总摩尔蛋白质浓度的函数。
553.根据条款551所述的方法,其中一种或多种蛋白质浓度的一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度是所述目的亚蛋白质组或蛋白质组中的肽、寡肽、多肽、蛋白质或蛋白质复合物浓度的函数或所述总蛋白质浓度的函数。
554.根据条款551所述的方法,其中一种或多种蛋白质浓度的一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度是所述目的亚蛋白质组或蛋白质组中的总摩尔肽、寡肽、多肽、蛋白质或蛋白质复合物浓度的函数或所述总摩尔蛋白质浓度的函数。
555.根据条款551所述的方法,其中每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度作为取决于蛋白质浓度的共同参数的向量值函数提供。
556.根据条款551所述的方法,其中每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度作为取决于蛋白质浓度的共同参数的向量函数提供。
557.根据条款551所述的方法,其中每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度作为取决于所述目的亚蛋白质组或蛋白质组中总摩尔蛋白质、肽、寡肽、多肽、蛋白质复合物或总摩尔蛋白质浓度的所述共同参数的向量函数提供。
558.根据条款555至557所述的方法,其中提供每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述氨基酸浓度的所述向量的方向是每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种氨基酸类型的氨基酸数目或加权平均数。
559.根据条款558所述的方法,其中提供每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述氨基酸浓度的所述向量的所述方向是每种蛋白质、肽、寡肽、多肽、蛋白质复合物中每种氨基酸类型的氨基酸数目或加权平均数。
560.根据条款555至559所述的方法,其中如果所述样本中所有氨基酸类型的所述标记的值经背景校正,则所述向量在原点处开始,或如果所述样本中每种/任何氨基酸类型的所述标记的所述值未经背景校正,则所述向量在提供所述样本中标记和测量的n种氨基酸类型中的每一种的所述背景值的点(n-元组)处开始。
561.根据条款555至559所述的方法,其中所述向量由能够从已知或计算的蛋白质表达数据获得的蛋白质浓度的下限和上限界定。
562.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数是向量函数1并且采取以下形式:
根据其中p
563.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
根据其中p
564.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
565.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数是向量函数2并且采取以下形式:
根据其中p
566.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
567.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数是向量函数3并且采取以下形式:
其中p
568.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
569.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数是向量函数4并且采取以下形式:
其中p
570.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
/>
其中p
571.根据条款557所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
572.根据条款546所述的方法,其中使用参数方程组根据所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列计算一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度。
573.根据条款572所述的方法,其中所述参数方程组由能够从已知或计算的蛋白质表达数据获得的蛋白质浓度的下限和上限界定。
574.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的所述参数方程组是参数方程组1并且采取以下形式:
根据其中p
575.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的参数方程组采取以下形式:
其中p
576.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的所述参数方程组是参数方程组2并且采取以下形式:
根据其中p
577.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的参数方程组采取以下形式:
其中p
578.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的所述参数方程组是参数方程组3并且采取以下形式:
其中p
579.根据条款572或573中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的参数方程组采取以下形式:
其中p
580.根据条款550中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
581.根据条款550中任一项所述的方法,其中取决于蛋白质浓度的所述共同参数的所述向量函数采取以下形式:
其中p
582.根据条款572所述的方法,其中使用参数方程1或3或向量函数1或3的组根据所述一种或多种蛋白质、肽、寡肽、多肽或蛋白质复合物的所述氨基酸序列计算一种或多种蛋白质、肽、寡肽、多肽或蛋白质复合物中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度。
583.根据条款572所述的方法,其中使用参数方程2或4或向量函数2或4的组根据所述一种或多种目的蛋白质组或亚蛋白质组的所述氨基酸序列计算一种或多种目的蛋白质组或亚蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度。
584.根据条款549所述的方法,其中从数据库获得所述参考。
585.根据前述条款中任一项所述的方法,其中步骤e)包含当所述样本中每种标记的氨基酸类型的所述测量的标记、氨基酸浓度和/或氨基酸数目与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中所述样本中已标记的相同的两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目的误差容限相同或者小于或等于所述误差容限时,鉴定所述样本中所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。
586.根据条款585所述的方法,其中所述误差容限包括用户特定的公差值,或是所述样本的所述标记的氨基酸类型的所述测量的标记、氨基酸浓度或数目与所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目之间的最小距离的顺序统计量,其中k阶统计量是第k个最小值。
587.根据条款585所述的方法,其中所述误差容限是所述样本的所述标记的氨基酸类型的所述测量的标记、氨基酸浓度或数目与所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目之间的距离阈值。
588.根据条款587所述的方法,其中所述样本的所述标记的氨基酸类型的所述测量的标记、氨基酸浓度或数目与每种目的蛋白质、肽、寡肽、多肽、蛋白质复合体、亚蛋白质组或蛋白质组中相同氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目之间的距离是欧几里德距离(Euclidian distance)测量值。
589.根据条款585所述的方法,其中所述误差容限是所述样本的所述标记的氨基酸类型的所述测量的标记、氨基酸浓度或数目与所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目之间的最小距离。
590.根据条款588所述的方法,其中使用方程17计算欧几里德距离测量值:
其中S
591.根据条款585所述的方法,其中所述误差容限包括用户特定的公差值乘以针对所述样本测量的两种或更多种氨基酸类型的所述标记值、氨基酸浓度或氨基酸数目。
592.根据条款585所述的方法,其中所述误差容限包括用户特定的公差值乘以针对所述样本所测量的两种或更多种氨基酸类型的所述标记值、氨基酸浓度或氨基酸数目的平方的总和的平方根。
593.根据条款585所述的方法,其中所述误差容限是由用户输入的公差值提供的,所述公差值乘以所述样本值的平方的平方根,反映所述距离计算。这由方程8提供:
其中ε是误差容限,
594.根据条款593所述的方法,其中所述用户指定的公差值
595.根据条款585所述的方法,其中如果怀疑所述样本含有k种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,则所述误差容限是对所有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组计算k
596.根据条款585所述的方法,其中如果怀疑所述样本含有k种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,则将所述距离分类,并且所述误差容限为k最小距离。
597.根据前述条款中任一项所述的方法,其中步骤e)包含将所述样本中每种标记的氨基酸类型的所述测量的标记与一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述已知标记值进行比较,其中在一种或多种蛋白质浓度下所述一种或多种目的蛋白质、肽、寡肽,多肽,蛋白质复合物、亚蛋白质组或蛋白质组的所述两种或更多种氨基酸类型的所述已知标记值是根据使用向量函数或参数方程组的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述一个或多个氨基酸序列和/或关于翻译后修饰的实验信息计算的。
598.根据前述条款中任一项所述的方法,其中步骤e)包含将所述样本中每种标记的氨基酸类型的所述氨基酸浓度与一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述氨基酸浓度进行比较,其中在一种或多种蛋白质浓度下所述一种或多种目的蛋白质、肽、寡肽,多肽,蛋白质复合物、亚蛋白质组或蛋白质组的所述两种或更多种氨基酸类型的所述氨基酸浓度是根据使用向量函数或参数方程组的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述一个或多个氨基酸序列和/或关于翻译后修饰的实验信息计算的。
599.前述条款中任一项的方法,其中步骤e)包含将所述样本中每种标记的氨基酸类型的所述氨基酸数目与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的两种或更多种氨基酸类型的所述氨基酸数目进行比较,其中所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述两种或更多种氨基酸类型的所述氨基酸数目是根据所述一个或多个目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述一个或多个氨基酸序列和/或关于翻译后修饰的实验信息计算的。
600.根据前述条款中任一项所述的方法,其中步骤e)包含使用n维空间将所述样本中每种标记的氨基酸类型的所述测量的标记、氨基酸浓度或氨基酸数目与一种或多种蛋白质浓度的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度,或所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的氨基酸数目进行比较。
601.根据前述条款中任一项所述的方法,其中步骤e)包含使用n维空间的将所述样本中每种标记的氨基酸类型的所述测量的标记、氨基酸浓度和/或氨基酸数目与作为蛋白质浓度的函数的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度,或所述一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或目的蛋白质组中相同的两种或更多种氨基酸类型的氨基酸数目进行比较,其中作为蛋白质浓度的函数的所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度提供n维空间中的线或曲线,其能够任选地由生物样本中的已知蛋白质表达水平界定,并且所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述氨基酸数目提供n维空间中的点。
602.根据条款601所述的方法,其中在所述样本中标记2个氨基酸,并且所述n维空间是2维空间。
603.根据条款601所述的方法,其中在所述样本中标记3个氨基酸,并且所述n维空间是3维空间。
604.根据条款601所述的方法,其中在所述样本中标记4个氨基酸,并且所述n维空间是4维空间。
605.根据条款601所述的方法,其中在所述样本中标记5个氨基酸,并且所述n维空间是5维空间。
606.根据条款601所述的方法,其中在所述样本中标记6个氨基酸,并且所述n维空间是6维空间。
607.根据条款601所述的方法,其中在所述样本中标记7个氨基酸,并且所述n维空间是7维空间。
608.根据条款601所述的方法,其中在所述样本中标记8个氨基酸,并且所述n维空间是8维空间。
609.根据条款601所述的方法,其中在所述样本中标记9个氨基酸,并且所述n维空间是9维空间。
610.根据条款601所述的方法,其中在所述样本中标记10个氨基酸,并且所述n维空间是10维空间。
611.根据条款601所述的方法,其中在所述样本中标记11个氨基酸,并且所述n维空间是11维空间。
612.根据条款601所述的方法,其中在所述样本中标记12个氨基酸,并且所述n维空间是12维空间。
613.根据条款601所述的方法,其中在所述样本中标记13个氨基酸,并且所述n维空间是13维空间。
614.根据条款601所述的方法,其中在所述样本中标记14个氨基酸,并且所述n维空间是14维空间。
615.根据条款601所述的方法,其中在所述样本中标记15个氨基酸,并且所述n维空间是15维空间。
616.根据条款601所述的方法,其中在所述样本中标记16个氨基酸,并且所述n维空间是16维空间。
617.根据条款601所述的方法,其中在所述样本中标记17个氨基酸,并且所述n维空间是17维空间。
618.根据条款601所述的方法,其中在所述样本中标记18个氨基酸,并且所述n维空间是18维空间。
619.根据条款601所述的方法,其中在所述样本中标记19个氨基酸,并且所述n维空间是19维空间。
620.根据条款601所述的方法,其中在所述样本中标记20个氨基酸,并且所述n维空间是20维空间。
621.根据条款601所述的方法,其中在所述样本中标记21个氨基酸,并且所述n维空间是21维空间。
622.根据条款601所述的方法,其中在所述样本中标记22个氨基酸,并且所述n维空间是22维空间。
623.根据条款601所述的方法,其中在所述样本中标记23个氨基酸,并且所述n维空间是23维空间。
624.根据条款601所述的方法,其中在所述样本中标记24个氨基酸,并且所述n维空间是24维空间。
625.根据条款601所述的方法,其中在所述样本中标记25个氨基酸,并且所述n维空间是25维空间。
626.根据条款601所述的方法,其中在所述样本中标记26个氨基酸,并且所述n维空间是26维空间。
627.根据条款601所述的方法,其中在所述样本中标记27个氨基酸,并且所述n维空间是27维空间。
628.根据条款601所述的方法,其中在所述样本中标记28个氨基酸,并且所述n维空间是28维空间。
629.根据条款601所述的方法,其中在所述样本中标记29个氨基酸,并且所述n维空间是29维空间。
630.根据条款601所述的方法,其中在所述样本中标记30个氨基酸,并且所述n维空间是30维空间。
631.根据条款601所述的方法,其中在所述样本中标记31个氨基酸,并且所述n维空间是31维空间。
632.根据条款601所述的方法,其中在所述样本中标记32个氨基酸,并且所述n维空间是32维空间。
633.根据条款601所述的方法,其中在所述样本中标记33个氨基酸,并且所述n维空间是33维空间。
634.根据条款601所述的方法,其中在所述样本中标记34个氨基酸,并且所述n维空间是34维空间。
635.根据条款601所述的方法,其中在所述样本中标记35个氨基酸,并且所述n维空间是35维空间。
636.根据条款601所述的方法,其中在所述样本中标记36个氨基酸,并且所述n维空间是36维空间。
637.根据条款601所述的方法,其中在所述样本中标记37个氨基酸,并且所述n维空间是37维空间。
638.根据条款601所述的方法,其中在所述样本中标记38个氨基酸,并且所述n维空间是38维空间。
639.根据条款601所述的方法,其中在所述样本中标记39个氨基酸,并且所述n维空间是39维空间。
640.根据条款601所述的方法,其中在所述样本中标记40个氨基酸,并且所述n维空间是40维空间。
641.根据条款585所述的方法,其中如果存在单个蛋白质浓度的值,则在所述样本中鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,对于所述单个蛋白质浓度的值,在所述样本中测量的两种或更多种氨基酸类型的所述标记或氨基酸浓度的值等于或者小于或等于由一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考函数提供的两种或更多种氨基酸类型的所述标记的已知值或氨基酸浓度的误差容限。
642.根据条款585所述的方法,其中在所述样本中鉴定的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的蛋白质浓度是在所述样本中测量的两种或更多种氨基酸类型的所述标记或氨基酸浓度的值等于或者小于或等于由所述样本中鉴定的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述参考函数提供的两种或更多种氨基酸类型的所述标记的已知值或氨基酸浓度的误差容限的所述蛋白质浓度。
643.根据条款642所述的方法,其中在所述样本中鉴定的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的蛋白质量是在所述样本中鉴定的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述蛋白质浓度乘以所述样本的体积。
644.根据前述条款中任一项所述的方法,其中如果存在单个蛋白质浓度的值,则在所述样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,其中对于所述单个蛋白质浓度的值,对所述样本测量的两种或更多种氨基酸类型的所述氨基酸浓度等于通过其参考向量函数或参数方程组为所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组提供的相同的两种或更多种对应氨基酸类型的氨基酸浓度。
645.根据条款228所述的方法,其中如果存在蛋白质浓度t的单一解,则所述样本点在参考线上,并且t的所述解是样本中鉴定的所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的蛋白质浓度。
646.根据条款585所述的方法,其中如果存在单一的蛋白质浓度值,则在所述样本中鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,对于所述单一的蛋白质浓度值,在所述样本中测量的两种或更多种氨基酸类型的所述标记或氨基酸浓度的值小于或等于由一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考函数提供的两种或更多种氨基酸类型的所述标记的已知值或氨基酸浓度的误差容限。
647.根据条款234所述的方法,其中计算在所述样本中测量的两种或更多种氨基酸类型的所述标记或氨基酸浓度的值与由一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述参考函数提供的两种或更多种氨基酸类型的所述标记的已知值或氨基酸浓度之间的距离。
648.根据条款647所述的方法,其中通过在所述参考线上找到点来计算在所述样本中测量的两种或更多种氨基酸类型的所述标记或氨基酸浓度的值与由一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的所述参考函数提供的两种或更多种氨基酸类型的所述标记的已知值或氨基酸浓度之间的最小距离,对于所述点,样本点与参考线之间的距离是垂直的。
649.根据条款648所述的方法,其中通过提供所述样本点与所述参考线之间的向量的通用向量方程,获取所述向量与所述参考线的方向向量的点积,将所述点积设置为等于0,并且求解蛋白质浓度t,这是产生与所述样本点的距离垂直的点的参考线的蛋白质浓度,以求所述参考线上的所述样本点与所述参考线之间的距离垂直的点。
650.根据条款649所述的方法,其中计算在所述参考线上所述蛋白质浓度下每种氨基酸类型的所述氨基酸浓度或所述标记的值,并且计算所述点与所述样本点之间的距离并且与所述误差容限进行比较。
651.根据条款650所述的方法,其中如果所述距离小于或等于所述误差容限,则所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组以所述距离垂直的所述蛋白质浓度包含在所述样本中。
652.根据条款647所述的方法,其中如果在所述样本中鉴定了多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,则在所述样本中鉴定了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物,并且所述混合物内的每种组分的相对组成与针对所述样本测量的值与针对所述混合物的每种鉴定的组分提供的值之间的距离成反比。
653.根据条款652所述的方法,其中所述混合物内的每种组分的所述相对组成通过将所述样本与每种组分之间的距离与所述样本与任何组分之间的最大距离逆归一化来确定。
654.根据条款653所述的方法,其中将每个组分的逆归一化距离除以所有组分的所述逆归一化距离的总和以提供所述混合物内每种组分的所述相对组成。
655.根据条款652所述的方法,其中将所述混合物内每种组分的所述相对组成乘以鉴定每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组时的蛋白质浓度,以提供所述混合物内每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度。
656.根据前述条款中任一项所述的方法,其中目的亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目是基于基于所述目的蛋白质组或亚蛋白质组内含有的所有氨基酸序列的每种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目的加权平均值。
657.根据前述条款中任一项所述的方法,其中目的亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述氨基酸数目是所述目的蛋白质组或亚蛋白质组内含有的所有氨基酸序列中每种氨基酸类型的所述氨基酸数目的加权平均值。
658.根据条款656所述的方法,其中使用所述目的蛋白质组或亚蛋白质组内含有的所有氨基酸序列的每种氨基酸类型的氨基酸的加权平均数计算目的亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值或氨基酸浓度。
659.根据前述条款中任一项所述的方法,其中步骤e)包含从所述样本中去除任何目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,其中每种氨基酸类型的所述测量的标记、氨基酸浓度或数目是指目的复制的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组。
660.根据前述条款中任一项所述的方法,其中步骤e)包含当所述样本中每种标记的氨基酸类型的所述测量的标记、氨基酸浓度或氨基酸数目与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目的误差容限相同或者小于或等于所述误差容限时,并且当所鉴定的浓度在基于目的样本类型中所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的已知浓度水平的蛋白质浓度界限(c
661.根据条款233至238所述的方法,其中当经由所述样本点与所述向量上对应于目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的任何点之间的向量与对应于所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的所述向量的方向之间的点积,求所述样本点与所述向量上对应于目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的任何点之间的最小距离时,仅考虑对应于所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的所述向量的方向。
662.根据条款564、566、568所述的方法,其中当计算所述点积时,对应于所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的所述向量被视为无界限,或仅在所述原点处有界限。
663.根据条款1a至1h所述的方法,其中在所述样本中三种氨基酸类型被标记,并且将所述样本中三种标记的氨基酸类型中的每一种的所述测量的标记、氨基酸浓度或氨基酸数目与不超过200个目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相同的三种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目进行比较。
664.根据条款1a至1h中任一项所述的方法,其中在所述样本中三种氨基酸类型被标记,并且将所述样本中所述三种标记的氨基酸类型中的每一种的所述测量的标记、氨基酸浓度或氨基酸数目与不超过9000个目的蛋白质组或亚蛋白质组的相同的三种氨基酸类型的所述已知标记值、氨基酸浓度或氨基酸数目进行比较。
665.根据前述条款中任一项所述的方法,其中所述目的蛋白质组或亚蛋白质组具有少于4000个蛋白质。
666.根据前述条款中任一项所述的方法,其中不对所述样本进行测序以经由所述样本中所述氨基酸的顺序鉴定所述目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组。
667.根据前述条款中任一项所述的方法,其中所述样本不需要分离成单个蛋白质组分以鉴定所述样本中目的蛋白质组、亚蛋白质组或蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量。
668.根据条款1至350中任一项所述的方法,步骤a)包含在标记之前从所述样本中分离所述蛋白质组分。
669.根据条款668所述的方法,其中使用离心、过滤、电泳或色谱法分离所述蛋白质组分。
670.根据条款669所述的方法,其中色谱法分离涉及HPLC。
671.根据前述条款中任一项所述的方法,其中所述方法在本体中进行。
672.根据前述条款中任一项所述的方法,其中步骤d)和e)在分类器中进行。
673.根据条款472或475中任一项所述的方法,其中在所述样本中标记的氨基酸类型的氨基酸比例与在用于产生校准曲线的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
674.根据条款472或476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的氨基酸比例与用作标准的任何蛋白质中标记的所述氨基酸比例相同。
675.根据条款472或476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的氨基酸比例与用作标准的任何氨基酸中标记的所述氨基酸比例相同。
676.根据条款472和475中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-5%的氨基酸比例与在用于产生校准曲线的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
677.根据条款472和476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-5%的氨基酸比例与用作标准的任何蛋白质中标记的所述氨基酸比例相同。
678.根据条款472和476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-5%的氨基酸比例与用作标准的任何氨基酸中标记的所述氨基酸比例相同。
679.根据条款472和475中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-10%的氨基酸比例与在用于产生校准曲线的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
680.根据条款472和476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-10%的氨基酸比例与用作标准的任何蛋白质中标记的所述氨基酸比例相同。
681.根据条款472和476中任一项所述的方法,其中在所述样本中标记的氨基酸类型的+/-10%的氨基酸比例与用作标准的任何氨基酸中标记的所述氨基酸比例相同。
682.根据条款225或545所述的方法,其中将所述样本中两种或更多种氨基酸类型的所述氨基酸浓度与所述一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述氨基酸浓度进行比较,其中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的所述氨基酸浓度是实验参考。
683.根据条款682所述的方法,其中在所述样本中标记的氨基酸类型的氨基酸比例与在用于产生校准曲线和任何实验参考的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
684.根据条款682所述的方法,其中在所述样本中标记的氨基酸类型的氨基酸比例与在用作标准和任何实验参考的任何蛋白质中标记的所述氨基酸比例相同。
685.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的氨基酸比例与在用作标准的任何氨基酸中标记的所述氨基酸比例相同。
686.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/-5%的氨基酸比例与在用于产生校准曲线的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
687.根据条款682中任一项所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/-5%的氨基酸比例与用作标准的任何蛋白质中标记的所述氨基酸比例相同。
688.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/-5%的氨基酸比例与在用作标准的任何氨基酸中标记的所述氨基酸比例相同。
689.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/-10%的氨基酸比例与在用于产生校准曲线的任何/所有蛋白质和/或氨基酸中标记的所述氨基酸比例相同。
690.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/10%的氨基酸比例与在用作标准的任何蛋白质中标记的所述氨基酸比例相同。
691.根据条款682所述的方法,其中在所述样本和任何实验参考中标记的氨基酸类型的+/-10%的氨基酸比例与在用作标准的任何氨基酸中标记的所述氨基酸比例相同。
692.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例。
693.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-5%。
694.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-5%。
695.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-5%。
696.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-10%。
697.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-10%。
698.根据条款682所述的方法,其中在所述样本和任何实验参考中标记氨基酸类型的相同的氨基酸比例为+/-10%。
699.根据条款1c所述的方法,其中所述细菌蛋白质组是沙n氏菌和/或大肠杆菌。
700.根据条款1d所述的方法,其中所述目的病毒蛋白质组是SARS-CoV-2蛋白质组。
701.根据条款1d所述的方法,其中所述目的病毒蛋白质组是动物源性病毒蛋白质组。
702.根据条款1d所述的方法,其中所述目的病毒蛋白质组是HIV蛋白质组。
703.根据条款1f所述的方法,其中所述目的人蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组用于癌症的早期检测。
704.根据条款1g所述的方法,其中所述感染是动物源性感染。
附图说明
下面将参考附图描述本发明的实施例,其中:
图1示出了绘示针对目的蛋白质-A、目的蛋白质-B、目的蛋白质-C和目的蛋白质-D计算的独特特征如何作为每种目的蛋白质的蛋白质浓度的函数而变化的示意图。为每种目的蛋白质提供参考向量,并且参考向量上的每个点对应于目的蛋白质的独特蛋白质浓度(例如1μM,实心圆)。计算从样本点(空心正方形)到每个参考线的最短距离,鉴定样本中目的蛋白质-B的存在;样本中目的蛋白质-B的浓度是提供最短距离(例如0.5μM)的目的蛋白质-B的蛋白质浓度。
图2示出了n维空间中的参考线。参数方程组1提供下列BSA、LYZ和TTR的参考线。样本点用空心圆示出。本发明的方法包括基于样本点与每条参考线之间距离的比较,确定样本中目的蛋白质/蛋白质复合物的存在和/或浓度和/或量。
图3示出了致病性蛋白质组的独特特征。(a)分析的所有7581种细菌参考蛋白质组具有细菌参考蛋白质组中所有蛋白质的已知标记值、氨基酸浓度或氨基酸平均数的独特特征。(b)示出每个平均蛋白质序列内两种或更多种氨基酸类型的氨基酸数目的平均数的广泛分布的缩放图像。(c)所分析的所有9377种病毒参考蛋白质组具有病毒参考蛋白质组中所有蛋白质的已知标记值、氨基酸浓度或氨基酸平均数的独特特征。(d)所分析的所有16958种细菌和病毒参考蛋白质组具有细菌或病毒参考蛋白质组中所有蛋白质的已知标记值、氨基酸浓度或氨基酸平均数的独特特征。这使得能够在不分离的情况下鉴定样本中的完整蛋白质组。
图4示出了根据本福特定律(Benford′s law)对数集中前导数位的概率分布的分析,其示出了人血浆蛋白质组中的氨基酸类型遵循预期分布。
图5示出了根据本福特定律对数集中前导数位的概率分布的分析,其示出了病毒蛋白质组中蛋白质、肽、寡肽、多肽和蛋白质亚基的氨基酸平均数偏离预期分布,表明该数据集中相对于人蛋白质组的变异性增加。
图6示出了根据本福特定律对数集中前导数位的概率分布的分析,其示出了细菌蛋白质组中蛋白质、肽、寡肽、多肽和蛋白质亚基的氨基酸平均数偏离预期分布,表明该数据集中相对于人蛋白质组的变异性增加。
图7示出了与仅鉴定蛋白质序列内的氨基酸数目相比,鉴定人蛋白质组中蛋白质序列内的氨基酸顺序是无效的。鉴定蛋白质序列内两种类型氨基酸的顺序不增加鉴定蛋白质序列内一种类型氨基酸的顺序的附加信息。
图8示出了将参考线约束在人血浆蛋白质组内已知蛋白质浓度范围的效果展示。(a)人血浆蛋白质组内所有3263种蛋白质、肽、寡肽、多肽和蛋白质复合物的参考线。(b)人血浆蛋白质组内所有3263种蛋白质、肽、寡肽、多肽和蛋白质复合物的有界参考线,其中参考线以人血浆蛋白质组内这些蛋白质、肽、寡肽、多肽和蛋白质复合物的已知浓度范围为界限。
图9示出了参考事件,其涉及与已知的蛋白质浓度界限相比,可经由本发明的方法获得的有和没有蛋白质浓度信息的氨基酸类型的各种组合(C和W、K和W、K和Y、K和S、K和P、L和S、L和K、E和L、G和L、C K和W、C K和Y、L K和S、E G和K、E G和S、R E P和T,和Q L K和V)的人血浆蛋白质组中定量的多于一种目的蛋白质。
图10示出了当标记和比较两种氨基酸类型时,在不对蛋白质浓度或其它分类施加任何界限或约束的情况下,所有参考是可区分的,并且独特地映射到所考虑的大多数临床相关蛋白质组和亚蛋白质组(SARS-CoV-2、HIV、爱泼斯坦-巴尔、神经胶质瘤)内的目的蛋白质,并且不对应于临床相关蛋白质组和亚蛋白质组内的多种目的蛋白质。
图11示出了将两种氨基酸类型的所有组合提供的信息内容与(a)人血浆蛋白质组和(b)人唾液蛋白质组内蛋白质序列的参考的独特性进行比较。
图12示出了所有参考细菌蛋白质组(7581种参考蛋白质组)在其蛋白质组中蛋白质的两种氨基酸类型内具有氨基酸的平均数,这与所有其它蛋白质组中蛋白质的两种氨基酸类型内的所有其它氨基酸的平均数不同。
图13示出了为了仅标记目的蛋白质组内两种氨基酸类型,细菌和病毒蛋白质组根据它们的谱系聚集在一起。这里提供了K和W氨基酸类型的标记,示出了在以下顺序中的聚类:棒状杆菌科(Corynebacteriaceae)、军团菌目(Legionellales)、芽孢杆菌目(Bacillales)、链霉菌科(Streptomycetaceae)和支原体科(Mycoplasmataceae)。
图14描述了对未知蛋白质混合物的处理。混合物的身份是未知的,并且混合物的蛋白质浓度是未知的。
图15示出了不能仅基于蛋白质序列预测流体动力学半径,因为现有技术的缩放方法仍然需要知道蛋白质是折叠还是未折叠的,并且没有考虑部分内在无序。
图16示出了(a)色氨酸(W)、(b)酪氨酸(Y)、(c)还原的半胱氨酸(C
图17示出了患者样本与(a)C和K、(b)C和W,和(C)K和W SARS-CoV-2和A型流感参考线的比较。
图18示出了从以任意单位(AU)计的K氨基酸类型K F.I.的背景校正的荧光强度转换为以μM计的K氨基酸类型[K]的氨基酸浓度的校准曲线。非线性回归揭示了对于R
图19示出了从以任意单位(AU)计的C氨基酸类型C F.I.的背景校正的荧光强度转换为以μM计的C氨基酸类型[C]的氨基酸浓度的校准曲线。非线性回归揭示了对于R
图20示出了从以任意单位(AU)计的W氨基酸类型W F.I.的背景校正的荧光强度转换为以μM计的W氨基酸类型[W]的氨基酸浓度的校准曲线。非线性回归揭示了对于R
图21示出了当在N维空间(4维空间)中绘制每个用实验方法测量的患者PPP样本的三个技术复制品上的平均测量的氨基酸浓度时,数据在N维空间中呈现的线如本发明的概念所预测的。通过绘制穿过数据集的线来绘示概念线。为了计算定义目的PPP蛋白质组的参考线的实际位置和方程,定义目的PPP蛋白质组的向量函数的K、C、W和Y分量在下面的图中用实验方法计算。
图22示出了实验参考线的K分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型K的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图23示出了实验参考线的C分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型C的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图24示出了实验参考线的W分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型W的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图25示出了实验参考线的Y分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型Y的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图26示出了实验参考线的K分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型K的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图27示出了实验参考线的C分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型C的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图28示出了实验参考线的W分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型W的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μg/mL计的总蛋白质浓度绘制,并且进行线性回归。约束线性回归穿过原点。在后续8个图中,解释了实验参考线的分量的系数(方向)是如何基于共同的摩尔参数,而不是质量、蛋白质浓度。
图29示出了实验参考线的K分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型K的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图30示出了实验参考线的C分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型C的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图31示出了实验参考线的W分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型W的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图32示出了实验参考线的Y分量的系数(方向)是如何针对目的PPP和PRP蛋白质组计算的。将测量的氨基酸类型Y的以μM计的氨基酸摩尔浓度相对于测量的每种目的蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图33示出了实验参考线的K分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型K的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图34示出了实验参考线的C分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型C的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图35示出了实验参考线的W分量的系数(方向)是如何针对目的PPP_50和PRP_50亚蛋白质组计算的。将测量的氨基酸类型W的以μM计的氨基酸摩尔浓度相对于测量的每种目的亚蛋白质组的以μM计的总蛋白质摩尔浓度绘制,并且进行线性回归。约束线性回归穿过原点。
图36示出了在每个患者样本的三个技术复制品(星形)和理论参考线(实线)上测量的平均氨基酸浓度。用实验方法测量的数据集与预测的参考线之间密切一致绘示了本文所公开的方法的稳健性,其中任何目的蛋白质组或亚蛋白质组可以通过单一参考用代数方法描述,该参考是总蛋白质浓度的共同参数的向量函数。
图37示出了目的PPP和PRP蛋白质组的氨基酸类型K的以μM计的氨基酸浓度对氨基酸类型C的以μM计的氨基酸浓度。将该数据集分割成训练集和检验集,训练集用于训练分类器以基于其测量的K和C氨基酸类型的浓度来鉴定患者样本的目的蛋白质组。
图38示出了图37中解释的经训练的分类器的预测。没有示出不正确的预测,因为其100%的预测是正确的。
图39示出了仅使用根据两种标记的氨基酸类型:K和C的标记的测量值计算的氨基酸浓度的PPP对PRP蛋白质组鉴定的K-最近邻(K-Nearest Neighbor,KNN)分类器的100%准确度百分比(使用精细(Fine)KNN的真实对预测分类)。
图40示出了高分类灵敏度和特异性对所使用的分类器类型是稳健的。例如,示出了只使用两种氨基酸类型K和C的PPP对PRP蛋白质组鉴定的100%准确度百分比(使用袋装决策树分类器的真实对预测分类)。附加地,基于根据两种标记的氨基酸类型:K和C的标记的测量值计算的氨基酸浓度,不需要优化或超参数调整来实现分类器性能的该水平(100%准确度)。
图41示出了只使用两种氨基酸类型K和C的PPP对PRP蛋白质组鉴定的100%阳性预测值(使用袋装决策树分类器的真实对预测分类)。
图42示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP和PRP蛋白质组的实验参考线的K系数。患者性别或年龄对为每个患者计算的实验蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定蛋白质组学特征。
图43示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP和PRP蛋白质组的实验参考线的C系数。患者性别或年龄对为每个患者计算的实验蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定蛋白质组学特征。
图44示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP和PRP蛋白质组的实验参考线的W系数。患者性别或年龄对为每个患者计算的实验蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定蛋白质组学特征。
图45示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP和PRP蛋白质组的实验参考线的Y系数。患者性别或年龄对为每个患者计算的实验蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定蛋白质组学特征。
图46示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP_50和PRP_50亚蛋白质组的实验参考线的K系数。患者性别或年龄对为每个患者计算的实验亚蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的亚蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定亚蛋白质组学特征。
图47示出了作为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP_50和PRP_50亚蛋白质组的实验参考线的C系数。患者性别或年龄对为每个患者计算的实验亚蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的亚蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定亚蛋白质组学特征。
图48示出了为患者年龄的函数绘制的每个个体男性和女性患者的目的PPP_50和PRP_50亚蛋白质组的实验参考线的W系数。患者性别或年龄对为每个患者计算的实验亚蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的亚蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定亚蛋白质组学特征。
图49示出了根据健康患者质谱数据计算的w
图50示出了卵巢癌血浆样本、胰腺癌血浆样本、结肠直肠癌血浆样本和健康患者血浆(PPP)样本的氨基酸类型C、W、Y和K的以μM计的氨基酸浓度,其绘制在N维空间中,并且观察到这些数据集中的每一个采取如本文所讲解的参考线(其为总蛋白质浓度的共同参数的函数)的形式。
图51示出了对于卵巢癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型K的以μM计的氨基酸浓度和卵巢癌参考线的K系数(方向)的计算。
图52示出了对于卵巢癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型C的以μM计的氨基酸浓度和卵巢癌参考线的C系数(方向)的计算。
图53示出了对于卵巢癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型W的以μM计的氨基酸浓度和卵巢癌参考线的W系数(方向)的计算。
图54示出了对于卵巢癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型Y的以μM计的氨基酸浓度和卵巢癌参考线的Y系数(方向)的计算。
图55示出了对于胰腺癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型K的以μM计的氨基酸浓度和胰腺癌参考线的K系数(方向)的计算。
图56示出了对于胰腺癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型C的以μM计的氨基酸浓度和胰腺癌参考线的C系数(方向)的计算。
图57示出了对于胰腺癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型W的以μM计的氨基酸浓度和胰腺癌参考线的W系数(方向)的计算。
图58示出了对于胰腺癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型Y的以μM计的氨基酸浓度和胰腺癌参考线的Y系数(方向)的计算。
图59示出了对于结肠直肠癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型K的以μM计的氨基酸浓度和结肠直肠癌参考线的K系数(方向)的计算。
图60示出了对于结肠直肠癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型C的以μM计的氨基酸浓度和结肠直肠癌参考线的C系数(方向)的计算。
图61示出了对于结肠直肠癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型W的以μM计的氨基酸浓度和结肠直肠癌参考线的W系数(方向)的计算。
图62示出了对于结肠直肠癌血浆蛋白质组,作为以μM计的总摩尔蛋白质浓度的函数绘制的氨基酸类型Y的以μM计的氨基酸浓度和结肠直肠癌参考线的Y系数(方向)的计算。
图63示出了当进行本文所描述的向量函数方法作为确定患者样本中目的蛋白质组或亚蛋白质组的存在和/或浓度和/或量的一种可能方式时,获得非常高的敏感性和特异性以确定患者血浆中结肠直肠癌、卵巢癌和胰腺癌的存在与否。具体地,如在所提供的混淆矩阵中所概述的,对于从血浆中鉴定结肠直肠癌和胰腺癌实现了100%准确度,对于从血浆中鉴定卵巢癌实现了90%准确度,并且对于将癌症阴性的健康样本正确鉴定为癌症阴性的健康样本实现了95%的特异性。
图64示出了作为在本文中描述的(定量)向量函数方法的一部分确定的目的蛋白质组的浓度和/或量是高度准确的,对于所有目的蛋白质组,遵循线y=x,并且允许以非常低的误差(仅2%的误差)确定患者样本内的目的蛋白质组的浓度和/或量。
图65示出了还可以使用机器学习分类器在血浆中鉴定目的蛋白质组。对患者血浆样本的K、C、W和Y氨基酸类型的摩尔(μM)氨基酸浓度进行线性支持向量机(SVM)分类器训练,其中保留25%的数据。对于每种目的癌症蛋白质组(所有癌症患者样本)以及健康目的蛋白质组(所有健康患者样本)获得100%阳性预测值和0%错误发现率。
图66示出了也可以使用仅对三种标记的氨基酸类型的氨基酸浓度训练的机器学习分类器在血浆中鉴定目的蛋白质组。对患者血浆样本的K、C和W氨基酸类型的摩尔(μM)氨基酸浓度进行线性支持向量机(SVM)分类器训练,其中保留25%的数据。对于每种目的癌症蛋白质组(所有癌症患者样本)以及健康目的蛋白质组(所有健康患者样本)获得100%阳性预测值和0%错误发现率。
图67示出了也可以使用仅对两种标记的氨基酸类型的氨基酸浓度训练的机器学习分类器在血浆中鉴定目的蛋白质组。仅对患者血浆样本的K和C氨基酸类型的摩尔(μM)氨基酸浓度进行线性支持向量机(SVM)分类器训练,其中保留25%的数据。对于每种目的癌症蛋白质组(所有癌症患者样本)以及健康目的蛋白质组(所有健康患者样本)获得100%阳性预测值和0%错误发现率。
图68示出了混淆矩阵,其指示基于K、C、W和Y氨基酸类型的量使用本发明的方法检测阶段III结肠直肠癌的78%准确度。
图69使出了混淆矩阵,其指示基于K、C、W和Y氨基酸类型的量使用本发明的方法检测结肠直肠癌位置的100%阳性预测值。
图70示出了在尿中测量的膀胱癌样本、前列腺癌样本和肾癌样本中K、C、W和Y氨基酸类型的以μM计的氨基酸的摩尔浓度。
图71示出了阳性预测值错误发现混淆矩阵,其指示使用本发明的方法从尿样本中鉴定膀胱癌、前列腺癌和肾癌的100%阳性预测鉴定和0%错误发现。所有包括的癌症类型(膀胱癌、前列腺癌和肾癌)可以从尿样本中正确鉴定,其中真阳性率为100%,并且假阴性率为0%。
具体实施方式
在前述说明书,或下面的权利要求,或附图中公开的,以它们的特定形式或按照用于执行所公开的函数的手段,或用于获得所公开的结果的方法或过程来表达的特征,在适当时,可以单独地或以此类特征的任何组合,用于以其不同的形式实现本发明。
本发明基于以下发现:仅需要测量样本中两种或更多种氨基酸类型的标记和/或氨基酸浓度或氨基酸数目,以鉴定样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。仅需要标记和测量样本内的两种或更多种氨基酸类型,以鉴定和定量蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,而不需要对样本进行测序。这是因为每种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有基于蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目的独特特征。基于蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的测量的标记和氨基酸浓度特征是独特的。不必鉴定样本中氨基酸的顺序,例如,通过对样本进行测序来鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组。当在样本中标记和测量两种或更多种氨基酸类型时,鉴定样本中蛋白质序列内的氨基酸顺序不增加额外的信息(图7)。
本文所描述的本发明的方法可以用于鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。这是因为每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有基于每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目的独特特征。因此,可以将样本的特征与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的特征进行比较,以鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。例如,与每种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目和A型流感蛋白质组的浓度相比,SARS-CoV-2蛋白质组具有基于每种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目和SARS-CoV-2蛋白质组的浓度的独特特征。因此,可以确定样本中两种或更多种氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目,并且与SARS-CoV-2蛋白质组和/或HIV蛋白质组中相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度或氨基酸数目进行比较,以鉴定样本中SARS-CoV-2蛋白质组和/或HIV蛋白质组的存在和/或浓度和/或量。
先前,没有可用于同时鉴定样本内完整目的蛋白质组或亚蛋白质组的策略。鉴定病原体诸如SARS-CoV-2的策略依赖于逆转录聚合酶链式反应(RT-PCR)来定性检测SARS-CoV-2的核酸。当前现有技术的检验具有大约30%的假阴性率,对感染控制具有显著的后果。关于病毒载量的定量信息通常是不可获得的。作为一般替代,本发明的方法用于同时鉴定样本内完整目的蛋白质组或亚蛋白质组,例如,用于鉴定患者样本内目的SARS-CoV-2蛋白质组的存在和/或浓度和/或量。
本文所描述的本发明的方法可以用于鉴定样本中目的亚蛋白质组或蛋白质组的存在和/或浓度和/或量,因为每种目的亚蛋白质组或蛋白质组具有基于目的亚蛋白质组或蛋白质组中的每种蛋白质、肽、寡肽、多肽和蛋白质复合物中两种或更多种氨基酸类型的标记的已知值、氨基酸浓度和/或氨基酸数目的独特特征。因此,可以将样本的特征与一种或多种目的亚蛋白质组或蛋白质组的特征进行比较,以鉴定样本中目的亚蛋白质组或蛋白质组的存在和/或浓度和/或量。例如,与人眼蛋白质组中每种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目相比,人血浆蛋白质组具有基于每种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目的独特特征。因此,可以确定样本中两种或更多种氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目,并且与目的蛋白质组中相同的两种或更多种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目进行比较,以鉴定样本中该蛋白质组的存在和/或浓度和/或量。
本发明的方法可以用于鉴定样本中病毒蛋白质组的存在。每种病毒蛋白质组具有基于两种或更多种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目的独特特征。因此,可以将样本中两种或更多种氨基酸类型的平均测量的标记、氨基酸浓度和/或氨基酸数目与病毒蛋白质组的相同的两种或更多种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目进行比较,以鉴定样本中病毒蛋白质组的存在和/或浓度和/或量。此外,本发明的方法可以用于鉴定样本内病毒蛋白质组的病毒载量。例如,每种病毒蛋白质组具有基于病毒蛋白质组中的每种蛋白质中两种或更多种氨基酸类型的氨基酸的平均数乘以病毒蛋白质组的总蛋白质浓度的独特特征。因此,可以在一种或多种蛋白质浓度下将样本中两种或更多种氨基酸类型的氨基酸浓度与病毒蛋白质组的相同的两种或更多种氨基酸类型的平均氨基酸浓度进行比较,以鉴定样本内病毒蛋白质组的浓度。
先前,当使用溶液相策略来鉴定样本中蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量时,必须首先将混合物分离成其单个蛋白质组分。例如,在对单个蛋白质测序之前,通过凝胶电泳基于大小或基于使用色谱柱将化合物吸附到吸附剂上来分离混合物内的蛋白质。例如,如果混合物含有两种蛋白质;牛血清白蛋白和溶菌酶,先前需要将混合物分离成牛血清白蛋白和溶菌酶的单个蛋白质组分。相反,已经发现本文所述的本发明的方法可以用于基于来自完整混合物的平均特征鉴定样本中蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量,而不需要将混合物分离成单个组分。例如,可以鉴定含有牛血清白蛋白和溶菌酶的混合物,而不需要将该混合物分离成其牛血清白蛋白和溶菌酶的单个蛋白质组分。这是因为已经发现蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物具有基于混合物中蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的氨基酸的平均数的独特特征。例如,与含有牛血清白蛋白和α突触核蛋白的另一种混合物相比,含有牛血清白蛋白和溶菌酶的混合物具有基于牛血清白蛋白和溶菌酶中两种或更多种氨基酸类型的平均测量的标记、氨基酸浓度和/或氨基酸数目的独特特征,该另一种混合物具有基于牛血清白蛋白和α突触核蛋白混合物中相同的两种或更多种氨基酸类型的平均测量的标记、氨基酸浓度和/或氨基酸数目的不同独特特征。为了鉴定样本内混合物的存在和/或浓度和/或量,不必知道混合物内组分的比例。相反,当在样本中鉴定了多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组时,在样本中鉴定混合物的存在。样本的特征受混合物内组分中的每一种的特征的影响。如果目的蛋白质A在混合物内被鉴定,并且包含比同样在混合物中被鉴定的目的蛋白质B更高比例的混合物,则样本点与目的蛋白质A的参考线或点之间的距离小于样本点与目的蛋白质B的参考线或点之间的距离。相反,发现可以计算并且比较样本点与目的蛋白质A和B之间的距离,以确定混合物中目的蛋白质A和B的比例。因此,可以将样本的特征与鉴定为存在于样本中的多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的特征进行比较,以鉴定样本中此类混合物的存在和/或浓度和/或量。
本发明的方法也可以用于鉴定样本中两种或更多种蛋白质组,即样本中蛋白质组的混合物,的共感染。这是因为蛋白质组的混合物具有基于蛋白质组的混合物中的每种蛋白质中两种或更多种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目的独特特征。因此,可以确定样本中两种或更多种氨基酸类型的测量的标记值、氨基酸浓度和/或氨基酸数目,并且与多于一种目的蛋白质组中相同的两种或更多种氨基酸类型的平均已知标记值、氨基酸浓度和/或氨基酸数目进行比较。如果在样本内鉴定了多于一种目的蛋白质组的存在,则在样本内鉴定目的蛋白质组的混合物,并且混合物内每种蛋白质组的比例可以如上文对蛋白质的混合物的解释来确定。如果目的蛋白质组A在混合物内被鉴定,并且包含比同样在混合物中被鉴定的目的蛋白质组B更高比例的混合物,则样本点与目的蛋白质组A的参考线或点之间的距离小于样本点与目的蛋白质组B的参考线或点之间的距离。相反,可以计算并且比较样本点与目的蛋白质组A和B之间的距离,以确定混合物中目的蛋白质组A和B的比例。因此,可以将样本的特征与鉴定为存在于样本中的多于一种目的蛋白质组的特征进行比较,以鉴定样本中此类混合物的存在和/或浓度和/或量。例如,患者可能具有病毒和继发性细菌感染,或两种病毒感染。在这种情况下,细菌和病毒蛋白质组以及两种病毒蛋白质组在实施本发明的方法之前不需要彼此分离。这可以同样适用于蛋白质组的任何组合,诸如细菌、真菌、原生动物、植物、动物,包括人,及其任何组合。
本文所描述的本发明的方法简单、不费力并且高效,并且避免了需要已知测序技术和/或分离技术的方法的固有缺点。
本文所公开的方法可以应用于任何蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或蛋白质、肽、多肽、寡肽、亚蛋白质组和/或蛋白质组的混合物。本发明的方法仅需要标记两种或更多种氨基酸类型的氨基酸并且测量这些标记。氨基酸类型由每种氨基酸特有的R基团定义。氨基酸的每种类型的R基团是独特的。氨基酸类型可以包括22种蛋白原性氨基酸和/或非蛋白原性或合成氨基酸的修饰的和/或未修饰的氨基酸。
该方法的唯一要求是可获得一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组(例如参考)的两种或更多种氨基酸类型的特征,或氨基酸序列和/或关于翻译后修饰的任何实验信息。为了鉴定样本中蛋白质的存在和/或浓度和/或量,不必确定样本内氨基酸的序列。在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的特征是已知的(例如来自数据库)。在一些实施例中,根据作为本发明的方法的一部分的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的一个或多个氨基酸序列确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的特征。在一些实施例中,如果不知道一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的特征,则一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列可以用于确定该特征。替代地,使用本文所公开的方法(例如,标记两种或更多种氨基酸类型、测量标记的值、经由标准方法测量样本的总蛋白质浓度和将测量的标记转换为每种标记的氨基酸类型的氨基酸数目)确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的特征。
如果一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有一种或多种氨基酸类型,其包括氨基酸类型的修饰的氨基酸,则可以确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的氨基酸类型的修饰的氨基酸的特征。在一些实施例中,这根据一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的翻译后修饰信息确定。例如,如果氨基酸类型C在样本中被标记并且包括修饰的半胱氨酸氨基酸半胱氨酸二硫化物(C
定义
除非另外定义,否则本文所使用的所有技术和科学术语具有与本领域中的普通技术人员通常所理解的相同含义。除非另有说明,本文中引用的所有专利、申请、公开的申请和其它出版物以全文引用的方式并入。在本文的术语具有多个定义的情况下,除非另有说明,否则以本节中的那些为准。
如本文所使用的,术语“存在”是指样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的阳性鉴定。
如本文所使用的,术语“浓度”是指每单位体积的实体丰度。实体可以是分子、复合物、聚合物内的单体,诸如蛋白质链内含有的氨基酸,或原子。质量浓度是指每单位体积的实体质量。数浓度是指每单位体积的实体的分子数。摩尔浓度是指每单位体积的实体的摩尔数。实体的摩尔数是样本内含有的实体的总数除以阿伏伽德罗常数NA,即6.02214076×1023mol-1。除非另有说明,术语“浓度”是指实体的摩尔浓度。经常提及“作为浓度t的函数的目的蛋白质、肽、寡肽、多肽或蛋白质复合物”或等效物。这意味着t是目的蛋白质的浓度,或者,t是目的肽的浓度,或者,t是目的寡肽的浓度,或者,t是目的多肽的浓度,或者,t是目的蛋白质复合物的浓度。如本文所使用的,在一些实施例中,目的蛋白质复合物的浓度是指复合物的浓度,而不是复合物内亚基的单体浓度。例如,如果目的蛋白质复合物α具有两个亚基A和B,使得目的蛋白质复合物α可以用复合物化学计量A:B来描述,则蛋白质复合物α的浓度是复合物A:B的浓度,不是亚基A的浓度加上亚基B的浓度。还经常提及“作为浓度t的函数的目的亚蛋白质组或蛋白质组”或等效物。目的亚蛋白质组的浓度是包含目的亚蛋白质组的所有蛋白质、肽、寡肽、多肽和蛋白质复合物的总浓度。这意味着t是包含目的亚蛋白质组的所有蛋白质、肽、寡肽、多肽和蛋白质复合物的总浓度。目的蛋白质组的浓度是包含目的蛋白质组的所有蛋白质、肽、寡肽、多肽和蛋白质复合物的总浓度。这意味着t是包含目的蛋白质组的所有蛋白质、肽、寡肽、多肽和蛋白质复合物的总浓度。一旦鉴定了样本中存在的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的摩尔浓度,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的质量浓度是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的摩尔浓度乘以目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的分子量(现在已鉴定,使得其一个或多个氨基酸序列可用)。在一些实施例中,蛋白质复合物的分子量是其亚基的组合分子量。目的亚蛋白质组或蛋白质组的分子量是包含目的蛋白质组或亚蛋白质组的蛋白质、肽、寡肽、多肽和/或蛋白质复合物的分子量的平均值。在一些实施例中,蛋白质组的浓度是样本中蛋白质组或蛋白质组混合物的病毒载量、细菌载量和/或寄生虫载量的量度。在一些实施例中,蛋白质组是病毒蛋白质组,并且该方法提供样本内病毒蛋白质组的总摩尔蛋白质浓度。这等同于以拷贝/mL计的传统病毒载量测量值。替代地,该方法使用本领域已知的标准技术提供以拷贝/mL计的病毒载量测量值。在一些实施例中,蛋白质组是细菌蛋白质组,并且该方法提供样本内细菌蛋白质组的总细菌浓度。这等同于以菌落形成单位(CFU)计的细菌载量测量值。替代地,该方法使用本领域已知的标准技术提供以CFU计的细菌载量测量值。在一些实施例中,蛋白质组是寄生虫蛋白质组,并且该方法提供样本内寄生虫蛋白质组的总寄生虫浓度。这等同于以每宿主样本的寄生虫数计的寄生虫载量测量值。或者,该方法使用本领域已知的标准技术提供以每宿主样本的寄生虫数计的寄生虫载量测量值。虽然我们已经关于摩尔浓度描述了某些实施例,但是这些实施例同样适用于质量浓度,如在实例中已经描述的。
如本文所使用的,术语“目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度”是指目的蛋白质的蛋白质浓度,或目的肽的肽浓度,或目的寡肽的寡肽浓度,或目的多肽的多肽浓度,或目的蛋白质复合物的蛋白质复合物浓度,或目的亚蛋白质组的亚蛋白质组浓度,或目的蛋白质组的蛋白质组浓度的缩写。
如本文所使用的,术语“量”是指样本内实体的摩尔数。实体可以是分子、复合物、聚合物内的单体,诸如蛋白质链内含有的氨基酸,或原子。实体的摩尔数是样本内含有的实体的总数除以阿伏伽德罗常数N
如本文所使用的,术语“相对浓度”是指样本之间分子浓度的倍数变化。例如,已经从第二样本稀释的第一样本具有比第二样本低的相对浓度。
如本文所使用的,术语“氨基酸浓度”是指氨基酸类型内氨基酸的摩尔或质量浓度。氨基酸浓度是指每单位体积的氨基酸类型内的氨基酸的量或质量。除非另有说明,术语氨基酸浓度是指氨基酸类型内氨基酸的摩尔浓度。氨基类型内氨基酸的摩尔浓度可以不同于分子的浓度,因为在分子内可以含有多于一种氨基酸类型的氨基酸或零个氨基酸类型的氨基酸。氨基酸类型内氨基酸的氨基酸浓度等于分子的总摩尔浓度乘以每分子氨基酸类型的氨基酸数目。例如,如果分子是蛋白质,则氨基酸类型的氨基酸浓度可以(并且通常)不同于蛋白质浓度。使用提供已知氨基酸浓度的一种或多种蛋白质或氨基酸的标记值的校准曲线或标准,根据样本内氨基酸类型的标记的测量值计算样本内氨基酸类型的氨基酸浓度。重要的是,样本的两种或更多种氨基酸类型的氨基酸浓度不是指样本的浓度。目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的氨基酸浓度不是指目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度。
如本文所使用的,术语“蛋白质”是指由一个或多个氨基酸的线性多肽链组成的生物分子或大分子。蛋白质是氨基酸的聚合物。术语“蛋白质”包括但不限于含有约50至约3000个氨基酸的分子。术语“蛋白质”是指以通常具有生物功能的方式排列的一条或多条多肽链。蛋白质可以具有折叠的3维结构、内在无序的3维结构或部分折叠和部分无序的3维结构。蛋白质也指由一个或多个氨基酸的线性多肽链组成的生物分子或大分子,其也包括其它组分。例如,蛋白质还包括糖蛋白(其中糖分子链共价附接至蛋白质分子),或核蛋白,其中蛋白质与核酸相结合或键合。
如本文所使用的,术语“肽”是指通过肽(酰胺)键连接的氨基酸短链。术语“肽”包括但不限于含有约2至约50个氨基酸的分子。在优选的方面,术语“肽”是指含有多于10个氨基酸的分子。
如本文所使用的,术语“寡肽”是指肽中的一类,包括但不限于含有约2至约20个氨基酸的分子。术语“寡肽”包括但不限于含有2个氨基酸的二肽、含有3个氨基酸的三肽、含有4个氨基酸的四肽和含有5个氨基酸的五肽。
如本文所使用的,术语“多肽”是由肽键结合在一起的许多氨基酸的单线性链。
如本文所使用的,术语“蛋白质复合物”是指含有至少一个蛋白质亚基的两个或更多个亚基的结构相关基团。蛋白质复合物通常含有两种或更多种蛋白质。它还可以含有一种或多种蛋白质和一种或多种核酸(核糖核蛋白)。蛋白质复合物是稳定的蛋白质-蛋白质相互作用的形式,其中蛋白质亚基通常协作以执行生物功能。蛋白质复合物的实例是核糖体。因为蛋白质复合物内的蛋白质亚基在结构上稳定地彼此相关联并且协作以形成生物功能,所以将蛋白质复合物的每个亚基内的两种或更多种氨基酸类型中的每一种的氨基酸数目相加,以确定蛋白质复合物的两种或更多种氨基酸类型中的每一种的氨基酸数目。
如本文所使用的,术语“蛋白质-蛋白质相互作用”是指蛋白质分子之间的相互作用,通常涉及特定的物理接触。蛋白质-蛋白质相互作用可以是稳定的或瞬时的。在本发明的方法中,不包含蛋白质复合物的蛋白质-蛋白质相互作用,诸如瞬时蛋白质相互作用,被视作蛋白质混合物。
如本文所使用的,术语“亚蛋白质组”是作为蛋白质组的一部分并且共有共同特性,诸如疾病相关,的蛋白质的集合。例如,人血浆蛋白质组内的亚蛋白质组是心脏病亚蛋白质组。疾病相关的亚蛋白质组可以包括蛋白质组内的所有或一些蛋白质。亚蛋白质组也可以描述蛋白质组内共有共同物理特性的蛋白质,诸如但不限于低分子量、大小、电荷和/或密度。在一些实施例中,低分子量特性是指小于10kDa、小于30kDa、小于50kDA、小于100kDa、10至30kDa、30至50kDa、10至50kDA、30至50kDA、10至100kDa、50至100kDa或30至100kDa的蛋白质。在优选的实施例中,低分子量是指小于10kDa、小于30kDa、小于50kDa、小于100kDa的蛋白质,或10kDa、30kDa、50kDa或100kDa的蛋白质。在优选的实施例中,低分子量是指小于50kDa的蛋白质或50kDa的蛋白质。在一些实施例中,电荷特性是指色谱法,包括可以用于选择与带相反电荷的树脂结合的蛋白质的离子交换色谱法。在一些实施例中,密度特性是指与蛋白质大小和形状相关的沉降系数。
如本文所使用的,术语“蛋白质组”是指有机体表达的所有蛋白质。术语“蛋白质组”还指由特定组织类型,例如人血浆蛋白质组,内的有机体表达的所有蛋白质。术语“蛋白质组”还指在特定细胞类型,例如成胶质细胞瘤细胞,内表达的所有蛋白质。术语“蛋白质组”还指在给定时间或在给定条件下,例如当用药物治疗时,由有机体、组织类型或细胞类型表达的蛋白质的变化。术语“蛋白质组”包括但不限于病毒蛋白质组、细菌蛋白质组、古细菌蛋白质组、寄生虫蛋白质组、酵母蛋白质组、植物蛋白质组、动物蛋白质组、哺乳动物蛋白质组和人蛋白质组。术语“蛋白质组”包括但不限于具有少于50个蛋白质的病毒蛋白质组、具有少于7000个蛋白质的细菌蛋白质组、具有少于5000个蛋白质的人血浆蛋白质组、具有少于5000个蛋白质的人尿蛋白质组、具有少于5000个蛋白质的人唾液蛋白质组,以及具有大约22000个蛋白质的人蛋白质组。
如本文所使用的,术语“混合物”是指样本中的两种或更多种蛋白质、肽、多肽或寡肽、亚蛋白质组和/或蛋白质组。例如,肽的混合物是两种或更多种肽的组合,多肽的混合物是两种或更多种多肽的组合,蛋白质的混合物是两种或更多种蛋白质的组合。混合物不必由相同的组分组成。例如,混合物也可以是蛋白质和肽的混合物、肽和多肽的混合物、蛋白质和多肽的混合物等。
如本文所使用的,“样本”是指可以含有一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的任何样本。术语“样本”还包括不含任何蛋白质的任何样本,并且因此当测量标记时没有获得值(例如标记的信号)。
如本文所使用的,术语“氨基酸类型”是指包含一个胺(-NH)和一个羧基(-CO)基团、一个α碳和一个每种氨基酸类型特有的R基团(侧链),或其包含一个胺(-NH
如本文所使用的,术语“R基团”是指存在于每种氨基酸类型的每种氨基酸中的侧链。R基团是取代基;置换氨基酸的α碳上的一个或多个氢原子的原子或原子团。每种氨基酸类型的R基团对于该氨基酸类型是独特的。本发明涵盖的每种氨基酸类型的R基团在表2中定义。氨基酸类型由存在于未修饰的(如翻译的)氨基酸类型上的R基团定义。如果后续对R基团进行修饰,则氨基酸类型不改变。例如,半胱氨酸(C)氨基酸类型由硫醇R基团定义。这是半胱氨酸氨基酸类型(还原的半胱氨酸C
如本文所使用的,“修饰的氨基酸”是指在掺入蛋白质后已经化学修饰的氨基酸类型的氨基酸。在一些实施例中,酶进行该化学修饰。在一些实施例中,修饰的氨基酸已经经历翻译后修饰。氨基酸的此类翻译后修饰的实例包括但不限于甲基化、脱氨、脱酰胺、N-连接的糖基化、异构化、二硫键形成、氧化成次磺酸、亚磺酸或磺酸、棕榈酰化、N-乙酰化(N-末端)、S-亚硝基化、环化成焦谷氨酸(N-末端)、γ-羧化、异肽键形成、N-肉豆蔻酰化(N-末端)、磷酸化、乙酰化、泛素化、SUMO化、甲基化、羟基化、氧化成亚砜或砜、羟基化、O-连接的糖基化、单-或二-氧化、犬尿氨酸的形成和/或硫酸化。例如,氨基酸类型半胱氨酸(C)的氨基酸可以在翻译后修饰期间被修饰以形成含有二硫键和氧化的硫醇R基团的半胱氨酸二硫化物(C
如本文所使用的,“未修饰的氨基酸”是指在掺入蛋白质后未经化学修饰的氨基酸类型的氨基酸。例如,氨基酸类型半胱氨酸(C)的未修饰的氨基酸是还原的半胱氨酸(C
如本文所使用的,术语“两种或更多种氨基酸类型”是指至少两种氨基酸类型。术语“两种或更多种氨基酸类型”涵盖但不限于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40种氨基酸类型。在一些实施例中,2种氨基酸类型被标记。在一些实施例中,3种氨基酸类型被标记。在一些实施例中,4种氨基酸类型被标记。在一些实施例中,5种氨基酸类型被标记。在一些实施例中,6种氨基酸类型被标记。在一些实施例中,7种氨基酸类型被标记。在一些实施例中,8种氨基酸类型被标记。在一些实施例中,9种氨基酸类型被标记。在一些实施例中,10种氨基酸类型被标记。在一些实施例中,11种氨基酸类型被标记。在一些实施例中,12种氨基酸类型被标记。在一些实施例中,13种氨基酸类型被标记。在一些实施例中,14种氨基酸类型被标记。在一些实施例中,15种氨基酸类型被标记。在一些实施例中,16种氨基酸类型被标记。在一些实施例中,17种氨基酸类型被标记。在一些实施例中,18种氨基酸类型被标记。在一些实施例中,19种氨基酸类型被标记。在一些实施例中,20种氨基酸类型被标记。在一些实施例中,21种氨基酸类型被标记。在一些实施例中,22种氨基酸类型被标记。在一些实施例中,23种氨基酸类型被标记。在一些实施例中,24种氨基酸类型被标记。在一些实施例中,25种氨基酸类型被标记。在一些实施例中,26种氨基酸类型被标记。在一些实施例中,27种氨基酸类型被标记。在一些实施例中,28种氨基酸类型被标记。在一些实施例中,29种氨基酸类型被标记。在一些实施例中,30种氨基酸类型被标记。在一些实施例中,31种氨基酸类型被标记。在一些实施例中,32种氨基酸类型被标记。在一些实施例中,33种氨基酸类型被标记。在一些实施例中,34种氨基酸类型被标记。在一些实施例中,35种氨基酸类型被标记。在一些实施例中,36种氨基酸类型被标记。在一些实施例中,37种氨基酸类型被标记。在一些实施例中,38种氨基酸类型被标记。在一些实施例中,39种氨基酸类型被标记。在一些实施例中,40种氨基酸类型被标记。
如本文所使用的,术语“标记”或“标记的”是指添加、插入、附接、结合或键合至氨基酸类型内的氨基酸以帮助检测和/或鉴定样本内的氨基酸类型的标签、标识符或探针。例如,标记可以包括荧光团、同位素或串联质谱标签。在一些实施例中,标记提供信号。在一些实施例中,标记是荧光标记。在一些实施例中,标记是荧光染料,或在与氨基酸类型反应时变成发荧光的分子。在一些实施例中,标记共价键合至氨基酸类型内的氨基酸。在一些实施例中,标记共价键合至氨基酸类型内的氨基酸的R基团。
如本文所使用的,术语“信号”是指传达信息的事件。在一些实施例中,信号是传达信息的时变事件。标记的信号可以在单个时间点被读取,或者标记的信号可以作为时间的函数被读取。在一些实施例中,标记是荧光标记并且标记的信号是荧光强度。
如本文所使用的,术语“发光”是指由不是由热引起的物质自发发射的光。在一些实施例中,标记是发光标记并且标记的信号是发光信号。发光的几种类型,包括但不限于光致发光(其包括荧光)、化学发光(其包括生物发光)、电致发光、辐射发光和热致发光。光致发光是光子吸收的结果。光致发光的几种类型包括作为具有典型的寿命为纳秒的单线态-单线态电子弛豫的结果的光致发光的荧光。磷光是另一种类型的光致发光,它是具有典型的寿命为毫秒到小时的三线态-单线态电子弛豫的结果。化学发光是作为化学反应的结果的光发射。生物发光是化学发光的一种形式,它是活有机体中生化反应的结果。电化学发光是电化学反应的结果。电致发光是电流穿过物质的结果。阴极发光是发光材料被电子撞击的结果。声致发光是当被声音激发时气泡在液体中内爆的结果。辐射发光是电离辐射轰击的结果。热致发光是当物质被加热时吸收的能量的再发射。低温发光是当物体被冷却时的光发射。
如本文所使用的,术语“校准曲线”或术语“标准”是指用于通过将未知样本与已知浓度的一组标准样本或一个标准样本进行比较来确定未知样本中物质的浓度的通用分析化学方法。如果将未知样本与一组标准样本进行比较,则使用“校准曲线”。如果将未知样本与单个标准样本进行比较,则使用术语“标准”。校准曲线或标准用于在目的蛋白质的两种或更多种氨基酸类型中的每一种的已知氨基酸浓度与测量的标记(例如标记的信号)之间转换,或用于在相同的两种或更多种氨基酸类型的测量的标记(例如标记的信号)与样本中每种氨基酸类型的氨基酸浓度之间转换。氨基酸类型的校准曲线是指对于氨基酸类型的几种已知氨基酸浓度收集的数据(标记的信号),以及标准是指对于氨基酸类型的一种已知氨基酸浓度收集的数据(标记的信号)。根据校准曲线或标准计算校准函数或(标量)校准因子。
如本文所使用的,术语“比例”是指少于样本中氨基酸类型的所有氨基酸,即少于样本中氨基酸类型的氨基酸的100%的氨基酸类型的任何氨基酸数目。术语“比例”还指例如根据表4中提供的规则,小于与标记反应的氨基酸类型的氨基酸的所有子集(例如,氨基酸类型的未修饰的氨基酸)的氨基酸类型的任何氨基酸数目。术语“比例”包括但不限于样本中被标记的每种氨基酸类型的氨基酸的约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%。在一些实施例中,比例为样本中存在的特定氨基酸类型的氨基酸的约50%。在一些实施例中,比例为样本中存在的特定氨基酸类型的氨基酸的约60%。在一些实施例中,比例为样本中存在的特定氨基酸类型的氨基酸的约70%。在一些实施例中,比例为样本中存在的特定氨基酸类型的氨基酸的约80%。在一些实施例中,比例为样本中存在的特定氨基酸类型的氨基酸的约90%。
如本文所使用的,术语“测量”是指检测和定量。在一些实施例中,测量包括测量信号。
如本文所使用的,术语“氨基酸数目”是指每分子特定氨基酸类型的氨基酸数目。为了确定样本中每种标记类型的氨基酸数目,将样本中氨基酸类型的氨基酸浓度除以样本的摩尔蛋白质浓度。为了确定目的蛋白质或参考中氨基酸类型的氨基酸数目,氨基酸类型的氨基酸数目根据目的蛋白质的蛋白质序列计算,或先前已经确定并且例如可经由数据库访问。替代地,目的蛋白质中氨基酸类型的氨基酸数目可以通过在已知蛋白质浓度下标记目的蛋白质中的氨基酸类型、测量标记、使用本文所公开的方法将测量的标记转换为氨基酸浓度,并且将氨基酸类型的氨基酸浓度除以目的蛋白质的摩尔蛋白质浓度来确定。例如,如果赖氨酸是被标记的氨基酸类型并且样本中每蛋白质分子有54个赖氨酸,则赖氨酸的氨基酸类型的氨基酸数目是54。氨基酸类型的氨基酸数目不是指含有样本的溶液中氨基酸类型的总氨基酸数目。例如,如果样本中有10000个蛋白质分子,并且每个蛋白质分子含有54个赖氨酸氨基酸,则赖氨酸氨基酸类型的氨基酸数目是54,而不是540000。
如本文所使用的,术语“背景校正”或“背景校正的”是指已被校正以排除来自溶液中的游离标记的任何信号的每种标记的氨基酸类型的测量的标记,该游离标记未添加、插入、附接、结合、键合或共价键合至目的氨基酸类型的氨基酸、非特异性标记,或否则将有助于测量总标记的信号的其它来源,诸如细胞自体荧光。这通过本领域中的标准手段来实现。
如本文所使用的,术语“本体”是指在不将样本约束在尺寸通常为数百微米或更小的通道内的情况下进行的研究。经典地,本体研究不涉及少量(皮升到纳升)流体的操作,并且流体除了扩散之外还湍流地混合。本体研究包括流体的自动操作,例如通过泵或机器人。本体研究可以涉及分析板中的样本,该板具有样本储器以平行进行许多反应和/或测量,并且可以涉及使用板读取器或类似仪器。通常,本体研究不试图检测单一蛋白质分子。
如本文所使用的,术语“溶液相”是指在溶液中进行和测量的研究。溶液相不包括需要在表面上测量的方法,诸如转变内反射荧光(TIRF)显微术。溶液相不包括要求样本内的蛋白质穿过表面内的合成或天然孔的方法。例如,溶液相不包括在表面内掺入纳米孔、小通道的方法,并且不包括掺入生物纳米孔、包埋在脂质膜内的跨膜蛋白的方法。
如本文所使用的,术语“解卷积”是指其中分析或转变从多个分量得到的信号以揭示来自每个分量的部分的过程。在一些实施例中,如果时间分辨信号来源于两个分量并且存在两个分离的峰,则信号可以被动态地解卷积,使得对一个峰的分析提供关于一个分量的信息,并且对另一峰的分析提供关于另一分量的信息。例如,如果标记是荧光标记并且两种或更多种氨基酸类型在相同条件下用相同荧光标记标记,但标记反应以不同速率进行,则可以使用动力学解卷积,使得在某一时刻测量标记的信号提供仅关于一种氨基酸类型的信息,并且在另一时刻测量标记的信号提供仅关于另一氨基酸类型的信息。替代地,如果信号来源于两个分量并且一个分量是已知的,则可以转变该信号以去除已知分量并且仅揭示关于未知分量的信息。
如本文所使用的,术语“解卷积标准”是指样本中标记和测量的两种或更多种氨基酸类型的已知氨基酸浓度的蛋白质,其用于解卷积在相同条件下用相同标记标记两种氨基酸类型时获得的信号。解卷积标准可以在不同的激发和发射波长下测量,以解卷积每种标记的氨基酸类型在每种波长下的贡献,并且能够分离样本中每种标记的氨基酸类型的信号。解卷积标准不是上面讨论的“校准曲线或标准”。
如本文所使用的,术语“蛋白质测序”是指确定蛋白质、肽、寡肽或多肽中的氨基酸序列。蛋白质测序涉及从氨基酸链的一个末端开始沿着氨基酸序列连续读取和鉴定单个氨基酸,并且沿着氨基酸链一次移动一个氨基酸。蛋白质测序确定蛋白质内氨基酸的位置。例如,埃德曼降解是蛋白质测序的常用方法。
如本文所使用的,术语“n维空间”是指数学空间,其中n是指定其内任何点所需的坐标的最小数。在n维空间内,存在n维信息。信息的维度是被标记的氨基酸类型的数目。例如,3维信息是指被标记的3种氨基酸类型并且需要3维空间。在一些实施例中,n维空间用于绘制n种氨基酸类型的标记值、氨基酸浓度或氨基酸数目。在n维空间中,存在指定任何向量所必需的n个坐标。
如本文所使用的,术语“参考”是标准或对照值,将样本的值与该标准或对照值进行比较。该参考可以包括指示与在样本中标记的每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值,和/或氨基酸浓度,和/或氨基酸数目的信息。该参考可以包括已知标记值(例如信号,例如荧光强度)或一种或多种蛋白质浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的氨基酸浓度,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列中两种或更多种氨基酸类型的氨基酸数目。两种或更多种氨基酸类型与样本中标记的两种或更多种氨基酸类型相同。每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考用于鉴定样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度和/或量。在一些实施例中,该参考是蛋白质组或亚蛋白质组的所有氨基酸序列中两种或更多种氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目的加权平均值,其通过蛋白质组、亚蛋白质组或蛋白质的混合物中每种蛋白质的比例加权。在一些实施例中,该参考被存储在数据库中,并且从数据库中被访问/获得。在一些实施例中,参考是用实验方法确定的。在一些实施例中,参考根据一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列计算。在一些实施例中,产生参考包括访问各种蛋白质的公开可获得的氨基酸序列并且去除在成熟蛋白质中生物裂解的序列部分。在一些实施例中,创建参考包括确定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列内与已标记的相同的两种或更多种氨基酸类型的氨基酸数目,其具有任选地应用表4中概述的规则以从氨基酸类型的氨基酸数目中去除翻译后修饰的氨基酸,该翻译后修饰的氨基酸将不与该氨基酸类型的标记反应。在一些实施例中,使用本文所公开的方法确定参考,即标记两种或更多种氨基酸类型、测量标记并且使用测量的标记确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种氨基酸类型的氨基酸数目,或含有每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中每种氨基酸类型的氨基酸浓度。在一些实施例中,该参考提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度,作为参数方程组或取决于共同浓度参数的向量函数。在其它实施例中,该参考提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的氨基酸数目。在一些实施例中,该参考包括已知的或使用本发明的方法确定的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度范围。在一些实施例中,这些已知浓度范围用作组成参考的一个或多个函数的界限。在一些实施例中,该参考包括附加信息,诸如并入了观察到的实验误差率的信息。在一些实施例中,该参考包括源于本福特定律的信息,该本福特定律提供了本质上观察到的许多数据集内的前导数位的频率分布。
如本文所使用的,术语“单一参考”是指为目的蛋白质组和/或亚蛋白质组提供的参考,其基于其平均组成独特地鉴定目的蛋白质组和/或亚蛋白质组。尽管目的蛋白质组和/或亚蛋白质组中可以含有许多单个蛋白质,但不需要提供已知标记值、氨基酸浓度和/或氨基酸数目作为目的蛋白质组和/或亚蛋白质组内含有的每种蛋白质的参考,以鉴定目的蛋白质组和/或亚蛋白质组。例如,如果目的蛋白质组含有700个蛋白质,则不需要提供已知标记值、氨基酸浓度和/或氨基酸数目作为目的蛋白质组和/或亚蛋白质组内含有的所有700个蛋白质的参考。相反,为目的蛋白质组和/或亚蛋白质组提供的单一参考提供了允许其鉴定的目的蛋白质组和/或亚蛋白质组的平均特征。例如,血浆中目的结肠直肠癌蛋白质组的单一参考允许仅通过标记和测量血浆溶液中的两种或更多种氨基酸类型,并且将标记的测量值或根据标记的测量值计算的氨基酸浓度与由单一参考提供的值进行比较来从血浆中鉴定目的结肠直肠癌蛋白质组。为了检测目的结肠直肠癌蛋白质组和/或亚蛋白质组的存在和/或浓度和/或量,不需要测量目的结肠直肠癌蛋白质组和/或亚蛋白质组内的单个蛋白质和/或生物标记。鉴定目的蛋白质组和/或亚蛋白质组,并且确定其浓度/量,而不需要测量其中的单一蛋白质。目的蛋白质组和/或亚蛋白质组的单一参考可以使用本发明的方法在理论上或用实验方法计算,并且是目的蛋白质组和/或亚蛋白质组的总蛋白质浓度的代数函数,其可以例如通过本文所描述的向量函数或参数方程组中的一个来描述。
如本文所使用的,术语“还原的半胱氨酸”(C
如本文所使用的,术语“半胱氨酸二硫化物”(C
如本文所使用的,术语“半胱氨酸”(C)是指未修饰的半胱氨酸氨基酸(C
如本文所使用的,术语“分类器”是指实施分类的算法。分类是基于含有已知其类别成员的观察结果的数据的训练集来鉴定新观察结果所属的类别。术语“分类器”涵盖机器学习分类器,其使用监督学习来学习基于示例性输入-输出对将输入映射到输出的函数,包括使用懒惰学习(基于实例的学习)和急切学习。例如,分类器描述了k-最近邻分类器(惰性学习)和/或支持向量机分类器(急切学习)。分类器可以用于本文所描述的方法的比较步骤中。
如本文所使用的,术语“复制品”是指罕见的情况,其中多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有相同的参考,或其中基于两种或更多种氨基酸类型的标记值、氨基酸浓度或两种或更多种氨基酸类型的氨基酸数目的比较,对于多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考是难以区分的。这是因为一种目的蛋白质中两种或更多种氨基酸类型的氨基酸数目与另一目的蛋白质中相同的两种或更多种氨基酸类型的氨基酸数目相同或为其倍数。参考可以具有1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60个复制品,但多于1个复制品是罕见的。如果两种目的蛋白质具有相同的参考,并且该参考在样本内被鉴定,则样本被鉴定为含有这两种目的蛋白质中的任一种。有许多方法来消除这种影响并且独特地鉴定样本内存在的目的蛋白质,诸如将样本中已鉴定的参考的蛋白质浓度与两种目的蛋白质的已知生物学相关浓度范围进行比较。样本被鉴定为含有在其生物学相关浓度范围内的目的蛋白质。
为了清楚和解释,在目的蛋白质或蛋白质组的上下文中描述了该方法。然而,除非另有说明或从上下文中变得清楚,否则本发明的方法应理解为一般地、附加地或替代地适用于一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组。
样本
本方法中使用的样本已经使用标准方法从受试者中获得。优选地,样本是体液样本、组织样本、土壤样本、水样本、环境样本、作物样本、食品样本、饮料样本或实验室样本。
本发明涵盖的体液样本包括但不限于:全血样本、血清样本、血浆样本、唾液样本、痰样本、粪便样本、尿样本、精液样本、鼻拭子样本、鼻咽吸出物样本、咽拭子,或下呼吸道样本,诸如下呼吸道粘液吸出物样本、脑脊髓(CSF)样本、性健康样本,诸如尿道拭子、子宫颈拭子、阴道拭子或直肠拭子。替代地,样本可以含有本领域已知的任何其它体液。在一些实施例中,体液样本是由病变产生的任何类型的流体。在一些实施例中,样本是血浆样本。在一些实施例中,样本是贫血小板血浆(PPP)样本。在一些实施例中,样本是富血小板血浆(PPP)样本。在一些实施例中,样本是血小板样本。在一些实施例中,样本是血浆外来体样本。在一些实施例中,样本是血细胞样本。在一些实施例中,血细胞样本是淋巴细胞样本或骨髓细胞样本。在一些实施例中,样本是尿样本。
替代地,样本可以是组织样本。优选地,组织样本是任何目的组织类型的活组织检查。例如,组织样本可以是实体瘤的活组织检查。这包括例如肉瘤、淋巴瘤、癌和黑素瘤。
替代地,样本可以是环境样本。优选地,环境样本是水样本,诸如饮用水样本或废水样本。在一些实施例中,样本是疑似生物战的样本。
替代地,样本可以是食品样本,例如在食品工业中。例如,本发明的方法可以用于检验食品样本的细菌生长和组成,例如在乳酪制作中,检验面包制作中的面粉和面包质量,诸如经由评估谷蛋白的强度、定量发酵剂的量(例如,鉴定和定量红茶菌中的细菌量以确保消费安全)、检验酸奶,或检验酸面团母培养物。优选地,食物样本疑似含有过敏原。
在一些实施例中,样本可能疑似含有过敏原。优选地,过敏原是花生、谷蛋白、乳糖、花粉或尘螨、灰尘、酪蛋白、脂质运载蛋白、c型溶菌酶、蛋白酶抑制剂、原肌球蛋白、小清蛋白、猫皮屑、狗皮屑。
替代地,样本可以是饮料样本,诸如奶样本、水样本或果汁样本。例如,本发明的方法可以用于农业产业,以测量奶的激素组分的化学特征,或评估未灭菌的奶或果汁的细菌污染。
在一些实施例中,样本是体液样本(例如全血样本、血清样本、血浆样本、唾液样本、痰样本、粪便样本、尿样本、精液样本、鼻拭子样本、鼻咽吸出物样本、咽拭子,或下呼吸道样本,诸如下呼吸道粘液吸出物样本、脑脊液(CSF)样本、性健康样本,诸如尿道拭子、子宫颈拭子、阴道拭子或直肠拭子,或由病变产生的任何类型的流体)、组织样本、土壤样本、环境样本(例如水样本,诸如饮用水样本或废水样本;或疑似生物战的样本)、食品样本(例如疑似含有过敏原诸如花生、谷蛋白、乳糖或花粉、酪蛋白、脂质运载蛋白、c型溶菌酶、蛋白酶抑制剂、原肌球蛋白、小清蛋白、猫皮屑和/或狗皮屑,或功能性食品样本)或饮料样本(例如奶、水、果汁)。
在一些实施例中,使用本领域的标准技术诸如离心、过滤、提取、沉淀和差异化溶解、超速离心、尺寸排阻色谱法、基于电荷或疏水性的分离(实例包括疏水相互作用色谱法、离子交换色谱法和/或自由流动电泳)和/或亲和色谱法诸如免疫亲和色谱法或高效液相色谱法(HPLC)从样本中分离蛋白质。一旦分离,也可以浓缩样本内的蛋白质。这可以涉及但不限于冻干或超滤。例如,如果样本是唾液样本,并且在样本中检测到病毒或细菌的存在,则通过离心将样本中的病毒和细菌蛋白质与样本中的人蛋白质分离。离心后,沉淀物对应于样本中存在的病毒和细菌,上清液中不存在人蛋白质。在另一实例中,如果样本是固体组织样本,并且在样本中检测到病毒或细菌的存在,则通过冷冻组织样本、压碎样本并且将蛋白质从组织中提取到缓冲液中,将样本中的病毒和细菌蛋白质与样本中的人蛋白质分离。本领域中标准的用于从组织样本中提取蛋白质的这些技术的实例由January Ericsson,C.的从固体组织中提取蛋白质(Protein Extraction from Solid Tissue)2011,《分子生物学方法(Methods in molecular biology)》(Clifton,N.J)675:307-12.DOI:10.1007/978-1-59745-423-0_17提供。
样本可能疑似含有一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物或蛋白质组的存在。在一些实施例中,目的蛋白质、肽、寡肽、多肽、蛋白质复合物或蛋白质组是从样本中的其它蛋白质分离的。
目的蛋白质
尽管在本申请中通篇提及“目的蛋白质”,但是术语“目的蛋白质”作为实例提供并且可以用目的肽、目的寡肽、目的多肽、目的蛋白质组复合物、目的亚蛋白质组,或目的蛋白质组,或其组合替代,其在样本内的存在和/或浓度和/或量正在被检验。在该术语的一般意义上,“目的蛋白质”疑似在样本中,并且目的蛋白质在样本内的假说经由本发明的方法检验。
在一些实施例中,目的蛋白质组是疑似分别引起病毒感染、细菌感染、真菌感染或寄生虫感染的病毒蛋白质组、细菌蛋白质组、真菌蛋白质组或寄生虫蛋白质组。例如,在一些实施例中,受试者疑似患有疟疾并且目的蛋白质组包括恶性疟原虫(P.falciparum)、三日疟原虫(P.malariae)、卵形疟原虫(P.ovale)、间日疟原虫(P.vivax)和诺氏疟原虫(P.knowlesi)蛋白质组。这些寄生虫是已知的疟疾病原体。从疑似患有疟疾的受试者获得样本,诸如血液样本,并且使用过滤从血液中分离寄生虫蛋白质组。检验从血液样本中分离的寄生蛋白质中恶性疟原虫、三日疟原虫、卵形疟原虫、间日疟原虫和诺氏疟原虫蛋白质组中的任何一种的存在以证实疟疾的诊断和鉴定受试者样本中引起疟疾的特定寄生虫。
在一些实施例中,目的蛋白质组是病毒蛋白质组。例如,在一些实施例中,受试者示出干咳、疲劳,肌肉疼痛和发烧的症状,并且因此受试者疑似患有流感或冠状病毒。从受试者获得样本,诸如血液样本、鼻拭子、鼻咽吸出物或下呼吸道粘液吸出物样本,并且检验样本中流感蛋白质组,例如A型流感H1N1蛋白质组,和/或冠状病毒蛋白质组,例如SARS-CoV-2(Covid-19)蛋白质组,的存在,以鉴定引起受试者症状的病毒,并且因此鉴定受试者具有的感染。
在一些实施例中,目的蛋白质组是人蛋白质组。在一些实施例中,目的蛋白质组是人血浆蛋白质组。在一些实施例中,在该方法的剩余步骤之前去除人血浆蛋白质组的白蛋白级分。在一些实施例中,在该方法的剩余步骤之前去除人血浆蛋白质组的白蛋白和球蛋白级分。在替代实施例中,在该方法的剩余步骤之前不除去人血浆蛋白质组的白蛋白级分。在一些实施例中,在该方法的剩余步骤之前不除去人血浆蛋白质组的白蛋白和球蛋白级分。在一些实施例中,在该方法的剩余步骤之前使用离心过滤步骤去除人血浆蛋白质组的白蛋白和球蛋白级分,该离心过滤步骤在该方法的剩余步骤之前去除高分子量蛋白质诸如白蛋白和球蛋白。在一些实施例中,目的蛋白质组是以下特定腺体/组织的人蛋白质组中的一种或多种:人眼蛋白质组、视网膜、心脏、骨骼肌、平滑肌、肾上腺、甲状旁腺、甲状腺、垂体、肺、骨髓、淋巴组织、肝、胆囊、睾丸、附睾、前列腺、精囊、输精管、脂肪组织、脑、唾液腺、食道、舌、胃、肠、胰腺、肾、膀胱、乳房、阴道、子宫颈、子宫内膜、输卵管、卵巢、胎盘、皮肤、血液或其任何组合。目的蛋白质组还可以包括人代谢蛋白质组和/或人分泌蛋白质组。
在一些实施例中,目的蛋白质组可以是亚蛋白质组。例如,一种或多种人癌亚蛋白质组,其选自:人胰腺癌亚蛋白质组、人神经胶质瘤亚蛋白质组、人头颈癌亚蛋白质组、人甲状腺癌亚蛋白质组、人肺癌亚蛋白质组、人肝癌亚蛋白质组、人睾丸癌亚蛋白质组、人前列腺癌亚蛋白质组、人胃癌亚蛋白质组、人结肠/直肠癌亚蛋白质组、人乳腺癌亚蛋白质组、人子宫内膜癌亚蛋白质组、人卵巢癌亚蛋白质组、人宫颈癌亚蛋白质组、人肾癌亚蛋白质组、人泌尿和膀胱癌蛋白质组、人黑素瘤亚蛋白质组及其任何组合。以下亚蛋白质组也是目的亚蛋白质组:人I型糖尿病亚蛋白质组、人II型糖尿病亚蛋白质组、阿尔茨海默病亚蛋白质组、人帕金森氏病亚蛋白质组,人痴呆亚蛋白质组、人心血管疾病亚蛋白质组、人唐氏综合征亚蛋白质组、人衰老亚蛋白质组或其任何组合。
在一些实施例中,疾病相关亚蛋白质组包括受该有机体的疾病状态影响的有机体的那些蛋白质。在一些实施例中,目的亚蛋白质组是人血浆蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人贫血小板血浆(PPP)蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人富血小板血浆(PRP)蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人血浆蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人贫血小板血浆(PPP)蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人富血小板血浆(PRP)蛋白质组的人胰腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人前列腺癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人结肠直肠癌亚蛋白质组。在一些实施例中,目的亚蛋白质组是人胰腺癌亚蛋白质组。
在一些实施例中,目的蛋白质组是病毒蛋白质组。在一些实施例中,病毒蛋白质组选自:人乳头瘤病毒(HPV)蛋白质组、人免疫缺陷病毒(HIV)蛋白质组、正粘病毒科蛋白质组、爱泼斯坦巴尔蛋白质组、埃博拉病毒蛋白质组、狂犬病毒属蛋白质组、冠状病毒属蛋白质组、诺如病毒蛋白质组、A型肝炎蛋白质组、B型肝炎蛋白质组、C型肝炎蛋白质组、E型肝炎蛋白质组、丁型肝炎蛋白质组、疱疹病毒蛋白质组、乳头瘤病毒蛋白质组、鼻病毒属蛋白质组、麻疹病毒蛋白质组、腮腺炎病毒蛋白质组、脊髓灰质炎病毒蛋白质组、狂犬病蛋白质组、轮状病毒蛋白质组、西尼罗病毒蛋白质组、黄热病病毒蛋白质组、寨卡病毒蛋白质组、有尾噬菌体目蛋白质组、线头病毒科蛋白质组、核糖病毒域蛋白质组、丝形病毒科蛋白质组、小纺锤形噬菌体科蛋白质组、疱疹病毒目蛋白质组、非洲猪瘟病毒科蛋白质组、双尾病毒科蛋白质组、结核病蛋白质组、牛结核病蛋白质组及其任何组合。
在一些实施例中,正粘病毒科蛋白质组是流感蛋白质组。流感蛋白质组包括但不限于:A型流感蛋白质组、A型流感亚型H1N1蛋白质组、B型流感蛋白质组、C型流感蛋白质组或D型流感蛋白质组,或其任何组合。在一些实施例中,冠状病毒蛋白质组是SARS-CoV-2(Covid-19)蛋白质组、SARS-CoV蛋白质组或MERS-CoV蛋白质组。在一些实施例中,目的病毒蛋白质组是动物源性病毒蛋白质组。
在一些实施例中,目的蛋白质组是细菌蛋白质组。在一些实施例中,细菌蛋白质组包括但不限于大肠杆菌(Escherichia coli,E.coli)蛋白质组、铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)蛋白质组、沙n氏菌蛋白质组、金黄色葡萄球菌蛋白质组、鲍氏不动杆菌蛋白质组、脆弱拟杆菌蛋白质组、洋葱伯克霍尔德菌蛋白质组、艰难梭菌蛋白质组、索氏梭菌蛋白质组、肠杆菌科蛋白质组、粪肠球菌蛋白质组、肺炎克雷伯氏菌蛋白质组、耐甲氧西林金黄色葡萄球菌蛋白质组、摩氏摩根氏菌蛋白质组、分枝杆菌蛋白质组及其任何组合。在一些实施例中,分枝杆菌蛋白质组是结核分支杆菌(Mycobacterium tuberculosis)蛋白质组。
在一些实施例中,目的蛋白质组是寄生虫蛋白质组。在一些实施例中,寄生虫蛋白质组选自:疟原虫蛋白质组、刚地弓形虫蛋白质组、阴道毛滴虫蛋白质组、十二指肠贾第虫蛋白质组、隐孢子虫蛋白质组或其任何组合。在一些实施例中,疟原虫蛋白质组是恶性疟原虫蛋白质组、诺氏疟原虫蛋白质组、三日疟原虫蛋白质组、卵形疟原虫蛋白质组和/或间日疟原虫蛋白质组。
在一些实施例中,目的蛋白质组是过敏原。优选地,过敏原是花生、谷蛋白、乳糖、酪蛋白、脂质运载蛋白、c型溶菌酶、蛋白酶抑制剂、原肌球蛋白、小清蛋白、猫皮屑和/或狗皮屑。
在一些实施例中,目的化合物是一种或多种蛋白质或肽(例如α突触核蛋白、溶菌酶、牛血清白蛋白、卵清蛋白、β-乳球蛋白、胰岛素,胰高血糖素、淀粉样蛋白β、血管紧张素转换酶2、血管紧张素转换酶、缓激肽、脊索蛋白样蛋白1、肿瘤坏死因子β、骨调节蛋白前体、基质金属蛋白酶蛋白、多效生长因子、分泌粒蛋白-3、人生长激素、胰岛素样生长因子1、瘦蛋白、端粒酶、促甲状腺激素)、人蛋白质组(例如人血浆蛋白质组、人眼蛋白质组、视网膜、心脏、骨骼肌、平滑肌、肾上腺、甲状旁腺、甲状腺、垂体、肺、骨髓、淋巴组织、肝、胆囊、睾丸、附睾、前列腺、精囊、输精管、脂肪组织、脑、唾液腺、食道、舌、胃、肠、胰腺、肾、膀胱、乳房、阴道、子宫颈、子宫内膜、输卵管、卵巢、胎盘、皮肤、血液、人代谢蛋白质组、人分泌蛋白质组)、人亚蛋白质组(例如人癌亚蛋白质组,其选自:人胰腺癌蛋白质组、人神经胶质瘤亚蛋白质组、人头颈癌亚蛋白质组、人甲状腺癌亚蛋白质组、人肺癌亚蛋白质组、人肝癌亚蛋白质组、人睾丸癌亚蛋白质组、人前列腺癌亚蛋白质组、人胃癌亚蛋白质组、人结肠/直肠癌亚蛋白质组、人乳腺癌亚蛋白质组、人子宫内膜癌亚蛋白质组、人卵巢癌亚蛋白质组、人宫颈癌亚蛋白质组、人肾癌亚蛋白质组、人泌尿和膀胱癌亚蛋白质组、人黑素瘤亚蛋白质组),(或例如人I型糖尿病亚蛋白质组、人II型糖尿病亚蛋白质组、阿尔茨海默病亚蛋白质组、人帕金森氏病亚蛋白质组、人痴呆亚蛋白质组、人心血管疾病亚蛋白质组、人唐氏综合征亚蛋白质组、人衰老亚蛋白质组)、病毒蛋白质组(例如人乳头瘤病毒(HPV)蛋白质组、人免疫缺陷病毒(HIV)蛋白质组、正粘病毒科蛋白质组,诸如流感蛋白质组,诸如A型流感蛋白质组、A型流感亚型H1N1蛋白质组、B型流感蛋白质组、C型流感蛋白质组或D型流感蛋白质组、爱泼斯坦巴尔蛋白质组、埃博拉病毒蛋白质组、狂犬病毒属蛋白质组、冠状病毒属蛋白质组,诸如SARS-CoV-2(Covid-19)蛋白质组、SARS-CoV蛋白质组或MERS-CoV、诺如病毒蛋白质组、A型肝炎蛋白质组、B型肝炎蛋白质组、C型肝炎蛋白质组、E型肝炎蛋白质组、丁型肝炎蛋白质组、疱疹病毒蛋白质组、乳头瘤病毒蛋白质组、鼻病毒属蛋白质组、麻疹病毒蛋白质组、腮腺炎病毒蛋白质组、脊髓灰质炎病毒蛋白质组、狂犬病蛋白质组、轮状病毒蛋白质组、西尼罗病毒蛋白质组、黄热病病毒蛋白质组、寨卡病毒蛋白质组、有尾噬菌体目蛋白质组、线头病毒科蛋白质组、核糖病毒域蛋白质组、丝形病毒科蛋白质组、小纺锤形噬菌体科蛋白质组、疱疹病毒目蛋白质组、非洲猪瘟病毒科蛋白质组、双尾病毒科蛋白质组、结核病蛋白质组、牛结核病蛋白质组)、动物源性病毒蛋白质组、细菌蛋白质组(例如大肠杆菌(Escherichiacoli,E.coli)蛋白质组、铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)蛋白质组、沙n氏菌蛋白质组、金黄色葡萄球菌蛋白质组、鲍氏不动杆菌蛋白质组、脆弱拟杆菌蛋白质组、洋葱伯克霍尔德菌蛋白质组、艰难梭菌蛋白质组、索氏梭菌蛋白质组、肠杆菌科蛋白质组、粪肠球菌蛋白质组、肺炎克雷伯氏菌蛋白质组、耐甲氧西林金黄色葡萄球菌蛋白质组、摩氏摩根氏菌蛋白质组、分枝杆菌蛋白质组诸如结核分枝杆菌蛋白质组)、寄生虫蛋白质组(例如疟原虫蛋白质组、刚地弓形虫蛋白质组、阴道毛滴虫蛋白质组、十二指肠贾第虫蛋白质组、隐孢子虫蛋白质组或其任何组合)。在一些实施例中,疟原虫蛋白质组是恶性疟原虫蛋白质组、诺氏疟原虫蛋白质组、三日疟原虫蛋白质组、卵形疟原虫蛋白质组或间日疟原虫蛋白质组)及其任何组合。
氨基酸类型
在该方法中,两种或更多种氨基酸类型被标记。
所有氨基酸具有共同的结构:羧酸、胺和具有R基团侧链的α碳。羧酸、胺和α碳为所有氨基酸类型所共有。在氨基酸链(肽、寡肽、多肽、蛋白质)中,肽键是一种类型的酰胺键,连接相邻的氨基酸。这些相邻的氨基酸已经经历缩合反应,其中一个氨基酸的非-侧链羧酸基团与另一个氨基酸的非-侧链胺基团反应。一个相邻的氨基酸从其羧基基团(COOH)失去氢和氧,并且另一个从其胺基团(NH
本发明涵盖的两种或更多种氨基酸类型包括每种氨基酸类型的修饰的和/或未修饰的氨基酸。这包括22种蛋白原性氨基酸类型的修饰的和/或未修饰的氨基酸和/或非蛋白原性或合成氨基酸。
本发明涵盖的两种或更多种氨基酸类型包括选自以下的22种蛋白原性氨基酸:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。
在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、酪氨酸(Y)、赖氨酸(K)、精氨酸(R)、组氨酸(H)、脯氨酸(P)、天冬氨酸(D)、谷氨酸(E)、天冬酰胺(B)、谷氨酰胺(Q)、丝氨酸(S)和/或苏氨酸(T)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)、赖氨酸(K)、精氨酸(R)、组氨酸(H)、脯氨酸(P)、天冬氨酸(D)、谷氨酸(E)、天冬酰胺(B)和/或谷氨酰胺(Q)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)和/或赖氨酸(K)及其任何组合。在一些实施例中,两种或更多种氨基酸选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、组氨酸(H)和/或谷氨酰胺(Q)或其修饰的类型及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、精氨酸(R)、色氨酸(W)和/或天冬氨酸(D)或其修饰的形式及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:赖氨酸(K)、精氨酸(R)、组氨酸(H)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:赖氨酸(K)、色氨酸(W)、精氨酸(R)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:赖氨酸(K)、天冬酰胺(B)、色氨酸(W)和/或半胱氨酸(C)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、组氨酸(H)、脯氨酸(P)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或天冬氨酸(D)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或谷氨酸(E)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或色氨酸(W)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和/或酪氨酸(Y)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或色氨酸(W)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或半胱氨酸(C)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、赖氨酸(K)、组氨酸(H)和/或酪氨酸(Y)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、半胱氨酸(C)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:精氨酸(R)、半胱氨酸(C)、色氨酸(W)和/或脯氨酸(P)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:色氨酸(W)、半胱氨酸(C)和/或赖氨酸(K)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:赖氨酸(K)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:色氨酸(W)、酪氨酸(Y)和/或半胱氨酸(C)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:色氨酸(W)、酪氨酸(Y)和/或赖氨酸(K)及其任何组合。在一些实施例中,两种或更多种氨基酸类型选自:半胱氨酸(C)、色氨酸(W)和/或酪氨酸(Y)及其任何组合。在一些实施例中,两种氨基酸类型是亮氨酸(L)和丝氨酸(S)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和赖氨酸(K)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和谷氨酸(E)。在一些实施例中,两种酸类型是甘氨酸(G)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是丙氨酸(A)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是天冬氨酸(D)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和脯氨酸(P)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和缬氨酸(V)。在一些实施例中,两种氨基酸类型是赖氨酸(K)和丝氨酸(S)。在一些实施例中,两种氨基酸类型是谷氨酸(E)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是丙氨酸(A)和精氨酸(R)。在一些实施例中,两种氨基酸是丙氨酸(A)和谷氨酸(E)。在一些实施例中,两种氨基酸是丙氨酸(A)和甘氨酸(G)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是色氨酸(W)、半胱氨酸(C)和酪氨酸(Y)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是半胱氨酸(C)、酪氨酸(Y)和赖氨酸(K)。在一些实施例中,3种氨基酸类型被标记,并且该3种氨基酸类型是色氨酸(W)、半胱氨酸(C)和赖氨酸(K)。在一些实施例中,3种氨基酸类型被标记,并且该3种氨基酸类型是赖氨酸(K)、色氨酸(W)和酪氨酸(Y)。在一些实施例中,3种氨基酸类型被标记,并且该3种氨基酸类型是色氨酸(W)、酪氨酸(Y)和半胱氨酸(C)。在一些实施例中,3种氨基酸类型被标记,并且该3种氨基酸类型是色氨酸(W)、酪氨酸(Y)和赖氨酸(K)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:半胱氨酸(C)、色氨酸(W)和酪氨酸(Y)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:天冬酰胺(R)、谷氨酸(E)和甘氨酸(G)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和丝氨酸(S)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:天冬酰胺(A)、谷氨酸(E)和亮氨酸(L)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:丙氨酸(A)、天冬氨酸(D)和亮氨酸(L)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和脯氨酸(P)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:丙氨酸(A)、谷氨酸(E)和亮氨酸(L)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:亮氨酸(L)、丝氨酸(S)和缬氨酸(S)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:谷氨酸(E)、异亮氨酸(I)和脯氨酸(P)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:谷氨酸(E)、甘氨酸(G)和缬氨酸(V)。在一些实施例中,3种氨基酸类型被标记,并且标记的3种氨基酸类型是:精氨酸(R)、丝氨酸(S)和缬氨酸(V)。在一些实施例中,3种氨基酸类型被标记,并且标记的3个氨基酸类型是:丙氨酸(A)、亮氨酸(L)和赖氨酸(K)。在一些实施例中,3种氨基酸类型被标记,并且标记的3个氨基酸类型是:丙氨酸(A)、精氨酸(R)和亮氨酸(L)。在一些实施例中,3种氨基酸类型被标记,并且标记的3个氨基酸类型是:丙氨酸(A)、亮氨酸(L)和缬氨酸(V)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型选自由以下组成的组:丙氨酸(A)、精氨酸(R)、天冬酰胺(N)、天冬氨酸(D)、半胱氨酸(C)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、亮氨酸(L)、赖氨酸(K)、甲硫氨酸(M)、苯丙氨酸(F)、脯氨酸(P)、吡咯赖氨酸(O)、硒代半胱氨酸(U)、丝氨酸(S)、苏氨酸(T)、色氨酸(W)、酪氨酸(Y)和缬氨酸(V)及其任何组合。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是色氨酸(W)、酪氨酸(Y)、赖氨酸(K)和半胱氨酸(C)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、组氨酸(H)和谷氨酰胺(Q)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、精氨酸(R)、色氨酸(W)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是赖氨酸(K)、精氨酸(R)、组氨酸(H)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是赖氨酸(K)、色氨酸(W)、精氨酸(R)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是酪氨酸(Y)、赖氨酸(K)、半胱氨酸(C)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是脯氨酸(P)、半胱氨酸(C)、精氨酸(R)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是半胱氨酸(C)、天冬酰胺(B)、精氨酸(R)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是赖氨酸(K)、天冬酰胺(B)、色氨酸(W)和半胱氨酸(C)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、组氨酸(H)、脯氨酸(P)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和天冬氨酸(D)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和谷氨酸(E)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和色氨酸(W)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、半胱氨酸(C)和酪氨酸(Y)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和色氨酸(W)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和半胱氨酸(C)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、赖氨酸(K)、组氨酸(H)和酪氨酸(Y)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、半胱氨酸(C)、色氨酸(W)和酪氨酸(Y)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、半胱氨酸(C)、色氨酸(W)和脯氨酸(P)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是谷氨酰胺(Q)、亮氨酸(L)、赖氨酸(K)和缬氨酸(V)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是精氨酸(R)、异亮氨酸(I)、亮氨酸(L)和丝氨酸(S)。在一些实施例中,4种氨基酸类型被标记,并且标记的4种氨基酸类型是丙氨酸(A)、天冬酰胺(N)、谷氨酸(E)和丝氨酸(S)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是精氨酸(R)、谷氨酸(E)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是精氨酸(R)、天冬氨酸(D)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是精氨酸(R)、甘氨酸(G)、赖氨酸(K)、丝氨酸和谷氨酰胺(Q)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是丙氨酸(A)、天冬氨酸(D)、甘氨酸(G)、丝氨酸和精氨酸(R)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、甘氨酸(G)、丝氨酸和精氨酸(R)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、硒代半胱氨酸(U)、丝氨酸和精氨酸(R)。在一些实施例中,5种氨基酸类型被标记,并且标记的5种氨基酸类型是吡咯赖氨酸(O)、天冬氨酸(D)、硒代半胱氨酸(U)、赖氨酸和精氨酸(R)。
氨基酸类型涵盖每种氨基酸类型的L(左旋)异构体和/或D(右旋)异构体。
在一些实施例中,两种或更多种标记的氨基酸类型包含氨基酸类型的修饰的氨基酸和/或未修饰的氨基酸。在一些实施例中,氨基酸类型包含氨基酸类型的未修饰的氨基酸。在一些实施例中,氨基酸类型的未修饰的氨基酸未经历翻译后修饰。在一些实施例中,氨基酸类型包含氨基酸类型的修饰的氨基酸。在一些实施例中,氨基酸类型的修饰的氨基酸已经经历翻译后修饰。在一些实施例中,氨基酸类型包含氨基酸类型的修饰的和未修饰的氨基酸。例如,氨基酸类型半胱氨酸(C)可以包含未修饰的半胱氨酸氨基酸(C
在一些实施例中,氨基酸类型丙氨酸(A)是指未修饰的丙氨酸氨基酸、修饰的丙氨酸氨基酸和/或修饰的和未修饰的丙氨酸氨基酸的组合。在一些实施例中,氨基酸类型精氨酸(R)是指未修饰的精氨酸氨基酸、修饰的精氨酸氨基酸和/或修饰的和未修饰的精氨酸氨基酸的组合。在一些实施例中,氨基酸类型天冬酰胺(N)是指未修饰的天冬酰胺氨基酸、修饰的天冬酰胺氨基酸和/或修饰的和未修饰的天冬酰胺氨基酸的组合。在一些实施例中,氨基酸类型天冬氨酸(D)是指未修饰的天冬氨酸氨基酸、修饰的天冬氨酸氨基酸和/或修饰的和未修饰的天冬氨酸氨基酸的组合。在一些实施例中,氨基酸类型半胱氨酸(C)是指未修饰的半胱氨酸氨基酸、修饰的半胱氨酸氨基酸和/或修饰的和未修饰的半胱氨酸氨基酸的组合。在一些实施例中,氨基酸类型谷氨酸(E)是指未修饰的谷氨酸氨基酸、修饰的谷氨酸氨基酸和/或修饰的和未修饰的谷氨酸氨基酸的组合。在一些实施例中,氨基酸类型谷氨酰胺(Q)是指未修饰的谷氨酰胺氨基酸、修饰的谷氨酰胺氨基酸和/或修饰的和未修饰的谷氨酰胺氨基酸的组合。在一些实施例中,氨基酸类型甘氨酸(G)是指未修饰的甘氨酸氨基酸、修饰的甘氨酸氨基酸和/或修饰的和未修饰的甘氨酸氨基酸的组合。在一些实施例中,氨基酸类型组氨酸(H)是指未修饰的组氨酸氨基酸、修饰的组氨酸氨基酸和/或修饰的和未修饰的组氨酸氨基酸的组合。在一些实施例中,氨基酸类型异亮氨酸(I)是指未修饰的异亮氨酸氨基酸、修饰的异亮氨酸氨基酸和/或修饰的和未修饰的异亮氨酸氨基酸的组合。在一些实施例中,氨基酸类型亮氨酸(L)是指未修饰的亮氨酸氨基酸、修饰的亮氨酸氨基酸和/或修饰的和未修饰的亮氨酸氨基酸的组合。在一些实施例中,氨基酸类型赖氨酸(K)是指未修饰的赖氨酸氨基酸、修饰的赖氨酸氨基酸和/或修饰的和未修饰的赖氨酸氨基酸的组合。在一些实施例中,氨基酸类型甲硫氨酸(M)是指未修饰的甲硫氨酸氨基酸、修饰的甲硫氨酸氨基酸和/或修饰的和未修饰的甲硫氨酸氨基酸的组合。在一些实施例中,氨基酸类型苯丙氨酸(F)是指未修饰的苯丙氨酸氨基酸、修饰的苯丙氨酸氨基酸和/或修饰的和未修饰的苯丙氨酸氨基酸的组合。在一些实施例中,氨基酸类型吡咯赖氨酸(O)是指未修饰的吡咯赖氨酸氨基酸、修饰的吡咯赖氨酸氨基酸和/或修饰的和未修饰的吡咯赖氨酸氨基酸的组合。在一些实施例中,氨基酸类型脯氨酸(P)是指未修饰的脯氨酸氨基酸、修饰的脯氨酸氨基酸和/或修饰的和未修饰的脯氨酸氨基酸的组合。在一些实施例中,氨基酸类型硒代半胱氨酸(U)是指未修饰的硒代半胱氨酸氨基酸、修饰的硒代半胱氨酸氨基酸和/或修饰的和未修饰的硒代半胱氨酸氨基酸的组合。在一些实施例中,氨基酸类型丝氨酸(S)是指未修饰的丝氨酸氨基酸、修饰的丝氨酸氨基酸和/或修饰的和未修饰的丝氨酸氨基酸的组合。在一些实施例中,氨基酸类型苏氨酸(T)是指未修饰的苏氨酸氨基酸、修饰的苏氨酸氨基酸和/或修饰的和未修饰的苏氨酸氨基酸的组合。在一些实施例中,氨基酸类型色氨酸(W)是指未修饰的色氨酸氨基酸、修饰的色氨酸氨基酸和/或修饰的和未修饰的色氨酸氨基酸的组合。在一些实施例中,氨基酸类型酪氨酸(Y)是指未修饰的酪氨酸氨基酸、修饰的酪氨酸氨基酸和/或修饰的和未修饰的酪氨酸氨基酸的组合。在一些实施例中,氨基酸类型缬氨酸(V)是指未修饰的缬氨酸氨基酸、修饰的缬氨酸氨基酸和/或修饰的和未修饰的缬氨酸氨基酸的组合。
在优选的实施例中,R基团与表3中公开的特定染料的反应性定义了,如果氨基酸类型内的氨基酸已经历翻译后修饰,则标记反应将标记未经历翻译后修饰的该氨基酸类型内的氨基酸(未修饰的氨基酸),或还将标记已经历翻译后修饰的该氨基酸类型内的氨基酸(修饰的氨基酸)。例如,本领域技术人员将理解,如果标记反应涉及亲核R基团,诸如赖氨酸伯胺,对亲电染料的攻击,则如果赖氨酸已经被翻译后修饰使得其不再具有亲核伯胺,则标记反应将不进行。作为另一实例,本领域技术人员将理解,如果标记反应涉及与色氨酸吲哚R基团和三氯乙醇(TCE)的自由基反应,则如果色氨酸吲哚R基团被单氧化成包含羟基基团,则该反应不被抑制。应用这些原则,无论本文讨论的标记是标记未修饰的氨基酸还是标记已经历可用于氨基酸类型的翻译后修饰的几乎修饰的氨基酸,在下表(表1)中提供。如果标记反应仅标记具有指定翻译后修饰的未修饰的指定氨基酸类型内的氨基酸,则标记栏中示出“未修饰的”。如果标记反应也将标记具有指定的翻译后修饰的修饰的指定氨基酸类型内的氨基酸,则在标记栏中示出“未修饰的+修饰的”)。
表1:标记每种氨基酸类型的修饰的和/或未修饰的氨基酸
/>
在一些实施例中,如果用户希望,该用户可以通过将氨基酸类型的修饰的氨基酸(例如通过化学修饰)转变为未修饰的氨基酸以使得能够检测氨基酸类型的修饰的和未修饰的氨基酸两者来选择是否仅标记氨基酸类型的未修饰的和/或未修饰的+修饰的形式。例如,当修饰的和未修饰的半胱氨酸氨基酸的组合被标记时,修饰的氨基酸(C
半胱氨酸二硫化物(C
在一些实施例中,术语半胱氨酸(C)是指未修饰的半胱氨酸氨基酸,即还原的半胱氨酸(C
半胱氨酸的未修饰的氨基酸,即还原的半胱氨酸(C
具有可以被标记的不同R基团的任何其它氨基酸类型同样可以用作本发明的一部分。例如,本发明涵盖的两种或更多种氨基酸类型也包括合成氨基酸类型。合成氨基酸类型是天然存在的或化学合成的非蛋白原性氨基酸。本发明涵盖的合成氨基酸类型包括含有以下官能团的氨基酸类型:叠氮化物、炔烃、烯烃、环辛炔、二烯、酰基、碘、硼酸、双吖丙啶、环辛烯、环氧化物、环丙烷、生物素、亲二烯体、磺酸、亚磺酸、生物素、肟、硝酮、降冰片烯、四氮烯、四唑、四环烷、贫电子π体系、富电子π体系、卤素、NHS酯、马来酰亚胺和/或重氮基及其任何组合。并入这些官能团代替天然官能团。此外,本发明涵盖的合成氨基酸类型还包括具有附加或附接到氨基酸类型的天然官能团上的合成取代基的氨基酸类型。例如,本发明涵盖色氨酸氨基酸,其已经被合成修饰以在其吲哚环上含有降冰片烯。在一些实施例中,当合成取代基附加或附接至氨基酸类型的天然官能团时,该并入发生在本文所公开的标记反应之前。
标记两种或更多种氨基酸类型
在样本中标记两种或更多种氨基酸类型的氨基酸。
在一些实施例中,标记反应对每种氨基酸类型是特异的。完整的蛋白质分子内含有每种氨基酸类型内的所有氨基酸。这允许仅与完整蛋白质链内目的氨基酸类型反应,而不需要将蛋白质链水解成单个氨基酸或将蛋白质链蛋白水解消化成仅含有完整蛋白质链内所含的一种或一部分氨基酸类型的片段。这类似于抗体如何仅与目的蛋白质反应,即使溶液内也存在其它非目的蛋白质。由于标记和氨基酸类型的互补化学反应性,因此标记仅与目的氨基酸类型反应。在一些实施例中,每个标记仅与一种氨基酸类型反应。在一些实施例中,每个标记与一种或两种氨基酸类型反应。在一些实施例中,每个标记与一种、两种或三种氨基酸类型反应。例如,标记邻马来酰亚胺-氟硼二吡咯对半胱氨酸(C)氨基酸类型是特异的,因为只有限定半胱氨酸(C)R基团的硫醇可以与马来酰亚胺部分反应。这是因为硫醇是“软”亲核试剂并且优先与“软”亲电试剂诸如马来酰亚胺反应。
在一些实施例中,每种氨基酸类型具有用于鉴定的不同标记。例如,如果5种氨基酸类型被标记,则存在5种不同的标记。如果2种氨基酸类型被标记,则存在2种不同的标记。例如,用第一标记来标记氨基酸类型K的氨基酸,并且用不同于第一标记的第二标记来标记氨基酸类型W的氨基酸。
在一些实施例中,2种氨基酸类型被标记。在一些实施例中,3种氨基酸类型被标记。在一些实施例中,4种氨基酸类型被标记。在一些实施例中,5种氨基酸类型被标记。在一些实施例中,6种氨基酸类型被标记。在一些实施例中,7种氨基酸类型被标记。在一些实施例中,8种氨基酸类型被标记。在一些实施例中,9种氨基酸类型被标记。在一些实施例中,10种氨基酸类型被标记。在一些实施例中,11种氨基酸类型被标记。在一些实施例中,12种氨基酸类型被标记。在一些实施例中,13种氨基酸类型被标记。在一些实施例中,14种氨基酸类型被标记。在一些实施例中,15种氨基酸类型被标记。在一些实施例中,16种氨基酸类型被标记。在一些实施例中,17种氨基酸类型被标记。在一些实施例中,18种氨基酸类型被标记。在一些实施例中,19种氨基酸类型被标记。在一些实施例中,20种氨基酸类型被标记。在一些实施例中,21种氨基酸类型被标记。在一些实施例中,22种氨基酸类型被标记。在一些实施例中,23种氨基酸类型被标记。在一些实施例中,24种氨基酸类型被标记。在一些实施例中,25种氨基酸类型被标记。在一些实施例中,26种氨基酸类型被标记。在一些实施例中,27种氨基酸类型被标记。在一些实施例中,28种氨基酸类型被标记。在一些实施例中,29种氨基酸类型被标记。在一些实施例中,30种氨基酸类型被标记。在一些实施例中,31种氨基酸类型被标记。在一些实施例中,32种氨基酸类型被标记。在一些实施例中,33种氨基酸类型被标记。在一些实施例中,34种氨基酸类型被标记。在一些实施例中,35种氨基酸类型被标记。在一些实施例中,36种氨基酸类型被标记。在一些实施例中,37种氨基酸类型被标记。在一些实施例中,38种氨基酸类型被标记。在一些实施例中,39种氨基酸类型被标记。在一些实施例中,40种氨基酸类型被标记。在一些实施例中,2、3、4或5种氨基酸类型被标记。在一些实施例中,4或5种氨基酸类型被标记。在一些实施例中,3或4种氨基酸类型被标记。在一些实施例中,2种氨基酸类型被标记。
在一些实施例中,2种标记的氨基酸类型选自:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)或赖氨酸(K)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和丝氨酸(S)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和赖氨酸(K)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和谷氨酸(E)。在一些实施例中,两种酸类型是甘氨酸(G)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是丙氨酸(A)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是天冬氨酸(D)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和脯氨酸(P)。在一些实施例中,两种氨基酸类型是亮氨酸(L)和缬氨酸(V)。在一些实施例中,两种氨基酸类型是赖氨酸(K)和丝氨酸(S)。在一些实施例中,两种氨基酸类型是谷氨酸(E)和亮氨酸(L)。在一些实施例中,两种氨基酸类型是丙氨酸(A)和精氨酸(R)。在一些实施例中,两种氨基酸是丙氨酸(A)和谷氨酸(E)。在一些实施例中,两种氨基酸是丙氨酸(A)和甘氨酸(G)。
在一些实施例中,3种标记的氨基酸类型选自:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)或赖氨酸(K)。在一些实施例中,标记的3种氨基酸类型是:色氨酸(W)、半胱氨酸(C)和赖氨酸(K)。在一些实施例中,标记的3种氨基酸类型是:赖氨酸(K)、色氨酸(W)和酪氨酸(Y)。在一些实施例中,标记的3种氨基酸类型是:色氨酸(W)、酪氨酸(Y)和半胱氨酸(C)。在一些实施例中,标记的3种氨基酸类型是:色氨酸(W)、酪氨酸(Y)和赖氨酸(K)。在一些实施例中,标记的3种氨基酸类型是:半胱氨酸(C)、色氨酸(W)和酪氨酸(Y)。在一些实施例中,标记的3种氨基酸类型是:天冬酰胺(R)、谷氨酸(E)和甘氨酸(G)。在一些实施例中,标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和丝氨酸(S)。在一些实施例中,标记的3种氨基酸类型是:天冬酰胺(A)、谷氨酸(E)和亮氨酸(L)。在一些实施例中,标记的3种氨基酸类型是:标记的3种氨基酸类型是:丙氨酸(A)、天冬氨酸(D)和亮氨酸(L)。在一些实施例中,标记的3种氨基酸类型是:标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和脯氨酸(P)。在一些实施例中,标记的3种氨基酸类型是:丙氨酸(A)、谷氨酸(E)和亮氨酸(L)。在一些实施例中,标记的3种氨基酸类型是:亮氨酸(L)、丝氨酸(S)和缬氨酸(S)。在一些实施例中,标记的3种氨基酸类型是:谷氨酸(E)、异亮氨酸(I)和脯氨酸(P)。在一些实施例中,标记的3种氨基酸类型是:谷氨酸(E)、甘氨酸(G)和缬氨酸(V)。在一些实施例中,标记的3种氨基酸类型是:精氨酸(R)、丝氨酸(S)和缬氨酸(V)。在一些实施例中,标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和赖氨酸(K)。在一些实施例中,标记的3种氨基酸类型是:丙氨酸(A)、精氨酸(R)和亮氨酸(L)。在一些实施例中,标记的3种氨基酸类型是:丙氨酸(A)、亮氨酸(L)和缬氨酸(V)。
在一些实施例中,标记的4种氨基酸类型是:色氨酸(W)、酪氨酸(Y)和赖氨酸(K)以及半胱氨酸(C),其中半胱氨酸的修饰的和未修饰的氨基酸的组合被标记。在一些实施例中,标记的4种氨基酸类型是:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)和赖氨酸(K),其中还原的半胱氨酸(C
每种氨基酸类型是指该氨基酸类型的修饰的和/或未修饰的氨基酸。优选地,一旦修饰的氨基酸被还原,则氨基酸半胱氨酸(C)指未修饰的氨基酸(C
在一些实施例中,标记的5种氨基酸类型是:色氨酸(W)、半胱氨酸(C)、酪氨酸(Y)和赖氨酸(K),其中还原的半胱氨酸(C
在一些实施例中,两种或更多种氨基或更多种酸类型可以用相同的标记来标记,并且对于每种氨基酸类型独立地鉴定该标记。例如,用与氨基酸类型Y的氨基酸相同的标记来标记氨基酸类型W的氨基酸,并且将氨基酸类型W的标记独立地鉴定为氨基酸类型Y的标记。在一些实施例中,当两种氨基酸类型用相同的标记来标记时,用于检测标记的参数是不同的。例如,一种氨基酸类型的标记与第二种氨基酸类型的标记解卷积。例如,色氨酸(W)和酪氨酸(Y)的氨基酸类型都可以用相同的荧光标记来标记,但是色氨酸(W)标记的荧光强度与酪氨酸(Y)标记的荧光强度解卷积。在一些实施例中,色氨酸(W)和酪氨酸(Y)的氨基酸类型均用相同的荧光染料标记,但用于测量来自荧光染料的色氨酸(W)信号的激发和发射波长不同于用于测量来自荧光染料的酪氨酸(Y)信号的激发和发射波长参数。在一些实施例中,色氨酸(W)和酪氨酸(Y)的氨基酸类型均用相同的荧光染料标记,但用于测量来自荧光染料的色氨酸(W)信号的激发和发射波长不同于用于测量来自荧光染料的酪氨酸(Y)和色氨酸(W)信号的激发和发射波长。在一些实施例中,酪氨酸(Y)信号是根据总色氨酸(w)和酪氨酸(Y)信号减去色氨酸信号(W)测量的。
在一些实施例中,两种或更多种氨基酸类型可以用相同的标记来标记(例如反应),但标记(例如反应)在不同的条件下进行。在一些实施例中,多步骤标记过程允许相同的标记特异性地仅与一种氨基酸类型反应。例如,甲硫氨酸(M)和苯丙氨酸(F)氨基酸类型可以与相同的标记,带有叠氮化物反应性基团的染料,反应。标记反应涉及铜(I)-催化的叠氮化物-炔烃环加成(CuAAC),也称为“点击化学”。甲硫氨酸(M)或苯丙氨酸(F)氨基酸类型的标记反应的第一步是将炔烃基团引入到甲硫氨酸(M)或苯丙氨酸(F)R基团上,随后在标记反应的第二步中与染料上的叠氮化物反应。该第一步在仅与甲硫氨酸(M)氨基酸类型或仅与苯丙氨酸(F)氨基酸类型反应特异的条件下进行。以这种方式,相同的标记(例如染料)可以特异性地与多于一种氨基酸类型反应,使得在反应条件下仅所需的氨基酸类型被标记。
在一些实施例中,所有被标记的两种或更多种氨基酸类型在整个样本内被标记。在一些实施例中,在标记反应之前不将样本分离成多个单个级分。例如,提供尿样本并且在尿样本中标记氨基酸类型W、Y和K,而不将样本分离成多个单个级分,并且在单独的级分中分别标记W、Y和K。例如,单个蛋白质分子将具有所有在分子内被标记的两种或更多种氨基酸类型。在一些实施例中,所有被标记的氨基酸类型在一个级分中被标记。在该实施例中,选择对一种氨基酸类型特异的每种氨基酸类型的标记,使得它不与另一种氨基酸类型交叉反应。在一些实施例中,标记的选择取决于待修饰的氨基酸类型的化学性质。例如,当赖氨酸和色氨酸在相同的级分中被标记时,标记化学不会相互干扰,并且连接到色氨酸的染料的信号可与连接到赖氨酸的染料的信号分离,即在荧光强度的情况下不同的激发和发射波长。
在一些实施例中,在标记反应之前将样本分离成多个级分。因为未水解或消化的完整蛋白质分子内含有每种氨基酸类型的氨基酸,所以一种蛋白质分子含有许多氨基酸类型,并且因此一种级分含有许多氨基酸类型。当样本被分离成多个级分时,在每个级分中进行不同的标记反应,其特异性地标记目的氨基酸类型。在一些实施例中,每个级分含有相等的体积。在该实施例中,每个级分被标记。例如,在标记前将样本分离成两个级分,并且标记4种氨基酸类型;其中在一个级分中标记两种氨基酸类型,并且在第二个级分中标记两种替代氨基酸类型。例如,标记的样本中的4种氨基酸类型是W、K、Y和C,其中C是C
在一些实施例中,如果两种氨基酸类型具有相同的标记,则在不同的级分中标记和测量它们。例如,在一些实施例中,在不同的级分中标记和测量氨基酸类型W和Y。在一些实施例中,如果预测第一氨基酸类型的标记与第二氨基酸类型的标记交叉反应,则将第一和第二氨基酸类型分离成单独的级分。第一个级分与样本内特异于第一氨基酸类型的标记反应,并且第二个级分与样本内特异于第二氨基酸类型的标记反应。这避免了标记的交叉反应。
在一些实施例中,用不与样本中的另一荧光染料或氨基酸类型交叉反应的荧光染料将待标记的两种或更多种氨基酸类型分离成级分。
在一些实施例中,标记样本中两种或更多种氨基酸类型的所有氨基酸,即每个氨基酸。在一些实施例中,标记样本中两种或更多种氨基酸类型中的每一种的每个氨基酸(即所有氨基酸)。例如,如果氨基酸类型色氨酸被标记,则标记样本中存在的每个色氨酸氨基酸。在一些实施例中,标记样本中两种或更多种氨基酸类型中的每一种的每个氨基酸(即所有氨基酸)。例如,如果待标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则标记样本中的每个,即所有,色氨酸(W)氨基酸并且标记样本中的每个,即所有,赖氨酸(K)氨基酸。在另一实例中,如果待标记的两种或更多种氨基酸类型是色氨酸(W)、赖氨酸(K)和酪氨酸(Y),则标记样本中的每个,即所有,色氨酸(W)氨基酸,标记样本中的每个,即所有,赖氨酸(K)氨基酸,并且标记样本中的每个,即所有,酪氨酸(Y)氨基酸。
在一些实施例中,标记样本中两种或更多种氨基酸类型的一定比例的氨基酸(即不是所有氨基酸)。在一些实施例中,标记样本中两种或更多种氨基酸类型中的每一种的一定比例的氨基酸(即不是所有氨基酸)。例如,如果氨基酸类型色氨酸被标记,则标记样本中存在的一定比例的色氨酸氨基酸。例如,如果待标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则标记样本中一定比例的色氨酸(W)氨基酸,并且标记样本中一定比例的赖氨酸(K)氨基酸。如果待标记的两种或更多种氨基酸类型是色氨酸(W)、赖氨酸(K)和酪氨酸(Y),则标记样本中一定比例的色氨酸(W)氨基酸,标记样本中一定比例的赖氨酸(K)氨基酸,并且标记样本中一定比例的酪氨酸(Y)氨基酸。优选地,在样本内标记两种或更多种氨基酸类型中的每一种的约50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%,或79%、80%、81%、82%、83%、84%、85%、86%、87%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的氨基酸。在一些实施例中,使用质谱确定样本内标记的氨基酸类型的氨基酸的比例。在一些实施例中,标记样本内所含的蛋白质组或亚蛋白质组中两种或更多种氨基酸类型的一定比例的氨基酸(即不是所有氨基酸)。
在一些实施例中,标记一种氨基酸类型的每个(即所有)氨基酸,并且标记另一种氨基酸类型的一定比例的氨基酸。例如,如果待标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则标记样本中所有色氨酸(W)氨基酸和样本中90%的赖氨酸(K)氨基酸。替代地,标记样本中90%的色氨酸(W)氨基酸和所有赖氨酸(K)氨基酸。
在一些实施例中,在样本内标记两种或更多种氨基酸类型内的氨基酸的R基团。每种氨基酸类型的R基团对于每种氨基酸类型是独特的。例如,色氨酸(W)的R基团不同于赖氨酸(K)的R基团。表2中提供了每种氨基酸类型特有的R基团。标记样本中的两种或更多种氨基酸类型。在一些实施例中,标记待标记的所选氨基酸类型的每个氨基酸(即所有氨基酸)。在一些实施例中,标记氨基酸类型的每个氨基酸(即所有氨基酸)的R基团。在一些实施例中,标记一定比例的氨基酸类型(即不是每个氨基酸)。在一些实施例中,氨基酸类型的一定比例的氨基酸(即不是所有氨基酸)的R基团被标记。在一些实施例中,标记氨基酸类型的每个氨基酸(即所有氨基酸),并且标记一定比例的第二氨基酸类型(即不是所有氨基酸)。在一些实施例中,标记第一氨基酸类型的每个氨基酸(即所有氨基酸)的R基团,并且标记第二氨基酸类型的一定比例的氨基酸(即不是所有氨基酸)的R基团。
优选地,标记选自以下的两种或更多种氨基酸类型中的每一种的R基团:W、C、Y或K。优选地,针对C标记的R基团是还原的半胱氨酸(C
在优选的实施例中,标记两种或更多种氨基酸类型,并且在样本中标记氨基酸类型中的每一种的R基团(即标记两种或更多种类型的R基团)。R基团的两种或更多种氨基酸类型对应于两种或更多种氨基酸类型。例如,当色氨酸和赖氨酸是被标记的两种氨基酸类型时,样本中色氨酸的R基团和赖氨酸的R基团被标记。在一些实施例中,标记2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或22种氨基酸类型中的每一种的R基团。在一些实施例中,标记的3个氨基酸R基团是选自以下的3种氨基酸类型中的每一种的R基团:C、W和Y,其中C是未修饰的C氨基酸(C
在一些实施例中,针对每种氨基酸类型标记一个氨基酸R基团。例如,针对氨基酸类型色氨酸标记每个色氨酸氨基酸上的吲哚R基团。在另一实例中,针对氨基酸类型赖氨酸标记每个赖氨酸氨基酸上的ε-氨基R基团。表2列出了每种氨基酸类型的R基团。
表2:每个氨基酸类型的R基团
在优选的实施例中,样本内的两种或更多种氨基酸类型被荧光标记、同位素标记或使用质量标签标记。替代地,用核苷酸标记样本内的两种或更多种氨基酸类型。在一些实施例中,每种氨基酸类型的R基团被荧光标记、同位素标记或使用质量标签标记。在一些实施例中,用核苷酸标记每个氨基酸的R基团。
在一些实施例中,一种氨基酸用一种类型的标记来标记,并且另一种氨基酸类型用另一种类型的标记来标记。例如,一种氨基酸类型用荧光标记来标记,并且第二种氨基酸类型用串联质量标签来标记。
在一些实施例中,标记是荧光标记。在一些实施例中,荧光标记是荧光染料、荧光标签、荧光探针或荧光蛋白。在一些实施例中,荧光标记包括荧光团。在一些实施例中,荧光团选自由以下组成的组:羟基香豆素、氨基香豆素、甲氧基香豆素、瀑布蓝(Cascade Blue)、太平洋蓝、太平洋橙、荧光黄、NBD、R-藻红蛋白(PE)、PE-Cy5共轭物、PE-Cy7共轭物、红613、PerCP、TruRed、FluorX、氟硼二吡咯-FL(BODIPY-FL)、G-染料100、G-染料200、G一染料300、G-染料400、Cy2、Cy3、Cy3B、Cy3.5、Cy5、Cy5.5、Cy7、TRITC、X-罗丹明(X-Rhodamine)、丽丝胺罗丹明B、德克萨斯红、别藻蓝蛋白(APC)、APC-Cy7共轭物、DAPI、赫斯特(Hoechst)33258、SYTOX蓝、色霉素A3、光神霉素、YOYO-1、ATTO 390、ATTO 425、ATTO 465、ATTO 488、ATTO495、ATTO 514、ATTO 520、ATTO 532、ATTO Rho6G、ATTO 550、ATTO 565、ATTO Rho3B、ATTORho11、ATTO Rho12、ATTO Thio12、ATTO Rho101、ATTO 590、ATTO Rho13、ATTO 594、ATTO610、ATTO Rho14、ATTO 633、ATTO 647、ATTO 647N、ATTO 655、ATTO Oxa12、ATTO 665、ATTOOxa12、ATTO 665、ATTO 680、ATTO 700、ATTO 725、ATTO 740、亮紫421、亮紫510、亮紫570、亮紫605、亮紫650、亮紫711、亮紫750、亮紫785、TM-BDP、KFL-1、KFL-2、KFL-3、KFL-4、超亮(Super Bright)436、超亮600、超亮645、超亮702、超亮780、Alexa Flour 350、Alexa Flour405、Alexa Flour 488、Alexa Flour 532、Alexa Flour 546、Alexa Flour 555、AlexaFlour 568、Alexa Flour 594、Alexa Flour 647、Alexa Flour 680、Alexa Flour 850、香豆素、太平洋绿、俄勒冈绿(Oregon Green)、荧光素(FITC)、PE-青色素7、PerCP-青色素5.5、四甲基罗丹明(Tetramethylrhodamine,TRITC)、eFlour 450、eFlour506、eFlour660、PE-eFlour 610、PerCP-eFlour 710、APC-eFlour 780、超亮436、超亮600、超亮645、超亮702、超亮780、DAPI、SYTOX绿、SYTO 9、TO-PRO-3、Qdot 525、Qdot 565、Qdot 605、Qdot 655、Qdot705、Qdot 800、R-藻红素(R-PE)、VioBlue、VioGreen、VioBright 515、Vio 515、VioBrightFITC、PE、PE-Vio 615、PerCP、PerCP-Vio 700、PE-Vio 770、APC、APC-Vio 770、1,8-萘酰亚胺、噻唑橙、CyTRAK橙、LDS 751、7-AAD、SYT0X橙、T0TO-3、TO-PRO-3、DRAQ5、DRAQ7、Indo-1、Fluo-3、Fluo-4、DCFH、DHR、SNARF、CFP、GFP(emGFP)、RFP(tagRFP)、GFP(Y66H突变)、GFP(Y66F突变)、EBFP、EBFP2、蓝铜矿、GFPuv、T-天蓝色、mCerulean、mCerulean3mCFP、mTurquoise2、ECFP、CyPet、GFP(Y66W突变)、mKeima-红、TagCFP、AmCyan1、mTFP1、GFP(S65A突变)、Midoriishi青色、野生型GFP、GFP(S65C突变)、TurboGFP、TagGFP、GFP(S65L突变)、翠绿色、GFP(S65T突变)、EGFP、Azami绿、ZsGreen1、TagYFP、EYFP、Topaz、Venus、mCitrine、YPet、TurboYFP、ZsYellow1、Kusabira橙、亮橘色(mOrange)、别藻蓝素(APC)、mKO、TurboRFP、tdTomato、TagRFP、DsRed单体、DsRed2(“RFP”)、mStrawberry、TurboFP602、AsRed2、mRFP1、J-红、R-藻红蛋白(RPE)、B-藻红蛋白(BPE)、mCherry、HcRedl、Katusha、P3、多甲藻素叶绿素(PerCP)、mKate(TagFP635)、TurboFP635、mPlum或mRaspberry。
在一些实施例中,荧光标签或荧光标记不是荧光染料。在一些实施例中,荧光标签或荧光标记还包括对定义氨基酸类型的R基团特异的反应性基团。以这种方式,荧光标记靶向特定的氨基酸类型。在一些实施例中,标记目的氨基酸类型是共价标记目的氨基酸类型。在一些实施例中,反应性基团允许选择性共价标记目的氨基酸类型的R基团。在一些实施例中,反应性基团选自由以下组成的组:NHS-酯、马来酰亚胺、炔烃、叠氮化物、溴化物、氯化物、氟化物、碘化物、芳基溴化物、芳基氯化物、芳基氟化物、芳基碘化物、二烯、亲二烯体、烯烃、四嗪、环辛炔、生物素、链霉抗生物素蛋白、异硫氰酸酯、活性酯、磺酰氯、二醛、碘乙酰胺、乙二胺、氨基吖啶酮、酰肼、羧基或烷氧基胺。例如,本领域技术人员将理解,亲电子马来酰亚胺基团选择性地靶向亲核半胱氨酸硫醇残基。因此,可以选择上面列出的任何荧光团并且与马来酰亚胺反应性基团偶联,以选择性标记半胱氨酸硫醇残基。例如,可以用包含超亮436和马来酰亚胺反应性基团的荧光标记来标记半胱氨酸硫醇残基。作为另一实例,本领域技术人员将理解不稳定的NHS酯基团选择性靶向赖氨酸伯胺R基团,并且可以与赖氨酸伯胺R基团进行共价SN2反应。因此,赖氨酸残基可以用Cy5的NHS-酯形式标记。这些标记方法是本领域技术人员所理解的,并且所公开的荧光团的指定反应性形式是可商购的。
在一些实施例中,荧光标记是靶向氨基酸类型的荧光染料或在与氨基酸类型反应时仅变成发荧光的分子。优选地,荧光染料仅在与蛋白质内的特定氨基酸类型共价反应后才变成发荧光。在这种情况下,不需要将荧光团与反应性基团偶联,因为在荧光染料或分子仅在与氨基酸类型反应时变成发荧光的情况下,对氨基酸类型的选择性已经建立在荧光染料或分子的化学结构中,该荧光染料或分子仅在与氨基酸类型反应时变成发荧光。在一些实施例中,靶向氨基酸类型的荧光染料或仅在与氨基酸类型反应后变成发荧光的分子选自由以下组成的组:4-氟-7-氨磺酰基苯并呋喃(ABD-F)、2,2,2-三氯乙醇(TCE)和/或邻苯二甲醛(OPA),或其混合物。优选地,针对每种氨基酸类型或表2和表3中的R基团选择荧光染料。然而,该列表是非排他性的,并且也可以使用在与本领域已知的氨基酸类型反应时变成发荧光的任何其它荧光染料或分子。本领域技术人员将理解,用高量子产率荧光或非荧光标记来标记可以允许鉴定样本内极低浓度的蛋白质,诸如在单分子水平。这对应于1pM至1nM的蛋白质浓度。
在一些实施例中,氨基酸类型与在与该氨基酸类型反应后变成发荧光的分子反应,或将已经发荧光的氨基酸类型的荧光转移到可见光谱中。例如,在一些实施例中,在与氨基酸类型反应后变成发荧光的分子是卤代化合物。在一些实施例中,卤代化合物是三氯乙酸、三氯甲烷、三氟乙醇、三氟乙酸、三氟甲烷、三溴乙醇、三溴乙酸、三溴甲烷、三碘乙醇、三碘乙酸或三碘甲烷。在一些实施例中,在Rh2(OAc)4、tBuHNOH的存在下,用三氯乙醇三氯乙醇(TCE)、三氯乙酸(TCA)、三氯甲烷、三氟乙醇(TFE)、三氟乙酸(TFA)、三氟甲烷、三溴乙醇、三溴乙酸(TBA)、三溴甲烷、三碘乙醇(TIE)或三碘乙酸(TIA)、三碘甲烷或用2-(2-(2-甲氧基乙氧基)乙氧基)乙基(E)-2-重氮基-4-苯基丁-3-烯酸酯标记氨基酸类型色氨酸(W)和/或酪氨酸(Y)。在一些实施例中,用三氯乙醇(TCE),或使用[RhCl(PPh3)3]、R2P(OAr)、Ar-Br、CsCO3在酪氨酸羟基基团邻位引入芳基基团来标记氨基酸类型Y。
本领域技术人员容易理解如何可以标记氨基酸。
在一些实施例中,基于与氨基酸类型的特异相互作用选择标记。例如,该标记是荧光染料并且基于与氨基酸类型的特异相互作用来选择,其中染料仅在其与特异氨基酸类型反应后变成发荧光(即其信号仅变成可检测的)。在一些实施例中,标记的选择取决于待修饰的氨基酸类型的化学性质。在一些实施例中,对于与氨基酸类型的特异反应,在氨基酸类型上存在反应性基团并且在标记上存在反应性基团,该反应性基团仅彼此反应。这由氨基酸类型上的R基团和标记上的反应性基团的特异化学反应性确定。例如,ABD-F在芳族系统上的不稳定位置处含有卤素并且易受亲电芳香族取代的影响。存在几种亲核氨基酸类型(例如半胱氨酸、赖氨酸、组氨酸),但是半胱氨酸氨基酸类型(C)是最强的亲核试剂,因为它是最可极化的。由于电子云更易可极化,亲核攻击的活化能降低。因此,ABD-F优先与半胱氨酸(C)残基反应,并且不与需要较高活化能的其它氨基酸类型诸如赖氨酸或组氨酸氨基酸类型反应。
在一些实施例中,标记反应是荧光反应。这意味着仅在与氨基酸类型反应后生成荧光,使得不需要从样本中纯化未反应的标记。
在一些实施例中,荧光反应涉及从淬灭反应的荧光团中去除基团。例如,已知当马来酰亚胺直接共轭至荧光团时,由于马来酰亚胺的低能nπ*态提供了荧光团激发态衰变的非辐射途径,马来酰亚胺猝灭荧光团,并且当其通过间隔基团连接至荧光团时,也可以猝灭荧光团,因为可以发生可光诱导的电子转移(PET)至C=C双键。例如,当马来酰亚胺附接在荧光染料BODIPY的邻位时,马来酰亚胺猝灭染料BODIPY的荧光。然而,当邻马来酰亚胺BODIPY与半胱氨酸(C)氨基酸类型的硫醇R基团反应时,C=C双键变得饱和并且不再淬灭荧光,因此BODIPY标记变得发光。本领域已知的其它淬灭基团包括叠氮基、炔烃、膦、斯德酮、四嗪或肟,并且这些可以在荧光点击反应后变得未淬灭,该荧光点击反应包括铜催化/应变促进的炔烃-叠氮化物环加成(CuAAC/SPAAC)、施陶丁格连接、铜催化/应变促进的斯德酮-炔烃环加成(CuSAC/SPSAC)、逆电子需求狄尔斯-阿德尔反应(iEDDA)或1,3-偶极环加成。
在一些实施例中,荧光反应涉及生成荧光团。这种类型的荧光反应的实例是赖氨酸(K)氨基酸类型与邻苯二醛的反应。形成第二环,延伸电子共轭,并且该较大的离域π体系在光谱的可见区域中变成发荧光。在一些实施例中,荧光反应涉及改变现有荧光底物的荧光特性。例如,固有荧光的氨基酸色氨酸与三氯乙醇(TCE)进行光-催化的自由基反应,该反应在色氨酸吲哚环上引入α-羟基酮,延伸共轭并且将色氨酸的固有荧光转移100nm至光谱的红色末端。
为了进一步说明如何对氨基酸类型进行特异性和荧光标记,下面呈现了用于本发明的荧光染料和反应方法的表格,从中可以为每种反应类型选择合适的标记和反应策略。
表3:每种氨基酸类型的每个R基团的荧光标记
/>
利用C-H键官能化的现有技术领域的标记脂肪族氨基酸的策略(DOI:10.1002/ejoc.201800896)。在替代实施例中,对P1或P1′位置的脂肪族(A、I、L、F或V)氨基酸具有裂解特异性的蛋白酶可以用于在目的氨基酸类型出现时切割蛋白质序列。这在蛋白质序列被切割的任何地方生成新的蛋白质N-末端。由于蛋白酶的裂解特异性是已知的,这可以容易地模拟。蛋白质N-末端可以使用对N-末端特异的荧光染料诸如NHS-酯反应。以这种方式,当N-末端与目的氨基酸类型相邻时,仅对N-末端特异的荧光染料反应,因此,基于当蛋白酶在V位置裂解时生成的N-末端的浓度(标记的信号报告V氨基酸类型的氨基酸浓度),测量样本中脂肪族例如缬氨酸(V)氨基酸类型的浓度。例如,人嗜中性粒细胞弹性蛋白酶在缬氨酸氨基酸处裂解。调节目的蛋白质的V氨基酸数目以增加已经存在于目的蛋白质内的N-末端的数目(基于蛋白质链的数目),并且将其用作参数方程组1的输入。在一些实施例中,蛋白酶也裂解,由于其自身的缬氨酸氨基酸而生成信号,但这被并入背景荧光强度测量中。
优选地,氨基酸类型的标记的R基团是氨基酸类型的R基团;这些包括标记含有对含有糖苷的R基团特异的糖苷的R基团,并且包含用TT/n-Bu4NN3或Ph3P:2,3-二氯-5,6-二氰基苯醌(DDQ):n-Bu4NN3选择性转换为叠氮化物,随后与Fl-DIBO反应。
标记含有脂肪酸的R基团对于含有脂肪酸的R基团是特异的,其包含用偶极3-甲氧基色酮标记,从而允许检测所有脂化氨基酸类型。标记含有磷酸基的R基团包含用羰二咪唑活化以提供离去基团,随后与半胱氨酸BODIPY染料反应,并且对于含有磷酸基的R基团是特异的,从而允许检测用磷酸基修饰的所有氨基酸类型。
在一些实施例中,氨基酸类型的修饰的氨基酸与氨基酸类型的未修饰的氨基酸标记不同。例如,对于氨基酸类型半胱氨酸,未修饰的氨基酸C
本领域技术人员将理解,尽管肽内的全部或一定比例的氨基酸暴露于溶剂并且可用于标记反应,但这可能不是折叠蛋白质的情况。在一些实施例中,样本在标记反应之前或期间变性。使蛋白质变性的方法是本领域已知的。在一些实施例中,这经由添加可混溶的有机溶剂诸如二甲基亚砜、甲醇、乙腈、乙醇或异丙醇来实现。在一些实施例中,这经由将缓冲液条件改变为低或高pH诸如pH 2、pH 3、pH 4、pH5、pH 7.5、pH 8.5、pH 9、pH 10或pH 10.5来实现。在一些实施例中,这通过将溶液加热至40℃、50℃、60℃、70℃、80℃、90℃或100℃来实现。在一些实施例中,这通过用TCEP、β-巯基乙醇、DTBA或DTT还原蛋白质二硫键来实现。在一些实施例中,这通过添加变性剂诸如脲、氯化胍或硫氰酸胍来实现。在一些实施例中,这通过添加表面活性剂诸如十二烷基硫酸钠(SDS)、十二烷基三甲基溴化铵(DTAB)、溴化十六烷基三甲铵(CTAB)、磷脂酰胆碱、Triton X-100、Triton X-114、CHAPS、NP-40、1-十一烷磺酸钠(SUS)、十二烷基苯磺酸钠(SDBS)、脱氧胆酸钠(DOC)、硬脂酸钠、4-(5-十二烷基)苯磺酸酯、磺基琥珀酸二辛酯钠、烷基醚磷酸盐、苯扎氯铵(BAC)和全氟辛烷磺酸(PFOS)来实现。在一些实施例中,在标记反应期间实现使样本内所含的蛋白质变性。在一些实施例中,标记反应在本文列出的添加剂的存在下进行。在一些实施例中,通过还原多肽二硫键并且添加表面活性剂来实现使样本内所含的多肽变性。在一些实施例中,通过还原蛋白质二硫键并且添加表面活性剂来实现使样本内所含的蛋白质变性。在一些实施例中,通过还原多肽二硫键、添加表面活性剂并且将缓冲液条件改变为高或低pH来使实现样本内所含的多肽变性。在一些实施例中,通过还原蛋白质二硫键、添加表面活性剂并且将缓冲液条件改变为高或低pH来实现使样本内所含的蛋白质变性。在一些实施例中,通过用TCEP还原蛋白质二硫键并且添加表面活性剂SDS来实现使样本内所含的蛋白质变性。在一些实施例中,通过还原蛋白质、肽、寡肽、多肽和/或蛋白质复合物二硫键并且添加表面活性剂来实现使样本内所含的包含亚蛋白质组或蛋白质组的蛋白质、肽、寡肽、多肽和/或蛋白质复合物变性。在一些实施例中,通过还原通过还原蛋白质、肽、寡肽、多肽和/或蛋白质复合物二硫键、添加表面活性剂并且将缓冲液条件改变为高或低pH来实现使样本内所含的包含亚蛋白质组或蛋白质组的蛋白质、肽、寡肽、多肽和/或蛋白质复合物变性。在一些实施例中,通过还原蛋白质、肽、寡肽、多肽和/或蛋白质复合物二硫键、添加表面活性剂并且将缓冲液条件改变为高或低pH来实现使样本内所含的包含亚蛋白质组或蛋白质组的蛋白质、肽、寡肽、多肽和/或蛋白质复合物变性。在一些实施例中,通过用TCEP还原蛋白质、肽、寡肽、多肽和/或蛋白质复合物二硫键并且添加表面活性剂SDS来实现使样本内所含的包含亚蛋白质组或蛋白质组的蛋白质、肽、寡肽、多肽和/或蛋白质复合物变性。例如,在4%w/v SDS和18mMβ-巯基乙醇的存在下,在pH 10下进行标记反应。作为另一实例,在4%SDS和10mM TCEP存在下,在pH10.5下进行标记反应。在一些实施例中,标记反应有多个步骤。在一些实施例中,第一步使未修饰的或修饰的氨基酸类型的R基团对标记具有反应性,并且在适于该反应的一组条件下进行。然后标记的第二步是在所描述的用于标记氨基酸类型的所有氨基酸的变性条件下使现在的反应性R基团反应。例如,标记C
在一些实施例中,在用TCEP还原并且用十二烷基硫酸钠(SDS)在缓冲液中变性后,用ABD-F荧光标记C
在一些实施例中,还原的半胱氨酸(C
在一些实施例中,在缓冲液中用OPA、β-巯基乙醇(BME)和SDS荧光标记赖氨酸(K)的氨基酸类型(例如R基团)的未修饰的氨基酸。在一些实施例中,缓冲液是碳酸钠缓冲液。在一些实施例中,用10至20mg OPA+5至10mL碳酸盐缓冲液+10至20μL BME+1至5mL 20%SDS荧光标记氨基酸。在一些实施例中,在200mM碳酸钠缓冲液中用12mM邻苯二甲醛(OPA)、18mMβ-巯基乙醇(BME)、4%SDS荧光标记氨基酸。染料分子OPA是二醛。赖氨酸伯胺攻击一种醛并且失去水。这导致形成亚胺,特别是席夫碱。由BME呈现的硫醇亲核试剂攻击该席夫碱,使得胺再次可用于对其它侧挂醛的闭环攻击。BME参与产生荧光团的反应,然而,可以使用其它硫醇代替BME。失去水,并且共轭延伸到新形成的环中,导致在光谱的可见区域生成荧光。
在一些实施例中,在用TCEP还原和用十二烷基硫酸钠(SDS)在缓冲液中变性之后,用TCE荧光标记色氨酸(W)的氨基酸类型的修饰的和未修饰的氨基酸(例如R基团)的组合和酪氨酸(Y)的修饰的和未修饰的氨基酸类型(例如R基团)的组合。TCEP还原蛋白质内的二硫键,使得与SDS变性一起,所有色氨酸(W)和酪氨酸(Y)氨基酸可用于反应。在一些实施例中,缓冲液是HEPES缓冲液。在一些实施例中,W氨基酸、Y氨基酸或W和Y氨基酸的激发态经历与TCE的自由基反应。在一些实施例中,该反应是用被W氨基酸、Y氨基酸,或W和Y氨基酸吸收的波长的UV光进行光催化的。在一些实施例中,在波长为260至310nm的UV光的催化下,在1至10mM HEPES中用0.01至5M TCE、2至50mM TCEP和2至20%SDS对W的氨基酸类型进行荧光标记。在一些实施例中,在波长为295至305nm的UV光的催化下,在5mM HEPES中的0.2M TCE、10mM TCEP和4%SDS中荧光标记W的氨基酸类型。在一些实施例中,在波长为260至310nm的UV光的催化下,在1至10mM HEPES中用0.01至5M TCE、2至50mM TCEP和2至20%SDS对Y的氨基酸类型进行荧光标记。在一些实施例中,在波长为285至295nm的UV光的催化下,在5mMHEPES中的0.2M TCE、10mM TCEP和4%SDS中荧光标记Y的氨基酸类型。
在一些实施例中,当标记氨基酸类型(例如R基团)半胱氨酸(C)时,其中半胱氨酸的修饰的和未修饰的氨基酸均被标记,在半胱氨酸R基团内含有的半胱氨酸硫醇在染料ABD-F上的亲电加成/消除反应中充当亲核试剂之前,氧化的(二硫化物键合的)半胱氨酸经由还原剂(TCEP)还原。这导致氟淬灭基团的损失,使得染料的荧光不再淬灭。当标记氨基酸类型赖氨酸(K)时,R基团内所含的赖氨酸伯胺攻击OPA内所含的醛中的一种。这形成亚胺,其被添加到反应中的硫醇(BME)攻击,释放伯胺以攻击剩余的侧挂醛。这封闭了第二环,并且延伸了芳族共轭,使荧光进入可见区域。
氨基酸类型色氨酸和酪氨酸的标记反应是光催化的自由基反应。可以用2,2,2-三氯乙醇(TCE)、2,2,2-三氯乙酸(TCA)或三氯甲烷以及其它二/三卤代化合物来标记色氨酸。来自色氨酸R基团的自由基与TCE结合,并且失去氢原子,导致二卤化合物添加到吲哚环上。这是不稳定的,并且被水分子攻击,然后失去盐酸,导致α羟基酮添加到吲哚环上,其使色氨酸的固有荧光向右转移约100nm,并且进入可见区域。酪氨酸反应的标记反应也是与TCE的光催化自由基反应,它使酪氨酸的固有荧光向右转移约100nm,并且进入可见区域。酪氨酸的苯酚R基团与TCE结合,经由与色氨酸标记反应相同的机制,导致α-羟基酮添加到环上。
发现对已经有固有荧光的氨基酸类型进行标记,可以实现未标记的氨基酸类型不可能实现的定量检测。例如,色氨酸和酪氨酸氨基酸是固有荧光的,因此用荧光标记来标记固有荧光的氨基酸是违反直觉的。本领域技术人员将理解,色氨酸和酪氨酸氨基酸类型的固有荧光高度依赖于3D蛋白质结构内这些残基周围的局部环境,因此色氨酸和酪氨酸氨基酸类型的固有荧光不能揭示蛋白质序列内色氨酸和酪氨酸残基的含量。然而,当这些氨基酸类型被标记后,其荧光的环境敏感性消失,并且标记的色氨酸或酪氨酸的荧光确实可以揭示样本内色氨酸或酪氨酸氨基酸类型的数目或浓度。例如,对于用三氯乙醇(TCE)标记的色氨酸和酪氨酸氨基酸类型,可以观察到荧光的环境敏感性消失了。这种意料不到的结果可能是由于色氨酸或酪氨酸的电子特性的改变,该色氨酸或酪氨酸的吲哚或苯酚环共轭已经经由添加α羟基酮而延伸,使得荧光团对局部环境的极性较不敏感。
替代地,荧光标记包括荧光蛋白或共轭抗体。优选地,荧光蛋白选自由以下组成的组:CFP、GFP(emGFP)、RFP(tagRFP)、GFP(Y66H突变)、GFP(Y66F突变)、EBFP、EBFP2、蓝铜矿、GFPuv、T-天蓝色、mCerulean、mCerulean3 mCFP、mTurquoise2、ECFP、CyPet、GFP(Y66W突变)、mKeima-红、TagCFP、AmCyan1、mTFP1、GFP(S65A突变)、Midoriishi青色、野生型GFP、GFP(S65C突变)、TurboGFP、TagGFP、GFP(S65L突变)、翠绿色、GFP(S65T突变)、EGFP、Azami绿、ZsGreen1、TagYFP、EYFP、Topaz、Venus、mCitrine、YPet、TurboYFP、ZsYellow1、Kusabira橙、亮橘色(mOrange)、别藻蓝素(APC)、mKO、TurboRFP、tdTomato、TagRFP、DsRed单体、DsRed2(“RFP”)、mStrawberry、TurboFP602、AsRed2、mRFP1、J-红、R-藻红蛋白(RPE)、B-藻红蛋白(BPE)、mCherry、HcRed1、Katusha、P3、多甲藻素叶绿素(PerCP)、mKate(TagFP635)、TurboFP635、mPlum或mRaspberry。在一些实施例中,特异于翻译后修饰的共轭抗体可以用于本发明的方法内。在一些实施例中,用本文提供的荧光标记或荧光团中的一种标记共轭抗体。优选地,共轭抗体是传统上或合成衍生的单克隆抗体,并且选自包括IgG、IgM、IgA、IgE或纳米抗体的组。优选地,每抗体用一种或荧光染料、荧光标记或荧光团标记。在一些实施例中,共轭抗体对翻译后修饰具有选择性,包括:N-乙酰化、甲基化、脱亚胺成瓜氨酸、脱酰胺成天冬氨酸或异天冬氨酸、N-连接的糖基化、异构化成异天冬氨酸、二硫键形成、氧化成次磺酸、亚磺酸或磺酸、棕榈酰化、N-乙酰化(N-末端)、S-亚硝基化、环化成焦谷氨酸(N-末端)、γ-羧化、脱酰胺成谷氨酸、异肽键形成、N-肉豆蔻酰化(N-末端)、磷酸化、泛素化、SUMO化、异肽键形成为谷氨酰胺、羟基化、N-连接的泛素化、氧化成亚砜或砜、羟基化、O-连接的糖基化、单-或二-氧化、犬尿氨酸的形成或硫酸化。
替代地,标记是串联质量标签(TMT)。优选地,串联质量标签是TMTzero、TMTduplex、TMTsimplex、TMT 10-plex、TMTpro和TMTpro Zero。替代地,标记是稳定同位素标记(即同位素标记)。在一些实施例中,稳定同位素标记是非放射性同位素。在一些实施例中,非放射性同位素标记是2H、13C和/或15N。在一些实施例中,标记策略结合使用。例如,每种氨基酸类型可以用化学方法标记(例如用荧光染料),并且然后用抗体标记。例如,化学标记两种或更多种氨基酸类型,并且然后使用翻译后修饰特异抗体,例如,检测不同氨基酸类型的氨基酸的磷酸化。
本领域技术人员将理解,作为本发明的一部分所涵盖的标记反应可以在没有分离步骤的情况下进行,或在分离样本的蛋白质组分或样本中特定目的蛋白质的分离步骤之后进行。例如,可以使用分离步骤诸如提取、沉淀和差异化增溶、离心、超速离心、超声处理、尺寸排阻色谱法、基于电荷或疏水性的分离(实例包括疏水相互作用色谱法、离子交换色谱法和/或自由流动电泳、毛细管电泳)、亲和色谱法诸如免疫亲和色谱法或高效液相色谱法(HPLC),或技术领域内已知的其它方法。
在一些实施例中,样本内的蛋白质一旦分离就被浓缩。这可以涉及但不限于冻干或超滤。在一些实施例中,样本内的一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组一旦分离就被浓缩。
在一些实施例中,标记是荧光标记,并且两种或更多种氨基酸类型在相同条件下用相同荧光标记来标记,但标记反应以不同速率进行。因此,在某一时刻测量标记的时间分辨信号揭示标记的信号仅来自一种标记的氨基酸类型,而在另一时刻测量标记的时间分辨信号揭示标记的信号仅来自另一标记的氨基酸类型,或来自两种标记的氨基酸类型,使得在第一时间的标记的信号可以从在第二时间的标记的信号中减去,以揭示仅来自第二氨基酸类型的标记的信号。这是动力学解卷积。优选地,每种氨基酸类型的标记的检测与其它氨基酸类型解卷积,以使每种单个氨基酸类型的标记能够被检测。例如,W和Y氨基酸类型都用荧光标记TCE标记,并且标记反应在相同条件下进行,0.2M TCE、10mM TCEP和4%SDS于5mMHEPES中,以及用波长为280nm的UV光进行光催化,但标记反应以不同速率进行。在该实例中,W标记发生在Y标记之前。因此,当仅标记W残基时,通过停止标记反应使W和Y解卷积,并且然后进行反应,使W和Y都有足够的时间被标记,从而可以测量样本中Y和W中的每一个的荧光。在一些实施例中,样本中Y的荧光等于样本中W和Y的荧光减去样本中W的荧光。在优选的实施例中,氨基酸类型W和Y彼此解卷积。在优选的实施例中,氨基酸类型丝氨酸和苏氨酸彼此解卷积。在优选的实施例中,氨基酸类型天冬酰胺和谷氨酰胺彼此解卷积。在优选的实施例中,氨基酸类型谷氨酸和天冬氨酸彼此解卷积。在优选的实施例中,氨基酸类型亮氨酸和异亮氨酸彼此解卷积。
解卷积可以在标记阶段实现。在一些实施例中,当形成荧光染料时实现解卷积。在该实施例中,改变形成标记时的条件,使得用相同荧光标记来标记的两种或更多种氨基酸类型与标记相互不同地反应。在一些实施例中,用相同标记来标记的两种氨基酸类型的解卷积可以通过选择其中一种氨基酸类型将与标记反应而另一种氨基酸类型将不与标记反应的条件来实现。优选地,一种氨基酸类型的标记反应被催化,并且另一种氨基酸类型的标记反应不被催化。例如,对于W和Y氨基酸类型的光催化的修饰反应,标记在不同的光催化波长下形成,使得仅W氨基酸或W和Y氨基酸都吸收在光催化波长下催化反应所需的光。在一些实施例中,选择性标记W氨基酸类型。本领域众所周知,W氨基酸和Y氨基酸的吸收光谱不同,如
在一些实施例中,样本含有或怀疑含有亚蛋白质组或蛋白质组。在此类实施例中,标记样本中的两种或更多种氨基酸类型(例如R基团),而不需要将样本分离成其单个蛋白质、肽、寡肽、多肽或蛋白质复合物组分。本领域技术人员将理解,将复杂混合物诸如蛋白质组或亚蛋白质组分离成其单个组分可能需要大量的时间和劳力。本领域技术人员将理解,顺序分析蛋白质组或亚蛋白质组内的每个单个蛋白质的需要显著增加了分析所需的时间,就像蛋白质组含有1000个蛋白质一样,这将需要对1000个样本进行顺序分析。本发明分析蛋白质组、亚蛋白质组或混合物样本而不将样本分离成其单个蛋白质组分的能力允许该方法的高通量,因为不需要分离亚蛋白质组、蛋白质组或混合物。
测量标记
测量样本中标记的氨基酸类型中的每一种的标记。在一些实施例中,标记提供信号,并且测量标记的信号。
测量的每种氨基酸类型的标记与样本内该氨基酸类型的浓度、样本中每种氨基酸类型的氨基酸数目和样本的蛋白质浓度线性相关。在优选的实施例中,标记是荧光染料,并且测量的每种氨基酸类型的荧光强度与样本内该氨基酸类型的浓度、样本中每种氨基酸类型的氨基酸数目和样本的蛋白质浓度线性相关。在优选的实施例中,标记是非荧光染料,并且测量的每种氨基酸类型的非荧光染料的信号与样本中该氨基酸类型的浓度、样本中每种氨基酸类型的氨基酸数目和样本的蛋白质浓度线性相关。优选地,纯化非荧光染料的信号以去除未反应的染料。这可以通过色谱柱实现。在一些实施例中,标记是可以使用PCR扩增的核苷酸序列,并且测量的每种氨基酸类型的核苷酸序列与样本内该氨基酸类型的浓度、样本中每种氨基酸类型的氨基酸数目和样本的蛋白质浓度线性相关。在优选的实施例中,标记是质量标签或同位素标记,并且测量的标签或同位素标记与样本内该氨基酸类型的浓度、样本中每种氨基酸类型的氨基酸数目和样本的蛋白质浓度线性相关。
在一些实施例中,样本中的两种或更多种氨基酸类型各自用不同的同位素标记来标记,并且至少两种标记的氨基酸类型的每种同位素标记通过核磁共振(NMR)和质谱检测。
在一些实施例中,样本中的两种或更多种氨基酸类型各自用串联质量标签系统内的不同串联质量标签标记,并且至少两种标记的氨基酸类型中的每一种的串联质量标签通过质谱检测。在一些实施例中,使用TMTduplex、TMTsixplex、TMT10plex、TMT11plex或TMT16plex串联质量标签系统。在一些实施例中,串联质量标签内的蛋白质反应性基团对两种或更多种氨基酸类型中的每一种是特异的。
优选地,标记是发荧光、化学发光或生物发光的。在一些实施例中,测量标记的光谱特性。在一些实施例中,标记的光谱特性是在对标记进行照明或对标记进行化学反应时测量的。在对标记进行照明时,光可以被反射、透射、吸收或发射。可以测量标记的光的反射、透射、吸收或发射。优选地,标记是荧光的,并且响应于光的照射测量标记的光发射。在一些实施例中,一种荧光标记的氨基酸类型的激发光谱和发射光谱可与第二种荧光标记的氨基酸类型的激发光谱和发射光谱区分开。如果两种或多种氨基酸类型在一个单一级分中标记,则这是优选的。荧光标记为样本中每种标记的氨基酸类型提供了独特的荧光特征。
在一些实施例中,标记是荧光。样本中的两种或多种氨基酸类型各自用荧光标记,诸如荧光染料,并且确定至少两种标记的氨基酸类型中的每一种的荧光强度。在一些实施例中,使用荧光显微法检测至少两种标记的氨基酸类型中的每一种的荧光标记的荧光强度。在一些实施例中,使用荧光板读取器检测至少两种标记的氨基酸类型中的每一种的荧光标记的荧光强度。在一些实施例中,检测非荧光染料的荧光强度。优选地,在检测之前从未反应的染料中纯化非荧光染料。在一些实施例中,使用荧光显微法检测至少两种标记的氨基酸类型中的每一种的非荧光标记的荧光强度。在一些实施例中,使用荧光板读数器检测至少两种标记的氨基酸类型中的每一种的非荧光标记的荧光强度。
在一些实施例中,在约250nm至约400nm的激发波长和约370nm至约600nm的发射波长下测量氨基酸类型Y的荧光标记的荧光。优选地,在约270nm至约330nm的激发波长和约375nm至约500nm的发射波长下测量氨基酸类型Y的荧光。在一些实施例中,在用TCEP还原蛋白质内所含的任何二硫键,并且在缓冲液中用十二烷基硫酸钠(SDS)变性后,氨基酸类型Y的标记是TCE,并且在约270nm至约330nm的激发波长和约375nm至约500nm的发射波长下测量荧光。
在一些实施例中,在约250nm至约400nm的激发波长和约370nm至约600nm的发射波长下测量氨基酸类型W的荧光标记的荧光。优选地,在约270nm至约320nm或约350nm至约370nm的激发波长和约440nm至约550nm的发射波长下测量氨基酸类型W的荧光。在一些实施例中,在用TCEP还原蛋白质内所含的任何二硫键并且在缓冲液中用十二烷基硫酸钠(SDS)变性后,氨基酸类型W的荧光标记是TCE,并且在约250nm至约400nm的激发波长和约370nm至约600nm的发射波长下测量荧光。在一些实施例中,在用TCEP还原蛋白质内所含的任何二硫键并且在缓冲液中用十二烷基硫酸钠(SDS)变性后,氨基酸类型W的荧光标记是TCE,在约270nm至约320nm或约350nm至约370nm的激发波长和约440nm至约550nm的发射波长下测量荧光。
在一些实施例中,在约320nm至约400nm的激发波长和约415nm至约500nm的发射波长下测量氨基酸类型K的荧光。优选地,在约330nm至约390nm的激发波长和约415nm至约480nm的发射波长下测量氨基酸类型K的荧光。在一些实施例中,在标记反应开始后约2至约25秒测量氨基酸类型K的荧光。优选地,在标记反应开始后4秒内测量氨基酸类型K的荧光。在一些实施例中,在缓冲液中用OPA、β-巯基乙醇(BME)和SDS标记氨基酸类型K,并且在约320nm至约400nm的激发波长和约415nm至约500nm的发射波长下测量荧光。在一些实施例中,在缓冲液中用OPA、β-巯基乙醇(BME)和SDS标记氨基酸类型K,并且在约330nm至约390nm的激发波长和约415nm至约480nm的发射波长下测量荧光。在一些实施例中,在缓冲液中用OPA、β-巯基乙醇(BME)和SDS标记氨基酸类型K,并且在350nm的激发波长和460nm的发射波长下测量荧光。
在一些实施例中,在约330nm至约400nm的激发波长和约430nm至约550nm的发射波长下测量氨基酸类型C的荧光。优选地,在约340nm至约390nm的激发波长和约470nm至约530nm的发射波长下测量氨基酸C的荧光。这些激发和发射波长用于测量还原的半胱氨酸(C
优选地,对于被测量的每种氨基酸类型的荧光标记,激发波长与发射波长彼此分离约10nm至约20nm以避免任何串扰。这确保激发光不提供发射光的错误信号。优选地,对于每种氨基酸类型的荧光标记,激发波长与发射波长彼此分离约15nm至约20nm以避免任何串扰。
在一些实施例中,标记是荧光标记,并且两种或更多种氨基酸类型在相同条件下用相同荧光标记来标记(例如,标记是相同的,标记的浓度是相同的,用于催化反应的光的波长是相同的)。优选地,每种氨基酸类型的标记的检测与其它氨基酸类型解卷积,以使每种单个氨基酸类型的标记能够被检测。例如,用荧光标记TCE标记W和Y氨基酸类型。例如,用在5mM HEPES中用0.2M TCE、10mM TCEP和4%SDS标记W和Y氨基酸类型,并且用波长为280nm的UV光进行光催化,其中氨基酸类型W和氨基酸类型Y都吸收。因此,W和Y的荧光强度被解卷积,使得可以在样本中测量Y和W中每一个的荧光。在优选的实施例中,氨基酸类型W和Y彼此解卷积。在优选的实施例中,氨基酸类型丝氨酸和苏氨酸彼此解卷积。在优选的实施例中,氨基酸类型天冬酰胺和谷氨酰胺彼此解卷积。在优选的实施例中,氨基酸类型谷氨酸和天冬氨酸彼此解卷积。在优选的实施例中,氨基酸类型亮氨酸和异亮氨酸彼此解卷积。
在一些实施例中,解卷积在检测阶段实现。优选地,解卷积使用分离的激发波长。在其它实施例中,解卷积使用分离的发射波长。在其它实施例中,解卷积使用分离的激发和分离的发射波长。
分离的光激发波长激发新形成的染料并且测量染料的荧光。在该实施例中,通过使用激发和发射波长对来实现解卷积,其中仅一种氨基酸类型对荧光强度有贡献。分离的光激发波长靶向每种氨基酸类型。例如,含有用TCE标记的W和Y氨基酸的蛋白质具有两个激发峰。在约310nm处激发样本并且在约450至480nm处测量荧光导致检测来自W和Y氨基酸类型的荧光(波长对1)。然而,在约355nm处激发样本并且在约450至480nm处测量荧光导致测量仅来自W氨基酸类型的荧光强度(波长对2)。这提供了一种氨基酸类型的测量的标记,例如经由波长对2的W氨基酸类型。优选地,使用解卷积标准根据样本中测量的荧光强度确定样本中标记并且在检测两种氨基酸类型的激发-发射波长对处测量的其它氨基酸类型的测量的标记。
解卷积标准仅需要测量一次,并且结果可以存储或供应给用户。对于样本,每次测量在激发和发射波长对处解卷积的氨基酸类型时,不需要测量解卷积标准。不需要在每次测量样本时测量解卷积标准。
在一些实施例中,通过获得各种蛋白质的公开可获得的氨基酸序列并且去除在成熟蛋白质中生物裂解的序列部分来选择解卷积标准。确定这些蛋白质中两种或更多种对应氨基酸类型内的氨基酸数目。例如,如果样本中W和Y氨基酸类型被标记,则确定这些蛋白质序列内W和Y氨基酸的数目。
在一些实施例中,解卷积标准物包含仅一种氨基酸类型的氨基酸,其在样本中被标记并且在检测两种类型的氨基酸的波长对处被解卷积。例如,如果样本中氨基酸类型W和Y被标记,则解卷积标准含有W氨基酸,但不含有Y氨基酸。在另一实例中,解卷积标准含有Y氨基酸,但不含有W氨基酸。优选地,解卷积标准仅含有标记的氨基酸的类型,其样本的标记值(例如信号)基于激发和发射波长对是已知的。解卷积标准用于确定仅一种类型的氨基酸对在检测两种类型的氨基酸的波长对处测量的总标记(例如信号)的贡献。
在一些实施例中,解卷积标准用于解卷积色氨酸和酪氨酸;亮氨酸和异亮氨酸;天冬氨酸和谷氨酸;丝氨酸和苏氨酸;和/或天冬酰胺和谷氨酰胺的氨基酸类型。例如,对于色氨酸和酪氨酸;亮氨酸和异亮氨酸;天冬氨酸和谷氨酸;丝氨酸和苏氨酸;和/或天冬酰胺和谷氨酰胺氨基酸类型的解卷积呈现解卷积标准的选择。这些解卷积标准是通过鉴定人血浆蛋白质组内的蛋白质而发现的,对于该蛋白质,卷积的氨基酸类型的数目的乘积是零,并且卷积的氨基酸类型的数目的总和是非零的。在一些实施例中,对于色氨酸和酪氨酸氨基酸类型的解卷积,解卷积标准选自包含以下的组:α-突触核蛋白甲状旁腺激素、年龄相关的黄斑病易感性蛋白质2、10kDa热休克蛋白质线粒体、小的富含脯氨酸的蛋白质2F、精子鱼精蛋白P1、库尼茨(Kunitz)型蛋白酶抑制剂4、富酪蛋白、富组蛋白-3、弹性蛋白、β-防御素133、肿瘤抑制因子ARF、Complexin-2、B黑素瘤抗原5和/或硒蛋白W。在一些实施例中,对于亮氨酸和异亮氨酸氨基酸类型的解卷积,解卷积标准物选自包含以下的组:富含脯氨酸的蛋白质9、富含丝氨酸/精氨酸的剪接因子3、兜甲蛋白、金属硫蛋白-1M载脂蛋白C-III、β-防御素124和锌指蛋白575。在一些实施例中,对于天冬氨酸和谷氨酸氨基酸类型的解卷积,解卷积标准选自包含以下的组:Humanin样9、β-防御素136、β-防御素4A、推定的锌指蛋白726P1、T细胞受体δ多样性1、小的富含脯氨酸的蛋白质2A、小的膜内在蛋白38、T细胞受体β连接1至3、推定的未表征的蛋白质PRO0628、小的富含脯氨酸的蛋白质2D、T细胞受体β连接2至5、胰岛淀粉样多肽和/或推定的未表征的蛋白质URB1-AS1。在一些实施例中,对于丝氨酸和苏氨酸氨基酸类型的解卷积,解卷积标准选自包含以下的组:细胞色素c氧化酶装配因子1同系物、碱性唾液富含脯氨酸的蛋白质1、蛋白质BEX3、富组蛋白-1、β-防御素134、Adropin、地塞米松(Dexamethasone)诱导的蛋白质、眼质蛋白和/或蛋白质BEX5。在一些实施例中,对于天冬酰胺和谷氨酰胺氨基酸类型的解卷积,解卷积标准选自包含以下的组:甲状腺素运载蛋白、T细胞白血病/淋巴瘤蛋白质1A、睾丸发育相关蛋白质1、蛋白质WFDC11、泛素样蛋白质FUBI和/或线粒体输入受体亚基TOM7同系物。
解卷积的标记的氨基酸类型中,仅含有单独检测的氨基酸类型并且不含有未单独检测的氨基酸类型的解卷积标准经荧光标记,并且在检测两种氨基酸类型的激发和发射波长对(波长对1)处检测荧光。然后在仅检测到一种氨基酸类型的激发和发射波长对(波长对2)处测量来自相同荧光标记的解卷积标准的荧光。不需要知道解卷积标准的蛋白质浓度。优选地,在波长对1和波长对2处测量解卷积标准的相同溶液,因此在波长对1和波长对2下测量的溶液的相对和绝对蛋白质浓度是相同的。如果改变在波长对1和波长对2处测量的溶液的相对蛋白质浓度(例如,通过将相等体积的溶液添加到相等体积的缓冲液中将样本稀释2倍),则记录该稀释倍数,并且将解卷积标准已被稀释的波长对的测量信号乘以稀释倍数以获得未稀释溶液的测量信号。在该任选的稀释调整步骤之后,将波长对1处的标记的解卷积标准的测量信号除以波长对2处的标记的解卷积标准的测量信号,得到波长信号转换。然后,将仅检测到一种氨基酸类型的波长对2处的样本的标记的信号乘以波长信号转换,以揭示源自单独检测的氨基酸类型的波长对1处的信号。从波长对1的总信号中减去该信号,以揭示仅来自其它氨基酸类型的信号。以这种方式,来源于两种氨基酸类型的信号被分成两个信号,每个信号仅来源于一种氨基酸类型,使得信号的数目等于样本中标记和测量的氨基酸类型的数目。例如,荧光标记仅含有W氨基酸并且不含有任何Y氨基酸的解卷积标准,并且在激发和发射波长对处检测该荧光,在该波长对处检测到W和Y氨基酸类型(波长对1;激发:310nm,发射:450nM)。然后在激发和发射波长对处测量来自相同荧光标记的解卷积标准溶液的荧光,在该波长对处仅检测到W氨基酸类型(波长对2;激发:355nm,发射:450nM)。在波长对1和2处测量相同荧光标记的解卷积标准溶液,因此没有稀释。在波长对1处的标记的解卷积标准的测量信号除以在波长对2处的标记的解卷积标准的测量信号,得到波长信号转换。然后,将仅检测到W氨基酸类型的波长对2处的样本的标记的信号乘以波长信号转换,以揭示源自W氨基酸类型的波长对1处的信号。从波长对1的总信号中减去该信号,以揭示仅来自Y氨基酸类型的信号。
替代地,使用已知蛋白质浓度的两种解卷积标准在相同激发和发射波长对处检测的两种标记类型的氨基酸之间解卷积。在被解卷积的标记的氨基酸类型中,第一解卷积标准仅具有基于其中仅检测到一种氨基酸类型的激发-发射波长对(波长对2)的信号未知的氨基酸类型。第二解卷积标准具有信号已知的氨基酸类型和信号未知的氨基酸类型。在检测到两种氨基酸类型的激发-发射波长对(波长对1)处测量第一解卷积标准。在检测到两种氨基酸类型的激发-发射波长对(波长对1)处测量第二解卷积标准。第一解卷积标准中检测到的氨基酸类型的氨基酸浓度是已知的,因为该氨基酸类型的氨基酸数目是已知的并且第一解卷积标准的蛋白质浓度是已知的;这些相乘以揭示该氨基酸类型在第一解卷积标准中的氨基酸浓度。在波长对1处第一解卷积标准的测量的信号除以在波长对1处第一解卷积标准的该氨基酸类型的氨基酸浓度,以揭示第一解卷积标准中存在的被解卷积的氨基酸类型的每氨基酸浓度的信号。在第二解卷积标准中被解卷积的两种氨基酸类型的氨基酸浓度是已知的,因为在第二解卷积标准中两种氨基酸类型的数目是已知的,并且第二解卷积标准的蛋白质浓度是已知的。将第一解卷积标准中提供的氨基酸类型的氨基酸浓度乘以使用第一解卷积标准计算的该氨基酸类型的每氨基酸浓度的信号。这提供了第二解卷积标准内该氨基酸类型的信号。从在波长对1处测量的总信号中减去在波长对1处的第二解卷积标准内该氨基酸类型的信号,这揭示了在波长对1处的其它氨基酸类型的信号。这是相同的氨基酸类型,其信号分别在波长对2处检测。在波长对1处的第二解卷积标准的该氨基酸类型的测量信号除以在波长对2处的第二解卷积标准的该氨基酸类型的测量信号,得到波长信号转换。然后,将仅检测到一种氨基酸类型的波长对2处的样本的标记的信号乘以波长信号转换,以揭示源自单独检测的氨基酸类型的波长对1处的信号。从波长对1的总信号中减去该信号,以揭示仅来自其它氨基酸类型的信号。以这种方式,来源于两种氨基酸类型的信号被分成两个信号,每个信号仅来源于一种氨基酸类型,使得信号的数目等于样本中标记和测量的氨基酸类型的数目。例如,第一解卷积标准仅含有Y氨基酸而不含有任何W氨基酸。第一个解卷积标准具有已知的Y氨基酸浓度。第二个解卷积标准含有Y和W氨基酸。第二解卷积标准具有已知的Y和已知的W氨基酸浓度。荧光标记第一解卷积标准,并且在激发和发射波长对处检测荧光,在该波长对处检测到W和Y氨基酸类型(波长对1;激发:310nm,发射:450nM)。荧光标记第二解卷积标准,并且在激发和发射波长对处检测荧光,在该波长对处检测到W和Y氨基酸类型(波长对1;激发:310nm,发射:450nM)。第一解卷积标准在波长对1处的荧光强度除以第一解卷积标准的Y氨基酸类型的氨基酸浓度,以揭示每Y氨基酸浓度的荧光强度。每Y氨基酸浓度的荧光强度乘以第二解卷积标准的已知Y氨基酸浓度,以揭示在波长对1处来自第二解卷积标准的Y氨基酸类型的荧光强度。从第二解卷积标准在波长对1处测量的总荧光强度中减去这一点,以揭示在波长对1处w氨基酸类型的荧光强度。在波长对1处第二解卷积标准的W氨基酸类型的荧光强度除以在波长对2处第二解卷积标准的W氨基酸类型的荧光强度(波长对2;激发:355nm,发射:450nm)以揭示波长信号转换。将在波长对2处对样本测量的W氨基酸类型的荧光强度乘以波长信号转换以获得在波长对1处对W氨基酸类型测量的荧光强度。从在波长对1处对样本的W和Y氨基酸类型测量的荧光强度中减去在波长对1处对样本的W氨基酸类型测量的荧光强度,以揭示在波长对1处对样本的Y氨基酸类型测量的荧光强度。以这种方式,获得W和Y氨基酸类型的单独荧光强度。
然后在激发和发射波长对处测量来自相同荧光标记的解卷积标准溶液的荧光,在该波长对处仅检测到W氨基酸类型(波长对2;激发:355nm,发射:450nM)。在波长对1和2处测量相同荧光标记的解卷积标准溶液,因此没有稀释。在波长对1处的标记的解卷积标准的测量信号除以在波长对2处的标记的解卷积标准的测量信号,得到波长信号转换。然后,将仅检测到W氨基酸类型的波长对2处的样本的标记的信号乘以波长信号转换,以揭示源自W氨基酸类型的波长对1处的信号。从波长对1的总信号中减去该信号,以揭示仅来自Y氨基酸类型的信号。
替代地,荧光强度的信号可以在时间上解卷积。例如,一种标记反应的动力学可能比另一种标记反应的动力学快。在一些实施例中,监测信号,并且在一个标记反应已经完成并且另一个标记反应没有开始的时间点处进行测量。在一些实施例中,监测荧光强度,并且在一个标记反应已经完成并且另一个标记反应没有开始的时间点处进行测量。
在一些实施例中,测量的标记是背景校正的。在优选的实施例中,测量的标记是荧光强度,并且每种标记的氨基酸类型的荧光强度是背景校正的。从荧光强度中减去荧光背景以产生背景校正的荧光值。可以使用本领域已知的任何背景校正技术。在一些实施例中,为了计算背景荧光,将荧光染料溶液与相等体积的缓冲液而不是蛋白质组合。在一些实施例中,将荧光染料溶液与标记反应期间供应的含蛋白质溶液的体积相等体积的缓冲液组合。从染料和蛋白质溶液检测的荧光强度中减去从染料和缓冲溶液检测的荧光强度以提供背景校正的荧光特征。替代地,滴定曲线可以用于确定荧光的低浓度极限,其可被鉴定为背景。检测极限被鉴定为在该极限之上可检测的蛋白质的第一浓度。
样本中氨基酸类型的测量的标记与样本中该氨基酸类型的氨基酸浓度相关。在一些实施例中,样本中氨基酸类型的测量的标记与样本中该氨基酸类型的氨基酸浓度线性相关。在一些实施例中,样本中氨基酸类型的测量的标记与样本中该氨基酸类型的氨基酸浓度非线性相关。在一些实施例中,非线性关系的实例包括幂律、多项式方程或指数方程。在一些实施例中,样本中氨基酸类型的测量的标记用多项式方程与样本中该氨基酸类型的氨基酸浓度相关。
每种标记的氨基酸类型的测量的标记、氨基酸浓度或氨基酸数目提供了样本中该标记的氨基酸类型的特征。可以将样本中标记的氨基酸类型中的每一种的特征与参考中相同氨基酸类型的特征进行比较,以鉴定样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或量。
当在样本和用于校准曲线或标准的任何氨基酸或蛋白质中标记氨基酸类型的所有氨基酸时,测量的标记(例如标记的信号)揭示样本中该氨基酸类型的所有(例如100%)氨基酸的浓度和/或所有(例如100%)氨基酸的数目。当在样本和用于校准曲线或标准的任何氨基酸或蛋白质中标记相同比例(例如80%)的氨基酸类型的氨基酸时,测量的标记(例如标记的信号)揭示样本中该氨基酸类型的所有(例如100%)氨基酸的浓度和/或所有(例如100%)氨基酸的数目。这是因为当在所测量的任何蛋白质中标记相同比例的氨基酸时,该比例因子超出了测量的标记(例如标记的信号)与样本的浓度或氨基酸数目之间的转换。
测量每种标记的氨基酸类型的浓度
在一些实施例中,测量样本中每种标记的氨基酸类型的浓度。在一些实施例中,样本中每种标记的氨基酸类型的浓度根据氨基酸类型的测量的标记(例如,测量的标记的信号)计算。在一些实施例中,样本中氨基酸类型的浓度根据样本中该氨基酸类型的测量的荧光强度计算。在一些实施例中,样本中每种标记的氨基酸类型的浓度与测量的标记之间存在线性关系。在替代实施例中,样本中每种标记的氨基酸类型的浓度与测量的标记之间存在非线性关系。在一些实施例中,这种非线性关系的实例包括多项式关系、幂律关系或指数关系。在一些实施例中,样本中每种标记的氨基酸类型的浓度与测量的标记之间存在多项式关系。在一些实施例中,样本中每种标记的氨基酸类型的浓度与测量的标记之间存在幂律关系。在一些实施例中,样本中每种标记的氨基酸类型的浓度与测量的标记之间存在指数关系。在一些实施例中,当两种或更多种氨基酸类型用荧光染料标记时,样本中每种标记的氨基酸类型的浓度与测量的荧光强度之间存在线性关系。在一些实施例中,当两种或更多种氨基酸类型用荧光染料标记时,样本中每种标记的氨基酸类型的浓度与测量的荧光强度之间存在线性关系。荧光强度随着样本中该氨基酸类型的浓度的增加而增加。
在一些实施例中,使用校准曲线或标准根据样本中相同的两种或更多种氨基酸类型的测量的标记确定样本中两种或更多种标记的氨基酸类型中的每一种的氨基酸的浓度。校准曲线或标准是用于通过将未知样本与一组已知浓度的标准样本或一个标准样本进行比较来确定未知样本中的物质浓度的通用分析化学方法。当使用校准曲线时,绘制了氨基酸类型的已知氨基酸浓度的多于一种标准的标记值。数据与校准曲线拟合,并且校准曲线提供标记的氨基酸类型的氨基酸浓度与氨基酸类型的标记值之间的关系。当绘制已知氨基酸类型的氨基酸浓度的单一标准时,整个校准曲线无法获得,并且单一蛋白质标准的标记的氨基酸类型的氨基酸浓度和氨基酸类型的标记值提供标记的氨基酸类型的氨基酸浓度与氨基酸类型的标记值之间的关系。因为单一蛋白质标准可获得的信息较少,所以当标记值与氨基酸类型的氨基酸浓度之间的关系是线性的并且通过原点时,并且当氨基酸类型的标记值已被背景校正时,可使用该信息。
在一些实施例中,将标记的信号绘制为每种校准蛋白的每种氨基酸浓度的氨基酸浓度的函数,以提供每种氨基酸类型的校准图。在一些实施例中,以任意单位(AU)测量并且绘制标记的信号。每个校准图被拟合以提供校准曲线。在一些实施例中,校准曲线确定样本中每种标记的氨基酸类型的荧光强度或背景校正的荧光强度与氨基酸浓度之间的关系。在一些实施例中,以任意单位(AU)绘制荧光强度或背景校正的荧光强度。例如,校准曲线确定了对氨基酸类型色氨酸(W)测量的荧光强度与W的对应氨基酸浓度之间的关系。
在一些实施例中,拟合(线性)校准图以提供校准曲线是执行线性最小二乘回归。计算最佳拟合线的方程以校准氨基酸类型的标记的信号与氨基酸浓度之间的关系。在一些实施例中,这是线性方程。在一些实施例中,该线性拟合被约束穿过原点。
在一些实施例中,当使用线性回归计算最佳拟合线时,用于氨基酸类型n的最佳拟合线的方程为方程5:
标记值
其中标记值
当测量样本的氨基酸类型的信号时,通过拟合确定的校准可以用于将对样本的氨基酸类型测量的信号转变为样本的氨基酸类型的氨基酸浓度。在一些实施例中,来自方程5的拟合的输出用于使用方程6将以AU计的氨基酸类型n的标记的值转换为氨基酸类型n的氨基酸浓度:
其中A.A.浓度
在一些实施例中,当使用线性回归计算最佳拟合线时,并且用于氨基酸类型n的最佳拟合线的方程是方程7:
标记值
其中标记值
在一些实施例中,来自方程7的拟合的输出用于使用方程8将以AU计的氨基酸类型n的标记的值转换为氨基酸类型n的氨基酸浓度:
其中A.A.浓度
只要样本的标记的测量信号将转变为样本的标记的氨基酸浓度,就不需要进行该步骤。在一些实施例中,针对每种标记的氨基酸类型的校准曲线包括并且延伸超过针对每种氨基酸类型的标记反应的线性范围。在一些实施例中,用于计算校准曲线的数据含有氨基酸浓度的相等间隔,使得线性最小二乘回归是无偏的。在一些实施例中,用于计算校准曲线的数据被归一化。在一些实施例中,在拟合之前取氨基酸浓度和信号数据的对数,以避免如果考察宽氨基酸浓度范围则将拟合偏向于更高的氨基酸浓度。
替代地,通过将含有氨基酸或蛋白质的已知氨基酸浓度的标准溶液的标记的信号除以氨基酸或蛋白质的已知氨基酸浓度来确定校准因子。在一些实施例中,使用来自一种标准(校准蛋白质或氨基酸)的一种氨基酸浓度的数据确定每种氨基酸类型的校准因子。在该实施例中校准曲线是无法获得的,因为只有一个点用于校准,并且曲线需要至少两个点。每个标准具有被校准的氨基酸类型的已知氨基酸浓度,或被校准的氨基酸类型的已知蛋白质浓度和氨基酸数目,它们被相乘以提供被校准的氨基酸类型的氨基酸浓度。所有或恒定比例的被校准的氨基酸类型被标记,因此对于每种校准蛋白质测量的标记的信号与对于每种校准蛋白质被校准的氨基酸类型的氨基酸浓度成比例。被校准的氨基酸类型的氨基酸浓度除以对被校准的氨基酸类型测量的标记的信号,以提供每测量的标记的信号的氨基酸浓度。例如,对于10μM的氨基酸类型色氨酸(W)测量的标记的信号是100AU。因此,氨基酸类型色氨酸(W)的校准因子为10μM/100AU=0.1μM/AU。对于10μM的氨基酸类型赖氨酸(K)测量的信号是500AU。因此,氨基酸类型赖氨酸(K)的校准因子为10μM/500AU=0.02μM/AU。这对将在实验中标记和测量的氨基酸类型中的每一种进行。例如,如果在实验中标记和测量两种氨基酸类型,则有两种校准因子,并且如果在实验中标记和测量三种氨基酸类型,则有三种校准因子。
在一些实施例中,使用来自游离氨基酸的一个或多个氨基酸浓度的数据确定每种氨基酸类型的校准或校准因子。游离氨基酸不并入蛋白质链或肽内。在一些实施例中,使用游离氨基酸的多于一种氨基酸浓度。在一些实施例中,使用游离氨基酸的一种氨基酸浓度。
在一些实施例中,使用校准氨基酸校准一种或多种氨基酸类型,并且使用一种或多种校准蛋白的一种或多种蛋白质浓度校准一种或多种氨基酸类型。在一些实施例中,当确定标记的信号与每种氨基酸类型的氨基酸浓度之间的关系的数据被确定时,来自溶液中游离氨基酸的数据可以与来自氨基酸序列内并入的氨基酸的数据一起包括在内。
该步骤仅需执行一次,并且结果可以存储和/或供应给用户;只要样本的标记的测量信号将转变为样本的标记的氨基酸浓度,就不需要进行该步骤。
在一些实施例中,使用校准因子根据样本中相同的两种或更多种氨基酸类型的测量的荧光强度确定样本中两种或更多种标记的氨基酸类型中的每一种的氨基酸的浓度。标记和测量的每种类型的氨基酸具有不同的校准。标记和测量的每种类型的氨基酸具有不同的校准因子。校准因子在样本的测量的标记,通常以任意单位(AU)计,与样本中该氨基酸类型的氨基酸浓度之间转换。校准因子确定样本中每种标记的氨基酸类型的测量的标记与氨基酸浓度之间的关系。
这对将在实验中标记和测量的氨基酸类型中的每一种进行。例如,如果在实验中标记和测量两种氨基酸类型,则有两种校准因子,并且如果在实验中标记和测量三种氨基酸类型,则有三种校准因子。
为了鉴定和定量样本,用户仅需要标记和测量样本内两种或更多种氨基酸类型的标记。可以为几种检测设置提供任何氨基酸类型的校准函数或校准因子;例如,用于基于荧光的检测的校准因子可以根据仪器的激发波长、发射波长和增益或光电倍增管(PMT)设置来提供。
该校准因子或校准函数不依赖于氨基酸序列,并且通过在每种标记的氨基酸类型的已知和非零氨基酸浓度的一种或多种校准氨基酸或校准蛋白质的一种或多种氨基酸浓度下测量的标记来计算。在一些实施例中,一种或多种校准氨基酸或蛋白质的一种或多种氨基酸浓度在测量样本和任何任选的实验参考的相同条件(例如激发和发射波长对)下测量。在一些实施例中,不同的一种或多种校准氨基酸或校准蛋白质用于每种氨基酸类型。在一些实施例中,校准函数是非线性的。在优选的实施例中,校准函数是线性的,提供标量校准因子。如果使用一种或多种校准氨基酸或校准蛋白质的多于一种氨基酸浓度,则通过拟合描述该氨基酸类型的已知氨基酸浓度与该氨基酸类型的标记值(例如标记的测量信号)之间的关系的数据来计算每种氨基酸类型的校准因子。如果使用一种校准氨基酸或蛋白质的一种氨基酸浓度,则通过将氨基酸类型的测量的标记除以氨基酸类型的已知氨基酸浓度来计算每种氨基酸类型的校准因子,从而提供对于该氨基酸类型的已知氨基酸浓度,将测量的每种氨基酸类型的标记的标记值(例如信号)。
在一些实施例中,使用来自一种或多种校准蛋白质的几种氨基酸浓度的数据确定每种氨基酸类型的校准函数或校准因子。每种校准蛋白质具有被校准的氨基酸类型的已知氨基酸浓度,或被校准的氨基酸类型的已知蛋白质浓度和氨基酸数目,它们被相乘以提供被校准的氨基酸类型的氨基酸浓度。在一些实施例中,对于每种校准蛋白质,所有或相同比例的被校准的氨基酸类型被标记,因此对于每种校准蛋白质测量的标记的信号与对于每种校准蛋白质被校准的氨基酸类型的氨基酸浓度成比例。例如,如果待标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则样本中90%的色氨酸(W)氨基酸和用于校准的任何氨基酸或蛋白质被标记,并且样本中90%的赖氨酸(K)氨基酸和用于校准的任何氨基酸或蛋白质被标记。在一些实施例中,标记的氨基酸的比例对于每种氨基酸类型不需要是相同的比例。例如,如果待标记的两种或更多种氨基酸类型是色氨酸(W)和赖氨酸(K),则样本中90%的色氨酸(W)氨基酸和用于校准的任何氨基酸或蛋白质被标记,并且样本中80%的赖氨酸(K)氨基酸和用于校准的任何氨基酸或蛋白质被标记。在另一实例中,如果待标记的两种或更多种氨基酸类型是色氨酸(W)、赖氨酸(K)和酪氨酸(Y),则样本中90%的色氨酸(W)氨基酸和用于校准的任何氨基酸或蛋白质被标记,样本中85%的赖氨酸(K)氨基酸和用于校准的任何氨基酸或蛋白质被标记,并且样本中80%的酪氨酸(Y)氨基酸和用于校准的任何氨基酸或蛋白质被标记。
在一些实施例中,任何用实验方法测量的蛋白质(样本、任何标准诸如蛋白质或氨基酸,和任何实验参考蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组,或目的蛋白质组,或校准曲线)中的所有或相同比例的氨基酸是相同的。这确保了氨基酸类型内一定比例的氨基酸的标记被抵消并且在结果中没有观察到。当在样本和用于校准的任何氨基酸或蛋白质中标记氨基酸类型的相同比例(例如80%)的氨基酸时,标记的信号揭示样本中该氨基酸类型的所有(例如100%)氨基酸的浓度和/或所有(例如100%)氨基酸的数目。这是因为当相同比例的氨基酸被标记时,该比例因子超出了从标记的信号与样本或校准的氨基酸浓度或数目之间的转换。
测量每种标记的氨基酸类型的氨基酸数目
在一些实施例中,当样本的摩尔蛋白质浓度已知时,可以测量样本中每种标记的氨基酸类型的氨基酸数目。氨基酸类型的氨基酸数目等于该氨基酸类型的氨基酸浓度除以蛋白质浓度。氨基酸类型的氨基酸数目等同于氨基酸类型的氨基酸浓度随蛋白质浓度的变化。
根据样本中标记的氨基酸类型的测量的标记计算样本中标记的氨基酸类型的氨基酸数目。测量的标记提供了样本中该标记的氨基酸类型的氨基酸浓度。优选地,氨基酸类型用荧光染料标记,并且根据样本中标记的氨基酸类型的荧光强度计算标记的氨基酸类型的氨基酸数目。荧光强度提供了样本中该标记的氨基酸类型的氨基酸浓度。
在一些实施例中,样本的标记的氨基酸类型的氨基酸数目根据方程9计算:
测量的标记提供氨基酸浓度。一种或多种校准氨基酸或校准蛋白质的一种或多种氨基酸浓度用于使用校准曲线或标准将样本的测量的标记转换为样本中标记的氨基酸类型的摩尔氨基酸浓度。样本中标记的氨基酸类型的摩尔氨基酸浓度除以样本的总摩尔蛋白质浓度以提供样本的氨基酸类型的氨基酸数目。对样本中每种标记的氨基酸类型进行该计算。例如,如果样本中的氨基酸类型W、K和Y被标记,则对氨基酸类型W、K和Y中的每一种进行等式9。例如,通过将样本中W的摩尔氨基酸浓度除以样本的总摩尔蛋白质浓度来计算样本中W氨基酸的数目。通过将样本中K的摩尔氨基酸浓度除以样本的总摩尔蛋白质浓度来计算样本中K氨基酸的数目。通过将样本中Y的摩尔氨基酸浓度除以样本的总蛋白质浓度来计算样本中Y氨基酸的数目。
样本中每种标记的氨基酸类型的氨基酸数目为样本提供了独特特征。例如,标记样本中的三种氨基酸类型;W、K和C,其中C是C
在一些实施例中,样本的总摩尔蛋白质浓度是已知的,或使用本领域的标准技术确定。在一些实施例中,总摩尔蛋白质浓度是被动已知的。例如,例如经由A
在一些实施例中,总蛋白质浓度是主动已知的,即已经主动确定了以mg/mL计的蛋白质浓度。例如,质量蛋白质浓度已被称出或测量,因此样本中总蛋白质的质量浓度是已知的。例如,已称出0.05mg/mL蛋白质并且溶解于1mL缓冲液中,并且因此已知总质量蛋白质浓度为0.05mg/mL。作为另一实例,本领域已知的方法用于确定样本的质量蛋白质浓度。当已经确定总质量蛋白质浓度时,不可能计算样本的两种或更多种氨基酸类型中的每一种的氨基酸数目。如果总蛋白质浓度由质量提供,并且氨基酸浓度由质量提供,则方程9不允许计算样本中的氨基酸数目。代替计算样本中每蛋白质的氨基酸数目,将氨基酸质量浓度除以蛋白质质量浓度的结果将是由标记的氨基酸类型的氨基酸贡献的蛋白质的质量的相对分数。从该信息确定样本中两种或更多种氨基酸类型中的每一种的氨基酸数目需要知道确切的蛋白质分子量(MW),这取决于蛋白质序列,而由于样本的身份是未知的,所以无法获得样本的蛋白质序列。MW也不能根据蛋白质大小诸如样本的流体动力学半径(R
对于在方程9中计算样本的氨基酸数目,氨基酸浓度必须是摩尔氨基酸浓度而不是质量氨基酸浓度;这是该单位取消所需要的以揭示无单位的氨基酸数目。然而,发现当仅知道样本的总质量蛋白质浓度时仍可以使用本发明的方法,因为可以对目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组进行相关转变,根据定义,其蛋白质身份是已知的。
在一些实施例中,如果仅将蛋白质的N-末端或C-末端用荧光染料标记,则样本的摩尔蛋白质浓度是主动已知的。例如,蛋白质的N-末端经由与磷酸吡哆醛-5-(PLP)的仿生转氨反应进行位点特异性修饰,其将N-末端氧化成酮(除甘氨酸外的所有氨基酸类型)或醛(甘氨酸氨基酸类型),然后使其与携带烷氧基胺反应性基团的荧光标记物反应,形成稳定的共价肟键,如(
参考
在一些实施例中,将样本中两种氨基酸类型的测量的标记物(例如标记的信号)与含有一种或多种蛋白质浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液中相同的两种或更多种氨基酸类型的已知标记值(例如标记的信号,例如标记的荧光强度或质荷比的强度)的参考进行比较。在一些实施例中,将样本中两种或更多种氨基酸类型的氨基酸浓度与含有一种或多种浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液中相同的两种或更多种氨基酸类型的氨基酸浓度的参考进行比较。在一些实施例中,当参考是氨基酸浓度或已知标记值(例如标记的信号)时,参考是一组函数,其提供参考值作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度的函数。在一些实施例中,对于任何目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,参考提供了作为浓度的函数的样本测量值(例如氨基酸浓度,或每种标记的氨基酸类型的标记的信号,诸如荧光强度或信号与质量比强度)。在一些实施例中,这些函数是线性的,并且提供n维空间中的线(其中n是样本中被标记的氨基酸类型的数目)。例如,如果样本中的W和K氨基酸类型被标记,则参考是2维空间中的W和K的线。对样本测量的值(例如,n种氨基酸类型的氨基酸浓度,或n种氨基酸类型的标记的信号)总是提供n维空间中的点。当样本点在参考线上或在参考线的误差容限内时,可以检测目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在。每当检测到目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在时,还可以通过求解浓度的参考函数来确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度。在一些实施例中,使用参数方程组1、2、3和4或向量函数1、2、3或4来生成包含参考的函数。
在一些实施例中,将样本中两种或更多种标记的氨基酸类型的测量的标记与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的一个或多个已知标记值(例如标记的信号,例如标记的荧光强度、质量、振动模式或标记的放射性衰变,或标记的M-F-N-R区域)的参考进行比较。在一些实施例中,将样本中两种或更多种标记的氨基酸类型的氨基酸浓度与含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中相同的两种或更多种氨基酸类型的一种或多种氨基酸浓度的参考进行比较。在一些实施例中,将样本中两种或更多种标记的氨基酸类型的氨基酸数目与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中相同的两种或更多种氨基酸类型的数目的参考进行比较。
参考的单位必须与样本确定的单位相同。例如,将样本中氨基酸类型的氨基酸浓度与参考中相同氨基酸类型的氨基酸浓度进行比较。如果参考的单位不相同,则将参考的单位转换为样本的相同单位,或反之亦然。在一些实施例中,参考的单位被转换。在一些实施例中,样本的单位被转换。例如,样本中氨基酸类型的荧光强度不能与参考中相同氨基酸类型的氨基酸浓度进行比较,因为荧光强度和氨基酸浓度是不同的单位。相反,参考中氨基酸类型的氨基酸浓度可以使用参数方程组3转换为荧光强度。然后,将样本中氨基酸类型的荧光强度与参考中相同氨基酸类型的荧光强度进行比较。替代地,样本的单位可以转换为与参考相同的单位。例如,使用校准曲线或标准将样本中氨基酸类型的荧光强度转换为氨基酸类型的氨基酸浓度,并将样本中氨基酸类型的氨基酸浓度与参考中相同氨基酸类型的氨基酸浓度进行比较。如果样本的摩尔浓度是已知的,则样本中每种标记的氨基酸类型的氨基酸浓度可以用于使用本文所公开的方法计算样本中每种标记的氨基酸类型的氨基酸数目。将样本中标记的氨基酸类型的氨基酸数目与参考中相同氨基酸类型的数目进行比较。
在一些实施例中,如果样本的值(即两种或更多种氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目)与每种氨基酸类型的参考的值(即相同的两种或更多种氨基酸类型的已知标记值、氨基酸浓度和/或氨基酸数目)相同或在其误差容限内,则这指示目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组以特定的浓度和/或量存在于样本中。相反,在一些实施例中,样本的值(即两种或更多种氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目)与参考的值(即相同的两种或更多种氨基酸类型的已知标记值、氨基酸浓度和/或氨基酸数目)相比在误差容限之外的差异指示参考蛋白质不以任何浓度和/或量存在于样本中。
在一些实施例中,先前已经确定了参考。例如,先前已经确定了将两种或更多种氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份和/或浓度相关的信息。例如,先前已经确定了在含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的一种或多种浓度下的两种或更多种氨基酸类型的荧光强度,或在含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液中的一种或多种浓度下的两种或更多种氨基酸类型的氨基酸浓度,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列中的两种或更多种氨基酸类型的氨基酸数目。在一些实施例中,参考被存储在可以被复制、访问或传输的介质中。作为鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在和/或浓度的指示与样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目的信息,可以存储在可以被复制、访问或传输的介质中。参考名称(例如目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的名称)也可以存储在可以被复制、访问或传输的介质中。例如,在含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的一种或多种浓度下的两种或更多种氨基酸类型的荧光强度,或在含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的一种或多种浓度下的两种或更多种氨基酸类型的氨基酸浓度,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列中的两种或更多种氨基酸类型的氨基酸数目存储在可以被复制、访问或传输的介质中。在一些实施例中,参考可以源自或衍生自任何合适的数据源,包括例如数据库、基因组信息的公用数据库、已发布的数据,或为参考受试者的特定群体生成的数据,其可以各自具有共同的属性(例如,有机体的类型、疾病状态、病原体、组织类型、细胞类型、预后值、年龄或对药物的响应)。例如,在不同浓度下含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的氨基酸浓度或已知标记值(例如标记的信号,例如荧光强度),和/或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列中的每种氨基酸类型的氨基酸数目,和/或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的名称或标识符可以从文库或数据库中访问。在一些实施例中,该参考作为取决于共同浓度参数的参数方程组或向量函数提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度。在其它实施例中,该参考提供了与在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的氨基酸数目。
在一些实施例中,参考提供了与样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的氨基酸数目,并且使用Power BI;Microsoft分析程序、Microsoft Excel或Python确定氨基酸的数目。
在一些实施例中,含有一种或多种浓度的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液中的两种或更多种氨基酸类型的参考氨基酸浓度或已知标记值(例如信号)可以根据每种氨基酸类型的氨基酸数目或平均数和目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列中的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度来计算,并且可以包括使用参数方程组1、2、3或4或向量函数1、2、3或4的每种目的氨基酸类型的校准因子。
在一些实施例中,可以用关于在各种样本和/或亚蛋白质组和/或蛋白质组上观察到的氨基酸数目的频率分布的信息,诸如关于氨基酸数目的前导数位的频率分布的观察来增强参考。本福特定律、纽康-本福特(Newcomb-Benford)定律、第一数位定律或有效数位定律,提供了关于在自然产生的数据集(特别是具有高数量级的数据集)的不同集合中的有效数位(数字的前导数字)的预期分布的信息,并且可以用于检测模式或其缺乏,使得能够检测数字模式中的异常。该定律指出,前导有效数位的预期分布不是均匀分布的,而是遵循特定的对数分布。在下面的图4、5和6中,P(d)表示前导数位d在本福特定律下的预期概率,其中d在{1,2,3,4,5,6,7,8,9}中。
发现人血浆蛋白质组的平均氨基酸数的前导数位服从该定律(图4),然而病毒蛋白质组稍微偏离(图5),其中对于细菌蛋白质组的氨基酸的平均数的前导数位的分布观察到最大的偏离(图6)。对于目的病毒和细菌蛋白质组缺乏与本福特定律的一致性证实了任何目的病毒或细菌蛋白质组内两种或更多种氨基酸类型的氨基酸平均数、氨基酸浓度和/或标记值的特征的信息丰富性。相反,如果氨基酸数目的前导数位均匀分布,则对于{1,2,3,4,5,6,7,8,9}中的所有d,P(d)将是11.11%。附加地,已知符合或偏离本福特定律或均匀分布的特定氨基酸可以用于指定某些样本类型内发生某些特征的概率。
在一些实施例中,参考是计算的参考,其基于从目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的公开可获得的氨基酸序列获得的序列数据计算。替代地,如果目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列不是公开可获得的,则可以使用标准测序方法,例如埃德曼降解,确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的一个或多个氨基酸序列。在一些实施例中,该参考是实验参考。在一些实施例中,当确定实验参考时,以已知摩尔浓度提供目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,如本文所公开的标记两种或更多种氨基酸类型,测量标记并且测量的标记用于通过将氨基酸浓度(由测量的标记确定)除以已知蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组浓度确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种标记的氨基酸类型的氨基酸数目。替代地,在一些实施例中,当确定实验参考时,以已知浓度提供实验参考中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,该已知浓度诸如经由本领域已知的方法诸如Bradford测定确定的质量浓度,如本文所公开的标记两种或更多种氨基酸类型、测量标记并且测量的标记用于确定使用校准曲线或标准的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种标记的氨基酸类型的氨基酸浓度。替代地,在一些实施例中,当确定实验参考时,实验参考中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度是未知的和未确定的。这允许鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,并且确定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的相对浓度和/或量。提供样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组相对于另一样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度和/或量的相对浓度和/或量。
在所有实施例中,实验参考可以与样本的检验同时地确定、在样本的检验之前确定或在样本的检验之后确定。通常,如本领域技术人员所理解的,在与用于确定或表征样本的那些条件相当的条件下确定或表征该参考。
标记样本中氨基酸类型的所有或一定比例的氨基酸不影响计算的参考,因为所有氨基酸或相同比例的氨基酸被标记在样本和用于校准曲线或标准的一种或多种蛋白质中,该校准曲线或标准用于在(样本或参考的)荧光强度与氨基酸浓度之间转换。如果在样本中标记了氨基酸类型的所有氨基酸,则也应在实验参考中标记该氨基酸类型的所有氨基酸。如果在样本中标记了氨基酸类型的一定比例的氨基酸,则在实验参考中应标记该氨基酸类型的相同比例的氨基酸。这是因为当在用实验方法测量的任何蛋白质中标记相同比例的氨基酸时,该比例因子超出了标记值(例如标记的信号)与样本或参考的浓度或氨基酸数目之间的转换。
在一些实施例中,样本的身份和蛋白质数量(浓度和量)都是未知的。在一些实施例中,样本的身份和蛋白质数量(摩尔蛋白质浓度和摩尔蛋白质量)都是未知的。这是在诊断设置中遇到的最常见的情况,因为如果样本含有其身份未知的蛋白质,则在不知道该蛋白质的身份的情况下不能确定其摩尔蛋白质浓度,因为这需要知道从其氨基酸序列确定的蛋白质的精确分子量。当样本的身份和蛋白质数量(摩尔蛋白质浓度和摩尔蛋白质量)均未知时,为样本提供的测量值(两种或更多种标记的氨基酸类型的氨基酸浓度,或两种或更多种标记的氨基酸类型的测量的标记(例如标记的信号))取决于样本的未知蛋白质浓度。因此,目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考是样本未知浓度的函数。参数方程将一组数量描述为被称为参数的共同自变量的函数。这里,样本的未知摩尔浓度是被称为t的参数,其必须大于或等于0,因为负浓度在物理上是不可能的。
参考的一般形式是n维空间中的线,其中n是样本中标记和测量的氨基酸类型的数目。参考可以用参数方程来描述,该参数方程指定了坐标中的每一个(氨基酸浓度,或标记的信号)如何作为浓度t的函数而变化。一般参数方程为:
其中n
·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时,c
·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质组或亚蛋白质组时,c
·当样本的测量值以测量的标记(例如标记的信号)提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时为c
·当样本的测量值以测量的标记(例如标记的信号)提供并且参考线描述了目的蛋白质组或亚蛋白质组时为c
其中t是含有蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的浓度,该浓度是n个函数中的每一个中的共同自变量(或参数),该函数共同指定了n维中的每一个中的参考线,并且其中t是针对大于或等于
参考线可以替代地描述为n维空间中的向量(参见假设检验2的讨论,其中形式方程已经在发明内容部分中提供)。
如何在比较步骤中使用参考的方法,在此以目的蛋白质和为样本测量的氨基酸浓度为背景进行概述,在本发明的实施例中是保守的,并且具体细节在以下比较步骤部分提供。
在一些实施例中,该参考是目的蛋白质的两种或更多种氨基酸类型的氨基酸浓度。目的蛋白质p
标记和测量样本中两种或更多种氨基酸类型的氨基酸浓度。在样本中标记和测量氨基酸类型1,在样本中标记和测量氨基酸类型2,和任选地在样本中标记和测量氨基酸类型n。在参数方程1中,a
由于在样本中标记和测量了n类型的氨基酸,n种函数定义了该参考。例如,如果在样本中标记和测量了2种氨基酸类型,则含有t≥0的任何浓度t的目的蛋白质p
为了鉴定样本内目的蛋白质n
如果针对目的蛋白质p
这在比较步骤中进行。在一些实施例中,在比较步骤内,通过将针对样本测量的每个氨基酸浓度设置为等于由参考函数提供的对应氨基酸浓度,将针对目的蛋白质p
AAC
AAC
AAC
其中方程的数目等于样本中标记和测量的n种氨基酸类型的数目。如果n个方程包含可以对t的单一值求解的检验1,则目的蛋白质p
在一些实施例中,这可以被正式地陈述为如果,则完成检验1
这表明如果对于所有t≥0,存在t的值,使得对于所有k=1,2,...,n,AAC
例如,获得未知蛋白质身份和未知浓度的样本,样本中色氨酸(W)和赖氨酸(K)氨基酸类型被标记,并且如本文所公开的根据测量的标记确定样本中W和K氨基酸类型的氨基酸浓度。色氨酸(W)是氨基酸类型1,并且赖氨酸(K)是氨基酸类型2。样本中氨基酸色氨酸(W)的浓度S
在该实例中,目的蛋白质是细胞因子白介素-6(IL-6),其涉及不同的宿主响应SARS-CoV-2感染。在一些实施例中,氨基酸类型的氨基酸数目是目的蛋白质的氨基酸序列中该氨基酸类型的氨基酸出现的总数。IL-6中W氨基酸的数目是1,并且IL-6中K氨基酸的数目是14。W氨基酸类型是氨基酸类型1,并且K氨基酸类型是氨基酸类型2。因此,任何蛋白质浓度的IL-6的参考由参数方程1提供为:
n
根据检验1,通过将对样本测量的每个氨基酸浓度设置为等于为参考提供的对应氨基酸浓度函数来评价样本内目的蛋白质IL-6的任何蛋白质浓度的存在:
AAC
AAC
其中
0.5μM=t
7μM=14t
并且确定是否存在解
7μM=14(0.5μM)
∴t=0.5μM
这意味着当样本中针对氨基酸类型1测量的氨基酸浓度被设置为等于为参考的氨基酸类型1提供的氨基酸浓度函数,并且样本中针对氨基酸类型2测量的氨基酸浓度被设置为等于为参考的氨基酸类型2提供的氨基酸浓度函数时,存在方程的解。方程的解是t=0.5μM。因此,目的蛋白质IL-6被鉴定为以0.5μM的蛋白质浓度存在于样本中。
作为另一实例,获得未知蛋白质身份和未知蛋白质浓度的样本,样本中色氨酸(W)和赖氨酸(K)氨基酸类型被标记,并且如本文所描述的根据标记的信号测量样本中W和K氨基酸类型的氨基酸浓度。色氨酸(W)是氨基酸类型1,并且赖氨酸(K)是氨基酸类型2。样本中氨基酸色氨酸(W)的浓度S
在该实例中,目的蛋白质是细胞周期蛋白依赖性激酶5(CDK5),它是神经元发育所必需的激酶,被认为涉及神经疾病中的凋亡细胞死亡,其被分泌到血浆中。蛋白质序列内色氨酸(W)氨基酸的数目是3,并且蛋白质序列内赖氨酸(K)氨基酸的数目是23。然而,从公开的SwissProt数据库可知,1个赖氨酸氨基酸是翻译后修饰的(乙酰化的),并且因此不可用于与本实验选择的赖氨酸标记染料反应。在一些实施例中,目的蛋白质内氨基酸类型的氨基酸数目是该氨基酸类型在目的蛋白质的一个或多个氨基酸序列内出现的数目减去该氨基酸类型的翻译后修饰的数目,该翻译后修饰将阻止该氨基酸类型与标记反应。因此,目的蛋白质内赖氨酸(K)氨基酸类型的氨基酸数目是22,并且目的蛋白质内色氨酸(W)氨基酸数目是3。参数方程组1提供了样本的未知蛋白质浓度的目的蛋白质(CDK5)的以下参考:
n
根据检验1,通过将对样本中的每种标记的氨基酸类型测量的每个氨基酸浓度设置为等于为参考提供的对应氨基酸浓度函数来评价样本内目的蛋白质CDK5的任何蛋白质浓度的存在:
AAC
AAC
其中
2.4μM=3t
17.6μM=22t
并且确定是否存在解
2.4uM=3t
17.6μM=22(0.8μM)
∴t=0.8μM
这意味着当样本中针对氨基酸类型1测量的氨基酸浓度被设置为等于为参考的氨基酸类型1提供的氨基酸浓度函数,并且样本中针对氨基酸类型2测量的氨基酸浓度被设置为等于为参考的氨基酸类型2提供的氨基酸浓度函数时,存在方程的解。方程的解是t=0.8μM。因此,目的蛋白质CDK5被鉴定为以0.8μM的蛋白质浓度存在于样本中。
在一些实施例中,参数方程1提供了对于多种目的蛋白质的参考,并且任选地,将结果存储在参考数据库中。在一些实施例中,参数方程1中使用的每种氨基酸类型的氨基酸数目也存储在数据库中,并且参数方程1对该数据库进行操作以提供参考数据库。
例如,使用HPLC从人血浆中分离蛋白质,并且其摩尔蛋白质浓度是未知的。在样本中标记氨基酸类型C、K和W。在样本中,C氨基酸类型的所有(未修饰的+修饰的)氨基酸被标记,K氨基酸类型的未修饰的氨基酸(K氨基酸类型的氨基酸,其ε-氨基基团是伯胺,而不是仲胺)和W氨基酸类型的所有(未修饰的+修饰的)氨基酸被标记。如本文所描述的,根据标记的信号在样本中测量3.8μM C、15.9μM K和0.9μM W的氨基酸浓度。C氨基酸类型是AAC
构建人血浆内发现的5种目的蛋白质的参考。这些包括Affamin、踝蛋白-1、L-选择素、C-反应蛋白和光蛋白聚糖。在一些实施例中,参考是从参考数据库获得的。
在一些实施例中,每种目的蛋白质中C、K和W氨基酸类型的氨基酸数目通过去除每种目的蛋白质的氨基酸序列的部分诸如在成熟蛋白质中裂解的信号序列、确定每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的成熟蛋白质序列中C、K和W氨基酸的出现的数目,以及从计算的K氨基酸的出现中减去将导致赖氨酸ε-氨基基团从伯胺转换为仲胺的翻译后修饰(PTM)的数目,特别是乙酰化、烷基化和甘氨酰-赖氨酸异肽形成的数目来确定。
这提供了可以任选地从数据库获得的C、K和W氨基酸类型的以下氨基酸数目:
将参数方程1顺序地应用于数据库的每一行,以产生作为任何蛋白质浓度t的函数的每种目的蛋白质的参考:
每种目的蛋白质的参考p
在比较步骤中,将检验1应用于为每种目的蛋白质提供的每个参考。我们有:
AAC
AAC
AAC
对于目的蛋白质p
3.8μM=34t;15.9μM=49t;0.9μM=0t
因此,对于所有t≥0,不存在满足包含检验1的所有方程的t的单一值,因此任何蛋白质浓度的目的蛋白质n
对于目的蛋白质p
3.8μM=38t;15.9μM=159t;0.9μM=9t
对于所有t≥0,存在t,使得对于t的单一值求解包含检验1的所有方程,因此目的蛋白质p
对于目的蛋白质p:
3.8μM=22t;15.9μM=24t;0.9μM=11t
因此,对于所有t≥0,不存在满足包含检验1的所有方程的t的单一值,因此任何蛋白质浓度的目的蛋白质p
对于目的蛋白质p
3.8μM=2t;15.9μM=13t;0.9μM=6t
因此,对于所有t≥0,不存在满足包含检验1的所有方程的t的单一值,因此任何蛋白质浓度的目的蛋白质p
对于目的蛋白质p
3.8μM=6t;15.9μM=25t;0.9μM=1t
因此,对于所有t≥0,不存在满足包含检验1的所有方程的t的单一值,因此任何蛋白质浓度的目的蛋白质p
在一些实施例中,检验1概述的步骤作为具有计算机程序的算法自动化,如果(1=真,0=假)目的蛋白质p
在一些实施例中,如果对于样本测量的点,例如(AAC
检验2通过检验样本点是否在参考线的误差容限ε内来检验目的蛋白质p存在于样本内的假设。在一些实施例中,这是通过求样本点与参考线之间的最短距离,并且然后确定该距离是否小于误差容限来实现的。如果样本点与参考线之间的最短距离小于误差容限,则鉴定样本内目的蛋白质p
在一些实施例中,点与线之间的最短距离是点与线之间的垂直距离。除了例如通过参数方程1进行参数描述之外,参考线还可以用向量格式来描述,该向量格式允许计算参考线上的精确点(浓度),该精确点(浓度)经由点积产生该垂直距离。然后,使用距离公式,例如欧几里得距离公式来求样本点与该垂直距离点之间的距离,并且将该距离与误差容限ε进行比较,以确定目的蛋白质p
检验2的一般方法是:
1.令R为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p
2.求作为t的函数的向量格式的参考线R的方程,其是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p
3.求参考线R上的点P的一般方程
4.求点P在参考线R上的精确位置,称为Q,使得从S到P的向量垂直于R。这意味着求参考线R上的点Q,使得S和Q之间的向量得到垂线。这是通过求从S到P的向量与R的方向的点积(-),将其设置为等于0,并且求解t以提供t的值而实现的,当将该值代入R上的点P的一般方程中时,产生垂直向量。如果该参考包含在样本内,则对于t,该解是其浓度。
5.使用称为D的距离公式求Q和S之间的距离。
6.评价D是否小于误差容限ε。
7.如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p
8.如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p
例如,该参考线(R)的参数形式是
参考线的向量形式是R=<0,0,0>+t 参考线上的点(P)的一般方程是 P=<0+a 测量的样本点(S)具有坐标S=(AAC 从测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S= 为了使该向量垂直,该向量与参考线 a a a t(a t的解是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p 为了确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p P=<0+a Q是点,其是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p 使用距离公式求S与Q之间的距离D。 例如,点S与点Q之间的欧几里得距离公式为 因此,我们有 ε是例如由用户提供的错误阈值。 如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p 如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组p 存在于样本内 例如,使用HPLC从人血浆中分离蛋白质,并且其摩尔蛋白质浓度是未知的。在样本中标记氨基酸类型C、K和W。在样本中C氨基酸类型的所有(未修饰的+修饰的)氨基酸被标记,即C 在该实例中,已经为在人血浆中发现的5种目的蛋白质构建了参考数据库。这些包括Affamin、踝蛋白-1、L-选择素、C-反应蛋白和光蛋白聚糖,如上所描述的,使用参数方程1以产生每种目的蛋白质的任何蛋白质浓度t的参考。 每种目的蛋白质p 在比较步骤中,将检验1应用于为每种目的蛋白质提供的每个参考。我们有: AAC AAC AAC 对于目的蛋白质p 3.9μM=34t;16.1μM=49t;1.0μM=0t 目的蛋白质p 对于目的蛋白质p 3.9μM=38t;16.1μM=159t;1.0μM=9t 目的蛋白质p 对于目的蛋白质p 3.9μM=22t;16.1μtM=24t;1.0μM=11t 目的蛋白质p 对于目的蛋白质p 3.9μM=2t;16.1μM=13t;1.0μM=6t 目的蛋白质P 对于目的蛋白质p 3.9μM=6t;16.1μM=25t;1.0μM=1t 目的蛋白质p 因此,样本点不在任何目的蛋白质的参考线上。然而,如果存在单一浓度值,其中在样本中测量的两种或更多种氨基酸类型的氨基酸浓度小于或等于与在一种或多种目的蛋白质的样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的氨基酸浓度的误差容限,则鉴定样本内目的蛋白质的存在和/或浓度和/或量。在一些实施例中,误差容限由方程10提供: 其中ε是误差容限, 用户已提供用户输入公差值 在检验2中,评估所有目的蛋白质以确定每个目的蛋白质的测量的样本点与参考线之间的最短(垂直)距离是否落在误差容限内。 该方法具体针对目的蛋白质p 目的蛋白质p 在向量形式中,用于该参考线的方程是 R=<0,0,0>+t<38,159,9> P=(38t,159t,9t) 该样本点是S=(3.9,16.1,1) 从测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S=<38t-3.9,159t-16.1,9t-1> 为了使该向量垂直,该向量与参考线<38,159,9>的方向的点积(-)必须为0。因此,我们设置 <38t-3.9,159t-16.1,9t-1>-<38,159,9>=0 1444t-148.2+25281t-2559.9+81t-9=0 26806t=2717.1 t=0.1014 该t的解是目的蛋白质p 为了确定参考是否存在于样本内,在参考线上求点Q,其给出垂直距离。Q=P(t)。 P= Q=(38×0.1014,159×0.1014,9×0.1014)=(3.8532,16.1226,0.9126) S=(3.9,16.1,1) D=0.1017 ε=0.167 D≤ε 因此,目的蛋白质n 在一些实施例中,每种氨基酸类型(a 已经解释了,对于目的蛋白质的情况,如何通过参数方程提供参考,以及如何在比较步骤内使用参考,以基于对样本的两种或更多种标记的氨基酸类型测量的氨基酸浓度来评价样本内目的蛋白质的存在和/或浓度和/或量。在其它实施例中,以相同的方式在比较步骤中使用参考,并且这在“比较步骤”部分中进一步描述。这里,描述参考的剩余形式,其遵循相同的方法。 本发明的方法还用于确定样本内目的蛋白质组或亚蛋白质组的存在和/或浓度和/或量。目的蛋白质组或亚蛋白质组的参考也可以是n维空间中的线,其中n是实验中标记和测量的氨基酸类型的数目。在一些实施例中,通过确定目的蛋白质组或亚蛋白质组的(假设的)平均蛋白质序列的氨基酸数目,能够构建目的亚蛋白质组的蛋白质组的参考线,其具有每种氨基酸类型的氨基酸数目,该氨基酸数目是目的蛋白质组或亚蛋白质组内含有的所有蛋白质序列的氨基酸的加权平均数;在该代表性蛋白质序列中没有氨基酸顺序的概念,并且具有每个氨基酸类型的氨基酸数目是正整数的规范约束(例如a 其中w 如本文所公开的,在优选的实施例中,q 其中int 在方程11内,q是含有c蛋白质的目的蛋白质组或亚蛋白质组内的所有目的蛋白质i上的q 由此得出,就像方程11内int q=∑int 因此, 是如本文所公开的方程11中的 为了便于参考, 质谱摩尔强度分数MSIF 其中平均(∑int 附加地,在一些实施例中,期望将质谱强度值转换为目的蛋白质组或亚蛋白质组的质量浓度或量,而不是转换为目的蛋白质组或亚蛋白质组的摩尔浓度。在这种情况下,不是计算质谱摩尔强度分数,而是计算质谱质量强度分数。不计算方程11中 其中int是目的蛋白质组或亚蛋白质组内给定蛋白质的质谱强度,并且∑int是目的蛋白质组或亚蛋白质组内所有蛋白质的强度值的总和。与MSIF 其中平均(∑int)是人血浆蛋白质组的健康亚蛋白质组的所有患者样本的∑int值的平均值。 在一些实施例中,可能需要使用质谱数据库中可获得的质谱总摩尔强度值来计算存在的蛋白质的摩尔量或质量量。总强度值∑int与质量成比例,因此如果添加到质谱仪的总蛋白质浓度是已知的,例如因为它已经被标准化,则已知总强度值∑int的总和等于该总蛋白质的质量。因此,计算每种蛋白质的强度除以样本中所有蛋白质的强度的总和 在方程11中,q 替代地,每个氨基酸类型的氨基酸的加权平均数可以用方程12确定: 其中w 替代地,氨基酸类型1的氨基酸的加权平均数(w 每种氨基酸类型的氨基酸的加权平均数用于提供目的蛋白质组或亚蛋白质组的参考线。当提供给样本的测量值是如本文所公开的针对氨基酸类型1、氨基酸类型2和氨基酸类型n测量的氨基酸浓度时,参考线由参数方程组2描述: 其中p 在一些实施例中,不需要对样本进行计算;可以简单地测量样本的标记,并且所有的计算可以替代地在目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组上进行。样本测量值的直接输出是在本发明的方法中标记和测量的两种或更多种氨基酸类型中的每一种的测量的标记(例如标记的信号),并且可以构建参考以提供作为含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的溶液的浓度的函数的已知标记值(例如标记的已知信号)。校准曲线或标准在每种氨基酸类型的氨基酸浓度与每种氨基酸类型的已知标记值(例如标记的信号)之间转换。优选地,校准曲线是线性函数。通过测量已知氨基酸浓度的一种或多种标准溶液,例如由一种或多种校准氨基酸或校准蛋白质提供的,来确定校准曲线或标准。在一些实施例中,氨基酸浓度以浓度单位提供,诸如nM或μM,并且标记的信号以任意单位测量,诸如AU。 f 在一些实施例中,校准曲线是线性的,意味着氨基酸类型n的标记值与氨基酸类型n的氨基酸浓度线性相关,并且校准函数是校准因子。在替代实施例中,校准曲线是非线性的,并且校准函数不能被简化为校准因子,因为需要附加的转变(例如,校准函数可以描述幂律关系)。 例如,测量W氨基酸类型的已知氨基酸浓度的标记值,并且将其绘制为W氨基酸类型的氨基酸浓度的函数,并且将该线拟合到方程7(在“测量每种标记的氨基酸类型的浓度”部分内)。对于W氨基酸类型,这提供了: W信号(AU)=100(AU/μM)×w浓度(μM) 校准曲线是线性的,因此可以确定校准因子。W氨基酸类型的校准因子f 当在对样本进行的测量上执行校准时使用 当根据氨基酸类型1、氨基酸类型2和氨基酸类型n的测量的标记(例如标记的信号)提供样本的测量值时,目的参考线蛋白质、肽、寡肽、多肽或蛋白质复合物的参数方程由参数方程3给出: /> 其中p 如果需要,可以进行任选的处理步骤以确保用于创建参考或参考数据库的a 在一些实施例中,可以进行处理步骤以确保将样本的测量值与反映一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的函数形式的参考进行比较,或能够与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的多于一种形式进行比较。例如,可以进行处理步骤以确保将样本的测量值与反映已经历翻译后修饰,或已经历和未经历翻译后修饰的目的蛋白质的参考进行比较。 在一些实施例中,根据一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸序列确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中对应氨基酸类型的氨基酸数目。在一些实施例中,目的蛋白质、肽、寡肽或多肽中每种氨基酸类型的氨基酸数目是指氨基酸序列中氨基酸类型的出现频率,并且可以例如通过使用计算机程序求对应于目的蛋白质、肽、寡肽或多肽的公开可获得的FASTA序列内的氨基酸类型的特性的出现的数目来确定。不考虑翻译后修饰。例如,鸡蛋清溶菌酶是目的蛋白质。鸡蛋清溶菌酶的一个分子的氨基酸序列如下: 氨基酸类型K在蛋白质序列中出现6次(斜体)。每蛋白质分子的K数目是6,这在参数方程组1中是a 在一些实施例中,当计算用于创建参考或参考数据库的a 表4:氨基酸类型内氨基酸的PTM规则 /> 许多PTM消除了使用经典方法诸如埃德曼降解或现有技术方法诸如荧光测序对目的蛋白质进行测序的可能性。如果PTM消除了使用埃德曼降解和荧光测序对蛋白质进行测序的可能性,则“Y”出现在消除埃德曼列中。然而,含有用所有PTM修饰的蛋白质的样本能够用本发明的方法鉴定,特别是当使用本文所公开的规则计算氨基酸数目时。 在一些实施例中,可以为已经历某些翻译后修饰的目的蛋白质提供参考,并且可以为未经历某些翻译后修饰的目的蛋白质提供另一参考。在一些实施例中,当根据目的蛋白质的蛋白质序列确定每种氨基酸类型的氨基酸数目时,本发明的方法用于通过提供应用PTM规则的目的蛋白质的参考值,和不应用任何规则的附加参考值来检测目的蛋白质是否经历了特定PTM。因为PTM可以是蛋白质行为的动态调节剂,所以该结果可以指示疾病。 在一些实施例中,使用本发明的方法标记和测量未修饰的氨基酸类型。在这种情况下,在表4的规则列中存在-1(规则=-1),并且从目的蛋白质的蛋白质序列中的该氨基酸类型的氨基酸的出现的数目中减去1。例如,用OPA标记来标记赖氨酸(K)氨基酸类型并且测量未修饰的赖氨酸氨基酸,并且用F1-DIBO标记来标记丝氨酸并且测量未修饰的丝氨酸氨基酸。在一些实施例中,使用本发明的方法标记和测量氨基酸类型的修饰的和未修饰的氨基酸。在这种情况下,在表4的规则列中存在0(规则=0),并且当实验或理论数据示出观察到所指示的翻译后修饰时,没有值从目的蛋白质的蛋白质序列中的该氨基酸类型的氨基酸的出现的数目中减去。例如,用TCE标记来标记色氨酸(W)氨基酸类型并且测量未修饰的和修饰的色氨酸氨基酸,因为取代基与芳环的附接不显著影响芳环对自由基介导的TCE化学的亲核性。用TCE标记来标记酪氨酸(Y)氨基酸类型并且测量未修饰的和修饰的酪氨酸氨基酸,因为取代基与芳环的附接不显著影响芳环对自由基介导的TCE化学的亲核性。总结用于标记表4中报告的氨基酸类型内的所有(未修饰的+修饰的)或未修饰的氨基酸的这些规则,如果翻译后修饰不影响与选择用于标记氨基酸类型的标记(例如染料)反应的R基团部分,则标记未修饰的和修饰的氨基酸两者,并且如果翻译后修饰确实影响与选择用于标记氨基酸类型的染料反应的R基团部分,则仅标记未修饰的氨基酸。 在一些实施例中,氨基酸类型内的氨基酸可以在标记反应内在它们的修饰的和未修饰的形式之间转换。具体地,修饰的氨基酸可以转换为未修饰的氨基酸。这使得能够标记氨基酸类型内的氨基酸类型(未修饰的+修饰的)的所有氨基酸。这通过在与标记反应之前首先用化学反应将氨基酸类型的修饰的氨基酸转换为氨基酸类型的未修饰的氨基酸来实现。例如,修饰的氨基酸可以经由用三(2-羧乙基)膦(TCEP)还原转换为未修饰的半胱氨酸氨基酸。作为另一实例,糖基化的(修饰的)丝氨酸、苏氨酸或天冬酰胺氨基酸可以通过升高样本溶液的pH,例如升高至pH 10.5而转换为未修饰的丝氨酸、苏氨酸或天冬酰胺氨基酸,如在https://www.hindawi.com/journs/ijcc/2012/64092中所描述的。这将聚糖残基从氨基酸R基团上裂解下来,使得氨基酸不再被修饰。酶可以替代地用于将修饰的氨基酸转换为未修饰的氨基酸。如果标记方法在与标记反应之前并入转换步骤,使得该氨基酸类型的所有(未修饰的+修饰的)氨基酸可用于与标记反应,则当计算目的蛋白质的蛋白质序列中该氨基酸类型的氨基酸数目时不应用所讨论的PTM规则。例如,当标记半胱氨酸氨基酸类型的所有(未修饰的+修饰的)氨基酸时,参与二硫键的半胱氨酸氨基酸数目不从蛋白质序列中显示的C氨基酸数目中减去,因为修饰的半胱氨酸氨基酸已经经由还原转换为未修饰的氨基酸。 在一些实施例中,当TCEP不用作样本中半胱氨酸氨基酸类型的标记的一部分时,导致仅未修饰的、还原的半胱氨酸被标记(C 在一些实施例中,目的蛋白质组或亚蛋白质组的w 在一些实施例中,当确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的序列中每种氨基酸类型的氨基酸数目时,在确定该序列中每种氨基酸类型的氨基酸出现的数目和/或应用PTM规则之前,从该序列中去除生物裂解的信号序列或区域。这提供了成熟蛋白质中每种氨基酸类型的氨基酸数目。然而,如果一种或多种蛋白质、肽、寡肽、多肽、蛋白质复合物或蛋白质、肽、多肽、寡肽的混合物不是成熟蛋白质,则这不需要。 在一些实施例中,当存在目的蛋白质复合物时,将蛋白质复合物的每个亚基中每种氨基酸类型的氨基酸数目与蛋白质复合物的一个或多个剩余亚基中每种对应氨基酸类型的氨基酸数目相加。例如,为了计算26S蛋白酶体蛋白质复合物的W和K氨基酸类型的氨基酸数目,在26S蛋白酶体的所有亚基上对W氨基酸类型的氨基酸数目求和,并且在26S蛋白酶体的所有亚基上对K氨基酸类型的氨基酸数目求和。 在一些实施例中,确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物中每种氨基酸类型的氨基酸数目以提供a 在替代实施例中,作为该方法的一部分,确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的一个或多个序列。在一些实施例中,使用埃德曼蛋白质降解或质谱确定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的一个或多个序列。在所有实施例中,不必对样本进行测序。 在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的一个或多个蛋白质序列是已知的。在一些实施例中,一个或多个蛋白质序列是已知的并且提供在数据库中。在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的序列提供在数据库中。优选地,数据库是UniProt数据库、UniProt蛋白质组数据库、Swiss Prot数据库、基因库(GenBank)、Blast、NCBI蛋白质数据库或基因库序列读取存档(SRA)。 在一些实施例中,具体地目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或包含目的亚蛋白质组或蛋白质组的蛋白质的序列在数据库中显示和访问。该数据库是列出所有已知蛋白质序列的较大数据库,如UniProt数据库,的子集。可以使用它们的标识符,诸如它们的UniProt KB标识符,和它们的序列信息下载,例如以FASTA格式,从公开可获得的数据库中检索蛋白质序列。每个序列的名称或标识符也可以在这个较小的数据库中存储和访问,或者在具有与蛋白质序列数据库相同索引的对应数据库中存储和访问。这确保,例如,如果用户发现样本内存在第10种目的蛋白质,因为参考数据库(例如参考数据库的第10行)内的第10种目的蛋白质满足检验2,则用户可以通过访问含有每种目的蛋白质的名称和/或标识符和/或完整蛋白质序列的对应数据库的第10个条目(例如行)来方便地访问第10种目的蛋白质的名称和/或标识符和/或完整蛋白质序列(参见本文提供的样本表)。在一些实施例中,如果已经进行任选的预处理步骤以例如组合(例如卷起)将反映在参考数据库中的蛋白质复合物的亚基,则更新蛋白质序列名称和/或标识符和/或完整蛋白质序列的数据库。 在一些实施例中,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的a 例如,数据库含有人血浆蛋白质组内所有蛋白质的C、K和W氨基酸类型的氨基酸数目。例如经由蛋白质图谱、肽图谱或Proteome Xchange数据库访问人血浆蛋白质组内的蛋白质,该数据库提供公开可获得的蛋白质鉴定和定量数据的资源库(https://www.nature.com/articles/nbt.2839、http://proteomecentral.proteomexchange.org/cgi/GetDataset)。提供并且可公开获得的标识符,例如UniProt KB标识符,用于检索每个标识符的蛋白质序列。一旦检索蛋白质序列,就丢弃成熟蛋白质中不存在的信号序列,并且将蛋白质复合物中亚基的氨基酸序列组合成一个条目。在一些实施例中,C、K和W氨基酸类型的氨基酸数目通过在应用表4中提供的规则后确定处理的蛋白质序列内C、K和W氨基酸类型的出现的数目来计算,以避免计算将不与标记反应的氨基酸类型的氨基酸,因为它们以使得它们不与标记反应的方式翻译后修饰。例如,如果指示赖氨酸氨基酸被翻译后修饰以与谷氨酰胺形成异肽键,并且另一赖氨酸氨基酸被乙酰化,则从该蛋白质的蛋白质序列内K氨基酸类型的出现总数中减去2。优选地,该步骤用计算机程序自动化,其根据表4中列出的逻辑规则处理蛋白质序列。如果在标记反应之前或期间将修饰的氨基酸类型转换为未修饰的氨基酸类型(如果需要标记氨基酸类型的未修饰的加修饰的氨基酸),则可以推翻从氨基酸类型的氨基酸数目中减去1的规则。例如,如果修饰的和未修饰的半胱氨酸氨基酸类型都被标记,TCEP用于还原样本中含有的二硫化物键合的半胱氨酸,因此忽略用于二硫化物键合的半胱氨酸的逻辑规则,并且不从蛋白质序列内C氨基酸类型的出现的数目中减去任何值。通常,蛋白质序列内未修饰的和修饰的氨基酸的出现数目等于蛋白质序列内C氨基酸类型的所有出现的数目,因为除二硫键形成以外的半胱氨酸氨基酸的翻译后修饰是罕见的。 作为另一实例,对于C、K和W氨基酸类型,应用这些步骤产生以下氨基酸数目,其可以显示在数据库中: 在该实例中,用户将测量样本中C、W和的氨基酸浓度。为了创建参考数据库,将参数方程1顺序地应用于数据库的每一行以产生作为任何蛋白质浓度t的函数的每种目的蛋白质的参考: 每种目的蛋白质p 在其它实施例中,如果用户将测量C、K和W氨基酸类型的标记的值,则将每种氨基酸类型的校准因子fn并入参考数据库中。 例如,C氨基酸类型是氨基酸类型1,并且根据线性校准曲线确定的C氨基酸类型的校准因子f f K氨基酸类型是氨基酸类型2,并且根据线性校准曲线确定的K氨基酸类型的校准因子f f W氨基酸类型是氨基酸类型3,并且根据线性校准曲线确定的W氨基酸类型的校准因子f f 为了创建参考数据库,将参数方程3顺序地应用于数据库的每一行以产生作为蛋白质浓度t的函数的每种目的蛋白质的参考: 当根据氨基酸类型1、氨基酸类型2和氨基酸类型n的测量的标记(例如标记的信号)提供样本的测量时,目的蛋白质组或亚蛋白质组的参考线的参数方程由参数方程4给出: 其中n 混合物 当本发明的方法用于检测蛋白质、蛋白质组、肽、寡肽、多肽、蛋白质复合物或亚蛋白质组的混合物时,使用本部分中概述的方法提供单一蛋白质、蛋白质组、肽、寡肽、多肽、蛋白质复合物或亚蛋白质组的参考。如比较步骤部分所概述的,检测混合物是因为在样本中检测到多种纯蛋白质、蛋白质组、肽、寡肽、多肽、蛋白质复合物或亚蛋白质组的存在,并且本发明的方法用于提供混合物内每种组分的比例和浓度。 特殊情况 这些实施例有两种特殊情况,以参数方程组的形式描述; 在特殊情况1中,样本的摩尔浓度是已知的,并且这是常数SC。因此,如果样本内存在目的蛋白质n 一般的参数方程组是 在特殊情况1中,一般的参数方程组简化为n维空间中的点。 p 这不再是参数方程,因为它不是共同参数(自变量)的函数,因为变量t被替换为常数SC。在特殊情况1中,对于目的蛋白质p p 这描述了n维空间中的点,其中n是样本中标记和测量的氨基酸类型的数目。 在特殊情况1中,如果存在目的蛋白质p S S S 其中S 在特殊情况1中,如果完成检验1,则目的蛋白质p 在特殊情况1中,如果存在目的蛋白质p 使用距离公式诸如欧几里得距离计算样本点(S 仅在特殊情况1中,可计算样本中每个标记和测量的氨基酸类型内的氨基酸数目。这是可获得的,因为样本的每种氨基酸类型的氨基酸数目等于样本的该氨基酸类型的氨基酸浓度除以样本的已知摩尔浓度。样本中氨基酸类型1的氨基酸数目是N 当在特殊情况1内计算样本中每种氨基酸类型的氨基酸数目时,完成检验1,条件是: N N N 当样本点恰好等于参考点时,完成检验1。 当在特殊情况1内计算样本中每种氨基酸类型的氨基酸数目时,当目的蛋白质、肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中每种氨基酸类型的氨基酸数目小于或等于样本中每种氨基酸类型的氨基酸数目的误差容限ε时,完成检验2。这通过确定样本点与参考点之间的距离D,例如欧几里得距离来评价。 该式为: 在特殊情况2中,样本内目的蛋白质、肽、寡肽、多肽、亚蛋白质组或蛋白质组n 一般参数方程保持 然而,未使用检验1评价目的蛋白质p S S S 因为已知样本内存在目的蛋白质、肽、寡肽、多肽、亚蛋白质组或蛋白质组n 在一些实施例中,如果已对样本执行分离步骤,则应对理论参考进行相同的分离步骤。作为实例,对样本的分离步骤可以包括通过并入离心分子量筛截过滤器的离心过滤装置过滤,其中分子量小于筛截过滤器分子量的蛋白质穿过过滤器进入滤液中,并且分子量大于筛截过滤器的蛋白质不穿过过滤器,并且因此不存在于滤液中,诸如Amicon 50kDa离心过滤单元。如本文所公开的,该步骤可以用于从样本中消耗高丰度高分子量蛋白质。如果对样本执行该步骤,则分子量大于50kDa的蛋白质也应从用于计算理论参考的数据库中去除。这模拟了过滤步骤后样本内不再存在分子量大于50kDa的蛋白质的情况。过滤步骤减少了样本内平均蛋白质序列中每种氨基酸类型的氨基酸数目。样本内平均蛋白质序列的分子量降低,因为分子量例如大于50kDa的蛋白质不再包括在样本中,并且分子量和蛋白质长度线性相关。 比较 将样本的每种标记的氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的已知标记值、氨基酸浓度和/或数目进行比较。优选地,一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的已知标记值、氨基酸浓度和/或数目是参考。在一些实施例中,如果样本的每种标记的氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的已知标记值和/或作为蛋白质浓度的函数的氨基酸浓度和/或数目相同,或在误差容限内,然后对样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量进行阳性鉴定。 如果样本的每种标记的氨基酸类型的测量的标记、氨基酸浓度和/或氨基酸数目在一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的已知标记值和/或作为蛋白质浓度的函数的氨基酸浓度和/或数目的误差容限之外,则在样本中未鉴定出一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的存在。如果样本中不存在目的蛋白质,则其在样本中不能具有浓度。在一些实施例中,如果样本中目的蛋白质的存在是已知的,则通过求解蛋白质浓度(t)的参考函数来确定蛋白质浓度。在一些实施例中,通过将样本体积乘以样本中鉴定的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度来鉴定目的蛋白质的量。 如参考部分所描述的,每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组可以独特地由参考描述。每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考提供了每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的值(每种氨基酸类型的测量的标记例如标记的信号和/或每种氨基酸类型的氨基酸浓度)作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的浓度的函数或每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的每种氨基酸类型的氨基酸数目。每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考可以是一组函数,其预测每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的值(每种氨基酸类型的测量的标记,例如标记的信号、每种氨基酸类型的氨基酸浓度)作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的浓度的函数。替代地,如果样本的摩尔蛋白质浓度是已知的,则参考是每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的每种对应氨基酸类型的氨基酸数目,或在每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的样本浓度下每种对应氨基酸类型的氨基酸浓度或标记的值。将样本的测量值(每种氨基酸类型的测量的标记,例如标记的信号、每种氨基酸类型的氨基酸浓度,和/或每种氨基酸类型的氨基酸数目)与由参考提供的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的值进行比较。在一些实施例中,如果样本的测量值与由参考提供的值相同或在参考提供的值的误差容限内,则在样本中鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在和/或浓度和/或量。在一些实施例中,如果样本的测量值与由参考提供的值相同或在参考提供的值的误差容限内,则在样本中鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在。在一些实施例中,如果样本的测量值在由参考提供的值的误差容限之外,则在样本中未鉴定出一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在。 在一些实施例中,将样本的两种或更多种氨基酸类型中的每一种的测量的标记(例如,氨基酸类型W和K的荧光强度)与由目的蛋白质的相同氨基酸类型的参考提供的已知标记值(例如,氨基酸类型W和K的荧光强度)进行比较。如果样本的测量的标记(例如氨基酸类型W和K的荧光强度)与由作为蛋白质浓度的函数的目的蛋白质的参考提供的已知标记值(例如氨基酸类型W和K的荧光强度)相同或在其误差容限内,则对样本中目的蛋白质的存在和/或浓度和/或量进行阳性鉴定。如果样本的测量的标记(例如氨基酸类型W和K的荧光强度)与由作为蛋白质浓度的函数的目的蛋白质的参考提供的已知标记值(例如氨基酸类型W和K的荧光强度)不相同,或在其误差容限之外,则该目的蛋白质的存在被鉴定为不存在于样本中。因为在样本中未鉴定出目的蛋白质,所以在样本内没有目的蛋白质的浓度或量。 在一些实施例中,将样本的两种或更多种氨基酸类型中的每一种的氨基酸浓度(例如,氨基酸类型W和K的氨基酸浓度)与由作为蛋白质浓度的函数的目的蛋白质的参考提供的相同氨基酸类型的氨基酸浓度(例如,氨基酸类型W和K的氨基酸浓度)进行比较。如果样本的氨基酸浓度(例如氨基酸类型W和K的氨基酸浓度)与由作为蛋白质浓度的函数的目的蛋白质的参考提供的氨基酸浓度(例如氨基酸类型W和K的氨基酸浓度)相同或在其误差容限内,则对样本中目的蛋白质的存在和/或浓度和/或量进行阳性鉴定。如果样本的氨基酸浓度(例如氨基酸类型W和K的荧光强度)与由作为蛋白质浓度的函数的目的蛋白质的参考提供的氨基酸浓度(例如氨基酸类型W和K的荧光强度)不相同,或在其误差容限之外,则该目的蛋白质被鉴定为不存在于样本中。因为在样本中未鉴定出目的蛋白质,所以在样本内没有目的蛋白质的浓度或量。 在一些实施例中,将样本的两种或更多种氨基酸类型中的每一种的氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数目)与目的蛋白质的相同氨基酸类型的参考氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数目)进行比较。如果样本的每种氨基酸类型的氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数量)与目的蛋白质的每种氨基酸类型的参考氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数目)相同,或在其误差容限内,则对样本中目的蛋白质的存在进行阳性鉴定。如果样本的每种氨基酸类型的氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数量)在目的蛋白质的参考氨基酸数目(例如,氨基酸类型W和K的每蛋白质的氨基酸数目)的误差容限之外,则该目的蛋白质被鉴定为不存在于样本中。因为在样本中未鉴定出目的蛋白质,所以在样本内没有目的蛋白质的浓度或量。当样本的摩尔蛋白质浓度是已知的并且属于特殊情况1时,测量样本中每种氨基酸类型的氨基酸数目是唯一可用,所以该实施例特有的比较步骤将在此讨论。 参考的一般形式是n维空间中的线,其中n是样本中标记和测量的氨基酸类型的数目。参考可以用参数方程组来描述,该参数方程组指定了坐标中的每一个(氨基酸浓度,或测量的标记,例如标记的信号)如何作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的浓度t的函数而变化。在参考部分中提供并且解释了特定参数方程。一般参数方程为: 其中p ·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时,c ·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质组或亚蛋白质组时,c ·当样本的测量值以测量的标记,例如标记的信号,提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时为c ·当样本的测量值以测量的标记,例如标记的信号,提供并且参考线描述了目的蛋白质组或亚蛋白质组时为c 其中t是含有参考的溶液的蛋白质浓度,该蛋白质浓度是n个函数中的每一个中的共同自变量(或参数),该函数共同指定了n维中的每一个中的参考线,并且其中t是针对大于或等于 参考线可以替代地描述为n维空间中的向量,这将在后面对假设检验2的讨论内进行解释。 在本发明的方法中标记和测量了n种氨基酸类型(n≥2)。样本的测量值总是提供n维空间中的点,因为对于n维中的每一个提供了一个值。该点具有坐标(S 上述解释的提供作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的蛋白质浓度的函数的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 参数方程组1、2、3或4用于为本发明的特定实施例生成每个参考线,如参考部分中所解释的。 在比较步骤内,将样本点的测量值与该参考进行比较。在一些实施例中,如果样本的测量值等于由参考线提供的值,则鉴定样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在和/或浓度和/或量。这意味着样本点在参考线上。如果样本点在参考线上,则样本中存在目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的假设为真。为了评价该假设,执行检验1。 在一些实施例中,每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考是一组函数,该组函数提供了样本中标记和测量的每种氨基酸类型的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的值作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的蛋白质浓度的函数。检验1将样本的测量值(S 可以非正式地或正式地执行比较。非正式地,通常可以通过对结果作图或者通过将对样本测量的值与参考函数进行比较,通过眼睛来判断样本点是否在参考线上。例如,标记和测量样本中的氨基酸类型W和K。W氨基酸类型是氨基酸类型1,并且K氨基酸类型是氨基酸类型2。目的蛋白质溶菌酶(LYZ)的参考是: 针对样本测量的60μM W和60μM K的氨基酸浓度。当将针对样本测量的氨基酸浓度与参考进行比较时,显然样本点在参考线上,并且该参考具有10uM的蛋白质浓度t(图X)。 正式地,检验1涉及将针对样本测量的每个值(S S S S 其中方程的数目等于样本中标记和测量的n种氨基酸类型的数目。如果n个方程包含可以对t的单一值求解的检验1,则每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 在一些实施例中,这可以被正式地陈述为如果,则完成检验1 这表明如果对于所有t≥0,存在t的值,使得对于所有k=1,2,...,n,S 继续该实例,针对该样本测量的每个值被设置为等于包含该参考的对应函数,并且确定是否存在t的单一解。 60μM=6t 60μM=6t 如果存在t的值,使得对于所有k=1,2,...,n,s 在一些实施例中,如果样本的测量值在由目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考提供的值的误差容限ε内,则还可以鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在和/或浓度和/或量。这反映了实验测量既不具有无限准确度也不具有无限精确度的事实,因此当样本内含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 检验2考虑了实验误差,并且通过检验样本点是否在参考线的误差容限ε内来检验目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 点与线之间的最短距离是点与线之间的垂直距离。除了例如通过一般参数方程进行参数描述之外,参考线还可以用向量格式来描述,该向量格式允许计算参考线上的精确点(蛋白质浓度),该精确点(蛋白质浓度)经由点积产生该垂直距离。然后,使用距离公式,例如欧几里得距离公式来求样本点与该垂直距离点之间的距离,并且将该距离与误差容限ε进行比较,以确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 线与点之间的最短距离总是线与点之间的垂直距离。这是因为点与线之间除了90度以外的任何其它角度将形成斜边,其长度将总是大于垂直距离。 最短距离,即垂直距离,通过求参考线的方向与样本点和参考线上的任何点之间的向量的点积,将点积设置为等于0,并且求解参考线的浓度来实现的,该浓度提供了样本点与参考线之间的垂直线。点积是表示两个向量A和B之间的角度关系的标量值,即A·B=|A|*|B|*coSθ其中值|A|和|B|分别表示向量A和B的长度,并且θ是两个向量之间的角度。如果A和B垂直(即彼此成90度),则点积将为零,因为cos 90°将为零。计算样本点与参考线之间的距离,并且如果该距离小于或等于误差容限,则将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组鉴定为以提供垂直(最小)距离的参考线上的蛋白质浓度存在。 在一些实施例中,在本发明的方法中使用其它距离度量,例如城市街区(cityblock)、切比雪夫(chebychev)、相关量、余弦、汉明(hamming)、雅科比(jaccard)、马氏(mahalanobis)、闵可夫斯基(minkowski)、seuclidean或斯皮尔曼(spearman)。 检验2的一般方法是: 9.令R为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 10.在向量格式中求参考线R的方程 11.求参考线R上的点P的一般方程 12.求点P在参考线R上的精确位置,称为Q,使得从S到P的向量垂直于R。这意味着求参考线R上的点Q,使得S和Q之间的向量得到垂线。这是通过求从S到P的向量与R的方向的点积(·),将其设置为等于0,并且求解t以提供t的值而实现的,当将该值代入R上的点P的一般方程中时,产生垂直向量。如果样本内含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 13.使用称为D的距离公式求Q和S之间的距离。 14.评价D是否小于误差容限ε。 15.如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 16.如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 为了说明如何执行检验2,该方法应用于在本部分中讨论的一般参数方程。 例如,目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 参考线的向量形式是R=<0,0,...,0〉+t 参考线上的点(P)的一般方程是 P=<0+c 我们测量的样本点(S)具有坐标S=(S 从我们测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S= 为了使该向量垂直,该向量与参考线 c c c t(c 该t的解是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 为了确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p P=<0+c Q是点,它是对应于t的解的参考的值的集合。S也是点。 使用距离公式求S与Q之间的距离D。 例如,点S与点Q之间的欧几里得距离公式为 因此,我们有 ε是例如由用户提供的误差容限。 如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 并且检验2为阳性。如前所述,通过将目的蛋白质蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 回到LYZ实例,标记和测量样本中的氨基酸类型W和K。W氨基酸类型是氨基酸类型1,并且K氨基酸类型是氨基酸类型2。代替测量样本的60μM W和60μM K的氨基酸浓度,测量样本的56μM W和62μM K的氨基酸浓度。用户供应了距离阈值为6uM,对应于针对其样本测量的值的大约10%,以说明实验误差。在一些实施例中,误差容限的单位(即氨基酸浓度,例如μM,或标记的值,例如A.U,或氨基酸数目,例如标量)是与针对样本测量的值相同的单位。 目的蛋白质溶菌酶(LYZ)的参考是由参数方程组1提供的: 如所描述的,当测量样本的氨基酸浓度,并且参考描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时,c 参考线的向量形式是R=<0,0,...,0〉+t 对于目的蛋白质LYZ,这变为R=<0,0>+t<6,6> 参考线上的点(P)的一般方程是 P=<0+6t,0+6t> 测量的样本点(S)具有坐标S=(56,62) 从测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S=<6t-56,6t-62〉 为了使该向量垂直,该向量与参考线的方向(6,6)的点积(-)必须为0。因此,我们设置 <6t-56,6t-62〉-<6,6〉=0 36t-336+36t-372=0 72t=708 该t的解是目的蛋白质LYZ的蛋白质浓度,其中样本与参考线之间的距离最短。因此,如果目的蛋白质LYZ存在于样本内,则LYZ以蛋白质浓度t存在于样本内。t的单位是提供样本的测量的氨基酸浓度的相同单位。如果提供的样本的测量的氨基酸浓度以μM计,则t的单位为μM。如果提供的样本的测量的氨基酸浓度以nM计,则t的单位为nM。如果提供的样本的测量的氨基酸浓度以pM计,则t的单位为pM。这里,提供的样本的测量的氨基酸浓度以μM计,因此t的单位为μM。如果LYZ存在于样本内,则其以9.833μM的蛋白质浓度存在于样本内。 为了确定目的蛋白质LYZ是否存在于样本内,在参考线上求点Q,其给出垂直距离。Q=P(t)。 P=(0+6t,0+6t)=(6t,6t) Q是点,它是对应于t的解的参考的值的集合。S也是点。 使用距离公式求S与Q之间的距离D。 例如,点S与点Q之间的欧几里得距离公式为 因此,我们有 D=4.24 用户已指定误差容限ε为6。 如果D>ε,则目的蛋白质LYZ不存在于样本内。 如果D≤ε,则目的蛋白质LYZ以9.833μM的蛋白质浓度t存在于样本内。 D≤ε。因此,LYZ以9.833μM的蛋白质浓度存在于样本内。 样本体积为100μL,因此LYZ的蛋白质量为9.833μM×100μL=0.9833nmol。在样本中已经鉴定了LYZ的存在,并且LYZ的分子量为14.3kDa。因此,样本中LYZ的质量为14.06ng。 在优选的实施例中,用户对误差阈值的选择由样本中标记和测量的氨基酸类型的数目和样本中测量的值指导。由于距离计算中的总和 样本点与线之间的总距离将随着维数的增加而增加。附加地,如果根据标记的信号提供针对样本测量的值,则该值取决于校准因子或校准函数,并且可能显著大于氨基酸浓度值。提供用于已知W浓度(μM)的W信号(AU)的示例校准因子f是 f 因此,在一些实施例中,误差容限由用户输入的公差值提供,该公差值乘以样本值平方的平方根,反映了距离计算。这由方程10提供: 其中ε是误差容限, 在替代优选的实施例中,用户检验样本中多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在。例如,存在如参考部分所描述的多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考数据库。用户怀疑样本中存在的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的数目。怀疑的样本中存在的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的数目是c。 例如,用户怀疑一种目的蛋白质存在于样本中,因此c=1。作为另一实例,用户怀疑两种目的蛋白质组存在于样本中,因此c=2。在这种情况下,用户对目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组中的每一种进行检验2,生成到每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的每条参考线的距离D。例如,如果存在50种目的蛋白质,则存在目的蛋白质p 该方法可以正式表达为:令β为在参考数据库中针对所有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组计算的D值的集合。集合β中存在αD值。c阶统计量(在统计学上)是集合的第c个最小(第c个最小)值。β的c阶统计量是β 因此,在参考数据库中对于c种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的D≤ε,并且因此在样本中鉴定c种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组。 当c>1时或当使用检验2鉴定样本中多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组时的方法和误差阈值ε在本部分后面的混合物小节中解释。 在一些实施例中,执行检验1。在一些实施例中,执行检验2。在一些实施例中,执行检验1和检验2两者。在一些实施例中,执行检验1,并且如果在用检验1的样本中未鉴别出目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 在一些实施例中,将样本的每种标记的氨基酸类型的值(例如测量的标记、氨基酸浓度和/或氨基酸数目)与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组的相同的两种或更多种氨基酸类型的参考(即已知标记值、氨基酸浓度和/或氨基酸数目)进行比较,并且因为多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组满足检验1和/或检验2,所以多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组被鉴定为存在于样本内。鉴定了多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,因此鉴定了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的存在。蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的浓度和/或量也使用如混合物部分所描述的样本点与每种混合物组分之间的垂直距离来鉴定。如果混合物是简单的混合物,例如5种或更少目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物,则优选该实施例。 在替代实施例中,将样本的每种标记的氨基酸类型的值(例如测量的标记、氨基酸浓度和/或氨基酸数目)与目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的相同的两种或更多种氨基酸类型的参考(例如已知标记值、氨基酸浓度和/或氨基酸数目)进行比较,并且因为其参考满足检验1或检验2,所以目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物被鉴定为存在于样本中。在该实施例中,目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物以及目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的蛋白质浓度被鉴定为满足检验1或检验2的t的值。这两个实施例之间的区别在于,在该实施例中,由方程11或方程12提供的氨基酸的加权平均数用于生成混合物的氨基酸的加权平均数,并且这在参数方程2或4的集合内使用以生成目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物以及目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的参考。如果混合物不是简单的混合物,例如多于5种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物,则优选该实施例。 在一些实施例中,样本的总摩尔蛋白质浓度是未知的。将测量的A 在一些实施例中,当样本的总摩尔蛋白质浓度未知时,将样本中每种标记的氨基酸类型的氨基酸的氨基酸浓度与使用参数方程组1针对一种或多种目的蛋白质、肽、寡肽、多肽或蛋白质复合物的相同(即对应)氨基酸类型的氨基酸浓度生成的参考进行比较。在一些实施例中,当样本的总摩尔蛋白质浓度未知时,将样本中每种标记的氨基酸类型的氨基酸的氨基酸浓度与使用参数方程组2针对一种或多种目的蛋白质组或亚蛋白质组的相同(即对应)氨基酸类型的氨基酸浓度生成的参考进行比较。这允许鉴定未知蛋白质浓度的蛋白质,并且同时确定其蛋白质浓度。例如,将样本中W和K氨基酸类型的氨基酸浓度与针对目的蛋白质n 在一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物中的对应氨基酸类型的氨基酸浓度可以使用参数方程组1或2测量或可以作为蛋白质浓度的函数提供,该函数并入了一种或多种目的蛋白中的每种氨基酸类型的氨基酸数目。参数方程组1或2已经在参考部分中详细描述,并且在此再现。 参数方程组1是: 参数方程组2是: 如果样本中每种标记的氨基酸类型的浓度与作为通过参数方程组1或2的蛋白质浓度的函数提供的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的浓度相同,或在其误差容限ε内,则可以鉴定样本内这些一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量。检验1评估样本中每种标记的氨基酸类型的浓度是否与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的浓度相同,并且检验2评估样本中每种标记的氨基酸类型的浓度是否在一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的相同氨基酸类型的浓度的误差容限ε内。例如,将样本中W和K的氨基酸浓度与作为目的蛋白质的蛋白质浓度的函数提供的目的蛋白质中W和K的氨基酸浓度进行比较。如果样本中的W和K的氨基酸浓度与作为目的蛋白质的蛋白质浓度的函数提供的目的蛋白质中W和K的氨基酸浓度相同(检验1),或在其误差容限内(检验2),则样本中该目的蛋白质的存在被肯定地鉴定,并且样本中目的蛋白质的浓度和/或量是满足检验1或检验2的目的蛋白质的蛋白质浓度。如果样本中W和K的氨基酸浓度在作为目的蛋白质的蛋白质浓度的函数提供的目的蛋白质中W和K的氨基酸浓度的误差容限之外,则样本中该目的蛋白质的存在不存在。因为样本内不存在目的蛋白质,所以根据定义,样本内目的蛋白质的蛋白质浓度和/或量为零。 在一些实施例中,当蛋白质组或亚蛋白质组为目的蛋白质组或亚蛋白质组时,将样本的每种标记的氨基酸类型的测量的标记、每种标记的氨基酸类型的氨基酸浓度和/或每种氨基酸类型的氨基酸数目与提供目的蛋白质组或亚蛋白质组的对应的两种或更多种氨基酸类型的已知标记值、对应的两种或更多种氨基酸类型的平均氨基酸浓度,或对应两种或更多种氨基酸类型的氨基酸的平均数的参考进行比较。 在一些实施例中,将样本的每种标记的氨基酸类型的测量的标记、每种标记的氨基酸类型的氨基酸浓度,和/或每种标记的氨基酸类型的氨基酸数目与提供目的蛋白质、肽、多肽、寡肽、蛋白质组或亚蛋白质组的混合物中的标记值、对应的两种或更多种氨基酸类型的平均浓度,或对应的两种或更多种氨基酸类型的氨基酸的平均数的参考进行比较。当本发明的方法不用于确定混合物内组分的相对比例时,使用该实施例。 在一些实施例中,将样本的标记的氨基酸类型的测量的标记或氨基酸浓度与提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中相同的对应氨基酸类型的已知标记值或浓度的参考线进行比较,通过计算样本点与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的参考线之间的距离来计算样本的标记的氨基酸类型的测量的标记或浓度与作为一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的蛋白质浓度的函数提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的标记值或氨基酸浓度的参考线之间的距离。 在一些实施例中,将样本中每种标记的氨基酸类型的测量的标记与作为每种目的蛋白质、肽、寡肽、多肽或蛋白质复合物的蛋白质浓度的函数提供一种或多种蛋白质、肽、寡肽、多肽或蛋白质复合物的相同(即对应的)氨基酸类型的已知标记值的参考进行比较,其中该参考使用参数方程组3生成。参数方程组3已经在参考部分中详细描述,并且在此再现: 在一些实施例中,将样本中每种标记的氨基酸类型的测量的标记与作为每种目的蛋白质组或亚蛋白质组的蛋白质浓度的函数提供一种或多种目的蛋白质组或亚蛋白质组的相同(即对应)氨基酸类型的已知标记值的参考进行比较,其中该参考使用参数方程组4生成。参数方程组4已经在参考部分中详细描述,并且在此再现: 例如,将样本中标记的氨基酸类型W和K的荧光强度与作为目的蛋白质的蛋白质浓度的函数的目的蛋白质的W和K的参考荧光强度进行比较,其中该参考使用参数方程组3提供。 在一些实施例中,如果样本中每种标记的氨基酸类型的测量的标记与作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物的蛋白质浓度的函数提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同(即对应)氨基酸类型的已知标记值的参考相同或在其误差容限内,则可以对样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度和/或量进行鉴定。样本的蛋白质浓度是标记值与样本中测量的相同氨基酸类型的标记值相同或在其误差容限内的参考的蛋白质浓度。例如,将样本中氨基酸类型W和C的荧光强度与由作为目的蛋白质的蛋白质浓度的函数的目的蛋白质的参考提供的氨基酸类型W和C的荧光强度进行比较。如果样本中氨基酸类型W和C的荧光强度与由作为目的蛋白质的蛋白质浓度的函数的目的蛋白质的参考提供的氨基酸类型W和C的荧光强度相同,或在其误差容限内,则阳性鉴定样本中目的蛋白质的存在和/或浓度和/或量。鉴定目的蛋白质的存在,并且蛋白质浓度是经由参考函数提供的目的蛋白质的蛋白质浓度,氨基酸类型W和C的荧光强度与样本中测量的氨基酸类型W和C相同或在其误差容限内。如果样本中氨基酸类型W和C的荧光强度在由作为目的蛋白质的蛋白质浓度的函数的目的蛋白质的参考提供的氨基酸类型W和C的荧光强度的误差容限之外,则样本中目的蛋白质的存在和/或浓度和/或量不存在。样本中目的蛋白质的存在不存在,并且因此样本内不存在该目的蛋白质的量和/或浓度。 目的蛋白质或蛋白质组中每种对应氨基酸类型的已知标记值(例如荧光强度)可以预先测量,其由作为目的蛋白质的蛋白质浓度与使用参数方程组3或4生成的参考的函数的参考提供,或者可以作为方法的一部分主动测量。 在一些实施例中,当鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物存在时,样本中每种标记的氨基酸类型的浓度可以用于确定样本的未知总蛋白质浓度;样本的蛋白质浓度是满足检验1或检验2的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的蛋白质浓度。 在一些实施例中,通过本文所公开的本发明的方法已确定的样本的总蛋白质浓度提供了患者样本内的总病毒蛋白质浓度。在一些实施例中,病毒蛋白质组的身份已被同时确定。每单一病毒颗粒的总蛋白质浓度是恒定的,并且因此患者样本内病毒蛋白质组的总浓度是患者样本内病毒的相对病毒载量的量度。优选地,这以摩尔浓度单位报告,诸如μM。通常,病毒载量描述为每mL样本中病毒颗粒的数目。通过理论上确定一个病毒颗粒内蛋白质的总摩尔数,可以将本发明的方法内计算的病毒载量转换为这些单位。如果需要,这可以用于将摩尔总蛋白质浓度测量值转换为病毒颗粒每mL样本的标准量度。然而,因为这仅仅涉及将经由本发明的方法直接获得的值除以标量,所以计算病毒载量的两种方法给出了可以用于患者护理和建模的等效定量信息。 在一些实施例中,使用n维空间将样本的标记的氨基酸类型的测量的标记、标记的氨基酸类型的氨基酸浓度和/或每种标记的氨基酸类型的氨基酸数目与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组、蛋白质组的混合物的相同氨基酸类型的已知标记值、相同氨基酸类型的氨基酸浓度或相同氨基酸类型的氨基酸数目进行比较。将例如由参数方程组1、2、3或4构建的参考提供的化学信息投影到样本内标记的n氨基酸类型中的每一种的n维空间中,其中n是标记的氨基酸类型的数目,以便于可视化。例如,当样本中2种氨基酸类型被标记时,存在2维空间。当样本中3种氨基酸类型被标记时,存在3维空间。当样本中4种氨基酸类型被标记时,存在4维空间。这提供了例如由参数方程提供的参考的行为的图形表示,然而,执行本发明的方法不需要该步骤。 n维空间含有作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物的蛋白质浓度的函数的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的n种氨基酸类型的已知标记值或氨基酸浓度。替代地,如果样本的蛋白质浓度是已知的,则n维空间提供样本的已知蛋白质浓度的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物的标记值、氨基酸浓度或氨基酸数目。n维空间中的氨基酸类型与样本中已标记的氨基酸类型相同。例如,如果样本中4种氨基酸类型被标记;W、C、Y和K,则n维空间含有一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物,在样本的蛋白质浓度下,如果已知的话,的W、C、Y和K的已知标记值、氨基酸浓度或氨基酸数目,或如果样本的蛋白质浓度未知的话,作为蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物的蛋白质浓度的函数,提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的标记值或氨基酸浓度。 在一些实施例中,在一般参数方程、参数方程组1、2、3或4内使用每种标记的氨基酸类型的氨基酸数目来计算参考,其提供作为目的蛋白质、肽、寡肽、多肽、蛋白质组或亚蛋白质组的蛋白质浓度的函数的针对目的蛋白质、肽、寡肽、多肽、蛋白质组或亚蛋白质组的样本中标记和测量的每种氨基酸类型的氨基酸浓度或每种氨基酸类型的标记的信号。在一般参数方程、参数方程组1、2、3或4内,目的蛋白质、肽、寡肽、多肽、蛋白质组或亚蛋白质组的蛋白质浓度是变量t。这提供了n维空间中的线。每个参数方程具有域 已对比较步骤进行了一般性描述,并提供了特定实例。现在更详细地描述比较步骤,说明在每个实施例中如何基于可用于样本的信息进行比较。当可用于样本的信息是样本内两种或更多种氨基酸类型的测量的标记时,并且当样本的信息是样本中两种或更多种氨基酸类型的浓度时,在下文描述了比较步骤,该浓度任选地根据样本内两种或更多种氨基酸类型的测量的标记计算。每种情况均参考目的蛋白质和蛋白质组进行描述。然而,针对目的蛋白质概述的方法也可以应用于鉴定目的肽、寡肽、多肽或蛋白质复合物的存在和/或浓度和/或量。当混合物内每种组分的相对比例已知时,针对目的蛋白质组概述的方法也可以应用于鉴定目的亚蛋白质组的存在和/或浓度和/或量,或应用于目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物。这之后是当混合物的每种组分的相对比例未知时使用本发明的方法来鉴定蛋白质或蛋白质组的混合物的单独讨论,并且这作为该方法的一部分来确定。当混合物中每种组分的相对比例未知时,针对蛋白质或蛋白质组混合物概述的方法也适用于鉴定目的肽、寡肽、多肽、蛋白质复合物或亚蛋白质组的混合物的存在和/或浓度和/或量。最后,描述了两种特殊情况,其中已经知道关于样本的一些信息。在特殊情况1中,样本的摩尔蛋白质浓度是已知的,因此可用于计算样本的两种标记的氨基酸类型中的每一种的氨基酸数目。在特殊情况2中,样本内目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物的存在是已知的,并且本发明的方法用于准确地确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组,或目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的混合物的浓度和/或量。 两种或更多种氨基酸类型的标记的信号,目的蛋白质 当在样本中测量两种或更多种氨基酸类型的标记(例如标记的信号),并且这不转换为样本的两种或更多种氨基酸类型的氨基酸浓度时,在提供目的蛋白质的参考时使用参数方程组3。参数方程组3已在参考部分中充分描述,并且在此再现: 在该方程中,校准因子或校准函数(f 在一些实施例中,如果在氨基酸浓度和在参考部分中描述的每种氨基酸类型的标记信号之间转换的校准函数f不是线性的,或在某些浓度范围,例如高或低氨基酸浓度,上不是线性的,则一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中的每一种具有标记参考曲线的信号,而不是参考线。在该实施例中,将样本的标记的氨基酸类型的测量的标记与提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中相同的对应氨基酸类型的标记值的参考曲线进行比较,通过计算样本点与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的参考曲线之间的距离来计算样本的标记的氨基酸类型的测量的标记与作为一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的蛋白质浓度的函数提供一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组、蛋白质组或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的相同的对应氨基酸类型的标记值的参考曲线之间的距离。样本中目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在在样本点在目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的参考曲线上被鉴定。这通过将包含每种氨基酸类型的参考曲线的函数设置为等于样本中标记和测量的每种氨基酸类型的标记的对应信号,并且如在试验1中那样求解t来评估。如果存在t的单一解,则在样本中鉴定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的存在,并且目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的蛋白质浓度是求解方程的t的单一解。替代地,确定样本点与参考曲线之间的最小距离(例如,如10.1109/TPCG.2003.1206938中所描述的),并且检验2评估此最小距离是否小于误差阈值ε。如果样本点与参考曲线之间的最小距离小于误差阈值,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组以提供最小距离的参考曲线上的点的蛋白质浓度存在于样本内。 优选地,在每种氨基酸类型的氨基酸浓度与标记的信号之间转换的校准曲线是线性的。在这种情况下,校准因子f f K氨基酸类型的校准因子f f W氨基酸类型的校准因子f f 在一些实施例中,校准曲线取决于为实验选择的参数和报告氨基酸浓度的浓度单位。例如,基于所提供的C氨基酸类型的校准曲线是 C信号(AU)=50(AU/μM)×C浓度(μM) 校准因子是校准曲线f ,如果C氨基酸类型的氨基酸浓度代替为以nM报告,则C氨基酸类型的校准曲线将是 并且作为校准曲线的斜率的校准因子f 优选地,每种氨基酸类型的校准曲线或校准因子以相同单位提供(例如,在实验中标记和测量的所有氨基酸类型具有以μM为单位的校准因子,或在实验中标记和测量的所有氨基酸类型具有以nM为单位的校准因子)。如参考部分所描述的,每种氨基酸类型的校准因子用于产生每种目的蛋白质的参考。例如,在样本中标记C、K和W氨基酸类型。对于C氨基酸类型(氨基酸类型1),测量的标记的值是690。对于K氨基酸类型(氨基酸类型2),测量的标记的值是3938。对于W氨基酸类型,测量的标记的值是242。已经使用参数方程组3为光蛋白聚糖创建了参考。该参考为: 为了鉴定样本中目的蛋白质的存在和/或浓度和/或量,当可用于样本的值是两种或更多种氨基酸类型的标记的值时,执行检验1和/或检验2。 检验1涉及将针对样本测量的每个值(V V V V 其中方程的数目等于样本中标记和测量的n种氨基酸类型的数目。如果n个方程包含可以对t的单一值求解的检验1,则目的蛋白质p 因为检验1失败,样本点不在参考线上。 检验2的方法是: 1.令R为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 2.在向量格式中求参考线R的方程。这是R=<0,0,...,0>+t 3.求参考线R上的点P的一般方程。这是P=<0+a 4.从S到P的向量是P-S= 5.使用称为D的距离公式求Q和S之间的距离。 6.评价D是否小于误差容限ε。 7.如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 8.如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 参考线的向量形式是R=<0,0,...,0>+t 对于目的蛋白质光蛋白聚糖,这变为 R=<0,0,0>+t<300,1875,100> 参考线上的点(P)的一般方程是 P=<0+300t,0+1875t,0+100t> 我们测量的样本点(S)具有坐标(V1,V2,V3),其为(690,3938,242) 从我们测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S=<300t-690,1875t-3938,100t-242> 为了使该向量垂直,该向量与参考线<300,1875,100>的方向的点积(-)必须为0。 因此,我们设置 <300t-690,1875t-3938,100t-242>-<300,1875,100>=0 90000t-207000+3515625t-7383750+10000t-24200=0 3615625t=7614950 该t的解是目的蛋白质光蛋白聚糖的蛋白质浓度,其中样本与参考线之间的距离最短。因此,如果目的蛋白质光蛋白聚糖存在于样本内,则LYZ以蛋白质浓度t存在于样本内。t的单位与校准因子中使用的单位相同。如果校准因子具有单位为μM,则t的单位为μM。如果校准因子具有单位为nM,则t的单位为nM。如果校准因子具有单位为pM,则t的单位为pM。这里,校准因子具有单位为μM,因此t的单位为μM。如果光蛋白聚糖存在于样本内,则其以2.106μM的蛋白质浓度存在于样本内。 为了确定目的蛋白质光蛋白聚糖是否存在于样本内,在参考线上求点Q,其给出垂直距离。Q=P(t)。P=<0+300t,0+1875t,0+100t>=<300t,1875t,100t> Q=(300×2.106,1875×2.106,100×2.106)=(631.837,3948.980,210.613) Q是点,它是对应于t的解的参考的值的集合。S也是点。我们使用距离公式求S与Q之间的距离D。 例如,点S与点Q之间的欧几里得距离公式为 因此,我们有 由方程10提供的误差阈值是 当针对样本测量两种或更多种氨基酸类型的标记的值时,S 用户已指定公差值 因此, 如果D>ε,则目的蛋白质光蛋白聚糖不存在于样本内。 如果D≤ε,则目的蛋白质光蛋白聚糖以2.106μM的蛋白质浓度t存在于样本内。 D≤ε,因为66.997≤200.27。因此,光蛋白聚糖以2.106μM的蛋白质浓度存在于样本内。 样本体积为100μL,因此光蛋白聚糖的蛋白质量为2.106μM×100μL=2.106nmol。样本中已经鉴定了光蛋白聚糖的存在,并且光蛋白聚糖的分子量为36.66kDa。因此,样本中光蛋白聚糖的质量为77.21ng。 两种或更多种氨基酸类型的信号,目的蛋白质组 对于目的蛋白质概述的相同方法适用于目的蛋白质组。不同之处在于使用参考部分中定义的参数方程组4而不是参数方程组3来提供目的蛋白质组的参考。参数方程组4为: 其中目的蛋白质组中每种氨基酸类型的氨基酸的加权数如参考部分所解释的定义,例如使用方程11或方程12。如上所解释的,应用检验1或检验2来确定样本是否含有目的蛋白质组,并且如果在样本中鉴定出目的蛋白质组的存在,则同时确定样本内目的蛋白质组的蛋白质浓度。 例如,SARS-CoV-2蛋白质组的参考已经使用描述的如下的参数方程组4内的W和K氨基酸类型的校准因子提供: 其中W氨基酸类型是氨基酸类型1,并且K氨基酸类型是氨基酸类型2。使用具有相同氨基酸类型和校准函数的参数方程组4,还提供了HIV蛋白质组的参考: 取血液样本并且分离病毒级分。针对W和K氨基酸类型测量的标记的信号分别为327AU和837AU,在n维空间中提供点(327,837)。 使用本文所描述的方法,执行检验2。对于目的SARS-CoV-2蛋白质组,我们有: <1130t-327,4545t-837>·<1130,4545>=0 t=0.191uM,Q=(215.8,868.1),D=115.5 对于目的HIV蛋白质组,我们有: <1090t-327,2093t-837>·<1090,2093>=0 t=0.378uM,Q=(413.6,792.4),D=97.41 距离阈值已被设置为 因为对于两种目的蛋白质组,D>ε,两种目的蛋白质组被鉴定为不存在于患者样本内(鉴定患者样本内不存在每种目的蛋白质组)。 作为另一实例,已经报告在SARS-CoV-2感染后IL-6、I L1RN和IL1RA保持升高,如针对MERS所观察到的。目的亚蛋白质组,例如包含IL-6、I L1RN和IL1RA或基于SARS-CoV-2感染后患者的鼻分泌物或血浆用实验方法确定的,可以使用样本中标记和测量的W和K氨基酸类型的荧光强度来鉴定和定量。相对于先前没有感染SARS-CoV-2的对照,该目的亚蛋白质组的存在或升高可以鉴定先前SARS-CoV-2感染的亚蛋白质组标记,作为抗体检验的替代。 两种或更多种氨基酸类型的氨基酸浓度,目的蛋白质 如已经描述的,使用每种氨基酸类型的校准曲线,的倒数,根据两种或更多种氨基酸类型的标记的值计算两种或更多种氨基酸类型的氨基酸浓度。例如,使用下列逆校准曲线计算C、K和W氨基酸类型的氨基酸浓度 其提供了作为其斜率的以下逆校准因子。 如参考部分所描述的,目的蛋白质p AAC AAC AAC 检验2的方法是: 1.令R为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 2.在向量格式中求参考线R的方程。这是R=<0,0,...,0>+t 3.求参考线R上的点P的一般方程。这是P=<0+a 4.从S到P的向量是P-S= 5.使用称为D的距离公式求Q和S之间的距离。 6.评价D是否小于误差容限ε。 7.如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 8.如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 在样本中标记氨基酸类型C、K和W。在C标记步骤期间添加TCEP,因此在样本中标记所有(未修饰的+修饰的)C氨基酸。在样本中标记K氨基酸类型的未修饰的氨基酸(未经历表4中所列的任何PTM的K氨基酸类型的氨基酸)。在样本中标记所有(未修饰的+修饰的)W氨基酸。在样本中测量的氨基酸浓度为37.4μM C、37.4μM K和22.0μM W。AAC 已经如参考部分中所描述的构建了参考数据库,并且使用表4中描述的规则以确保参考数据库反映标记C氨基酸类型的所有(未修饰的+修饰的)氨基酸、K氨基酸类型的未修饰的(未经历表4中列出的任何PTM的K氨基酸类型的氨基酸)和W氨基酸类型的所有(未修饰的+修饰的)氨基酸。结果为: S=(37.4,43.2,22) 检验1已经被描述并且不应用在该实例中。 应用检验2,其中S=(37.4,43.2,22) 对于p P=<34t,49t,0t>。P-S=<34t-37.4,49t-43.2,0t-22>。R的方向为<34,49,0>。 <34t-37.4,49t-43.2,0t-22>·<34,49,0>=0 1156t-1271.6+2401t-2116.8+0t-0=0;3557t=3388.4;t=0.953 Q=P(t)。Q=<34×0.953,49×0.953,0×0.953>=<32.402,46.697,0> 应用针对p <38t-37.4,159t-43.2,9t-22>·<38,159,9>=0 t=0.3166;Q=P(t)=(12.031,50.339,2.849) D 对于P t=1.780;Q=(39.149,42.708,19.57);D 对于p t=3.677;Q=(7.353,47.795,22.059);D 对于p t=2.004;Q=(12.022,50.091,2.004);D 用户未定义公差值,而是怀疑样本内存在1种目的蛋白质,设置c=1。误差容限被定义为β的c阶统计量,ε=β β是针对所有目的蛋白质p β=[22.477,32.578,3.030,30.396,33.036]。 β的1阶统计量,β 因此,对于目的蛋白质,D≤ε,对于n 如参考部分所描述的,目的蛋白质p 其中C氨基酸类型(未修饰的+修饰的)是氨基酸类型1,并且W氨基酸类型(未修饰的+修饰的)是氨基酸类型2,以及提供以μM计的t的值的约束。该约束对比较步骤有影响。在比较步骤期间,鉴定目的蛋白质的蛋白质浓度。当对参考施加约束时,检验1和/或检验2正常执行,但执行附加步骤。如果求得蛋白质浓度t的解,使得目的蛋白质的氨基酸浓度等于(检验1)或小于或等于针对样本测量的氨基酸浓度的误差容限(检验2),则执行检验3。在检验3中,将鉴定的蛋白质浓度的解与提供的蛋白质浓度值范围进行比较。如果蛋白质浓度解在为参考提供的蛋白质浓度值的范围内,则在样本中鉴定出以提供此类解的蛋白质浓度的目的蛋白质的存在。然而,如果蛋白质浓度解在为参考提供的蛋白质浓度值的范围之外,则在样本内未鉴定出目的蛋白质的存在。替代地,可以将计算的蛋白质浓度相对于提供的浓度范围的这种检查并入检验2中。 在一些实施例中,当应用约束时,参数方程组1变为: /> 其中参数方程组1是针对集合 在检验3中,如果 两种或更多种氨基酸类型的氨基酸浓度,目的蛋白质组 基于样本中两种或更多种氨基酸类型的氨基酸浓度,将相同的方法用于检测样本内的目的蛋白质组。已经在参考部分定义了参数方程组2,并且提供了目的蛋白质组或亚蛋白质组的两种或更多种氨基酸类型的氨基酸浓度: 在此描述的检验(检验2或检验1)是对由来自目的蛋白质组p 例如,对于其W(氨基酸类型1)和K(氨基酸类型2)氨基酸类型也提供了HIV蛋白质组的参考: 取血液样本并且分离病毒级分。针对W和K氨基酸类型测量的标记的信号分别为8.7uM和19.5uM,在n维空间中提供点(8.7,19.5)。 使用本文所描述的方法,执行检验2。我们有: <10.9t-8.7,27.9t-19.5>·<10.9,27.9>=0 t=0.712uM,Q=(7.761,18.865),D=1.134 距离阈值已被设置为 因为D≤ε,所以目的HIV蛋白质组被鉴定为存在于样本中,在t的解为1.134μM。 特殊情况1 在特殊情况1中,样本的总摩尔蛋白质浓度是已知的,因此可以计算样本的两种或更多种氨基酸类型的氨基酸数目,并且提供目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的数目作为参考。替代地,可以在样本的蛋白质浓度下提供相同的两种或更多种氨基酸类型的氨基酸浓度或标记的值。不需要计算样本点与每种目的蛋白质的参考线之间的最小距离,因为每种目的蛋白质的参考只是n维空间中的点,而不是线。因此,使用如本文所描述的方法计算样本点与每种目的蛋白质的参考点之间的距离,将计算的距离与误差容限ε进行比较,如果怀疑混合物含有c种目的蛋白质,则该误差容限可以是计算的距离的c阶统计量,或基于针对样本测量的值(标记的测量值、氨基酸浓度或氨基酸数目)提供,诸如使用方程10, 在特殊情况1中,样本的摩尔蛋白质浓度是已知的,并且这是常数SC。因此,如果样本内存在目的蛋白质p 一般参数方程是 在特殊情况1中,一般参数方程简化为n维空间中的点。 p 这不再是参数方程,因为它不是共同参数(自变量)的函数,因为变量t被替换为常数SC。在特殊情况1中,对于目的蛋白质p p 这描述了n维空间中的点,其中n是样本中标记和测量的氨基酸类型的数目。 在特殊情况1中,如果存在目的蛋白质p 其中S 在特殊情况1中,如果完成检验1,则目的蛋白质p 在特殊情况1中,如果存在目的蛋白质p 使用距离公式诸如欧几里得距离计算样本点(S 计算。仅在特殊情况1中,可计算样本中每个标记和测量的氨基酸类型内的氨基酸数目。这是可获得的,因为样本的每种氨基酸类型的氨基酸数目等于样本的该氨基酸类型的氨基酸浓度除以样本的已知摩尔蛋白质浓度。样本中氨基酸类型1的氨基酸数目是N 当在特殊情况1内计算样本中每种氨基酸类型的氨基酸数目时,完成检验1,条件是: /> 当样本点恰好等于参考点时,完成检验1。 当在特殊情况1内计算样本中每种氨基酸类型的氨基酸数目时,当参考中每种氨基酸类型的氨基酸数目在样本中每种氨基酸类型的氨基酸数目的误差容限ε内时,完成检验2。这通过确定样本点与参考点之间的距离D,例如欧几里得距离来评价。 该式为: 根据测量的标记计算样本中每种标记的氨基酸类型的氨基酸数目并且将氨基酸浓度除以样本的总摩尔蛋白质浓度以提供如本文所描述的样本中每蛋白质分子的每种氨基酸类型的数目。 在一些实施例中,参考是用实验方法提供的而不是计算的,并且参考的蛋白质浓度等于样本的已知蛋白质浓度。然后可以将样本的氨基酸浓度直接与参考蛋白质或目的蛋白质组的氨基酸浓度进行比较。在其它实施例中,参考是用实验方法提供的而不是计算的,并且参考的蛋白质浓度等于样本的已知蛋白质浓度。在几种已知的蛋白质浓度下提供实验参考,并且计算每种氨基酸类型的氨基酸浓度相对于蛋白质浓度的变化率。这等同于在n维空间中沿穿过原点的信息的每个维度的线的斜率,并且也等同于单一目的蛋白质的参数方程组1或目的蛋白质组的参数方程组2的每种对应氨基酸类型的a 在另一实施例中,测量样本的C的测量的标记和W的测量的标记。在样本的已知蛋白质浓度下,将目的蛋白质或蛋白质组中的每一种的C氨基酸数目和W氨基酸数目转变为目的蛋白质或蛋白质组中的每一种的C氨基酸浓度和W氨基酸浓度,并且通过将每种氨基酸类型的氨基酸浓度乘以每种氨基酸类型的校准因子将目的蛋白质或蛋白质组中的每一种的C氨基酸浓度和W氨基酸浓度转变为目的蛋白质或蛋白质组中的每一种的已知标记值(例如信号,诸如荧光强度)。这提供了n维空间中的点,而不是线,因为样本的蛋白质浓度是已知的。 在一些实施例中,参考是用实验方法提供的而不是计算的,并且目的蛋白质的蛋白质浓度等于样本的已知蛋白质浓度。然后可以直接将样本的测量的标记(例如信号)与目的蛋白质的已知标记值(例如信号)进行比较。在其它实施例中,参考是用实验方法提供的而不是计算的,并且目的蛋白质的蛋白质浓度不等于样本的已知蛋白质浓度。在目的蛋白质的几种已知蛋白质浓度下提供实验参考,并且计算每种氨基酸类型的信号相对于蛋白质浓度的变化率。这等同于在n维空间中沿穿过原点的信息的每个维度的线的斜率,并且提供了用于目的蛋白质的参数方程组3的a 在这两个附加实施例中的转变都允许你进行类似比较,从而可以进行样本中的未知蛋白质与每种参考蛋白质之间的比较,并且任选地使用距离计算来确认。 特殊情况2 在特殊情况2中,样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在是已知的,但样本内一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的总摩尔蛋白质浓度是未知的。参数方程组1、2、3或4提供了一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考函数。如果已知的多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组在样本内,则参数方程组2用于提供样本内已知的多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的氨基酸浓度的参考,并且参数方程组4用于提供样本内已知的多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的标记的值的参考。在这两种情况下,这可以使用方程6或方程7来提供。 在特殊情况2中,没有执行检验,因为没有检验假设。因此,不执行检验1或检验2。相反,将样本中标记的两种或更多种氨基酸类型的测量值设置为等于由参考函数提供的对应值,求解t的每个方程,并且将结果平均(即平均值)。 在 一般参数方程保持 然而,未使用检验1评价目的蛋白质pi的存在。相反,将已知值输入到包含检验1的方程中,并且求解t的方程, 因为样本内目的蛋白质p 根据方程19计算根据针对2至n种氨基酸类型(其中i=1,2,…n)测量的氨基酸浓度计算样本的蛋白质浓度的公式: 本发明的方法也可以用于计算蛋白质的量,因为蛋白质浓度等于蛋白质的量除以溶液的体积。根据方程20计算根据针对2至n种氨基酸类型(其中i=1,2,…n)测量的氨基酸浓度计算样本的蛋白质量的公式: /> 其中样本体积等于标记了氨基酸类型n的溶液的体积。在一些实施例中,计算的蛋白质量是存在的蛋白质的总摩尔数。这可以通过乘以阿伏伽德罗(Avogadro)数,每摩尔6.022x10 复制品 很少可以将样本鉴定为参考,但该参考可以指多于一种目的蛋白质。当蛋白序列中两种或更多种氨基酸类型的数目相同时,或当一个蛋白序列中两种或更多种氨基酸类型的数目是另一蛋白序列中两种或更多种氨基酸类型的数目的倍数时,这会发生。如果一种目的蛋白质内两种或多种氨基酸类型的数目与另一目的蛋白质内相同的两种或更多种氨基酸类型的数目相同,则目的蛋白质的参考线将是相同的。在这些情况下,样本被鉴定为参考,但是参考可以指多于一种目的蛋白质,例如该参考可以指两种目的蛋白质。 对于这些情况中的任一种,优选的方法是通过将参考线仅约束为生物学相关的目的蛋白质的蛋白质浓度来消除涉及多于一种目的蛋白质的参考。优选地,如果目的蛋白质的参考仅限定在目的蛋白质的生物学相关浓度范围内,则可以避免涉及多于一种目的蛋白质的参考的问题。已经发现,通过在空间中约束参考线,这显着地减少了涉及多于一种目的蛋白质的参考的存在,或者两条参考线是难以区分的。图8示出了对血浆的影响,在其上存在10个数量级的蛋白质浓度范围。10个数量级浓度范围的信息丰富性显着地降低了人血浆蛋白质组(3263个蛋白质和肽)内目的蛋白质的相同或难以区分的参考线的存在。 该发现在图9中进一步定量,其中针对氨基酸类型的各种组合(C和W、K和W、K和Y、K和S、K和P、L和S、L和K、E和L、G和L、C K和W、C K和Y、L K和S、E G和K、E G和S、R E P和T,以及Q L K和V)在人血浆蛋白质组中定量涉及多于一种目的蛋白质的参考的出现。涉及多于一种目的蛋白质的参考的出现百分比在所考虑的氨基酸类型中变化很大,但是发现当将作为本发明方法的一部分可获得的目的蛋白质的蛋白质浓度与可获得的目的蛋白质的浓度界限进行比较时,对于所检验的两种、三种和四种氨基酸类型的每种组合,一个参考映射到一种独特的目的蛋白质(氨基酸序列/蛋白质序列)的时间为100.00%。在一些实施例中,将两种或更多种标记的氨基酸类型内的标记的值和/或氨基酸的氨基酸浓度和/或氨基酸数目与为样本中标记的相同的两种或更多种氨基酸类型提供的标记的值、氨基酸浓度或氨基酸数目进行比较,并且将所鉴定的蛋白质浓度与目的蛋白质的已知蛋白质浓度范围进行比较,独特地鉴定并且确定目的蛋白质的浓度和/或量。因此,测量样本内两种或更多种标记的氨基酸类型的特征,并且执行本发明的比较步骤,将样本独特地鉴定为含有任何目的蛋白质。 该约束对比较步骤有影响。在比较步骤期间,鉴定目的蛋白质的蛋白质浓度。当对参考施加约束时,检验1和/或检验2正常执行,但执行附加步骤。如果求得蛋白质浓度t的解,使得目的蛋白质的氨基酸浓度等于(检验1)或小于或等于针对样本测量的氨基酸浓度的误差容限(检验2),则执行检验3。在检验3中,将鉴定的蛋白质浓度的解与提供的蛋白质浓度值范围进行比较。如果蛋白质浓度解在为参考提供的蛋白质浓度值的范围内,则在样本中鉴定出以提供此类解的蛋白质浓度的目的蛋白质的存在。然而,如果蛋白质浓度解在为参考提供的蛋白质浓度值的范围之外,则在样本内未鉴定出目的蛋白质的存在。 当应用约束时,参数方程的一般形式变为: 其中参数方程的一般形式是针对集合 p ·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时,c ·当样本的测量值以氨基酸浓度提供并且参考线描述了目的蛋白质组或亚蛋白质组时,c ·当样本的测量值以标记的信号提供并且参考线描述了目的蛋白质、肽、寡肽、多肽或蛋白质复合物时为c ·当样本的测量值是测量的标记(例如标记的信号)并且参考线描述了目的蛋白质组或亚蛋白质组时为c 在检验3中,如果 样本的量是样本的蛋白质浓度乘以样本的体积。 作为替代或补充方法,如果参考涉及多于一种目的蛋白质(例如两种目的蛋白质),则可获得一些信息以确定样本内存在哪种目的蛋白质,因为可获得关于如何获得样本的信息。例如,在20,353-蛋白质人蛋白质组的实例内(在亚基卷成蛋白质复合物之前),样本可以从血浆、从子宫内膜组织的活组织检查、从潜在的癌性皮肤生长、从唾液或从尿中获得。在样本被鉴定为参考,但该参考是指多于一种目的蛋白质的情况下,该信息被用于确定该参考是指哪种目的蛋白质,并且因此确定哪种目的蛋白质存在于样本内。该过程可以用分类器自动化。例如,尽管人蛋白质组含有20,353个蛋白质,但这些蛋白质在不同的组织类型和不同的疾病状态中表达不同。因此,用于确认样本中一种或多种目的蛋白质的身份和/或存在和/或浓度并且根据分类组织类型内目的蛋白质的表达数据进行训练的分类器可以用于基于样本已被识别为的参考和从其获得样本的输入的分类组织类型来鉴定参考所指的是哪种目的蛋白质。 即使不应用缓解步骤,非独特或难以区分的参考不会在大多数临床相关的目的蛋白质组或亚蛋白质组中频繁出现。图10分析了几种临床相关蛋白质组和亚蛋白质组的这种行为。图10示出了当标记和比较两种氨基酸类型时,在不对蛋白质浓度或其它分类施加任何界限或约束的情况下,所有参考是可区分的,并且独特地映射到所考虑的大多数临床相关蛋白质组和亚蛋白质组(SARS-CoV-2、HIV、爱泼斯坦-巴尔、神经胶质瘤)内的目的蛋白质,并且不对应于临床相关蛋白质组和亚蛋白质组内的多种目的蛋白质。在一些实施例中,当本发明的方法用于鉴定来自目的蛋白质的参考组的样本内目的蛋白质的存在和浓度时,标记了3种氨基酸类型,该目的蛋白质的参考组含有存在于蛋白质组或亚蛋白质组内的所有蛋白质,该蛋白质组或亚蛋白质组含有超过200种蛋白质而没有蛋白质浓度约束。图10示出了当标记和比较三种氨基酸类型时,所有参考是可区分的,并且独特地映射到所有临床相关的含有少于4000个蛋白质的蛋白质组和亚蛋白质组内的目的蛋白质。 在替代实施例中,如果一种目的蛋白质内的两种或更多种氨基酸类型的数目是另一目的蛋白质内的两种或更多种氨基酸类型的数目的倍数,则参考线将占据n维空间内的相同位置(即,它们将在彼此之上),但具有不同的参数化。因此,将样本鉴定为参考,但该参考与另一参考重叠,使得该样本可以含有由任一参考提及的目的蛋白质。在这种情况下,测量样本的质量蛋白质浓度(例如使用A280/A205比率以mg/mL计的样本的质量蛋白质浓度,并且经由Scopes方法提供ε 在一些实施例中,选择用于标记的氨基酸类型可以是消除或最小化蛋白质组或亚蛋白质组内不可区分或对应于多于一种目的蛋白质的任何参考的氨基酸类型。已经分析了由两种、三种、四种和五种氨基酸类型的每种可能组合提供的信息内容,并且参考的百分比是可区分的并且独特地对应于代表性的图11中所示的目的蛋白质。在图11中,氨基酸类型组合已经通过对目的蛋白质的独特映射的百分比分级,并且示出了具有最高百分比的独特映射的氨基酸类型组合;氨基酸类型组合的大小指示独特映射的相对百分比。例如,通常,对于两种氨基酸类型,KW、CW、KC、KY、CY、WY、LS、LK、EL、GL、AL、DL、LS、LP、LV、KS、EL、AR、AE、AG和AI氨基酸类型组合消除或最小化了蛋白质组或亚蛋白质组内不可区分或映射到多于一种目的蛋白质的任何参考。 有趣的是,当取混合物诸如蛋白质组或亚蛋白质组的平均值时,不会出现倍数。即使蛋白质组或亚蛋白质组含有氨基酸数目是彼此的倍数的纯蛋白质,整个蛋白质组或亚蛋白质组的氨基酸的平均数不是任何其它蛋白质组或亚蛋白质组的氨基酸的平均数的倍数。例如,大肠杆菌蛋白质组内的单个纯蛋白质含有许多彼此为倍数的氨基酸,但大肠杆菌蛋白质组含有与任何其它细菌蛋白质组不同的氨基酸的平均数。图12示出了可从UniProt数据库获得的所有超过7000种参考细菌蛋白质组具有与每种其它细菌蛋白质组的氨基酸的平均数不同的氨基酸的平均数,即使当仅两种氨基酸类型被标记时。对于可从UniProt数据库获得的超过9000种病毒蛋白质组发现了相同的行为。 令人惊讶的是,已经发现通过标记和比较复杂混合物诸如蛋白质组或亚蛋白质组内的所有蛋白质的两种或更多种氨基酸类型的氨基酸数目、氨基酸浓度或标记的信号,未观察到倍数。因此,即使不能从其所有组分蛋白质中鉴定蛋白质组,因为对于一些组分蛋白质观察到的氨基酸数目是倍数的,使得它们的鉴定具有挑战性,可以基于蛋白质组内代表性蛋白质序列的氨基酸的加权平均数鉴定整个蛋白质组。通过发现细菌和病毒蛋白质组的氨基酸的平均数不遵循本福特定律,这已经被合理化。这意味着该数集是特别丰富的信息,并且相对于其它自然出现的数集是不同的,如图4、5和6所示。 已经发现,即使仅标记目的蛋白质组内两种氨基酸类型,细菌和病毒蛋白质组也是彼此不同的,允许基于仅标记两种氨基酸类型快速鉴定细菌或病毒感染,如图3所示。 已经发现,即使仅标记目的蛋白质组内两种氨基酸类型,细菌和病毒蛋白质组根据它们的谱系聚集在一起,如图13所示。 例如,为了标记K和W氨基酸类型,棒状杆菌科、军团菌目、芽孢杆菌目、链霉菌科和支原体科的细菌目形成不同的簇并且提供不重叠的特征。K和W标记均可以在大约5分钟内快速进行。因此,本发明的方法可以用于任何类型的细菌感染的快速诊断,以及选择对细菌敏感的合适的抗生素治疗。诊断细菌感染的传统方法涉及培养板生长约2至5天,因此本发明的方法提供了比现有技术快500至1500倍的诊断细菌感染的方法。 混合物 关于蛋白质混合物讨论了以下方面。然而,本发明的这些方面同样可以应用于蛋白质、肽、寡肽、蛋白质复合物、多肽、亚蛋白质组或蛋白质组的任何混合物及其任何组合。 在一些实施例中,当样本含有或怀疑含有蛋白质混合物时,每种标记的氨基酸类型的氨基酸数目是样本内蛋白质混合物中所有蛋白质中每种标记的氨基酸类型的氨基酸的平均数。优选地,平均值是样本内蛋白质混合物中所有蛋白质中的每种标记的氨基酸类型的氨基酸的平均数。在一些实施例中,平均值是样本内蛋白质混合物中所有蛋白质中的每种标记的氨基酸类型的氨基酸的加权平均数。混合物或蛋白质组内每种蛋白质中每种标记的氨基酸类型的氨基酸数目由蛋白质或蛋白质组的混合物中该蛋白质的级分加权。当计算样本内的蛋白质组或蛋白质混合物的所有蛋白质中的每种标记的氨基酸类型的氨基酸的平均数时,考虑这些权重,并且这些权重还可以用于提供蛋白质混合物的参考,诸如蛋白质的简单混合物。 在优选的实施例中,本发明的方法已经鉴定了多于一种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组存在于样本内。因此,本发明的方法已经鉴定了目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物存在于样本内。样本内存在的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的身份已经经由本发明的方法、经由执行检验2和鉴定每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的蛋白质浓度来确定,使得参考线与样本点之间的垂直(最小)距离小于或等于误差容限ε。如果混合物内组分的数目已知或怀疑为c,则误差容限可以定义为针对每种目的蛋白质β 发现这些距离可以进一步用于鉴定混合物的比例组成。 在一些实施例中,鉴定混合物中每种组分的比例。例如,如果样本含有两种蛋白质的混合物,则确定样本中混合物中每种蛋白质的比例。例如,可以确定样本含有蛋白质A和B的混合物,其中混合物含有90%蛋白质A和10%蛋白质B。这是因为样本的测量值是包含混合物的纯组分(例如纯蛋白质组分,例如蛋白质A和蛋白质B)的参考值之间的平均值。如果样本含有两种蛋白质的混合物;蛋白质A和B,样本的测量值是蛋白质A和蛋白质B的预期值之间的平均值。(垂直)距离越接近纯蛋白质的参考值,混合物内纯蛋白质的比例越大,因此距离被倒置。 在本发明的一些实施例中,混合物的身份是未知的,并且混合物的蛋白质浓度也是未知的。这意味着以下各项均未知:包含混合物的蛋白质的身份、混合物内每种蛋白质的相对比例、混合物的总蛋白质浓度和混合物内每种混合物组分的相对浓度。鉴定和定量混合物涉及将针对未知混合物测量的氨基酸浓度或标记的值与针对未知混合物内可能含有的一系列参考蛋白质测量的氨基酸浓度或标记的值进行比较。在一些实施例中,提供了混合物内存在的蛋白质的数目。在其它实施例中,不提供混合物内存在的蛋白质的数目。每种情况都用扩展的实例来描述。 混合物内存在的蛋白质的数目是已知或可疑的 在一些实施例中,提供了混合物内存在的蛋白质的数目。例如,样本是未知的蛋白质混合物。针对样本的每一维信息测量的原始信号已被转换为氨基酸浓度。因为3种类型的氨基酸被标记,所以有3维信息。图14示出了由参数方程组1提供的针对目的蛋白质1、目的蛋白质2、目的蛋白质3、目的蛋白质4、目的蛋白质5和目的蛋白质6测量的预期氨基酸浓度。 样本点不在任何目的蛋白质的参考线上,因此如本文所描述的执行检验2,并且求每种目的蛋白质的t的值,使得对于每种目的蛋白质,样本点与参考线之间的垂直距离最小化。如本文所描述的计算在蛋白质浓度t下样本点与每条参考线之间的垂直距离,得到6个距离值,D 3个最小距离为D ·通过将最大距离除以所有其它的距离来对距离进行逆归一化。 ·然后,将逆归一化距离相加。 ·最后,通过将其逆归一化距离除以所有逆归一化距离的总和来计算混合物内每种组分的分数。 这被正式地陈述为,来自目的蛋白质的集合p 将该方法应用于该实例,研究人员确定D 因此,基于氨基酸浓度的混合物中目的蛋白质1百分比为 基于氨基酸浓度的混合物中目的蛋白质3的百分比为 基于氨基酸浓度的混合物中目的蛋白质5的百分比为 在一些实施例中,如果为样本和目的参考蛋白质提供测量的标记(例如标记的信号),则使用测量的标记(例如标记的信号)而不是氨基酸浓度执行该步骤。因为测量的标记(例如标记的信号)是常数乘以氨基酸浓度,所以常数在上述除法步骤中抵消,并且获得等效的比例结果,其示出基于氨基酸浓度的混合物内的每种组分的比例。 已经鉴定了每种纯组分(例如纯蛋白质)的表观蛋白质浓度,这是满足检验2的每种纯组分的t的解,使得在样本内鉴定目的蛋白质。然而,混合物内含有纯组分(例如纯蛋白质),因此将t的每个鉴定的解乘以混合物内每种组分的比例以弄清样本内每种组分的蛋白质浓度。目的蛋白质1的t的解是t 未提供混合物内存在的蛋白质的数目 在其它实施例中,混合物内存在的蛋白质的数目是未知或可疑的。在该实施例中,第一步与混合物内存在的蛋白质的数目是已知或可疑的部分和图14中该已知或可疑情况所描述的相同。样本点不在任何目的蛋白质的参考线上,因此如本文所描述的执行检验2,并且求每种目的蛋白质的t的值,使得对于每种目的蛋白质,样本点与参考线之间的距离最小化。如本文所描述的计算在蛋白质浓度t下样本点与每条参考线之间的距离,得到6个距离值,D 在该实例中,ε定义了3维空间中的球体(也称为2-球体)。ε为20。D D 然后应用混合物内存在的蛋白质的数目是已知或可疑的部分中描述的相同方法确定样本内目的蛋白质1和目的蛋白质5的比例。原则是样本的测量值是包含混合物的纯组分(例如纯蛋白质组分)的预期值的平均值。距离越近,混合物内纯组分(例如纯蛋白质)的比例越大,因此距离被倒置。该距离也必须归一化,使得混合物内所有组分的比例总和为1。因此,计算混合物内每种组分的比例: ·通过将最大距离除以所有其它的距离来对距离进行逆归一化。 ·然后,将逆归一化距离相加。 ·最后,通过将其逆归一化距离除以所有逆归一化距离的总和来计算基于氨基酸浓度的混合物内每种组分的分数。 其可以正式陈述为: 将该方法应用于该实例,研究人员确定D 因此,基于氨基酸浓度的混合物中目的蛋白质1百分比为 基于氨基酸浓度的混合物中目的蛋白质5百分比为 在一些实施例中,如果为样本和目的参考蛋白质提供测量的标记(例如标记的信号),则使用测量的标记(例如标记的信号)而不是氨基酸浓度执行该步骤。因为标记的信号是常数乘以氨基酸浓度,所以常数在上述的除法步骤中抵消,并且获得等效的比例结果,其关于基于氨基酸浓度的混合物内每种组分的比例。 已经鉴定了每种纯组分的表观蛋白质浓度,这是满足检验2的每种纯组分的t的解,使得在样本内鉴定目的蛋白质。然而,混合物内含有纯组分,因此将t的每个鉴定的解乘以混合物内每种组分的比例以弄清样本内每种组分的蛋白质浓度。目的蛋白质1的t的解是t 样本的总蛋白质浓度则为0.58×t 确定混合物内每种组分的相对比例和混合物内每种组分的蛋白质浓度的方法是相同的,无论是否怀疑混合物内蛋白质的数目;差异仅仅是作为对该过程的输入,是否基于针对样本测量的值或基于混合物内存在的可疑的蛋白质的数目供应了误差容限。 在特殊情况1中,样本的总摩尔蛋白质浓度是已知的,因此可以计算样本的两种或更多种氨基酸类型的氨基酸数目,并且提供目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中两种或更多种氨基酸类型的数目作为参考。替代地,可以在样本的蛋白质浓度下提供相同的两种或更多种氨基酸类型的氨基酸浓度或标记的值。不需要计算样本点与每种目的蛋白质的参考线之间的最小距离,因为每种目的蛋白质的参考只是n维空间中的点,而不是线。因此,使用如本文所描述的方法计算样本点与每种目的蛋白质的参考点之间的距离,将计算的距离与误差容限ε进行比较,如果怀疑混合物含有c种目的蛋白质,则该误差容限可以是计算的距离的c阶统计量,或基于针对样本测量的值(标记的测量值、氨基酸浓度或氨基酸数目)提供,诸如使用方程10, 例如,怀疑样本含有3种蛋白质,但混合物的组分及其在混合物内的比例是未知的。在样本中标记氨基酸类型W和C,并且确定W和C的氨基酸数目。将样本中W和C的氨基酸数目与每种目的蛋白质中W和C氨基酸的数目进行比较(参见图14)。 目的蛋白质1、目的蛋白质3和目的蛋白质4落入误差容限内,并且因此对包含目的蛋白质1、目的蛋白质3和目的蛋白质4的混合物进行阳性鉴定。这通过正式计算样本点与对应于所有参考蛋白质的点之间的距离(例如欧几里得距离)来确认。 计算每种目的蛋白质的欧几里德距离: 样本至目的蛋白质1:D 样本至目的蛋白质2:D 样本至目的蛋白质3:D 样本至目的蛋白质4:D 样本至目的蛋白质5:D 样本至目的蛋白质6:D 所有测量的距离的集合是β。因为怀疑样本含有3种蛋白质,所以将β的3阶统计量设置为距离阈值D=β 可以基于通过将欧几里德距离测量值逆归一化比较D D 因此,混合物中目的蛋白质1的百分比为 混合物中目的蛋白质3的百分比为 混合物中目的蛋白质4的百分比为 因此,证实样本含有36%蛋白质1、36%蛋白质3和28%蛋白质4。 无论是否是蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的混合物,处理都是相同的。如本文方法中所描述的,适当的参数方程提供了参考蛋白质的氨基酸浓度或信号,以匹配在每种情况下针对样本测量的值。 分类器 在一些实施例中,比较步骤在分类器中进行。在一些实施例中,该方法进一步包含确认分类器中目的蛋白质的存在和/或浓度和/或量的鉴定。 在一些实施例中,样本中目的蛋白质的存在和/或浓度和/或量的阳性鉴定通过将样本的测量的标记、每种标记的氨基酸类型的浓度或每种标记的氨基酸类型的氨基酸数目输入到分类器来确认。如本文所描述的,这是分析地求解参考函数的替代。相反,参考线可以离散化,以提供目的蛋白质、肽、寡肽、多肽、亚蛋白质组或蛋白质组的多种特定蛋白质浓度的信号。例如,存在50种目的蛋白质、在样本中标记和测量的3种氨基酸类型,以及每种目的蛋白质的100种蛋白质浓度。参数方程组1用于50种目的蛋白质中的每一种,以将3种氨基酸类型中的每一种的氨基酸数目乘以100种蛋白质浓度。如果需要,离散化参考线也可以在b维空间中可视化。在该实施例中,t是蛋白质浓度的1x1x100矩阵。将结果存储在大小为50x3x100的数据库中(也可以将矩阵调换为3x50x100矩阵、50x100x3矩阵、3x100x50矩阵、100x50x3矩阵或100x3x50矩阵)。50x3x100矩阵有3个索引,i是目的蛋白质矩阵行的索引,n是氨基酸类型的索引,以及k是蛋白质浓度t的索引。参数方程组1通过生成针对每种目的蛋白质的每种蛋白质浓度测量的氨基酸浓度,通过对每个k=1∶100进行操作,并且然后对每个i=1∶50进行操作来填充该数据库。在n维空间中每种目的蛋白质的每种蛋白质浓度提供了点,这里是3维空间。对应于每种蛋白质浓度下每种目的蛋白质的点存储在数据库中,其索引为(i,:,k)。 机器学习分类器,诸如K为1的K-最近邻(KNN)分类器,可以用于鉴别离样本点最近的单一参考点(特定蛋白质浓度的目的蛋白质)。KNN分类器可以使用各种距离度量,诸如欧几里得距离函数。该KNN分类器确定样本最接近的参考点;目的蛋白质被鉴定为该参考点的索引i,并且蛋白质鉴定被鉴定为该参考点的索引k。例如,样本最接近具有索引i=20,k=40的参考点,然后样本在第40个蛋白质浓度下被鉴定为第20个目的蛋白质。然而,该方法生成比已经描述的分析解法更大量的数据,并且不提供目的蛋白质的蛋白质浓度的精确解。 在一些实施例中,将样本中每种标记的氨基酸类型的测量的标记、每种标记的氨基酸类型的氨基酸数目和/或每种标记的氨基酸类型的浓度输入到分类器以实施蛋白质鉴定和定量。优选地,分类器还含有一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中相同的两种或更多种氨基酸类型的标记、氨基酸数目和/或浓度,从而鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或浓度或量。分类器将样本中每种标记的氨基酸类型的测量的标记、每种标记的氨基酸类型的氨基酸数目和/或每种标记的氨基酸类型的浓度与一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物中相同的两种或更多种氨基酸类型的已知标记值、氨基酸数目和/或浓度进行比较,从而鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或量。在一些实施例中,分类器考虑沿信息的每个维度遇到的实验误差,使得与具有较小实验误差的维度相比,具有较大实验误差的维度在鉴定中可以被给予较小的权重。在一些实施例中,10%的随机噪声被插入到分类器中。 在一些实施例中,分类器是支持向量机分类器。支持向量机分类器找到分离不同类的数据点同时实现不同类的数据点之间的最大分离的超平面。在一些实施例中,分类器是机器学习分类器。在一些实施例中,分类器是K-最近邻分类器。K-最近邻分类器基于其K最近邻来确定点的种类。在一些实施例中,分类器是集成分类器。集成以增强预测的方式组合不同子空间的结果。在一些实施例中,集成分类器是集成子空间K-最近邻分类器。优选地,分类器可以结合非数(NaN)值。 在一些实施例中,分类器已对来自蛋白质、肽、寡肽、多肽、蛋白质复合物或目的蛋白质、肽、多肽、寡肽、亚蛋白质组或蛋白质组的混合物的已知氨基酸序列的氨基酸数目、氨基酸浓度或信号进行训练,从而鉴定一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组,或目的蛋白质、肽、多肽或寡肽、亚蛋白质组或蛋白质组的混合物的存在和/或量。在一些实施例中,对来自参数方程组1、2、3或4的离散输出的子集训练分类器。在一些实施例中,分类器具有根据UniProt内发现的已知氨基酸序列计算的已知值。在一些实施例中,分类器已经对75%的数据进行了训练,并且剩余的25%的数据被保留用于验证。 检测癌症的方法 本文所公开的方法可以用于鉴定样本中多种类型的癌症的存在与否,例如;胰腺癌、人神经胶质瘤、头颈癌、甲状腺癌、肺癌、肝癌、睾丸癌、前列腺癌、胃癌、结肠/直肠癌、乳腺癌、子宫内膜癌、卵巢癌、宫颈癌、肾脏癌、泌尿和膀胱癌、人黑素瘤、脑癌、子宫内膜癌、白血病、泌尿道上皮癌及其任何组合。在优选的实施例中,本文所公开的方法可以用于鉴定以下一种或多种的存在与否:卵巢癌、胰腺癌、结肠直肠癌或前列腺癌;及其任何组合。这是因为不同类型的癌症具有基于两种或更多种氨基酸类型中的每一种的标记值、氨基酸浓度或氨基酸数目的独特蛋白质组学特征。因此,可以将样本中两种或更多种氨基酸类型中的每一种的标记值、氨基酸浓度或氨基酸数目与已知癌症的相同的两种或更多种氨基酸类型的已知标记值、氨基酸浓度或氨基酸数目进行比较,以确定样本中此类癌症的存在和量。例如,本文所公开的方法可以用于以100%敏感性和100%特异性确定血浆中卵巢癌、胰腺癌和结肠直肠癌的存在。附加地,本文所公开的方法可以用于以100%敏感性和100%特异性确定尿中膀胱癌、前列腺癌和肾癌的存在。本文所公开的方法还可以用于确定结肠直肠癌的阶段和位置,其中对于检测结肠直肠癌的阶段具有高达78%的敏感性,并且对于确定结肠直肠癌的位置具有高达100%的阳性预测值。 当讨论目的疾病亚蛋白质组的鉴定时,这也指目的疾病相关蛋白质组的鉴定,反之亦然。 在优选的实施例中,样本中癌症的量是指样本中癌症的阶段。癌症的阶段可以用数字描述,例如阶段0、阶段I、阶段II、阶段III、阶段IV。阶段0描述了原位癌,即其中存在异常细胞的癌前状态。阶段I癌症描述了已经扩散到小区域,例如小于20mm的区域,中的其它组织的癌症。阶段II癌症描述了癌症的局部扩散;癌症已经更显着地扩散,例如扩散到20至50mm之间的区域,有淋巴结转移或扩散到大于50mm的区域,没有淋巴结转移。阶段III癌症描述了癌症的区域性扩散;癌症已经扩散到大于50mm的区域,有弥漫性淋巴结转移。阶段IV癌症描述了癌症的远处扩散;癌症已经扩散到身体的至少一个其它器官。替代地,可以使用TNM分期系统确定阶段,该TNM分期系统提供肿瘤、结节和转移的值,诸如T1、T2、T3、T4、N0、N1、N2、N3、M0或M1。本文所使用的术语“早期”是指癌症的阶段I和II,并且“晚期”是指癌症的阶段III和IV。术语“早期”另外指TNM分期系统内T值为1和2、N值为0和1以及M值为0。如果TNM值中的一个高于所提供的截止点,则在本文所公开的方法中这被认为是晚期癌症。例如,T2N1M0是早期癌症。作为另一实例,T1N0M0是早期癌症。作为另一实例,T3N3M1是晚期癌症。作为附加实例,T2N3M1是晚期癌症。 在优选的实施例中,样本中癌症的量是指癌症是早期(阶段I或II)还是晚期(阶段III或IV)。 在优选的实施例中,样本中癌症的量是指癌症的等级。存在三种癌症的等级:1级、2级和3级。1级癌症由与正常组织类似的分化良好的细胞组成,并且可能缓慢生长和扩散。3级癌症由分化差的细胞组成,缺乏正常的结构和组织模式,并且可能侵袭性地生长和扩散。2级癌症是在1级与3级癌症之间的中间级。尽管通常定性地确定癌症的等级,但在一些实施例中,样本中癌症的量是指已经半定量地或定量地确定的癌症的等级。在本发明的方法中,1级癌症被认为是早期癌症(https://www.cancerresearchuk.org/about-cancer/what-is-cancer/cancer-grading以及https://www.cancerresearchuk.org/about-cancer/what-is-cancer/stages-of-cancer)。 本发明的方法可以用于检测一种或多种类型的癌症的存在与否,只要在患者样本内标记了两种或更多种氨基酸类型、测量的标记的值并且任选地由测量的标记转换为每种标记的氨基酸类型的氨基酸浓度和/或任选地计算患者样本内每种标记的氨基酸类型的氨基酸数目,并且通过将样本中每种标记的氨基酸类型的测量的标记和/或氨基酸浓度与一种或多种浓度的一种或多种目的健康或癌症亚蛋白质组或蛋白质组中的每一种的样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度进行比较,或将样本中每种标记的氨基酸类型的氨基酸数目与一种或多种目的健康或癌症亚蛋白质组或蛋白质组中的样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目进行比较,来鉴定样本中一种或多种目的癌症亚蛋白质组或蛋白质组的存在和/或不存在。 在一些实施例中,使用如本文所公开的方法用实验方法确定与癌症相关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度,或使用本文所公开的方法用实验方法确定与癌症相关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸数目。 在一些实施例中,在比较步骤中,指示与在样本中已标记的氨基酸类型相同的两种或更多种氨基酸类型的已知标记值,和/或氨基酸浓度,和/或氨基酸数目的信息是参考,该信息鉴定一种或多种目的健康或癌症蛋白质组或亚蛋白质组中的每一种的存在和/或浓度和/或量。 在一些实施例中,在与癌症相关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目是参考,并且该参考使用本文所公开的方法用实验方法确定。在一些实施例中,在与癌症相关的一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的每一种的样本中已标记的相同的两种或更多种氨基酸类型的已知标记值和/或氨基酸浓度和/或氨基酸数目是单一参考,并且使用本文所公开的方法用实验方法确定。 该参考可以作为数据库提供,或作为在数据库上执行的操作提供,或该参考可以使用函数、方程、函数组或方程组分析地提供,其提供了针对一种或多种总蛋白质浓度的一种或多种目的健康或癌症亚蛋白质组或蛋白质组测量的值。在一些实施例中,这些函数是向量函数或参数方程组,诸如在向量函数1至4或参数方程组1至4中提供的实例,或它们的任何变体,其包括任何目的癌症或健康亚蛋白质组或蛋白质组的总蛋白质浓度的边界范围,并且穿过N维空间中的不同点。替代地,在其它实施例中,这些函数、方程或方程组可以是任何形式的非线性方程,包括但不限于幂律方程、指数方程、多项式方程、阶梯函数方程。在其它实施例中,这些函数方程或函数组或方程组可以描述表面或体积,该表面或体积鉴定了针对任何目的癌症或健康亚蛋白质组或蛋白质组测量的或将测量的值。 比较步骤可以参考这些函数、方程、函数组或方程组来分析地执行,例如通过求一个或多个样本点与函数、方程、函数组或方程组之间的最小距离来执行,该函数、方程/函数组或方程组定义了在一种或多种目的体液,诸如尿、唾液或血清,中测量的目的癌症或健康蛋白质组或亚蛋白质组的参考。比较步骤可以并入任何假设检验。 替代地或附加地,该比较步骤可以并入机器学习方法,诸如本文所公开的机器学习分类器,以便将测量的样本鉴定为对应于目的癌症或健康亚蛋白质组或蛋白质组。可以使用任何机器学习分类器,优化的或未优化的、单个的、组合的,或通过例如经由本领域已知的任何假设更新方法,诸如贝叶斯(Bayesian)更新,或预测器校正器方法,诸如预测-评价-校正-评价(PECE),来改进的。 本文所公开的本发明的方法可以用于经由测量患者体液内的两种或更多种标记的氨基酸类型检测多种(即多于2种、多于3种、多于4种、多于5种、多于6种、多于7种、多于8种、多于9种或多于10种、多于11种、多于12种、多于13种、多于14种、多于15种、多于16种、多于17种、多于18种、多于19种、多于20种、多于21种、多于22种、多于23种、多于24种、多于25种、多于26种、多于27种、多于28种、多于29种、多于30种,或2、3、4、5、6、7、8、9或10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30种)类型的癌症的存在、阶段和位置。在优选的实施例中,确定选自卵巢癌、胰腺癌、结肠直肠癌、膀胱癌、前列腺癌、肾癌、脑癌、神经胶质瘤、头颈癌、甲状腺癌、肺癌、肝癌、睾丸癌、胃癌、乳腺癌、子宫内膜癌、宫颈癌、肾脏癌、黑素瘤、白血病、儿童白血病和淋巴瘤的癌症类型的存在和/或不存在和/或阶段。在优选的实施例中,本发明的方法用作检测来自患者血浆或患者尿的两种或更多种类型的癌症的存在和/或不存在和/或阶段的液体活检检验。在一些实施例中,可以根据本发明的方法测量和鉴定来自多个患者体液的样本以提供癌症诊断和分期。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有卵巢癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人卵巢癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的卵巢癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的卵巢癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有胰腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人胰腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的胰腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的胰腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有结肠直肠癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人结肠直肠癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的结肠直肠癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的结肠直肠癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自健康人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人健康蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的健康蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的健康蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有前列腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人前列腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的前列腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的前列腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有膀胱癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人膀胱癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的膀胱癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的膀胱癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有肾癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人肾癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的肾癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的肾癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有白血病的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人白血病蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的白血病蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的白血病蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有黑素瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人黑素瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的黑素瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的黑素瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有神经胶质瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人神经胶质瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的神经胶质瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的神经胶质瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有淋巴瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人淋巴瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的淋巴瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的淋巴瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有胃癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人胃癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的胃癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的胃癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有肺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人肺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的肺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的肺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有脑癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人脑癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的脑癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的脑癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有乳腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人乳腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的乳腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的乳腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有头颈癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人头颈癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的头颈癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的头颈癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有甲状腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人甲状腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的甲状腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的甲状腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有子宫内膜癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人子宫内膜癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的子宫内膜癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的子宫内膜癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有泌尿道上皮癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的泌尿道上皮癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期卵巢癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期卵巢癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期卵巢癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期卵巢癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期胰腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期胰腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期胰腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期胰腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期结肠直肠癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期结肠直肠癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期结肠直肠癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期结肠直肠癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期前列腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期前列腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期前列腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期前列腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期膀胱癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期膀胱癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期膀胱癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期膀胱癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期肾癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期肾癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期肾癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期肾癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期白血病的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期白血病蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期白血病蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期白血病蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期黑素瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期黑素瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期黑素瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期黑素瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期神经胶质瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期神经胶质瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期神经胶质瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期神经胶质瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期淋巴瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期淋巴瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期淋巴瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期淋巴瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期胃癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期胃癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期胃癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期胃癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期肺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期肺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期肺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期肺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期脑癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期脑癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期脑癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期脑癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期乳腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期乳腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期乳腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期乳腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期头颈癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期头颈癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期头颈癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期头颈癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期甲状腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期甲状腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期甲状腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期甲状腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期子宫内膜癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期子宫内膜癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期子宫内膜癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期子宫内膜癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有早期泌尿道上皮癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人早期泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的早期泌尿道上皮癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的早期泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期卵巢癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期卵巢癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期卵巢癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期卵巢癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期胰腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期胰腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期胰腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期胰腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期结肠直肠癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期结肠直肠癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期结肠直肠癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期结肠直肠癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期前列腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期前列腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期前列腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期前列腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期膀胱癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期膀胱癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期膀胱癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期膀胱癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期肾癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期肾癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期肾癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期肾癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期白血病的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期白血病蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期白血病蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期白血病蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期黑素瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期黑素瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期黑素瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期黑素瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期神经胶质瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期神经胶质瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期神经胶质瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期神经胶质瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期淋巴瘤的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且可以使用人尿蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期淋巴瘤蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期淋巴瘤蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期淋巴瘤蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期胃癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期胃癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期胃癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期胃癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期肺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期肺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期肺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期肺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期脑癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期脑癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期脑癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期脑癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期乳腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期乳腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期乳腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期乳腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期头颈癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP_50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP_50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期头颈癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期头颈癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期头颈癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期甲状腺癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期甲状腺癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期甲状腺癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期甲状腺癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期子宫内膜癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期子宫内膜癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期子宫内膜癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期子宫内膜癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在一些实施例中,目的蛋白质组和/或亚蛋白质组来自患有晚期泌尿道上皮癌的人受试者的样本。在一些实施例中,使用的样本是人血浆,并且可以使用人血浆蛋白质组或其亚蛋白质组。在一些实施例中,目的蛋白质组是人贫血小板血浆(PPP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的贫血小板血浆(PPP 50)亚蛋白质组。在一些实施例中,目的蛋白质组是富血小板血浆(PRP)蛋白质组。在一些实施例中,目的亚蛋白质组是人过滤的富血小板血浆(PRP 50)亚蛋白质组。在一些实施例中,使用的样本是人血清,并且可以使用人血清蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人痰,并且可以使用人痰蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人粪便,并且可以使用人粪便蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人脑脊液,并且可以使用人脑脊液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人汗液,并且可以使用人汗液蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人尿,并且人尿蛋白质组或其亚蛋白质组可以。在一些实施例中,使用的样本是人唾液,并且可以使用人唾液蛋白质组或其亚蛋白质组。在一些实施例中,多种不同的蛋白质组和/或亚蛋白质组样本类型可以提供目的人晚期泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考,这些不同的蛋白质组和/或亚蛋白质组样本类型中的每一种可以针对给定的患者测量,并且目的晚期泌尿道上皮癌蛋白质组和/或亚蛋白质组的存在与否可以基于测量的标记值、氨基酸浓度或氨基酸数目与目的晚期泌尿道上皮癌蛋白质组和/或亚蛋白质组的参考标记值、氨基酸浓度或氨基酸数目的比较来鉴定。在一些实施例中,使用的样本是人宫颈粘液或人月经,并且可以使用人宫颈粘液蛋白质组或其亚蛋白质组,或人月经蛋白质组或其亚蛋白质组。在一些实施例中,使用的样本是人羊水,并且可以使用人羊水蛋白质组或亚蛋白质组。 在优选的实施例中,样本是血浆样本。在优选的实施例中,样本是尿样本。 在一些实施例中,本文所公开的方法可以用于鉴定样本中癌症的阶段。例如,本文所公开的方法可以用于鉴定样本中存在的癌症是阶段I、阶段II、阶段III还是阶段IV。这是因为癌症的每个阶段具有独特的蛋白质组学特征。 在一些实施例中,本文所公开的方法可以用于鉴定癌症的类型和阶段。例如,本发明的方法可以用于鉴定结肠直肠癌的存在及其是早期(阶段II)还是晚期(阶段III)。 在一些实施例中,本文所公开的方法可以用于检测癌症的位置。例如,在一些实施例中,该方法可以用于检测结肠直肠癌的位置。例如,本文所公开的方法可以用于基于血浆蛋白质组学特征鉴定肿瘤特异地位于患者的右结肠而不是其左结肠或直肠。这是因为不同类型的癌症具有基于两种或更多种氨基酸类型中的每一种的标记值、氨基酸浓度或氨基酸数目的独特蛋白质组学特征。这是因为癌症的位置具有独特的蛋白质组学特征。 在一些实施例中,参考是每种目的蛋白质组(例如健康患者的贫血小板血浆(PPP)样本、卵巢癌血浆样本、胰腺癌血浆样本、结肠直肠癌血浆样本)。在一些实施例中,使用来自人类蛋白质图谱、人类肽图谱和/或Proteome Xchange的数据用实验方法确定参考。 在一些实施例中,本文所公开的方法的比较步骤使用机器学习分类器。机器学习分类器确认癌症的类型、阶段和/或位置。在一些实施例中,机器学习分类器是线性支持向量机(SVM)。 在一些实施例中,本文所公开的方法可以用于检测液体活检样本中癌症的存在、类型、阶段和位置。 当在本说明书和权利要求中使用时,术语“包含(comprises)”和“包含(comprising)”及其变型意味着包括指定的特征、步骤或整数。这些术语不应被解释为排除其它特征、步骤或组分的存在。 在前述说明书,或下面的权利要求,或附图中公开的,以它们的特定形式或按照用于执行所公开的函数的手段,或用于获得所公开的结果的方法或过程来表达的特征,在适当时,可以单独地或以此类特征的任何组合,用于以其不同的形式实现本发明。 虽然已经描述了本发明的某些示例性实施例,但是所附权利要求的范围并不旨在仅限于这些实施例。权利要求应被解释为字面上地、有目的地,和/或涵盖等同物。 工作实例 在以下实例中进一步描述本发明,这些实例不限制权利要求中描述的本发明的范围。 实例1 标记两种或更多种氨基酸类型 在pH 7下,在5mM HEPES缓冲液中用10mM的三(2-羧乙基)膦(TCEP),随后在pH10.5下,在80mM碳酸钠缓冲液中用5mM 4-氟-7-氨磺酰基苯并呋喃(ABD-F)、4%十二烷基硫酸钠(SDS)标记氨基酸类型半胱氨酸(C)的氨基酸。 在pH 10.5下,在80mM碳酸钠缓冲液中用5mM 4-氟-7-氨磺酰基苯并呋喃(ABD-F)、4%十二烷基硫酸钠(SDS)标记氨基酸类型还原的半胱氨酸(C 在pH 7下,在5mM HEPES中用0.2M三氯乙醇(TCE)、10mM TCEP、4%SDS标记氨基酸类型色氨酸(W)的氨基酸。 在pH 10.5下,在200mM碳酸钠缓冲液中用12mM邻苯二甲醛(OPA)、18mMβ-巯基乙醇(BME)、4%SDS标记氨基酸类型赖氨酸(K)的氨基酸。 荧光标记反应中的每一个的化学机理如图16所示。 除了在-20℃下存储的ABD-F和TCEP溶液之外,将标记溶液避光并且在4℃下存储。 蛋白质溶液 制备以下蛋白质溶液: 牛血清白蛋白(BSA):在pH.7下,1BSA于5mM HEPES缓冲液中 卵清蛋白(OVA):在pH.7下,2μM OVA于5mM HEPES缓冲液中 β-乳球蛋白(β-Lac,Beta-Lac):在pH.7下,4μMβ-Lac于5mM HEPES缓冲液中溶菌酶(LYZ):在pH.7下,5μM LYZ于5mM HEPES缓冲液中 以1∶1的比率制备以下混合物蛋白质溶液: 50μL 1μM BSA+50μL 2μMβ-乳球蛋白 测量荧光强度 使用BMG板读取器执行反应。使用UV透射(康宁(Corning)3370)96孔板,其中每孔100μL蛋白质溶液。在所有情况下,将100μL染料溶液添加到蛋白质溶液中用于1∶1稀释(至以上列出的最终蛋白质浓度)。因为C 对于色氨酸修饰反应,将100μL的色氨酸标记溶液添加到每种蛋白质溶液(也是100μL)中。通过用UV光照射30分钟来光催化该反应。使用以约320nm为中心的广谱UV光。照射30分钟后,通过使用350-10和480-10激发和发射过滤器测量荧光来确定新形成的荧光团的荧光。 对于赖氨酸反应,在混合样本和染料溶液后迅速测量荧光。在混合试剂后3秒测量荧光以提供最佳结果。 对于半胱氨酸反应,将1μL的1mM TCEP储备溶液添加到每个100μL蛋白质孔,使总TCEP浓度为10mM。允许该反应在避光的情况下进行30分钟,以允许二硫化物键合的半胱氨酸氨基酸类型的氨基酸的TCEP还原在这些氨基酸被荧光染料修饰之前达到完成。将100μL半胱氨酸染料溶液(与还原的半胱氨酸染料溶液相同)添加到每个孔中,同时在3个对照孔中将染料添加到缓冲液。将孔内的反应避光培养45分钟的时间,并且然后使用350-10和480-10激发和发射过滤器读取荧光。 对于还原的半胱氨酸反应,将100μL的还原的半胱氨酸染料溶液添加到每个孔中,同时在3个对照孔中将染料添加到缓冲液。将孔内的反应避光培养45分钟的时间,并且然后使用350-10和480-10激发和发射过滤器读取荧光。 背景校正 任选地,可以从样本的荧光强度中减去荧光背景。为了计算荧光背景,将染料溶液与等量的缓冲液而不是蛋白质组合,并且使用在测量荧光强度部分下提供的参数测量荧光强度以计算荧光背景。例如,测量以下荧光背景: C=2177.5;W=20632;C 可以从样本的测量的荧光中减去荧光背景以产生“背景校正的”荧光强度。 校准曲线或标准 校准曲线或标准是通过将未知的与一组已知浓度的标准样本或一个标准样本进行比较来确定未知样本中的物质浓度的一般方法。通过测量已知氨基酸浓度的蛋白质的荧光强度,计算每种标记的氨基酸类型的校准曲线。这建立了以任意单位(AU)测量的荧光强度与氨基酸浓度之间的关系。还通过测量已知氨基酸浓度的蛋白质的荧光强度计算每种标记的氨基酸类型的标准。针对每种氨基酸类型测量一次校准曲线或标准,覆盖执行的所有实验,而不是包含测量样本的每个实验的一部分。 在每种情况下,将测量的荧光强度绘制为每种氨基酸类型的已知氨基酸浓度的函数。 测量的数据是线性的。执行线性最小二乘拟合,得到校准曲线的以下最佳拟合方程: 方程1:C荧光强度(AU)=705.1AU/μM×C AA浓度(μM) 方程2:C 方程3:W荧光强度(AU)=2362AU/μM×W A.A浓度(μM)+9859AU 方程1至3允许将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的每种氨基酸类型的氨基酸(A.A.)浓度转换为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的每种氨基酸类型的标记的已知值。 对于C氨基酸类型,校准因子被确定为最佳拟合线的斜率。 fc=705.1AU/μM 对于C 对于W氨基酸类型,校准因子被确定为最佳拟合线的斜率加上最佳拟合线的y截距。 f 这意味着当将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的W氨基酸类型的氨基酸浓度转换为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的W氨基酸类型的标记的对应已知值时,将W氨基酸浓度乘以2362,并且然后加9859。加9859与W氨基酸浓度无关。 校准曲线的倒数提供了以下逆最佳拟合方程: 方程4: 方程5: 方程6: 方程4至6允许将每种氨基酸类型的标记的测量的信号(荧光强度,AU)转换为样本中对应氨基酸类型的氨基酸(A.A.)浓度。 对于C氨基酸类型,校准因子被确定为线的斜率。 f 对于C 对于W氨基酸类型,校准因子被确定为线的斜率加上线的y截距。 f 这意味着W氨基酸类型的氨基酸浓度乘以2362,然后加9859以提供W氨基酸类型的标记的已知值。 替代地,可以针对每种氨基酸类型计算标准。在这种情况下,已知氨基酸浓度的单一蛋白质的荧光强度用于建立氨基酸浓度与该氨基酸类型的荧光强度之间的关系。例如,测量K氨基酸类型的标准。 含有120μM K氨基酸浓度(钙调蛋白)的标准溶液具有86390AU的荧光强度。因此,目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组中的氨基酸类型K的标记的已知值是86390AU/120uM,其提供了校准因子 f 参考 如本文所公开的,每种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的参考经由向量函数(或参数方程组)作为其蛋白质浓度的函数提供。向量函数1用于目的蛋白质,其中样本的值是两种或更多种标记的氨基酸类型的氨基酸浓度,并且向量函数2用于目的蛋白质组,其中样本的值是两种或更多种标记的氨基酸类型的氨基酸浓度。当样本的值是两种或更多种标记的氨基酸类型的标记的测量值时,向量函数3用于目的蛋白质,并且当样本的值是两种或更多种标记的氨基酸类型的标记的测量值时,向量函数4用于目的蛋白质组。 本文对每个向量函数(相当于参数方程组)进行了全面描述,并且向量函数再现如下: 向量函数1是: 其中p 向量函数2是: 其中p 向量函数3是: 其中p 向量函数4是: 其中p 目的蛋白内氨基酸类型的氨基酸数目计算为该氨基酸类型在目的蛋白质的一个或多个氨基酸序列内出现的数目减去该氨基酸类型的翻译后修饰的数目,该翻译后修饰将阻止该氨基酸类型与标记反应。例如,对于C氨基酸类型,氨基酸的数目是未修饰的(C 对于目的蛋白质组,计算包含目的蛋白质组的所有蛋白质、肽、寡肽、多肽和/或蛋白质复合物的氨基酸的加权平均数。氨基酸的加权平均数计算为每蛋白质、肽、寡肽、多肽或蛋白质复合物的氨基酸数目乘以目的蛋白质组内该蛋白质、肽、寡肽、多肽或蛋白质复合物的比例的线性组合。 通常不可能测量未知样本的每蛋白质的氨基酸数目,因为未知样本的摩尔蛋白质浓度是未知的(作为本领域用于确定这一点的标准方法,诸如经由A280,依赖于蛋白质序列比消光系数,当蛋白质身份未知时,该比消光系数是不可获得的)。然而,如果样本的摩尔蛋白质浓度是已知的,参考可以替代地作为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的两种或更多种氨基酸类型的氨基酸的数目/加权平均数提供。 样本的测量值与由参考提供的值的比较 样本的测量值(两种或更多种氨基酸类型的标记的值、氨基酸浓度、氨基酸数目)总是提供点,对于样本中标记和测量的n种氨基酸类型,该点可以任选地在n维空间中可视化。比较步骤涉及将样本的测量点与为一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组提供的参考线进行比较,并且评价样本点与参考线之间的最短距离是否为零,或是否小于或等于误差容限。如果样本点与参考线之间的最短距离小于或等于误差容限,则在样本内鉴定目的蛋白质、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的存在,并且其浓度由提供到样本点的最短距离的参考线上的精确点(浓度)确定。 线与点之间的最短距离总是线与点之间的垂直距离。这是因为点与线之间除了90度以外的任何其它角度将形成斜边,其长度将总是大于垂直距离。 这是通过求参考线的方向与样本点和参考线上的任何点之间的向量的点积,将点积设置为等于0,并且求解参考线的浓度来实现的,该浓度提供了样本点与参考线之间的垂直线。点积是表示两个向量A和B之间的角度关系的标量值,即A·B=|A|*|B|*cosθ其中值|A|和|B|分别表示向量A和B的长度,并且θ是两个向量之间的角度。如果A和B垂直(即彼此成90度),则点积为零,因为cos 90°为零。计算样本点与参考线之间的距离,并且如果该距离小于或等于误差容限,则将目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组鉴定为以提供垂直(最小)距离的参考线上的蛋白质浓度存在。 本文所使用的比较方法总结在以下方法中: 1.令R为目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组pi的参考线,并且令S为样本点以求距离其的最短距离 2.在向量格式中求参考线R的方程 3.求参考线R上的点P的一般方程 4.求点P在参考线R上的精确位置,称为Q,使得从S到P的向量垂直于R。这意味着求参考线R上的点Q,使得S和Q之间的向量得到垂线。这是通过求从S到P的向量与R的方向的点积(·),将其设置为等于0,并且求解t以提供t的值而实现的,当将该值代入R上的点P的一般方程中时,产生垂直向量。如果样本内含有目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 5.使用称为D的距离公式求Q和S之间的距离。 6.评价D是否小于误差容限ε。 7.如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 8.如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 对参考线的一般向量函数执行以下计算、解释和概述: 例如,目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 其可以替代地写为R=<0,0,...,0〉+t 参考线上的点(P)的一般方程是 P=<0+c 测量的样本点(S)具有坐标S=(S 从测量的样本点(S)到参考线上的任何点(P)的向量是P-S P-S= 为了使该向量垂直,该向量与参考线 c c c t(c 并且针对t求解方程。该t的解是目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 为了确定目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p Q=P(t)。 P=<0+c Q是点,它是对应于t的解的参考的值的集合。S也是点。 使用距离公式确定S与Q之间的距离D。 在本文提供的工作实例中使用点S与点Q之间的欧几里德距离公式。 该方程变为 ε是误差容限。根据两种方法中的一种提供误差容限。在第一种方法中,如果不怀疑所含样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的数目,则使用公差乘以样本值平方的平方根来提供误差容限,反映距离计算。这由方程7提供: 其中ε是误差容限, 在第二种方法中,怀疑所含样本中一种或多种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、多肽、蛋白质复合物、亚蛋白质组或蛋白质组的数目。怀疑样本含有k种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、多肽、蛋白质复合物、亚蛋白质组或蛋白质组。在该方法中,对计算的垂直距离进行排序,并且将第k个最小值(k阶统计量)设置为误差容限,使得样本中k种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、多肽、蛋白质复合物、亚蛋白质组或蛋白质组具有小于或等于误差容限的垂直距离。正式地,k阶统计量是计算出的垂直距离的第k个最小(第k个最小)值。例如,样本点与每条参考线之间的所有垂直距离的集合是β,并且β的k阶统计量是β 因此,在参考数据库中对于c种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组的D≤ε,并且因此在样本中鉴定c种目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组 如果D>ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 如果D≤ε,则目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 样本内存在的目的蛋白质、肽、寡肽、多肽、蛋白质复合物、蛋白质组或亚蛋白质组p 实例1中描述的方法现在应用于附加实例中。 实例2-基于氨基酸浓度确定样本中蛋白质、肽、寡肽、多肽或蛋白质复合物的存在和/或浓度和/或量 获得用于检验的样本。怀疑样本可能含有未知的蛋白质、肽、寡肽、多肽或蛋白质复合物。样本的浓度是未知的。对样本进行一次测量。 使用实例1中概述的荧光染料对C和W氨基酸类型进行荧光标记。 使用BMG板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度。 获得的原始荧光强度值为: C=31191AU;W=34576AU 获得的原始荧光强度值如实例1所概述的进行背景校正。获得的背景校正的荧光强度值为: C=2177.5AU;W=20632AU 如实例1中概述的,使用下式将背景校正的荧光强度值转换为氨基酸浓度 /> 这提供了对样本测量的以下氨基酸浓度: 样本读数(S) [C(μM)][W(μM)] 41.151.73 氨基酸类型C是氨基酸类型1,a 将针对样本测量的氨基酸浓度,其为2维空间中的点,与针对以下目的肽、蛋白质、寡肽、多肽和蛋白质复合物的选择而提供的参考线进行比较。实例1中进行的方法的结果提供在下表中。 表5:实例1的结果 执行检验2。怀疑样本含有1种目的蛋白质、肽、寡肽、多肽或蛋白质复合物,因此计算的欧几里得距离(D)的最小值计算为0.62。误差容限被设置为等于ε=0.62。如果D≤ε,目的蛋白质、肽、寡肽、多肽或蛋白质复合物被鉴定为存在于样本内。对于BSA,D≤ε。因此,在样本中鉴定了BSA的存在。样本中BSA的浓度是提供满足假设检验的解的BSA浓度。这是1.17μM。将该浓度乘以样本的体积(200μL)以获得样本内存在的BSA的量。结果总结于下表中: 实例3-基于氨基酸浓度确定样本中蛋白质、肽、寡肽、多肽或蛋白质复合物的存在和/或浓度和/或量 获得用于检验的样本。怀疑样本可能含有实验室蛋白质。样本的身份和浓度是未知的。 使用实例1中概述的荧光染料对K和W氨基酸类型进行荧光标记。 使用平板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度。 获得的原始荧光强度值如实例1所概述的进行背景校正。获得的背景校正的荧光强度值为: K=41804AU;W=29865AU 如实例1中概述的,将背景校正的荧光强度值转换为氨基酸浓度,其提供以下氨基酸浓度: K(μM) 58.07 W(μM) 8.47 选择公差值为 使用所描述的方法(检验2),将针对样本测量的氨基酸浓度,其为2维空间中的点,与针对以下实验室蛋白质的选择提供的参考线进行比较。 表6:实例3的结果 提供误差容限为1.76μM。如果D≤ε,目的蛋白质、肽、寡肽、多肽或蛋白质复合物被鉴定为存在于样本内。 仅针对β-Lac,D≤ε。因此,在样本中鉴定了β-Lac的存在。样本中β-Lac的浓度是β-Lac的浓度,其提供了满足检验2的解。这是3.88μM。将该浓度乘以样本的体积(200μL)以获得样本内存在的BSA的量。结果总结于下表中: 实例4-基于标记的值确定样本中蛋白质、肽、寡肽、多肽或蛋白质复合物的存在和/或浓度和/或量 获得用于检验的样本。怀疑样本可能含有实验室蛋白质。样本的身份和浓度是未知的。 使用实例1中概述的荧光染料对K和C氨基酸类型进行荧光标记。 使用平板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度。 获得的原始荧光强度值如实例1所概述的进行背景校正。 K FI24448a C FI28413a 然而,背景校正的荧光强度值没有转换为氨基酸浓度。相反,根据基于向量函数3的K(a 表7:实例4的结果 怀疑该样本含有单一目的蛋白。因此,鉴定样本中目的蛋白质的存在,其给出最小的垂直距离。这是LYZ。样本中鉴定的LYZ的浓度是浓度sol t,其提供垂直距离的该最低值。这是4.95μM。 实例5-基于标记的值确定样本中蛋白质、肽、寡肽、多肽或蛋白质复合物的存在和/或浓度和/或量 获得用于检验的样本。怀疑样本可能含有目的蛋白质、肽、寡肽、多肽或蛋白质复合物。样本的身份和浓度是未知的。 使用实例1中概述的荧光染料对K和C氨基酸类型进行荧光标记。 使用平板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度。 获得的原始荧光强度值如实例1所概述的进行背景校正。 获得以下背景校正的荧光强度值: 这些背景校正的荧光强度值未转换为氨基酸浓度或氨基酸数目;相反,使用向量函数3生成目的蛋白质、肽、寡肽、多肽和蛋白质复合物的大数据库的K、C和W氨基酸类型的标记的已知值,并且应用假设检验2。 表8:实例5的结果 怀疑样本含有一种目的蛋白质、肽、寡肽、多肽或蛋白质复合物,因此将误差容限定义为垂直距离的最小值,使得只有最接近样本点的目的蛋白质、肽、寡肽、多肽或蛋白质复合物被鉴定为存在于样本中。垂直距离的最小值为5235。因此,在提供的该垂直距离为0.99μM的蛋白质浓度下鉴定样本中BSA的存在。 实例6-确定样本中多于一种目的蛋白质的存在和/或浓度和/或量 获得用于检验的样本。怀疑样本可能含有一种或多种目的蛋白质、肽、寡肽、多肽或蛋白质复合物。样本的身份和浓度是未知的。 使用实例1中概述的荧光染料对C和W氨基酸类型进行荧光标记。 使用平板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度。原始荧光强度为: C=24130AU;W=36947AU 获得的原始荧光强度值如实例1所概述的进行背景校正以提供以下背景校正的荧光强度: C=21679AU;W=16891AU 已知氨基酸浓度的标准用于在C氨基酸类型的标记的测量的信号与C氨基酸类型的氨基酸浓度之间转换,并且已知氨基酸浓度的标准用于在C氨基酸类型的标记的测量的信号与C氨基酸类型的氨基酸浓度之间转换。含有6μM C氨基酸浓度(卵清蛋白)的标准溶液具有1322AU的荧光强度,因此荧光强度(AU)与μM氨基酸浓度之间的转换由6uM/1322.4AU=4.54×10 将针对样本测量的荧光强度转换为以下氨基酸浓度: 16.39μM C;2.45μM W。 该样本点是(16.39,2.45)。 C氨基酸类型是氨基酸类型1(a 向量方程1用于提供氨基酸浓度,定义为各种目的蛋白质的蛋白质浓度t的函数,每个蛋白质具有参考线R。 表9:实例6的结果 执行实例1中所描述的比较步骤,得到所提供的垂直距离值(D)。 怀疑样本含有2种目的蛋白质,因此将误差容限设置为垂直距离的第二最小值3.8,使得仅对于BSA和βLac为D≤ε。 2种目的蛋白质被鉴定为存在于混合物中,并且它们的垂直距离值的比较鉴定了混合物内组分的比例。具体地,原则是样本的测量值是包含混合物的纯组分(例如纯蛋白质)的预期值的平均值。距离越近,混合物内纯组分(例如纯蛋白质)的比例越大,因此垂直距离被倒置。该垂直距离也必须归一化,使得混合物内所有组分的比例总和为1。因此,计算混合物内每种组分的比例: ·通过将最大距离除以所有其它的距离来对距离进行逆归一化。 ·然后,将逆归一化距离相加。 ·最后,通过将其逆归一化距离除以所有逆归一化距离的总和来计算混合物内每种组分的分数。 这应用如下: 然后,将混合物内每种组分的比例乘以纯组分的确定的蛋白质浓度(sol t),以求混合物内该组分的浓度。 该样本被鉴定为含有BSA和βLac的混合物,其包含0.34μM BSA和0.84μMβLac。 实例7-使用两种氨基酸类型确定整个人血浆蛋白质组(>3000种目的蛋白质)内目的蛋白质的存在和/或浓度和/或量 从人血浆获得样本。样本的身份和浓度是未知的。如实例1所概述的标记C(a C和K氨基酸类型的原始荧光强度如实例1所描述的进行背景校正。测量的背景校正的荧光强度为: C 如实例1所描述的,将背景校正的荧光强度转换为氨基酸浓度。计算的氨基酸浓度为: C 使用本文所描述的方法,生成3263-蛋白质人血浆蛋白质组内所有蛋白质的参考数据库。 在工作实例中包括整个数据库是不实际的,但是在下面的表10中示出了每50行的代表性行。 计算样本点与每种目的蛋白质的参考线之间的距离,并且求其对应蛋白质浓度。将每种蛋白质浓度与可公开获得的目的蛋白质的上限(UB)和下限(LB)浓度范围进行比较。从公开可获得的蛋白质图谱数据库访问该浓度范围。浓度范围的下限设置为所提供浓度的0.9倍,并且浓度范围的上限设置为所提供浓度的1.1倍。如前所述,应用本发明的方法,并且使用所描述的垂直距离方法确定每种目的蛋白质(如果存在于样本中)的蛋白质浓度t。如果LB<t<UB,则参考数据库的行接收1作为逻辑输出。矩阵内的LB、t和UB列被突出显示。在代表性的行表示中,没有目的蛋白质在它们的浓度界限内(因此没有1逻辑输出)。 表10:实例7的结果 然后,对矩阵进行过滤以仅示出LB<t<UB的行。将计算的距离与误差容限进行比较。 表11:继续实例7的结果 不怀疑样本内含有的目的蛋白质数目,因此基于公差值为0.03,根据方程7供应的误差容限为38.93。仅VCL具有D≤ε,因此在14.45nM的蛋白质浓度下在样本(来自3263种目的蛋白质、肽、寡肽、多肽和蛋白质复合物的参考组)内鉴定了目的蛋白质VCL。 通过将由本发明的方法确定的蛋白质浓度(如果目的蛋白质存在于样本中)与变化超过10个数量级的丰富数据集进行比较,该策略排除了涉及多于一种目的蛋白质的参考线(R)的任何实例。 实例8-确定样本中目的(SARS-CoV-2或A型流感)蛋白质组的存在和/或浓度和/或量 3名患者出现干咳、疲劳、肌肉疼痛和发热。症状表现为普通流感或早期冠状病毒。目的是快速确定每个患者具有什么感染,如果有的话,并且确定每个个体中病原体的丰度,以允许评估每个个体患者如何侵袭性地传播感染和/或预测宿主对病毒的响应,从而可以开出适当的治疗处方。 经由本领域已知的方法收集来自每个患者的样本。这可以包括血液样本、鼻拭子、鼻咽吸出物或下呼吸道粘液吸出物样本。如果适当的话,将样本稀释到缓冲液或载体溶液中,并且通过本领域已知的方法如离心、超速离心、琼脂糖凝胶电泳或柱色谱法分离以分离对应于病毒颗粒大小(直径约80至350nm)的级分。还可以使用本领域已知的方法诸如冻干或纤维素膜浓缩器浓缩样本。样本的身份是未知的。样本的(蛋白质)浓度是未知的,并且任何稀释液内含有的(蛋白质)浓度是未知的。 经由本领域已知的方法溶解该病毒级分,诸如使用十二烷基硫酸钠(SDS)+/-EDTA。 2种氨基酸类型;K和C,或C和W,或K和W使用实例1中概述的荧光染料进行荧光标记。 2种氨基酸类型;K和C,或C和W,或K和W中的每一种的所有氨基酸使用实例1中概述的荧光染料进行荧光标记。氨基酸类型的这些组合中的每一种的诊断结果示出于本实例中。 使用平板读数器测量标记的每种氨基酸类型的每种荧光染料的荧光强度,并且如实例1中概述的校正背景。背景校正的荧光强度(FI)值为: C和K C和W K和W 使用线性拟合根据荧光强度确定每个患者样本中两种氨基酸类型(K和C、C和W,或K和W)的荧光强度。如实例1中概述的,基于校准曲线计算线性拟合,该校准曲线将标记的氨基酸的已知浓度与荧光强度联系起来。 例如,如实例1中概述的和具体的方程4,患者1的C氨基酸浓度通过将患者1的测量的C FI除以705.1AU/μM来确定。 这为患者1提供了0.288μM的C氨基酸浓度,其为288nM。 作为另一实例,通过将患者1的背景校正的荧光强度乘以实例1中提供的校准因子的倒数来确定患者1的K氨基酸浓度。 因此,患者1的K氨基酸浓度为0.545μM,其为545nM。 作为另一实例,通过从测量的荧光强度中减去9859AU,并且除以2362AU/μM来确定患者1的W氨基酸浓度,如由方程6提供的, 方程6: 这给出106μM W氨基酸浓度,其为106nM W氨基酸浓度。 以这种方式确定的患者1、2和3的两种标记的氨基酸类型的三种组合中的每一种的氨基酸浓度如下所示。 C和K C和W K和W 基于公开可获得的蛋白质序列,该蛋白序列构成A型流感H1N1和SARS-CoV-2(a.k.a.2019-nCoV)蛋白质组,确定A型流感蛋白质组中K和C氨基酸的加权平均数为24.00K和7.18C,而SARS-CoV-2蛋白质组中K和C氨基酸的加权平均数为60.57K和31.36C。使用等式12提供权重: 其中w 在替代实施例中,确定A型流感蛋白质组中C和W氨基酸的平均数为7.18C和6.91W,而SARS-CoV-2蛋白质组中C和W氨基酸的平均数为31.36C和11.29W。在替代实施例中,确定A型流感蛋白质组中K和W氨基酸的平均数为24.00K和6.91W,而SARS-CoV-2蛋白质组中K和W氨基酸的平均数为60.57K和11.29W。 对于两个目的蛋白质组,以及对于2种氨基酸类型的所有组合,这些值提供了向量函数2中的w1和w2。 例如,目的SARS-CoV-2蛋白质组的向量函数2,其中K氨基酸类型是w1,并且W氨基酸类型是w2,是 而目的A型流感蛋白质组的向量函数2是 这些向量函数定义了目的SARS-CoV-2和A型流感H1N1蛋白质组的参考(向量)线。执行实例1的检验2中所描述的方法,其中经由点积确定从样本点到参考线的垂直距离,揭示参考线上的最近点和参考线上的浓度。如果垂直距离小于或等于误差容限,则将目的SARS-CoV-2和/或A型流感H1N1蛋白质组鉴定为存在于患者样本中。 下面提供了每个患者和每个实施例(C和K、C和W,或K和W)的结果。 C和K C和W K和W 所有实施例(C和K、C和W,以及K和W)的参考函数的结果绘制在n维空间中(参见图17)。 在本实例的所有实施例中,选择10.0的误差容限。这反映了对大量患者群体的实验结果。替代地,可以使用方程10定义误差容限,或者如果怀疑样本内存在k种目的蛋白质组,则将距离的第k个最小值设置为误差容限。 对于以下情况,D≤ε C和K 患者1,存在SARS-CoV-2蛋白质组,浓度为9.04nM 患者2,存在SARS-CoV-2蛋白质组,浓度为5.13nM 患者3,存在A型流感蛋白质组,浓度为22.19nM C和W 患者1,存在SARS-CoV-2蛋白质组,浓度为9.04nM 患者2,存在SARS-CoV-2蛋白质组,浓度为5.13nM 患者3,存在A型流感蛋白质组,浓度为22.19nM K和W 患者1,存在SARS-CoV-2蛋白质组,浓度为9.01nM 患者2,存在SARS-CoV-2蛋白质组,浓度为5.08nM 患者3,存在A型流感蛋白质组,浓度为22.06nM 在本实例的所有实施例中,患者1和2对SARS-CoV-2的检验呈阳性,并且患者3对A型流感的检验呈阳性。患者1的SARS-CoV-2蛋白质组的(蛋白质)浓度显著高于患者2。这可以被认为是病毒载量的量度,因为当病毒被溶解时,较高浓度的病毒导致较高的病毒蛋白质总浓度。因此可以得出结论,患者2具有比患者1更高的SARS-CoV-2病毒散发,并且比患者1具有更高的将疾病传播给更多联系人的可能性。该信息可以用于流行病诸如SARS-CoV-2或其它动物源性病毒的流行病学模型,以及在指导遏制指令中的实际用途。附加地,该信息可以帮助询问具有更高循环病毒载量的患者是否存在更严重的感染和/或更高的并发症可能性。 实例9-特殊情况1 在特殊情况1中,样本的摩尔蛋白质浓度是可用的。因此,可以通过将计算的两种或更多种氨基酸类型的氨基酸浓度除以溶液的已知摩尔蛋白质浓度来计算两种或更多种氨基酸类型的氨基酸数目。 测量以下背景校正的荧光强度值: W:15890AU;CR=2371AU 方程5用于将测量的C 方程6用于将测量的W背景校正的荧光强度转换为W氨基酸类型的氨基酸浓度: 已知目的蛋白质以1μM的蛋白质浓度存在于样本中。因此,可以使用下式计算每个氨基酸类型的氨基酸数目: /> 因此,样本中C 在这种情况下,该参考提供点而不是线。比较步骤涉及根据以下公式计算样本点与每个参考点之间的距离: 这导致以下距离计算 怀疑样本含有一种目的蛋白质。因此,误差阈值被设置为最小距离。在样本中鉴定BSA的存在,因为这是提供到其参考点的最小距离的目的蛋白质。 实例10:用于测量和鉴定来自患者体液样本的目的蛋白质组和亚蛋白质组的方法 在以下三个实例中,患者血液样本内的两种或更多种氨基酸类型如本文所公开的进行标记和测量,并且本发明的方法用于鉴定患者血液样本内一种或多种目的蛋白质组或亚蛋白质组的存在和/或浓度和/或量。 根据患者血浆样本的制备方式,可以获得两种目的蛋白质组。贫血小板血浆蛋白质组描述了已经耗尽血小板的血浆。相反,富血小板血浆蛋白质组描述了未耗尽血小板的血浆。当制备富血小板血浆样本时,将血小板溶解并且将其内容物释放到血浆中,因此血小板含有的蛋白质成为富血小板血浆蛋白质组的一部分。作为本发明方法的敏感检验,以下三个工作实例证实本发明的方法可以检测贫血小板血浆(PPP)和富血小板血浆(PRP)蛋白质组的蛋白质组学特征的小差异,并且确定未知患者样本是否含有目的PPP蛋白质组或目的PRP蛋白质组。实际上,使用本发明的方法准确地确定患者样本内目的蛋白质组的存在和/或浓度和/或量。如本文所公开的,在一些实施例中,该比较步骤涉及使用机器学习分类器,其能够在鉴定样本内目的PPP和PRP蛋白质组的存在与否时实现100%敏感性和100%特异性。作为本发明方法的进一步检验,从这些血浆样本中制备另外两种目的蛋白质组。使用本发明的方法以100%敏感性和100%特异性将剩余的低分子量目的贫血小板血浆亚蛋白质组(PPP 50)和低分子量目的富血小板血浆亚蛋白质组(PRP 50)彼此区分,并且与目的PPP和PRP蛋白质组区分。 如本文所公开的,在一些实施例中,该比较步骤涉及计算参考线。每条参考线独特地描述了目的蛋白质组,例如参考线独特地描述了目的PPP蛋白质组并且另一参考线独特地描述了目的PRP蛋白质组。本发明的方法可以计算目的蛋白质组的理论和实验参考线。在目的PPP蛋白质组的情况下,在实例11中计算实验参考线,并且将该实验参考线与在实例12中针对目的PPP蛋白质组计算的理论参考线进行比较,并且证明实验参考线与理论参考线之间的强一致性。该一致性进一步证明,当目的蛋白质组或亚蛋白质组存在于样本内时,使用本发明的方法计算的目的蛋白质组或亚蛋白质组的理论参考线准确地预测将使用本发明的方法测量的两种或更多种标记的氨基酸类型的氨基酸浓度、标记的值或氨基酸数目。 在本实例中,首先详细描述该研究的方法。 从同意的健康成年患者获得N=25份全血样本。患者正在经受再生骨科手术,其中通常收集全血用于进一步处理,并且获得大约15mL全血的附加Vacutainer小瓶作为医学废物用于医学研究目的。因为全血将用于制备血浆,所以每瓶全血含有大约17.5%v/v抗凝剂作为本领域的标准(酸-柠檬酸盐-右旋糖,ACD-A)。将ACD-A标准化为每100mL水中含有以下质量的组分:20.59至22.75g柠檬酸、23.28至25.73g右旋糖、4.90至5.42g钠。 有两种类型的血浆制剂可用:贫血小板血浆(PPP)和富血小板血浆(PRP)。PPP是具有非常低的血小板数目(大约0.5x10 当遵循两步程序时,患者血液的PRP和PPP级分都可从单一患者血液样本中获得。在第一步中,将全血以200x g离心10分钟,并且经由移液管去除富白细胞血沉棕黄层上方的含血小板血浆,注意不要干扰血沉棕黄层。在第二步中,将该分离物再次以2300x g离心10分钟。 以200×g离心10分钟(“软旋转”)后,将富血小板血浆(PRP)与其它血液组分手动分离。在PRP分离过程中注意避免干扰富白细胞血沉棕黄层,从而使有核细胞污染最小化。将分离的PRP以2300×g进行第二轮离心10分钟(“硬旋转”),形成血小板沉淀。收集体积的上部2/3作为PPP,因为其血小板浓度低。经由轻轻摇动将血小板沉淀重悬于较低的1/3体积中,并且由于其较高的血小板浓度,将该级分收集为PRP。 在储存在-80℃下之前,然后将所有血浆样本(PPP和PRP)经由浸没在液氮(N2)中快速冷冻。附加地,该步骤用于溶解PRP制剂内的血小板,使得它们将其内容物释放到血浆溶液中。 血浆为大约90重量%的白蛋白和球蛋白(免疫球蛋白),并且两者都具有高于50kDa的高分子量。为了进一步证明本发明的方法检测特定低分子量血浆亚蛋白质组的存在和/或浓度和/或量的能力,进行如本文所描述的分离步骤以从PPP和PRP样本中耗尽高丰度蛋白质诸如白蛋白和球蛋白。为了实现这一点,使用如本文所公开的离心过滤步骤,导致耗尽来自PPP和PRP样本的白蛋白、球蛋白和分子量大于50kDa的其它蛋白质。所得低分子量血浆样本是低分子量目的贫血小板血浆亚蛋白质组(PPP 50)和低分子量目的富血小板血浆亚蛋白质组(PRP 50)。这通过将每种PPP和PRP制剂分别等分成两个级分来实现。一个级分不经受如本文所公开的分离步骤,并且另一个级分经受如本文所公开的分离步骤。所使用的样本制备程序描述于下表12中。 表12:PPP、PPP_50、PRP和PRP_50的样本制备描述 收集关于提供样本的每个患者的患者信息。另外记录了每名患者的性别和年龄,并且在表13中呈现。表13左侧图例中提供的每种样本类型的缩写在本实例后面提供测量的数据时使用。 表13:患者信息 作为图例中提供的样本类型的进一步说明,样本7A是来自43岁生物男性的PPP样本,而样本23D是来自67岁生物女性的PRP_50样本。 样本制备按预期进行,但注意到样本15B在闪冻过程中被液态N 标记溶液的制备 在这些实例中,K、C、W和Y氨基酸类型的氨基酸如本文所公开的进行标记和测量。尽管所有这些氨基酸类型都被标记和测量,但这些氨基酸类型的所选组合用于鉴定患者样本中目的蛋白质组的存在和/或浓度和/或量,以说明本文所公开的本发明的特征,即为了独特地鉴定目的蛋白质组,仅需要标记和测量两种氨基酸类型。 如本文所公开的制备以下标记溶液。 为了标记K氨基酸类型的患者血浆样本内的氨基酸,制备K标记溶液:12mM OPA、18mM BME和4%w/v SDS于pH 10.5的200mM碳酸盐缓冲液中。制备50mL的K标记溶液:称取80.5mg OPA,并且添加pH 10.5的20mL的500mM碳酸盐缓冲液,然后添加63.4μL BME。接着,添加20mL H 为了标记W氨基酸类型和Y氨基酸类型的患者血浆样本内的氨基酸,制备WY标记溶液:0.2M TCE、10mM TCEP、4%w/v SDS于pH 7的5mM HEPES中。向38.54mL的5mM HEPES缓冲液中添加500μL的1M TCEP储备溶液,随后添加964μL TCE和10mL的20%w/v SDS储备溶液。然后将溶液等分成5个10mL等分试样。在储存在-20℃之前,所有等分试样用石蜡膜密封并且避光。 为了标记C氨基酸类型的患者血浆样本中的氨基酸,制备C标记溶液:5mM ABD-F、4%w/v SDS于160mM pH 10.5的碳酸盐缓冲液中。向供应的10mg的ABD-F中添加1mL的pH10.5的200mM碳酸盐缓冲液。将小瓶封闭并且涡旋几分钟以使所有ABD-F溶解。然后将含有ABD-F的溶液与6.36mL的200mM碳酸盐缓冲液组合,并且用碳酸盐缓冲液洗涤ABD-F小瓶以确保组合所有ABD-F溶液。然后,添加1.84mL的20%w/v SDS。对所供应的附加10mg小瓶ABD-F重复相同的程序。将溶液组合并且等分成5个等分试样,将其存储在-20℃下直至使用。 在该实例中,总半胱氨酸氨基酸类型(C)被标记,其包括半胱氨酸(C)氨基酸类型的还原的(C 激发和发射过滤器 如本文所公开的,使用特异的激发和发射过滤器检测来自标记的氨基酸类型的所有氨基酸的荧光强度。 表14中呈现的过滤器对用于本实例中的所有实验。 表14:氨基酸类型C、K、W和Y的激发和发射波长以及带宽 在本实例和以下工作实例中描述的整个实验中,每个实验一式三份进行(3个技术复制品)。在显示误差条的地方,这些是每个实验的三个技术复制品的样本标准偏差。在显示误差条的地方,它们围绕每个实验的三个技术复制品的平均值显示。 本实例和以下实施例中的所有荧光测量均使用使用标准设置的赛默飞世尔(Thermo Fisher)Flouroskan Ascent FL板读数器进行。这些包括自动增益选择、使用Ascent软件的过滤器对验证、所有测量和孵育的静态条件(例如,无振荡或搅拌)、大约22℃的室温、垂直光束、从上方的测量方向和从左到右的测量顺序。使用200毫秒积分时间,而不是默认的20毫秒积分时间。 校准曲线的测量 在本发明的方法中,根据测量的标记可以计算样本中每种标记的氨基酸类型的氨基酸浓度,并且使用校准曲线或标准根据测量的标记计算氨基酸浓度,使用一种或多种蛋白质或氨基酸的一种或多种已知氨基酸浓度的测量的标记使校准曲线或标准在样本的测量的标记与样本中该氨基酸类型的氨基酸浓度之间转换。校准曲线可以是线性或非线性的,并且使用线性或非线性回归来计算。校准曲线确定标记的测量值(以任意单位计,AU)与未知氨基酸浓度(以摩尔浓度计,诸如微摩尔、μM)之间的关系,使得患者样本可以从以AU计的测量的荧光强度转换为以μM计的其相关氨基酸浓度。如本文所公开的,对于每种氨基酸类型仅计算一次校准曲线,并且然后在整个研究中使用该曲线。 为了产生校准曲线,制备几种蛋白质溶液。用下面概述的步骤制备蛋白质溶液作为储备溶液,并且然后在执行标记反应之前,经由在PBS中稀释将其稀释至指定浓度。制备的储备溶液如下,然后是由每种储备溶液制备的稀释溶液。 300μM BSA于PBS中:112mg牛血清白蛋白(来自密理博西格玛(MilliporeSigma)公司的BSA,产品号A7030-10G)溶解于5mL PBS中。这提供了339μM储备溶液,其经由在PBS中稀释向下调节至300μM。 300μMβ-Lac于PBS中:30mgβ-乳球蛋白(来自密理博西格玛公司的β-Lac,产品号L0130-1G)溶解于5mL PBS中。这提供了329μM溶液,其经由添加PBS被稀释至300μM。 600μM LYZ于PBS中:46mg鸡蛋清溶菌酶(来自密理博西格玛公司的LYZ,产品号10837059001)溶解于5mL PBS中。这提供了643μM溶液,其经由添加PBS被稀释至600μM。 附加地,通过将供应的具有82%肽含量的50μg PH溶解于310μL PBS中来制备14μM甲状旁腺激素(来自密理博西格玛公司的PH,产品号P7036-50UG)的溶液。根据该储备溶液,经由在PBS中稀释制备600μL的2.33μM PH。PH用作解卷积标准以在检测阶段分离从色氨酸和酪氨酸氨基酸类型读取的荧光信号,如本文所公开的。 根据以上所提供的储备溶液,经由在PBS缓冲液中稀释来制备以下稀释的蛋白质溶液:60μM BSA、50μM BSA、45μM BSA、30μM BSA、25μM BSA、20μM BSA、15μM BSA、5μM BSA、60μMβ-Lac、50μMβ-Lac、45μMβ-Lac、30μMβ-Lac、25μMβ-Lac、20μMβ-Lac、15μMβ-Lac、5μMβ-Lac、120μM LYZ、100μM LYZ、90μM LYZ、60μM LYZ、50μM LYZ、40μM LYZ、30μM LYZ、30μMLYZ、10μM LYZ。 校准曲线的创建,标记反应 如实例1中所公开的,标记反应能够使用允许大量反应平行执行和测量的微孔板以高通量方便地执行。在一个微孔板上执行K标记反应,在另一微孔板上执行C标记反应,并且在第三个微孔板上执行W和Y标记反应。使用解卷积标准解卷积来自W和Y氨基酸类型的荧光强度,如本文所公开的和稍后在本实例中进一步解释的。在所有情况下,将稀释的蛋白质溶液(或缓冲溶液,用于如本文所公开的背景校正)和标记溶液以等体积组合。将所有稀释的蛋白质溶液和缓冲溶液顺序添加到微孔板中,然后将标记溶液添加到含有稀释的蛋白质溶液或缓冲溶液的微孔板的所有孔中。这是在执行化学反应时的标准实践,并且确保允许所有反应进行大约相同的时间量。 如本文所公开的,为了标记K氨基酸类型的氨基酸,将100μL的上述稀释的蛋白质溶液添加到96孔微孔板(格瑞纳生物科技(Grenier Bio One)公司目录号655076微孔板)的每个孔中。如所讨论的,标记反应以一式三份进行,因此每微孔板的3个技术复制孔含有相同的稀释蛋白质溶液。附加地,3个孔仅填充缓冲液(PBS),因为这些孔将用于如本文所公开的背景校正。然后,将100μL的K标记溶液添加到微孔板的所有含有蛋白质和缓冲液的孔中。在将K-标记溶液添加到微孔板的所有含有蛋白质和缓冲液的孔中后,立即使用以上所描述的设置和表14中提供的过滤器对(355nm激发,460nm发射)测量微孔板,得到K氨基酸类型的一系列测量值(原始荧光强度)。 如本文所公开的,在标记半胱氨酸(C)氨基酸类型的所有氨基酸之前,使用还原剂(TCEP)还原半胱氨酸氨基酸类型(C 如本文所公开的,为了标记W和Y氨基酸类型的所有氨基酸,将120μL的每种稀释蛋白质溶液添加到96孔微孔板(格瑞纳生物科技公司UV透射板,目录号655801)。如所讨论的,标记反应以一式三份进行,因此每微孔板的3个技术复制孔含有相同的稀释蛋白质溶液。附加地,3个孔仅填充缓冲液(PBS),因为这些孔将用于如本文所公开的背景校正。然后,将120μL的WY-标记溶液添加到微孔板的所有含有蛋白质和缓冲液的孔中。接着,将微孔板置于透照器(产品号NEB-MLB-16)的中心,并且使用302nmUB波长设置和100%(最大)强度照射微孔板30分钟。使用所描述的设置并且顺序使用表14中描述的过滤器对来测量该板;顺序用W过滤器对(355nm激发和510nm发射)、Y波长对1过滤器对(320nm激发和460nm发射)和Y波长对2过滤器对(320nm激发和510nm发射)测量该板。当呈现Y氨基酸类型的校准曲线时,下面将讨论使用本文所公开的解卷积标准(甲状旁腺激素PH)对来自W和Y氨基酸类型的荧光强度的解卷积。 如本文所公开的,可以对每种氨基酸类型的测量的标记进行背景校正。如上所描述的,通过将荧光染料溶液与标记反应期间供应的含蛋白质溶液的体积相等体积的缓冲液组合,并且然后从每种染料和蛋白质溶液检测的荧光强度中减去从染料和缓冲溶液检测的荧光强度以提供背景校正的荧光测量值来实现这一点。对所有标记反应进行该步骤。为了提供在所有标记反应中进行该步骤的代表性实例,为标记K氨基酸类型而测量的标记的原始值提供于下表15和16中: 表15:当标记K氨基酸类型时,测量蛋白质溶液和染料溶液的荧光强度值 计算测量的染料荧光强度值的平均值,其为3.156。然后从每种染料和蛋白质溶液检测的荧光强度中减去提供从染料和缓冲溶液检测的荧光强度的该值,以提供背景校正的荧光强度。从表15中所有孔标记的“蛋白质”检测的荧光强度中减去3.156,得到表16中的以下背景校正的荧光强度值。 表16:当标记K氨基酸类型时,测量的蛋白质溶液的背景校正的荧光强度值 /> 如上所说明的,进行所有测量的荧光强度的背景校正。 将标记的蛋白质溶液的氨基酸浓度相对于每种氨基酸类型的标记的氨基酸的背景校正的荧光强度绘制,并且将该校准图数据拟合以提供校准曲线。每种标记的蛋白质溶液的每种氨基酸类型的氨基酸浓度是蛋白质溶液的蛋白质浓度乘以蛋白质的一个分子中指定氨基酸类型的氨基酸数目(通过计数蛋白质的氨基酸序列中氨基酸的出现数目来提供)。每种氨基酸类型的氨基酸浓度与每种氨基酸类型的标记的氨基酸的荧光强度之间的关系可以是线性的,并且可以使用提供线性最佳拟合的线性回归来计算线性校准曲线。如本文所公开的,每种氨基酸类型的氨基酸浓度与每种氨基酸类型的标记的氨基酸的荧光强度之间的关系可以替代地是非线性的,并且可以使用提供非线性最佳拟合的非线性回归来计算非线性校准曲线。校准曲线用于将以任意单位(AU)计的值转化为定量值(摩尔浓度μM)。 如本文所公开的创建校准曲线。校准曲线在图18至20中提供,并且校准曲线的方程在下面附加提供。 图18提供了K氨基酸类型的校准曲线。使用非线性回归计算多项式拟合。多项式拟合是一种非线性拟合。其它类型的非线性拟合包括指数、幂律和S形拟合。对于K氨基酸类型,通过使用非线性回归计算的多项式拟合很好地描述了以μM计的[K]氨基酸浓度与以任意单位计的荧光强度之间的关系。多项式拟合的形式为[K(μM)]=a[K F.I.(AU)] 因此,当在本实例中随后针对患者样本测量标记(荧光强度)的值,并且使用校准曲线在K氨基酸类型的标记的测量值与K氨基酸类型的氨基酸浓度之间转换时,使用以下关系将以任意单位计的针对患者样本的K氨基酸类型测量的荧光强度转换为K氨基酸类型的氨基酸浓度。 [K(uM)]=7.642×10 图19提供了C氨基酸类型的校准曲线。通过使用非线性回归计算的多项式拟合很好地描述了[C]氨基酸浓度与荧光强度之间的关系。多项式拟合的形式为[C(μM)]=a[CF.I.(AU)] 因此,当在本实例中随后针对患者样本测量标记(荧光强度)的值,并且使用校准曲线在C氨基酸类型的标记的测量值与C氨基酸类型的氨基酸浓度之间转换时,使用以下关系将以任意单位计的针对患者样本的C氨基酸类型测量的荧光强度转换为C氨基酸类型的氨基酸浓度。 [C(uM)]=1.474×10 图20提供了W氨基酸类型的校准曲线。对于W氨基酸类型,数据可以是穿过以下形式的原点的线性拟合:[W(μM)]=a[W F.I.(AU)],其中系数a=2.315。 因此,当在本实例中随后针对患者样本测量标记(荧光强度)的值,并且使用校准曲线在W氨基酸类型的标记的测量值与W氨基酸类型的氨基酸浓度之间转换时,使用以下关系将以任意单位计的针对患者样本的W氨基酸类型测量的荧光强度转换为W氨基酸类型的氨基酸浓度。 [W(uM)]=2.315[W F.I.(且U)] 如本文所公开的,使用两个波长对和解卷积标准定量Y氨基酸。在波长对1处,观察到来自Y和W氨基酸类型的荧光,而在波长对2处,观察到来自W氨基酸类型的荧光。这里使用的波长对利用相对于Y氨基酸类型具有红移发射波长的W氨基酸类型,因此W氨基酸类型可以用510的发射波长检测,而W和Y氨基酸类型都可以用460的发射波长检测。然而,使用分离的激发波长和/或分离的激发和发射波长也是可能的。解卷积标准是人甲状旁腺激素(PH),其具有1个色氨酸氨基酸和0个酪氨酸氨基酸。在波长对2处,针对2.33μM PH测量的0.83的平均荧光强度对应于2.33μM W氨基酸。在波长对1处,针对2.33μM PH孔(2.33μM W氨基酸)测量的平均荧光强度为4.13。因此,在波长对1处,相同浓度的W氨基酸的荧光是波长对2处的 因此4.97被用作波长信号转换以将来自波长对2处的W氨基酸的荧光转换为波长对1处的荧光。将波长对2处的每个背景校正的荧光强度值乘以波长信号转换,并且从波长对1处的W和Y氨基酸的每个对应的背景校正的荧光中减去该结果。这揭示了来自波长对1处的Y氨基酸类型的荧光。 作为这些步骤的实例,针对在波长对1和波长对2处的60μM BSA溶液测量背景校正的荧光强度值。该BSA溶液在波长对1处的背景校正的荧光强度为297.26AU。相同BSA溶液在波长对2处的背景校正的荧光强度为38.88AU,并且这提供了来自BSA内W氨基酸类型的残基的荧光。 将在波长对2处的该值(38.88AU)乘以波长信号转换(4.97)以提供在波长对1处来自BSA内的W氨基酸类型的残基的荧光,在波长对1处检测来自W氨基酸类型和Y氨基酸类型的荧光。38.88AUx 4.97=193.23AU,由波长对1处的BSA的W氨基酸类型提供。然后,从在波长对1处的W和Y氨基酸类型的荧光中减去在波长对1处的W氨基酸类型的荧光,提供在波长对1处的Y氨基酸类型的荧光。297.26AU-193.23AU=103.90AU。 将Y氨基酸类型的氨基酸浓度相对于以这种方式计算的Y氨基酸类型在波长对1处的荧光强度绘制,并且对来自波长对1处的Y氨基酸类型的荧光强度执行线性回归,得到Y氨基酸类型的氨基酸浓度与Y氨基酸类型的荧光强度之间的以下关系: [Y(uM)]=7.381[YF.I.(AU)] 患者样本的测量 现在已经计算了用于将针对患者样本测量的以任意单位(AU)计的荧光强度转变为患者样本的对应摩尔氨基酸浓度(μM)的校准曲线,讨论了患者样本的测量。 使用微孔板中的K-标记溶液、C-还原溶液后的C-标记溶液和WY-标记溶液标记患者PPP、PRP、PPP_50和PRP_50样本。标记步骤与前面描述的用于创建校准板的步骤相同。然而,为了方便起见,下面也指示了它们与所使用的特定微孔板布局(尽管它们可以通过本领域已知的任何方式和任何格式来标记)。 表17中提供了所有患者样本的板布局 表17:患者样本的板布局 在表17中,术语“Pat.n”,其中n=1∶20,是指表13中提供的样本类型的第n名患者。例如,对于PPP样本,Pat.16是来自19岁女性的样本16A。作为另一实例,对于PRP样本,Pat.16是来自73岁男性的样本21C。 板上用浅灰色指示的蛋白质被用于缩放,因为默认自动增益选择特征用于所有测量的板。它们用于将来自测量的患者样本的荧光转变为校准板上的等效荧光(其用于产生校准曲线),校正为在标准恒定增益实验装置中观察到的。然而,当使用恒定增益特征时,在标准测定操作中不需要这些。 如表12中所解释的,在进行标记反应之前立即稀释患者血浆样本,以使测量的荧光强度范围达到由校准曲线覆盖的范围,用于荧光强度与氨基酸浓度之间最准确的转换。这是任选的步骤,作为替代,可以计算更宽范围的校准曲线。 表18中突出显示了每种样本类型所用的稀释因子。 表18:在指示的标记反应之前立即稀释 执行对所有(PPP、PRP、PPP_50和PRP_50K标记)板进行每个标记反应的步骤: 1.在格瑞纳生物科技公司目录号655076微孔板的每个标记的白色孔中添加100μL的指示的患者样本 2.向每个浅灰色孔中添加100μL的指示的蛋白质溶液 3.向每个黑色染料孔中添加100μL的PBS缓冲液 4.向每个深灰色孔中添加100μL的指示的患者样本或PBS 5.向每个深灰色孔中添加100μL的PBS 6.向每个黑色孔中添加100μL的K-标记溶液 7.向每个浅灰色孔中添加100μL的K-标记溶液 8.向每个标记的白色孔中添加100μL的K-标记溶液 9.在完成步骤8后,立即使用以上所描述的设置和表14中提供的过滤器对测量微孔板(355激发,460发射)。 对于所有(PPP、PRP、PPP_50,和PRP_50)C标记板: 1.将200μL的指示的溶液(白色孔中指示每个病人样本,浅灰色孔中指示蛋白质,以及黑色孔中的缓冲液)与200μL C-还原溶液在微管中组合,并且避光30分钟。将深灰色孔中指示的200μL患者样本或指示的PBS也与200μL PBS组合并且避光30分钟。 2.向格瑞纳生物科技公司目录号655076微孔板的白色孔中添加40μL的每种患者样本溶液(指示的患者样本+C-还原溶液) 3.向浅灰色孔中添加40μL的每种蛋白质溶液(指示的蛋白质+C-还原溶液) 4.向黑色孔中添加40μL的缓冲液+C-还原溶液 5.向深灰色孔中添加40μL的指示的患者样本+PBS溶液或PBS溶液,然后在每个孔中添加另一40μL PBS 6.向黑色孔中添加40μL C-标记溶液 7.向每个黑色孔中添加40μL C-标记溶液 8.向每个浅灰色孔中添加40μL C-标记溶液 9.向每个标记的白色孔中添加40μL C-标记溶液 10.允许反应在静态条件下进行45分钟,其中使板避光。 11.使用以上所描述的设置和表14中提供的过滤器对测量微孔板(355nm激发,510nm发射)。 对于所有(PPP、PRP、PPP_50,和PRP_50)WY标记板: 1.在格瑞纳生物科技公司UV透射板目录号655801的每个标记的白色孔中添加120μL的指示的患者样本 2.向每个浅灰色孔中添加120μL的指示的蛋白质溶液 3.向每个黑色孔中添加120μL的PBS 4.向每个深灰色孔中添加120μL的每种指示的患者样本,向缓冲液孔中添加120μL PBS。 5.向每个深灰色孔中添加120μL的PBS 6.向每个黑色孔中添加120μL WY-标记溶液 7.向每个浅灰色孔中添加120μL WY-标记溶液 8.向每个标记的白色孔中添加120μL WY-标记溶液 9.微孔板 10.将微孔板置于NEB-MLB-16透照器的中心,并且在静态条件下使用302nm UB波长设置和100%(最大)强度照射微孔板30分钟 11.使用所描述的设置并且顺序使用表14中描述的过滤器对来测量该板;顺序用W过滤器对(355nm激发和510nm发射)、Y波长对1过滤器对(320nm激发和460nm发射)和Y波长对2过滤器对(320nm激发和510nm发射)测量该板 对于所有PPP板(K氨基酸类型、C氨基酸类型、W和Y氨基酸类型),考虑到表13中描述的样本的板布局如下 对于所有PRP板(K氨基酸类型、C氨基酸类型、W和Y氨基酸类型),考虑到表13中描述的样本的板布局如下 对于所有PPP_50板(K氨基酸类型、C氨基酸类型、W和Y氨基酸类型),考虑到表13中描述的样本的板布局如下 对于所有PRP 50板(K氨基酸类型、C氨基酸类型、W和Y氨基酸类型),考虑到表13中描述的样本的板布局如下 测量以下原始荧光强度用于标记K氨基酸类型 测量以下原始荧光强度用于标记C氨基酸类型 测量以下原始荧光强度用于标记W氨基酸类型 针对Y氨基酸类型测量以下原始荧光强度 实例11:确定目的患者蛋白质组和亚蛋白质组的实验参考线 计算标记的氨基酸类型的氨基酸浓度 对于所有患者样本类型和所有类型的标记反应,实例10中提供的原始临床数据通过从每个含有染料的孔中减去平均荧光强度进行背景校正,该平均荧光强度是在不与患者样本混合的情况下针对单个染料测量的,并且然后减去针对不含染料的特定患者样本测量的荧光强度(其提供了可以在如本文所公开的背景校正步骤期间去除的自体荧光)。这去除了由于未反应染料引起的荧光强度和由于患者样本在指示的波长处的任何自体荧光引起的荧光强度。例如,提供用于标记实例10中PPP样本中的K氨基酸类型的原始荧光强度数据以及板布局再现如下 为了背景校正原始荧光强度数据,计算“染料”孔的平均值,其为3.704。首先,从接受染料,在这种情况下是K-标记溶液,的每个孔中减去3.704。从未接受染料的孔(深灰色孔)中未减去未反应染料的荧光。结果在下面示出。 接下来,为了从每个未标记的血浆样本中去除任何自体荧光,从以上标记的患者样本的所有孔中减去来自已经接受缓冲液(PBS)而不是实例10中的染料(深灰色孔)的指示的血浆样本的荧光。例如,未接受K-标记溶液的样本1A具有1.68的原始荧光强度(孔B10);将其从确实接受K-标记溶液的样本1A孔(孔A1-3)的荧光强度中减去。孔A1-3中提供的患者1A的三个技术复制品的结果为1868.61、1829.61和1811.61。因为浅灰色的含蛋白质孔(E7-H9)未接受任何血浆样本,所以没有从这些孔中减去血浆值。作为另一实例,对所有患者PPPK-标记样本进行该方法,并且结果再现在表19中。 表19:PPP样本的K氨基酸类型的背景校正的荧光强度 对实例10中提供的所有原始标记荧光强度数据执行以上说明的背景校正步骤。这包括PPP、PRP、PPP_50和PRP_50样本类型,并且对于每种样本类型,包括K-标记微孔板、C-标记微孔板、W-标记微孔板和Y-标记微孔板的两个波长对(波长对1和波长对2)。 因为已经选择了自动增益调节,所以使用含蛋白质孔将在该微孔板上针对蛋白质溶液测量的荧光强度值缩放为在K氨基酸类型的校准板上针对相同蛋白质溶液测量的荧光强度值。这提供了用于均衡该板与校准板之间的可变增益的缩放因子,其中对于该校准板已经计算了校准曲线。该步骤通常不是必需的,并且在该实例中被执行以补偿可变增益设置。下面绘示了PPP样本类型的K-标记板的结果。 缩放因子为1.02指示在用于计算校准曲线的校准板上测量的值比在该板上针对相同溶液测量的值亮2%,因此将在该板上测量的值乘以1.02以缩放至校准曲线板。结果在下面再现。 对根据实例10中提供的原始标记荧光强度数据计算的所有背景校正的标记荧光强度数据执行以上说明的缩放步骤。这包括PPP、PRP、PPP_50和PRP_50样本类型。对于每种样本类型,这包括K-标记荧光强度数据、C-标记荧光强度数据、W-标记荧光强度数据和Y-标记荧光强度数据。 关于Y-标记荧光强度数据,执行本文所公开的和实例10中说明的方法,其中将波长对2处Y氨基酸类型的背景校正的荧光强度值乘以信号转换因子(如实例10中计算的4.97),并且从波长对1处Y氨基酸类型的背景校正的荧光强度值中减去该结果。在波长对1处,可以观察来自Y和W氨基酸类型的荧光,并且在检测阶段步骤处的这种解卷积去除了对来自W氨基酸类型的荧光的任何贡献,仅揭示了Y-标记荧光强度数据。作为另一实例,下面提供了在Y-标记波长对1和波长对2处PRP样本类型的背景校正的荧光强度值。 波长对1 /> 波长对2 将波长对2的荧光强度乘以缩放因子4.97,以揭示来自波长对1处W氨基酸类型的氨基酸的荧光强度。 然后从所提供的波长对1的值(其包括来自W和Y氨基酸类型的贡献)中减去这些值,揭示在波长对1处仅来自Y氨基酸类型的荧光强度,并且因此揭示Y标记荧光强度数据。 然后以与K-标记、C-标记和W-标记荧光强度数据相同的方式缩放该Y-标记荧光强度数据。 在实例10中使用每种氨基酸类型(K、C、W和Y)的校准曲线建立荧光强度(C F.I、KF.I、W F.I.和Y F.I.)与氨基酸浓度([C(μM)]、[K(μM)]、[W(μM)]和[Y(μM)])之间的关系。该转变总结于表20中。 表20:在以AU计的荧光强度与以μM计的氨基酸浓度之间转变的校准曲线 /> 将表20中提供的C氨基酸类型转变应用于来自所有样本类型(PPP、PRP、PPP 50、PRP 50)的缩放的C荧光强度数据。将表20中提供的K氨基酸类型转变应用于来自所有样本类型(PPP、PRP、PPP_50、PRP_50)的缩放的K荧光强度数据。将表20中提供的W氨基酸类型转变应用于来自所有样本类型(PPP、PRP、PPP_50、PRP_50)的缩放的W荧光强度数据。将表20中提供的Y氨基酸类型转变应用于来自所有样本类型(PPP、PRP、PPP_50、PRP_50)的缩放的Y荧光强度数据。 例如,C氨基酸类型的缩放的PPP数据在下面 进行表20中提供的C氨基酸类型转变,产生以下微摩尔C氨基酸浓度[C(μM)] 最后,将针对每种氨基酸类型计算的氨基酸浓度乘以表18中提供的稀释因子。这提供了未稀释的血浆溶液的氨基酸浓度。作为实例,针对PPP样本类型、患者1(样本1A)、技术复制品2的C标记反应测量的稀释的氨基酸浓度为389。表24和30中提供的稀释度为60,因此该样本的该技术复制品(未稀释的PPP血浆)的氨基酸浓度为389μM x 60=23,340μM。 每个患者样本的氨基酸浓度(μM) 到目前为止,详细解释的所有步骤均用于计算患者(未稀释的)血浆血浆样本的以μM计的氨基酸浓度。 当所有这些步骤如本文所公开的和针对每个患者、技术复制品、氨基酸类型和样本类型所解释的那样进行时,以μM计的氨基酸浓度如下针对PPP的表21.1和21.2、针对PRP的表22.1和22.2、针对PPP_50的表23.1和23.2、针对PRP_50的表24.1和24.2所呈现的。 表21.1 表21.2 表22.1 表22.2 表23.1 *异常值 表23.2 *异常值 表24.1 *异常值 表24.2 *异常值 将氨基酸浓度结果绘制在N维空间中揭示了通过本发明的方法公开的参考线 本发明基于以下发现:由两种或更多种标记的氨基酸类型的氨基酸浓度或标记的值提供的目的蛋白质组或亚蛋白质组的参考是目的蛋白质组或亚蛋白质组的总蛋白质浓度的共同参数的函数。因此,当目的蛋白质组或亚蛋白质组的总蛋白质浓度改变时,在N维空间中形成线。该概念在图1和实例1至9中解释,并且在图17中进一步绘示。 在图21中为目的PPP蛋白质组提供了由本发明的方法教导的N维空间中的线的概念。表21.1和21.2中示出了为每个技术复制品提供的氨基酸浓度的平均值,其中第四维以灰度比色指示。在图21中,N维空间(N=4,4维空间)中的线的概念用穿过数据集绘制的线来绘示。 为了计算目的PPP蛋白质组和其它目的蛋白质组(例如PRP、PPP_50和PRP_50)的线在N维空间中的精确位置,用实验方法计算线在N维空间中的方程。随后,将该实验线在N维空间中的方程与使用蛋白质表达数据计算的理论线在N维空间中的方程进行比较,该蛋白质表达数据对于目的PPP蛋白质组是公开可获得的。 计算目的PPP、PRP、PPP_50和PRP_50蛋白质组和亚蛋白质组的实验参考线 在本文所公开的本发明的方法中,定义目的蛋白质组或亚蛋白质组的参考线的向量函数可以用实验方法计算,例如通过将测量的氨基酸浓度除以使用本领域标准方法计算的总蛋白质浓度(例如质量蛋白质浓度)。为此,使用制造商提供的说明书,使用二喹啉甲酸蛋白质确定试剂盒(产品号BCA1-1KT,密理博西格玛公司)以μg/mL计测量每个患者样本的总蛋白质浓度。使用二喹啉甲酸(BCA)标准测定法确定总蛋白质浓度。简言之,蛋白质内的肽键将Cu 在表25中提供了根据制造商的说明书以这种方式测量的每个患者样本的总蛋白质浓度的结果。为每个样本提供三种总蛋白质浓度,涵盖1∶60稀释、1∶2稀释和1∶1稀释(纯的、未稀释的)。如表12和表18所解释的,1∶60稀释用于PPP和PRP标记微孔板,1∶2稀释用于PPP_50和PRP_50K和WY标记微孔板(WY标记微孔板揭示W和Y氨基酸类型的氨基酸浓度),以及1∶1稀释用于PPP_50和PRP_50C标记微孔板。当计算实验参考线时,将每种氨基酸类型的氨基酸浓度相对于在已经测量该氨基酸类型的氨基酸浓度的稀释度下的总蛋白质浓度绘制。为了便于参考,在表25中用粗体表示所指示的稀释度。 表25:用BCA测定法测量的每个患者样本的每种蛋白质的总蛋白质浓度,用于计算实验参考线 /> 在本文所公开的本发明的方法中,可以使用本发明的方法用实验方法计算目的PPP、PRP、PPP 50和PRP 50蛋白质组的参考线。为了实现这一点,将根据本实例中K、C、W和Y标记的测量值计算的氨基酸类型(K、C、W和Y)的测量的氨基酸浓度相对于实例10中提供的每种样本的以μg/mL计的测量的总蛋白质浓度绘制,并且对每种样本类型和每种氨基酸类型执行线性回归。对于除PRP_50样本类型之外的所有样本类型,将线性回归约束为穿过原点(0,0)。该线性回归的输出用于以以μg/mL计的总蛋白质浓度的向量函数的形式提供每种目的蛋白质组和亚蛋白质组的实验参考。 结果绘制在图22至28中。图22提供了目的PPP和PRP蛋白质组的实验参考线的K分量,图23提供了目的PPP和PRP蛋白质组的实验参考线的C分量,图24提供了目的PPP和PRP蛋白质组的实验参考线的W分量,图25提供了目的PPP和PRP蛋白质组的实验参考线的Y分量。附加地,图26提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的K分量,图27提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的C分量,以及图28提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的W分量。在所有情况下,示出了三个技术复制品的平均值,在氨基酸浓度的计算和以μg/mL计的总蛋白质浓度的计算中也提供了三个技术复制品的标准偏差。 在每个图上,包括最佳拟合线的方程。在所有样本类型中,所有氨基酸类型是蛋白质浓度t的共同参数的函数,这里以μg/mL表达。每个最佳拟合线提供了参数方程组内的一个参数方程(作为t的函数),其定义每种目的蛋白质组或亚蛋白质组。等效地,每个最佳拟合线提供了向量函数的一个分量(作为t的函数),其描述了每种目的蛋白质组或亚蛋白质组。 附加地,可以根据目的蛋白质组或亚蛋白质组的总摩尔浓度而不是总质量浓度来提供向量函数。为此,针对每种目的蛋白质组和亚蛋白质组建立了质量蛋白质浓度与摩尔蛋白质浓度之间的转变。首先,访问公开可获得的人类蛋白质图谱,并且下载表格,其基于公开的研究文章提供了活性分泌到血液中的419个蛋白质的参考血浆浓度,其中使用免疫测定诸如ELISA测量目标蛋白质(https://www.proteinatlas.org/humanproteome/blood/proteins+detected+by+immunoassay)。以不同单位(g/L至ng/L)提供按质量计的蛋白质浓度,并且将每个提供的质量蛋白质浓度转换为标准单位μg/mL。为了计算每种蛋白质的摩尔蛋白质浓度,通过将μg/mL蛋白质浓度除以蛋白质分子量,并且然后乘以1000,将以μg/mL计的蛋白质浓度转换为摩尔蛋白质浓度(以μM计)。将蛋白质组或亚蛋白质组中所有蛋白质的总摩尔蛋白质浓度值相加。对于目的PPP和PRP蛋白质组,将数据集中所有蛋白质的摩尔浓度相加。对于目的PPP_50和PRP_50低分子量亚蛋白质组,其由于离心过滤步骤而不含有分子量小于50kDa的蛋白质,分子量大于50kDa的蛋白质不包括在总蛋白质浓度中。这是经由Microsoft Excel中的逻辑标志完成的。 以μg/mL和μM计的总血浆蛋白质组浓度提供于下表26中。 表26 表26附加地提供了用于计算患者样本的以μg/mL计的测量的总蛋白质浓度至摩尔蛋白质浓度的转换因子:对于目的PPP和PRP蛋白质组为0.01551vM/(μg/mL),并且对于过滤的目的PPP_50和PRP_50亚蛋白质组为0.03132μM/(μg/mL)。 当使用这些转换因子时,可以将每种样本类型的测量的氨基酸浓度相对于对应目的蛋白质组的总摩尔蛋白质浓度绘制,结果示出于图29至35中。图29提供了目的PPP和PRP蛋白质组的实验参考线的K分量,图30提供了目的PPP和PRP蛋白质组的实验参考线的C分量,图31提供了目的PPP和PRP蛋白质组的实验参考线的W分量,图32提供了目的PPP和PRP蛋白质组的实验参考线的Y分量。附加地,图33提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的K分量,图34提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的C分量,以及图35提供了目的PPP_50和PRP_50亚蛋白质组的实验参考线的W分量。而在图22至28中提供了稀释的氨基酸浓度和蛋白质浓度,在图29至35中提供了未稀释的氨基酸浓度和蛋白质浓度。因为在标记反应之前和在测量以μg/mL计的蛋白质浓度之前进行了相等的稀释,所以这是提供的实验参考线的斜率之外的因素,因为分子和分母都乘以相同的常数。在所有情况下,示出了三个技术复制品的平均值,还提供了三个技术复制品的标准偏差用于计算氨基酸浓度。 在每个图上,包括最佳拟合线的方程。在所有样本类型中,所有氨基酸类型是总蛋白质浓度t的共同参数的函数,这里以μM表达。每个最佳拟合线提供了参数方程组内的一个参数方程(作为t的函数),其定义每种目的蛋白质组或亚蛋白质组。等效地,每个最佳拟合线提供了向量函数的一个分量(作为t的函数),其描述了每种目的蛋白质组或亚蛋白质组。 为每种氨基酸类型和样本类型的氨基酸浓度/总蛋白质浓度数据的线性拟合提供了用实验方法计算的描述每种目的蛋白质组或亚蛋白质组的向量函数的氨基酸类型的系数。每种氨基酸类型和每种目的蛋白质组或亚蛋白质组的实验向量函数系数提供于下表39至42中。表27提供了目的PPP和PRP蛋白质组的以μg/mL计的总蛋白质浓度t的系数(w 表27 表28 表29 表30 如本文所公开的,这些值提供了描述和独特地鉴定每种目的蛋白质组和亚蛋白质组的向量函数的系数。下面为目的PPP和PRP蛋白质组提供了四种标记的氨基标记的氨基酸类型(K、C、W、Y)的氨基酸浓度的向量函数,其中目的蛋白质组的总蛋白质浓度以摩尔浓度单位提供。 p p 作为另一实例,下面为目的PPP 50和PRP 50亚蛋白质组提供了两种标记的氨基标记的氨基酸类型(C、W)的氨基酸浓度的向量函数,其中目的亚蛋白质组的总蛋白质浓度以摩尔浓度单位提供。 p p 这些结果指示,目的PRP蛋白质组内每蛋白质序列的K、C、W和Y氨基酸的平均数始终稍高于目的PPP蛋白质组的。附加地,如所预期的,目的低分子量PPP_50和PRP_50亚蛋白质组的每蛋白质序列的氨基酸的平均数显著低于目的PPP和PRP蛋白质组的每蛋白质序列的氨基酸的平均数。 本发明的方法还提供了可以在理论上计算参考线。对于目的PPP蛋白质组,公开可获得的数据使得能够计算目的PPP蛋白质组的理论参考线,并且将理论参考线与实验参考线进行比较(使用针对目的PPP蛋白质组测量的数据)。使用本文所公开的本发明的方法根据公开可获得的数据计算目的PPP蛋白质组的理论参考线。 如上所描述的访问和处理公开可获得的人类蛋白质图谱数据。附加地,使用UniProt数据库将提供的人类基因名称映射为UniProtKB标识符,并且下载每个映射的UniProtKB标识符的氨基酸序列(使用单字母缩写)和分子量。成功地将415个基因名称映射为蛋白质,并且将这些蛋白质用于进一步计算。为了计数C、K、W和Y氨基酸类型在蛋白质氨基酸序列内出现的次数,使用Microsoft Excel计数氨基酸序列串内指示的字符“C”、“K”、“W”或“Y”的出现数目。这可以替代地使用Python ProtParam氨基酸计数函数来计算,该函数简单地计数蛋白质序列中氨基酸重复的次数。为了计算每种蛋白质的摩尔蛋白质浓度,通过将μg/mL蛋白质浓度除以蛋白质分子量,并且然后乘以1000,将以μg/mL计的蛋白质浓度转换为摩尔蛋白质浓度(以μM计)。然后,通过将氨基酸序列内的C、K、W或Y氨基酸的数目分别乘以以μM计的摩尔蛋白质浓度来计算以μM计的每种标记的氨基酸类型(C、K、W和Y)的总浓度。这提供了贫血小板血浆(PPP)内每种单个蛋白质的以μM计的C、K、W和Y氨基酸浓度,并且为了获得贫血小板血浆内所有蛋白质的以μM计的C、K、W或Y氨基酸类型的总氨基酸浓度,将C、K、W或Y氨基酸类型的单个氨基酸浓度相加。类似地,为了获得贫血小板血浆中所有蛋白质的以μg/mL计的总蛋白质浓度,将以μg/mL计的单个蛋白质浓度相加。这得到以μM([C(μM)])计的C氨基酸类型的总浓度、以μM([K(μM)])计的K氨基酸类型的总浓度、以μM([W(μM)])计的W氨基酸类型的总浓度、以μM([Y(μM)])计的Y氨基酸类型的总浓度和以μg/mL([总蛋白质(μg/mL)])计的总蛋白质浓度的单一值。附加地,为了获得贫血小板血浆内所有蛋白质的以μM计的总蛋白质浓度,将以μM计的单个蛋白质浓度相加,提供以μM计的总蛋白质浓度的单一值。 每个值 表31:目的PPP蛋白质组(目的血浆蛋白质组)的理论和实验向量函数系数的比较 附加地,每个值 表32 在所有情况下,理论向量函数系数与实验向量函数系数之间密切一致。计算理论向量函数系数与实验向量函数系数之间的百分比差。使用本发明的方法计算理论向量函数系数,以根据公开可获得的数据确定将描述针对目的PPP蛋白质组测量的参考的向量函数。这使用方程11计算,如本文所公开的,其用于计算将经由平均特征描述目的蛋白质组或亚蛋白质组的向量函数的系数。为此,方程11将公开可获得的数据转化为平均鉴定的蛋白质组学或亚蛋白质组学特征,这些数据是在单独测量目的蛋白质组或亚蛋白质组内的每个蛋白质时收集的(这可能包括单独分离的或靶向的),可以在不分离和不靶向目的蛋白质组或亚蛋白质组内单个蛋白质的情况下进行测量,或者需要开发检验来专门寻找和测量目的蛋白质组或亚蛋白质组内的某些生物标记。所有用实验方法测量的向量函数系数在其理论预测值的11%内,并且所有包括的向量函数系数的平均百分比差为摩尔系数的0%和质量系数的2%。 实验与理论参考线之间的这种密切一致证实了测量平均蛋白质组学或亚蛋白质组学特征(经由标记的值,根据测量的标记计算的总氨基酸浓度,或根据总氨基酸浓度计算的氨基酸数目)提供了与单独测量蛋白质组或亚蛋白质组内的每种蛋白质,诸如经由免疫测定或质谱,等效的信息,并且汇总了数百甚至数千个实验结果,其中蛋白质被费力地鉴定和定量。如本文所公开的,不必分离蛋白质组或亚蛋白质组,或不必单独检测蛋白质组或亚蛋白质组内的单个蛋白质、肽、寡肽和多肽,以鉴定和定量蛋白质组或亚蛋白质组。此外,即使在诸如血浆,其中含有细胞碎片、小分子、离子、自发荧光物种和高度的分子集群,的复杂的人类生物流体中进行本发明的方法,与预测结果没有明显的偏差。 预测的向量函数与实验数据之间的密切一致绘制在图36中,其示出了每个患者样本(星形)和预测的参考线(实线)的三个技术复制品的平均测量的氨基酸浓度,其系数提供在表31中。 在后续实例中提供了使用本文所公开的向量函数方法的鉴定和量化。 使用分类器进行鉴定(任选的步骤) 如本文所公开的,比较步骤可以替代地或附加地涉及机器学习分类器。将所有25例患者PPP和PRP样本(不包括样本制备异常值)的三个技术复制品的完整数据集随机分成两组。第一组包括25%的数据点作为样本点,并且提供两种或更多种氨基酸类型(四种氨基酸类型)的氨基酸浓度,该氨基酸浓度根据相同的两种或更多种氨基酸类型(四种氨基酸类型)的测量的标记计算。第二组包括75%的数据点,并且提供了在目的PPP和PRP蛋白质组样本中已标记的相同的两种或更多种氨基酸类型的已知氨基酸浓度。第二组(在目的PPP和PRP蛋白质组中的样本中标记的相同的两种或更多种氨基酸类型的已知氨基酸浓度)用于训练机器学习分类器,特别是决策树模型(精细K-最近邻)。欧几里得距离度量与相等的距离加权和数据标准化以及默认成本矩阵一起使用。准确鉴定不需要分类器优化或超参数调整。 图37示出了使用的数据集,包括训练集和检验集,并且图38示出了检验集的预测。100%的预测是正确的。 这导致100%真阳性率和0%假阴性率,用于使用本发明所公开的方法和2种标记的氨基酸类型鉴定患者样本类型内的目的蛋白质组,如图39所示。 结果对于所使用的分类器类型是稳健的。还使用30个学习器的119次分裂和默认成本矩阵训练了集成袋装决策树分类器,并且提供了等效结果。如图40所示,使用本发明所公开的方法和2种标记的氨基酸类型鉴定患者样本类型内目的蛋白质组实现了100%真阳性率和0%假阴性率。如图41所示,也实现了100%阳性预测值和0%错误发现率。 在患者样本中鉴定一种或多种目的蛋白质组实现了极好的结果。 患者蛋白质组学和亚蛋白质组学特征的普遍性确认 本发明可以提供诊断筛选检验,并且因此当收集临床数据时,选择代表用于初级护理水平的诊断筛选检验的预期使用环境的患者群体。如表13所总结的,患者群体包括年龄在50岁以上变化的男性和女性。为了检验患者群体中的这些变化是否对测量的实验参考线具有任何影响,进行了详细分析。在图42至48中,将每个个体男性和女性患者的实验参考线的系数绘制为患者年龄的函数。对于测量的所有蛋白质组和亚蛋白质组样本类型和标记的所有氨基酸类型,在所有情况下,患者性别或年龄对针对每个患者计算的实验蛋白质组参考线的系数没有影响。这证实了使用本发明的方法测量的蛋白质组学和亚蛋白质组学特征描述了任何患者群体并且特别不受性别或年龄的影响。该结果证实了本发明的方法对个体患者变异是稳健的,并且健康患者展示了单一的鉴定蛋白质组学和亚蛋白质组学特征。 在以下工作实例中,将健康患者的蛋白质组学特征与各种类型的癌症患者的蛋白质组学特征进行比较。 实例13:建立将用实验方法测量的质谱数据转换为理论参考线的机制 在工作实例10至12中,证明了针对目的PPP蛋白质组测量的实验值与由目的PPP蛋白质组理论参考线预测的值匹配。理论参考线由本文所公开的向量函数定义并且使用本文所公开的向量函数计算,在血浆内测量的单个蛋白质的公开可获得的蛋白质定量值的数据集上操作。用实验方法测量来自健康患者的PPP血浆蛋白质组样本,并且因此提供健康患者血浆(PPP)蛋白质组学特征。 在建立了健康患者血浆(PPP)蛋白质组的参考线后,在以下工作实例中,理论参考线由本文所公开的向量函数定义并且使用本文所公开的向量函数计算,其在癌症患者血浆内测量的单个蛋白质的公开可获得的蛋白质定量值的数据集上进行操作。这些蛋白质是从已经耗尽血小板的血浆中测量的,相当于已经呈现的实验数据中的贫蛋白质血浆(PPP)。 因此,然后将用实验方法测量的PPP数据与针对具有不同类型和阶段的癌症的患者计算的理论参考线进行比较。然后使用本文所公开的机器学习和最小垂直距离方法来将患者样本鉴定为对应于健康患者(健康患者样本在工作实例10至12中用实验方法测量),或具有不同类型和阶段的癌症的患者。以这种方式,建立了本文所公开的蛋白质组学特征、亚蛋白质组学特征、参考线、向量函数和鉴定方法可以用于鉴定对应于健康患者或具有指示的癌症类型和阶段的患者的样本。 由Proteome Xchange数据库提供在癌症患者血浆内测量的单个蛋白质的公开可获得的蛋白质定量值。 首先,检查卵巢癌数据集,因为这附加地提供了健康对照,其允许验证本文所公开的方法用于在定量质谱数据上操作向量函数。 使用ProteomeXchange,在http://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD020557处下载PXD020557原始数据集。PXD020557原始数据集衍生自本研究,本研究的目的是通过使用质谱检查来自10名患有阶段III或IV浆液性卵巢癌的患者(卵巢癌患者)和10名不患有卵巢癌的患者(健康对照患者)的血浆样本来发现血浆内高级浆液性卵巢癌的个体代谢和蛋白质生物标记。使用液相色谱与串联质谱(LC-MS/MS)来鉴定血浆样本内的蛋白质。在LC-MS/MS方法中,将复杂样本分离成单个蛋白质组分,并且将这些单个蛋白质组分顺序电离并且导入两个质量分析器中。第一质量分析器通过它们的质荷比(m/z)分离每种蛋白质组分的离子,并且然后选择特定m/z比的离子,分成较小的碎片离子,在第二质量分析器中通过碎片离子的m/z比分离,并且然后检测。在分析患者血浆样本之前,执行分离步骤以去除血浆中的14种高丰度蛋白质,特别是使用MARS14亲和柱。该分离步骤耗尽了血浆样本内的白蛋白、a1-抗胰蛋白酶、a1-酸性糖蛋白、载脂蛋白A1、载脂蛋白A2、a2-巨球蛋白、补体C3、纤维蛋白原、触珠蛋白、IgA、IgG、IgM、转铁蛋白和甲状腺素运载蛋白,并且由于有限的仪器动态范围而在患者蛋白质组样本的质谱分析领域中是常见的。使用具有纳米ESI源的Q Exactive Plus组合型四极杆-轨道阱质谱仪执行MS/MS步骤。使用无标记定量(LFQ)来计算已被鉴定为存在于血浆样本内的每种蛋白质在每个血浆样本中的丰度,并且使用每种蛋白质的独特肽和剃刀肽的峰强度执行。 在PXD020557的ProteomeXChange中保存的文件内,提供了每个血浆样本内检测的每种蛋白质的登录号。有1385个登录号,并且其中1382个作为UniProt ID提供。每个血浆样本内检测的每种蛋白质的强度(丰度)也提供为使用无标记定量(LFQ)计算的强度。首先,将作为UniProt ID提供的1382个登录号映射到Swiss-蛋白质审查的人类蛋白质的1359个UniProt KB ID。每个UniProt KB ID描述了一种蛋白质。下载这些1359个UniProt KB ID以及每个UniProt KB ID描述的蛋白质的序列和分子量。 因为理论参考线数据将与实例10至12中报告的实验数据进行比较,其中C、K、W和Y氨基酸类型被标记和测量,使用本文所公开的方程11计算C、K、W和Y氨基酸类型的w 其中w q 质谱数据库中的无标记定量数据作为密度值int提供,其与存在的蛋白质的量(质量)成比例。这些提供的int值可以通过将单个蛋白质的强度除以其分子质量而转换为与存在的蛋白质的摩尔量成比例。 int 在方程11内,q是含有c蛋白质的目的蛋白质组或亚蛋白质组内的所有目的蛋白质i上的q 由此得出,就像方程11内int q====∑int 因此, 是如本文所公开的方程11中的 为了便于参考, 使用方程11中 表33 为了进一步验证使用MSIF 然后将针对已经耗尽MARS 14柱蛋白质的健康患者质谱数据集计算的w 方程11对从质谱和免疫测定两者生成的丰度数据稳健地执行,从而提供构建一致/统一的参考集(向量函数)的手段,即使采用不同的实验技术来生成基础数据。这提供了建立在现有数据源上的框架。 表34 健康患者血浆样本(其已经耗尽MARS14柱蛋白质)的质谱和免疫测定数据可以通过以下向量函数定义。 健康血浆 健康血浆 在本文所公开的本发明的方法之前,测量目的蛋白质组或亚蛋白质组需要单独测量目的蛋白质组或亚蛋白质组内的每种蛋白质。这可能是劳动力、成本和时间密集的,因为在进行可能合适的分析(诸如质谱实验所需的)之前需要将目的蛋白质组或亚蛋白质组分离成许多级分,或在靶向目的蛋白质组或亚蛋白质组内的每种单个蛋白质的免疫测定中使用结合剂诸如抗体。如果目的蛋白质组或亚蛋白质组含有400个蛋白质,用本文所公开的发明之前的本领域已知的方法,测量目的蛋白质组或亚蛋白质组将需要对目的蛋白质组或亚蛋白质组内含有的每种单个蛋白质进行400次测量(这是在分析的质谱和免疫测定数据中的情况)。 相反,在本文所公开的本发明的方法中,可以经由仅对目的蛋白质组或亚蛋白质组内的两种或更多种标记的氨基酸类型进行一次测量来鉴定目的蛋白质组或亚蛋白质组。本文所公开的方法与现有技术方法的现状互补,并且提供了一种方法,其中可以用简单的平均荧光强度测量来鉴定疾病状态,而不必单独测量体液内的蛋白质或寻求鉴定疾病的生物标记。因为测量平均特征,其按照定义覆盖了所有生物标记,所以不需要相关生物标记的先验知识。 此外,可以根据质谱数据集计算两种或更多种氨基酸类型的氨基酸浓度,其通过认识到质谱摩尔强度分数MSIF 此外,已建立使用MSIF 并且∑int 因此,通过简单除以a,可以将质谱数据库中针对单个患者计算的总摩尔强度(∑int 在实例12中已经建立,根据针对健康患者血浆样本(PPP样本)测量的实验数据计算的向量函数系数与根据人类肽图谱中健康患者贫血小板血浆样本内蛋白质的免疫测定测量计算的向量函数系数匹配。 在该实例中建立,来自健康患者的质谱向量函数与使用免疫测定质谱数据计算的向量函数匹配。已经建立根据从健康患者血浆样本中测量的实验数据计算的向量函数、根据从健康患者血浆样本的免疫测定数据计算的向量函数,和根据从健康患者血浆样本的质谱数据计算的向量函数都可以定量比较,在下面的工作实例中,将实例10至12中测量的健康患者血浆样本的实验数据与根据患有不同类型和阶段的癌症的患者的血浆样本计算的质谱数据进行比较。 实例14:与健康、卵巢癌或胰腺癌血浆蛋白质组对应的患者样本的鉴定 数据集PXD020557提供卵巢癌患者的贫血小板血浆内测量的单个蛋白质的蛋白质定量数据,并且数据集PXD005144提供胰腺癌患者的贫血小板血浆内测量的单个蛋白质的蛋白质定量数据,其各自如实例13中所解释的来处理。例如,通过认识到∑int 通过取健康患者的平均总摩尔丰度值,并且将其除以人类肽图谱免疫测定数据集中的总摩尔蛋白质浓度来计算a,该数据集不包括在使用MARS14柱的质谱实验中耗尽的蛋白质。例如,对于卵巢癌数据集,a计算为4.41x10 表35 然后,如向量函数2所指定的,将总摩尔浓度值乘以向量函数系数w 用于分析卵巢癌数据集的相同方法被复制以分析胰腺癌数据集(数据集PXD005144),其也可从http://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD005144的Proteome Xchange中获得。 下面提供了被复制的步骤的说明性子集。 表36 /> 对于该数据集,无癌症(慢性胰腺炎)患者的平均总摩尔强度为281.303,得到a值为0.547,然后将该值乘以总摩尔强度以计算以μM计的总摩尔浓度。 K、C、W和Y氨基酸类型的两组氨基酸浓度的结果如下表37所示。 表37 /> 为了检验本发明的方法从血浆中鉴定三种癌症特征的能力,添加了附加数据集。PXD013150数据集在http://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD013150处访问并且从Proteome Xchange中下载。该数据集提供了在临床干预之前在患有结肠直肠癌的患者的血浆样本内测量的蛋白质的定量质谱数据。 尽管复制了许多步骤,但因为这个数据集的处理略有不同,所以要对其进行解释。在衍生PXD013150数据集的本研究中,作者使用BCA测定测量了每种血浆样本的按质量计的总蛋白质浓度,并且将样本标准化,使得每种具有按质量计的100μg总蛋白质。当将本文所公开的方法应用于该数据集时,该特征允许执行替代的归一化。质谱强度值与质量成比例(https://www.ncbi.nlm.nih.gov/pmc/artic1es/PMC3946283/)。已知每种中所有蛋白质的总质量浓度为100μg,因为这已经使用BCA测定计算了。因为质谱强度值与质量成比例,所以对于每个样本,强度值的总和等于100kg总蛋白质。因此,计算每种蛋白质的强度除以样本中所有蛋白质的强度的总和 在方程11中,q 附加地,步骤总结如下,并且结果报告于表39中。 =根据质谱数据库诸如Proteome Xchange计算的归一化强度(这是分数,单位为AU) (分数,AU)x 100μg总蛋白质=每种蛋白质的质量量(μg) 质量量(μg)/蛋白质质量(g/mol)=摩尔量(μmol) 摩尔量的总和(μmol)给出总摩尔量(μmol) 摩尔量(μmol)/总摩尔量(μmol)在方程式11中给出 表38:结肠直肠癌数据集的总摩尔量(nmol)、K量(nmol)、C量(nmol)、W量(nmol)和Y量(nmol)。 /> 通过假定所有样本的标准体积为5μL,将以上针对以上结肠直肠癌计算的总摩尔量值转变为总摩尔浓度值。如前所解释的,为了将量转换为浓度,将该量除以体积。这将结肠直肠癌总摩尔量值转变为与针对卵巢癌和胰腺癌计算的总摩尔浓度值相当的总摩尔浓度值,从而允许在最严谨和稳健的环境中从待评估的患者血浆样本中鉴定多于一种目的疾病状态蛋白质组。 如上所描述的计算的结肠直肠癌总摩尔浓度和总摩尔氨基酸浓度值呈现在表39中。如上所解释的计算的它们的以μM计总摩尔浓度值也提供在该表中。另外,将目的结肠直肠癌亚蛋白质组的氨基酸浓度绘制为总摩尔蛋白质浓度的函数,以计算目的结肠直肠癌亚蛋白质组的参考线,如图59至62所示。 表39:结肠直肠癌总摩尔浓度和总摩尔氨基酸浓度值 /> /> 最后,将所有这些数据集与实例10至12中测量的健康患者目的亚蛋白质组(PPP样本类型)的实验值一起绘制在N维空间中。结果示出在图50中。该数据的线性性质允许参考线的方便可视化。 当在4维空间中针对标记和测量的4种类型的氨基酸(N维空间)绘制这些结果时,在图50中观察到健康患者(PPP,工作实例10至12)、卵巢癌、胰腺癌和结肠直肠癌样本在4维空间中的位置的显著差异。附加地,每个数据集采用如本文所公开的线的形式,并且由参考线很好地描述。每条参考线的方程由向量函数提供。 为了使用所提供的来自许多患者样本的数据计算向量函数2的每个向量函数分量的方向/系数,将每个目的蛋白质组的每个氨基酸浓度绘制为每个目的蛋白质组的总摩尔蛋白质浓度的函数,因为每个目的蛋白质组的总蛋白质浓度是共同的(参数的/基础的),经由该总蛋白质浓度,每个目的蛋白质组的氨基酸浓度参考经由向量函数2用代数方法表达。然后,执行线性回归,并且该斜率提供向量方向。线性回归示出在图51至62中。作为替代方法,可以计算每个目的蛋白质组(健康PPP、卵巢癌、胰腺癌、结肠直肠癌)的所有患者样本的w 每条参考线的方程由向量函数2提供,并且以下分别包括K、C、W和Y氨基酸类型。因为结肠直肠癌、胰腺癌和卵巢癌的参考线是在理论上计算的,所以对于健康患者PPP数据集在理论上计算的参考线也被提供用于该方法的稳健检验。 P P P P 将患者样本与每种目的蛋白质组(健康PPP、卵巢癌血浆、胰腺癌血浆、结肠直肠癌血浆)的参考进行比较。如本文所公开的,通过向量函数在任何总蛋白质浓度/量下用代数方法提供每个参考。如本文所公开的,每个参考由向量函数2提供。替代地,每个参考可以由产生等效结果的参数方程组2提供。然后,进行检验2以确定每个样本是否在每个目的蛋白质组的向量函数参考的误差容限内。因为已知在每个研究中,不包括具有多于一种癌症类型的患者,所以已知在每个患者样本内仅存在一种目的蛋白质组。因此,如本文所公开的,误差容限被设置为等于样本点与每条参考线之间的垂直距离的最小值。如本文所公开的,使用点积计算样本点与每条参考线之间的垂直距离(实例1至9)。因为误差容限被设置为等于垂直距离的最小值,所以每个样本点被鉴定为由提供垂直距离的最小值的参考线定义的目的蛋白质组。当在样本内鉴定目的蛋白质组时,如本文所公开的,还经由在提供垂直距离的最小值的参考线上找到特定点来鉴定样本内目的蛋白质组的总浓度。结果示出在下表40中并且在图63中总结。 表40 /> /> /> /> /> /> /> 本文所描述的向量函数方法对于从血浆中鉴定结肠直肠癌具有100%准确度(敏感性),对于从血浆中鉴定卵巢癌具有90%准确度(敏感性),对于从血浆中鉴定胰腺癌具有100%准确度(敏感性),并且对于从血浆中鉴定健康样本(不存在癌症)具有95%准确度(特异性)。 附加地,使用本文所描述的向量函数方法,不仅可以鉴定目的蛋白质组的存在与否,而且可以鉴定目的蛋白质组的量。为了说明本发明的方法可获得的稳健信息,下面图64示出了目的蛋白质组的总蛋白质浓度的预测值对真实值。 所有患者样本落在线y=x上,这意味着所鉴定的目的癌症或健康蛋白质组的量是准确的。在优选的实施例中,该量与癌症阶段相关。 作为替代方法,如本文所公开的,使用机器学习分类器在样本内鉴定目的蛋白质组。具体地,将数据集随机分成两部分,75%的数据提供用于训练分类器的每个目的蛋白质组的参考,以及25%的数据被保留并且用于检验训练后的分类器的性能。利用框式约束水平1、一对一多类方法、线性核函数、自动核缩放和数据标准化,对线性支持向量机(SVM)分类器进行了训练。使用K、C、W和Y氨基酸类型鉴定的结果示出在图65中。对于每种目的癌症蛋白质组(所有癌症患者样本)以及健康目的蛋白质组(所有健康患者样本)获得100%阳性预测值和0%错误发现率。 然而,当仅标记和测量三种或两种氨基酸类型时,本发明的方法提供等效结果。为了说明这一点,图66提供了当使用与上述相同的设置训练线性SVM分类器时的结果,但仅获得三种氨基酸类型(K、C和W)的氨基酸浓度。如在四种氨基酸类型的情况下,在所有目的癌症蛋白质组中获得100%敏感性和特异性。 最后,训练线性SVM分类器,但这次仅允许访问两种氨基酸类型(K和C)的氨基酸浓度。与3和4种氨基酸类型的情况一样,获得100%敏感性和100%特异性,如图67所示。 机器学习是稳健的方法,其中在参考训练集上训练计算机程序,并且学习正确地分类。本文呈现的其中执行假设检验以将样本鉴定为参考函数提供的参考的分析解方法不涉及训练或学习步骤,并且用于从血浆中鉴定多种癌症类型的敏感性和特异性与分析方法和机器学习(96.67%的平均敏感性和95%的特异性)相当的事实说明了将目的蛋白质组或亚蛋白质组描述为参考线,并且针对该参考执行鉴定的能力的稳健性。附加地,该方法允许同时高度准确(在2%误差内)确定目的癌症相关的蛋白质组或亚蛋白质组的浓度或量。 实例15:从血浆中鉴定癌症阶段和位置 在该数据集中,使用质谱对临床干预前来自阶段II和阶段III结肠直肠癌患者的贫血小板血浆样本内的蛋白质进行定量。附加地根据结肠直肠癌的类型(结肠癌、直肠癌)和癌症的位置(左和右结肠)将患者分组。结果提供在表41中。 表41:结肠直肠癌患者的氨基酸量,按癌症阶段和位置分组。 /> /> 表41中由向量函数提供的氨基酸量被随机分成两组。含有80%的氨基酸量的第一组提供了用于训练机器学习分类器的参考,并且评估了机器学习分类器在鉴定保留用于验证的另外20%的氨基酸量时作为参考中的一个的性能。 首先,使用氨基酸量训练集成子空间KNN分类器以从血浆中鉴定结肠直肠癌的阶段。分类器使用具有30个学习器、子空间维度为2,以及默认成本矩阵的最近邻学习器类型。78%的时间,阶段III结肠直肠癌被正确鉴定为特定阶段III(参见图68)。 附加地,氨基酸量用于训练线性支持向量机(SVM)分类器以从血浆中鉴定结肠直肠癌的位置。分类器使用数据标准化、自动核函数、一对一多类方法、1框式约束水平和默认成本矩阵。如图68和69所证明的,在患者的结肠直肠癌存在于左结肠中的情况下,分类器基于患者的氨基酸量和定义左结肠的氨基酸量的参考来正确地鉴定这一点。类似地,当患者的结肠直肠癌存在于右结肠中时,分类器基于患者的氨基酸量和定义右结肠的氨基酸量的参考来正确地鉴定这一点。最后,当分类器鉴定患者的氨基酸量对应于结肠直肠癌位置的参考时,该鉴定在100%的时间是正确的。这些结果总结为真阳性率、假阴性率混淆矩阵和阳性预测值、假发现率混淆矩阵(参见图68和69)。 实例16:从尿中鉴定多种类型的癌症 PXD008407数据集从在http://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD008407处的Proteome Xchange中下载。在PXD008407数据集中,在临床干预前从患者收集第一次晨尿样本,并且使用质谱定量每个样本内的蛋白质。 PXD008407数据集的作者已经使用BCA测定通过每个血浆样本的质量定量了总蛋白质。在这种情况下,将浓度标准化,使得每个蛋白质样本具有200μg/mL的总质量浓度。应用先前针对结肠直肠癌数据集描述的方法,然后通过将 表42:在尿中测量的三种癌症类型的氨基酸浓度 /> 将向量函数2应用于本文所公开的该数据集,在尿中膀胱癌、前列腺癌和肾癌蛋白质组的任何总摩尔蛋白质浓度下提供K、C、W和Y氨基酸类型的氨基酸浓度的向量函数计算为: P P P 最后,为了鉴定尿内目的膀胱癌、前列腺癌和肾癌蛋白质组的存在,在提供参考的80%的数据点上训练立方体支持向量机(SVM)分类器,同时在保留的剩余的随机选择的20%的数据点上检验训练的数据集。立方体SVM使用数据标准化、具有一对一多类方法的自动核缩放、框式约束水平1和默认成本矩阵。 如图71所示,实现了100%正确鉴定和0%不正确鉴定,提供了100%真阳性率和0%假阴性率,用于使用本文所公开的方法从尿样本中鉴定膀胱癌、前列腺癌和肾癌。 本发明的方法可以从多种体液中检测癌症以及其它目的疾病的存在与否。
- 基于蛋白质相互作用网络和蛋白质组学的蛋白质鉴定方法
- 基于蛋白质相互作用网络和蛋白质组学的蛋白质鉴定方法
