一种抗PD-L1蛋白的纳米抗体及其应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物技术领域,具体涉及一种抗PD-L1蛋白的纳米抗体及其应用。
背景技术
1993年,Hamers的研究报告中提到,在羊驼科动物体内首次发现了一种特殊的抗体,被称为重链抗体或VHH抗体。这些抗体缺失了常见的轻链,在抗原结合方面仅依赖于重链的可变区域(VHHs)。VHH抗体是迄今为止功能最小完整的抗体分子片段,由4个框架区域(FR1~FR4)和3个互补决定区域(CDR1~CDR3)构成。其相对分子质量约为15k Da,仅为常规抗体的十分之一。这种抗体分子高度为4.8 nm,直径约为2.2 nm,因此被称为纳米抗体(nanobody)。纳米抗体具备许多优点,如分子量小、物理稳定性高、易于表达等。此外,纳米抗体不容易聚集沉淀,并且仍然保持与抗原结合的能力。
PD-1(程序性死亡分子1)是一种免疫抑制性受体,属于CD28超家族的T细胞调节受体。PD-1基因位于2q37.3染色体,编码一种含有288个氨基酸的跨膜蛋白。它的结构包括胞外区、跨膜区和胞质区,其中胞外区具有一个重要的IgV样结构域和4个N连接糖基化位点。PD-1在氨基酸序列上与CD28、CTLA-4和诱导型T细胞共刺激因子存在差异,因此与配体的结合非常特异。PD-1的表达广泛分布在T淋巴细胞、自然杀伤细胞、B淋巴细胞、巨噬细胞、树突状细胞和单核细胞等免疫细胞中。特别是在肿瘤特异性T细胞上表达较高。PD-1的转录受多种转录因子的调节,如NFAT、NOTCH、FOXM1和IRF9等。PD-1的过度表达在肿瘤、慢性感染和其他免疫相关疾病中起到免疫抑制的作用。
PD-L1(程序性死亡配体1)和PD-L2(程序性死亡配体2)是PD-1的两个配体,其中PD-L1是主要配体,由PD-L1基因编码。PD-L1的全长由7个外显子编码,是一种1型跨膜蛋白。PD-L1的表达可以是构成性的或诱导性的。构成性的PD-L1低水平表达在静息淋巴细胞、抗原递呈细胞和某些组织中存在,并有助于维持组织的稳态。在炎症或感染的情况下,PD-L1可以被诱导表达在造血细胞、内皮细胞和上皮细胞等免疫细胞上。PD-L1的表达受多种因素影响,如TLR和IFN-γ等信号通路。PD-L1的过度表达在肿瘤中起到逃避免疫应答的作用。PD-L1通过与其受体结合并激活增生性和存活信号通路,在癌细胞中具有促肿瘤发生的作用。
肿瘤细胞表面的PD-L1与T细胞表面的PD-1受体结合后,可抑制T细胞的活性,使阻滞在G0/G1期,从而抑制T细胞的增殖,并诱导T细胞的凋亡,从而造成肿瘤免疫逃逸。PD-1/PD-L1抑制剂可阻断PD-1和PD-L1的结合,使T细胞恢复活性,实现对肿瘤细胞的免疫抑制。虽然PD-1/PD-L1抑制剂已在临床上用于治疗多种肿瘤,但仍面临着有效率低、引发自身免疫性疾病等问题。
近年来,越来越多的研究发现多种肿瘤病人的血浆中存在着高浓度的和可溶性PD-L1,并且可以发挥与细胞膜表面PD-L1同样的免疫抑制功能,这可能是PD-1/PD-L1疗法反应率低的一个原因。免疫细胞暴露于不含PD-L1的肿瘤细胞后可被重新激活,并可行进至远处攻击可分泌PD-L1的肿瘤细胞,还会诱导T细胞产生强大的记忆反应,抑制可分泌PD-L1肿瘤细胞的生长。
CN115433281A公开了抗PD-L1的人源化纳米抗体,结果显示:纳米抗体NB43,M2,M5和M7亲和力分别为6.772nM,2.667nM,1.047nM和19.84nM。
开发一种抗PD-L1白的纳米抗体具有非常重要的意义。
发明内容
本发明的目的在于克服现有技术的至少一个不足,提供一种PD-L1蛋白的纳米抗体及其应用。
本发明所采取的技术方案是:
本发明的第一个方面,提供:
一种抗PD-L1蛋白的纳米抗体,包括框架区域和互补决定区域,其互补决定区域CDR1~CDR3的氨基酸序列为CDR1:
在一些纳米抗体的实例中,其框架区域FR1~FR4的氨基酸序列如下:
FR1:VQLQESGGGSVQAGGSLRLSCAAS、FR2:MGWFRQAPGKEREGIAT、FR3:NYADSVRGRFTISKDNAKNTLYLQINSLKPEDTAVYYC、FR4:WGQGTQVTVSS。
在一些纳米抗体的实例中,其氨基酸序列为:
M
本发明的第二个方面,提供:
一种基因,其编码本发明第一个方面所述的纳米抗体。
在一些基因的实例中,根据表达体系的不同进行密码子优化。
在一些基因的实例中,其核苷酸序列为:
CCATGGTGCAGCTGCAGGAAAGCGGCGGCGGCAGCGTGCAGGCGGGCGGCAGCCTGCGCCTGAGCTGCGCGGCGAGCCGCTTTACCGCGAGCATGGGCTGGTTTCGCCAGGCGCCGGGCAAAGAACGCGAAGGCATTGCGACCGTGAGCGGCGCGGCGAGCACCAACTATGCGGATAGCGTGCGCGGCCGCTTTACCATTAGCAAAGATAACGCGAAAAACACCCTGTATCTGCAGATTAACAGCCTGAAACCGGAAGATACCGCGGTGTATTATTGCGCGGCGAGCAGCACCAGCACCTATGCGTATTATTGCGCGGCGCGCGATAACTATTATGCGTTTCTGAGCCGCGGCGCGCGCGATTTTCGCTATTGGGGCCAGGGCACCCAGGTGACCGTGAGCAGCCACCACCACCACCACCACTGACTCGAG。
本发明的第三个方面,提供:
一种表达体系,插入有本发明第二个方面所述的基因。
在一些表达体系的实例中,其为原核表达体系或真核表达体系。
在一些表达体系的实例中,原核表达体系为大肠杆菌。
在一些表达体系的实例中,真核表达体系为CHO细胞。
本发明的第四个方面,提供:
本发明第一个方面所述纳米抗体在制备PD-1配体免疫吸附剂中的应用。
在一些应用的实例中,所述PD-1配体包括但不限于PD-L1分子。
在一些应用的实例中,所述免疫吸附剂用于治疗由可溶性的PD-1配体引起的肿瘤抑制作用。
在一些应用的实例中,所述肿瘤包括但不限于透明细胞肾细胞癌、多发性骨髓瘤、黑色素瘤、非小细胞肺癌、胃癌、头颈癌、非小细胞肺癌、胰腺导管腺癌和胶质母细胞瘤等。
本发明的第五个方面,提供:
一种免疫吸附剂,包括固相载体,所述固相载体上偶联有本发明第一个方面所述的纳米抗体。
在一些免疫吸附剂的实例中,所述固相载体选自壳聚糖、琼脂糖、纤维素、葡聚糖、树脂、纤维素中的至少一种。
在一些免疫吸附剂的实例中,所述固相载体上还偶联有其他免疫吸附蛋白。
在一些免疫吸附剂的实例中,采用NHS活化法进行偶联。
在一些免疫吸附剂的实例中,所述偶联的步骤如下:
1) 纳米抗体溶液用pH=8 .0~8 .5含0 .1M NaHCO
2) 取NHS预活化的填料用预冷的1mM HCl偶联溶液A进行冲洗,冲洗完成后加入0.5倍填料体积的偶联溶液A,然后再加入1 .5倍填料体积的纳米抗体溶液,振荡孵育后加入2倍填料体积的封端液(0 .1M Tris-HCl,pH=8 .3)振荡封端,然后抽干;
3) 往抽干后的填料中加入pH=8~9的0 .1M Tris-HCl与pH=3~6的0 .2M醋酸交替洗涤,然后加入PBS溶液清洗填料,抽干,保存于20%乙醇中。
本发明的第六个方面,提供:
一种血液净化器械,其包括本发明第五个方面所述的免疫吸附剂。
本发明的第七个方面,提供:
一种PD-L1蛋白检测试剂,包括本发明第一个方面所述的纳米抗体。
本发明的有益效果是:
本发明一些实例的抗PD-L1蛋白的纳米抗体,对游离的可溶性PD-L1分子具有良好的结合力,可用于吸附去除肿瘤患者血液中游离的可溶性PD-L1分子。因抗原抗体的结合力更强,所以相较于受体PD-1合成的免疫吸附剂,其对特定的PD-L1蛋白的清除效率更高,为癌症的免疫治疗提供了新的治疗方式。同时也可以用于PD-L1蛋白的检测。
本发明一些实例的免疫吸附剂和血液净化器械,可以通过血液净化的方式同时清除肿瘤患者血清中游离的可溶性PD-L1分子,提高清除率,减少免疫逃逸作用,增强NK细胞的靶向杀伤作用。
附图说明
图1是纯化的抗PD-L1蛋白纳米抗体电泳图。
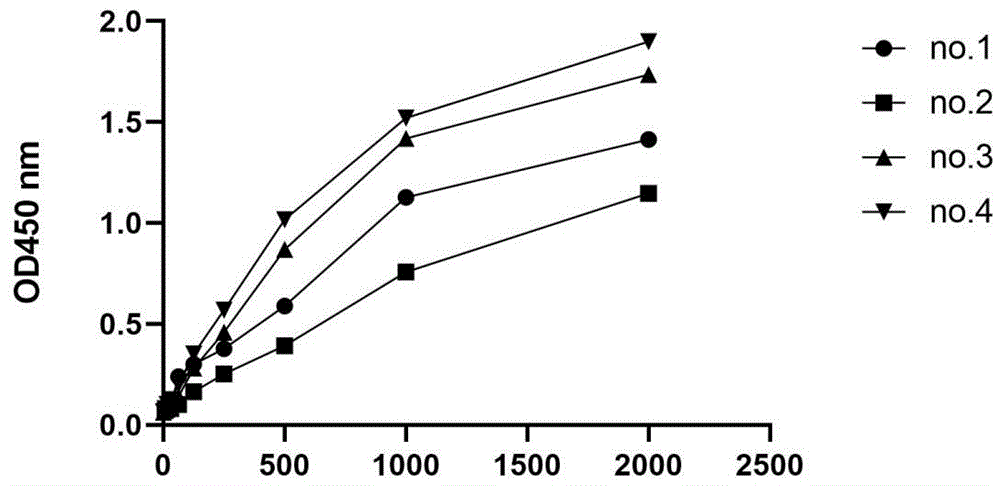
图2是抗PD-L1蛋白纳米抗体的ELISA结果。
具体实施方式
下面结合实例,进一步说明本发明的技术方案。
实施例1:抗PD-L1蛋白羊驼噬菌体抗体库的建立
通过真核表达带有His标签的PD-L1蛋白,并将其转染至C1R细胞(人B淋巴母细胞)中,利用6只免疫羊驼获得外周血单核细胞PBMC。随后,从这些细胞中提取RNA,并将其反转录成cDNA。经过PCR扩增后,利用HindIII和NotI酶将产物切割,并将其连接到带有噬菌粒载体pHIAT-1上。接着,将此重组载体转化至大肠杆菌TG1中,以建立起初的噬菌体文库。
在细菌菌株TG1生长至对数生长期后,将辅助噬菌体M13KO7引入培养体系中,经过过夜培养后,通过离心收集上清液。随后,利用聚乙二醇(PEG)沉淀噬菌粒,并经过PBS洗涤、0.45 μm滤器过滤以除菌,从而获得VHH抗体文库。该抗体文库的容量达到4.5×10
实施例2:结合抗PD-L1蛋白的单克隆噬菌体抗体的筛选
辅助噬菌体M13KO7的滴度经测定为1×10
第一轮筛选:首先,在ELISA板上包被抗PD-L1蛋白,每孔添加2 µg,然后在4℃条件下过夜。随后,对板进行洗涤处理,并用3% BSA进行封闭。每个孔中加入100 µL的噬菌体库溶液,在37℃下孵育2小时,然后进行6次板洗。接着,使用甘氨酸缓冲液(gly-HCl)进行洗脱,随后用Tris-HCl缓冲液进行中和。从洗脱液中取10 μL用于测定滴度,剩余的洗脱液加入至5 mL培养至对数生长期的TG1菌种中。对这些菌种进行感染,将其在37℃下孵育30min,然后加入预热的2×YT培养基以使总体积达到10 mL。继续在37℃、250rpm的条件下培养30 min,然后加入氨苄至最终浓度为100 μg/mL,继续培养2小时。随后,加入卡那霉素以使最终浓度达到70 μg/mL,进行过夜培养,在4℃条件下以4000 rpm离心15分钟,收集上清液。将上清液与5 mL的PEG/NaCl混合,置于冰浴中进行1 h,然后在4℃条件下以9000 rpm离心20 min,将上清液倒掉。最后,使用PBS缓冲液进行重悬,进行离心以去除细胞碎片,得到噬菌体抗体颗粒。
第二轮筛选:在ELISA板上分别包被抗抗PD-L1蛋白,2µg/孔;其余操作同第一轮筛选。
第三轮筛选:在ELISA板上包被抗PD-L1蛋白,2µg/孔;其余操作同第一轮筛选。
在经过筛选后,筛选出的噬菌体被用于感染TG1细菌,并将这些细菌涂布在培养皿中。从培养后的平板上随机选择单个克隆,并将原始文库作为阴性对照,通过ELISA检测筛选出那些具有OD450值超过原始文库2倍的初步阳性克隆。在进行测序后,对测序结果进行去重处理,得到一系列不同的序列。从中挑选出6条表现最佳的抗PD-L1蛋白纳米抗体序列,分别命名为No.1至No.4。
其中氨基酸序列为:
No.1
MD
No.2
MD
No.3
M
No.4
M
上述氨基酸序列中,下划线标记的部分为互补决定区域(CDR),波浪线标记部分为框架区域(FR),各CDR和FR的氨基酸序列如表1所示。
表1、不同纳米抗体的结构分析表
其核苷酸序列为:
No.1-DNA序列
CCATGGATGTGCAGCTGGTGGAAAGCGGCGGCGGCCAGGTGCAGGCGGCGGGCGGCAGCCTGAAACTGAGCTGCCAGGCGAGCGGCTATACCATTAGCCGCAACAGCATGGGCTGGTTTCGCCAGGCGCCGGGCAAACAGCGCGAAGGCGTGGTGGCGATTGAAAACAGCGATGGCAGCACCACCTATGCGGATAGCGTGAAAGGCCGCTTTACCATTAGCCTGGGCAACGCGGCGAAAAACACCCTGTATCTGGAAATGAACAGCCTGAAACCGGAAGATACCGCGATGTATTGCGCGGCGCCGAAAGTGGGCCAGGTGAGCCGCACCGTGCTGGGCCATCTGGCGTTTATGACCCTGCCGGCGCTGAACTATTGGGGCCAGGGCACCCAGGTGACCGTGAGCAGCCACCACCACCACCACCACTGACTCGAG (SEQ ID NO.:22)
No.2-DNA序列
CCATGGATCAGGTGCAGCTGGTGGAAAGCGGCGGCGGCCAGGTGCAGGCGGCGGGCGGCAGCCTGAAACTGAGCTGCCAGGCGAGCGGCTATACCATTAGCCGCAACAGCATGGGCTGGTTTCGCCAGGCGCCGGGCAAACAGCGCGAAGGCGTGGTGGCGATTGAAAACAGCGATAGCACCACCTATGCGGATAGCGTGAAAGGCCGCTTTACCATTAGCCTGGGCAACGCGGCGAAAAACACCCTGTATCTGGAAATGAACAGCCTGAAACCGGAAGATACCGCGATGTATTGCGCGGCGCCGAAAGTGGGCCAGTTTAGCGATATTGCGCTGGGCCATCTGGCGTTTATGACCCTGCCGGCGCTGAACTATTGGGGCCAGGGCACCCAGGTGACCGTGAGCAGCCACCACCACCACCACCACTGACTCGAG (SEQ ID NO.:23)
No.3-DNA序列
CCATGGTGCAGCTGGTGGAAAGCGGCGGCGGCCAGGTGCAGGCGGCGGGCGGCAGCCTGAAACTGAGCTGCCAGGCGAGCGGCTATACCGCGAGCATGGGCTGGTTTCGCCAGGCGCCGGGCAAAGAACGCGAAGCGGTGGCGATTGAAAACAGCGATAGCACCACCTATGCGGATAGCGTGCGCGGCCGCTTTACCATTAGCCTGGGCAACGCGGCGAAAAACACCCTGTATCTGCAGATTAACAGCCTGAAACCGGAAGATACCGCGGTGTATTATTGCGCGGCGCGCGATGATGATTATGCGTTTCTGAGCCGCGGCGCGCGCGATTTTCGCTATTGGGGCCAGGGCACCCAGGTGACCGTGAGCAGCCACCACCACCACCACCACTGACTCGAG (SEQ ID NO.:24)
No.4-DNA序列
CCATGGTGCAGCTGCAGGAAAGCGGCGGCGGCAGCGTGCAGGCGGGCGGCAGCCTGCGCCTGAGCTGCGCGGCGAGCCGCTTTACCGCGAGCATGGGCTGGTTTCGCCAGGCGCCGGGCAAAGAACGCGAAGGCATTGCGACCGTGAGCGGCGCGGCGAGCACCAACTATGCGGATAGCGTGCGCGGCCGCTTTACCATTAGCAAAGATAACGCGAAAAACACCCTGTATCTGCAGATTAACAGCCTGAAACCGGAAGATACCGCGGTGTATTATTGCGCGGCGAGCAGCACCAGCACCTATGCGTATTATTGCGCGGCGCGCGATAACTATTATGCGTTTCTGAGCCGCGGCGCGCGCGATTTTCGCTATTGGGGCCAGGGCACCCAGGTGACCGTGAGCAGCCACCACCACCACCACCACTGACTCGAG (SEQ ID NO.:25)
上述核苷酸序列中从酶切位点CCATGG里面的ATG开始翻译,最后六个核苷酸是构建环状质粒载体所需要的酶切位点。
实施例3:纳米抗体的体外表达和纯化
将No .1~No .4抗PD-L1蛋白纳米抗体的基因序列分别通过酶切位点NcoI和XhoI转入PET28质粒中,在大肠杆菌BL21(DE3)中表达。用含有70 µg/mL卡那霉素的LB培养基扩大培养后,收集菌体,超声破碎(开5s,停10s,工作时间20 min)后,10000rpm离心10 min,收集上清液。利用His标签用镍离子螯合填料进行纯化,收集洗脱峰即得到抗PD-L1蛋白羊驼纳米抗体。测定纳米抗体的表达量为358 mg/L。
纯化蛋白见图1,SDS-PAGE测定No.1抗PD-L1蛋白纳米抗体分子量为15 KD。其余3条抗PD-L1蛋白纳米抗体的氨基酸序列按同样的方法表达和纯化。
实施例4:纳米抗体对PD-L1蛋白结合活性检测
S1) 在ELISA板上包被PD-L1蛋白,用包被液(0 .1M PBS,pH=7 .4)将蛋白浓度稀释为5 μg/ml,然后按100 μL/孔加入,4℃过夜;
S2) 次日弃掉孔内缓冲液,使用吸水纸拍干,每孔再次加入250 μL的ELISA洗涤液(0 .05%吐温20/0 .1M PBS),洗板3次;
S3) 用5%的BSA封闭,37℃孵育2 h,洗板3次;
S4) 洗板后每孔中加入4种抗PD-L1纳米抗体蛋白,每种纳米抗体按照不同浓度稀释(2000 pg/mL、1000 pg/mL、500 pg/mL、250pg/mL、125 pg/mL、62.5 pg/mL…… 、3.9 pg/mL),37℃恒温培养箱孵育2 h,洗板3次;
S5) 洗板后加入抗His标签带HRP标记的抗体,按1: 5000比例稀释,100 μL/孔加入,之后置于37℃的恒温培养箱孵育1 h,洗板6次;
S6) 洗板后各孔加入100 μL TMB显色液,避光37℃反应10~15 min,当实验组孔内变为蓝色,空白及阴性对照组孔内无明显的颜色变化时终止反应;
S7) 加入100 μL的1M H
ELISA结果显示,4种抗PD-L1蛋白纳米抗体与PD-L1蛋白都有结合活性(图2),结合活性最高的抗PD-L1蛋白纳米抗体为No .4。
实施例5:免疫吸附剂的合成及吸附性能测定
S1) 取5 mL碘乙酰预活化的琼脂糖填料,用约30 mL的偶联液(50 mM Tris,5 mMEDTA-Na,pH 8 .5)冲洗填料,抽干;
S2) 分别加入5 mL浓度为10 mg/mL的抗体溶液(No1、No.2、No.3和No.4),充分混匀,取出转移到离心管中,28℃,120 rpm振荡孵育1 h;
S3) 反应完成后,流干其中溶液,再用3倍柱体积的偶联液(50 mM Tris,5 mMEDTA-Na,pH 8 .5)冲洗填料,抽干;
S4) 加入5 mL的封闭液(50 mM Tris,5 mM EDTA-Na,50 mM L-半胱氨酸,pH8.5),充分混匀,取出转移到离心管中,28℃振荡孵育1h;最后抽干封闭液,用3倍柱体积的pH8 .0,20 mM PBS清洗填料,用20%乙醇保存;
S5)用10mL EP管分别装入1 mL的上述合成填料及2 mL的PD-L1蛋白溶液(自制),28℃,100 rpm接触1~2 h后,将填料置于一次性亲和层析柱中,抽干填料;
S6)用PD-L1 Human ProcartaPlex™ Simplex Kit检测吸附前后上清液中PD-L1含量的变化。以空白的琼脂糖GE Sepharose 6FF作为对照。
S7)计算
吸附性能=(吸附前含量-吸附后含量)/填料体积
清除率=1-(吸附前含量-吸附后含量)/吸附前含量
吸附结果见表2。
表2 合成吸附剂吸附PD-L1性能测定
以上是对本发明所作的进一步详细说明,不可视为对本发明的具体实施的局限。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的简单推演或替换,都在本发明的保护范围之内。
