一种刚地弓形虫自噬相关蛋白8单克隆抗体及其制备方法和应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及生物技术领域,具体是一种刚地弓形虫自噬相关蛋白8单克隆抗体及其制备方法和应用。
背景技术
刚地弓形虫(
自噬(Autophagy)是从酵母到哺乳动物的真核生物间保守的细胞内降解过程。自噬的主要功能之一是在正常生长条件下维持基础细胞稳态,另一方面,自噬对于几乎所有真核生物在不同应激条件下的应激管理至关重要。自噬体的形成需要自噬相关蛋白(autophagy related proteins,Atg)及其复合体在不同阶段发挥作用,而Atg8在自噬体的扩张、闭合以及与溶酶体的融合形成自噬溶酶体的过程中发挥核心作用。目前研究表明,弓形虫自噬相关蛋白8(TgAtg8,TGGT1_254120)至少具有双重作用:(1)TgAtg8可以在饥饿诱导条件下参与自噬体形成;(2)在虫体正常分裂增殖过程中,TgAtg8可以定位在顶质体外膜,参与维持顶质体内稳态。因此,可以从TgAtg8发挥作用的两条途径中寻找新的药物靶点。
目前,对于TgAtg8蛋白的研究通常有两种方式,一种是通过构建在TgAtg8蛋白N端或C端连接标签蛋白的真核表达载体,转染至弓形虫中,通过标签抗体去间接识别TgAtg8在虫体的定位、蛋白表达以及蛋白间的相互作用等,另一种则是通过制备抗TgAtg8抗体直接识别内源性TgAtg8蛋白。前者可实现短期内对蛋白进行研究,但存在一些问题,例如标签蛋白可能影响TgAtg8在细胞内的定位以及蛋白间的相互作用等,同时该过表达TgAtg8蛋白的方式在某种程度上或影响内源性蛋白的表达和功能,而后者可弥补前者的不足。
本申请人课题组前期制备了兔TgAtg8多克隆抗体{刚地弓形虫自噬相关蛋白8(TgAtg8)多克隆抗体制备及初步应用[J].中国寄生虫学与寄生虫病杂志, 2014, 32(2):9-130-134}存在一些不足,例如抗体的特异性较差——在进行蛋白免疫印迹(WesternBlot,WB)以及间接免疫荧光法(Indirectimmunofluorescence,IFA)实验时分别出现杂带较多、荧光背景较高等问题,因此本发明人不断探索改进方案,希望找到一种杂带较少、荧光背景较低的抗体。
发明内容
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种刚地弓形虫自噬相关蛋白8单克隆抗体及其制备方法和应用,本发明所采取的技术方案如下:
第一方面,提供一种刚地弓形虫自噬相关蛋白8单克隆抗体,包括第一抗原结合区和第二抗原结合区,所述第一抗原结合区包括第一轻链可变区VL-1和第一重链可变区VH-1,第二抗原结合区包括第二轻链可变区VL-1和第二重链可变区VH-2,
所述第一轻链可变区VL-1的CDR1、CDR2、CDR3分别如SEQ ID NO:1的第27-37位、第55-57位、第94-102位所示,
所述第一重链可变区VH-1的CDR1、CDR2、CDR3分别如SEQ ID NO:2的第26-33位、第51-58位、第97-106位所示;
所述第二轻链可变区VL-2的CDR1、CDR2、CDR3分别如SEQ ID NO:3的第27-36位、第54-56位、第93-101位所示,
所述第二重链可变区VH-2的CDR1、CDR2、CDR3分别如SEQ ID NO:4的第26-33位、第51-58位、第97-108位所示。
所述第一抗原结合区的第一轻链可变区VL-1的氨基酸序列如SEQ ID NO:1所示,第一重链可变区VH-1的氨基酸序列如SEQ ID NO:2所示;
所述第二抗原结合区的第二轻链可变区VL-2的氨基酸序列如SEQ ID NO:3所示,第二重链可变区VH-2的氨基酸序列如SEQ ID NO:4所示。
第二方面,上述的刚地弓形虫自噬相关蛋白8单克隆抗体的制备方法中,选用免疫后血清效价高特异性好的小鼠的细胞与骨髓瘤细胞融合,并培养筛选得到阳性杂交瘤细胞。
第三方面,还包括上述刚地弓形虫自噬相关蛋白8单克隆抗体在制备检测试剂盒中的应用,尤其是检测刚地弓形虫自噬相关蛋白8的试剂盒中的应用。
本发明的有益效果如下:本发明制备了鼠抗TgAtg8单克隆抗体,与兔多克隆抗体相比杂带更少、荧光背景更低,有利于后续对TgAtg8蛋白的深入研究。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,根据这些附图获得其他的附图仍属于本发明的范畴。
图1为 His-TgAtg8融合蛋白的诱导表达、纯化及鉴定,其中A为原核表达蛋白His-TgAtg8融合蛋白的SDS-PAGE验证结果;B为His抗体识别原核表达蛋白His-TgAtg8融合蛋白的WB验证结果;C为His-TgAtg8融合蛋白纯化后的SDS-PAGE验证结果;
图2为单克隆细胞上清抗体效价检测和亚型鉴定,其中A为单克隆细胞上清抗体效价检测结果;B为单克隆细胞培养上清抗体亚型鉴定结果;
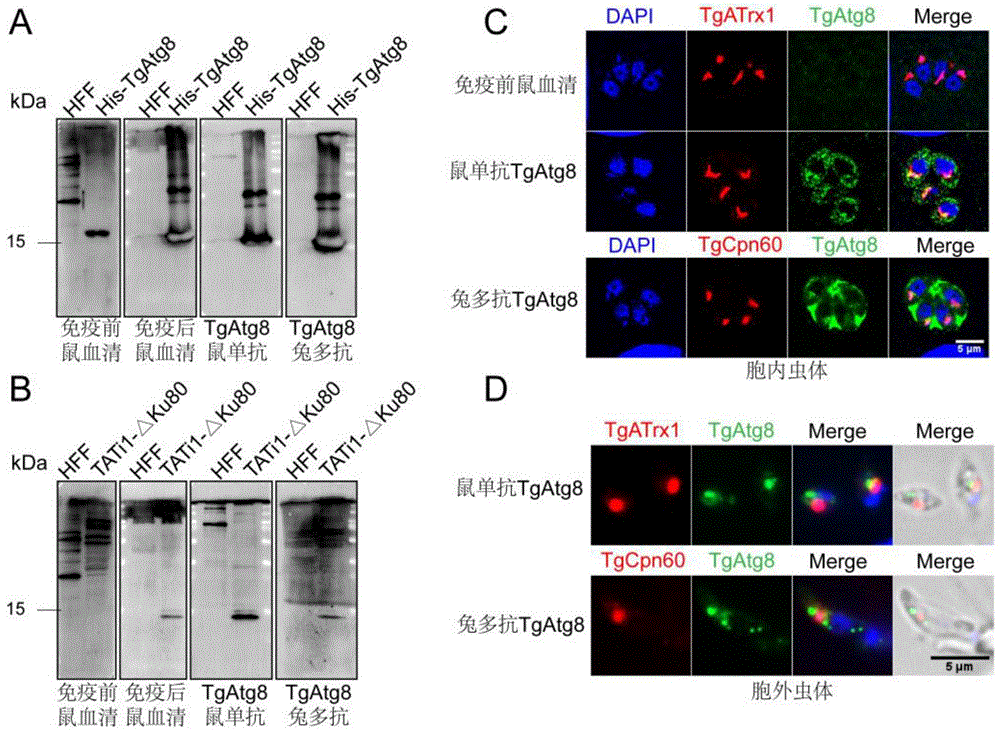
图3为鼠单克隆抗体TgAtg8识别内源性TgAtg8蛋白,其中A为单克隆抗体识别His-TgAtg8的WB检测结果;B为单克隆抗体识别内源性TgAtg8蛋白的WB检测结果;C为单克隆抗体识别胞内虫体TgAtg8蛋白的IFA结果;D为单克隆抗体识别胞外虫体TgAtg8蛋白的IFA结果,标尺为5μm。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
在本发明中,以原核表达、纯化的His-TgAtg8蛋白免疫BALB/c小鼠,经4次免疫后采取小鼠血清,以间接ELISA法与WB分别监测抗体效价及特异性;选择抗体效价较高、特异性较好的小鼠,取脾细胞与sp2/0骨髓瘤细胞进行细胞融合,将经HAT培养基筛选得到的阳性杂交瘤细胞以有限稀释法进行亚克隆;采用间接ELISA、WB和间接免疫荧光法IFA检测纯化的单克隆抗体效价和亚型、特异性和定位;将纯化单克隆抗体对应的杂交瘤细胞株进行抗体测序。
实施方法介绍:
1重组蛋白His-TgAtg8的诱导表达、纯化和鉴定
37℃过夜培养pCOLDⅢ-TgAtg8菌液,按照1:100比例重新接种于新的100mL的LB液体培养液中扩大培养,加入1mM IPTG诱导剂低温(16℃)诱导20-24 h,收集菌体,10mL预冷的PBS缓冲液重悬100 mL菌液沉淀,冰浴超声裂解,11000rpm,4℃离心15min收集上清。
小鼠免疫与杂交瘤细胞的筛选鉴定
取5只BALB/c小鼠,将纯化后的His-TgAtg8蛋白(100μl)与免疫佐剂(100μl)1:1混合乳化,于背部2点、腹部1点,各注射1/3体积(避免注射到小鼠左侧脾脏部位),第1次免疫抗原剂量为0.1mg/只,之后免疫为0.05mg/只,每隔两周免疫1次,共免疫4次。取免疫后小鼠血清进行抗体效价及特异性检测(WB检测免疫后血清是否识别弓形虫内源性TgAtg8蛋白),选取血清效价高特异性好的小鼠,在细胞融合前3天,取0.015mg His-TgAtg8蛋白进行腹腔注射加强免疫。小鼠安乐死后,取脾脏分离脾细胞后与骨髓瘤细胞SP2/0,在50%聚乙二醇的诱导下进行融合,通过含次黄嘌呤-氨基蝶呤-胸苷(hypoxanthine-aminopterin-thymidine,HAT)培养基筛选得到阳性杂交瘤细胞,将阳性杂交瘤细胞通过有限稀释法亚克隆得到单克隆细胞株,每次亚克隆期间,收集细胞上清作为一抗,进行2-3次间接ELISA筛选,得到能特异识别His-TgAtg8蛋白的阳性杂交瘤细胞株。
单克隆抗体的效价检测、亚型鉴定和纯化
(1)抗体效价检测
收集阳性杂交瘤细胞株的培养上清,以SP2/0细胞培养上清作为阴性对照,间接ELISA法检测A
(2)抗体亚型鉴定
间接ELISA法对单克隆抗体亚型进行鉴定。
(3)抗体纯化
(4)抗体测序
4单克隆抗体识别内源性TgAtg8
(1)WB检测抗体特异性
提取虫体总蛋白行SDS-PAGE电泳后,分别以免疫前鼠血清、纯化后的鼠抗TgAtg8单克隆抗体(1:1000)作为一抗,以课题组前期制备的兔抗TgAtg8多克隆抗体为阳性对照,羊抗鼠HRP-IgG(1:5000)、羊抗兔HRP-IgG(1:5000)作为二抗,WB检测抗体特异性。以重组His-TgAtg8蛋白为阳性对照,HFF细胞总蛋白为阴性对照。
(2)IFA检测单抗识别内源性TgAtg8
提前一天接种铺有爬片的HFF细胞(3.5×10
实施例:TgAtg8鼠单克隆抗体的制备
1重组蛋白His-TgAtg8的诱导表达、纯化和鉴定
为制备鼠单克隆抗体,首先获取抗原。原核表达His-TgAtg8蛋白,如图1A所示,诱导后沉淀及上清在15kDa左右均出现反应带,表明目的蛋白成功诱导表达;取诱导后超声裂解后上清进行纯化,以不同浓度咪唑洗脱液进行梯度洗脱,后对洗脱蛋白进行WB检测,anti-His为一抗,如图1B所示,His抗体能特异性识别目的蛋白;依据梯度洗脱WB结果,选择500mM咪唑洗脱液对后期纯化的结合蛋白进行洗脱,如图1C所示,得到纯度较高目的蛋白。综上,His-TgAtg8蛋白成功表达,可用于后续实施步骤。
单克隆细胞上清抗体效价检测、亚型鉴定及序列检测
ELISA检测结果显示,小鼠的血清抗体效价随着免疫次数的增加而逐渐升高,第四次免疫结束后小鼠血清抗体效价达1:128000。经过筛选得到三株阳性单克隆杂交瘤细胞,分别为15-A12-D2-B1、16-F9-F5、6-B9-E11-C1,取单克隆细胞培养上清进行抗体效价检测,各组取最高效价(1:128000)的OD值作图,结果显示(图2A),三株细胞培养上清抗体效价均达1:128000;结合细胞上清识别弓形虫内源性TgAtg8蛋白的WB检测,6-B9-E11-C1细胞株上清未能识别虫体内源性TgAtg8,15-A12-D2-B1、16-F9-F5细胞株均能识别虫体内源性TgAtg8但后者特异性最好,因此选取16-F9-F5细胞株培养上清进行抗体亚型鉴定以及后续抗体纯化以及抗体测序;间接ELISA结果显示,细胞分泌的抗体为IgG1亚型(图2B),抗体序列如表1所示。
效果验证
为检测纯化的单克隆TgAtg8是否能识别弓形虫内源性TgAtg8蛋白,提取弓形虫全虫蛋白进行WB检测,结果显示(图3A、3B),单抗能特异性识别内源性TgAtg8(免疫前鼠血清为阴性对照,TgAtg8兔多抗为阳性对照,His-TgAtg8作为阳性对照);胞内及胞外虫体IFA结果显示(3C、3D),单抗能特异性识别TgAtg8并与顶质体存在共定位。
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
