一种诱导多能干细胞定向分化为视网膜神经节细胞的方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物技术领域,涉及一种诱导多能干细胞定向分化为视网膜神经节细胞的方法,是将正常基因型和携带视神经疾病相关缺陷的诱导多能干细胞分化制备视网膜神经节细胞的方法。
背景技术
视网膜神经节细胞的损伤是多种视觉相关疾病的表征之一,并最终导致患者的视觉障碍,严重影响患者的个人生活,也对社会经济都造成巨大损失。目前,视网膜神经节细胞在人体中不可再生,也难以获取活体组织样本,这为视网膜神经节细胞退行性疾病的致病机制研究和治疗方案探索构成了障碍。因此,利用患者自体来源的体细胞诱导为诱导多能干细胞,体外定向分化为视网膜神经节是一种有效的用于研究视网膜神经节细胞退行性疾病的致病机制的细胞模型。但是携带严重的视觉相关疾病相关基因突变个体的诱导多能干细胞在体外诱导分化为视网膜神经节细胞的过程中通常面临较大的障碍,本发明通过对已有技术体系的改进,探索了一种可有效的将携带严重视觉相关疾病相关基因突变个体的诱导多能干细胞诱导为视网膜神经节细胞的方法。
发明内容
本发明的目的是提供一种诱导多能干细胞定向分化为视网膜神经节细胞的方法,是一种同时适用于正常个体和携带视觉障碍相关基因突变个体来源的诱导多能干细胞体外诱导为视网膜神经节细胞的方法。
本发明的诱导方法通过以下步骤实现:
(a)使用诱导分化培养基1将人诱导多能干细胞iPSC培养分化为富含神经祖细胞的拟胚体:将生长状态良好的正常或患者来源的诱导多能干细胞用Accutase消化为单细胞,计数后使用诱导分化培养基1悬浮培养7天形成富含神经祖细胞的拟胚体;
(b)使用诱导分化培养基2将(a)所述拟胚体分化为神经祖细胞:所述(a)中富含神经祖细胞的拟胚体使用诱导分化培养基2接种在0.1%浓度明胶包被的孔板上贴壁培养7天以使神经祖细胞成熟;
(c)使用诱导分化培养基3将(b)所述神经祖细胞分化为视网膜神经节细胞:所述(b)中成熟神经祖细胞用STEMdiff
其中步骤(a)在超低吸附6孔板中培养7天;步骤(b)在明胶包被6孔板中培养7天;步骤(c)在超低吸附6孔板中培养7天后在层粘连蛋白包被孔板中培养7-30天。所述的培养在37℃、5% CO
步骤(b)所述的明胶包被6孔板指提前加入0.1%浓度明胶溶液在37℃孵育30分钟以上孔板,使用前弃去孔中明胶。步骤(c)所述的层粘连蛋白包被孔板指提前加入1ng/ml浓度层粘连蛋白包被的孔板使用前弃去孔中包被液。所述的层黏连蛋白包被可用其它富含层黏连蛋白成分包被物如基质胶替代。
所述的神经祖细胞表达视神经祖细胞标志基因PAX6,RAX,ZO-1。所述的神经祖细胞在分化的第7-14天内聚集形成放射状的玫瑰花环细胞集落形态。
所述的视网膜神经节细胞表达视神经节细胞相关标志基因包括ATOH7,BRN3a,TUJ1,THY1,ISL1,SNCG。
所述的视网膜神经节细胞具备电生理功能,包括诱发电位和钠电流。
所述的诱导分化培养基1为:每ml含有非必须氨基酸2mM、谷氨酸/谷氨酰胺混合物2mM、丙酮酸钠1mM、尿苷50μg、N2 supplement 10μl,Y27632 10μg,Neurobasal培养基500μl,余量为DMEM/F12培养基,所述DMEM/F12培养基为DMEM高糖培养基和F12培养基按照体积比1:1混合而成。
所述的诱导分化培养基2为:每ml含有非必须氨基酸2mM、谷氨酸/谷氨酰胺混合物2mM、丙酮酸钠1mM、尿苷50μg、N2 supplement 10μl,Neurobasal培养基500μl,余量为DMEM/F12培养基,所述DMEM/F12培养基为DMEM高糖培养基和F12培养基按照体积比1:1混合而成。
所述的诱导分化培养基3为:每ml含有非必须氨基酸2mM、谷氨酸/谷氨酰胺混合物2mM、丙酮酸钠1mM、尿苷50μg、B27 supplement 20μl,DAPT 10μg,Neurobasal培养基500μl,余量为DMEM/F12培养基,所述DMEM/F12培养基为DMEM高糖培养基和F12培养基按照体积比1:1混合而成。
本发明的另一个目的是提供利用所述方法在体外诱导分化为视网膜神经节细胞中应用,是将正常诱导多能干细胞和基因缺陷诱导多能干细胞在体外诱导分化为视网膜神经节细胞。
通过本发明方法分化的视网膜神经节细胞,是适用于严重视觉疾病相关基因缺陷诱导多能干细胞分化为视网膜神经节细胞的方法。本发明方法具有高普适性,适用于将正常基因型,线粒体功能障碍和其它是视神经病变诱导多能干细胞分化为视网膜神经节细胞;降低了对手工操作的要求;减少了对细胞因子和抑制剂的需求,便于分析疾病表型;批次间重复性提高,为研究视网膜神经节退行性疾病提供了更好的细胞模型。
附图说明
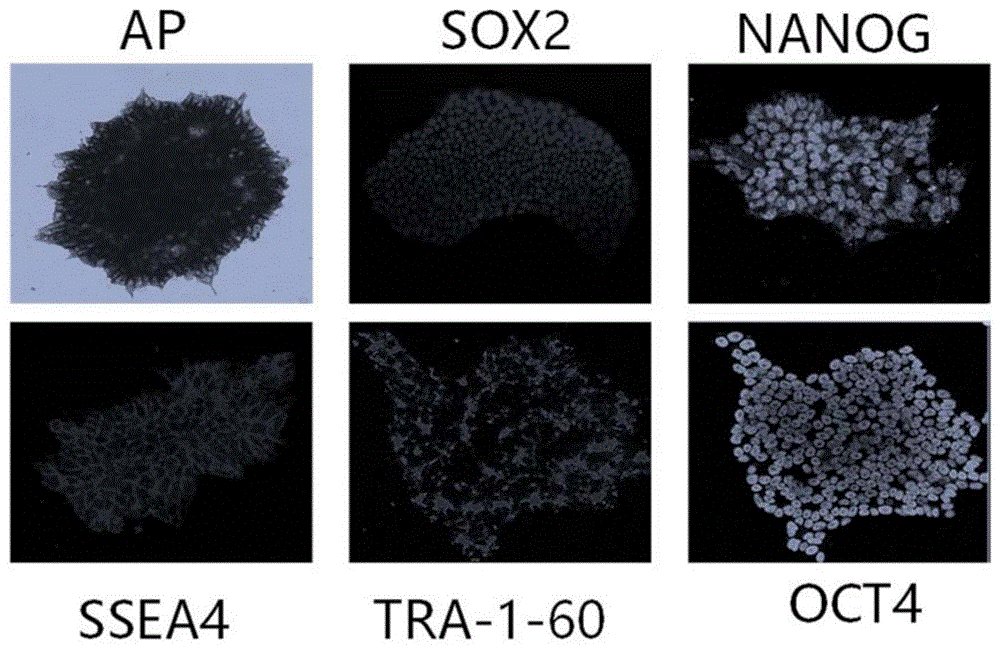
图1是无饲养层状态下培养的人诱导多能干细胞形态和干性鉴定,患者家系来源的诱导多能干细胞能长期传代,持续表现碱性磷酸酯酶(AP)染色阳性,表达多种多能性标志基因包括SOX2,NANOG,SSEA4,TRA-1-60,OCT4。
图2是诱导多能干细胞悬浮培养7天后富含神经祖细胞的拟胚体,拟胚体透明,圆形或椭圆形,边缘光滑,偶见凸起的单个细胞。
图3是拟胚体贴壁培养7天后的成熟神经祖细胞的特征性玫瑰花环细胞集落形态,玫瑰花环呈现清晰的上皮状细胞内核和放射状环状细胞群。
图4是成熟神经祖细胞悬浮培养7天后形成的富含未成熟视网膜神经节细胞的神经球,神经球边缘光滑,有界限清晰的亮环。
图5是从神经球中迁移出的成熟视网膜神经节的视网膜神经节细胞标志性细胞抗体ATOH7,BRN3a,TUJ1,THY1,ISL1,SNCG染色。
图6培养至52天的视网膜神经节细胞自发形成神经纤维束。
图7经过预贴附纯化的视网膜神经节细胞具有典型的神经细胞形态。
图8是成熟视网膜神经节细胞的动作电位检测,在接受外源刺激后,视网膜神经节细胞产生诱发电位。
图9是成熟视网膜神经节细胞的神经细胞钠电流检测,成熟视网膜神经节细胞存在内生性钠电流。
具体实施方式
以下是结合附图和实施例对本发明作进一步的说明,而不是对本发明的限制。
实施例1
(1)将诱导多能干细胞接种在基质胶包被的6孔板中,使用mTesR 1培养基日常培养,每天换液。选取生长状况良好,传代次数较少,处于对数生长期的诱导多能干细胞用于诱导分化。如附图1所示,这些细胞克隆形态清晰,表现出碱性磷酸酯酶阳性,表达干细胞相关标志基因SOX2,NANOG,SSEA4,TRA-1-60,OCT4。用Accutase将iPSC消化为单细胞,计数后取5X 10^6个细胞用3.6ml诱导分化培养基1重悬,转移到超低吸附孔板中悬浮培养,另外在细胞悬液中添加400ul胎牛血清和10ug Y27632。这一天被认为是诱导的D0。D0-D7拟胚体悬浮培养过程中Y27632需要持续添加。
(2)隔天更换新鲜的诱导分化培养基1,换液时使用自然沉降法收集拟胚体,以更好的去除死亡的细胞,同时避免离心导致的拟胚体过度黏连。换液时应动作轻柔,避免对拟胚体造成机械损伤。附图2所示为典型的成熟拟胚体形态。
(3)D7,自然沉降法收集拟胚体,用新鲜的诱导分化培养基2重悬,将拟胚体接种在明胶包被的6孔板上。
(4)D8-D13,隔天更换新鲜的诱导分化培养基2,期间可观察到神经花环结构出现,标志成熟神经祖细胞的出现。附图3所示为典型的神经祖细胞构成的神经花环。
(5)D14,用37℃预热的不含钙镁离子的PBS清洗孔板3次以洗掉死亡细胞和贴壁不牢的细胞,向孔板中加入1ml预热的STEMdiff
(6)D15-D20,每2-3天更换新鲜诱导分化培养基3,期间可见神经球形成。换液时500转离心3分钟后弃掉原培养基,加入新鲜培养基重悬,放在原来的孔中继续悬浮培养,换液时依然需要轻柔以避免对神经球造成机械损伤。附图4所示为典型的成熟神经球形态。
(7)D21,500转离心3分钟收集神经球。使用诱导分化培养基3将神经球以合适密度接种在层粘连蛋白包被的孔板上。接种2小时后即可见到视网膜神经节细胞贴附,可观察到神经突出现。
(8)D22以后,每天半量更换新鲜的诱导分化培养基3,避免细胞暴露在空气中以避免高氧气含量对神经细胞的损伤,也避免过于严重的微环境变化。
(9)对D28所获的视网膜神经节细胞免疫荧光染色可见视网膜视神经细胞相关标志基因表达,包括ATOH7,BRN3a,TUJ1,THY1,ISL1,SNCG,如附图5所示。诱导的视网膜神经节细胞可持续培养50天以上仍然保持活力,如附图6所示,高密度培养的视网膜神经节细胞可以自发形成神经纤维束。
实施例2
(1)将诱导多能干细胞接种在基质胶包被的6孔板中,使用mTesR 1培养基日常培养,每天换液。选取生长状况良好,传代次数较少,处于对数生长期的诱导多能干细胞用于诱导分化。用Accutase将iPSC消化为单细胞,计数后取5X 10^6个细胞用3.6ml诱导分化培养基1重悬,转移到超低吸附孔板中悬浮培养,另外在细胞悬液中添加400ul胎牛血清和10ug Y27632。这一天被认为是诱导的D0。D0-D7拟胚体悬浮培养过程中Y27632需要持续添加。
(2)隔天更换新鲜的诱导分化培养基1,换液时使用自然沉降法收集拟胚体,以更好的去除死亡的细胞,同时避免离心导致的拟胚体过度黏连。换液时应动作轻柔,避免对拟胚体造成机械损伤。
(3)D7,自然沉降法收集拟胚体,用新鲜的诱导分化培养基2重悬,将拟胚体接种在明胶包被的6孔板上。
(4)D8-D13,隔天更换新鲜的诱导分化培养基2,期间可观察到神经花环结构出现,标志成熟神经祖细胞的出现。
(5)D14,用37℃预热的不含钙镁离子的PBS清洗孔板3次以洗掉死亡细胞和贴壁不牢的细胞,向孔板中加入1ml预热的STEMdiff
(6)D15-D20,每2-3天更换新鲜诱导分化培养基3,期间可见神经球形成。换液时500转离心3分钟后弃掉原培养基,加入新鲜培养基重悬,放在原来的孔中继续悬浮培养,换液时依然需要轻柔以避免对神经球造成机械损伤。
(7)D21,将神经球收集到15ml离心管中,500转离心3分钟收集神经球。弃掉上清,使用1ml Accutase重悬神经球,在细胞培养箱中孵育30分钟,每隔5-10分钟取出吹打混匀一次,至无肉眼可见细胞团。向离心管中加入4ml DMEM/F12培养基,水平离心机1000转离心5分钟。弃上清,使用诱导分化培养基3重悬沉淀,40uM细胞筛过滤,将细胞悬液接种在明胶包被孔板上,放置于细胞培养箱,预贴附30分钟。30分钟后收集未贴附细胞,以合适密度接种在层粘连蛋白包被的孔板上。接种2小时后即可见到视网膜神经节细胞贴附,可观察到神经突出现。
(8)D22以后,每天半量更换新鲜的诱导分化培养基3,避免细胞暴露在空气中以避免高氧气含量对神经细胞的损伤,也避免过于严重的微环境变化。
(9)如附图7所示,分离出的视网膜神经节细胞具备神经细胞的典型形态特征。对视网膜神经节细胞进行电生理功能检验可见视网膜神经节细胞能够产生诱发电位(附图8),存在内生性钠电流(附图9),表明实施例产生了功能性的视网膜神经节细胞。
由以上实施例可知,本发明提供的方法即可以获得胞体主要存在于神经球中,向外延伸神经突的视网膜神经节细胞,也可以通过解离神经球和预贴附去除非神经细胞,简便的获得较为纯化的视网膜神经节细胞。该方法克服了已有方法的不足,在诱导过程中尽量避免了机械操作,节省时间和人力;减少了细胞因子和抑制剂使用,依赖分化中产生的细胞类群的相互作用,可以更好的模拟体内分化状况,适合用作疾病模型研究;可将携带严重视觉相关疾病相关基因突变个体的诱导多能干细胞诱导为视网膜神经节细胞,拓展了应用范围。
