一种用于蛋白质经皮给药的中空金属有机框架纳米粒子及其制备方法与应用
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及药剂学技术领域,特别涉及一种用于蛋白质经皮给药的中空金属有机框架纳米粒子及其制备方法与应用。
背景技术
蛋白多肽类药物是一类来源于或模拟人体内天然蛋白质或肽类的生物药物,可通过与体内特定靶点(如受体或酶)相互作用从而调节细胞通路、信号级联和生化过程发挥其治疗作用。该类药物更容易被机体吸收和代谢,具有高度特异性、高度亲和力以及低毒性等优点。然而,蛋白多肽类药物在递送过程中面临严峻的挑战,仅能通过注射进行给药,给患者带来巨大的身心痛苦。由此,为了提高患者使用蛋白多肽类药物的依从性,开发非侵入型给药方法至关重要。其中经皮给药具有独特的优势,可以避免首过效应,并实现灵活的给药方案。然而,皮肤的屏障和蛋白多肽类药物分子的大小限制了其经皮给药的可行性。此外,在经皮给药过程中,药物在皮肤中易积聚,从而导致起效延迟和作用持续时间有限。
为了克服上述挑战,基于纳米颗粒的递送系统、缓控释制剂、靶向药物递送方法和新型药物偶联技术的开发取得了一系列的进展,旨在提高药物稳定性、增强组织渗透、延长药物循环并最大限度地减少免疫原性。其中,基于纳米颗粒的递送系统可通过调整化学组成以及结构来获得预期的渗透、释放效果。Niidome等将金纳米棒涂覆甲氧基(聚乙二醇)-硫醇与表面活性剂和INS形成复合物,然后分散在油相中,形成了油包固体的配方,在近红外光照射下经皮递送INS。在近红外光持续照射10min后,金纳米棒引起的光热效应可能会通过破坏皮肤脂质或改变皮肤屏障的大小和密度来破坏皮肤屏障,联合表面活性剂的促渗透作用,使INS成功透过皮肤屏障。而Higaki等开发了新型CaCO
金属有机骨架(metal-organic framework,MOF)的研发为克服上述瓶颈问题提供了新的应对策略。MOF是近20年迅猛发展的最新一类具有广泛应用范围的多孔纳米材料,具有有序的孔结构、超大的比表面积和丰富的修饰位点,将其作为生物大分子药物的运输载体具有巨大的应用潜力。2020年甘肃大学唐瑜教授团队设计了基于模拟多酶MOF(钴掺杂ZIF-8)的刺激响应微针体系。GOx和Co
因此,急需开发一种基于MOF的纳米系统无需借助物理或化学助渗手段即可克服经皮屏障而取得优异治疗效果的方法。
发明内容
本发明目的是提供一种用于蛋白质经皮给药的中空金属有机框架纳米粒子及其制备方法与应用,该用于蛋白质给药的中空金属有机框架纳米粒子在高效经皮吸收的同时平衡蛋白质的起效时间与作用时长,从而显著提高蛋白质的经皮递送效率。
为了实现上述目的,本发明采用如下技术方案:
在本发明的第一方面,提供了一种用于蛋白质经皮给药的中空金属有机框架纳米粒子,所述用于蛋白质经皮给药的中空金属有机框架纳米粒子由纳米级的中空金属有机框架、蛋白质/多肽药物、具有羧基末端的的促渗剂组成;所述纳米级的中空金属有机框架内装载了蛋白质/多肽药物,所述纳米级的中空金属有机框架的表面包覆有了所述促渗剂。
进一步地,所述促渗剂包括透明质酸、壳聚糖、海藻酸钠、促渗肽、脂肪酸、神经酰胺及其类似物中的至少一种。
进一步地,所述蛋白质/多肽药物包括胰岛素、鲑鱼降钙素、胰高血糖素、干扰素和生长激素中的至少一种。
进一步地,所述纳米级的中空金属有机框架由羧酸盐配体和高价金属组合成酸性稳定的MOFs,所述高价金属选自Zr
进一步地,所述促渗剂为透明质酸,所述纳米级的中空金属有机框架为MOFHollow-PCN-224,所述蛋白质/多肽药物为胰岛素时,所述Hollow-PCN-224与胰岛素的质量比为3:1~1:3,Hollow-PCN-224与透明质酸的质量比为1:0.1~1:3。
当Hollow-PCN-224与胰岛素的投料质量比达到3:1时,胰岛素的载药量达到50%,当Hollow-PCN-224与胰岛素的投料质量比达到1:3时,胰岛素的载药量达到38%,因此,Hollow-PCN-2247与胰岛素的质量比优选为3:1~1:3。
Hollow-PCN-224与透明质酸的优选为质量比为10:1~5:2。
在本发明的第二方面,提供了一种用于蛋白质经皮给药的中空金属有机框架纳米粒子的制备方法,所述方法包括:
将蛋白/多肽或其溶液加入到中空金属有机框架的水溶液中,持续搅拌使中空金属有机框架包载上所述蛋白/多肽;
后加入渗透促进剂或其溶液,持续搅拌使渗透促进剂粘附在中空金属有机框架上,得到用于蛋白质经皮给药的金属有机框架纳米粒子。
进一步,所述的纳米级的中空金属有机框架为Hollow-PCN-224、所述蛋白质/多肽为胰岛素、所述促渗剂为透明质酸时,所述的制备方法包括:
将胰岛素粉末溶于pH=3±0.4的稀盐酸溶液中,在室温搅拌的条件下,将胰岛素盐酸溶液逐滴加入到Hollow-PCN-224水溶液中并继续搅拌0.1-12小时;在室温搅拌的条件下,加入透明质酸溶液并持续搅拌0.1-12小时;后通过离心将未包载的蛋白除去,获得用于蛋白质经皮给药的中空金属有机框架纳米粒子。
在本发明的第三方面,提供了所述的用于蛋白质经皮给药的中空金属有机框架纳米粒子在制备用于蛋白质经皮给药产品中的应用。
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
(1)本发明提供的一种用于蛋白质经皮给药的中空金属有机框架纳米粒子,所述的渗透促进剂可以靶向肠上皮细胞膜上的受体,从而实现纳米粒子的有效摄取,克服蛋白质在肠上皮细胞层渗透效率极低的问题。该中空金属有机框架纳米粒子能够用于蛋白质经皮给药的原理为:通过亲疏水相互作用装载治疗性蛋白质/多肽药物,并在表面修饰渗透促进剂制备而成。中空的金属有机框架纳米系统对蛋白多肽类药物具有超高的载药量和优越的保护性能,可降低给药剂量,提高用药的安全性。更重要的是,中空金属有机框架纳米系统在磷酸盐环境中易崩解,可弥补经皮给药效率低,起效慢的缺点,从而能在较短时间内释放负载的胰岛素,达到有效的作用时长。而利用渗透促进剂进行包覆后,其独特的促渗特性极大地促进了该纳米系统进行经皮渗透。从而在不借助任何物理促渗手段的情况下,可在动物体内起到了良好的降血糖效果,大大提高了蛋白质的经皮生物利用度。
(2)该纳米粒子克服了经皮给药中的皮肤屏障的同时还可控制释放的速率,平衡起效时间与作用时长,可以大幅提高蛋白质经皮递送的生物利用度;表现出对于蛋白质的极高载药能力,强保护性,并在体内表现出良好的生物相容性。
(3)本发明无需借助物理手段进行助渗,价格低廉,合成工艺简单,易于产业化,有望实现无痛、控释、便捷的蛋白质经皮给药。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
图1是实施例1中所制备的中空金属有机框架纳米粒子的透射电镜图像(标尺=200nm)。
图2是实施例1中所制备的中空金属有机框架纳米粒子的蛋白质载量。
图3是实施例2中I@H-P和H@I@H-P在模拟体内条件(PBS)下的体外释放动力学结果。
图4是实施例3中游离胰岛素、I@H-P和H@I@H-P的体外经皮渗透结果。
图5是实施例4中经皮游离胰岛素、I@H-P和H@I@H-P后糖尿病BALB/C小鼠(a)和SD大鼠(b)的血糖水平变化。
具体实施方式
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
下面将结合实施例及实验数据对本申请的一种用于蛋白质经皮给药的中空金属有机框架纳米粒子进行详细说明。
实施例1、基于中空金属有机框架纳米粒子的胰岛素经皮递送系统的制备与表征
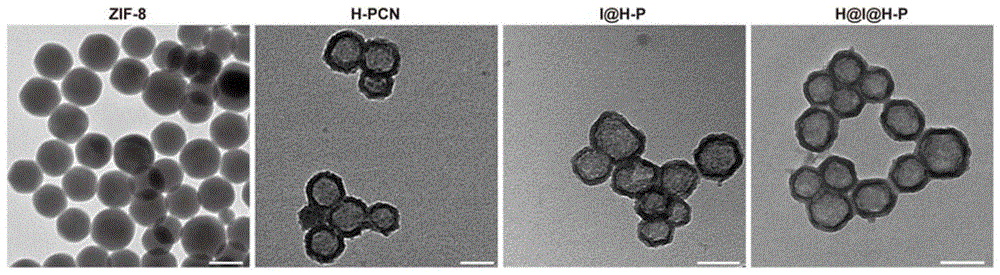
通过自牺牲模板法合成中空的卟啉MOF(Hollow PCN-224,H-P NPs):通过温和的常温溶剂法合成ZIF-8纳米粒子作为牺牲模板,在ZIF-8表面修饰PVP以增强ZIF-8在ZrCl
在室温下搅拌的条件下,将50-300μL胰岛素溶液(10mg/mL,pH=3.0,稀盐酸为溶剂)逐滴加入到4mL新合成的H-P NPs(1mg/mL)水溶液中,持续搅拌12小时以获得胰岛素@金属有机框架纳米粒子(I@H-P)。随后,1mL HA水溶液(3mg/mL)加入到上述I@H-P溶液中并在室温下持续搅拌12h以获得透明质酸@胰岛素@中空金属有机框架纳米粒子(H@I@H-P),11000rpm,4℃低温离心将未包载的蛋白除去。
结果如图1所示,通过上述合成步骤得到了形貌规整,粒径均一的中空金属有机框架结构。使用BCA法测定蛋白质的载药量。
如图2所示,中空金属有机框架显著提高了胰岛素的载药量,当胰岛素与中空金属有机框架的投料质量比达到(3:1)时,胰岛素的载药量达到50%。因此,后续实施例中所用的I@H-P、H@I@H-P,胰岛素与中空金属有机框架均采用3:1的投料质量比。
实施例2、I@H-P NPs和H@I@H-P NPs的释放行为检测
将I@H-P NPs和H@I@H-P NPs样品装入截留分子量为10kDa的透析袋后,浸没于20mL PBS缓冲液(pH 7.4)中。各样品置于37℃的摇床中以120rpm的转速孵育,于不同时间点从释放介质中取出100μL样品,同时加入等体积的新鲜PBS溶液以保持释放介质的体积恒定。每组设置三个平行对照,使用BCA蛋白测定试剂盒测定INS的含量并计算得出药物的累积释放量。
结果如图3所示,I@H-P NPs和H@I@H-P NPs在PBS的孵育下展示出较快的释放,且两组的释放结果没有显著性差异,HA的包覆并没有延缓I@H@I@H-P NPs的释放。在1h时,两组中的INS的释放量均达到20%左右,在12h时,两组中的INS的释放量均达到60%左右。证明了中空MOF在较短时间内达到了较高的INS释放水平,且在12h内维持匀速释放,平衡了释放速率以及作用时间,在后续的经皮递送中具有较大的应用潜力。
实施例3、H@I@H-P纳米系统离体透皮实验
取健康SD大鼠的腹部皮肤放置于垂直型Franz扩散池以测定H-P NPs纳米体系在离体皮肤中的渗透效率。在扩散池的供给侧中分别加入1mL INS溶液、1mL I@H-P NPs溶液和1mL H@I@H-P NPs溶液,在接收侧加满PBS溶液(pH 7.4),固定大鼠皮肤时注意将角质层朝向供给侧。随后,将透皮扩散池放置于37℃的恒温摇床中以100rpm的转速进行孵育。在不同的时间点从接收池中取出0.2mL样品,并添加0.2mL新鲜的PBS溶液以保持接收侧缓冲溶液体积恒定。通过牛INS ELISA试剂盒检测各样品中INS的含量,基于公式计算累积渗透率(Q,μg/cm
式中,Cn和Ci分别为第n和i个取样点测得的药物浓度;A为皮肤与供给侧样品的有效接触面积(cm
实验结果如图4所示,可知:H@I@H-P NPs溶液组的渗透率显著高于INS溶液和没有HA包覆的I@H-P NPs(图4)。在12h时三组的累积透皮渗透量分别为1.43、0.05、0.03μg/cm2。证明HA的包覆赋予了中空纳米系统克服皮肤角质层障碍的能力,大大地促进了中空MOF纳米系统在离体大鼠皮肤的递送效率。
实施例4、H@I@H-P纳米系统体内药效学与药动学研究
在糖尿病KM小鼠和SD大鼠中进行H-P NPs纳米体系的体内药效学和药代动力学研究。实验鼠在实验前脱毛并禁食过夜,实验当天通过涂抹给予以下制剂:Free INS,I@HNPs,H@I@H-P NPs(50IU/kg)和通过皮下注射给予INS溶液(5IU/kg)。在不同时间点从大小鼠眼眶静脉丛收集血样,并使用血糖仪进行血糖测试。如图5所示,H@I@H-P NPs组给药后,血糖在2h内快速降至初始水平的32%,这与皮下注射组几乎一致,表明了H@I@H-P NPs可以克服角质层的等皮肤障碍并快速起效的作用特点。而且该纳米递送系统在12h内均可维持降低至60%以下的BGL,直至24h后才恢复高血糖水平。上述结果均证明了该中空纳米系统在体内快速释放并起效,而且实现了一定的缓释效果,从而带来高经皮生物利用度。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 一种基于加热时间与温度控制烤箱的控制方法及其控制系统
- 一种用于蒸烤箱的烤架及其制造方法
- 一种基于烤箱控制系统的内存优化控制方法
- 一种抽屉式智能化控制电晕装置及控制方法
- 一种门把手控制方法、装置、门把手、烤箱及存储介质
- 一种用于烤箱的保温抽屉及其控制方法
- 一种带有控制开关的抽屉、烤箱灶、保温柜及集成灶
