一种光热生物活性水凝胶及其制备方法和应用
文献发布时间:2023-06-19 09:23:00
技术领域
本发明属于生物医学、生物材料技术、创伤修复以及医疗器械领域,具体涉及一种光热生物活性水凝胶及其制备方法及应用。
背景技术
慢性创伤的治疗是再生医学的重大挑战,血管生成对慢性创伤的愈合至关重要。没有血管系统和血液供应,细胞和组织会缺氧或缺乏营养物质的供应,且自身代谢废物无法排出。早期的研究主要是在生物材料中加入生长因子(如VEGF和bFGF)来促进血管生成。然而,添加生长因子的方法存在一些缺点,例如在材料制备过程中成本高、蛋白质易变性,以及过量使用的不良副作用。提高生物材料的促进成血管活性一直是组织修复领域的研究热点。天然的火山或海底温泉被认为是生命的起源地,其中的热量和矿物元素为各种生命活动提供能量和催化剂。此外,温泉浴是一种自然疗法,同时结合含有多种微量元素的矿物质泉水以及温和的热刺激,可以用于治疗皮肤病、心血管疾病等多种疾病,深受大众喜爱。温泉的温度在30-45℃之间且含有多种微量元素,根据温度和成分的不同可能有不同的治疗效果。但是温泉浴存在容易引发细菌感染等问题,导致温泉浴难以应用于开放性的或体内创伤的组织修复。目前也还没有具有温泉效应的生物材料在组织修复方面的研究。
发明内容
针对现有技术存在的问题,本发明的目的在于提供一种光热生物活性水凝胶及其制备方法及应用。
第一方面,本发明提供一种光热生物活性水凝胶,包括:生物相容性高分子材料、以及分布于所述生物相容性高分子材料中的、具有活性离子释放性能和光热性能的生物活性粉体。
所述生物活性粉体不仅能释放生物活性离子,还具有良好的光热效应,在近红外光照射下可迅速升温,对材料周围组织产生温和的热刺激。本发明通过构建同时含有生物相容性高分子材料和上述生物活性粉体的水凝胶体系,首次将“温泉效应”概念应用于组织再生领域,构建的组织工程支架(例如创面敷料材料)同时具有释放生物活性离子和产生温和热刺激的性能,两者可协同促进细胞的增殖、迁移和分化以及血管形成,可用于促进皮肤慢性创伤的愈合,大大提高生物材料的生物活性。另外,本发明的光热生物活性水凝胶,可以避免因生长因子、蛋白等易失活、难以复合加工等产生的不足,能够有效保持水凝胶的生物诱导活性。
较佳地,所述生物相容性高分子材料选自壳聚糖、海藻酸、透明质酸或其改性物中的至少一种。优选为具有良好生物相容性的氧化海藻酸钠和N,O-羧甲基壳聚糖的交联物。
较佳地,所述生物活性粉体为含有生物活性和光热性能离子的硅酸盐矿物。优选为铁橄榄石粉体。
所述光热生物活性水凝胶释放包括Fe
较佳地,所述光热生物活性水凝胶24h释放的Fe
较佳地,所述光热生物活性水凝胶在激光照射处理下产生温泉效应。本文的上下文中“温泉效应”可以理解为生物活性离子和温和热刺激综合作用下产生促进组织修复的效应。
优选地,室温下所述光热生物活性水凝胶在808nm近红外激光照射下达到的最高温度随着激光功率和生物活性粉体含量的增加而升高。
较佳地,所述光热生物活性水凝胶的成胶时间为2-16min。
第二方面,本发明提供上述任一项所述的光热生物活性水凝胶的制备方法,包括以下步骤:
(1)将生物活性粉体均匀分散在生物相容性高分子溶液或其前驱液中,混合均匀以形成混合溶液;
(2)将步骤(1)得到的混合溶液在25-37℃原位成胶,得到所述光热生物活性水凝胶。
较佳地,所述生物活性粉体与生物相容性高分子溶液或其前驱液的质量体积比为0.1%~5.0%。在这个范围内水凝胶具有良好的光热效应和离子释放性能。
第三方面,本发明提供上述任一项所述的光热生物活性水凝胶在组织修复尤其是皮肤创伤愈合中的应用。
附图说明
图1为本发明制备的生物活性粉体的XRD图(a)和不同倍数的SEM照片(b,c)。结果显示粉体为较纯的Fe
图2为铁橄榄石粉体释放铁离子种类的价态检测(a),以及不同激光功率下的光热性能(b)和光热稳定性(c)。(b)中的曲线由下至上依次为water-0.85W、FS/water-0.4W、FS/water-0.55W、FS/water-0.7W、FS/water-0.85W。结果显示铁橄榄石粉体能够释放二价铁离子,且粉体具有较好的光热性能。
图3为FA-NOCS复合水凝胶的成胶时间随FA粉体含量的变化(a),FA粉体含量对FA-NOCS复合水凝胶离子释放的影响(b),以及P-NOCS、CS-NOCS和FA-NOCS在激光功率密度为0.36W/cm
图4为0.5FA-NOCS水凝胶在不同激光功率(0.24,0.30,0.36,0.42,0.48W/cm
图5为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组对内皮细胞的活性(Live-Dead染色,绿色为活细胞,红色为死细胞)和形态(FITC-DAPI,绿色为细胞骨架,蓝色为细胞核)的影响(a);以及对内皮细胞(b)和成纤维细胞(c)增殖的影响。CS-NOCS复合水凝胶、FA-NOCS复合水凝胶、FA-NOCS-L复合水凝胶分别指的是0.5CS-NOCS水凝胶、0.5FA-NOCS水凝胶、激光照射的0.5FA-NOCS水凝胶(808nm,0.36W/cm
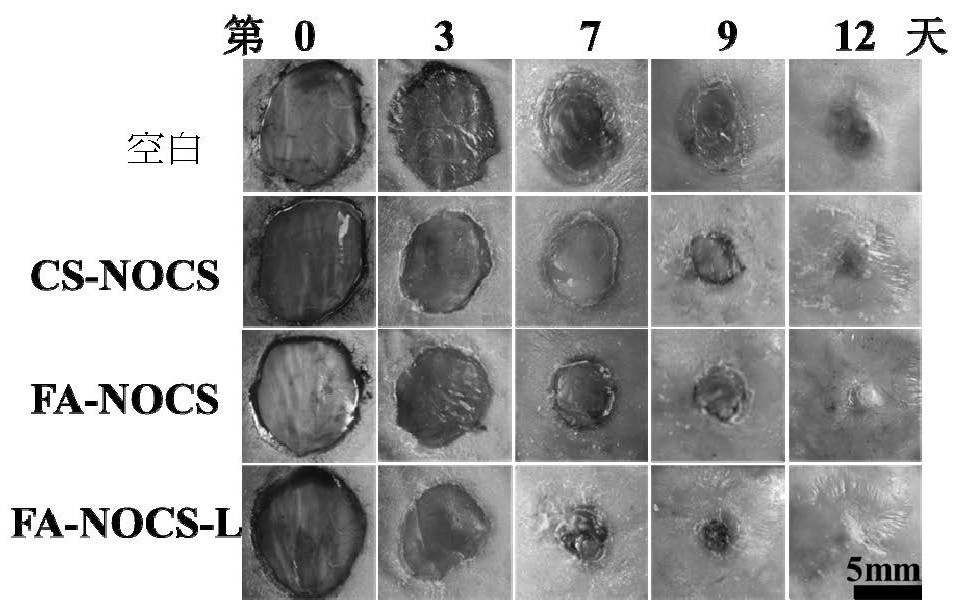
图6为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组的体内慢性创面修复效果:不同时间点(第0,3,7,9和12天)裸鼠背部创面的数码照片。可以看出,激光照射处理产生温泉效应的复合水凝胶组对伤口愈合有促进作用。
图7为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组的裸鼠创面的苏木精-伊红组织切片染色观察伤口修复情况。
图8为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组的裸鼠创面组织切片的CD31免疫组化染色,观察伤口修复过程中的血管生成情况。可以看出,激光照射处理产生温泉效应的复合水凝胶组在伤口愈合过程中产生更多的新生血管。
图9为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组的裸鼠创面组织切片的Collagen-I免疫组化染色,观察伤口修复过程中的I型胶原蛋白的生成情况。结果显示激光照射处理产生温泉效应的复合水凝胶组在伤口愈合过程中能促进I型胶原的生成。
图10为空白组、含亚铁离子组、含硅酸盐离子组、双离子组、热刺激组、热刺激-双离子组(分别记为B、F、S、FS、H-B、H-FS)对内皮细胞增殖(a)、迁移(b,d)和成环(c,e)的影响。(a)中的柱状体从左到右依次表示Day1、Day3和Day5。(b)中的柱状体表示Day5。(c)中的柱状体表示Day3。结果说明硅铁双离子与热刺激协同可以明显促进内皮细胞的增殖、迁移和成环。
图11为空白组、含亚铁离子组、含硅酸盐离子组、双离子组、热刺激组、热刺激-双离子组的成血管相关基因和热休克基因的表达结果,其中bFGF(a)、bFGFR(b)、eNOS(c)以及HSP90(d)。结果表明硅铁双离子与热刺激协同可以促进成血管相关基因和热休克基因的表达。
图12为空白试样组、CS-NOCS复合水凝胶组、FA-NOCS复合水凝胶组、FA-NOCS-L复合水凝胶组的裸鼠创面组织切片的HSP90免疫组化染色,观察热刺激的效果。结果显示激光照射处理产生温泉效应的复合水凝胶组热休克蛋白HSP90表达明显。
具体实施方式
以下,参照附图,并结合下述实施方式进一步说明本发明。应理解,附图和/或具体实施方式仅用于说明本发明而非限制本发明。“光热生物活性水凝胶”也可以称为“光热水凝胶”。在本发明未作具体说明的情况下,质量体积比指的是g/mL。
以下示例性说明本发明所述光热生物活性水凝胶的制备方法。
制备铁橄榄石粉体。
所述铁橄榄石粉体的制备方法可包括:(1)将硅源溶于溶剂中,得到硅源溶液。所述硅源可为正硅酸乙酯(TEOS)。所述溶剂可为硝酸水溶液。所述硅酸和溶剂的质量体积比可为TEOS:水:HNO
上述制备方法获得的粉体是纯相的铁橄榄石粉体。
将铁橄榄石粉体均匀分散在N,O-羧甲基壳聚糖溶液中得到混合溶液。N,O-羧甲基壳聚糖水溶液的浓度可为2%-4%(w/v)。铁橄榄石粉体和N,O-羧甲基壳聚糖水溶液的的质量体积比可为0.1%-5%。
将所得混合溶液与氧化海藻酸溶液充分混合,在一定的时间内原位成胶,得到光热生物活性水凝胶。氧化海藻酸水溶液的浓度可为0.5-5%(w/v)。其中N,O-羧甲基壳聚糖溶液与氧化海藻酸溶液的体积比为100:1–1:1。
本发明所述光热生物活性水凝胶在激光照射下产生温泉效应。例如光热生物活性水凝胶在1-3分钟内使得水凝胶周围区域温度升高至40-45℃。
下面列举实例对本发明做进一步说明。但本发明的范围不应局限在实施例和对比例所述的范围,任何不偏离本发明主题的改变能够为本领域的研究人员所理解,都在本发明的保护范围之内。下述示例具体的工艺参数等也仅是合适范围中的一个示例,而并非要限定于下文示例的具体数值。
原硅酸四乙酯(C
实施例1
(1)生物活性粉体的制备
采用改进的溶胶-凝胶法合成了铁橄榄石(Fe
通过X射线衍射(XRD)和扫描电子显微镜(SEM)对最终粉末进行表征。图1显示粉体为较纯的Fe
另外,通过KMnO
(2)FA-NOCS复合水凝胶的制备
采用亲电取代反应制备N,O-羧甲基壳聚糖(NOCS)。具体而言,将壳聚糖(5g)加入到-20℃的25mL质量分数40%的NaOH水溶液中过夜。将氯乙酸(20g)溶于100mL异丙醇中获得氯乙酸溶液。然后在30分钟内将氯乙酸溶液滴加到冷冻的壳聚糖悬浮液中。将混合物在25℃下搅拌2h,然后在60℃下再搅拌2h。最后,将所得物过滤并用水和无水乙醇洗涤三次。通过冷冻干燥获得NOCS的最终产物。
如所报道的,通过对海藻酸钠(SA)的高碘酸盐氧化获得作为交联剂的氧化海藻酸钠(OSA)。具体地,在黑暗中将海藻酸钠(1.0g,5mmol)和高碘酸钠(0.65g,3mmol)加入100mL蒸馏水中,反应2小时后用乙二醇(1.5mL)终止反应。然后将所得产物透析(透析袋MWCO30000,截留分子量为30000)以进行纯化,并进行冷冻干燥,得到OSA的最终产物。
制备FA-NOCS复合水凝胶时,使用留置针将不同量的FA粉(0.1%、0.2%、0.3%、0.5%、1%、5%,w/v)(这里的质量体积比指的是FA粉体与NOCS溶液和OSA溶液总体积的比值)均匀分散在4%(w/v)的NOCS溶液中,加入1.5%(w/v)的OSA溶液,NOCS/OSA体积比为25:2。
在对照实验中,以相同的方法制备不同硅酸钙(CS)含量(0.02%、0.05%、0.1%、0.5%、w/v)的CS-NOCS复合水凝胶和P-NOCS水凝胶(无FA)。在NOCS中加入CS而不是FA,制备了CS-NOCS复合水凝胶。
为了对P-NOCS、CS-NOCS和FA-NOCS水凝胶进行体内外生物实验,实验前对制备凝胶所需的材料进行灭菌处理。将固体NOCS在体积分数75%的乙醇水溶液浸泡30min;分别对FA、CS和固体OSA粉体在紫外线下灭菌30min;然后方在无菌环境中制备水凝胶。此外,对于细胞培养水凝胶,在成胶之前将混合溶液注入transwell中,并待其形成完整凝胶,100μL/孔(24孔板)和300μL/孔(6孔板)。
复合水凝胶的成胶时间通过以下方法测定:简而言之,将1mL新鲜胶凝液注入1.5mL的微量离心管(Eppendorf管)中,每15秒倾斜一次,每30秒倒置一次,直到水凝胶没有改变其相对于管轴的位置。相关记录时间为成胶时间。每个样品的成胶时间重复测试6次以上。从图3可以看出,FA粉体含量的增加会缩短FA-NOCS复合水凝胶的成胶时间,提高FA-NOCS复合水凝胶的离子释放浓度。此外,与P-NOCS NOCS水凝胶以及CS-NOCS水凝胶比,FA-NOCS具有明显的光热效果。
(3)FA粉末和FA-NOCS复合水凝胶的体外离子释放行为
为了研究FA粉和FA-NOCS复合水凝胶的离子释放性能,将不同FA添加量的FA-NOCS复合水凝胶分别加入10mL无血清培养基(ECM)中,37℃孵育24h。作为对照,将5mg FA粉末(与1g 0.5FA-NOCS水凝胶中FA的量相同)加入10mL无血清培养基(ECM)中,并与FA-NOCS复合水凝胶在相同的条件下进行处理。
为了评价加热对离子释放的影响,在培养开始时对一组0.5FA-NOCS水凝胶进行激光照射15min(0.5FA-NOCS-L,40℃/15min)。孵育24h后,4000rpm离心10min,收集上清液。作为对照,在10mL无血清培养基(ECM)中加入5mg FA粉(与1g 0.5FA-NOCS水凝胶中相同的FA量),并在与复合水凝胶相同的条件下处理。将混合液离心,上清通过滤膜(Millipore,0.22mol/L)滤除细菌,收集得到原液。对不同CS含量(0.02%、0.05%、0.1%、w/v)CS-NOCS水凝胶释放的Si离子浓度进行与FA-NOCS水凝胶相同的测试。将复合水凝胶以0.1g/mL的比例分散于tris-HCl溶液(pH=7.4,0.1M HCl)中,在37℃的摇床中振荡1、3、5、7、9、14d记录复合水凝胶的持续离子释放行为,收集各时间点的混合溶液并进行刷新。采用电感耦合等离子体原子发射光谱法(ICP-OES)测定所有收集的溶液中Fe和Si离子的浓度。
(4)FA粉末和FA-NOCS复合水凝胶的光热性能
为了研究FA粉末的光热性能,将FA水溶液(5mg/mL)在激光波长808nm的各种功率密度(0.4、0.55、0.7、0.85W/cm
为了评估制得的FA-NOCS水凝胶的光热效应,将P-NOCS以及0.1、0.2、0.3、0.5、1和5FA-NOCS水凝胶置于NIR激光辐照下以不同的功率密度(0.24、0.3、0.36、0.42,0.48W/cm
实施例2
FA-NOCS复合水凝胶的“温泉效应”的体外生物活性
使用人脐静脉内皮细胞(HUVEC,第3-6代)和人皮肤成纤维细胞(HDF)进行了生物学实验。对于单培养,HUVEC在ECM(美国Sciencell)中培养,补充有5%(v/v)胎牛血清(FBS),1%(v/v)青霉素-链霉素(P/S)和1%(v/v)内皮细胞生长补充剂(ECGS)。HDF在高DMEM(Gibco)加10%(v/v)FBS和1%(v/v)P/S的培养基中培养。培养基每2天更换一次。将正常细胞在5%CO
根据复合水凝胶的离子释放和光热性能,选择0.5FS-NOCS和0.05CS-NOCS水凝胶作为FS-NOCS和CS-NOCS水凝胶进行进一步研究。将HUVECs以5×10
实施例3
(1)复合水凝胶应用于小鼠全层切除伤口模型
动物研究是按照机构动物护理和使用委员会批准的方案进行的。BALB/c小鼠(6周,n=24只(国家实验动物种子中心上海分中心暨上海斯莱克实验动物有限责任公司),随机分为4组,每组6只,分别为空白、CS-NOCS、FA-NOCS、FA-NOCS-L。对于每组,每个时间点(7天和12天)使用3只小鼠。用1.5%戊巴比妥钠麻醉后,在每只小鼠背部进行直径为1cm的全层切除。将直径1cm、厚度2mm的CS-NOCS和FA-NOCS水凝胶放置于创面部位。未治疗的伤口记录为空白对照组。移植后,所有伤口用透明敷料(Tegaderm膜,3M)和绷带覆盖,以保护治疗区。Depo-Medrol(20mg/kg BW,辉瑞)在第0天皮下注射入所有小鼠,以延迟伤口愈合。FA-NOCS-L组小鼠从第1天至第5天,每天使用808nm激光照射,温度40℃照射15分钟。所有伤口的照片分别在第0、7、9、12天拍摄,并以标尺贴纸作为尺寸参考。在确定的时间点注射过量的1.5%戊巴比妥钠处死小鼠,收集创面皮肤组织,进行组织学分析。通过以下公式计算伤口闭合率:
伤口愈合率(%)=(A
其中,A
(2)染色和组织学分析
用质量体积比4%多聚甲醛溶液(Abcam)固定在
实施例4
温和热刺激和Fe/Si离子对体外血管生成的影响
为了明确生物活性离子和热刺激对温泉效应的不同作用,采用HUVECs细胞培养方法,进行了离子、热刺激、以及离子与热刺激相结合的对比实验。将六水合硫酸铁铵((NH
(1)细胞增殖的影响
为了研究Fe/Si离子和热刺激对内皮细胞增殖的影响,将HUVECs以1×10
(2)体外划痕实验
为了研究温泉效应对细胞迁移的影响,通过划痕试验评估了Fe/Si离子和轻度热应激对HUVECs体外迁移的影响。简而言之,将细胞接种到24孔板中并培养以获得融合的单层。随后通过用p200移液器枪头尖端在每个孔中刮出细胞单层上的划痕。用培养基轻轻洗涤后,将细胞以1%(v/v)的低FBS含量培养。然后用含离子的培养基代替培养基,将H-B和H-FS组的细胞,在更换培养基之后,置于40℃下孵育15分钟,给予轻度热刺激。将细胞用4%多聚甲醛固定20分钟,然后用结晶紫染色10分钟,并在装有数码相机(DMI300)的显微镜(Leica)孵育0小时和16小时后获得图像,并进行定量分析由ImageJ软件确定迁移率,该迁移率是根据以下公式计算的:
迁移率(%)=(M
其中M
(3)体外成环实验
使用ECMatix
(4)基因表达
通过实时定量聚合酶链反应进一步研究了轻度热应激和Fe/Si离子对HUVECs某些基因(bFGF,bFGFR,eNOS,HSP90)表达的影响(RT-qPCR)。对于总RNA提取,将HUVEC以每孔1×10
- 一种光热生物活性水凝胶及其制备方法和应用
- 一种具有光子上转换功能的生物活性水凝胶及其制备方法和应用
