一种具有抗菌能力的肺脏干细胞及其应用
文献发布时间:2023-06-19 09:24:30
技术领域
本发明涉及干细胞移植技术领域,具体涉及一种具有抗菌能力的肺脏干细胞及其应用。
背景技术
人的体表以及与外界相通的腔道存在大量的正常菌群,它们在人体免疫功能正常的情况下,对人体有益无害;但当机体抵抗力减弱,或由于各种原因引起防御免疫功能降低时,原来正常的寄居菌或外源性的细菌可能侵入人体,造成人体局部或全身性炎症反应,随之而来也会对机体内部分组织和细胞带来破坏性的伤害。对于患有组织损伤性病变的患者,细菌、真菌等微生物感染往往与组织损伤并存,一方面容易引起各种并发症,另一方面也会不断加重组织损伤,对实体脏器进行实质性损伤,严重危害患者的生命健康,组织损伤和细菌感染会形成一个恶性循环。
对于组织损伤性病变,本领域技术人员利用干细胞的无限自我更新和分化成多种类型细胞的能力,采取干细胞移植进行损伤组织的修复。干细胞移植,主要从成体中分离出干细胞,并在体外进行培养和扩增,再制备成临床级的细胞制剂后,移植到患者的体内对损伤组织进行修复,治疗相关的疾病。干细胞移植进行损伤组织修复,一方面,移植到体内的干细胞可以在损伤处进行组织再生,修复损伤结构;另一方面,干细胞通过旁分泌/自分泌途径产生的趋化因子和生长因子等众多生物活性分子可以改善移植部位的微环境。但是,干细胞并不能对细菌的感染起到直接的抑制作用,这减弱了干细胞对于细菌感染患者的治疗作用。
目前,人类应用抗生素和合成类抗菌药物治疗细菌感染性疾病,但是临床中抗生素及合成类抗菌药物的非理性使用而产生的耐药性和抗药性成为一个不可忽视的事实。
为此,寻找一种同时具有抗菌能力和组织修复能力的干细胞很有必要。
发明内容
因此,本发明的目的在于提供一种具有抗菌能力的肺脏干细胞及其应用。
Cathelicidins是一种古老而又庞大的抗菌肽家族,是哺乳动物防御系统的主要成员。人类阳离子抗菌蛋白18(human cationic antimicrobial protein 18,hCAP18)是迄今在人体中发现的cathelicidins家族的唯一成员。LL-37是hCAP18被蛋白酶水解后释放的有37个氨基酸的C端,因其N末端前两个氨基酸残基为亮氨酸(L)和氨基酸残基总数为37而得名,有的文献称之为LL-37/hCAP18。随着对LL-37研究的逐渐深入,发现LL-37作为一个固有免疫系统的重要组成成分,具有抗细菌、真菌,降解生物膜,抗病毒等多种抗微生物作用,除此之外LL-37还具有调节炎症反应,趋化免疫细胞,协调固有/获得性免疫系统,促进损伤修复等多种作用。LL-37具有广泛的抗革兰氏阳性和阴性菌的能力。许多研究表明,LL-37可以通过直接杀菌作用杀死铜绿假单胞菌、淋病奈瑟菌、肺炎克雷伯氏菌、金黄色葡萄球菌等。
本发明提供一种具有抗菌能力的肺脏干细胞,含有表达抗菌肽hCAP18/LL-37的重组载体。
进一步地,所述重组载体为病毒载体。
进一步地,所述抗菌肽hCAP18的表达框架为:5’到3’方向依次为启动子、抗菌肽hCAP18的编码基因;所述抗菌肽LL-37的表达框架为:5’到3’方向依次为启动子、信号肽的编码基因、抗菌肽LL-37的编码基因。
进一步地,所述hCAP18的氨基酸序列如SEQ ID NO.1所示;LL-37的氨基酸序列如SEQ ID NO.2所示;所述hCAP18的编码基因如SEQ ID NO.3所示;LL-37的编码基因如SEQ IDNO.4所示;所述信号肽的编码基因如SEQ ID NO.5所示。
进一步地,所述启动子为EF1a。
本发明还提供具有抗菌能力的肺脏干细胞的制备方法,其特征在于,包括如下步骤:
肺脏干细胞的获取:取离体肺脏组织进行消化处理,终止消化后收集细胞;取部分经消化处理后的细胞,利用铺被滋养层细胞的培养板对细胞进行铺板培养,收集细胞并利用铺被滋养层细胞的培养板对其进行扩增培养,待细胞长满至培养板表面积的85%-95%时,消化并收集贴壁细胞,即得;
重组载体的构建:构建表达抗菌肽hCAP18/LL-37的重组载体,并包装成为病毒颗粒;
肺脏干细胞的感染:用上述病毒颗粒感染上述肺脏干细胞,同时加入聚凝胺,培养24/48h,即得。
进一步地,铺板培养包括以下步骤:
取待进行铺板培养的细胞,用肺脏干细胞培养基重悬并铺于铺被滋养层细胞的培养板中;培养板中加入抗生素;
在37℃,CO
进一步地,所述组织消化液包含99v%的DMEM/F12、1-20ng/mL的DNA酶、0.1-4mg/mL蛋白酶和10-200ng/mL胰酶;所述消化处理的温度为37℃,时间为0.5-2h。
进一步地,肺脏干细胞培养基的配方为:225mL DMEM、225mL F12、20-70mL FBS、0.2-2mM L-谷氨酰胺、1-14ng/mL胰岛素、0.1-1ng/mL表皮生长因子、5-30ug/mL腺嘌呤、2-20ug/mL氢化可的松。
本发明还提供具有抗菌能力的肺脏干细胞在制备治疗肺脏组织损伤性病变药物中的应用。
本发明进一步提供一种治疗肺脏组织损伤性病变的药物,其主要活性成分为上述具有抗菌能力的肺脏干细胞。
本发明技术方案,具有如下优点:
1、本发明提供的具有抗菌能力的肺脏干细胞,具有损伤修复和抗菌的功能,一方面能够修复损伤组织,另一方面能够预防和解决患者体内的微生物感染。此外,肺脏干细胞可以在体内长期存留,抗菌的效果可以长期维持;肺脏干细胞能够特异性分布在肺脏,实现在肺脏内的抗菌效果。
2、本发明通过表达hCAP18基因来产生抗菌肽LL-37,与生理过程一致,LL-37的产生量受外界环境需求的调控,当出现大量感染时,可以诱导大量hCAP18基因的表达和剪切从而产生大量的LL-37分泌到细胞外发生抗菌的作用;当感染解除,不需LL-37进行抗菌时,hCAP18表达并剪切形成LL-37的过程会受到抑制,产生的LL-37减少,从而避免LL-37带来的副反应。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明实验例1hCAP18-mDASC中抗菌肽LL-37的qPCR定量结果;
图2是本发明实验例1hCAP18-mDASC中抗菌肽LL-37的蛋白免疫印迹实验结果;
图3是本发明实验例1hCAP18-mDASC中抗菌肽LL-37的免疫荧光染色结果,其中,A为hCAP18-mDASC和WT-mDASC干细胞标志物的检测;B为抗菌肽LL-37在hCAP18-mDASC和WT-mDASC细胞中的表达;
图4是本发明实验例1hCAP18-mDASC的杀菌能力评估结果;
图5是本发明实验例1WT-mDASC、hCAP18-mDASC分别与PAO1菌共培养6小时,体系中菌量检测结果;
图6是本发明实验例1WT-mDASC、hCAP18-mDASC分别与PAO1菌共培养6小时和18小时,体系中菌量检测结果;
图7是本发明实验例1hCAP18-mDASC在小鼠体内的再生和抗菌能力,其中,A为hCAP18-mDASC和WT-mDASC移植到小鼠体内后的肺部白光图和荧光图,B为hCAP18-mDASC和WT-mDASC移植到小鼠体内后的肺部切片荧光图,C为移植7天后hCAP18-mDASC和WT-mDASC移植到小鼠体内后的肺部切片荧光图;
图8是本发明实验例1hCAP18-mDASC移植后的肺损伤小鼠的铜绿假单胞菌和大肠杆菌负荷水平,其中,A和B分别为全肺匀浆中铜绿假单胞菌和大肠杆菌的菌浓度,C和D分别为支气管肺泡灌洗液中铜绿假单胞菌和大肠杆菌的菌浓度;
图9是本发明实验例1中hCAP18-mDASCs、WT-mDASC分别与PAO1共同移植于小鼠损伤肺部中的结果;其中,A、B分别为移植后肺部HE染色结果和损伤评分结果;C、D分别为移植后肺部CD68免疫组化染色图和阳性区域比率统计结果;E为移植后肺部的qPCR检测结果。
具体实施方式
本发明中FBS表示胎牛血清;
DMEM表示高糖型DMEM培养基;
F12表示F12营养混合物;
DPBS表示磷酸盐缓冲液;
HOPX表示肺组织细胞的标记物;
KRT5表示支气管基底层细胞的标记物。
实施例1
本实施例制备的人肺脏干细胞含有表达抗菌肽LL-37的重组载体,抗菌肽LL-37的表达框架为:5’到3’方向依次为启动子、信号肽的编码基因、抗菌肽LL-37的编码基因。制备方法如下:
人肺脏干细胞的分离和鉴定:
取离体活性支气管刷检组织备用。
取组织消化液和终止液备用;其中组织消化液中,99v%为DMEM/F12,其余为1-20ng/mL的DNA酶,0.1-4mg/mL蛋白酶和10-200ng/mL胰酶;终止液中90v%为DMEM,10v%为FBS。
利用组织消化液对上述刷检组织进行消化处理,利用终止液对经消化处理后的组织进行终止消化后收集细胞。
取培养基备用,其中培养基中225mL DMEM,225mL F12,20-70mL FBS,0.2-2mM L-谷氨酰胺,1-14ng/mL胰岛素,0.1-1ng/mL表皮生长因子,5-30ug/mL腺嘌呤,2-20ug/mL氢化可的松。
取部分经消化处理后的细胞,用培养基重悬并铺于铺被滋养层细胞的6孔培养板中;每个孔加200ul双抗(10000u/mL青霉素和10000ug/mL链霉素),在37℃,CO
待培养细胞长满至培养皿表面积的85%-95%时,每个培养皿加入1×DPBS洗涤一次,加入2mL 0.25%(质量体积比0.25g/100mL)胰酶,在37℃中放置5-15min,待大部分细胞变圆变亮后,用1mL枪头轻轻将贴壁细胞吹打下来并吹打成单细胞悬液,再用2mL终止液终止消化,收集细胞悬液,1200rpm离心5min,去上清,并用肺干细胞培养基重悬细胞,即得肺脏干细胞。
取肺脏干细胞进行细胞免疫荧光染色。待干细胞克隆生长到20-30个细胞时,使用4w/v%多聚甲醛固定细胞10分钟。固定结束后,使用PBS洗涤3次,每次5分钟以去除残留的多聚甲醛。加入0.2v%Triton X-100对细胞进行通透处理20分钟,然后使用PBS洗涤3次,每次5分钟。加入含有5-10w/v%驴血清的PBS溶液,对细胞进行封闭处理30-60分钟。去除驴血清PBS溶液,加入含有一抗(Krt5和p63)的PBS溶液,4℃孵育过夜。去除含有一抗的PBS溶液,使用PBS洗涤3次,每次10分钟。加入含有能够识别一抗的二抗PBS溶液,室温孵育2小时。去除二抗PBS溶液,加入20ng/mL DAPI溶液细胞核染色,孵育10分钟。使用PBS洗涤3次,每次20分钟。封片后置于显微镜下观察细胞。观察到细胞克隆为Krt5和p63阳性,表明本实施例分离和获取的细胞为人肺脏干细胞。
重组载体的构建:
根据如SEQ ID NO.2所示LL-37的氨基酸序列以及编码密码子,如SEQ ID NO.5所示信号肽的氨基酸序列以及编码密码子,设计并人工合成如SEQ ID NO.4所示的LL-37的编码基因,构建信号肽-LL-37-pHIV质粒,并包装成为病毒。
慢病毒感染肺脏干细胞:
将上述病毒溶液按MOI(感染复数)值为15加入到上述获取的人肺脏干细胞中,同时加入10ug/mL聚凝胺(Polybrene),培养24-48h,即得。
实施例2
本实施例制备的人肺脏干细胞含有表达抗菌肽hCAP18的重组载体,抗菌肽hCAP18的表达框架为:5’到3’方向依次为启动子、抗菌肽hCAP18的编码基因。制备方法如下:
人肺脏干细胞的分离和鉴定:
取离体活性支气管刷检组织备用。
取组织消化液和终止液备用;其中组织消化液中,99v%为DMEM/F12,其余为1-20ng/mL的DNA酶,0.1-4mg/mL蛋白酶XIV和10-200ng/mL胰酶;终止液中90v%为DMEM,10v%为FBS。
利用组织消化液对上述刷检组织进行消化处理,利用终止液对经消化处理后的组织进行终止消化后收集细胞。
取培养基备用,其中培养基中225mL DMEM,225mL F12,20-70mL FBS,0.2-2mM L-glutamine,1-14ng/mL胰岛素,0.1-1ng/mL表皮生长因子,5-30ug/mL腺嘌呤,2-20ug/mL氢化可的松。
取部分经消化处理后的细胞,用培养基重悬并铺于铺被滋养层细胞的6孔培养板中;每个孔加200ul双抗(10000u/mL青霉素和10000ug/mL链霉素),在37℃,CO
待培养细胞长满至培养皿表面积的85%-95%时,每个培养皿加入1×DPBS洗涤一次,加入2mL 0.25%(质量体积比0.25g/100mL)胰酶,在37℃中放置5-15min,待大部分细胞变圆变亮后,用1mL枪头轻轻将贴壁细胞吹打下来并吹打成单细胞悬液,再用2mL终止液终止消化,收集细胞悬液,1200rpm离心5min,去上清,并用肺干细胞培养基重悬细胞,即得肺脏干细胞。
取肺脏干细胞进行细胞免疫荧光染色。待干细胞克隆生长到20-30个细胞时,使用4w/v%多聚甲醛固定细胞10分钟。固定结束后,使用PBS洗涤3次,每次5分钟以去除残留的多聚甲醛。加入0.2v%Triton X-100对细胞进行通透处理20分钟,然后使用PBS洗涤3次,每次5分钟。加入含有5-10w/v%驴血清的PBS溶液,对细胞进行封闭处理30-60分钟。去除驴血清PBS溶液,加入含有一抗(Krt5和p63)的PBS溶液,4℃孵育过夜。去除含有一抗的PBS溶液,使用PBS洗涤3次,每次10分钟。加入含有能够识别一抗的二抗PBS溶液,室温孵育2小时。去除二抗PBS溶液,加入20ng/mL DAPI溶液细胞核染色,孵育10分钟。使用PBS洗涤3次,每次20分钟。封片后置于显微镜下观察细胞。观察到细胞克隆为Krt5和p63阳性,表明本实施例分离和获取的细胞为人肺脏干细胞。
重组载体的构建:
根据如SEQ ID NO.1所示hCAP18的氨基酸序列以及编码密码子,设计并人工合成如SEQ ID NO.3所示的hCAP18的编码基因,构建hCAP18-pHIV质粒,并包装成为病毒。
慢病毒感染肺脏干细胞:
将上述病毒溶液按MOI值为15加入到上述获取的人肺脏干细胞中,同时加入10ug/mL聚凝胺(Polybrene),培养24-48h,即得。
实验例1
本实施例制备的小鼠肺干细胞含有表达抗菌肽hCAP18的重组载体,抗菌肽hCAP18的表达框架为:5’到3’方向依次为启动子、抗菌肽hCAP18的编码基因。
小鼠肺脏干细胞的分离和鉴定:
用无菌镊取出成年C57小鼠的肺脏,浸泡在含有0.5-1.5v%Pen/Strep,3-10v%FBS的F12培养基中。弃去肺脏主支气管,用无菌手术刀将肺叶分离成小块。
取组织消化液和终止液备用;其中组织消化液中,99v%为DMEM/F12,其余为1-20ng/mL的DNA酶,0.1-4mg/mL蛋白酶和10-200ng/mL胰酶;终止液中90v%为DMEM,10v%为FBS。
利用组织消化液对上述肺叶小块消化过夜,终止消化后通过70μm尼龙网分离细胞,并用低温F12培养基洗涤2次,然后加入1mL配方为225mL DMEM、225mL F12、20-70mLFBS、0.2-2mM L-glutamine、1-14ng/mL胰岛素、0.1-1ng/mL表皮生长因子、5-30ug/mL腺嘌呤、2-20ug/mL氢化可的松的肺脏干细胞培养基重悬细胞,转至预先铺被滋养层细胞的12孔板中,每个孔加200ul双抗(10000u/mL青霉素和10000ug/mL链霉素),在37℃,5%CO2条件下培养,隔天更换培养基,一般在4-7天后即可见到细胞克隆出现,待细胞呈克隆状生长并长大至超过80%的克隆中有40-100个细胞,收集细胞,一半传代,一半利用铺被滋养层细胞的6cm培养皿对收集细胞进行铺板传代培养。
待培养细胞长满至培养皿表面积的85%-95%时,每个培养皿加入1×DPBS洗涤一次,加入2mL 0.25%(质量体积比0.25g/100mL)胰酶,在37℃中放置5-15min,待大部分细胞变圆变亮后,用1mL枪头轻轻将贴壁细胞吹打下来并吹打成单细胞悬液,再用2mL终止液终止消化,收集细胞悬液,1200rpm离心5min,去上清,并用肺干细胞培养基重悬细胞,即得肺脏干细胞。
取肺脏干细胞进行细胞免疫荧光染色。待干细胞克隆生长到20-30个细胞时,使用4w/v%多聚甲醛固定细胞10分钟。固定结束后,使用PBS洗涤3次,每次5分钟以去除残留的多聚甲醛。加入0.2v%Triton X-100对细胞进行通透处理20分钟,然后使用PBS洗涤3次,每次5分钟。加入含有5-10w/v%驴血清的PBS溶液,对细胞进行封闭处理30-60分钟。去除驴血清PBS溶液,加入含有一抗(Krt5和p63)的PBS溶液,4℃孵育过夜。去除含有一抗的PBS溶液,使用PBS洗涤3次,每次10分钟。加入含有能够识别一抗的二抗PBS溶液,室温孵育2小时。去除二抗PBS溶液,加入20ng/mL DAPI溶液细胞核染色,孵育10分钟。使用PBS洗涤3次,每次20分钟。封片后置于显微镜下观察细胞。观察到细胞克隆为Krt5和p63阳性,表明本实施例分离和获取的细胞为小鼠肺脏干细胞。
重组载体的构建:
根据如SEQ ID NO.1所示hCAP18的氨基酸序列以及编码密码子,设计并人工合成如SEQ ID NO.3所示的hCAP18的编码基因,构建hCAP18-pHIV-EGFP质粒,并包装成为病毒。同时将pHIV-EGFP包装为病毒作为对照。
慢病毒感染肺脏干细胞:
将上述病毒溶液按照MOI值为15加入到上述分离和获取的小鼠肺脏干细胞中,同时加入10ug/mL聚凝胺(Polybrene),培养24/48h,即得。将所得含有重组载体hCAP18-pHIV-EGFP和pHIV-EGFP的小鼠肺脏干细胞分别记为hCAP18-mDASC和WT-mDASC。将hCAP18-mDASC和WT-mDASC用PBS洗涤3遍,在荧光显微镜下镜检转染效率,80%以上的细胞表达GFP。
实验例2
采取以下方法检测实验例1hCAP18-mDASC中抗菌肽LL-37的表达。
1、qPCR定量法
利用RNeasy mini kit(Qiagen)提取hCAP18-mDASC和WT-mDASC的RNA,反转录的cDNA后。按照20ul体系进行荧光定量PCR,20ul体系如下:
10ul SYBR Premix EX Taq II(2x),
0.7ul PCR Forward Primer(10uM),
0.7ul PCR Reverse Primer(10uM),
0.4ul ROX Reference Dye II(50x),
1ul cDNA,7.2ul ddH2O。
引物:
qLL-37F CACAGCAGTCACCAGAGGATTG
qLL-37R GGCCTGGTTGAGGGTCACT
hGAPDH F CGGAGTCAACGGATTTGGTCGTAT
hGAPDH R AGCCTTCTCCATGGTGGTGAAGAC
结果如图1所示,pHIV-EGFP病毒转染的肺脏干细胞(WT-mDASC)几乎不表达LL-37,hCAP18-pHIV-EGFP病毒转染的肺脏干细胞(hCAP18-mDASC)表达高水平的LL-37。
2、蛋白免疫印迹法
分别取3*10
结果如图2所示,pHIV-EGFP病毒转染的肺脏干细胞(WT-mDASC)不表达LL-37,hCAP18-pHIV-EGFP病毒转染的肺脏干细胞(hCAP18-mDASC)表达高水平的LL-37。
3、免疫荧光染色法
利用配方为225mL DMEM、225mL F12、20-70mL FBS、0.2-2mM L-谷氨酰胺、1-14ng/mL胰岛素、0.1-1ng/mL表皮生长因子、5-30ug/mL腺嘌呤、2-20ug/mL氢化可的松的肺脏干细胞培养基培养WT-mDASC和hCAP18-mDASC,待干细胞克隆生长到20-30个细胞大时,使用4v%多聚甲醛固定细胞10分钟。固定结束后,使用PBS洗涤3次,每次5分钟以去除残留的多聚甲醛。加入0.2v%Triton X-100对细胞进行通透处理20分钟,使用PBS洗涤3次,每次5分钟。加入含有5-10w/v%驴血清的PBS溶液,对细胞进行封闭处理30-60分钟。去除驴血清PBS溶液,加入含有一抗(p63和Krt5)的PBS溶液,4℃孵育过夜。去除含有一抗的PBS溶液,使用PBS洗涤3次,每次10分钟。加入含有能够识别一抗的二抗PBS溶液,室温孵育2小时。去除二抗PBS溶液,加入0.1%DAPI溶液细胞核染色,孵育10分钟。使用PBS洗涤3次,每次20分钟。封片后置于显微镜下观察细胞。
结果如图3所示,WT-mDASC和hCAP18-mDASC表达的干细胞标志物p63和Krt5水平相似。
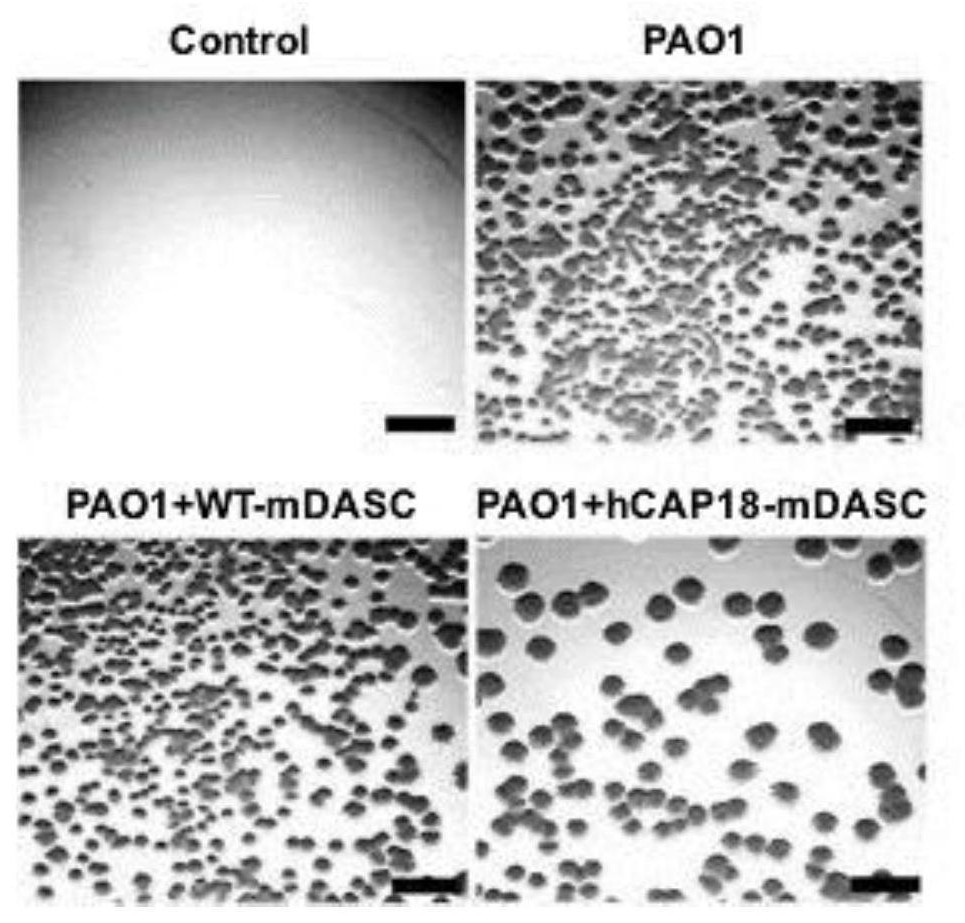
4、抑菌试验
铜绿假单胞菌(P.aeruginosa)选用PAO1菌株。用无菌枪头,将LB平板上的铜绿假单胞菌单克隆菌落挑至适量液体LB培养基,置于恒温摇床中,以37℃,200rpm条件培养过夜(12-16小时)。取1mL对数期菌液于EP管中,8000rpm离心5分钟,去除上清后1mL PBS重悬,反复洗涤3次。将培养至对数期的铜绿假单胞菌菌液,按照10
分别取hCAP18-mDASC和WT-mDASC培养48h的上清液培养计数好的PAO1菌液18h,对培养后的PAO1的CFU进行铺板测定。也可采取hCAP18-mDASC、WT-mDASC与细菌共培养方法。
结果如图4所示,hCAP18-mDASC上清液对PAO1的生长有明显的抑制作用,而WT-mDASC上清液对PAO1的生长没有明显的抑制作用,表明hCAP18-mDASC能产生和分泌功能性LL-37,具有抗菌作用。
实验例3
取WT-mDASC和hCAP18-mDASC分别与MOI值为1,5,10的PAO1菌共培养6小时,然后对共培养体系中菌的量进行检测。结果如图5所示,与WT-mDASC共培养体系相比,hCAP18-mDASC共培养体系中PAO1菌的数量明显减少。
进一步取MOI值为1的PAO1菌分别与WT-mDASC和hCAP18-mDASC共培养6h和18h,然后对共培养体系中菌的量进行检测。结果如图6所示,hCAP18-mDASC共培养体系中PAO1菌的数量少于WT-mDASC共培养体系中的PAO1菌。
在体外细胞细菌直接接触环境下,hCAP18-mDASC细胞能够明显抑制细菌的生长速度。并且在细菌数量远远高于细胞数量时,hCAP18-mDASC仍然能发挥抑菌作用,同时其抑菌作用具有一定的持续性。
实验例4
4v%水合氯醛0.2mL腹腔注射麻醉,5-10min后,将小鼠挂于鼠架上,压舌滴入法将博来霉素溶液滴入小鼠肺部。博莱霉素处理小鼠7-8天后,按1*10
实验例5
将化疗药物博来霉素(粉末)溶于DMSO,调整浓度至10mg/mL。取3uL博莱霉素溶液加入无菌PBS配至40uL,涡旋混匀。4v%水合氯醛0.2mL腹腔注射麻醉,5-10min后,将小鼠挂于鼠架上,压舌滴入法将博来霉素溶液滴入小鼠肺部。博莱霉素处理小鼠7-8天后,得到肺损伤的小鼠,备用。
按1*10
取移植后不同天数的小鼠肺脏组织进行分析。在体视镜下观察肺部绿色荧光,取绿色荧光的组织块OCT包埋后冰冻切片,取绿色荧光的组织块放入3.7v%多聚甲醛溶液,室温下摇床2小时,至于4℃冰箱过夜,将3.7v%多聚甲醛换为75v%乙醇过夜。然后进行如下操作:
脱水:75v%乙醇(180min)→85v%乙醇(180min)→95v%乙醇(180min)→100v%乙醇(180min)→100v%乙醇(180min)。
透明:将脱水后的组织置于二甲苯中,10min左右,待组织变硬和透明,放于液体石蜡中(60℃)。
包埋:提前将快速冷冻台启动,待温度下降至-16℃左右时,将组织和适量石蜡放于冷冻盒中,冷冻盒置于快速冷冻台,10-15分钟后,将组织和冷冻盒一起放于4℃冰箱过夜。
OCT包埋:3.7v%福尔马林固定过夜的组织,PBS洗涤1次。将组织浸泡于30w/v%蔗糖中脱水,待组织完全沉入底部后,置于盛有OCT的组织包埋盒,待组织沉降到底部,移至-20℃冰箱,30min后OCT完全变为固态进行切片。
上述石蜡切片用二甲苯脱蜡,经各级乙醇至水洗:
二甲苯(I)5min→二甲苯(Ⅱ)5min→二甲苯(III)5min→100v%乙醇3min→95v%的乙醇3min→80v%乙醇3min→75v%乙醇3min→PBS3min。苏木素染色1min,自来水冲洗。盐酸乙醇分化5s。自来水冲洗5min。PBS→50v%乙醇2min→75v%乙醇2min→80v%乙醇2min→95v%乙醇2min,伊红染色10s→100v%乙醇2min→二甲苯5min→中性树脂封片。
然后在56℃恒温箱中烘烤过夜,然后进行脱蜡和水化:
二甲苯(I)10min→二甲苯(Ⅱ)10min→二甲苯(III)10min→100v%乙醇6min→95v%的乙醇6min→80v%乙醇6min→75v%乙醇6min→PBS 6min
冰冻切片的处理:3.7v%多聚甲醛溶液和100v%甲醇降温至-20℃备用。将切片置于100v%甲醇中1-2分钟,3.7v%多聚甲醛洗净,并浸泡20分钟。
抗原修复:将前一步中处理好的组织切片,置于枸橼酸钠缓冲溶液(pH6.0)中,微波炉加热,高火处理4次,每次4min,中火处理1次,4min。待缓冲液冷却至室温后,将切片取出。PBS洗5min。
滴加10w/v%正常驴血清,室温封闭2小时。将封闭液甩去,滴加稀释好的一抗(GFP和LL-37),室温孵育1小时后4℃过夜。PBS洗3次,每次5min。滴加荧光标记的二抗,室温避光孵育2h。PBS洗3次每次5min。DAPI染色10min。苏丹黑处理1-2min。PBS洗3次每次5min。
封片:封固剂(Mounting Medium)封片,等Mounting Medium凝固后与荧光显微镜下观察。
结果如图7所示,mDASC(及其后代)在移植后定植于小鼠的肺脏区域(图7A)。组织切片后直接荧光显示,干细胞及其后代在小鼠肺实质中分布广泛,部分干细胞分化成肺泡结构(图7B)。GFP标记的hCAP18-mDASC在移植进入肺组织后,肺组织内可正常表达LL-37(图7C)。
实验例6
取实验例4中移植WT-mDASC和hCAP18-mDASC的肺脏损伤小鼠,对Control-lung和LL-37-lung气管内注射铜绿假单胞菌(PAO1)和大肠杆菌(Ecoli)诱导细菌性肺炎,采用细菌培养法测定小鼠全肺匀浆和支气管肺泡灌洗液中PAO1和Ecoli负荷水平(即检测菌浓度)。
结果如图8所示,其中,A和B分别为全肺匀浆中铜绿假单胞菌和大肠杆菌的菌浓度,C和D分别为支气管肺泡灌洗液中铜绿假单胞菌和大肠杆菌的菌浓度。结果表明,LL-37-lung在全肺匀浆和支气管肺泡灌洗液中PAO1和Ecoli负荷显著降低,表明hCAP18-mDASC的移植肺可以保护小鼠肺免受细菌感染,改善受体肺功能。
实验例7
将化疗药物博来霉素(粉末)溶于DMSO,调整浓度至10mg/mL。取3uL博莱霉素溶液加入无菌PBS配至40uL,涡旋混匀。4v%水合氯醛0.2mL腹腔注射麻醉,5-10min后,将小鼠挂于鼠架上,压舌滴入法将博来霉素溶液滴入小鼠肺部。博莱霉素处理小鼠7-8天后,得到肺损伤的小鼠,备用。
按1*10
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
SEQUENCE LISTING
<110> 同济大学
<120> 一种具有抗菌能力的肺脏干细胞及其应用
<130> 2019
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 170
<212> PRT
<213> 人工序列
<400> 1
Met Lys Thr Gln Arg Asp Gly His Ser Leu Gly Arg Trp Ser Leu Val
1 5 10 15
Leu Leu Leu Leu Gly Leu Val Met Pro Leu Ala Ile Ile Ala Gln Val
20 25 30
Leu Ser Tyr Lys Glu Ala Val Leu Arg Ala Ile Asp Gly Ile Asn Gln
35 40 45
Arg Ser Ser Asp Ala Asn Leu Tyr Arg Leu Leu Asp Leu Asp Pro Arg
50 55 60
Pro Thr Met Asp Gly Asp Pro Asp Thr Pro Lys Pro Val Ser Phe Thr
65 70 75 80
Val Lys Glu Thr Val Cys Pro Arg Thr Thr Gln Gln Ser Pro Glu Asp
85 90 95
Cys Asp Phe Lys Lys Asp Gly Leu Val Lys Arg Cys Met Gly Thr Val
100 105 110
Thr Leu Asn Gln Ala Arg Gly Ser Phe Asp Ile Ser Cys Asp Lys Asp
115 120 125
Asn Lys Arg Phe Ala Leu Leu Gly Asp Phe Phe Arg Lys Ser Lys Glu
130 135 140
Lys Ile Gly Lys Glu Phe Lys Arg Ile Val Gln Arg Ile Lys Asp Phe
145 150 155 160
Leu Arg Asn Leu Val Pro Arg Thr Glu Ser
165 170
<210> 2
<211> 37
<212> PRT
<213> 人工序列
<400> 2
Leu Leu Gly Asp Phe Phe Arg Lys Ser Lys Glu Lys Ile Gly Lys Glu
1 5 10 15
Phe Lys Arg Ile Val Gln Arg Ile Lys Asp Phe Leu Arg Asn Leu Val
20 25 30
Pro Arg Thr Glu Ser
35
<210> 3
<211> 522
<212> DNA
<213> 人工序列
<400> 3
atggggacca tgaagaccca aagggatggc cactccctgg ggcggtggtc actggtgctc 60
ctgctgctgg gcctggtgat gcctctggcc atcattgccc aggtcctcag ctacaaggaa 120
gctgtgcttc gtgctataga tggcatcaac cagcggtcct cggatgctaa cctctaccgc 180
ctcctggacc tggaccccag gcccacgatg gatggggacc cagacacgcc aaagcctgtg 240
agcttcacag tgaaggagac agtgtgcccc aggacgacac agcagtcacc agaggattgt 300
gacttcaaga aggacgggct ggtgaagcgg tgtatgggga cagtgaccct caaccaggcc 360
aggggctcct ttgacatcag ttgtgataag gataacaaga gatttgccct gctgggtgat 420
ttcttccgga aatctaaaga gaagattggc aaagagttta aaagaattgt ccagagaatc 480
aaggattttt tgcggaatct tgtacccagg acagagtcct ag 522
<210> 4
<211> 114
<212> DNA
<213> 人工序列
<400> 4
ctgctgggtg atttcttccg gaaatctaaa gagaagattg gcaaagagtt taaaagaatt 60
gtccagagaa tcaaggattt tttgcggaat cttgtaccca ggacagagtc ctag 114
<210> 5
<211> 93
<212> DNA
<213> 人工序列
<400> 5
atgagagaga acatggccag gggcccttgc aacgcgccga gatgggcgtc cctgatggtg 60
ctggtcgcca taggcaccgc cgtgacagcg gcc 93
- 一种具有抗菌能力的肺脏干细胞及其应用
- 一种具有自抗菌能力的面膜材料及其制备方法与应用
