一种细胞因子诱导的杀伤细胞的制备方法
文献发布时间:2023-06-19 09:26:02
技术领域
本发明涉及免疫细胞制备技术领域,具体来说,涉及一种细胞因子诱导的杀伤细胞的制备方法。
背景技术
1991年Schmidt Wolf等发现以INF-γ、anti-CD3Mab、IL-1a、IL-2因子组合分步诱导、扩增PBMNC,能获得一群以CD3+CD56+细胞为效应细胞的高增殖潜能、高杀伤活性的NK样T淋巴细胞,此后国内外大量的试验研究或临床应用所采用的培养体系均与Schmidt Wolf等的类似。既往的研究表明,未经分选的PBMNC诱导扩增得到的CIK细胞是高度异质性的,其中包含一群高杀伤活性的、低增殖能力的非MHC限制性的CD3+CD56+细胞和另外一群低杀伤活性的、高增殖能力的CD3+CD56-细胞。我们统计的48个临床研究显示CIK细胞得率大约在2×10
发明内容
针对相关技术中的上述技术问题,本发明提出一种细胞因子诱导的杀伤细胞的制备方法,能够克服现有技术的上述不足。
为实现上述技术目的,本发明的技术方案是这样实现的:
一种细胞因子诱导的杀伤细胞的制备方法,包括以下步骤 :
S1.将采集的人外周血样本分离得到PBMNC;
S2.将PBMNC接种至被重组人源化抗CD25mAb单克隆抗体包被过的培养瓶中培养;
S3.将步骤S2得到的未贴壁细胞和培养上清一起转移至被重组人源化抗CD3ε单克隆抗体包被过的培养瓶中,补充INF-γ继续培养。
进一步地,步骤S2中所述重组人源化抗CD25mAb单克隆抗体包被培养瓶的方法为:将含10μg/mL重组人源化抗CD25mAb单克隆抗体的GT-T551无血清培养基作为包被液加入到培养瓶中,37℃包被6小时,吸弃包被液,以GT-T551无血清培养基洗涤2次备用。
进一步地,步骤S2中PBMNC培养时间为24h。
进一步地,步骤S3中所述重组人源化抗CD3ε单克隆抗体包被培养瓶的方法为:将含重组人源化抗10μg/mLCD3ε单克隆抗体、50μg/mL NovoNectin的GT-T551无血清培养基作为包被液加入到培养瓶中,37℃包被6小时,吸弃包被液,以GT-T551无血清培养基洗涤2次备用。
进一步地,步骤S3中补充INF-γ继续培养24h后,补充重组人IL-2、IL-1a,继续培养48h,补充CIK细胞扩增培养基继续培养。
进一步地,补充CIK细胞扩增培养基继续培养过程中每隔48h补充一次CIK细胞扩增培养基。
进一步地,所述CIK细胞扩增培养基为含500Μ/mL重组人IL-2、2%灭活血浆的GT-T551无血清培养基。
进一步地,步骤S2中接种至培养瓶的PBMNC的细胞密度不低于5X10
进一步地,步骤S1中采用密度梯度离心法分离PBMNC。
进一步地,PBMNC在37℃,5%CO
本发明的有益效果:本发明的细胞因子诱导的杀伤细胞的制备方法通过采用CD25单抗改良CIK细胞传统培养工艺诱导、扩增CIK细胞,从而提高CD3+CD56+细胞得率,降低CD3+CD4+细胞比例,有效提高CIK细胞对K562和SK-MEL-5细胞的杀伤潜能,对制定临床级CIK细胞制剂的制备方法和质量标准有重要意义。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
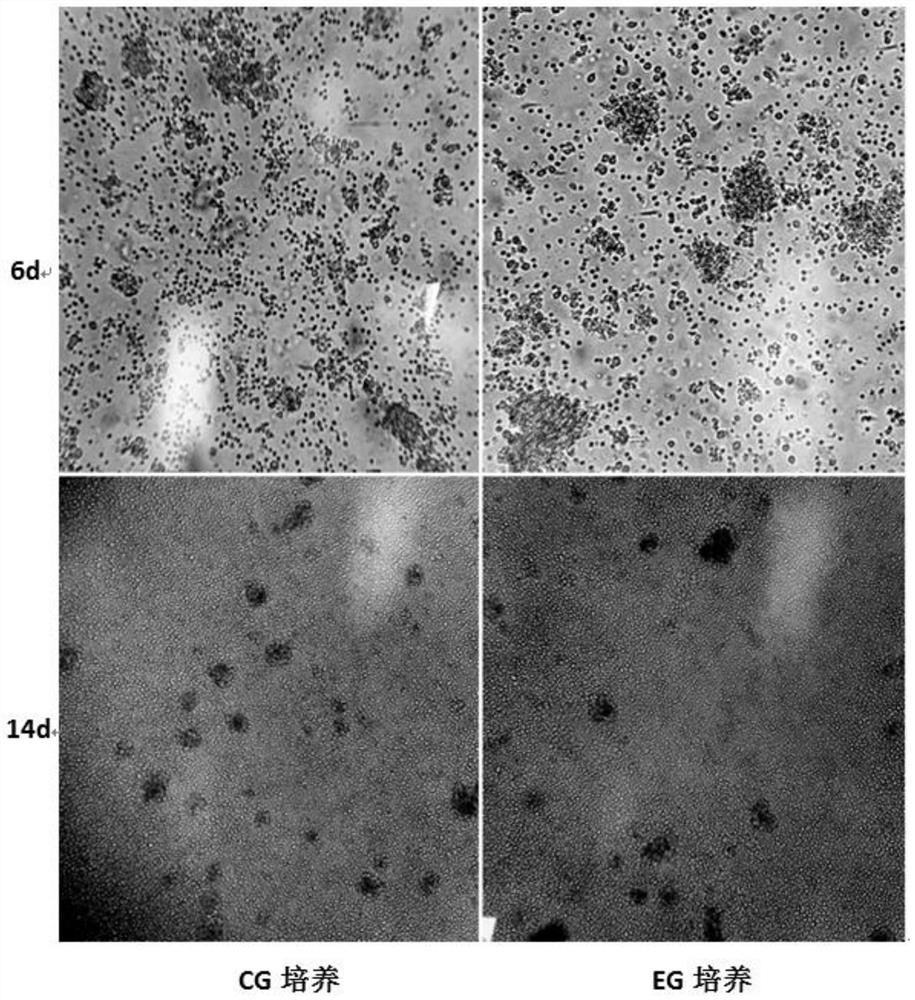
图1是根据本发明实施例所述的两种培养体系CIK细胞的生长状态对比图;
图2是根据本发明实施例所述的两种培养体系的有核细胞和CD3+CD56+效应细胞的数量对比图;
图3是根据本发明实施例所述的两种不同培养体系CIK细胞中淋巴细胞亚群的百分比对比图;
图4是根据本发明实施例所述的不同效靶比条件下,两种培养体系CIK细胞对K562细胞的杀伤效应对比图;
图5是根据本发明实施例所述的不同效靶比条件下,两种培养体系CIK细胞对SK-MEL-5细胞的杀伤效应对比图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
1. 外周血样本及试剂
1.1外周血样本
以枸橼酸钠抗凝管经肘正中静脉采集所述9例健康供者外周血,按“采血量(mL)=1X10
本实施例纳入9名健康供者的外周血样本,男6人,女3人;平均年龄(岁)29.22±5.58(21~42);采血前血常规检查结果表明LYM#(*10
1.2试剂
枸橼酸钠抗凝管(南格尔生物医学股份有限公司);
人外周血淋巴细胞分离液(LTS1077,天津灏洋生物制品科技有限责任公司);
人源化INF-γ(IFG-H4211,ACRO biosystems);
重组人IL-1a(KX-GMP-023,上海惠诚生物科技有限公司);
GT-T551无血清培养基(Takara BIO株式会社);
重组抗CD3ε人源化单克隆抗体(MT-OKT3-01,妙通(上海)生物科技有限公司);
NovoNectin(GMP-CH-38,上海近岸科技有限公司);
重组人源化抗CD25mAb单克隆抗体(健尼哌,三生制药);
重组人IL-2(因特康,江苏金丝利药业有限公司);
LDH检测试剂盒(KTB1110,Abbkine)。
2. 细胞因子诱导的杀伤细胞的制备方法
2.1分离PBMNC
本发明采用密度梯度离心法分离PBMNC:将血液样本从采血管转移至50mL一次性无菌锥形离心管中,400Xg离心20min,升速5,降速1;以一次性无菌嘴叨管小心吸取上层血浆,于56℃水浴中,恒温水浴30min,3000 X g离心取上清备用;以生理盐水重悬沉淀,将细胞悬液小心铺到25mL人外周血淋巴细胞分离液上,800Xg,升速1,降速1,离心30min;收取中间云雾层,洗涤2次,收集细胞沉淀,记为PBMNC。
2.2培养瓶包被
2.2.1将10mL含10μg/mL重组人源化抗CD25mAb单克隆抗体的GT-T551无血清培养基加入到175cm
2.2.2将10mL含重组人源化抗10μg/mLCD3ε单克隆抗体、50μg/mLNovoNectin的GT-T551无血清培养基加入到175cm
2.3CIK细胞培养
2.3.1实验组(EG)采用改良的CIK细胞培养工艺:
培养d0,将步骤2.1获得的PBMNC以适量GT-T551无血清培养基重悬,调整细胞密度至不低于5X10
d1,即培养24h,将未贴壁细胞和培养上清一起转移至CD3ε单抗包被培养瓶中,补充人源化INF-γ至终浓度1000U/mL、灭活血浆至终浓度5%;置于37℃,5%CO
d2,即培养48h,补充重组人IL-2、IL-1a至终浓度分别为500U/mL、10ng/mL;
d4,补充CIK细胞扩增培养基(含500U/mL重组人IL-2、2%灭活血浆(如果有)的GT-T551无血清培养基),终体积至100mL/瓶;
d6,补充CIK细胞扩增培养基,终体积至250mL/瓶;
d8、10、12天,分别补充等体积的CIK细胞扩增培养基。
2.3.2 培养d14时收获,收集培养的CIK细胞悬液,400Xg离心,以生理盐水洗涤2次,合并沉淀,以台盼蓝排斥法计数,核算细胞活率。
2.4 LDH释放法检测CIK细胞杀伤活性
2.4.1CIK细胞杀伤活性检测采用的靶细胞为慢性髓系白血病细胞系K562(ATCC)和皮肤恶性黑色素瘤细胞系SK-MEL-5(ATCC)。按ATCC推荐医疗方案(protocol)操作:以含10%FCS(SH30073.03,hyclone)、1%NEAA(11140050,Gibco)的IMDM(12-722F,Lonza)调整K562细胞密度至2X10
2.4.2收获的d14 CIK细胞以GT-T551无血清培养基重悬,调整细胞密度至4X10
按 “杀伤活性(%)=[(OD实验组-OD总自然释放)/(OD最大释放组-OD总自然释放)]×100% ”计算CIK细胞杀伤活性。
2.5 流式细胞术检测细胞表型
收集步骤2.1分离的PBMNC细胞、培养d14收获的CIK细胞按1X10
-CD8Mab-FITC孵育标记,上机(FACSCantoTM II flow cytometer,BD Bioscientics)行流式细胞术检测细胞表型。多色标记抗体、同型对照IgG均采购自恪敏生物。
3.统计方法
采用统计软件SPSS17.0进行分析。数值以平均值±标准差表示,均值比较采用独立样本t-test,频数资料比较采用Chi-square test。p<0.05有统计学意义。
对比例1
对照组(CG)采用传统的CIK培养工艺,其余均与实施例1相同:
d0,将步骤2.1获得的PBMNC以适量GT-T551无血清培养基重悬,调整细胞密度至不低于5X10
d1,即培养24h,补充重组人IL-2、IL-1a至终浓度分别为500U/mL、10ng/mL;
d3,补充CIK细胞扩增培养基,终体积至100mL/瓶;
d5,补充CIK细胞扩增培养基,终体积至250mL/瓶;
d7、9、11,分别补充等体积的CIK细胞扩增培养基。
实施例1与对比例1结果对比:
本发明的9名健康供者的外周血样本, PBMNC平均收率(*10
如图1所示,CIK细胞培养48h内,EG和CG两组均有少量细胞贴壁,逐渐有悬浮成团细胞和贴壁的集落状细胞出现;培养第6天之后,几乎所有的细胞团和细胞半悬浮在培养基中。至收获时(d14),EG培养和CG培养CIK细胞收率(*10
如图2所示,至收获时(d14),EG培养和CG培养CD3+CD36+细胞收率(*10
CG以常规培养体系培养CIK细胞,而EG以改良的培养体系培养CIK细胞。PBMNC样本中,CD3+细胞(%)占68.52±4.75,CD3+CD4+细胞(%)占47.91±4.58,CD3+CD8+细胞(%)占30.96±2.16,CD3+CD56+细胞(%)占5.06±1.06。如图3所示,至d14收获时,CG培养的CIK细胞中,CD3+细胞数量(*10
如图4所示,采用LDH释放法检测CIK细胞对K562和SK-MEL-5细胞的杀伤活性,发现CG培养的CIK细胞按效靶比1:1、2:1、5:1、10:1、20:1、40:1杀伤K562细胞的百分比(%)分别为16.09±3.42、24.24±4.16、34.66±4.71、43.50±3.50、72.40±4.17、74.19±7.21;EG培养的CIK细胞按效靶比1:1、2:1、5:1、10:1、20:1、40:1杀伤K562细胞的百分比(%)分别为28.65±4.82、46.16±7.91、71.81±6.65、74.82±4.36、77.44±3.78、78.58±4.84,除了效靶比20:1和40:1以外,效靶比1:1、2:1、5:1和10:1,CG培养的CIK细胞对K562细胞的杀伤率远低于EG培养的CIK细胞(p<0.05)。
如图5所示,CG培养的CIK细胞按效靶比1:1、2:1、5:1、10:1、20:1、40:1杀伤SK-MEL-5细胞的百分比(%)分别为5.31±1.50、8.24±1.66、12.42±2.22、15.91±1.92、47.78±5.50、53.27±3.53;EG培养的CIK细胞按效靶比1:1、2:1、5:1、10:1、20:1、40:1杀伤SK-MEL-5细胞的百分比(%)分别为18.62±1.63、34.93±3.66、48.85±5.81、52.04±5.84、57.66±3.70、56.02±5.06,除了20:1和40:1外,其它效靶比相同的情况下,CG培养的CIK细胞对K562细胞的杀伤率低于EG培养的CIK细胞(p<0.05)。
过继式免疫细胞治疗,是通过体外培养免疫细胞,转输患者体内,避免体内正常免疫调控制约和肿瘤免疫抑制、减少肿瘤逃逸作用的影响、增加靶向抗肿瘤免疫细胞的数量,从而杀伤肿瘤细胞,清除微小病灶和远端转移灶,抑制肿瘤发展、复发和转移。目前存在两类过继式免疫细胞治疗技术,即靶向免疫细胞治疗技术和非特异性免疫细胞治疗技术。靶向免疫细胞治疗技术以CTL和CAR-T技术为主,依赖于DC呈递的肿瘤细胞特异的靶分子或通过分子生物学技术构建、转染携带特异性肿瘤细胞靶分子信息的识别构件从而赋予CTL对肿瘤细胞的靶向杀伤活性。靶向免疫细胞治疗技术对肿瘤特异性标志物的要求极高,anti-CD19能标记几乎所有的大B淋巴细胞,因此CD19-CAR-T细胞治疗能用于治疗大B细胞淋巴瘤,但针对CD44、CD133等广谱肿瘤抗原设计的CAR-T治疗,不可避免发生严重的脱靶效应,与常规化疗的不良反应无异。因此对于实体瘤的CAR-T或CAR-NK等靶向性过继式免疫细胞治疗还有更长的路要走。与之相反,非特异性免疫细胞治疗,包括CIK细胞、NK细胞治疗,虽然对高负荷肿瘤的免疫杀伤效果较差,但由于其独特的免疫识别机制,能杀伤更广谱的肿瘤细胞,而没有更多不可预期的严重不良反应,在肿瘤术后、肿瘤发展早期、化放疗后恢复治疗以及预防性治疗和姑息治疗方面应该有更多的应用。
CIK细胞是一种高增殖潜能、高杀伤活性的NK样T淋巴细胞。既往的研究表明,采用传统的INF-γ、anti-CD3Mab、IL-1a、IL-2分步激活、诱导、扩增外周血、脐带血、胎盘血等来源的1*10
CIK细胞培养依赖于INF-γ、anti-CD3Mab、IL-1a、IL-2细胞因子的激活、诱导。一般认为INF-γ的添加能提高CIK细胞对肿瘤细胞的杀伤活性,而且能抑制CD4+的激活和扩增。在CIK细胞的长期培养过程中也能观察到这一点。我们过去的研究发现,CIK细胞在培养14天时,CD4+大约占32%左右,而培养到28天时,CD4+阳性细胞百分比降低到15%以下。那么如何在培养期14天内抑制CD4+细胞的激活和扩增是CIK细胞培养工艺改良的一个关键因素。CD25是IL-2Ra链,表达在激活的T淋巴细胞表面。临床上使用抗CD25单抗竞争结合IL-2受体以降低GVHD等免疫反应或治疗某些自身免疫性疾病。我们的研究发现,在培养CIK细胞的培养体系中加入CD25单抗,起到不同的作用。如果在INF-γ使用之后加入CD25单抗,会抑制包括CD4+、CD8+在内所有的T淋巴细胞增殖,在INF-γ使用之前加入CD25单抗,则主要抑制CD4+细胞增殖,而对CD8+细胞增殖没有明显的影响。因此,我们在改良的CIK细胞培养体系中,首先将PBMNC接种到CD25单抗包被的培养容器中,培养24小时后,再将悬浮细胞转移到OKT3包被的培养容器中,补充INF-γ继续培养。研究结果表明,至培养d14,CG培养的CIK细胞中CD3+CD4+细胞占29.15±8.24%,相比于PBMNC(47.91±4.58%)百分比增加了0.62±0.16倍,而EG培养的CIK细胞中CD3+CD4+细胞占5.71±2.21%,相比于PBMNC百分比增加了0.10±0.04倍,两种培养体系相比差异非常显著(p<0.01),说明改良的CIK细胞培养体系显著降低了CD4+细胞的激活、诱导和扩增。(图3)
CD3+CD56+细胞是CIK细胞的主要效应细胞,其数量代表培养的CIK细胞的肿瘤杀伤能力。既往的研究表明,采用INF-γ、anti-CD3Mab、IL-1a、IL-2分步激活、诱导、扩增获得的CIK细胞中CD3+CD56+细胞约占35.5%(7.6~65%)。在采用改良的培养体系之后,是否能保持甚至提高CD3+CD56+细胞在CIK细胞中的比例是另外的关键。我们的研究结果表明,至培养d14,CG培养的CIK细胞中CD3+CD56+细胞占24.09±8.24%,相比于PBMNC(5.06±1.06%)百分比增加了4.91±1.04倍,而EG培养的CIK细胞中CD3+CD56+细胞占68.07±8.02%,相比于PBMNC百分比增加了14.14±2.70倍,两种培养体系相比差异非常显著(p<0.01)。另外对CD3+CD56+细胞收率的统计结果表明,CG培养的CD3+CD56+细胞在培养d14时,相比于PBMNC扩增了503.56±112.29倍,而EG培养的CD3+CD56+细胞扩增了1167.63±363.64倍,也就是说,投入相同数量的PBMNC培养CIK细胞,EG培养的CD3+CD56+细胞数量是CG培养的2.20倍,两组差异非常显著(p<0.01),说明改良的CIK细胞培养体系显著促进了CD3+CD56+细胞的激活、诱导和扩增。(图2)
既往的研究表明,CIK细胞输入治疗多种肿瘤疾病,其临床疗效与输入剂量呈线性关系,而且单疗程输入剂量高于3*10
CIK细胞为非MHC限制杀伤性T淋巴细胞,对肿瘤细胞具有广泛的杀伤效应。既往的研究表明,体外CIK细胞对淋巴瘤、黑色素瘤、乳腺癌、肺癌、胃癌、肝癌等肿瘤组织来源的细胞系均有不同程度的杀伤作用,我们统计的9篇文献报道靶细胞杀伤率在29.21±2.23%~72.23±2.27%,差异比较大。我们的研究也发现了这一点,CG培养和EG培养的CIK细胞的对K562细胞的杀伤作用在任何效靶比条件下都远高于对SK-MEL-5细胞的杀伤作用(p<0.05),说明CIK细胞对不同肿瘤细胞的杀伤效应存在差异,提示在临床使用CIK细胞输入治疗技术时,应考虑CIK细胞对不同肿瘤的敏感性。文献报道还显示CIK细胞杀伤肿瘤细胞的最佳效靶比是20:1,也就是说效靶比在20:1时杀伤活性达到平台值,继续提高效靶比,比如40:1、50:1,也不能显著提高CIK细胞对靶细胞的杀伤潜能,这与我们的研究基本相符。本研究将一份PBMNC平均分成两份,一份采用传统CIK细胞培养体系培养,即CG培养组,另外一份采用改良的CIK细胞培养体系培养,即EG培养组。对靶细胞的杀伤实验研究结果表明,两组培养的CIK细胞对K562细胞和对SK-MEL-5细胞的杀伤作用都存在平台值,对K562细胞系杀伤的平台值大约在72%左右,而对SK-MEL-5细胞系杀伤的平台值大约在50%左右,继续提高CIK细胞的靶效比没有显著提高对靶细胞的杀伤比例。不同的是,EG培养的平台值出现的靶效比是5:1,而CG培养的平台值出现的靶效比是20:1(图4-5)。我们的研究结果显示,CG培养的CIK细胞中CD3+CD56+细胞占24.01±7.36%,而EG培养的CIK细胞中CD3+CD56+细胞占68.07±8.02%,暗示CD3+CD56+效应细胞比例的提高可能是低效靶比高靶细胞杀伤潜能的主要原因。
综上所述,借助于本发明的上述技术方案,通过以包含anti-CD25 Mab的改良CIK细胞培养体系诱导、扩增CIK细胞,能有效降低培养14天的CIK细胞中CD3+CD4+亚群的百分比、提高CD3+CD56+效应细胞的收率和百分比,而且能有效提高CIK细胞对K562和SK-MEL-5细胞的杀伤潜能,对制定临床级CIK细胞制剂的制备方法和质量标准有重要意义。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种细胞因子诱导的杀伤细胞的制备方法
- 包括细胞因子诱导的杀伤细胞的活化淋巴细胞及其制备方法
