用于确定体外血液回路中循环的血液的至少一个参数的传感器和设备
文献发布时间:2023-06-19 09:29:07
技术领域
本发明涉及一种用于确定体外血液回路中循环的血液的至少一个参数的设备、传感器和过程。特别地,本发明的设备、传感器和过程可以用于体外回路中循环的血浆或血液的相对血容量变化(ΔRBV)的非侵入式测量,并且更详细地用于相对血容量变化百分比(ΔRBV%)和/或血液或血浆钠浓度(Na
尽管本发明的设备、传感器和过程可以应用于任何体外血液或血浆处理,但是在本文中我们将通过举例的方式主要涉及诸如血液透析或血液滤过或血液透析滤过等的处理。
血液透析是一种治疗慢性肾脏损伤患者的疗法,通常每周进行3-4次,持续3-5小时。该治疗具有三个主要目标,其中,第一目标是去除各次透析之间积累的过量的体内水分,其通过超滤(UF)实现。第二目标是去除同样在各次透析之间积累的尿毒症毒素。第三目标是恢复血液中电解质的适当平衡。
在血液透析治疗中,患者的血液和与血液流大致等渗的处理液在血液透析器的相应的隔室中循环,因此血液中存在的杂质和不期望的物质(尿素、肌酐等)可以通过弥散转运从血液进入处理液。选择处理液的离子浓度以校正患者血液的离子浓度。换句话说,血液透析基于弥散和对流的两种现象,通过这两种现象,实现了水和溶质跨血液透析过滤器(血液透析器)膜的物质转运。血液透析器是中空纤维的圆柱形束,其被设计为使交换表面积最大化。在内部,血液和透析液(渗析液)在膜的相对的两侧逆流流动。
在血液滤过中,通过超滤的对流转运跨血液过滤器的半透膜发生。在通过血液透析滤过的处理中,由半透膜的血液侧和处理液侧之间产生的正压差导致的通过超滤的对流转运与通过透析获得的弥散转运相加。
在这些类型的处理中,令人感兴趣的是能够确定指示处理如何影响或已经影响处理的血液的一个或多个参数。另一方面,某些血液参数的在线监测可以允许修改最初固定的处理条件,或者至少将处理的进展情况告知患者和医务人员。
了解以下一个或多个参数可以允许追踪处理的进展,从而有助于评估最初固定的处理条件的适用性,或确定处理单元是否充分发挥作用或评估通路再循环的存在:
-体外血液或血浆中的一种或多种电解质的浓度,
-体外血液或血浆的电导率,
-血容量变化,例如,在透析过程期间的相对血容量损失,
-对于给定的溶质,交换器的实际透析率D或实际清除率K(透析率D和清除率K表示交换器的净化效率),
-在处理时间t之后给予的透析剂量,根据Sargent和Gotch的工作,透析剂量可以与无量纲比率Kt/V相关,其中,K是尿素的实际清除率,t是经过的处理时间,V是尿素的分布体积,即患者体内的总水量(Gotch F.A.和Sargent S.A.于《肾脏国际》1985年28卷3期第526-34页发表的“A mechanistic analysis of the National Cooperative DialysisStudy(NCDS)(国家合作透析研究的机理分析)”)。
确定以上参数需要精确了解血液或血浆的物理或化学特征。
可以理解,原则上可以通过直接测量血液样本来确定该特征。但是,出于治疗、预防和财务方面的原因,从经常贫血的患者身上采集监测处理效果所需的多个标本是不可能的。此外,考虑到与处理可能被污染的血液样本相关的风险,总的趋势是避免这种处理操作;最后,对血液样本的实验室分析既昂贵又相对冗长,这与在处理仍在进行的同时了解处理效果的理想目标是不相容的。
在现代血液透析中,已经非常重视用于收集生理信息的非侵入式方法的开发,这些非侵入式方法通过将传感器直接应用于患者身上或在处理过程中访问血液透析机来进行。除了对患者安全和收集临床知识很重要以外,生理参数的连续或半连续监测对作为生物反馈系统的输入则尤其重要。
进行研究的生理参数的示例是相对血容量变化(ΔRBV%)、透析率(D)和血浆电导率(σ
已经提出了若干已知方法用于体内确定血液浓度或其它血液透析参数(例如血容量变化和血浆电导率),而不必对血样进行测量。
例如,在废弃透析液管线中使用尿素传感器,可以计算血液中的尿素浓度。然而,尿素传感器复杂、昂贵并且可能无法导致精确的测量。
根据第二种方法,可以通过以下方法来测量血液电导率或血液电解质浓度:在血液处理单元(过滤器或血液透析器)的入口处施加给定物质的浓度的周期性变化或透析液的电导率的周期性变化,并且通过根据废弃的透析液中的同一物质的浓度或电导率变化测量对应影响。以下专利参考文献公开了用于体内确定血液电导率、给定物质的血液浓度、透析率和扰动新鲜的透析液的其它参数的方法,以及用于在设备的透析液侧进行浓度/电导率的测量的方法:EP 0547025、EP 0658352、EP 0920877、US 2001004523、EP 2687248、US6187199、US5100554。第二类型的方法的问题在于,需要扰动新鲜透析液的成分,以便随后通过或多或少有些复杂的计算来确定寻求的参数,例如血液中的钠浓度和/或钠透析率。此外,可能难以高精度地测量透析器下游的液体中的浓度/电导率。而且,液压延迟、由透析器引起的阻尼效应、以及由机器及其组件引入的噪声可能需要适当地细化由传感器检测到的信号。另外,所有上述方法都需要可能相对复杂的计算,然后才能确定血钠浓度或血液电导率。
最后,US8525533使用电导率传感器,该电导率传感器被应用于废弃透析液管线,并且能够确定用过的透析液的电导率。根据该参考,电导率传感器需要四个电极,即两个环形激励电极和两个环形拾取电极(pick-up electrode)。当传感器应用于透析液管线时,为了确定血液参数,将必须采用具有刚刚描述的缺点的上述公开的方法之一。
现在参考相对血容量变化(ΔRBV),该特定血液参数的在线测量通常使用光学方法。光学ΔRBV估计基于血红蛋白(Hgb)的吸光度,血红蛋白几乎完全包含在红细胞内部。在简单的光学传感器中,LED和光电二极管用于检测与红细胞浓度变化相关的吸光度变化。在处理过程中,红细胞的数量几乎是恒定的,因此血液浓缩主要是由于超滤导致的水分去除所引起的,水分去除比血浆的重填率更大。
已知的传感器只能测量从红外LED发出的以180度透射过血液的光。这种测量、吸光度取决于血细胞比容的变化,因此其可用于估计相对血容量的损失。
用于测量相对血容量损失的其它装置利用反射率传感器来测量血液反射光。在这种情况下,发光LED和光学传感器以一定距离放置在比色皿的同一侧。
超声波传感器还用于测量作为总蛋白质浓度的函数的RBV损失。
此外,用于在不同波长下进行测量的具有多个LED的光学系统也用于估计氧饱和度和用于校准目的。
光学传感器在血液应用中的使用是分散的,但是大多数实现只使用一个测量通道。使用多个通道时,主要是为了检测不同波长的光,用于如估计氧饱和度或进行附加校准等目的(例如,以补偿温度的影响)。
最近,据报道,通过光学传感器进行的ΔRBV估计受到对电解质浓度变化的交叉敏感性的困扰。透析液钠浓度的急剧变化可能导致低估或高估ΔRBV。这种变化可以通过考虑渗透压对红细胞体积的作用来解释。钠是透析液和血浆两者中浓度最高的溶质之一,是渗透压的主要驱动因素。透析液钠的变化由于跨血液透析膜的弥散而传播到血浆。因此,跨红细胞膜发生水转移,以平衡内部和外部渗透压,从而改变其体积。这种体积变化会改变局部Hgb浓度,并导致血液吸收和散射属性发生变化。尽管有待研究血液浓缩、渗透压和血液光学属性之间的关系,但是渗透压对ΔRBV估计的影响仍然是要处理的重要的问题,因为在某些处理中,医师可能设定处理结束时要达到的血容量变化目标,并且ΔRBV结束估计可以用作控制超滤以达到目标的反馈。此外,为了改善患者的健康,必须避免巨大的血容量变化,或者换句话说,要在处理期过程期间确定血容量变化。显然,不准确的ΔRBV估计可能导致过程结束时水分去除的轨迹不正确。
在全血中,沿不同轨迹的光传播有不同的名称:透射、反射、散射。
在根据文献WO0033053的方法中,测量系统是该装置的变型,其通过添加具有90度附加通道的传感器来仅测量从照明红外LED以180度透过血液的光。附加通道主要具有校准和/或校正目的。现有技术的计算单元被布置为通过将由散射光二极管提供的散射光信号与由透射光二极管提供的透射光信号相除来计算比率信号,从而提供光学比率信号。根据文献WO0033053,已经发现垂直散射信号和透射信号之间的比率基本上与红细胞浓度成比例,即,比率信号与红细胞浓度之间存在线性关系。此外,比率信号仅对氧饱和度水平、渗透压和血液速率具有很小的依赖性。
从文献US5331958A1中还已知一种方法和装置,其可用于连续在线监测血细胞比容和其它血液参数。根据该现有技术,考虑了血液电解质成分(例如,血液钠浓度)的变化的影响。已经发现这种影响改变了光束的几何形状,并被用来提供血钠浓度的测量。该装置可以应用于体外回路或能够被透照的身体部位。该装置可用于优化透析,也可用于监测光学可检测的外源大分子。
在当前情况下,本发明的目的是提供一种设备、传感器和过程,其能够可靠地确定在体外血液回路中循环的血液或血浆的至少一个参数(例如,血容量变化(ΔRVB)和/或血液或血浆钠浓度(Na
本发明的实施例的又一个目的是提供一种设备和过程,其不需要进行血液或血浆采样来确定关注的参数,并且可以在进行体外血液或血浆治疗或处理期间连续且有效地进行。
另一个目的是开发一种设备和方法,用于在例如血液透析处理期间准确估计血液浓度和渗透压(具体由ΔRVB和Na
本发明的实施例的目的还允许适当地确定一个或多个血液参数而不损害治疗处方,并且特别地,不需要在透析液回路或血液回路中引入扰动。
另外,目的在于,提供不需要高计算能力并且不需要复杂的数学模型的就可以实现的过程和设备。
另一个辅助目的是一种能够以安全方式运行的设备。
另一个辅助目的是一种设备和过程,其允许基于一个或多个血液或血浆参数的确定,来计算指示处理效果的参数,例如透析率和/或透析剂量。
发明内容
通过根据所附权利要求中的一项或多项的设备和/或传感器和/或过程基本上达到了以上目的中的至少一个。
下面描述根据本发明的各方面并且能够实现一个或多个以上目的的设备和方法。
第一方面涉及一种非侵入式传感器(50),特别是一种血容量传感器,用于确定在体外血液处理设备的体外段(61)(例如,管段)中流动的血液的至少一个属性参数和/或至少一个(辅助)参数,该非侵入式传感器包括:
-至少一个源(53),用于将信号沿着发射轴(54)导向血液;
-多个检测器(57),用于在所述源(53)发出的信号至少部分地通过段(61)中流动的血液之后接收所述信号,并发出与所接收的信号相关的相应的输出信号;
-控制器(65),其被配置为从多个检测器(57)接收相应的输出信号,并且用于基于输出信号确定血液的所述属性和/或参数的值,特别是其中,所述血液属性是血容量变化或血红蛋白浓度或与血容量变化或血红蛋白浓度直接相关的参数。
在以下各方面中,以非限制性方式将体外段(61)称为管段。每次提及管段时,都旨在也替代性地提及体外段,并且体外段可以用更限制性的术语代替。
在根据第一方面的第二方面中,控制器(65)还被配置为确定(辅助)血液参数的值,所述辅助参数选自由以下各项构成的组:血浆电导率(σ
在根据前述方面中的任一方面的第三方面中,控制器(65)还被配置为基于来自多个检测器(57)的输出信号来确定血液属性的值。
在根据前述方面中的任一方面的第四方面中,控制器(65)被配置为基于输出信号来确定所述辅助血液参数的时间变化。
在根据前述方面中的任一方面的第五方面中,控制器(65)被配置为基于输出信号来确定所述血液的属性的时间变化。
在根据前述方面中的任一方面的第六方面中,控制器(65)被配置为接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的钠浓度(Na
在根据前述方面中的任一方面的第七方面中,控制器(65)被配置为接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的钠浓度(Na
在根据前述方面中的任一方面的第八方面中,控制器(65)被配置为接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的电导率(σ
在根据前述方面中的任一方面的第九方面中,控制器(65)被配置为接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的电导率(σ
在根据前述两个方面的第十方面中,控制器(65)被配置为接收入口透析液电导率(σ
在根据前述方面8或9的第十一方面中,控制器(65)被配置为接收入口透析液电导率(σ
在根据前述方面6或7的第十二方面中,控制器(65)被配置为接收入口透析液的钠浓度(Na
在根据前述方面6或7的第十三方面中,控制器(65)被配置为接收入口透析液的钠浓度(Na
在根据前述方面中的任一方面的第十四方面中,控制器(65)被配置为接收在体外血液处理设备(1)的废弃透析液管线(13)中流动的出口透析液的电导率(σ
在根据前述方面中的任一方面的第十五方面中,控制器(65)被配置为接收在体外血液处理设备(1)的废弃透析液管线(13)中流动的出口透析液的电导率(σ
在根据前述方面14或15的第十六方面中,控制器(65)被配置为接收出口透析液电导率(σ
在根据前述方面中的任一方面的第十七方面中,控制器(65)被配置为使用状态空间数学模型来确定所述血液属性和/或所述辅助血液参数,其中,状态空间数学模型包括以下方程:
其中,
在根据前述方面的第十八方面中,弥散时间(τ
其中,
在根据前述两个方面中的任一方面的第十九方面中,弥散时间(τ
在根据前述方面中的任一方面的第二十方面中,控制器(65)被配置为基于来自多个检测器(57)的输出信号使用数学方程来确定所述血液属性和辅助血液参数两者,该数学方程线性地组合血液属性、辅助血液参数和输出信号的值。
在根据前述方面中的任一方面的第二十一方面中,控制器(65)被配置为基于来自多个检测器(57)的输出信号使用以下数学方程来确定所述血液属性和辅助血液参数两者:
ΔRP
其中,
在根据前述方面中的任一方面的第二十二方面中,控制器(65)被配置为使用状态空间数学模型来确定所述血液属性和/或所述辅助血液参数,其中,在入口透析液不进入过滤单元而是旁路过滤单元的体外血液处理设备的旁路状况下,状态空间数学模型包括以下方程:
其中,
在根据前述方面中的任一方面的第二十三方面中,控制器(65)被配置为还基于出口透析液电导率(σ
在根据前述方面中的任一方面的第二十四方面中,控制器(65)被配置为还基于以下数学关系来确定辅助血液参数:
σ
其中,
在根据前述方面的第二十五方面中,加权系数(G
其中,
在根据前述两个方面中的任一方面的第二十六方面中,所述加权系数(G
在根据前述三个方面中的任一方面的第二十七方面中,用于说明入口透析液成分经过液压回路的传播时间变化的延迟时间(τ
在根据前述方面中的任一方面的第二十八方面中,控制器(65)被配置为还基于血浆电导率(σ
在根据前述方面中任一方面的第二十九方面中,控制器(65)被配置为还基于以下数学关系来确定辅助血液参数:
σ
其中,
在根据前述方面中的任一方面的第三十方面中,控制器(65)被配置为使用卡尔曼滤波器来确定所述血液属性和/或所述辅助血液参数。
在根据前述方面中的任一方面的第三十一方面中,控制器(65)被配置为使用卡尔曼滤波器来确定所述血液属性和/或所述辅助血液参数,该卡尔曼滤波器包括基于以下方程的预测步骤:
其中,
方程(14)和(15)给出为通用时间步长k(例如,1秒)的函数;
u
x
Q是描述过程噪声协方差的[2x2]的矩阵。
A是函数f(·,·)关于相对血容量变化(ΔRBV)和血浆钠浓度(Na
P
在根据前述方面的第三十二方面中,初始向量x
在根据前述两个方面中的任一方面的第三十三方面中,初始对角矩阵P
在根据前述三个方面中的任一方面的第34方面中,函数f(·,·)由在处理模式下根据方面17的方程的离散化版本限定。
在根据前述四个方面的第三十五方面中,函数f(·,·)由在旁通模式下根据方面22的方程的离散化版本限定。
在根据前述方面中的任一方面的第三十六方面中,在处理模式下根据方面17的方程的离散化版本如下:
ΔRBV[k]=ΔRBV[k-1] (19)
其中,使用正向欧拉离散化方法。
在根据前述方面31至35中任一项的第三十七方面中,卡尔曼滤波器包括基于以下方程的基于测量的校正步骤:
其中
E
R是[5x5]的协方差对角矩阵,特别是与光学测量相关联的R的对角值被
设置为等于方程(9)的均方根拟合残差:
其中
与出口透析电导率(σ
Z
g(x
σ
σ
其中
H是函数g(·,·)关于相对血容量变化(ΔRBV)和血浆钠浓度(Na
在第三十八方面中,提供了一种非侵入式传感器(50),特别是血容量传感器,用于确定在体外血液处理设备的体外段(61)(例如,管段)中流动的血液的至少一个血液属性参数和/或至少一个辅助血液参数,包括:
-至少一个源(53),用于将信号沿着发射轴(54)导向血液;
-多个检测器(57),用于在所述源(53)发出的信号至少部分地通过段(61)中流动的血液之后接收由所述信号,并发出与所接收的信号相关的相应的输出信号。
在根据前述方面中的任一方面的第三十九方面中,至少一个检测器,特别是所有检测器,包括光电二极管接收器。
在根据前述方面中的任一方面的第四十方面中,该源包括电磁辐射源或超声源。
在根据前述方面中的任一方面的第四十一方面中,该源包括光源,特别是LED源。
在根据前述方面中的任一方面的第四十二方面中,该源包括多波长LED发射器,该多波长LED发射器包括在同一芯片的多个LED(例如,5个LED),拾取波长在红色和红外波段。
在根据前述方面中的任一方面的第四十三方面中,该源的照明峰值波长包括在790nm与820nm之间,特别是在800nm与810nm之间。
在根据前述方面中的任一方面的第四十四方面中,该源包括光纤,该光纤的一端与信号发射器耦合,另一端被放置成将发出的信号沿着发射轴朝向血液引导。
在根据前述方面中的任一方面的第四十五方面中,所述检测器相对于发射轴以不同的角度放置。
在根据前述方面中的任一方面的第四十六方面中,在源发出的信号通过在管段中流动的血液被透射和/或反射和/或散射之后,所述检测器基本上同时接收由源发出的同一信号。
在根据前述方面中的任一方面的第四十七方面中,所述检测器根据其相应位置收集反射信号、散射信号和/或透射信号。
在根据前述方面中的任一方面的第四十八方面中,所述检测器根据其相应位置收集电磁辐射、散射的电磁辐射和/或透射的电磁辐射。
在根据前述方面中的任一方面的第四十九方面中,至少一个检测器相对于源的发射轴以约180度放置和/或至少另一个检测器相对于源的发射轴以约45度放置。
在根据前述方面中的任一方面的第五十方面中,至少一个检测器相对于源的发射轴以约90度放置和/或至少另一个检测器相对于源的发射轴以约0度放置。
在根据前述方面中的任一方面的第五十一方面中,传感器包括四个不同的检测器,用于接收来自源的电磁辐射,第一检测器相对于源的发射轴以约180度放置,第二检测器相对于源的发射轴以约90度放置,第三检测器相对于源的发射轴以约45度放置,第四检测器相对于源的发射轴以约0度放置。
在根据前述方面中的任一方面的第五十二方面中,检测器被配置为接收由源发出的信号,该信号径向地沿体外血液处理设备的管中的血液流的法截面。
在根据前述方面中的任一方面的第五十三方面中,传感器还包括壳体,该壳体的一部分与体外血液处理设备的管基本上形状匹配,每个检测器包括放置在形状匹配部分处的相应的端部,其在壳体与管的耦接状态下面向管,特别是信号发射器包括放置在形状匹配部分处的相应的端部,其在壳体与管的耦接状态下面向管。
在根据前述方面中的任一方面的第五十四方面中,传感器还包括由限定贯通通道的两个或更多个组件制成的壳体,该壳体,该壳体被配置为耦接到体外血液处理设备的管,特别是在贯通通道内完全容纳管段。
在根据前述方面的第五十五方面中,贯穿通道与要流动血液的体外血液处理设备的管段的外部形状形状匹配。
在根据前述三个方面中的任一方面的第五十六方面中,壳体被配置为与管段的外表面紧密耦接。
在根据前述四个方面中的任一方面的第五十七方面中,该源包括光纤,该光纤的一端与信号发射器耦接,另一端固定至壳体,该壳体的一部分与体外血液处理设备的管形状匹配,该光纤的另一端在壳体与管的耦接状态下被放置在形状匹配部分处并面向管。
在根据前述方面中的任一方面的第五十八方面中,至少一个检测器,特别是所有检测器,包括光纤,该光纤的一端与管相对应地放置,另一端耦合至接收器(详细地,光电二极管接收器)。
在根据前述方面的第五十九方面中,与管相对应的光纤的端部固定到壳体,该壳体的一部分与体外血液处理设备的管基本上形状匹配,该光纤的端部在壳体与管段的耦合状态下被放置在形状匹配部分处并面向管。
在根据前述两个方面中的任一方面的第六十方面中,传感器包括具有用于跨阻放大的电路的印刷电路板,其中,检测器包括连接到印刷电路板的相应的光电二极管接收器,用于跨阻放大的电路是电流-电压转换器并放大检测器的电流输出。
在根据前述方面的第六十一方面中,印刷电路板包括低通滤波器,用于对离开用于跨阻放大的电路的信号进行滤波,特别地,低通滤波器的截止频率约为30Hz。
在根据前述两个方面中的任一方面的第六十二方面中,传感器包括用于防止电磁干扰的屏蔽壳,该屏蔽壳至少包围具有用于跨阻放大的电路和低通滤波的印刷电路板。
在第六十三方面中,提供了一种用于体外血液处理的设备,该设备包括:
-以下这种类型的体外血液回路(60)的支架(71、7、73):该体外血液回路(60)包括处理单元(2)、连接到处理单元(2)的入口的抽取管线(6)和连接至同一处理单元(2)的出口的返回管线(7),该体外血液回路(60)包括体外段(61),例如管段;
-控制单元(10),用于驱动体外血液处理设备;以及
-根据前述方面中任一方面的至少一个非侵入式传感器(50)。
-在根据前述方面的第六十四方面中,非侵入式传感器(50)的控制器(65)是控制单元(10)的一部分。
在根据前述方面63的第六十五方面中,非侵入式传感器(50)的控制器(65)与控制单元(10)分开。
在根据前述设备方面中任一方面的第六十六方面中,该设备包括体外血液回路(60),其安装在所述支架(71、72、73)上,并且所述管段(61)由所述传感器(50)接纳,其中,所述管段(61)是血液抽取管线或血液返回管线的管状段(61),并且其中,当传感器(50)处于操作状态时,该传感器被配置为围绕体外血液回路的所述段(61)的外表面并与之接触。
在根据前述设备方面中任一方面的第六十七方面中,传感器(50)的壳体(51)包括:
-第一壳体部分(51a),其带有相应的检测器端,以及
-第二壳体部分(51b);
其中,第一壳体部分(51a)和第二壳体部分(51b)在所述传感器(50)的加载状态和传感器50的操作状态之间是相对可移动的,在该加载状态中,壳体(51)处于打开状态并且所述管段(61)可以被插入壳体,而在该操作状态中,壳体形成与所述管段(61)的外表面的形状匹配的纵向座,以及
其中,与所述操作状态相对应,检测器的端部面向,特别地接触管段(61),该管段(61)朝向管段发展轴线被径向地引导;
可选地,其中,第一壳体部分(51a)可枢转地耦接到第二壳体部分(51b)。
在根据前述设备方面中任一方面的第被配置为六十八方面中,该设备包括:
-具有如下类型的所述处理单元(2)的体外回路(60),所述处理单元(2)具有将同一处理单元(2)的辅助腔室(4)与主腔室分隔开半渗透膜(5);
-制备管线(19),其一端被配置为连接至所述处理单元(2)的辅助腔室(4)的入口;
-废弃透析液管线(13),其一端被配置为连接到所述辅助腔室(4)的出口;
其中,控制单元(10)被配置为命令执行以下步骤:
·使患者的血液在体外血液回路中以血液流速(Q
·使新鲜处理液在制备管线(19)中以流速(Qd
·使用过的处理液在废弃透析液管线(13)中以流速(Qd
·接收与在制备管线(19)中流动的新鲜处理液的物质的电导率(σ
·接收与在废弃透析液管线(13)中流动的用过的处理液中所述物质的电导率(σ
·根据以下各项计算指示体外血液处理的有效性的至少一个参数值(D,K·t):
·与用过的处理液中所述物质的的电导率(σ
·新鲜处理液的所述物质的电导率(σ
·流过体外血液回路的所述段(61)的血液中所述物质的电导率(σ
·以下中的至少一个:新鲜处理液的所述流速(Qd
在根据前述设备方面中任一方面的第六十九方面中,该设备包括:
-具有如下类型所述处理单元(2)的体外回路(60),所述处理单元(2)具有将同一处理单元(2)的辅助腔室(4)与主腔室分隔开半渗透膜(5);
-制备管线(19),其一端被配置为连接至所述处理单元(2)的辅助腔室(4)的入口;
-废弃透析液管线(13),其一端被配置为连接到所述辅助腔室(4)的出口;
其中,该设备包括至少两个所述非侵入式传感器(50),使得血液抽取管线的第一管段(61)被所述两个传感器(50)中的第一个的壳体(51)接收,血液返回管线的第二管段(61)被所述两个传感器中的第二个的壳体(51)接收,
并且其中,该控制单元连接到每个传感器(50),并被配置为:
·使患者的血液在体外血液回路中以血液流速(Q
·使新鲜处理液在制备管线(19)中以流速(Qd
·使用过的处理液在废弃透析液管线(13)中以流速(Qd
·接收与在制备管线(19)中流动的新鲜处理液的物质的电导率(σ
·使患者血液以血液流速(Qb)进入体外血液循环,
·接收或计算在所述第一段(61)内流动的血液中所述物质的电导率(σ
·根据以下各项计算指示体外血液处理的有效性的至少一个参数值(D,K·t):
·新鲜处理液的所述物质的电导率(σ
·在所述第一段(61)内流动的血液中所述物质的电导率(σ
·所述血液流速(Q
在根据前述两个方面中任一方面的第七十方面中,
·使新鲜处理液在制备管线(19)中流动的步骤包括以下子步骤:维持新鲜处理液中的物质的浓度(Na
其中,至少在所述时间间隔(T)期间,控制单元被配置为使以下各项保持恒定:制备管线(19)中的新鲜处理液的流速(Qd
在根据前述三个方面中的任一方面的第七十一方面中,指示体外血液处理的有效性的参数(D,K·t)是使用以下公式之一计算的所述物质的透析率(D):
或
或
或
其中,
在根据前述设备方面中任一方面的第七十二方面中,该设备包括在线流体制备部分(100),其可连接至体外血液回路(60)并且被配置为制备预充液。
在根据前述设备方面中任一方面的第七十三方面中,该设备包括所述处理单元(2),其中:
-制备管线(19)的一端连接到处理单元(2)的辅助腔室(4)的入口,
-废弃透析液管线(13)的一端连接到所述辅助腔室(4)的出口,
-血液抽取管线(6)连接在主腔室(3)的入口处,以及
-血液返回管线(7)连接在主腔室(3)的出口处。
在第七十四方面中,提供了一种用于确定在体外血液处理设备的体外段(61)(例如,管段)中流动的血液的至少一个血液属性和/或血液辅助参数的过程,其中非侵入式传感器(50),特别是血容量传感器,包括:
-至少一个源(53),用于将信号沿着发射轴(54)导向血液。
-多个检测器(57),用于在所述源(53)发出的信号至少部分地通过在段(61)中流动的血液之后接收所述信号,并发出与所接收的信号相关的相应的输出信号,
该过程包括:
·接收来自多个检测器(57)的相应输出信号;以及
·根据输出信号确定所述血液属性的值,
特别地,其中,所述血液属性包括血容量变化或血红蛋白浓度或与血容量变化或血红蛋白浓度直接相关的参数。
在根据前述方面的第75方面中,该过程包括确定辅助血液参数的值,所述辅助参数是血浆电导率(σ
在根据前述过程方面中的任一方面的第七十六方面中,该过程包括基于来自多个检测器(57)的输出信号来确定血液属性的值。
在根据前述过程方面中任一方面的第七十七方面中,该过程包括基于输出信号来确定所述辅助血液参数的时间变化。
在根据前述过程方面中的任一方面的第七十八方面中,该过程包括基于输出信号来确定所述血液的属性的时间变化。
在根据前述过程方面中的任一方面的第七十九方面中,该过程包括:接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的钠浓度(Na
在根据前述过程方面中任一方面的第八十方面中,该过程包括:接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的钠浓度(Na
在根据前述过程方面中的任一方面的第八十一方面中,该过程包括:接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的电导率(σ
在根据前述过程方面中的任一方面的第八十二方面中,该过程包括:接收在体外血液处理设备(1)的制备管线(19)中流动的入口透析液的电导率(σ
在根据前述过程方面中的任一方面的第八十三方面中,该过程包括:接收在体外血液处理设备(1)的废弃透析液管线(13)中流动的出口透析液的电导率(σ
在根据前述过程方面中的任一方面的第八十四方面中,该过程包括:接收在体外血液处理设备(1)的废弃透析液管线(13)中流动的出口透析液的电导率(σ
在根据前述过程方面中的任一方面的第八十五方面中,该过程包括:
其中,
在根据前述过程方面中的任一方面的第八十六方面中,该过程包括:使用数学方程基于来自多个检测器(57)的输出信号来确定所述血液属性和辅助血液参数两者,该数学方程线性地组合血液属性、辅助血液参数和输出信号的值。
在根据前述过程方面中的任一方面的第87方面中,该过程包括使用以下数学方程基于来自多个检测器(57)的输出信号来确定所述血液属性和辅助血液参数两者:
ΔRP
其中,
在根据前述过程方面中的任一方面的第八十八方面中,该过程包括使用状态空间数学模型来确定所述血液属性和/或所述辅助血液参数,其中,在没有将入口透析液引导进入过滤单元而是旁路过滤单元的体外血液处理设备中的旁路条件下,状态空间数学模型包括以下方程:
其中,
在根据前述过程方面中的任一方面的第八十九方面中,该过程包括:还基于出口透析液电导率(σ
在根据前述过程方面中的任一方面的第九十方面中,该过程包括还基于以下数学关系来确定辅助血液参数:
σ
其中,
在根据前述过程方面中的任一方面的第九十一方面中,该过程包括还基于血浆电导率(σ
在根据前述过程方面中的任一方面的第92方面中,所述过程包括还基于以下数学关系来确定辅助血液参数:
σ
其中,
在根据前述过程方面中任一方面的第九十三方面中,所述过程包括使用卡尔曼滤波器来确定所述血液属性和/或所述辅助血液参数。
词汇表
在以下对体外血液处理设备的详细工作的描述中提供的所有方程中,始终使用以下术语。
附图说明
在附图中示出了本发明的各方面,这些附图以非限制性示例的方式提供,其中:
图1示出了根据本发明的一方面的血液处理设备的示意图;
图2示出了根据本发明的另一方面的血液处理设备的替代实施例的示意图;
图3是根据本发明的一个实施例的测量系统的示意图;
图3a示出了用于接收其中流动有血液的管段的壳体的示意性透视图;
图3b是测量系统的另一方案,用于揭示电路的某些组件;
图4是实验设备的示意图;
图5是过滤单元上游入口透析液Na
图6是具有血液和透析液进入/排放端口的血液透析仪的示意图,其中,电导率单元测量入口透析液电导率(σ
图7是用于计算参考信号的血池模型的示意图;
图8示出了输入信号、状态变量和输出信号之间的关系,虚线表示在旁路模式下不可靠的连接;
图9表示用于旁路状态管理的不同过滤器版本之间的过渡;
图10a至10f示出了状态估计结果的示例,其中,图10a、10b和10c示出了针对三个不同实验过程的ΔRBV估计,而图10d、10e和10f示出了针对对应的实验的Na
图11示出了图1或图2的设备的机柜结构的示意性前视图;
图12示出了在多个角度下测量的光强度,将其归一化为处理开始时的值;
图13示出了在归一化的45°通道处测得的光强度;该信号已经进行了过趋势处理(de-trend procedure),以消除由于RBV影响而产生的缓慢漂移;以及
图14是示出确定体外血液的属性和辅助参数的过程的主要步骤的流程图。
具体实施方式
在图1和图2中示出了用于血液体外处理的设备1的非限制性实施例,其可以实现本发明的创新方面。在以下说明及附图1和2中,相同的附图标记指示相同的组件。
设备1包括用于确定一个或多个血液或血浆参数的值的至少一个传感器50。
图1示出了被配置为实现诸如超滤、血液透析和血液透析滤过中的任何一种处理的设备1,而图2示出了被配置为实现血液透析或超滤处理的设备。
设备1包括:处理单元2(例如,血液过滤器、超滤器、血液透析过滤器、透析器、血浆过滤器等),其具有被半透膜5隔开的主腔室3和辅助腔室4。处理单元2的膜5可以依据处理而被选择为具有不同的属性和性能。
血液抽取管线6连接到主腔室3的入口,血液返回管线7连接到主腔室3的出口。血液抽取管线6、主腔室3和血液返回管线7是体外血液回路的一部分,该体外血液回路在图1和图2中以附图标记60整体标识。在使用时,血液抽取管线6和血液返回管线7连接到针头或导管或其它进入装置(未示出),然后这些进入装置被放置为与患者血管系统流体连通,以便可以抽取血液通过血液抽取管线、流经主腔室,然后通过血液返回管线返回患者的血管系统。空气分离器(例如,气泡收集器8)可以存在于血液返回管线上。体外血液回路由一个或多个支架支撑,这些支架由设备1的支撑框架70以传统方式提供。例如,如图11所示,体外血液回路60可以由支架71、支架72和支架73支撑,支架71支撑气泡收集器,支架72支撑处理单元2,支架73与血液泵相对应地定位。
由控制单元10控制的安全夹9可存在于气泡收集器8下游的血液返回管线上。可以存在气泡传感器8a,例如与气泡收集器8相关联或耦合至气泡收集器8和夹具9之间的管线7的一部分。如果存在气泡传感器,则气泡传感器连接到控制单元10,并在检测到超过特定安全阈值的一个或多个气泡的情况下,向控制单元发送控制单元的信号以使夹具9关闭。通过血液管线的血液流可以由血液泵11(例如,蠕动血液泵)控制,该血液泵11作用在血液抽取管线(如图1所示)或作用在血液返回管线上。操作者可以输入血液流速Qb的设定值:在处理期间,控制单元10被配置为基于设定的血液流速来控制血液泵。注意,控制单元10也可以连接到用户界面12(例如,图形用户界面),该用户界面12接收操作者的输入(例如,尤其是血液流速的设定值)并显示设备输出。例如,图形用户界面12可以包括用于显示输出和允许用户输入的触摸屏,或者用于输入用户输入的显示屏和硬键,或其组合。
被配置为排出来自辅助腔室4的污水的废弃透析液管线13的一端连接到辅助腔室4的出口,而另一端连接到废物,该废物可以是排泄管道或用于收集从辅助腔室提取的液体的污水容器14(图1和图2中的虚线)。污水泵17在控制单元10的控制下在废弃透析液管线13上运行,以调节通过废弃透析液管线的污水的流速Qd
图1的设备还包括流体制备管线19,该流体制备管线在一端处与进水口连接,在其另一端处与过滤单元的辅助腔室4的入口连接,用于向辅助腔室4供应新鲜处理液。透析液泵21在所述控制单元10的控制下在流体制备管线上工作,以将来自新鲜处理液源(例如,容器或用于在线制备新鲜透析液的部分100)的流体以流速Qd
在图1和图2的示例中,管线19将血液透析仪或血液透析过滤器2链接到用于制备透析液的在线制备部100。在线制备部100包括主管线101,该主管线101的上游端被设计为连接到水源。第一辅助管线102和第二辅助管线103连接到主管线101,并且被配置为至少供应必要量的缓冲剂和必要量的电解质。可以环回到主管线101上的第一辅助管线102被配置为装配包含缓冲剂的第一容器104(例如,袋子或筒或其它容器)。管线102还配备有第一计量泵105,用于将缓冲液计量加入新鲜处理液中:如图1所示,该泵可以位于第一容器104的下游。泵105的操作可以由控制单元10基于以下量之间的比较来控制:1)在主管线101和第一辅助管线102的接合处形成的溶液的缓冲液浓度的设定点值,和2)该混合的缓冲液浓度的值,其通过第一探针106测量,该第一探针106位于第一容器104下游的第一辅助管线中或紧接在主管线101和第一辅助管线102之间的接合点下游的主管线101中。此外,第二辅助管线103的自由端旨在从第二容器107接收流体,该第二容器107容纳有浓缩的盐溶液,例如电解质,例如氯化钠、氯化钙、氯化镁和氯化钾。在变型中,第二辅助管线103也可以环回到主管线101上。此外,在人们希望从相应的容器中馈送分开的电解质或电解质成分的情况下,可以设想多个独立的第二辅助管线103。注意,第二辅助管线103配备有第二计量泵108,用于将电解质计量加入到新鲜处理液中;第二计量泵的操作取决于以下两者之间的比较:1)在主管线101与第二辅助管线103的接合处形成的溶液的电导率设定值或电解质浓度设定值,以及2)通过第二探针109测量的该溶液的电导率或电解质浓度的值,该第二探针109位于第二容器107下游的第二辅助管线中或紧接在主管线101和辅助管线103之间的接合处下游的主管线101中。注意,容纳在容器104和107中的浓缩物的具体性质可以根据情况和要制备的新鲜处理液的类型而变化。此外,第一探针和第二探针的性质和位置可以取决于使用的缓冲液的类型、采用的电解质浓缩物的类型以及由主管线和辅助管线形成的电路的特定配置。此外,如已经提到的,在需要添加多个不同类型的物质以制备新鲜处理液的情况下,可以存在具有相应的浓缩物容器和相应的计量泵的多于两个的辅助管线。
第二探针通常是电导率计,其被配置为测量过滤单元2上游的透析液电导率σ
图2的实施例示出了替代设备1,其被设计用于实现诸如血液透析和超滤的任何一种处理。在图2所示的设备中,针对图1的实施例描述的相同组件由相同的附图标记标识,因此不再赘述。实际上,与图1的血液透析滤过设备不同,图2的设备不存在任何输注管线。
在上述实施例的每一个中,流量传感器110、111(体积或质量类型的流量传感器)可用于测量每条管线中的流速。流量传感器连接到控制单元10。在图1的示例中,其中输注管线15和超滤管线25分别通往容器或袋16、23,可以使用天平检测输送或收集的流体量。例如,图1的设备包括:第一天平33,其用于提供关于超滤容器23中收集的流体量的重量信息W
在图1和图2的示例中,为了控制供应到辅助腔室4的流体量与从辅助腔室中提取的流体量之间的流体平衡,位于新鲜透析液管线和废弃透析液管线13上的流量传感器110、111向控制单元10提供指示通过相应的管线的流体的流量的信号,并且天平提供重量信息,该重量信息允许控制单元导出通过超滤管线25和通过输注管线15(如果存在的话)的流速。控制单元被配置为至少控制泵17、21和27(在图3的情况下还包括泵18),以确保在(如经由例如用户界面12提供给控制单元的处方所要求的)规定的处理时间的过程中实现预定的患者流体去除。请注意,可以使用其它流体平衡系统:例如,在该设备包括作为新鲜处理液的源的容器和收集废物的容器的情况下,天平可以用来检测由每个容器输送或收集的流体的量,然后相应地通知控制单元。作为另外的备选,可以使用基于体积控制的系统,其中,制备管线19和废弃透析液管线13连接到平衡腔室系统,以确保在每个时刻流入管线19的液体量与从管线13离开的液体量相同。
从结构的角度来看,一个或多个容器104、107、16、23可以是一次性塑料容器。血液管线6、7管线和过滤单元也可以是一次性塑料组件,其可以在处理期开始时安装,然后在处理期结束时丢弃。泵(例如,蠕动泵或容积泵(positive displacement pump))已被描述为调节通过每条管线的流体流量的装置。然而,应当注意,可以替代地采用其它流量调节装置,例如阀或阀和泵的组合。天平可以包括压电传感器、应变仪或弹簧传感器,或能够感测施加在其上的力的任何其它类型的换能器。
测量系统
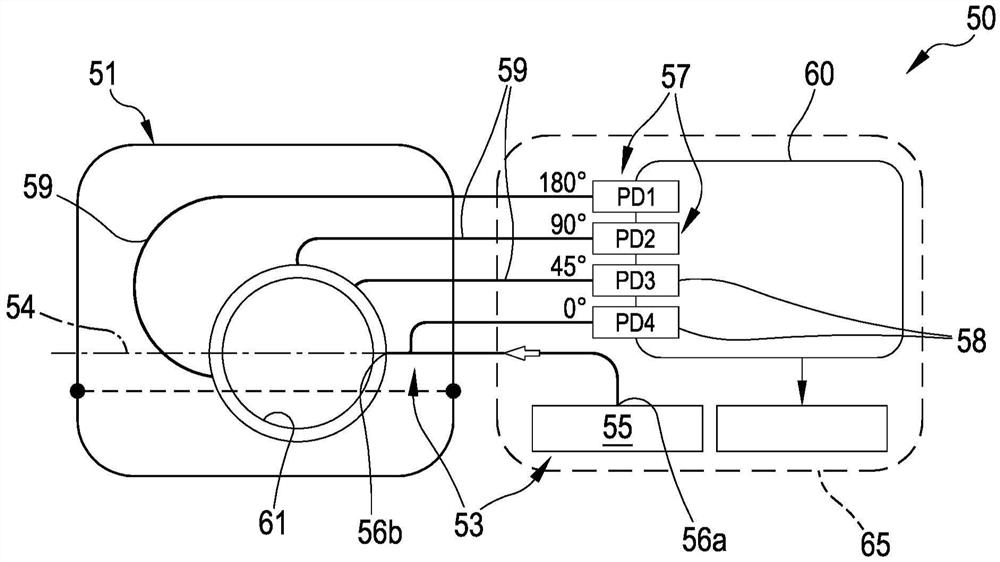
根据本发明的一方面,设备1包括至少一个血液或血浆参数传感器50,其被配置为与体外血液回路60的至少一个段61相对应地定位。
传感器50是非侵入式传感器,即,它不与在体外血液回路60内流动的血液接触,并且具体地,其被施加在体外血液处理设备的段的外部。在下文中,以非限制性的方式,体外血液处理设备的段是指管段。从结构的视角来看,传感器50包括仅在附图中示意性表示的塑料壳体51。壳体51被设计成紧密地耦合到需要测量血液或血浆参数的体外血液回路60的血液管线段61。壳体51可以是独立的主体,或者可以被附接到设备1的支撑框架70或成为其一部分。例如,图11示意性地示出了壳体51被附接到支撑框架70的前面板并且被配置为接纳体外血液回路的至少一个(在附图的示例中为一个)段61。
为此目的,壳体51可以直接与血液管线的管的一部分(即与血液抽取管线6或血液返回管线7的柔性透明塑料管的圆形横截面段)形状匹配(counter-shaped)。壳体可以是打开和关闭的壳体,其限定了旨在接收血液回路的管的内部贯通通道52。
值得注意的是,壳体51可以由两个或更多个部分51a,51b制成,这些部分可以是分开的或接合(例如,铰接)在一起以限定非耦接构造(见图3a)和耦接构造(见图3)。在耦接构造中,贯通通道52与要接纳的管形状匹配,以便与之完美地耦接并接纳该管。
示意图示出了柔性血液管耦接到传感器50的情况。然而,可替代地,壳体51可成形为与刚性比色皿(例如,用于甘布罗伦迪亚股份公司的
清楚的是,在将壳体应用于体外血液回路60的圆形柔性管的情况下,传感器沿血液抽取管线6或血液返回管线7的任何位置都是合适的。在传感器50具有与特定比色皿形状匹配的贯通通道的情况下,则传感器应当应用于与比色皿本身相对应的位置,以正常工作。
壳体51可以由防止外部环境光到达接收器的高吸光材料制成。
传感器50包括至少一个信号源53,用于将信号沿着发射轴54导向血液。
信号源53可以包括任何合适的信号发射器(例如光学或声发射器),其将适当的发出信号导向其中流动血液的管的内部。
在本发明的实施例中,信号源53包括电磁辐射源,特别是诸如有机发光二极管(LED)光源的光源。
在下面的描述中,我们指的是光学发射器,更详细地说,是指LED发射器55。然而,这不应解释为限制性的。
信号源的峰值波长通常被设置为800-810nm,对应于血红蛋白(Hgb)吸收光谱中吸收不依赖于氧化作用的点。同样,这不应被视为限制方面。
信号源53的具体实现包括用于发光的多波长LED发射器(即,美国纽约马克泰克公司生产的MTMD6788594SMT6)。特别地,发射器55包括在同一芯片上的5个LED,其峰值波长在红色/红外波段中。源53还包括光纤56,光纤56的一端56a与信号发射器55耦合,而另一端56b固定在壳体51上,并被放置成沿发射轴54将光信号导向血液。如图3所示,发射器光纤56的第二端56b放置在形状匹配部分处并且在壳体与管段61的耦合的状态下面向管。
传感器50包括多个检测器57,多个检测器57用于接收由所述源发出的、至少部分地通过血液之后的信号,特别地,检测器57根据其相应位置收集反射的信号、散射的信号和/或透射的信号。由于发射器55是LED发射器,所以检测器57包括光电二极管接收器58。
在有利的实施例中,光检测器57相对于发射轴54以不同的角度放置。更详细地,图3的传感器50包括四个不同的检测器57,用于接收来自信号源53的电磁辐射,其中,一个第一光电二极管接收器PD1相对于信号源的发射轴54放置在约180°处,一个第二光电二极管接收器PD2相对于信号源的发射轴放置在约90°处,一个第三光电二极管接收器PD3相对于信号源的发射轴放置在约45°处,一个第四光电二极管接收器PD4相对于信号源的发射轴放置在约0°处。当然,根据特定需要,可以使用多于(或少于)4个接收器,并且也可以将不止一个接收器放置在相对于发射轴54的相同角度处。
每个检测器57被配置为接收由信号源发出的并且沿体外血液处理设备的管中的血液流的法截面径向(充分反射、散射或透射)的信号。新的测量系统扩展了传统设计的体系结构以收集相对于发射器处于不同几何角度的光,从而允许在反射光、散射光和透射光之间进行区分。如果散射光同时由不同的接收器接收到,则由于散射增加而导致的透射光的损失不会错误地被检测为吸光度增加。
为了实现以上配置,每个检测器57包括相应的光纤59,其一端与管段61相对应地放置,另一端耦合到接收器(详细地是光电二极管接收器)。更详细地,光纤59与管相对应的端部固定至壳体51,并且放置在形状匹配部分处并且在壳体与管段的耦接状态下面向管。
如上所述,除了反射通道(0度)之外,用于接收信号的所有通道都沿血液流的法截面径向地放置,反射通道(0度)沿流动方向略微地偏移以允许放置发射光纤56。发出的光和收集的光使用例如塑料光纤(三菱丽阳生产的ESKA GH4001)耦合到血统和从血统耦合。
光电二极管接收器58可以具有特定的光纤耦合机制(例如,美国坦佩的工业光纤公司生产的IFD91),用于光收集通道,对应于图3中的PD1-PD4。
光电二极管接收器58与用于跨阻放大的模拟电路62一起被容纳在印刷电路板60上。用于跨阻放大的电路62包括电流-电压转换器(例如,使用运算放大器实现)。电路62可用于放大光电二极管接收器58的电流输出。电流-电压转换器与光电二极管一起使用,该光电二极管的电流响应比电压响应更线性(电流响应通常在宽范围的光输入上具有优于1%的线性度)。跨阻放大器向光电二极管提供低阻抗,并将其与运算放大器的输出电压隔离。跨阻放大器有几种不同的配置,它们共有的一个因素是需要将传感器的低电平电流转换为电压。
印刷电路板60还包括低通滤波级63和增益级放大。低通滤波器63的截止频率被设置为例如30赫兹。基于初步测试和校准,增益被设置为特定于通道的值。然后,模拟信号被合适的(ADC)转换器64转换为数字信号。更详细地,使用(意大利米兰的意大利国家仪器公司生产的)NI USB-6008DAQ卡利用12位分辨率以100Hz的速率对模拟输出进行采样,并由定制的LabView虚拟仪器进行记录。
多LED发射器、信号调节板和DAQ卡一起组装在3D打印的壳体上,并放置在用于电磁屏蔽的接地金属盒内(参见图3),并设置有用于光纤56、59、数据连接和电源的开口。
从以下详细描述中显然地,数字信号被输入到控制器65,用于检测在体外血液处理设备的管段61中流动的血液的一个或多个参数。
建模与估计
使用非侵入式传感器确定相关血液或血浆参数的一般物理原理与以下事实有关:渗透压变化会改变血红细胞的形状,因此其光学属性也会相应改变。渗透压是溶质浓度的量度,被限定为每升溶液中溶质的渗透压克分子的数量。如前所述,钠是透析液和血浆中浓度最高的溶质,因此是渗透压的主要驱动因素。
因此,申请人已经理解到,在血容量变化估计的过程中从(例如,光)检测器测量的(例如,光)响应信号受红细胞浓度和渗透压(并且因此主要受血液/血浆钠含量)的影响。
此外,申请人还出乎意料地发现,相对于体外血液流动的管段以不同角度放置的若干检测器对于组合的血细胞比容(HCT)/血容量变化(ΔRBV)和渗透压(OSM)/钠含量(Na
ΔRBV(t)=函数
Na
其中,I0标识来自检测器0的输出信号;I_N标识来自检测器N的输出信号。每个检测器都有自己的通道i(1至N)。
所述函数有许多可能的公式形式。例如,可能的公式是通道值的线性组合,通道值可能被升高到功率因数,以便每个通道或多或少地影响对应的参数,这取决于特定血液属性对以特定的角度位置捕获的信号的影响。
ΔRBV(t)=K0*(I0(t))^a0+K1*(I1(t))^a1+,....,+K_N*(I_N(t))^aN;
Na
更复杂的分类器或神经网络是另一种可能性。例如,可以训练神经网络,以便其接收来自以下各项作为输入:各种检测器的信号,以及(可能)与血容量变化和血浆钠浓度相关的其它输入变量,例如透析液回路中的电导率(上游和下游的过滤单元)和/或新鲜透析液中的钠浓度。神经网络提供所需血液参数的值作为输出,从而成功地将红细胞浓度和由于渗透压引起的形状变化的光学效应解耦。
显而易见的是,如果渗透压的影响可以被检测和解耦,则可以获得对血容量变化的更好的估计。同时,非常重要的是要注意,还可以得出对血浆钠浓度Na
换句话说,由于血液或血浆中的钠含量对渗透压具有主要影响,因此确定和消除此类影响允许适当地估计处理期间的血容量变化;另外,由于血浆钠浓度的影响是解耦的,因此这种参数的估计也是可行的。
结果表明,某些特定通道对特定参数最敏感,而其它通道的行为更像是属性(血细胞比容和渗透压)的混合。
图12示出了以不同角度测量的光强度,已将其归一化为处理开始时的值。中间有小段区域,在该区域中,记录被中断以允许修改设置。关于先前描述的传感器实现,该图包括来自以135度放置的附加的光电检测器的信号。然而,这里说明的总体构思并不取决于各种检测器的数量和位置。
图12表明0°通道(反射光,红线)主要取决于超滤和RBV变化。
图13示出了归一化的45°通道(散射光,蓝线)。该信号已进行去趋势处理,以消除由于RBV效应而引起的缓慢漂移。该过程不适用于实时算法,但线性组合方法可用于创建实时去趋势。如图所示,去趋势的45°通道能够检测透析液钠浓度变化引起的渗透压变化。第一阶响应主要是由于将血液钠浓度调整到透析液钠值所需的时间。
换句话说,以不同角度位置检测到的各种信号受血浆钠和相对血容量变化的影响不同。因此,通过适当的信号操纵,能够以实时且非侵入的方式更精确地确定所提及的两个血液参数。
用于建立允许确定所提及的血液参数(即,血容量变化量ΔRBV和血浆钠浓度Na
术语表提供了变量定义。
方程(1)限定了绝对血容量V
方程(2)限定了基于绝对血容量V
Na
状态空间建模与估计
选择状态空间方法来估计ΔRBV(t)和Na
血液透析机将Na
普通微分方程(6)和(7)对血池动力学(blood pool dynamics)进行建模,并且是通过从方程(3)和(4)中去除具有临床实践期间未知的参数的项(V
虽然方程(3)是更好的理论说明,但在临床常规中尚不知道V
方程(7)近似于方程(4):在处理期间临床上无法获得重填过程的参数,因此,仅通过采用弥散时间常数τ
ΔRP
可以为方程(8)中描述的ΔRP
σ
σ
最后一个输出元素(即,出口透析液电导率σ
在方程(12)中将血浆电导率σ
图8示出了输入信号、状态变量和输出信号之间的关系。出于安全原因或出于内部重新校准的目的,血液透析机会定期进入旁路模式。在旁路期间中,超滤被暂停并且透析液与血液透析器的液压连接被短路,参见图6(虚线),这意味着来自电导率单元的数据(σ
对Na
卡尔曼滤波基本上是如下算法:使用随时间观察的一系列测量结果(包含统计噪声和其它不准确性(例如,由于方程简化导致)),并通过估计每个时间范围(timeframe)内未知变量的联合概率分布生成这些变量的估计,这些估计往往比仅基于单个测量的那些估计更准确。该算法分两步过程进行。在预测步骤中,卡尔曼滤波器生成当前状态变量的估计及其不确定度。一旦观察到下一次测量的结果(必然有一定误差量的损坏,包含随机噪声),则使用加权平均值更新这些估计,其中,确定性高的估计被赋予更高的权重。该算法是递归的,并且可以仅使用当前输入测量结果和先前计算的状态及其不确定度矩阵来实时运行,不需要其它信息。
以下方程(14)至(18)限定了根据本实施例可以采用的卡尔曼滤波器的示例。
以上这些方程给出为通用时间步长k的函数。例如,可以选择1s的时间步长。方程(14)和(15)表示预测步骤,其中,采用了系统的建模知识,方程16至18表示基于测量的校正步骤。
输入u
在标准模式下,函数f(·,·)由方程(6)和(7)的离散化版本限定,而在旁路模式下,由离散化的方程(6)和(13)限定。方程(6)、(7)和(13)的离散化分别通过正向欧拉方法实现;离散化的方程分别为:
ΔRBV[k]=ΔRBV[k-1] (19)
Na
在旁路状态下,使用方程21代替方程20。[2x2]的矩阵Q描述了过程噪声协方差。矩阵A是f(·,·)关于ΔRBV和Na
标准Q
测量噪声的特征是[5x5]的协方差矩阵R,该矩阵被视为预定的对角矩阵。R的与光学测量相关联的对角线值被设置为等于方程(9)的均方根拟合残差。基于D与为方程(11)所考虑的平均值的实际偏差来选择R的与σ
观测向量Z
σ
在方程(23)中,k
σ
这是方程(12)的离散化版本。
来自方程(16)和(18)的矩阵H是关于ΔRBV和Na
矩阵P
考虑到P
简化的血池模型方程和卡尔曼滤波器方法的使用允许随时间确定和监测状态变量,即系统知道相对血容量变化ΔRBV和血浆钠浓度Na
根据上述方面,控制器65被配置为基于由检测器57接收的输出信号来计算流过体外血液回路60的所述段61的流体中存在的钠的浓度。例如,如果该段是血液抽取管线的一部分并且流体是血液,则控制器65可以连续地确定流过该血液抽取管线的血液中存在的钠的浓度,而如果该段是血液返回管线的一部分并且流体是血液,则控制单元或检测电路可以连续地计算流过血液返回管线的血液中存在的钠浓度。
可以(例如,由控制器65)计算体外回路中循环的血液的Na
此外,控制器65(或相应地设备控制单元10)可被配置为:基于对在管段中循环的血液的血浆钠浓度的测量(例如,基于体外血液处理期间血浆钠浓度的确定),确定指示体外血液处理的有效性的参数(D,K·t)的至少一个值。
详细地,控制器65可以被配置为命令执行以下步骤:
·一旦体外回路正确地安装在相应的支架上并连接到患者,则使患者的血液以(例如作用在血液泵11上的)血液流速Q
·使新鲜处理液在制备管线19中以流速(Qd
例如,这可以通过操作泵21来实现,并且在该设备包括制备部分100的情况下,该部分也适当地搭配有泵105和108;
·使用过的处理液以流速Qd
·接收与在制备管线19中流动的新鲜处理液的物质的电导率(σ
·接收与在废弃透析液管线13中流动的用过的处理液中所述物质的电导率(σ
·根据以下各项计算指示体外血液处理的有效性的至少一个参数值(D,K·t):
·与用过的处理液中所述物质的电导率(σ
·新鲜处理液的所述物质的电导率(σ
·流过体外血液回路60的所述段61的血液中所述物质的血浆电导率σ
·以下中的至少一个:新鲜处理液的所述流速Qd
可替代地,该设备可以包括至少两个上述电参数传感器50:这两个传感器50中的每一个将具有上述传感器50的特征,其中,血液抽取管线的第一管状段61容纳在所述两个传感器50中的第一个传感器的壳体主体中,血液返回管线的第二管状段61容纳在所述两个传感器50中的第二个传感器的壳体主体中。在该替代方案中,控制器65(连接至每个血液/血浆参数传感器50)可以被配置为:
·一旦体外回路已正确地安装在相应的支架上并连接到患者,则使患者的血液以(例如作用在血液泵11上的)血液流速Q
·使新鲜处理液在制备管线19中以流速Qd
·使用过的处理液在废弃透析液管线13中以流速Qd
·接收与在制备管线19中流动的新鲜处理液的物质的电导率(σ
·使用如刚才所述的安装在血液抽取管线和血液返回管线上的两个传感器50,来接收或计算在所述第一段(61)内流动的血液中所述物质的电导率(σ
·根据以下各项计算指示体外血液处理的有效性的至少一个参数值(D,K·t):
·新鲜处理液的所述物质的电导率(σ
·在所述第一段(61)内流动的血液中所述物质的电导率(σ
·所述血液流速(Q
注意,在知道血浆钠浓度Na
实际上,无需改变电导率来实现透析率或透析剂量的确定。
进一步详细地,指示体外血液处理有效性的参数是该物质的透析率D,其使用以下公式之一计算:
其中
一旦计算出透析率,就可以在时间上对透析率的瞬时值进行积分,以便实现以本身已知的方式来确定K·t的值,在此不再赘述。
本发明还涉及使用传感器50和/或设备来确定血液或血浆参数的过程,该传感器50和/或设备如以上公开的或如在所附权利要求中任一项所要求的用于血液的体外处理。图14示出了该过程的主要步骤,包括:朝向体外血液发送信号,以及借助于以不同角度位置放置在管段周围的接收器来接收反射信号、透射信号和/或散射信号。该过程包括:确定(如上所述)血液属性(例如,血容量变化ΔRBV)和/或辅助血液参数(例如,Na
控制单元
如已经指出的,根据本发明的设备利用控制单元10和传感器的至少一个控制器65。值得注意的是,传感器50的控制器65可以是体外血液处理设备的控制单元10的一部分(软件和/或硬件部分)或可以是单独的处理单元。
控制单元10和控制器65都可以包括具有存储器的数字处理器(CPU)、模拟电路或一个或多个模拟处理电路与一个或多个数字处理单元的组合。在本说明书和权利要求书中,表明控制单元/控制器被“配置”或“编程”为执行某些步骤:在实践中,这可以借助于允许对控制单元/控制器进行配置或编程的方式来实现。例如,在控制单元/控制器包括一个或多个CPU的情况下,一个或多个程序存储在适当的存储器中:程序包含指令,这些指令在由控制单元/控制器执行时使控制单元执行执行结合控制单元/控制器描述和/或要求保护的步骤。替代地,如果控制单元/控制器是模拟类型的,则控制单元/控制器的电路被设计为包括电路,该电路被配置为在使用时处理电信号以便执行本文公开的控制单元/控制器步骤。
实验过程
具有ΔRVB和/或Na
使用新鲜肝素化的牛血和
在临床血液透析期间,通过重填(液体从其它身体腔室转移到循环系统以维持生理血压的现象)部分地补偿患者的血液池的水分去除。在会话中,通过使用蠕动泵和新鲜透析液容器模拟重填,新鲜透析液的化学成分类似于血浆。请参见图4的设置的示意图。
通过将超滤速率设置为J
通过对入口透析液钠浓度Na
每个会话都由1小时的调整阶段和随后的3小时的实验阶段组成。调整阶段被设计为实现透析液和血液之间的平衡,以提高实验会话的可重复性,因为每新鲜体积的牛血可能带有不同的电解质的血浆浓度。在调整阶段期间,Na
在会话开始和结束时以及其间的每45分钟采集用于血气分析的样本(在图5中用黑点表示)。使用Stat Profile pHOx Ultra血气分析仪(Nova Biomedical,沃尔瑟姆,USA)来确定电解质浓度。在每个会话结束时,下载血液透析机的内部会话日志以访问内部传感器数据(超滤率J
对从光学测量系统记录的数据进行中值滤波以去除伪影(10样本窗口),然后进行移动平均平滑(5000样本窗口)。然后根据以下方程将来自3小时实验阶段的数据转换为相对光学功率变化:
其中,V
信号J
在整个会话中,出于安全原因或出于内部重新校准的目的,血液透析机会暂时切换到旁路模式。在旁路期间中,超滤被暂停并且透析液与血液透析器的液压连接被短路,参见图6(虚线),这意味着来自电导率单元的数据(σ
血气分析用来确定t=0、45、90、135和180分钟时的实验血浆钠浓度Na
实验过程的结果
如上所述,方程(9)中的参数G
针对ΔRBV和Na
表I估计过程的结果
在估计ΔRBV和Na
与对整个数据集进行评估相比,通过留一法程序评估的估计误差仅呈现出很小的差异,尤其是在考虑到较大的标准偏差的情况下。该结果表明,拟合过程尤其对来自一个会话的数据不敏感,并且证明了所提出的过滤器体系结构的可靠性。
图10例示了当使用来自完整数据集的数据计算估计器的参数时,最佳情况下的状态估计结果。为以下实验呈现ΔRBV和Na
由于卡尔曼滤波算法的属性,每个步骤都会更新的P
尽管已经结合当前被认为是最实际和优选的实施例描述了本发明,但是应当理解,本发明不限于所公开的实施例,相反,本发明旨在涵盖包括在所附权利要求书的精神和范围内的各种修改和等效布置。
- 用于确定体外血液回路中循环的血液的至少一个参数的传感器和设备
- 用于确定用于体外血液处理的装置的依赖于绝对压力的至少一个运行参数的方法和装置、用于体外血液处理的装置
