一种纤维素发酵工程菌及其构建方法和应用
文献发布时间:2023-06-19 09:47:53
技术领域
本发明涉及生物技术领域,特别是涉及一种纤维素发酵工程菌及其构 建方法和应用。
背景技术
随着化石能源的日趋枯竭以及人们对环境污染、能源危机等问题关注 度的提高,寻找清洁的可再生能源成为当前研究热点。木质纤维素是由多 种有机高分子化合物组成的具有高结晶度和聚合度的复合体,主要由纤维 素、半纤维素和木质素通过共价键和非共价键相互连接形成,因其储量丰 富、成本低廉、清洁环保而受到各国科学家的青睐。
纤维素酶,包含外切-1,4-β-D-葡聚糖酶(exo-β-glucanases,CBH)、内 切-1,4-β-D-葡聚糖酶(endo-β-glucanases,EG)、β-葡萄糖苷酶(endo-β -glucosidases,GE),可以将纤维素、半纤维素水解为单糖,其中外切-1,4-β -D-葡聚糖酶从纤维素的两端水解结晶纤维素,释放纤维二糖;内切-1,4-β -D-葡聚糖酶作用于纤维素内部的β-1,4糖苷键,随机水解无定形纤维素, 释放各种纤维寡糖;β-葡萄糖苷酶也称纤维二糖酶,主要水解纤维二糖、纤维寡糖,释放葡萄糖。纤维二糖对外切-1,4-β-D-葡聚糖酶和内切-1,4-β -D-葡聚糖酶有抑制作用,而葡萄糖对β-葡萄糖苷酶有抑制作用,当水解 液中的葡萄糖浓度升高时,纤维素的水解效率下降。因此,较低的木质纤 维素酶解效率,较高的纤维素酶使用成本是制约木质纤维素这一可再生能 源开发利用的瓶颈。
直接利用木质纤维素预处理液中的纤维寡糖是有效降低纤维素酶解和 发酵成本,实现木质纤维素高效发酵转化的途径之一。但是纤维寡糖是大 分子物质,不能以自由扩散等简单的扩散方式通过细胞膜,必需转运蛋白 的协助。在目前的工业发酵微生物菌株中,没有纤维寡糖转运蛋白,不具 有直接利用纤维寡糖进行发酵的能力。
发明内容
本发明的目的是提供一种纤维素发酵工程菌及其构建方法和应用,以 解决上述现有技术存在的问题,通过将火球菌纤维寡糖转运蛋白转入目的 菌株中获得能够高效利用纤维素,尤其是纤维二糖的工程菌,为实现产业 上利用纤维素奠定了基础。
为实现上述目的,本发明提供了如下方案:
本发明提供一种纤维素发酵工程菌,所述工程菌中含有火球菌纤维寡 糖蛋白基因;所述的火球菌纤维寡糖转运蛋白基因序列如SEQ ID NO.1所 示。
本发明提供一种纤维素发酵工程菌的构建方法,所述构建方法包括火 球菌纤维寡糖转运蛋白基因连接到载体上后转入表达宿主感受态细胞,再 诱导转化后表达宿主中火球菌纤维寡糖蛋白表达。
优选的,所述表达宿主感受态细胞的制备方法为氯化钙-氯化镁法。
优选的,所述的氯化钙-氯化镁法的具体步骤包括:
(1)从-40℃取出甘油保藏的E.coli菌种,在超净工作台里用接种环 蘸取菌液,在无抗生素的LA平板上划线,放37℃培养过夜。
(2)从LA平板上挑取生长良好的单菌落,接种到内含5mL LB培养 基的直形瓶,37℃,200rpm培养过夜。
(3)按1%的接种量(v/v)转接到内含100mL LB培养基的锥形瓶 里,37℃,200rpm培养2-3h,菌液OD600至0.4-0.6。
(4)将培养好的菌液使用冰浴进行冷却,冰浴时间约为30min,中间 偶有混匀。
(5)在超净台里将充分冷却的菌液分装到预冷的、无菌的容积为50 mL的聚丙烯管,在4℃下,5000rpm离心10min,弃去上清。
(6)向聚丙管中加入35mL预冷的氯化钙-氯化镁溶液,轻轻敲打重 悬菌体,在4℃下,5000rpm离心5min,弃去上清。
(7)重复步骤6两次。
(8)向聚丙管中加入4mL预冷的甘油-氯化钙溶液,轻轻敲打重悬菌 体,在冰上将感受态细胞分装到无菌的、预冷的EP管,每管100μL,放 -80℃冷藏。
优选的,所述的表达载体转化目的菌株的步骤包括:
(1)从-80℃取出大肠杆菌感受态细胞,迅速插入冰里,让大肠杆菌 感受态细胞在冰里自然融化。
(2)用微量移液器吸取适量表达载体加入内含100μL大肠杆菌感 受态细胞的EP管中,混匀后冰浴静置30min。
(3)将EP管快速地放入42℃水浴,在静置的条件下,热激90s。
(4)热激结束后立即取出EP管,冰浴静置3min。
(5)向EP管内加入200μL SOC培养基,37℃,200rpm培养1h,。
(6)取适量体积的培养物涂布到含有相应抗生素的LA平板上,放37℃ 恒温培养箱倒置培养12-16h。
优选的,所述诱导转化后目的菌株中火球菌纤维寡糖转运蛋白表达的 方法为:
(1)分别从转化平板上挑取生长良好的单菌落到内含5mL的LB培 养基(含50μg/mL卡那霉素,25μg/mL氯霉素)的直形瓶中,37℃、 200rpm培养10h。
(2)按1%(v/v)的接种量分别转接到内含65mL LB培养基(含50 μg/mL卡那霉素,25μg/mL氯霉素)的锥形瓶中,37℃、200rpm培养 过夜。
(3)按1%(v/v)的接种量分别转接到内含1L LB培养基(含50μ g/mL卡那霉素,25μg/mL氯霉素)的锥形瓶中,37℃、200rpm培养2- 3h,菌液OD600至0.4-0.6时加入终浓度为1mmol/L的IPTG。
(4)重组菌株E.coli Rosetta(DE3)/pET-Pfu-cbtA放37℃、200rpm培 养10-12h进行目的蛋白的诱导表达。
本发明还提供所述任一构建方法所构建的工程菌。
本发明还提供所述的工程菌在纤维素发酵中的应用。
优选的,所述的纤维素为纤维寡糖。
优选的,所述的纤维寡糖包括纤维二糖、纤维三糖、纤维四糖、纤维 五糖中的一种或多种。
优选的,所述的纤维寡糖为纤维二糖。
本发明公开了以下技术效果:
本发明通过将火球菌纤维寡糖转运蛋白基因转入感受态目的菌株并进 行诱导表达培养,成功构建了高效表达火球菌纤维寡糖转运蛋白的工程菌 株,并通过热力学实验证明了其能够高效结合纤维寡糖,尤其是纤维二 糖,为产业上进一步利用纤维素提供了工具。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对 实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附 图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出 创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为牛血清蛋白标准曲线;
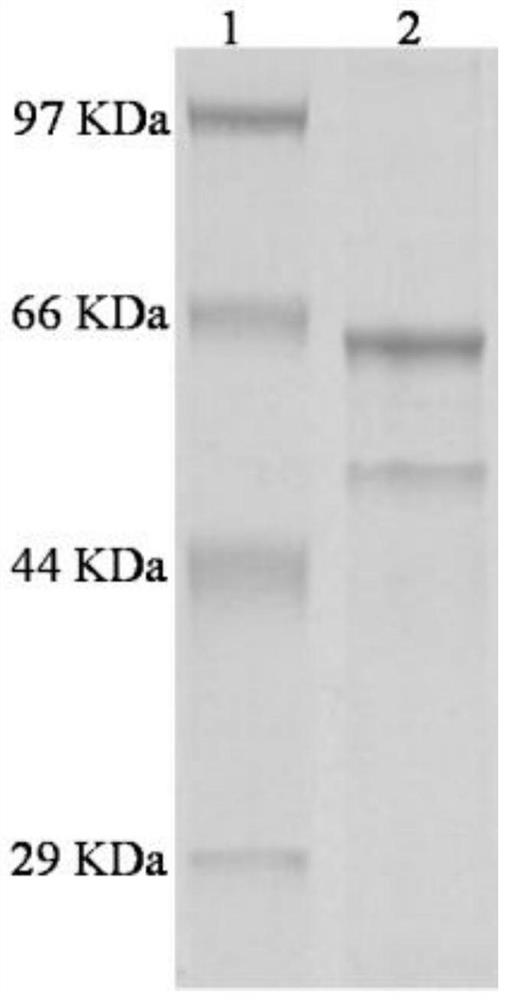
图2为表达产物的SDS—聚丙烯酰胺凝胶电泳分析,其中泳道1为 Standardprotein Marker(Low);泳道2为纯化的Pfu-CBTA;
图3为纤维寡糖和底物结合蛋白Pfu-CBTA在50℃等温滴定的曲线, 其中A为纤维二糖滴定Pfu-CBTA;B为纤维三糖滴定Pfu-CBTA;C为纤 维四糖滴定Pfu-CBTA;D为纤维五糖滴定Pfu-CBTA。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对 本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更 详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于 限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该 范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间 值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也 包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围 内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述 领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方 法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等 同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公 开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时, 以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实 施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本 发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申 请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为 开放性的用语,即意指包含但不限于。
本发明中所使用的材料、试剂等,如无特殊说明,均能够从商业途径 获得。
实施例1Pfu-cbtA基因转化大肠杆菌
1.基因序列合成和重组质粒构建
根据文献报道(The CebE/MsiK Transporter is a Doorway to the Cello-oligosaccharide-mediated Induction of Streptomyces scabies Pathogenicity,Jourdan S等,2016和Several Archaeal Homologs of Putative Oligopeptide- BindingProteins Encoded by Thermotoga maritima Bind Sugars,Nanavati D M 等,2006和Cellobiose Uptake in the Hyperthermophilic Archaeon Pyrococcus furiosus IsMediated by an Inducible,Konings S M等,2001和Cellodextrin UtilizationbyBifidobacterium breveUCC2003,Pokusaeva K等,2011和 HyperthermophilicThermotoga Species Differ with Respect to Specific Carbohydrate Transportersand Glycoside Hydrolases,Frock A D等,2012和 Tracking the Subtle MutationsDriving Host Sensing by the Plant Pathogen Streptomyces scabies,SamuelJourdan A I M F等,2017),对来自火球菌 (Pyrococcus furiosus)的基因序列进行BlastX比对分析,并对其编码的氨 基酸序列进行蛋白质结构域预测和信号肽分析,将其命名为Pfu-cbtA。根 据对基因序列的分析,由科雷生物科技有限责任公司合成该序列,构建到 pET-28a表达载体上。
2.从E.coli中小量制备质粒
(1)取1.5mL过夜培养的菌液加入容积为2mL的EP管,12000rpm 离心1min,弃去上清。
(2)向EP管中加入250μL预冷的P1溶液(使用前加入RNase A), 使用涡旋振荡器重悬菌体。
(3)向EP管中加入250μL预冷的P2溶液,温和地上下翻转6-8 次,使菌体充分裂解。
(4)向EP管中加入350μL预冷的P3溶液,立刻温和地上下翻转 6-8次,充分混匀,12000rpm离心10min。
(5)将上清转移到吸附柱CP3中,12000rpm离心1min,弃去收集 管中的废液,将吸附柱CP3放回收集管中。
(6)向吸附柱CP3中加入500μL去蛋白液PD,12000rpm离心1 min,弃去收集管中的废液,将吸附柱CP3放回收集管中。
(7)向吸附柱CP3中加入600μL去漂洗液PW,12000rpm离心1 min,弃去收集管中的废液,将吸附柱CP3放回收集管中。
(8)重复步骤7。
(9)将吸附柱CP3放回收集管中,12000rpm离心2min,将吸附柱 CP3转移到一个干净的EP管,向吸附膜中间部位加入50μL无菌水,室 温静置2min,12000rpm离心2min,将质粒溶液收集到EP管,放-20℃ 存储备用。
3.氯化钙-氯化镁法制备大肠杆菌感受态细胞(E.coli Rosetta(DE3))
(1)从-40℃取出甘油保藏的E.coli菌种,在超净工作台里用接种环 蘸取菌液,在无抗生素的LA平板上划线,放37℃培养过夜。
(2)从LA平板上挑取生长良好的单菌落,接种到内含5mL LB培养 基的直形瓶,37℃,200rpm培养过夜。
(3)按1%的接种量(v/v)转接到内含100mL LB培养基的锥形瓶 里,37℃,200rpm培养2-3h,菌液OD600至0.4-0.6。
(4)将培养好的菌液使用冰浴进行冷却,冰浴时间约为30min,中间 偶有混匀。
(5)在超净台里将充分冷却的菌液分装到预冷的、无菌的容积为50 mL的聚丙烯管,在4℃下,5000rpm离心10min,弃去上清。
(6)向聚丙管中加入35mL预冷的氯化钙-氯化镁溶液,轻轻敲打重 悬菌体,在4℃下,5000rpm离心5min,弃去上清。
(7)重复步骤6两次。
(8)向聚丙管中加入4mL预冷的甘油-氯化钙溶液,轻轻敲打重悬菌 体,在冰上将感受态细胞分装到无菌的、预冷的EP管,每管100μL,放 -80℃冷藏。
4.DNA分子转化大肠杆菌感受态细胞
(1)从-80℃取出大肠杆菌感受态细胞,迅速插入冰里,让大肠杆菌 感受态细胞在冰里自然融化。
(2)用微量移液器吸取适量表达载体加入内含100μL大肠杆菌感 受态细胞的EP管中,混匀后冰浴静置30min。
(3)将EP管快速地放入42℃水浴,在静置的条件下,热激90s。
(4)热激结束后立即取出EP管,冰浴静置3min。
(5)向EP管内加入200μL SOC培养基,37℃,200rpm培养1h。
(6)取适量体积的培养物涂布到含有相应抗生素的LA平板上,放37℃ 恒温培养箱倒置培养12-16h。
实施例2重组底物结合蛋白的诱导表达
(1)分别从转化平板上挑取生长良好的单菌落到内含5mL的LB培 养基(含50μg/mL卡那霉素,25μg/mL氯霉素)的直形瓶中,37℃、 200rpm培养10h。
(2)按1%(v/v)的接种量分别转接到内含65mL LB培养基(含50 μg/mL卡那霉素,25μg/mL氯霉素)的锥形瓶中,37℃、200rpm培养 过夜。
(3)按1%(v/v)的接种量分别转接到内含1L LB培养基(含50μ g/mL卡那霉素,25μg/mL氯霉素)的锥形瓶中,37℃、200rpm培养2- 3h,菌液OD600至0.4-0.6时加入终浓度为1mmol/L的IPTG。
(4)重组菌株E.coli Rosetta(DE3)/pET-Pfu-cbtA、放37℃、200rpm培 养10-12h进行目的蛋白的诱导表达。
实施例3重组底物结合蛋白质的纯化
1.重组底物结合蛋白质的纯化
(1)诱导6L菌液表达后,8000rpm离心10min,收集菌体。
(2)用300mL Lysis buffer(pH 8.0,咪唑10mmol/L,氯化钠300 mmol/L,磷酸二氢钠50mmol/L)重悬菌体,加入3mL 25mg/mL的溶菌 酶,混匀后冰上静置20min。
(3)在冰水混合物中使用超声波细胞破碎仪进行破胞,破胞总时间20 min,工作时间5s,间歇时间5s,破胞功率30%。
(4)破胞结束后,重组菌株E.coli Rosetta(DE3)/pET-Pfu-cbtA、的破胞 液放70℃水浴40min,水浴结束后于4℃,12000rpm离心30min;离心 后的上清液为粗蛋白液。
(5)分别吸取2mL Ni-NTA填料至层析柱中,用Lysis buffer(pH 8.0, 咪唑10mmol/L,氯化钠300mmol/L,磷酸二氢钠50mmol/L)充分平衡 层析柱中的Ni-NTA填料。
(6)分别将粗蛋白液与用Lysis buffer平衡的Ni-NTA填料混合,放 10℃,150rpm作用1h,使含有组氨酸标签的重组底物结合蛋白与Ni-NTA 填料充分结合。
(7)分别将混合液转移到层析柱中并排空液体,向层析柱中加入10 mL预冷的Washbuffer(pH 8.0,氯化钠300mmol/L,磷酸二氢钠50mmol/L, 咪唑浓度40mmol/L),轻轻重悬Ni-NTA,排空层析柱内的液体,重复4 次。
(8)充分洗涤以后向层析柱中加入10mL预冷的Elution buffe(pH 8.0,咪唑250mmol/L,氯化钠300mmol/L,磷酸二氢钠50mmol/L)洗脱 底物结合蛋白,收集洗脱液,重复3次,4℃保存含有底物结合蛋白的洗脱 液。
(9)底物结合蛋白洗脱结束以后,使用Elution buffe多次冲洗Ni-NTA 填料,冲洗结束后用20%的乙醇溶液保存。纯化同一种底物结合蛋白时, Ni-NTA填料可重复使用3-5次,结合率下降以后可对Ni-NTA填料进行再 生。
2.底物结合蛋白的脱盐
(1)将含有底物结合蛋白的洗脱液转移到30kDa的超滤管,洗脱液 较多时可分多次转移,在4℃条件下,5000rpm离心30min,弃去收集管 中的废液。
(2)超滤管中的洗脱液约为500μL时,向超滤管中加入buffer A溶 液(pH 7.0,50mM Tris-HCl,100mM NaCl)在4℃条件下,5000rpm离 心30min,弃去收集管中的废液。
(3)重复步骤2两次。
(4)分别将超滤管中含有底物结合蛋白的溶液和收集管中的超滤液转 移到干净的EP管和直形瓶,放4℃保存。
3.蛋白质标准曲线的绘制和定量分析
吸取100μL牛血清蛋白BSA标准品(2mg/mL),加入1900μL ddH20后充分混匀,按照表1在1.5mL的EP管内用稀释液(ddH2O、 0.9%NaCl或者PBS)稀释BSA标准品,每个浓度三个平行。
表1牛血清蛋白标准曲线测定
分别吸取20μL稀释后的BSA标准品溶液加入1.5mL的EP管,每 个浓度做三个平行,分别向每管加入1mL复温的Broadford Dye Reagent, 混匀后室温反应5min,各取200μL加入96孔板,使用酶标仪测定600 nm处的吸光度值,计算各浓度的平均值后减去Blank的平均值,以蛋白质 含量为横坐标,OD600的读数为纵坐标,绘制BSA标准品溶液的标准曲 线(图1)。
纯化的底物结合蛋白定量:分别取20μL不同稀释倍数的目的蛋白 溶液加入1mL复温的Broadford Dye Reagent,混匀后室温反应5min,各 取200μL加到酶标板,读取OD600的吸光度值,代入标准曲线计算目的 蛋白的质量浓度,为10.934539mg/ml。
实施例4底物结合蛋白的SDS-PAGE分析
SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)用于分析底物结合蛋白的表 达情况与纯化的底物结合蛋白的分子量和纯化程度,实验步骤如下:
(1)将制胶器、胶梳、玻璃板和Spacer洗干净,并组装好,用水检测 严密性,若严密性好,弃去玻璃夹板层里的水,用滤纸吸干。
(2)按照表2配制分离胶和浓缩胶溶液,混匀以后向玻璃板夹层灌注 分离胶溶液,灌至合适高度后加入1mL无水乙醇,室温静置30min。
(3)待分离胶凝固后弃去玻璃夹层里的无水乙醇,用滤纸吸干,快速 灌入浓缩胶溶液,灌满玻璃板夹层以后插入胶梳,室温静置30min。
(4)待浓缩胶凝固后将凝胶放入电泳槽,用电极缓冲液冲洗胶孔,用 10mA恒定电流进行预电泳15min。
表2 SDS-聚丙烯酰胺凝胶配方
(5)取30μL的底物结合蛋白溶液与10μL 4×protein loading buffer混匀,沸水浴30min,12000rpm离心10min。
(6)分别各取4-10μL上清加入聚丙烯酰胺凝胶胶孔,上样结束后 用120V恒定电压进行电泳,至溴酚兰条带到达聚丙烯酰胺凝胶底部止。
(7)电泳结束后,将玻璃板撬开,小心取出聚丙烯酰胺凝胶,放入考 马斯亮蓝R-250染色液进行染色,25℃,60rpm染色30min。
(8)染色结束后,弃去考马斯亮蓝R-250染色液,清水冲洗,加入适 量脱色液进行脱色,25℃,60rpm脱色,至聚丙烯酰胺凝胶无明显背景颜 色止,中间需多次换脱色液。
(9)待聚丙烯酰胺凝胶充分脱色以后,使用成像仪Gel DocTM XR+ 获得理想的SDS-聚丙烯酰胺凝胶电泳图。
如图2所示,对诱导后的重组菌株分别进行超声破胞纯化,在相应分 子量大小处出现了明显的蛋白质特征性条带,Pfu-CBTA(Lane 2)在70℃ 水浴1h后进行纯化,杂蛋白已经明显减少,说明我们已经成功表达了底 物结合蛋白。
实施例5等温滴定量热法(ITC)测定底物结合蛋白与纤维寡糖之间 的亲和力
1.各种纤维寡糖滴定底物结合蛋白
(1)分别用最后一次收集管中的超滤液将底物结合蛋白溶液稀释至 0.1—0.2mmol/L并配制浓度为底物结合蛋白浓度10倍左右的各种纤维寡 糖溶液。
(2)于4℃真空脱气10—20min,设置等温滴定的各个参数。
各个底物结合蛋白的滴定条件:
Ⅰ.Pfu-CBTA:底物结合蛋白的滴定浓度为0.15mmol/L,各种纤维寡 糖的滴定浓度为1mmol/L,进样针体积为40μL,进样针抽滤时间5s, 每次滴定持续时间6s,第1滴体积为0.1μL,第2-20滴体积为1.5μL, 共20滴,每两滴的间隔时间120s,样品池温度50℃,参考能量值10μ cal/sec,起始延长时间1min,进样针搅拌速度500rpm,反馈模式low。
2.底物结合蛋白的热力学参数
使用Origin ITC 200软件进行数据分析和曲线拟合,在一次等温滴定 实验中,ITC可以测定亲和力常数Kb,化学计量数n,结合的焓变△H和 熵变△S,根据实验测得的热力学参数和吉布斯—亥姆霍兹方程可以计算 出吉布斯自由能△G。
3.结果
使用等温滴定量热法(ITC)测定底物结合蛋白在buffer A中与纤维寡 糖的结合特性,在30℃或者50℃等温滴定时,等体积地把纤维寡糖分别滴 入充满底物结合蛋白的样品池内(第一滴体积较小,)。若底物结合蛋白与 纤维寡糖结合,则释放热量并被记录下来形成能量峰,最开始的几滴产生 能量较多,峰值较高,随着纤维寡糖不断地滴入样品池,底物结合蛋白趋 于饱和,产生的能量越来越少,峰值越来越低,当样品池中的底物结合蛋 白完全饱和时,记录到的峰值为纤维寡糖的稀释所产生的热量,化学计量 数n也不会再改变;若底物结合蛋白与纤维寡糖不结合,则只有微小的因 稀释放热形成的峰。在相同的滴定条件下,测定各种纤维寡糖滴定buffer A时产生的稀释热,作为空白,数据分析时点对点扣除背景。
等温滴定量热法可以直接测定底物结合蛋白和纤维寡糖结合时产生的 结合焓变化量(△H)、熵变化量(△S)、结合常数(K
使用终浓度为1mmol/L的纤维寡糖溶液在50℃恒温条件下分别滴定 底物结合蛋白Pfu-CBTA,测定Pfu-CBTA的结合热力学特性,结果如图3 所示。结果表明,底物结合蛋白Pfu-CBTA可与纤维二糖、纤维三糖、纤 维四糖、纤维五糖结合,使用一个结合位点模式对滴定结果进行拟合分析, 各结合热力学参数见表3。
表3底物结合蛋白Pfu-CBTA与纤维寡糖相互作用的热力学参数
从表3可知,Pfu-CBTA与纤维二糖、纤维三糖、纤维四糖、纤维五糖 均有结合,对纤维二糖亲和力最强,结合常数Kb为(3.56±1.09)×106M- 1,对纤维五糖亲和力最弱,结合常数Kb为(1.32±0.05)×106M-1。
从表3和表4可知,Pfu-CBTA对纤维二糖的亲和力最强,在50℃测 得其解离常数Kd为0.3μM,纤维三糖次之,解离常数为0.47μM,然后 是纤维四糖,解离常数为0.48μM,对纤维五糖的亲和力最弱,解离常数 为0.76μM。纤维寡糖和底物结合蛋白之间的亲和力越强,形成的纤维寡 糖-底物结合蛋白复合物越稳定,反之,复合物越容易解离。复合物的吉布 斯函数△G小于0时,复合物是稳定的,负值越大越稳定。
表4底物结合蛋白Pfu-CBTA的热力学参数
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范 围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对 本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确 定的保护范围内。
序列表
<110> 广西科学院
<120> 一种纤维素发酵工程菌及其构建方法和应用
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1869
<212> DNA
<213> 火球菌(Pyrococcus furiosus)
<400> 1
atgaagagac tcgttggtgt actaattgga gcgtttgtaa tatttggagt tttcggccaa 60
gtagtggccg cccaggaaca agaacttcca agggaagaaa cactatacgt tggtggtggt 120
ctctggagcc aaccaaacaa cttcaatccc cttatcccct ggagtgccgt tacaggaacc 180
attggcttga tttacgaaac cttgttcaac tacgacccat taaacgataa gctagagccc 240
tggcttgccg agagtggaag atgggttagc gacaacgtat atgaggttaa acttagggaa 300
ggattaacct ggcaggatgg aaagccacta acagctgagg acgttaagtt caccttcgag 360
ctccacaaga agtatcctgg tctagcatat caccagatgt gggagtggct ccaagaggtt 420
aaggttatag atgacagaac aatccagttt gtatttagca ctccccacta tgaagagtgg 480
aagtatctac tttatcaaat agcaattgtt ccgaagcaca tctggcagaa cattgataac 540
ccagttgaat tcgccaacgt tgacaaccca gttggttctg gtccctacaa gctctacaag 600
acagaccaga tgaggttcat tctcgttagg aacgacaact ggtggggaat caagtacttc 660
ggcaagcccg ctccaaagta catagtctac gttatagtct acagcaacaa cttggcatta 720
tcaatgctcg tcaagggtga gctcgactgg agcaacttct tcatcccggg tgtcccagat 780
gtcaaggctc agtatggaat agttacctgg tacgatgaac caccatacca cctaccagca 840
aacacggcat tcctattcct caacacccaa aagccaccac ttgacaaccc agagttcaga 900
agggccatag cctatgcaat aaacccagag gagatagctg ccagagcatc ccaaaaccag 960
gtaactccag ccgatcccac aggattacta atccagtatc cagcattcaa gaagatatac 1020
aacaaggagg ccgttgataa gtacggattc aagtatgatc cacaaaaggc catggagata 1080
ctcgacaagc taggatttaa ggatgtaaat ggtgatggct acagagagtt cccagatgga 1140
aaaccactca agttaacaat aatagtccca ttcggatgga ccgactggat ggagatgatc 1200
agagtaataa gcgagcagtt ggcaattgtt ggaatcaacg tcgagcccaa gttcccagac 1260
tattcaaagt actgggatga cctaaccaag ggtaacttcg acatggccat aaacaacttc 1320
ggaagcaacg tagttgcaac accatggcaa tggttcaact gggtcctcaa ccaagatgtc 1380
actccaatag gagagaactt ctacaacggt aacttcggta gatacaagaa tgagagagtt 1440
gcagagctcc tagagctcat aaacgttgag aaggatgaga acaagaagct tcaatactac 1500
tacgagctac aggagatatt cctcaaagac ttgccataca taccaataat ctacaacggt 1560
gcatggtttg aggcaagccc agagcactgg accaactggc ctacagcaaa gaacccatac 1620
gcattcccaa taagctggaa cggatactgg cagatgggtg gagtgaaggt gctactcaat 1680
atcaagccag taaaggcagc tacagaaaca acaactacag aggagaagac tgaaacgata 1740
gttcagactg ttaccgttac tccaacagag acggcaactt catcaacaga aacaggagga 1800
atctgtggac cagcaatatt agttggttta gccgtagtcc cactcctcct aaggaggaga 1860
agatcttaa 1869
- 一种纤维素发酵工程菌及其构建方法和应用
- 一株利用木质纤维素水解液厌氧发酵产L‑天冬氨酸的基因工程菌及其构建方法与应用
