一种肺癌患者的治疗预后评估模型
文献发布时间:2023-06-19 09:51:02
技术领域
本发明涉及生物信息学领域。具体来说,提供了一种通过建立计算模型对肺癌患者特别是晚期肺癌患者治疗预后的预测。
背景技术
肺癌是全球癌症死亡的主要原因,是我国发病率和死亡率均居首位的恶性肿瘤。70%~80%的肺癌患者就诊时已处于中晚期,错过了最佳的治疗时机,具有五年生存率低、预后差的特点。
近年来患者拥有越来越多的治疗选项,包括放疗、化疗、靶向药物,以及免疫疗法。然而,癌症患者对某种治疗的响应性具有个体差异。为了使患者特别是中晚期患者得到最有效的治疗,临床医生对晚期肺癌患者临床获益和预期生存时间的及时、可靠的评估非常重要,因为其有助于医生和患者共同选择合适的治疗方案,从而实现个体化治疗。
因此,仍需要一种方便、有效的模型来完成对治疗预后的评估。
发明内容
本申请的发明人通过统计、分析患者治疗前后的免疫状态和预后之间的关联,建立了一种在患有肺癌的受试者中基于患者的TCR多样性、血液中相关细胞类型的变化和吸烟史评估治疗预后的计算模型,由此完成了本发明。
因此,第一方面,本发明涉及一种在患有肺癌的受试者中评估治疗预后的系统,其包括:
(1)存储装置,其中存储以下信息:所述受试者是否为吸烟者,所述受试者的TCR多样性,以及所述受试者治疗前和治疗后的血常规检测结果,
(2)计算装置,其通过受试者的吸烟状态、TCR多样性以及治疗前和治疗后的血常规检测结果的变化计算风险评分,
(3)输出装置,其输出所述风险评分或基于所述风险评分预测的预后结果。
第二方面,本发明提供一种在患有肺癌的受试者中评估治疗预后的方法,包括通过受试者的吸烟状态、TCR多样性以及治疗前和治疗后的血常规检测结果的变化计算风险评分。
第三方面,本发明提供一种预测癌症治疗方法或治疗药物在受试者中的治疗效力的系统,包括:
(1)存储装置,其中存储以下信息:所述受试者是否为吸烟者,所述受试者的TCR多样性,以及所述受试者在使用所述治疗方法或治疗药物之前和之后的血常规检测结果,
(2)计算装置,其通过受试者的吸烟状态、TCR多样性以及治疗前和治疗后的血常规检测结果的变化计算风险评分,
(3)输出装置,其输出所述风险评分或基于所述风险评分预测的治疗效力。
第四方面,本发明提供一种在患有肺癌的受试者中预测癌症治疗方法或治疗药物的治疗效力的方法,包括通过受试者的吸烟状态、TCR多样性以及治疗前和治疗后的血常规检测结果的变化计算风险评分。
优选地,所述血常规检测结果包括血小板计数(P)、中性粒细胞计数(N)和淋巴细胞计数(L)。更优选地,所述计算装置计算所述受试者治疗前和治疗后的系统免疫炎症(SII)指数,所述SII指数=P x N/L。
所述TCR多样性通过使用所述受试者的外周血构建TCR序列文库并进行测序来确定。所述TCR序列文库使用外周血DNA或外周血RNA来构建,优选使用外周血RNA来构建。优选地,所述TCR多样性是通过计算所述受试者治疗之后TCR的香农-威纳指数并以10为底对所述香农-威纳指数进行对数换算确定的TCR多样性值。所述TCR多样性是治疗前TCR多样性或治疗后TCR多样性,优选治疗后TCR多样性。
优选地,所述风险评分按照如下公式计算:
风险评分=(0.9617×吸烟状态值)+(-2.9831×治疗后TCR多样性值)+(-1.6088×系统免疫炎症(SII)指数变化百分比值),
其中若所述受试者为吸烟者,则吸烟状态值为1,若所述受试者为非吸烟者,则吸烟状态值为0,所述SII指数变化百分比值=(治疗后SII指数-治疗前SII指数)/治疗前SII指数。
所述风险评分越高代表预后越差,风险评分越低代表所述受试者的预后越好。或者,所述风险评分越高代表所述治疗方法或治疗药物的效力越差,风险评分越低代表所述治疗方法或治疗药物的效力越好。
优选地,所述受试者患有晚期肺癌。所述受试者患有非小细胞肺癌、小细胞肺癌、大细胞肺癌中的一种或多种。
在进一步的实施方案中,所述计算装置将获得的风险评分与参比值比较,所述参比值来自接受了相同治疗且预后情况已知的受试者。
附图说明
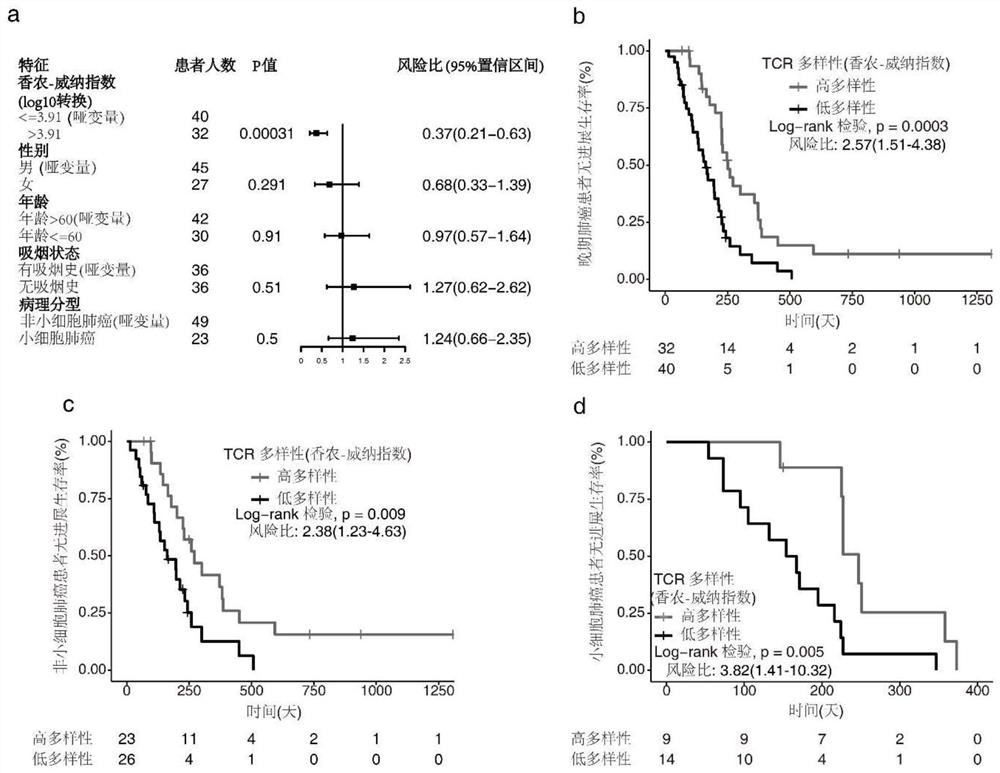
图1a-d显示了基线外周血TCR多样性与预后的关系。(a)基于风险比显示不同因素(以香农-威纳指数体现的TCR多样性;性别;年龄;吸烟状态;病例分型)与预后的关联性。(b-d)在不同病理类型的肺癌患者中(图1b,晚期肺癌患者(包含非小细胞肺癌和小细胞肺癌患者);图1c,非小细胞肺癌患者;图1d,小细胞肺癌患者),基线外周血TCR多样性与无进展生存率的关联性。
图2a-e显示了晚期肺癌(非小细胞肺癌和小细胞肺癌)患者中治疗前(基线)外周血TCR多样性与不同细胞亚群占比的相关性。(a)CD4
图3a-c显示了晚期肺癌(非小细胞肺癌和小细胞肺癌)患者中治疗后外周血TCR多样性与不同细胞亚群占比的相关性。(a)CD4
图4显示了晚期肺癌(非小细胞肺癌和小细胞肺癌)患者治疗前后外周血TCR多样性的相关性。
图5a-e显示了预后风险评估模型的预后价值。(a-c)显示了训练集(a)、测试集(b)和整个数据集(c)中高风险组和低风险组的无进展生存率差异;(d)显示了本发明的模型在训练集、测试集和整个数据集中的一致性指数(C-index);(e)对风险评分模型进行可视化展示的列线图(nomogram),用于预测晚期肺癌患者的无进展生存期。
肿瘤患者的全身免疫状态指包括固有免疫和适应性免疫在内的整体免疫反应能力,与患者的临床结局密切相关。适应性免疫状态指适应性免疫的反应能力,是抗肿瘤治疗的关键影响因素。机体抗肿瘤免疫应答以细胞免疫应答为主,其中T细胞介导的免疫应答在杀伤肿瘤细胞、控制肿瘤生长中至关重要。
T细胞通过T细胞抗原受体(T cell receptor,TCR)识别肿瘤抗原,引起效应细胞的激活和效应分子的释放,从而激活抗肿瘤免疫。T细胞抗原受体或T细胞受体(T cellreceptor,TCR)是T细胞特异性识别和结合抗原肽-MHC分子的分子结构,通常与CD3分子呈TCR-CD3复合物形式存在于T细胞表面。TCR可分为TCRα/β和TCRγ/δ两种类型,外周血T细胞主要是TCRα/βT细胞,是介导机体特异性细胞免疫反应的主要细胞。外周血T细胞TCR的多样性由α链和β链的V区决定,Vα和Vβ各有3个高度可变区,又称为互补决定区(CDR),即CDR1、CDR2和CDR3。但只有CDR3直接与抗原相互作用,在TCR识别抗原过程中具有核心地位,序列具有高度可变性,被认为是T细胞克隆来源的标识。从基因水平来讲,CDR1、CDR2仅由V基因片段编码,而Vβ的CDR3由V-D-J三个基因片段编码,Vα的CDR3则由V-J两个基因片段编码。多个基因片段编码增加了CDR3的变异,加之重排过程中的N区核苷酸插入和连接的变异性也集中在CDR3区,这些都丰富了CDR3的多样性。
在本发明的实施方案中,优选所述TCR多样性值是外周血TCR多样性值。外周血中初始T细胞和中央记忆性T细胞是未活化的T细胞,代表机体识别和清除非己成分的能力,每个克隆仅有一个细胞,TCR多样性高;而初始T细胞或中央记忆性T细胞特异性识别抗原后被激活从而产生抗原特异性的克隆扩增,此时每个克隆由多个细胞组成,TCR多样性低。因此,外周血TCR多样性实际上定量地反映了未活化的T细胞和效应T细胞的相对比例关系,也代表着机体的适应性免疫状态。在这一过程中,TCR多样性是特异性识别肿瘤抗原、产生有效免疫应答的先决条件。
发明人分析了治疗前后患者外周血TCR多样性与T细胞成分的相关性,发现治疗前后的外周血TCR多样性均能反映患者的适应性免疫状态,治疗前的基线外周血TCR多样性可以作为肺癌患者无进展生存期的独立预后指标(参见图1a-d),且治疗前后的TCR多样性指数有强相关性(参见图4)。在建立计算模型的过程中,同时纳入了治疗前和治疗后的TCR多样性作为候选参数进行筛选,基于具体的筛选标准,确定将治疗后的TCR多样性值用于构建模型。因此,本发明特别关注治疗后的适应性免疫状态,即具体的计算公式中使用的治疗后TCR多样性值。
在具体的实施方案中,本发明的TCR多样性值通过构建TCR多样性测序文库并进行测序,然后根据测序结果计算香农-威纳指数来获得。在本发明的模型中,通过上述计算得到的TCR多样性值越高,风险评分越低,意味着预后越好,例如无进展生存期更长。本发明的发明人开发了一种评估模型,该模型可用于在肺癌患者中评估治疗的预后和治疗的效力。所述评估模型基于三项筛选出的指标,即治疗后TCR多样性、吸烟史和血液中相关细胞计数的变化。具体来说,本发明提供如下计算公式来计算“风险评分”:
风险评分=(0.9617×吸烟状态值)+(-2.9831×治疗后TCR多样性值)+(-1.6088×系统免疫炎症(SII)指数变化百分比值)
其中若所述受试者为吸烟者,则吸烟状态值为1,若所述受试者为非吸烟者,则吸烟状态值为0,所述SII指数变化百分比值=(治疗后SII指数-治疗前SII指数)/治疗前SII指数。
在上述公式中,“治疗后TCR多样性值”反映了患者的适应性免疫状态。
所述TCR测序文库可以使用来自患者的样本的核苷酸构建,所述样本包括但不限于细胞、组织如肿瘤组织、血液如外周血、尿液。在优选的实施方案中,所述TCR多样性测序文库使用受试者的外周血样本构建。相对于其他样本如肿瘤组织,外周血样本更容易获得,对受试者造成的损伤更小。
另外,也可以使用外周血经过处理后的包括一种或多种细胞的级分来构建文库。所述一种或多种细胞例如外周血单个核细胞(PBMC),外周血淋巴细胞(PBL)和其他血细胞亚群,包括但不限于T细胞、自然杀伤细胞、单核细胞、单核细胞前体细胞、造血干细胞或非多能干细胞。在优选的实施方案中,本发明的方法使用外周血白细胞、外周血单个核细胞(PBMC)、外周血CD4
用于构建TCR测序文库的核苷酸可以是DNA或RNA。在优选的实施方案中,所述TCR多样性测序文库使用RNA构建,如外周血RNA。以RNA为模板时,通过反转录得到的cDNA,然后通过多轮巢氏PCR来构建文库。使用RNA相对于使用基因组DNA为模板而言,代表性更好,因为重组的V(D)J基因只占基因组DNA非常少的一部分,使用RNA时可以排除不参与重组的V(D)J基因和内含子,降低了背景杂质的比例。
在具体的实施方案中,使用专利申请公开CN107779495A中所述的方法构建,如该申请中实施例4所述的方法。这种方法使用了模板转换技术进行反转录,然后进行多轮巢氏PCR,通过设计每轮的引物,将测序接头序列添加到终产物中。这种方法的扩增体系简单,避免了多重PCR带来的非特异性扩增。同时通过引物引入分子标签,使得整个过程更加高效,并且能够在后期分析数据过程中进一步增加序列的特异性,减少由PCR造成的偏倚。
系统免疫炎症指数(systemic immune-inflammation index,SII)是基于外周血血小板、中性粒细胞和淋巴细胞的绝对值计数来计算的指数,由Hu等人提出,最初用于肝癌根治性切除后的预后评估(Hu等,Systemic immune-inflammation index predictsprognosis of patients after curative resection for hepatocellularcarcinoma.Clin Cancer Res.2014;20(23):6212-22)。SII指数代表了机体的免疫和炎性状态。由于这三种血液细胞计数属于血常规检测的内容,SII指数非常容易获得,因此逐渐成为预测肿瘤和其他炎性疾病临床结果的常用指标。
在本发明的方法中,在使用受试者外周血构建TCR多样性文库时,可以同时利用外周血样品测定SII,这简化了应用本发明的模型来评估预后时的采样过程。
本发明的模型关注治疗前后SII指数的变化,因为通过筛选发现其与患者的预后情况相关,因此将其作为计算风险评分的一个关键参数并赋予权重。在本发明的模型中,SII指数变化百分比值=(治疗后SII指数-治疗前SII指数)/治疗前SII指数。治疗后的SII指数如果高于治疗前的SII指数,那么风险评分会降低,并且SII指数在治疗后升高的幅度越大,风险评分降低的越多。这意味着患者SII指数的上升预示着更好的预后,例如更长的无进展生存期。
本领域已知吸烟会造成肺部损伤,吸烟史与肺癌的发生相关。本发明也发现患者的吸烟史与肺癌的治疗预后情况存在关联,因此将是否吸烟也纳入作为计算风险评分的参数。在本发明的模型中,吸烟状态值为1或0,代表吸烟或不吸烟,并为其赋予权重。根据本发明的计算模型,在患者为吸烟者时,风险评分更高,意味着预后更差,例如无进展生存期更短。
本发明的受试者是患有肺癌的受试者,特别是中晚期肺癌。肺癌包括非小细胞肺癌如肺腺癌、肺鳞状细胞癌,小细胞肺癌,大细胞肺癌。优选地,所述肺癌是非小细胞肺癌或小细胞肺癌。更优选地,所述肺癌是中期或晚期的非小细胞肺癌或小细胞肺癌。
本发明的计算模型具有良好的一致性指数(concordance index,C-index)。一致性指数是体现模型预测能力的参数。例如,对于两名受试者A和B而言,如果基于预测模型获得的结果是A的预后好于B,且最终观察结果一致,那么说明预测结果与实际一致。一致性指数是根据模型计算的预测结果与实际结果一致的情况所占的比例,其取值范围为0.5-1。若预测与实际完全不一致,则一致性指数为0.5,意味着预测模型的准确度没有超过随机判断的情况。如果模型计算的结果与实际结果完全一致,则一致性指数为1,预测非常可信。一般来说,如果计算模型具有0.7以上的一致性指数,可以认为该计算模型是不错的计算模型;如果具有0.8以上的一致性指数,可以认为该计算模型是强大的计算模型;如果一致性指数接近1,则是近乎完美的计算模型。本发明建立的预后风险评估模型训练集和测试集的一致性指数分别是0.726和0.694,高于或接近0.7,表示其预测效能良好,预测结果可靠。
使用本发明的模型计算的风险评分可以直接用于评估治疗的预后情况。所述预后情况包括但不限于治疗后的进展情况和治疗的最终结果,例如无进展生存期,总生存期,是否缓解,是否治愈等。优选地,所述预后情况包括无进展生存期。
实施例
为了更全面地理解和应用本发明,下文将参考实施例和附图详细描述本发明,所述实施例仅是意图举例说明本发明,而不是意图限制本发明的范围。本发明的范围由后附的权利要求具体限定。
根据如下流程从72名晚期肺癌患者的外周血提取RNA,通过使用提取的RNA建库、测序和分析获得了TCR多样性数据。
1.从血液样本提取RNA
研究纳入72名晚期肺癌患者,其中非小细胞肺癌49例,小细胞肺癌23例。患者接受1-2个疗程的化疗或靶向药物治疗,根据治疗方案的不同每个疗程3-4周不等。在接受治疗前和治疗后分别收集来自患者的外周血6ml,并使用EDTA抗凝。然后在12小时内提取白细胞,加入Trizol裂解液保存,防止RNA降解,具体方法如下。
首先将装有肺癌患者外周血的采血管在室温下,120g离心20分钟,将上层清液转移到新的1.5ml离心管中用以分离血小板和血浆,将中间白色细胞层和下层红色液体转移到装有15ml红细胞裂解液的50ml离心管中,颠倒混匀,冰上静置裂解15分钟,期间反复颠倒混匀3次以上。将裂解红细胞后的样本于4℃条件下,400g离心10分钟,随后弃上层液体,用移液枪尽量吸干净,留下沉淀。将沉淀用2ml红细胞裂解液重新悬浮,并转移到两个1.5ml离心管中,冰上静置裂解10分钟,然后于4℃,400g条件下离心10分钟,弃上清,保留底部白色沉淀,即为白细胞。为去除白细胞沉淀中过多的离子,我们使用含有0.8%EDTA的磷酸缓冲盐溶液(PBS)洗涤白细胞沉淀。使用含有0.8%EDTA的磷酸缓冲盐溶液重悬白细胞,吹吸混匀,于4℃,400g条件下离心10分钟,用移液枪将上层液体吸去,尽量吸干净,获得用于后续试验的白细胞样本。为保证RNA不降解,进行RNA的提取和后续试验,分离得到的白细胞样本中加入1ml Trizol裂解液,并吹吸15次以上,使得白细胞充分裂解,在提取RNA之前保存于-80℃待用。
使用Trizol法提取白细胞的总RNA。
2.建库测序
依据中国专利申请公开文本CN107779495A中描述的用于人类受试者建库的方法,使用上述步骤中获得的RNA建立T细胞抗原受体多样性测序文库。
采用Illumina测序仪,以双端150bp(PE150)方法测序,测序量为9G。
同时对同一患者的白细胞进行转录组测序。
4.数据清洗和处理
在MiGEC软件中将TCR序列文库测序数据中包含的序列按照唯一分子标识符(Unique Molecular Identifiers,UMIs)分组,把至少包含4~6个序列的UMI认为是有效的分子标签,从而获得目的片段的序列。唯一分子标识符(Unique Molecular Identifiers,UMIs)随机性地利用不同的分子标签标记、区分不同的分子,UMI给每一条原始DNA片段加上一段特有的标签序列,经PCR扩增后一起进行测序。根据不同的标签序列,就能区分不同来源的DNA模板,从而提高检测灵敏度和特异性。
将获得的序列比对到人的TCR参考V、D、J和C基因进行序列组装,利用MiXCR软件提取CDR3区序列并识别V、D和J基因区段。
VDJt
实施例2.TCR多样性与适应性免疫状态的关联性
首先利用外周血单个核细胞(peripheral blood mononuclear cell,PBMC)单细胞数据构建分子标签,随后利用CIBERSORTx工具整合分子标签和白细胞转录组数据得到除中性粒细胞外的细胞亚群相对比例。经过血常规中性粒细胞比例矫正后得到各细胞亚群在白细胞中所占比例。
为探究外周血TCR多样性与细胞亚群所占白细胞比例之间的关系,进行了Spearman相关性分析。结果显示,基线外周血TCR多样性与CD4
以上结果说明,未活化的免疫细胞占比与TCR多样性程度呈正相关,而激活后的免疫细胞占比与TCR多样性呈负相关。具体来说,外周血中初始T细胞和中央记忆性T细胞是未活化的T细胞,代表机体识别和清除非己成分的能力,每个克隆仅有一个细胞,TCR多样性高;而初始T细胞或中央记忆性T细胞特异性识别抗原后被激活从而产生抗原特异性的克隆扩增,此时每个克隆由多个细胞组成,TCR多样性低。因此,外周血TCR多样性实际上定量地反映了未活化的T细胞和效应T细胞的相对比例关系,也代表着机体的适应性免疫状态,即治疗前外周血的基线TCR多样性与患者的适应性免疫状态至少部分相关。
实施例3.预后风险评估模型的建立和验证
由于纳入的患者包括非小细胞肺癌患者和小细胞肺癌患者,所以我们根据病理分型分层抽样,将所有的患者划分为训练集(N=52)和测试集(N=17)。
生存资料的经典方法是Cox比例风险回归模型,该模型要求自变量之间相互独立,且样本量大于预测变量。因此,各变量之间常具有强相关、呈现高维度和共线性的资料中,传统Cox模型就不再适用。而LASSO(最小化绝对收缩和选择算子)方法通过构造一个罚函数得到一个较为精炼的模型,使得它压缩一些系数,同时设定一些系数为零,对高维资料进行降维,它提供了一种新的变量筛选算法,可以很好的解决共线性问题。
在本发明的模型构建中,共纳入了28个变量作为候选变量,具体为:吸烟状态、TNM分期、病理分型、治疗前克隆性指数、治疗后克隆性指数、重叠指数overlap、重叠指数cosine、治疗前NLR(中性粒细胞/淋巴细胞比值)、治疗后NLR、治疗前后的NLR差值、治疗前后NLR变化的百分比值、治疗前后NLR变化的百分比绝对值、治疗前PLR(血小板/淋巴细胞比值)、治疗后PLR、治疗前后的PLR差值、治疗前后PLR变化的百分比值、治疗前后PLR变化的百分比绝对值、治疗前SII、治疗后SII、治疗前后的SII差值、治疗前后SII变化的百分比值、治疗前后SII变化的百分比绝对值、治疗前后TCR多样性指数差值、log10(治疗前后TCR多样性指数差值绝对值)、治疗前后TCR多样性指数变化的百分比值和治疗前后TCR多样性指数变化的百分比绝对值。应用上述28个变量建立LASSO Cox回归模型,并用留一交叉验证法验证,采用最小lambda值筛选出与患者无进展生存期密切相关的三个参数:治疗后的外周血TCR多样性、系统免疫炎症指数(systemic immune-inflammation index,SII)治疗前后变化的百分比和吸烟状态,根据筛选出变量的多因素COX回归系数建立了晚期肺癌患者预后风险评估模型:
风险评分=(0.9617×吸烟状态值)+(-2.9831×治疗后TCR多样性值)+(-1.6088×SII指数变化百分比值)
其中“治疗后TCR多样性值”通过如实施例1中所述的方法确定并计算;
“吸烟状态值”在患者有吸烟史时取1,无吸烟史时取0;
SII指数变化百分比值=(治疗后SII-治疗前SII)/治疗前SII,并且
SII=P×N/L,其中P、N和L分别是外周血血小板、中性粒细胞和淋巴细胞的绝对值计数。
预后风险评估模型在训练集、测试集和整个数据集的一致性指数(concordanceindex;C-index)分别是0.726、0.694和0.675,预测效能良好(图5d)。从图5d中可以看出,治疗后TCR多样性、SII治疗前后百分比变化和吸烟状态这三个因素都具有超过0.5的一致性指数,意味着其都可以用来预测预后情况。重要的是,将三个因素整合在一起的本发明的计算模型获得的风险评分,与这三个因素中任何一个单独使用时相比,特别是与SII指数变化或吸烟状态相比,都具有更高的一致性指数,意味着通过本发明的计算模型将三个因素整合在一起,建立了更强力的预后预测体系。
分别计算训练集和测试集患者的风险评分,并通过中位值分组,风险评分较低的为低风险组,风险评分较高的为高风险组。具体来说,将52名训练集患者中风险评分排名前50%以内的26名患者划分为高风险组,另外26名患者为低风险组;将17名测试集患者中风险评分前50%以内的8名患者划分为高风险组,另外9名患者为低风险组。相应地,对于整个数据集中的69名患者而言,34名为高风险,35名为低风险。
制作Kaplan-Meier生存曲线,在曲线上某个时间点上的生存率=上一个时间点的存活率×(当前时间有多少人确实存活/当前时间有多少人可能还活着)=上一个时间点的存活率×(当前时间存活人数/(当前时间存活人数+删失人数))。其中“删失人数”为随访不到的受试者数。在每个发生删失的时间点上,画小竖线标记删失样本。Kaplan-Meier生存曲线如图5a-c所示,可见无论是在训练集还是在测试集或整个数据集中,高风险组的患者无进展生存期较短,低风险组的患者无进展生存期较长,存在显著差异。低风险组显示的患者数为3/2/1时,存在删失数据(随访不到),因此在图上显示为一条直线。
还统计了受试者的HR(hazard ratio)风险比,HR的计算方式为:HR=暴露组的风险函数h1(t)/非暴露组的风险函数h2(t),t指在某一相同的时间点。风险函数指危险率函数、条件死亡率、瞬时死亡率。HR由单因素Cox比例风险回归模型计算得到。HR表示暴露组与非暴露组相比,发生终点事件的风险的比值,是暴露组与非暴露组患者生存情况相比的相对值。HR值大于1,提示暴露因素是阳性事件发生的促进因素。因此,图5a-c中的风险比意味着高风险组疾病进展的风险分别是低风险组的2.72、2.22、1.82倍,进一步验证了本模型确定的低风险组具有更长的无进展生存期。
随后对上述风险评分模型进行可视化的展示,构建了列线图(Nomogram)(图5e)以便于预测晚期肺癌患者的无进展生存期。
- 一种肺癌患者的治疗预后评估模型
- 检测linc00673表达量在食管癌靶向治疗预后评估试剂盒中的应用
