用于治疗色素性视网膜炎的肽
文献发布时间:2023-06-19 10:00:31
技术领域
本发明涉及包含肽、其缀合物等的用于治疗或预防各种疾病的药物组合物,用于鉴定用于治疗或预防各种疾病的肽等的方法等。
背景技术
高温要求A丝氨酸肽酶1(HTRA1)是一种胰蛋白酶样丝氨酸蛋白酶(PRSS11;ClanPA, 家族S1),并且由N-末端结构域、蛋白酶结构域和C-末端PDZ结构域构成,所述N-末端结构域由IGFBP-样模块和Kazal-样模块组成。HTRA1属于包括HTRA2、HTRA3和HTRA4的HTRA家族,并且以与其他HTRA分子相同的方式可逆地表现出活性和非活性结构(非专利文献1和2)。其表达在人体中分布不均,并且在软骨、滑膜、胎盘等中以相对高的水平发现。已知HTRA1切割作为底物的许多细胞外基质成分,诸如淀粉样蛋白前体蛋白、纤维调节蛋白、簇蛋白、ADAM9和玻连蛋白,并且与以关节炎和骨钙化为代表的疾病相关(非专利文献3、4、5和6)。进一步已知,如果HTRA1启动子区域具有基因多态性(rs11200638),则HTRA1转录水平升高。全基因组关联分析还已经揭示,该多态性与年龄相关的黄斑变性(下文中被称为AMD)强烈相关(非专利文献7和8)。然而,与色素性视网膜炎的关联尚未得到充分报道。
色素性视网膜炎是一种进行性视网膜变性疾病,其开始于视杆感光细胞的变性和丧失。由于感光细胞的变性,观察到进行性夜盲、视野狭窄和畏光,导致视敏度下降,并且可能失明。色素性视网膜炎被称为遗传性疾病,并且迄今已鉴定3,000种或更多种引起色素性视网膜炎的基因突变(非专利文献9)。其中,对于单独的视紫红质的基因突变(其代表高比例),已经在人中证实了120种或更多种,并且已经根据分类提出11种导致视杆损失的机理(非专利文献10)。在这种情况下,缩小用于药物发现的靶标分子是极端困难的,并且被认为是使色素性视网膜炎的治疗药物的开发变得困难的因素。因此,期望开发不直接靶向基因的治疗方法(非专利文献11)。
目前没有确立的用于色素性视网膜炎的治疗药物。然而,从许多动物实验和人临床试验,已经确立以下概念作为色素性视网膜炎的潜在治疗(非专利文献9)。即:
a)甚至视杆存活的小改进也导致视锥保护
b)甚至用功能障碍的视杆也可以支持视锥存活
c)如果甚至在黄斑中仅可以保持几个视锥,则可能维持最低的视敏度,例如以能够独自良好行走。
基于这些概念,为了保护视杆或视锥的目的,已经对营养因子、诸如CNTF、丙戊酸、维生素A、二十二碳六烯酸(DHA)等进行临床试验。然而,到目前为止,尚未报道清楚的药物作用,并且没有化合物被FDA批准。
另一方面,目前正在非临床和临床阶段进行积极研究的是通过移植干细胞或分化成视杆的细胞的再生医学。然而,存在许多需要解决的问题,诸如免疫排斥、移植细胞的低存活率、保留率和生物安全性(非专利文献12)。
引文列表
非专利文献
非专利文献1:Truebestein L, 等人, 2011, Nat Struct Mol Biol., Vol. 18 (No.3): p. 386-8
非专利文献2:Eigenbrot C, 等人, 2012, Structure, Vol. 20 (No. 6): p. 1040-50
非专利文献3:Grau S, 等人, 2005, Proc Natl Acad Sci U S A., Vol. 102 (No.17): p. 6021-26
非专利文献4:Grau S, 等人, 2006, J Biol Chem., Vol. 281 (No. 10): p. 6124-29
非专利文献5:Hadfield KD, 等人, 2008, J Biol Chem., Vol. 283, (No. 9): p.5928-38
非专利文献6:An E, 等人, 2010, Invest Ophthalmol Vis Sci., Vol. 51 (No.7): p. 3379-86
非专利文献7:Yang Z, 等人, 2006, Science, Vol. 314 (No. 5801): p. 992-93
非专利文献8:Tang NP, 等人, 2009, Ann Epidemiol., Vol. 19 (No. 10): p.740-45
非专利文献9:Guadagni V, 等人, 2015, Prog Retin Eye Res., Vol. 48: p. 62-81
非专利文献10:Memdes HF 等人, 2005, TRENDS Mol. Medicine, Vol. 11: p. 177-185
非专利文献11:Farrar GJ, 等人, 2002, EMBO J., Vol. 21 (No. 5): p. 857-864
非专利文献12:He Y, 等人, 2014, Int. J. Mol. Sci., Vol. 15 (No. 8): p.14456-14474。
发明概述
技术问题
提供用于治疗或预防色素性视网膜炎的新型药物组合物。
问题的解决方案
本发明涉及:
(1)
用于治疗或预防色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的药物组合物,其包含SPINK2突变肽,所述SPINK2突变肽包含SEQ IDNO:30(图42)中所示的氨基酸序列并抑制人HTRA1的蛋白酶活性;
(2)
根据(1)所述的药物组合物,其中在所述肽中包含的SEQ ID NO:30(图42)中所示的氨基酸序列中,第一个Xaa (X
(3)
根据(1)或(2)所述的药物组合物,其中所述肽包含SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29(图15、17、19、21、23、25、27、29、31、33和35至41)中任一者中所示的氨基酸序列;
(4)
根据(1)至(3)中任一项所述的药物组合物,其中所述肽包含通过经由肽键在SEQ IDNO:30(图42)中所示的氨基酸序列的氨基末端侧添加1至3个氨基酸而制备的氨基酸序列;
(5)
根据(1)至(4)中任一项所述的药物组合物,其中所述肽包含通过经由肽键在SEQ IDNO:30(图42)中所示的氨基酸序列的羧基末端侧添加1或2个氨基酸而制备的氨基酸序列;
(6)
根据(1)至(5)中任一项所述的药物组合物,其中所述肽具有特征在于具有三个二硫键且包含环结构、α螺旋和β折叠的三维结构;
(7)
用于治疗或预防色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的药物组合物,其包含多核苷酸,所述多核苷酸包含编码在根据(1)至(6)中任一项所述的肽中包含的氨基酸序列的核苷酸序列;
(8)
用于治疗或预防色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的药物组合物,其包含载体,所述载体包含编码在根据(1)至(6)中任一项所述的肽中包含的氨基酸序列的核苷酸序列;
(9)
用于治疗或预防色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的药物组合物,其包含:含有包含编码在根据(1)至(6)中任一项所述的肽中包含的氨基酸序列的核苷酸序列的多核苷酸的细胞,或包含所述核苷酸序列的载体,或产生根据(1)至(6)中任一项所述的肽的细胞;
(10)
用于治疗或预防色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的药物组合物,其包含缀合物,所述缀合物包含与额外部分连接的根据(1)至(6)中任一项所述的肽;
(11)
根据(10)所述的药物组合物,其中所述缀合物是多肽;
(12)
根据(1)至(11)中任一项所述的药物组合物,其用于治疗或预防色素性视网膜炎;
(13)
根据(1)至(11)中任一项所述的药物组合物,其用于治疗或预防涉及感光细胞变性的遗传性疾病;
(14)
根据(13)所述的药物组合物,其中所述涉及感光细胞变性的遗传性疾病是黄斑营养不良;
(15)
根据(1)至(11)中任一项所述的药物组合物,其用于治疗或预防与PDE6蛋白功能障碍相关的疾病;
(16)
根据(15)所述的药物组合物,其中所述与PDE6蛋白功能障碍相关的疾病是色盲(achromatopsia)或常染色体显性先天性静止性夜盲;
(17)
根据(1)至(16)中任一项所述的药物组合物,其包含一种或两种或更多种额外的药物;
(18)
根据(1)至(17)中任一项所述的药物组合物,其与一种或两种或更多种额外的药物组合使用;和
(19)
用于鉴定色素性视网膜炎、涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的治疗药物或预防药物的方法,其包括以下步骤1至3:
[步骤1]在测试物质存在和不存在的情况下孵育HTRA1蛋白酶和底物,所述测试物质是包含SEQ ID NO:30(图42)中所示的氨基酸序列的SPINK2突变肽;
[步骤2]在所述测试物质存在和不存在的情况下检测HTRA1蛋白酶活性;和
[步骤3]当在所述测试物质存在的情况下的HTRA1蛋白酶活性低于在所述测试物质不存在的情况下的HTRA1蛋白酶活性时,确定所述测试物质为阳性。
本发明的有利效果
由本发明提供的肽和包含其的药物组合物具有HTRA1抑制活性,并且可用于色素性视网膜炎的治疗或预防等。
附图简述
[图1(A)] 图1(A)是显示比较人、小鼠、大鼠和猴HTRA1间的序列相似性的结果的图。虚线描绘酶促活性结构域(204Gly至364Leu)。
[图1(B)] 图1(B)是显示比较人、小鼠、大鼠和猴HTRA1间的序列相似性的结果的图(续)。
[图2] 图2是显示通过使用肽底物的分解率作为指标评估HTRA1-抑制肽的HTRA1(cat)抑制活性的结果的图。小图A至C各自显示每种抑制肽的评估结果,且小图D显示对照野生型SPINK2的评估结果。
[图3] 图3是显示通过使用肽底物的分解率作为指标评估HTRA1-抑制肽的HTRA1(全长)抑制活性的结果的图(小图A至C)。
[图4(A)] 图4(A)是显示通过使用人玻连蛋白的分解作为指标评估HTRA1-抑制肽的HTRA1 (cat)抑制活性的结果的图。通过使用人玻连蛋白抗体(R&D Systems, Inc.;MAB2349)的Western印迹进行分析。
[图4(B)] 图4(B)是显示通过使用人玻连蛋白的分解作为指标评估HTRA1-抑制肽的HTRA1 (cat)抑制活性的结果的图(续)。
[图5(A)] 图5(A)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分1)。对于使用的每种蛋白酶的名称及其浓度以及底物的名称及其浓度等,参见实施例3。
[图5(B)] 图5(B)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分2)。
[图5(C)] 图5(C)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分3)。
[图5(D)] 图5(D)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分4)。
[图6] 图6是显示通过X-射线晶体学获得的HTRA1 (cat)/HTRA1-抑制肽复合物的图。所述抑制肽与由HTRA1 (cat)形成的HTRA1三聚体的每个分子结合。
[图7] 图7是显示作为单体通过X-射线晶体学获得的HTRA1 (cat)/HTRA1-抑制肽复合物的图。所述抑制肽与HTRA1 (cat)的含有活性中心的区域结合。
[图8] 图8显示H2-Opt的氨基酸序列(SEQ ID NO:54)。N-末端"Mca-I"意指N-(4-甲基香豆基-7-酰胺)-异亮氨酸,且C-末端"(Dnp)K"意指Nε-(2,4-二硝基苯基)-赖氨酸。
[图9] 图9是显示在由光暴露诱导的视网膜损伤的大鼠模型的玻璃体液中的HTRA1的表达增加的图。通过使用人HTRA1/PRSS11抗体(R&D Systems, Inc.; AF2916)的Western印迹进行分析。
[图10] 图10是显示由光暴露诱导的视网膜损伤的大鼠模型的HTRA1-抑制肽施用组抑制视网膜的横截面上的外核层中的核计数的减少的图。对于生理盐水施用组,n = 4,且对于其他组,n = 5。
[图11] 图11是显示通过使用肽底物的分解率作为指标评估五种HTRA1-抑制肽衍生物的HTRA1 (cat)抑制活性的结果的图。
[图12] 图12是显示通过免疫沉淀方法评估三种HTRA1-抑制肽与HTRA1 (cat)的结合的结果的图。
[图13] 图13显示人SPINK2的氨基酸序列(SEQ ID NO:1)。
[图14] 图14显示编码人SPINK2的氨基酸序列的核苷酸序列(SEQ ID NO:2)。
[图15] 图15显示肽H218的氨基酸序列(SEQ ID NO:3)。
[图16] 图16显示编码肽H218的氨基酸序列的核苷酸序列(SEQ ID NO:4)。
[图17] 图17显示肽H223的氨基酸序列(SEQ ID NO:5)。
[图18] 图18显示编码肽H223的氨基酸序列的核苷酸序列(SEQ ID NO:6)。
[图19] 图19显示肽H228的氨基酸序列(SEQ ID NO:7)。
[图20] 图20显示编码肽H228的氨基酸序列的核苷酸序列(SEQ ID NO:8)。
[图21] 图21显示肽H308的氨基酸序列(SEQ ID NO:9)。
[图22] 图22显示编码肽H308的氨基酸序列的核苷酸序列(SEQ ID NO:10)。
[图23] 图23显示肽H321的氨基酸序列(SEQ ID NO:11)。
[图24] 图24显示编码肽H321的氨基酸序列的核苷酸序列(SEQ ID NO:12)。
[图25] 图25显示肽H322的氨基酸序列(SEQ ID NO:13)。
[图26] 图26显示编码肽H322的氨基酸序列的核苷酸序列(SEQ ID NO:14)。
[图27] 图27显示肽衍生物H308AT的氨基酸序列(SEQ ID NO:15)。
[图28] 图28显示编码肽衍生物H308AT的氨基酸序列的核苷酸序列(SEQ ID NO:16)。
[图29] 图29显示肽衍生物H321AT的氨基酸序列(SEQ ID NO:17)。
[图30] 图30显示编码肽衍生物H321AT的氨基酸序列的核苷酸序列(SEQ ID NO:18)。
[图31] 图31显示肽衍生物H322AT的氨基酸序列(SEQ ID NO:19)。
[图32] 图32显示编码肽衍生物H322AT的氨基酸序列的核苷酸序列(SEQ ID NO:20)。
[图33] 图33显示肽M7的氨基酸序列(SEQ ID NO:21)。
[图34] 图34显示编码肽M7的氨基酸序列的核苷酸序列(SEQ ID NO:22)。
[图35] 图35显示肽衍生物H308_S16A的氨基酸序列(SEQ ID NO:23)。
[图36] 图36显示肽衍生物H308_D1G_S16A的氨基酸序列(SEQ ID NO:24)。
[图37] 图37显示肽衍生物H308_D1S_S16A的氨基酸序列(SEQ ID NO:25)。
[图38] 图38显示肽衍生物H308_D1E_S16A的氨基酸序列(SEQ ID NO:26)。
[图39] 图39显示肽衍生物H308_D1SLI_S16A的氨基酸序列(SEQ ID NO:27)。
[图40] 图40显示肽衍生物H321AT_D1S_S16A的氨基酸序列(SEQ ID NO:28)。
[图41] 图41显示肽衍生物H322AT_D1S_S16A的氨基酸序列(SEQ ID NO:29)。
[图42] 图42显示HTRA1-抑制肽的通式(SEQ ID NO:30)。X
[图43] 图43显示由S标签和接头组成的氨基酸序列(SEQ ID NO:31)。
[图44] 图44显示C-末端六聚体的氨基酸序列(SEQ ID NO:32)。
[图45] 图45显示引物1的核苷酸序列(SEQ ID NO:33)。
[图46] 图46显示引物2的核苷酸序列(SEQ ID NO:34)。
[图47] 图47显示引物3的核苷酸序列(SEQ ID NO:35)。
[图48] 图48显示引物4的核苷酸序列(SEQ ID NO:36)。
[图49] 图49显示引物5的核苷酸序列(SEQ ID NO:37)。
[图50] 图50显示引物6的核苷酸序列(SEQ ID NO:38)。
[图51] 图51显示引物7的核苷酸序列(SEQ ID NO:39)。
[图52] 图52显示引物8的核苷酸序列(SEQ ID NO:40)。
[图53] 图53显示引物9的核苷酸序列(SEQ ID NO:41)。
[图54] 图54显示引物10的核苷酸序列(SEQ ID NO:42)。
[图55] 图55显示引物11的核苷酸序列(SEQ ID NO:43)。
[图56] 图56显示引物12的核苷酸序列(SEQ ID NO:44)。
[图57] 图57显示引物13的核苷酸序列(SEQ ID NO:45)。
[图58] 图58显示引物14的核苷酸序列(SEQ ID NO:46)。
[图59] 图59显示引物15的核苷酸序列(SEQ ID NO:47)。
[图60] 图60显示引物16的核苷酸序列(SEQ ID NO:48)。
[图61] 图61显示引物17的核苷酸序列(SEQ ID NO:49)。
[图62] 图62显示引物18的核苷酸序列(SEQ ID NO:50)。
[图63] 图63显示引物19的核苷酸序列(SEQ ID NO:51)。
[图64] 图64显示引物20的核苷酸序列(SEQ ID NO:52)。
[图65] 图65显示人HTRA1 (全长)的氨基酸序列(SEQ ID NO:53)。
[图66(A)] 图66(A)是显示通过使用肽底物的分解率作为指标评估HTRA1-抑制肽的HTRA1 (cat)抑制活性的结果的图。
[图66(B)] 图66(B)是显示通过使用肽底物的分解率作为指标评估HTRA1-抑制肽的HTRA1 (全长)抑制活性的结果的图。
[图67] 图67是显示通过使用人玻连蛋白的分解作为指标评估HTRA1-抑制肽的HTRA1 (cat)抑制活性的结果的图。通过使用人玻连蛋白抗体(R&D Systems, Inc.;MAB2349)的Western印迹进行分析。
[图68(A)] 图68(A)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分1)。
[图68(B)] 图68(B)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分2)。
[图68(C)] 图68(C)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分3)。
[图68(D)] 图68(D)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分4)。
[图68(E)] 图68(E)是显示通过使用肽底物的分解作为指标评估HTRA1-抑制肽与每种蛋白酶的交叉反应性的结果的图(部分5)。
[图69] 图69是显示通过免疫沉淀方法评估三种HTRA1-抑制肽与HTRA1 (cat)的结合的结果的图。
[图70(A)] 图70(A)是显示由光暴露诱导的视网膜损伤的大鼠模型的HTRA1-抑制肽H308_D1G_S16A施用组抑制视网膜的横截面上的外核层中的核计数的减少的图。对于所有组,n = 6。HTRA1-抑制肽H308_D1G_S16A的剂量为0.2和1 μg/眼。
[图70(B)] 图70(B)是显示由光暴露诱导的视网膜损伤的大鼠模型的HTRA1-抑制肽H321AT_D1G_S16A施用组抑制视网膜的横截面上的外核层中的核计数的减少的图。对于所有组,n = 6。HTRA1-抑制肽H321AT_D1G_S16A的剂量为0.2和1 μg/眼。
[图70(C)] 图70(C)是显示由光暴露诱导的视网膜损伤的大鼠模型的HTRA1-抑制肽H322AT_D1G_S16A施用组抑制视网膜的横截面上的外核层中的核计数的减少的图。对于所有组,n = 6。HTRA1-抑制肽H322AT_D1G_S16A的剂量为0.2和1 μg/眼。
[图71(A)] 图71(A)是显示用ZO-1抗体(Thermo Fisher Scientific Inc.)对12周龄兔、3岁兔和负载HFD-HQ的3岁兔中的RPE细胞进行免疫染色的结果的图。
[图71(B)] 图71(B)显示12周龄兔、3岁兔和负载HFD-HQ的3岁兔中的RPE细胞的平均面积。
[图71(C)] 图71(C)是显示负载HFD-HQ的3岁兔的视网膜组织中的作为AMD-相关因子的补体组分3 "C3"的mRNA的增加表达的图。
[图71(D)] 图71(D)是显示负载HFD-HQ的3岁兔的RPE /脉络膜组织中的作为AMD-相关因子的补体组分3 "C3"的mRNA的增加表达的图。
[图71(E)] 图71(E)是显示通过LC-MS/MS测量12周龄兔、3岁兔和负载HFD-HQ的3岁兔中的玻璃体液的HTRA1浓度的结果的图。
[图72(A)] 图72(A)是显示负载HFD-HQ的3岁兔的HTRA1-抑制肽H308施用组表现出对RPE细胞的肥大的抑制作用的图。对于所有组,n = 5。平均面积用作指标。
[图72(B)] 图72(B)是显示负载HFD-HQ的3岁兔的HTRA1-抑制肽H308施用组表现出对RPE细胞的肥大的抑制作用的图。对于所有组,n = 5。具有1500 μm
[图73] 图73是显示比较人、猴、兔、小鼠和大鼠HTRA1间的序列相似性的结果的图。虚线描绘酶促活性结构域(204Gly至364Leu)。
[图74] 图74是显示HTRA1-抑制肽表现出对通过添加H
[图75] 图75是显示HTRA1-抑制肽表现出对由血清诱导的人脐静脉内皮细胞(HUVEC)的迁移的抑制作用的图。
[图76] 图76显示引物21的核苷酸序列。
[图77] 图77显示引物22的核苷酸序列。
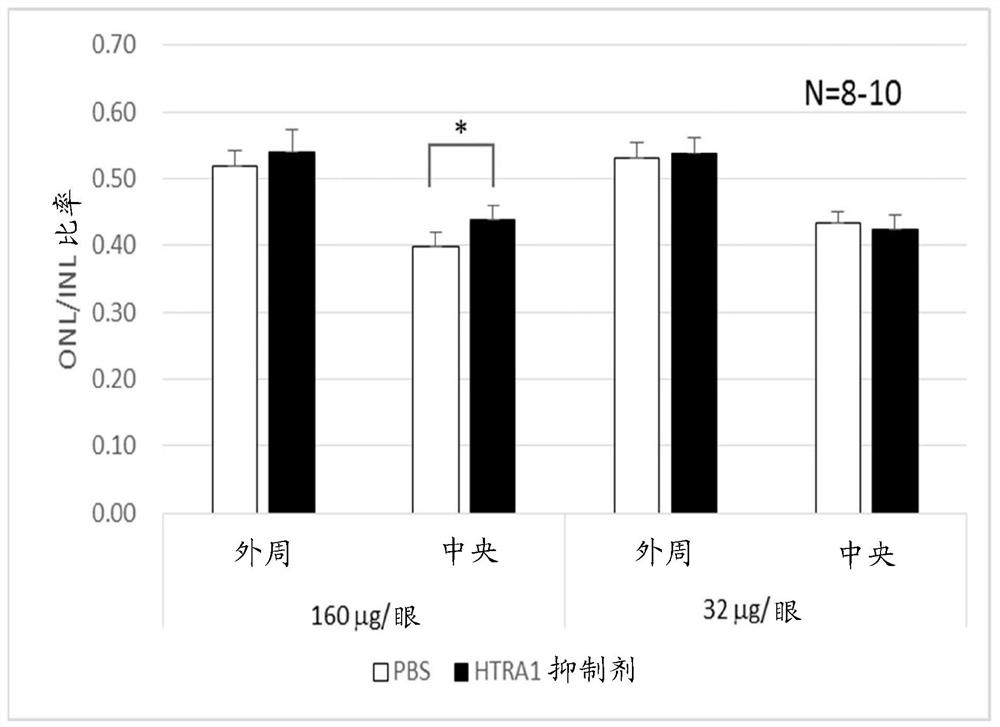
[图78] 图78是这样的图,其显示160 μg/眼施用组的中央部分中的ONL/INL比率与对照PBS组中相比显著增加,且当向Rd10小鼠(B6.CXB1-Pde6b
在本发明中,短语“SEQ ID NO:X (图Y)”或“图Y (SEQ ID NO:X)”意指该序列显示于SEQ ID NO:X中或显示于图Y中。
实施方案的描述
1. 定义
在本发明中,术语“基因”用于意指包含编码蛋白中含有的氨基酸序列的核苷酸序列或其互补链的核酸分子。所述基因由单链、双链或三链或更多链组成。DNA链和RNA链的缔合物,在一条链上共存的核糖核苷酸和脱氧核糖核苷酸以及包括这种链的双链或三链或更多链的核酸分子也包括在术语“基因”的含义内。
在本发明中,术语“基因”、“多核苷酸”和“核酸分子”与彼此同义,并且不以任何方式受到其组成单元、诸如核糖核苷酸、脱氧核糖核苷酸、核苷酸和核苷的数目的限制。例如,DNA、RNA、mRNA、cDNA、cRNA、探针、寡核苷酸、引物等也包括在其范围内。术语“核酸分子”也缩写为“核酸”。
在本发明中,术语“多肽”、“肽”和“蛋白”与彼此同义。抑制或遏制靶标分子X(下文中,这些抑制或遏制作用被统称为“X抑制活性”)的一种或两种或更多种活性或功能的肽可以被称为“X-抑制肽”。
术语“SPINK2”用于意指丝氨酸蛋白酶抑制剂Kazal-2型。该7 kDa的蛋白由具有三个二硫键的Kazal-样结构域组成。SPINK2优选是人来源的。在本发明中,人SPINK2被简称为“SPINK2”,除非另有指明。
术语“HTRA1”用于意指高温要求A丝氨酸肽酶1。该蛋白由以下构成:由IGFBP-样模块和Kazal-样模块组成的N-末端结构域、蛋白酶结构域和C-末端PDZ结构域,并且该蛋白属于HTRA家族。HTRA1优选是人来源的。在本发明中,人HTRA1也简称为“HTRA1”,除非另有指明。
术语“HTRA1-抑制肽”用于意指抑制或遏制HTRA1的一种或两种或更多种活性或功能的肽。术语“HTRA1-抑制肽”的范围内包括维持HTRA1抑制活性的所述肽的片段、所述肽与额外的部分的加合物或所述肽的缀合物。具体地,在术语“HTRA1-抑制肽”内还包括维持HTRA1抑制活性的所述肽的片段、加合物和修饰形式。
在本发明中,术语“细胞”用于包括源自动物个体的各种细胞,亚培养的细胞,原代培养的细胞,细胞系,重组细胞,酵母,微生物等。
在本发明中,术语肽结合的“位点”,即被肽识别的“位点”,用于意指待被肽结合或识别的靶标分子上的连续或间断的部分氨基酸序列或部分构象。在本发明中,这种位点可以被称为靶标分子上的表位或结合位点。
术语“SPINK2突变体”用于意指这样的肽,所述肽包含通过一个或两个或更多个氨基酸被不同于野生型氨基酸的氨基酸取代、缺失一个或两个或更多个野生型氨基酸、插入一个或两个或更多个野生型中不存在的氨基酸和/或将野生型中不存在的一个或多个氨基酸添加至野生型的氨基末端(N末端)和/或羧基末端(C末端)(下文中统称为“突变”)而衍生自野生型SPINK2的氨基酸序列的氨基酸序列。具有HTRA1抑制活性的“SPINK2突变体”包括在HTRA1-抑制肽中。在本发明中,“插入”也可以包括在“添加”中。
在本发明中,短语“一个或几个”中的术语“几个”是指3至10。
在本发明中,短语"在严格条件下杂交"用来意指在其中在65℃下在含有5 × SSC的溶液中实施杂交且然后将所得物在65℃下在含有2 × SSC和0.1% SDS的水溶液中洗涤20分钟、在65℃下在含有0.5 × SSC和0.1% SDS的水溶液中洗涤20分钟且在65℃下在含有0.2 × SSC和0.1% SDS的水溶液中洗涤20分钟的条件下或在与之等效的条件下实施杂交。SSC意指150 mM NaCl和15 mM柠檬酸钠的水溶液,且"n × SSC"意指n倍浓度的SSC。
在本发明中,术语“特异性的”和“特异性”分别与术语“选择性的”和“选择性”同义且可互换。例如,HTRA1-特异性抑制肽与HTRA1-选择性抑制肽同义。
2. 肽
2-1. 氨基酸
术语“氨基酸”用于意指含有氨基和羧基的有机化合物,且意指作为优选蛋白中且更优选天然蛋白中的构成单元含有的α-氨基酸。在本发明中,所述氨基酸更优选为Ala、Arg、Asn、Asp、Cys、Gln、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr和Val。术语“氨基酸”用于意指这些总共20种氨基酸,除非另有指定。这些总共20种氨基酸可以被称为“天然氨基酸”。本发明的HTRA1-抑制肽优选含有天然氨基酸。
在本发明中,术语“氨基酸残基”也被称为“氨基酸”。
在本发明中,所述氨基酸可以是L-氨基酸、D-氨基酸或其混合物(DL-氨基酸),并且意指L-氨基酸,除非另有指定。
基于侧链的共同特性,天然氨基酸可以被分为例如以下组:
(1)疏水氨基酸组:Met、Ala、Val、Leu和Ile;
(2)中性亲水氨基酸组:Cys、Ser、Thr、Asn和Gln;
(3)酸性氨基酸组:Asp和Glu;
(4)碱性氨基酸组:His、Lys和Arg;
(5)影响主链的方向的氨基酸组:Gly和Pro;和
(6)芳香族氨基酸组:Trp、Tyr和Phe。
然而,天然氨基酸的分类不限于此。
在本发明中,每个天然氨基酸可以接受保守的氨基酸取代。
术语“保守氨基酸取代”意指被功能上等效或相似的氨基酸取代。肽中的保守氨基酸取代带来肽的氨基酸序列中的静态变化。例如,具有相似极性的一个或两个或更多个氨基酸取代功能上等效地发挥作用,并且带来肽的氨基酸序列中的静态变化。通常,在结构和功能的方面,特定组内的取代可以被认为是保守的。然而,对于本领域技术人员将显而易见的是,特定氨基酸残基的作用可以通过其在含有该氨基酸的分子的三维结构中的位置来确定。例如,半胱氨酸残基可以采取极性比还原(硫醇)形式的极性更低的氧化(二硫化物)形式。精氨酸侧链的长脂族部分能够构成结构和功能上重要的特征。或者,含有芳香族环的侧链(色氨酸、酪氨酸和苯丙氨酸)能够促成离子-芳香族相互作用或阳离子-π相互作用。在这种情况下,甚至具有这些侧链的氨基酸被属于酸性或非极性组的氨基酸取代也可以在结构和功能上是保守的。残基,诸如脯氨酸、甘氨酸和半胱氨酸(二硫化物形式)可能对主链的三维结构具有直接影响,并且在没有结构扭曲的情况下经常无法被取代。
保守的氨基酸取代包括如下所示的基于侧链相似性的特异性取代(L.Lehninger, Biochemistry, 第2版, pp.73-75, Worth Publisher, New York (1975))和典型的取代。
(1)非极性氨基酸组:丙氨酸(下文中被称为“Ala”或简称“A”),缬氨酸(下文中被称为“Val”或简称“V”),亮氨酸(下文中被称为“Leu”或简称“L”),异亮氨酸(下文中被称为“Ile”或简称“I”),脯氨酸(下文中被称为“Pro”或简称“P”),苯丙氨酸(下文中被称为“Phe”或简称“F”),色氨酸(下文中被称为“Trp”或简称“W”)和甲硫氨酸(下文中被称为“Met”或简称“M”)
(2)不带电荷的极性氨基酸组:甘氨酸(下文中被称为“Gly”或简称“G”),丝氨酸(下文中被称为“Ser”或简称“S”),苏氨酸(下文中被称为“Thr”或简称“T”),半胱氨酸(下文中被称为“Cys”或简称“C”),酪氨酸(下文中被称为“Tyr”或简称“Y”),天冬酰胺(下文中被称为“Asn”或简称“N”)和谷氨酰胺(下文中被称为“Gln”或简称“Q”)
(3)酸性氨基酸组:天冬氨酸(下文中被称为“Asp”或简称“D”)和谷氨酸(下文中被称为“Glu”或简称“E”)
(4)碱性氨基酸组:赖氨酸(下文中被称为“Lys”或简称“K”),精氨酸(下文中被称为“Arg”或简称“R”)和组氨酸(下文中被称为“His”或简称“H”)
在本发明中,氨基酸可以是除了天然氨基酸以外的氨基酸。其实例可以包括硒代半胱氨酸、N-甲酰基甲硫氨酸、吡咯赖氨酸、焦谷氨酸、胱氨酸、羟基脯氨酸、羟基赖氨酸、甲状腺素、O-磷酸丝氨酸、锁链素、β-丙氨酸、肌氨酸、鸟氨酸、肌酸、γ-氨基丁酸、opine、茶氨酸、口蘑氨酸、红藻氨酸、软骨藻酸和acromelic acid (其在天然的肽或蛋白中找到),并且可以包括:N-末端保护的氨基酸,诸如正亮氨酸、Ac-氨基酸、Boc-氨基酸、Fmoc-氨基酸、Trt-氨基酸和Z-氨基酸;C-末端保护的氨基酸,诸如氨基酸的叔丁酯、苄酯、环己酯和芴酯;以及自然界中未发现的其他氨基酸,包括二胺、ω氨基酸、β氨基酸、γ氨基酸、氨基酸的Tic衍生物和氨基膦酸。为了方便起见,除了20种“天然氨基酸”以外的氨基酸不限于此,并且在本发明中统称为“非天然氨基酸”。
2-2. HTRA1-抑制肽
本发明的HTRA1-抑制肽是至少部分维持SPINK2的框架的SPINK2突变体(下文中被称为“SPINK2突变体”),并且抑制或遏制HTRA1或保留其酶活性的片段(下文中被称为“功能片段”)的蛋白酶活性(在下文中,将这种抑制和遏制统称为“HTRA1抑制活性”)。
作为本发明的抑制肽的靶标的HTRA1优选为哺乳动物HTRA1,更优选为灵长类动物HTRA1,且仍更优选为人HTRA1。全长成熟人HTRA1 (下文中被称为“HTRA1(全长)”)的氨基酸序列具有SEQ ID NO:53(图65)中所示的氨基酸序列。该氨基酸序列由位置23至480组成,并且没有由位置1至22组成的信号序列。人HTRA1的功能片段(下文中被称为“HTRA1 (cat)”)的氨基酸序列没有特别限制,只要功能片段保留蛋白酶活性。其实例可以包括由SEQ IDNO:53(图65)的158Gly至373Lys组成的功能片段,以及包含其158Gly至373Lys的功能片段。作为本发明的抑制肽的靶标的HTRA1或其功能片段也称为HTRA1蛋白酶。HTRA1蛋白酶优选为脊椎动物来源的,更优选为哺乳动物来源的,仍更优选是灵长类动物来源的,且最优选为人来源的,并且可以通过从任何这些动物的组织或细胞纯化或通过本领域技术人员已知为蛋白制备方法的方法(诸如基因重组、体外翻译或肽合成)来制备。HTRA1或其功能片段可以连接至信号序列、免疫球蛋白Fc区、标签、标记物等。
HTRA1抑制活性可以通过使用HTRA1的蛋白酶活性作为指标进行评估。例如,使HTRA1或其功能片段、底物和本发明的抑制肽或其候选物彼此共存。在这种情况下,当HTRA1的蛋白酶活性与在对照存在的情况下或抑制剂或其候选物不存在的情况下的蛋白酶活性相比为70%或更少、50%或更少、30%或更少、20%或更少、10%或更少、5%或更少、1%或更少或0%时,发生HTRA1的抑制,其中抑制活性分别为30%或更多、50%或更多、70%或更多、80%或更多、90%或更多、95%或更多、99%或更多或100%。所述HTRA1抑制活性可以根据反应条件、底物类型、浓度等而不同。反应条件的实例可以包括但不限于实施例中所述的那些。酶活性可以通过如下来评估:将底物肽或底物蛋白添加至给定浓度的HTRA1,并使混合物反应给定时间,随后检测底物肽的荧光或通过SDS-PAGE、Western印迹、液相色谱等检测底物蛋白。例如,磷酸盐缓冲盐水(下文中被称为“PBS”)、硼酸盐缓冲液(50 mM硼酸盐,pH 7至9,例如pH 8.5)或Tris缓冲液(50 mM Tris,pH 6至9,例如,pH 8.0)可用作缓冲溶液。可以将NaCl (50至300 mM,例如,150 mM)或表面活性剂、诸如CHAPS或辛基β-D-吡喃葡萄糖苷添加至反应体系中,尽管所述添加剂不限于此。
HTRA1蛋白酶的底物的实例包括但不特别限于内源底物、外源底物和合成底物。人内源底物的实例可以包括玻连蛋白。合成底物的实例可以包括但不特别限于H2-Opt (Mca-IRRVSYSFK(Dnp)K)、β-酪蛋白和其他HTRA1底物。本发明的肽的HTRA1抑制活性(IC
优选的是,本发明的抑制肽不应抑制或遏制除了HTRA1以外的蛋白酶的活性,或应具有相对弱程度的这种活性的抑制或遏制。换言之,本发明的抑制肽优选具有高HTRA1特异性。优选地,本发明的抑制肽不抑制或遏制蛋白酶、诸如胰蛋白酶、α-胰凝乳蛋白酶、类胰蛋白酶、纤溶酶、凝血酶、matriptase、蛋白C、组织纤溶酶原激活剂(tPA)、尿激酶(uPA)、纤溶酶或血浆激肽释放酶的活性,或具有相对弱程度的此类活性的抑制或遏制。本发明的这种优选的肽没有表现出由其他蛋白酶的活性的抑制或遏制引起的不良反应,并且可以优选地用作HTRA1相关疾病(上面提及)的治疗药物或预防药物。
如上所提及,作为本发明的肽的靶标的HTRA1优选为脊椎动物来源的,更优选为哺乳动物来源的,仍更优选为灵长类动物来源的,且最优选为人来源的。或者,作为本发明的肽的靶标的HTRA1可以源自非人动物,例如,啮齿动物,诸如大鼠或小鼠,或灵长类动物,诸如食蟹猴,普通狨猴或猕猴。具有针对非人动物来源的HTRA1的抑制活性的肽可以用于非人动物中的HTRA1相关疾病的诊断、检查、治疗或预防等。当这种肽还抑制人HTRA1时,非人动物可以用于:作为人HTRA1相关疾病的治疗药物或预防药物的肽的非临床研究和开发中;或使用非人动物作为疾病的动物模型进行药理学测试或药代动力学测试;或者使用非人动物作为健康动物进行安全性测试、毒性测试等。
本发明的HTRA1-抑制肽具有诸如以下的优点:分子量小于其他生物分子(诸如本领域中用作药剂和诊断药物的抗体)的分子量;其生产相对容易(后面提及);在组织渗透性、储存稳定性、热稳定性等方面优异的物理特性;和用作药物组合物的施用途径、施用方法、制备等的宽选择范围(后面提及)。可以通过应用已知方法,诸如添加生物分子或聚合物,且由此增加肽的分子量,来调节用作药物组合物的本发明的肽在血液中的半衰期,以使其更长。本发明的这种HTRA1-抑制肽的分子量小于10,000,优选小于8,000,且更优选约7,000至7,200。本发明的HTRA1-抑制肽内还包括由SEQ ID NO:23(图29)的15Cys至31Cys组成的可变环部分或由其15Cys至63Cys组成(下文中被称为“含有六个Cys残基的部分”)且具有HTRA1抑制活性的部分。可变环部分的分子量小于2,500,且优选为约1,800至2,000。含有六个Cys残基的部分的分子量小于6,000,且优选为约5,300至5,500。
本发明的HTRA1-抑制肽的范围内包括的至少部分维持SPINK2的框架的SPINK2突变体(下文中被称为“SPINK2突变体”)可以结合HTRA1,并且能够结合优选哺乳动物HTRA1、更优选灵长类动物HTRA1且仍更优选人HTRA1。结合HTRA1的这种肽识别或结合HTRA1的部分肽、部分构象等(下文中,此类识别和结合作用被统称为“靶标结合活性”)。
在一个方面,本发明的抑制肽能够结合HTRA1的免疫原性片段。HTRA1的免疫原性片段具有一个或两个或更多个表位、模拟表位或其他抗原决定簇,且因此能够诱导免疫应答或能够引起针对待产生的片段的抗体。
根据本发明的SPINK2突变体与HTRA1或与其免疫原性片段的结合可以通过使用本领域技术人员已知的方法、诸如测量可检测的结合亲和力(ELISA,表面等离振子共振(下文中被称为“SPR”)分析(也称为“BIAcore”方法)、等温滴定量热法(下文中被称为“ITC”)、流式细胞术、免疫沉淀方法等)来评估、测量或测定。
ELISA的实例包括涉及检测已经识别并结合至固定在板上的HTRA1的HTRA1-抑制肽的方法。HTRA1的固定可以采用生物素-链霉抗生物素蛋白,以及例如识别与HTRA1融合的标签的用于固定的抗体。HTRA1-抑制肽的检测可以采用标记的链霉抗生物素蛋白以及例如标记的识别与HTRA1-抑制肽融合的标签的用于检测的抗体。标记可以采用生物素以及在生物化学分析中可行的方法,诸如HRP、碱性磷酸酶或FITC。使用酶促标记的检测可以采用发色底物,诸如TMB (3,3',5,5'-四甲基联苯胺),BCIP (5-溴-4-氯-3-吲哚基磷酸酯),p-NPP(对硝基苯基磷酸酯),OPD(邻苯二胺),ABTS (3-乙基苯并噻唑啉-6-磺酸)或SuperSignalELISA Pico化学发光底物(Thermo Fisher Scientific Inc.),荧光底物,诸如QuantaBlu(TM)荧光过氧化物酶底物(Thermo Fisher Scientific Inc.),和化学发光底物。检测信号的测量可以采用吸收板读取器、荧光板读取器、发光板读取器、RI液体闪烁计数器等。
用于SPR分析中的仪器的实例包括BIAcore(TM) (GE Healthcare),ProteOn(TM)(Bio-Rad Laboratories, Inc.),SPR-Navi(TM) (Oy BioNavis Ltd.),Spreeta(TM)(Texas Instruments Inc.),SPRi-PlexII(TM) (HORIBA, Ltd.),和Autolab SPR(TM)(Metrohm AG)。用于BLI中的仪器的实例可以包括Octet(TM) (Pall Corp.)。
免疫沉淀方法的实例包括涉及检测已经识别并结合至固定在珠粒上的HTRA1-抑制肽的HTRA1的方法。磁性珠粒、琼脂糖珠粒等可以用作珠粒。HTRA1-抑制肽的固定可以采用生物素-链霉抗生物素蛋白以及识别该肽或与该肽、蛋白A或蛋白G等融合的标签的抗体。使用磁体、离心等分离珠粒,并且通过SDS-PAGE或Western印迹检测与珠粒沉淀的HTRA1。HTRA1的检测可以采用标记的链霉抗生物素蛋白以及例如标记的识别与HTRA1融合的标签的用于检测的抗体。标记可以采用生物素以及在生物化学分析中可行的方法,诸如HRP、碱性磷酸酶或FITC。使用酶促标记的检测可以采用与ELISA中相同的底物。检测信号的测量可以采用ChemiDoc(TM) (Bio-Rad Laboratories, Inc.)、LuminoGraph (ATTO Corp.)等。
在本发明中,术语“特异性识别”,即,“特异性结合”,用于意指不是非特异性吸附的结合。用于确定结合是否特异性的标准的实例包括ELISA中的结合活性EC
尽管进行了上述描述,但对于充当本发明的抑制肽的SPINK2突变体,结合HTRA1或其免疫原性片段的能力不是必需的,只要所述SPINK2突变体具有HTRA1抑制活性。
本发明的抑制肽在蛋白酶底物与HTRA1的结合中可能是竞争性的。
在一些优选的方面,本发明的抑制肽具有视网膜保护作用。例如,本发明的优选抑制剂可以遏制由光暴露诱导的视网膜损伤的模型中的外核层中的核计数的光暴露诱导的减少,其在实施例中详细描述。与非暴露组相比,在该模型的光暴露组的玻璃体液中已检测到更大量的HTRA1蛋白。因此,本发明公开了:HTRA1参与视网膜损伤;且HTRA1抑制活性带来视网膜保护作用。
充当本发明的抑制肽的SPINK2突变体可以具有如上所述的活性、特性、功能、特征等,而其全长氨基酸序列与人野生型SPINK2的氨基酸序列具有高序列同一性。本发明的SPINK2突变体与人SPINK2的氨基酸序列(SEQ ID NO:1:图13)具有60%或更高、70%或更高、75%或更高、80%或更高、85%或更高、90%或更高、95%或更高、98%或更高或99%或更高的序列同一性。
术语“同一性”用于意指指示两个序列之间的相似性或关系的程度的特性。通过将相同氨基酸或氨基酸残基的数目除以氨基酸或氨基酸残基的总数并将所得的数值乘以100来计算氨基酸序列的同一性(%)。
术语"空位"用于意指作为两个或更多个序列中的至少一个中的缺失和/或添加的结果的两个或更多个序列之间的比对中的空间。
具有完全相同的氨基酸序列的两个氨基酸序列之间的同一性是100%。如果所述氨基酸序列之一与另一个氨基酸序列相比具有一个、两个或更多个氨基酸或氨基酸残基的取代、缺失或添加,则这两个氨基酸序列之间的同一性低于100%。用于在考虑空位的情况下确定两个序列之间的同一性的算法或程序的实例可以包括本领域技术人员已知的那些,诸如BLAST (Altschul, 等人, Nucleic Acids Res., Vol. 25, p. 3389-3402, 1997)、BLAST2 (Altschul, 等人, J. Mol. Biol., Vol. 215, p. 403-410, 1990)和Smith-Waterman (Smith, 等人, J. Mol. Biol., Vol. 147, p. 195-197, 1981)。
在本发明中,术语“突变的”用于意指与天然存在的核酸分子或肽相比,在核苷酸序列或氨基酸序列中取代、缺失或插入一个或两个或更多个核苷酸或核苷酸残基或氨基酸或氨基酸残基。与人SPINK2的氨基酸序列相比,本发明的SPINK2突变体的氨基酸序列具有一个或两个或更多个突变的氨基酸或氨基酸残基。
在本发明的一个方面,所述SPINK2突变体的氨基酸序列可以具有以下中的任一者:
人SPINK2的氨基酸序列(SEQ ID NO:1:图13)中的16Ser至22Gly的1、2、3、4、5、6或7个氨基酸被其他氨基酸或氨基酸残基取代;
人SPINK2的氨基酸序列(SEQ ID NO:1:图13)中的24Pro至28Asn的1、2、3、4或5个氨基酸被其他氨基酸或氨基酸残基取代;
人SPINK2的氨基酸序列(SEQ ID NO:1:图13)中的39Ala和43Thr的1或2个氨基酸被其他氨基酸或氨基酸残基取代,
或者可以具有这些氨基酸作为野生型氨基酸(在α螺旋中包括2个氨基酸或氨基酸残基),只要由位置16至30等处的氨基酸残基构成的环的主链的三级结构能够至少部分发挥HTRA1抑制活性;为了维持天然的二硫键,15Cys、23Cys、31Cys、42Cys、45Cys和63Cys各自优选为Cys,与野生型一样。其中1、2、3、4、5或6个可以被其他氨基酸取代,以便缺失天然的二硫键或生成非天然的二硫键。在本发明的SPINK2突变体中的一些优选的HTRA1-抑制肽维持这6个位置处的Cys,与天然SPINK2中一样,并且保留二硫键。在这种抑制肽的一些更优选形式中,15Cys-45Cys、23Cys-42Cys和31Cys-63Cys分别形成二硫键。
当这种SPINK2突变体的氨基酸序列包含在HTRA1-抑制肽中时,优选的是,在可以发挥HTRA1抑制活性的程度上,应当维持野生型SPINK2的氨基酸序列中含有的由以下构成的三维结构:例如由16Ser至30Val组成的环结构,由31Cys和32Gly组成的β链(1)和57Ile至59Arg组成的β链(2)构成的β折叠,由41Glu至51Gly组成的α螺旋,或与其类似或与其(或与这些位置)至少部分对应的环结构、β折叠或α螺旋。
下面将提及本发明的SPINK2突变体中的一些HTRA1-抑制肽的氨基酸序列。如上所提及,在本发明中,术语“氨基酸残基”也简称为“氨基酸”。
SEQ ID NO:30(图42)中的所示的氨基酸序列中的第一个至第十一个Xaa(其分别与X1至X11相同)各自是任何任意氨基酸,而没有特别限制,只要所得突变体结合HTRA1且抑制HTRA1活性。在下文中,将描述X1至X11的优选氨基酸。然而,这些氨基酸可以包括天然氨基酸,即与野生型人SPINK2的氨基酸序列中的那些相同的氨基酸。
位置1处的X1优选为Asp、Glu、Gly、Ser或Ile,更优选为Asp或Gly,且仍更优选为Gly;
位置16处的X2 优选为Ala、Asp、Glu、Phe、Gly、His、Lys、Leu、Met、Gln、Arg、Ser、Thr或Tyr,更优选为Ala、Asp、Gly、His、Lys、Leu、Met、Gln、Arg、Ser或Thr,仍更优选为Ala、Gly、Lys、Leu、Ser或Thr,进一步优选为Ala、Gly、Leu、Ser或Thr,且仍进一步优选为Ala或Ser;
位置17处的X3优选为Ala、Asp、Glu、Gly、His、Lys、Leu、Met、Asn、Gln、Arg、Ser、Thr或Tyr,更优选为Asp、Gly、His、Lys、Leu、Met、Asn、Gln、Arg、Ser、Thr或Tyr,仍更优选为Asp、His、Lys、Met或Gln,且进一步优选为Asp或Gln;
位置18处的X4 优选为Ala、Asp、Glu、Phe、Gly、His、Ile、Leu、Lys、Met、Asn、Gln、Arg、Ser、Thr、Val、Trp或Tyr,更优选为Asp、Phe、His、Met、Asn、Gln、Ser或Tyr,仍更优选为Asp、Phe、His、Ser或Tyr,且进一步优选为Phe或His;
位置19处的X5 优选为Ala、Asp、Glu、Gly、His、Ile、Lys、Met、Asn、Gln、Arg、Ser、Thr、Val或Tyr,更优选为Ala、Asp、Glu、Gly、His、Lys、Met、Asn、Gln、Arg、Ser或Val,仍更优选为Ala、Asp、Glu、Met或Asn,且进一步优选为Ala、Asp或Glu;
位置21处的X6优选为Ala、Glu、Phe、Gly、Ile、Leu、Met、Gln、Arg、Ser、Trp或Tyr,更优选为Glu、Phe、Ile、Leu、Met、Gln、Arg或Trp,仍更优选为Met或Trp,进一步优选为Met;
位置24处的X7优选为Ala、Asp、Glu、Phe、Gly、His、Lys、Leu、Met、Pro、Gln、Arg、Ser、Thr、Val、Trp或Tyr,更优选为Asp、Glu、His、Pro、Gln、Ser、Thr、Val、Trp或Tyr,仍更优选为Gln、Trp、Tyr或Val,且进一步优选为Tyr或Val;
位置26处的X8优选为Ala、Asp、Glu、Phe、His、Ile、Lys、Leu、Met、Asn、Gln、Arg、Ser、Val或Tyr,更优选为Ala、Phe、His、Ile、Leu、Met、Gln、Arg、Ser、Val或Tyr,仍更优选为Phe、Leu或Tyr,且进一步优选为Phe或Leu;
位置27处的X9优选为Glu、Phe、Leu、Ser、Thr或Tyr,更优选为Phe、Leu、Ser、Thr或Tyr,仍更优选为Phe或Tyr,进一步优选为Tyr;
位置39处的X10优选为Ala、Glu、Met或Val,且更优选为Ala或Glu;且
位置43处的X11 优选为Ala、Thr或Val,更优选为Thr或Val。
野生型X1至X11分别为Asp、Ser、Gln、Tyr、Arg、Pro、Pro、His、Phe、Ala和Thr。位置20为Leu,位置22为Gly,位置25为Arg,位置28为Asn。
在本发明中,可以将一个或几个或更多个氨基酸进一步添加至第一氨基酸的N-末端侧。待添加的此类氨基酸的实例可以包括Ser-Leu,和由S标签和接头组成的氨基酸序列(SEQ ID NO:31:图43)。
可以将一个或几个氨基酸进一步添加至位于C末端的63Cys。这种氨基酸序列的实例可以包括通过添加Gly-Gly而在C末端具有64Gly的氨基酸序列和在C末端具有65Gly的氨基酸序列。待添加的这种氨基酸的实例可以包括Gly-Gly,和C末端六聚体(SEQ ID NO:32:图44)。
通过将其他氨基酸添加至SEQ ID NO:30(图42)中所示的氨基酸序列的N末端和/或C末端而制备的氨基酸序列或衍生自SEQ ID NO:30的氨基酸序列的一种更优选形式包括SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29(图15、17、19、21、23、25、27、29、31、33和35至41)中任一者中所示的氨基酸序列,以及由SEQ ID NO:4、6、8、10、12、14、16、18、20和22(图16、18、20、22、24、26、28、30、32和34)中任一者中所示的核苷酸序列编码的氨基酸序列。其仍更优选的形式包括SEQ ID NO:24、28和29(图36、40和41)中任一者中所示的氨基酸序列。
在本发明中,通过在、向或从SPINK2突变肽或SPINK2突变肽的N-末端和/或C-末端加合物(下文中被称为“亲本肽”)取代、添加和/或缺失一个或两个或更多个氨基酸而制备的肽被称为“亲本肽的衍生物”或“亲本肽衍生物”(例如,实施例6)。这种“衍生物”也包括在本发明的“肽”的范围内。
在本发明的抑制肽的范围内包括的SPINK2突变体的氨基酸序列可以在野生型人SPINK2的氨基酸序列(SEQ ID NO:1:图13)中的除了X1至X11以外的部分、即2Pro至15Cys、20Pro、22Gly、23Cys、25Arg、28Asn至38Tyr、41Glu、42Cys和44Thr至63Cys的位置处包含天然氨基酸或突变的氨基酸或氨基酸序列。例如,所述SPINK2突变体可以在一个或两个或更多个位置处具有突变,只要至少部分既不阻碍、也不干扰HTRA1抑制活性或折叠。这种突变通过使用本领域技术人员已知的标准方法获得。氨基酸序列中突变的典型实例可以包括一个、两个或更多个氨基酸的取代、缺失或添加。取代的实例可以包括保守取代。保守取代用不仅在体积而且在极性方面化学特征与之相似的氨基酸残基取代某些氨基酸残基。保守取代的实例描述于本说明书的其他部分中。另一方面,除了X1至X11以外的部分可以接受一个或两个或更多个氨基酸的非保守取代,只要至少部分既不阻碍、也不干扰HTRA1抑制活性或折叠。
在充当本发明的抑制肽的SPINK2突变体的氨基酸序列中,在SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29(图15、17、19、21、23、25、27、29、31、33和35至41)和更优选SEQID NO:24、28和29(图36、40和41)中任一者中,X1至X11分别优选为氨基酸X1至X11,并且除了X1-X11以外的部分可以具有至少部分既不阻碍、也不干扰HTRA1抑制活性或折叠的氨基酸或氨基酸序列。
充当本发明的HTRA1-抑制肽的SPINK2突变体的氨基酸序列的实例可以包括以下氨基酸序列(a)至(e)中的任一者:
(a) SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29(图15、17、19、21、23、25、25、29、31、33和35至41)中任一者中所示的氨基酸序列;
(b)由核苷酸序列编码的氨基酸序列,所述核苷酸序列在严格条件下与和编码氨基酸序列(a)的核苷酸序列互补的核苷酸序列杂交,且编码具有HTRA1抑制活性的肽中包含的氨基酸序列;
(c)通过取代、缺失、添加和/或插入1至20、1至15、1至10、1至8、1至6、1至5、1至4、1至3、1或2或1个氨基酸而衍生自氨基酸序列(a)且包含在具有HTRA1抑制活性的肽中的氨基酸序列;
(d)与氨基酸序列(a)具有60%、70%、80%、85%、90%、92%、94%、96%、97%、98%或99%或更高同一性且包含在具有HTRA1抑制活性的肽中的氨基酸序列;和
(e)由SEQ ID NO:4、6、8、10、12、14、16、18、20和22(图16、18、20、22、24、26、28、30、32至34)中任一者中所示的核苷酸序列编码的氨基酸序列。
然而,编码HTRA1-抑制肽的核酸分子不限于(a)至(e)。包含编码具有HTRA1抑制活性的SPINK2突变体中含有的氨基酸序列和优选地SEQ ID NO:30(图42)中所示的氨基酸序列的核苷酸序列的每个核酸分子都包括在编码HTRA1-抑制肽的核酸分子的范围内。
为了提高其折叠稳定性、热稳定性、储存稳定性、血液中的半衰期、水溶性、生物活性、药理活性、次要作用等的目的,可以将突变引入本发明的抑制肽中。例如,可以通过突变向其中引入新的反应性基团、诸如Cys,以便将抑制肽与额外物质、诸如聚乙二醇(PEG)、羟乙基淀粉(HES)、生物素、肽或蛋白缀合。在本发明中,可以将HTRA1-抑制肽添加、连接或结合至额外的部分。此类缀合物统称为“HTRA1-抑制肽的缀合物”。在本发明中,术语“缀合物”用于意指添加、连接或结合至额外的部分的本发明的肽或其片段的分子。术语“缀合(conjugate)”或“缀合(conjugation)”包括这样的形式,其中特定部分经由适合于将特定部分连接至氨基酸的侧链的试剂等(包括化学物质,诸如交联剂)通过合成化学方法、基因工程改造方法等连接或结合至本发明的肽的N末端和/或C末端。用于提高血液中的半衰期的这种“部分”的实例可以包括聚亚烷基二醇分子,诸如聚乙二醇(PEG),羟乙基淀粉,脂肪酸分子,诸如棕榈酸,免疫球蛋白Fc区,免疫球蛋白CH3结构域,免疫球蛋白CH4结构域,白蛋白或其片段,白蛋白结合肽,白蛋白结合蛋白,诸如链球菌蛋白G和转铁蛋白。或者,“部分”可以经由接头、诸如肽接头连接至本发明的肽。
为了发挥或增强药理活性,本发明的HTRA1-抑制肽可以与额外药物缀合。在抗体的领域中,通过用本发明的肽替代抗体,本领域技术人员已知为抗体-药物缀合物(ADC)的技术或形式构成本发明的一些方面。
本发明的HTRA1-抑制肽可以进一步包含一个或两个或更多个针对除了HTRA1以外的靶标分子发挥结合亲和力、抑制活性、拮抗活性、激动活性等的部分,或者可以与此类部分缀合。“部分”的实例可以包括抗体或其片段,以及具有非抗体框架的蛋白,诸如SPINK2突变体,或其片段。在抗体的领域中,通过用本发明的肽替代其中包含的至少一个或两个或更多个“抗体”,本领域技术人员已知为多特异性抗体和双特异性抗体的技术或形式构成本发明的缀合物的一些方面。
本发明的肽或其前体可以包含信号序列。在特定多肽或其前体的N末端存在或向其添加的信号序列可用于将多肽递送至细胞的特定区室,例如大肠杆菌的周质或真核细胞的内质网。许多信号序列是本领域技术人员已知的,并且可以根据宿主细胞选择信号序列。用于将期望的肽分泌至大肠杆菌的周质中的信号序列的实例可以包括OmpA。包含信号序列的形式也可以包括在本发明的缀合物的一些方面内。
本发明的肽可以预先标记,且由此通过亲和色谱法纯化。本发明的肽可以在其C-末端包含例如生物素、Strep标签(TM)、Strep标签II(TM)、寡组氨酸诸如His6、聚组氨酸、免疫球蛋白结构域、麦芽糖-结合蛋白、谷胱甘肽-S-转移酶(GST)、钙调蛋白-结合肽(CBP)、半抗原诸如洋地黄毒苷或二硝基苯酚、表位标签诸如FLAG(TM)、myc标签或HA标签(下文中统称为“亲和标签”)。标记的形式也可以包括在本发明的缀合物的一些方面内。本发明的缀合物作为整体可以是肽(多肽)。
本发明的肽可以包含用于标记的部分。具体地,本发明的肽可以与标记部分诸如酶促标记物、放射性标记物、有色标记物、荧光标记物、显色色标记物、发光标记物、半抗原、洋地黄毒苷、生物素、金属络合物、金属或胶体金缀合。包含用于标记的部分的形式也可以包括在本发明的缀合物的一些方面内。
本发明的抑制肽可以在其肽部分中包含天然氨基酸和非天然氨基酸中的任一种,并且可以包含L-氨基酸和D-氨基酸作为天然氨基酸。
本发明的抑制肽的氨基酸序列可以包含天然氨基酸和非天然氨基酸中的任一种,并且可以包含L-氨基酸和D-氨基酸作为天然氨基酸。
本发明的抑制肽可以作为单体、二聚体或三聚体或更高寡聚体或多聚体存在。所述二聚体或三聚体或更高寡聚体或多聚体可以是由单一单体构成的同型形式和由两种或更多种不同单体构成的异型形式中的任一种。例如,所述单体可以快速扩散并且在渗透至组织中是优异的。所述二聚体、寡聚体和多聚体可以具有优异的方面,例如,对于靶标分子的高局部亲和力或结合活性,缓慢的解离速率,或高HTRA1抑制活性。除了自发二聚化、寡聚化和多聚化以外,还通过将jun-fos结构域、亮氨酸拉链等引入本发明的抑制肽中来实现意欲的二聚化、寡聚化和多聚化。
本发明的抑制肽可以以单体、二聚体或三聚体或更高寡聚体或多聚体的形式结合一个或两个或更多个靶标分子,或抑制靶标分子的活性。
本发明的抑制肽可以采取的形式的实例可以包括但不限于分离的形式(冷冻干燥的制剂、溶液等),上面提及的缀合物以及与其他分子结合的形式(固定的形式,与不同分子的缔合形式,与靶标分子结合的形式等)。可以任意选择与表达、纯化、使用、储存等相容的形式。
3. HTRA1-抑制肽的鉴定
可以通过本领域技术人员众所周知的方法,使用起始材料、诸如SPINK2的氨基酸序列或本发明的HTRA1-抑制肽的氨基酸序列(例如,选自SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29,或选自图15、17、19、21、23、25、27、29、31、33和35至41的氨基酸序列)、编码所述氨基酸序列的核苷酸序列或包含所述核苷酸序列的核酸分子来鉴定HTRA1-抑制肽。作为一个优选的实例,可以通过使用HTRA1抑制活性作为指标(其可以与作为另一种指标的HTRA1结合活性组合),从人SPINK2突变体文库鉴定HTRA1-抑制肽。
例如,可以通过使用重组DNA技术诱变充当起始材料的核酸分子,并将其转移至适当的细菌宿主或真核宿主中。SPINK2突变体文库已知为用于鉴定靶标分子的结合剂或抑制剂的技术。例如,WO2012/105616的公开内容也以其整体通过引用并入本文。在适当的宿主中表达诱变的核苷酸序列后,可以从文库富集和/或选择其中具有期望的特性、活性、功能等的SPINK2突变体与其基因型连接的克隆,并且进行鉴定。克隆的富集和/或选择采用本领域技术人员已知的方法,诸如细菌展示方法(Francisco, J.A., 等人, (1993), Proc.Natl. Acad. Sci. U.S.A. Vol. 90, p. 10444-10448),酵母展示方法(Boder, E.T., 等人, (1997), Nat. Biotechnol., Vol. 15, p. 553-557),哺乳动物细胞展示方法(Ho M,等人, (2009), Methods Mol Biol., Vol. 525: p. 337-52),噬菌体展示方法(Smith,G.P. (1985), Science., Vol. 228, p. 1315-1317),核糖体展示方法(Mattheakis LC,等人, (1994), Proc. Natl. Acad. Sci. U.S.A. Vol. 91, No. 19, p. 9022-9029),核酸展示方法,诸如mRNA展示(Nemoto N, 等人, (1997), FEBS Lett., Vol. 414, No. 2,p. 405-408),或集落筛选方法(Pini, A. 等人, (2002), Comb. Chem. High ThroughputScreen., Vol. 5, p. 503-510)。可以确定因此选择和鉴定的克隆中含有的SPINK2突变体的核苷酸序列,以便将由所述核苷酸序列编码的氨基酸序列确定为克隆中含有的SPINK2突变体的氨基酸序列,即HTRA1-抑制肽。
本发明的SPINK2突变体可以例如通过诱变天然SPINK2而获得。术语“诱变”用于意指在特定氨基酸序列的其各自位置处的一个或两个或更多个氨基酸可以被其他氨基酸取代,或缺失,或者可以向其中添加或插入所述氨基酸序列中不存在的氨基酸。这种缺失或这种添加或插入可以改变序列长度。在本发明的SPINK2突变体中,诱变可以优选地发生在SEQID NO:30(图42)中所示的氨基酸序列中X1至X11的一个或两个或更多个位置处。
然而,所述突变体的范围内还包括在这种优选的诱变后维持在X1至X11中的一个或两个或更多个位置处的天然氨基酸、即与天然氨基酸序列中的特定位置处存在的氨基酸相同的氨基酸的形式,只要在整体上突变至少一个氨基酸。同样,在本发明的一个方面,所述突变体的范围内还包括在除了X1至X11以外的部分的一个或多个位置处诱变后维持在这些位置处的天然氨基酸、即与天然氨基酸序列中的特定位置处存在的氨基酸相同的氨基酸的形式,只要在整体上突变至少一个氨基酸。
术语“随机诱变”用于意指对于序列上的特定位置,通过诱变以给定的概率将一个或两个或更多个不同的氨基酸引入该位置。引入至少两个不同氨基酸的概率可能并不总是相同的。本发明不排除所述至少两个不同的氨基酸包括天然存在的氨基酸(作为氨基酸之一)。这种情况也包括在术语“随机诱变”的范围内。
可以将本领域技术人员已知的标准方法用作在特定位置进行随机诱变的方法。诱变可以通过例如使用在序列中的特定位置处包括简并核苷酸组成的合成寡核苷酸的混合物的PCR(聚合酶链式反应)来实现。例如,使用密码子NNK或NNS (N =腺嘌呤、鸟嘌呤、胞嘧啶或胸腺嘧啶;K =鸟嘌呤或胸腺嘧啶;且S =鸟嘌呤或胞嘧啶)引起诱变,以引入任何所有20种天然氨基酸以及终止密码子,而使用密码子VVS (V =腺嘌呤、鸟嘌呤或胞嘧啶)消除引入Cys、Ile、Leu、Met、Phe、Trp、Tyr和Val的可能性,并且引起诱变以引入任何剩余的12种天然氨基酸。例如,使用密码子NMS (M = 腺嘌呤或胞嘧啶)消除引入Arg、Cys、Gly、Ile、Leu、Met、Phe、Trp和Val的可能性,并且引起诱变以引入任何剩余的11种天然氨基酸。特定密码子、人工密码子等可以用于诱变以引入非天然氨基酸。
也可以通过使用关于含有构象的靶标和/或针对靶标的肽或衍生所述肽的野生型肽的结构信息进行定点诱变。在本发明中,可以通过使用关于靶标HTRA1和/或针对靶标的SPINK2突变体或野生型SPINK2或其之间的复合物的结构信息来引入定点突变,所述结构信息包括高阶信息。在一个实例中,鉴定具有HTRA1抑制活性的SPINK2突变体。随后,获得HTRA1和SPINK2突变体的晶体复合物,并进行X-射线晶体学分析。基于分析结果,鉴定SPINK2突变体结合的HTRA1分子上的位点,以及参与与该位点的相互作用的SPINK2突变体中的氨基酸残基。可以发现通过此类方法获得的结构信息与HTRA1抑制活性的相关性。基于这种结构-活性相关性,可以设计特定位置处的氨基酸被特定氨基酸取代,在特定位置处的氨基酸的插入或缺失等,以实际证实HTRA1活性。
诱变还可以使用例如具有修饰碱基对特异性的核苷酸组成单元、诸如肌苷来实现。
此外,通过例如使用缺乏错误校正功能并且产生高错误率的DNA聚合酶(诸如TaqDNA聚合酶)的易错PCR或化学诱变来实现随机位置处的诱变。
可以通过使用细菌展示、酵母展示、哺乳动物细胞展示、噬菌体展示、核糖体展示、核酸展示、集落筛选等来从适合于各自的筛选方法并且是本领域技术人员已知的文库、诸如噬菌体文库或集落文库富集和/或选择所述HTRA1-抑制肽。这些文库可以使用载体和方法、诸如用于噬菌体文库的噬菌粒或用于集落筛选的粘粒(其适合于每种文库并且是本领域技术人员已知的)进行构建。这种载体可以是感染原核细胞或真核细胞的病毒或病毒载体。这些重组载体可以通过本领域技术人员已知的方法、诸如遗传操作来制备。
细菌展示是一种将期望的蛋白与例如一部分大肠杆菌外膜脂蛋白(Lpp)和外膜蛋白OmpA融合并在大肠杆菌的表面上展示期望的蛋白的技术。将通过随机诱变编码特定蛋白的氨基酸序列的核苷酸序列获得的DNA组插入适合于细菌展示的载体中,并用所述载体转化细菌细胞,以获得在转化的细菌细胞表面上展示随机诱变的蛋白组的文库(Francisco,J.A., 等人, (1993), Proc. Natl. Acad. Sci. U.S.A. Vol. 90, p. 10444-10448)。
酵母展示是一种将期望的蛋白与外壳蛋白(诸如,在酵母的细胞表面上的α-凝集素)融合并在酵母的表面上展示期望的蛋白的技术。α-凝集素包含具有推定的糖基磷脂酰肌醇(GPI)锚定附接信号的C-末端疏水区、信号序列、活性结构域、细胞壁结构域等。通过对其进行操作,可以将期望的蛋白展示在酵母的细胞表面上。将通过随机诱变编码特定蛋白的氨基酸序列的核苷酸序列获得的DNA组插入适合于酵母展示的载体中,并用所述载体转化酵母细胞,以获得在转化的酵母的细胞表面上展示随机诱变的蛋白组的文库(Ueda, M.&Tanaka, A., Biotechnol. Adv., Vol. 18, p. 121-, 2000; Ueda, M.& Tanaka, A.,J. Biosci. Bioeng., Vol. 90, p. 125-, 2000; 等)。
动物细胞展示是一种将期望的蛋白与例如以血小板衍生的生长因子受体(PDGFR)为代表的膜蛋白的跨膜区融合并在哺乳动物细胞(例如,HEK293和中国仓鼠卵巢(CHO)细胞)的表面上展示期望的蛋白的技术。将通过随机诱变编码特定蛋白的氨基酸序列的核苷酸序列获得的DNA组插入适合于动物细胞展示的载体中,并且可以用所述载体转化酵母细胞,以获得在转化的动物细胞的表面上展示随机诱变的蛋白组的文库(Ho M, 等人,(2009), Methods Mol Biol. Vol. 525: p. 337-52)。
在细胞、诸如酵母细胞、细菌细胞或动物细胞上展示的期望的文库可以在靶标分子存在的情况下孵育或与靶标分子接触。例如,将涉及文库的细胞与用生物素等修饰的HTRA1孵育给定时间。然后,向其中添加支持物、诸如磁性珠粒,并且将细胞与支持物分离。随后,可以洗涤支持物以除去非特异性吸附物质和结合物质,以回收展示与支持物(其具有与之结合的HTRA1)结合的肽、肽集合或富集的肽集合的细胞群体。同样,可以分别在添加磁性珠粒后通过磁活化的细胞分选(MACS)或在使用抗HTRA1抗体进行细胞染色后通过FACS,可以回收展示与支持物(其具有与之结合的HTRA1)结合的肽、肽集合或富集的肽集合的细胞群体,或展示与HTRA1结合的肽、肽集合或富集的肽集合的细胞群体。例如,可以封闭(饱和)非特异性吸附位点和/或结合位点。本文可以并入封闭步骤,只要通过适当的方法进行封闭。回收因此获得的表达的肽、肽集合或富集的肽集合的载体,并且可以确定插入载体中的多核苷酸的核苷酸序列,以确定由核苷酸序列编码的氨基酸序列。此外,可以将载体再次转移至宿主细胞中,并且可以将上面提及的操作循环重复一次至几次以高度富集结合靶标分子的肽集合。
在噬菌体展示的情况下,例如,噬菌粒是一种细菌质粒,其含有质粒复制起点以及源自单链细菌噬菌体的第二复制起点。具有噬菌粒的细胞可以通过用M13或与其类似的辅助噬菌体共感染而经由单链复制模式复制噬菌粒。具体地,将单链噬菌粒DNA包装至以噬菌体外壳蛋白为外壳的感染颗粒中。以这种方式,噬菌粒DNA可以在感染的细菌中形成为克隆双链DNA质粒,而噬菌粒可以从共感染细胞的培养上清液形成为细菌噬菌体样颗粒。将细菌噬菌体样颗粒注射至具有F-菌毛的细菌中,用于用DNA感染细菌,使得可以将颗粒本身重新形成质粒。
将包含具有编码测试肽的氨基酸序列的核苷酸序列的多核苷酸和噬菌体外壳蛋白基因的融合基因插入噬菌粒,并用所得噬菌粒感染细菌。培养细胞,使得该肽可以在细菌上或在噬菌体样颗粒上表达或展示,或者可以作为与外壳蛋白的融合蛋白产生至噬菌体颗粒中或细菌的培养上清液中。
例如,将包含所述多核苷酸和细菌噬菌体外壳蛋白基因gpIII的融合基因插入噬菌粒,并将大肠杆菌用所得的噬菌粒和M13或与其类似的辅助噬菌体共感染,使得可以产生包含所述肽和所述外壳蛋白的融合蛋白并且将其释放至大肠杆菌的培养上清液中。
在使用各种环状或非环状载体(例如病毒载体)代替噬菌粒的情况下,根据本领域技术人员已知的方法,具有由插入载体中的多核苷酸的核苷酸序列编码的氨基酸序列的肽可以在携带所述载体的细胞或病毒样颗粒上表达或展示,或者可以产生和释放至细胞的培养上清液中。
因此获得的表达肽的文库可以在靶标分子存在的情况下孵育,或与靶标分子接触。例如,将HTRA1-固定的支持物与含有所述文库的流动相孵育给定时间。然后,将流动相与支持物分离。随后,洗涤所述支持物以除去非特异性吸附物质和结合物质。可以通过洗脱回收与支持物(其具有与之结合的HTRA1)结合的肽、肽集合或富集的肽集合。所述洗脱可以例如在相对高离子强度、低pH、中等变性条件或离液盐存在的情况下非选择性进行,或者可以通过添加可溶性靶标分子(诸如HTRA1)、结合靶标分子的抗体、天然配体、底物等并与固定的靶标分子竞争来选择性进行。例如,可以封闭非特异性吸附位点和/或结合位点。可以本文可以并入封闭步骤,只要通过适当的方法进行封闭。
回收因此获得的表达的肽、肽集合或富集的肽集合的载体,并且可以测定插入载体中的多核苷酸的核苷酸序列,以确定由所述核苷酸序列编码的氨基酸序列。此外,可以将所述载体再次转移至宿主细胞中,并且可以将上面提及的操作循环重复一次至几次以高度富集结合靶标分子的肽集合。
核糖体展示是这样的技术,其使用例如编码期望的蛋白且缺乏终止密码子的mRNA和无细胞蛋白合成系统,且由此在体外合成期望的蛋白的分子、其相应的mRNA和与彼此连接的核糖体。通过使用通过随机诱变编码特定蛋白的氨基酸序列的核苷酸序列获得的mRNA组和无细胞蛋白合成系统,可以获得在核糖体上展示随机诱变的蛋白组的文库(Mattheakis LC, 等人, (1994) Proc. Natl. Acad. Sci. U.S.A. Vol. 91, No. 19,p. 9022-9029)。
核酸展示,也称为mRNA展示,是这样的技术,其使用例如接头、诸如在结构上与酪氨酰tRNA的3'末端相似的嘌呤霉素,且由此合成期望的蛋白的分子、其编码mRNA和与彼此连接的核糖体。该技术采用无细胞蛋白合成系统,而不是活细胞,且因此允许体外合成。通过使用通过随机诱变编码特定蛋白的氨基酸序列的核苷酸序列获得的mRNA组、接头(诸如嘌呤霉素)和无细胞蛋白合成系统,可以获得在核糖体上展示随机诱变的蛋白组的文库(Nemoto N, 等人, (1997), FEBS Lett., Vol. 414, No. 2, p. 405-408)。
经由无细胞合成系统、诸如核糖体展示或核酸展示获得的展示肽的文库可以在靶标分子存在的情况下孵育,或与靶标分子接触。例如,将HTRA1-固定的支持物与含有所述文库的流动相孵育给定时间。然后,将流动相与支持物分离。随后,洗涤所述支持物以除去非特异性吸附物质和结合物质。可以通过洗脱回收与支持物(其具有与之结合的HTRA1)结合的肽、肽集合或富集的肽集合。所述洗脱可以例如在相对高离子强度、低pH、中等变性条件或离液盐存在的情况下非选择性进行,或者可以通过添加可溶性靶标分子(诸如HTRA1)、结合靶标分子的抗体、天然配体、底物等并与固定的靶标分子竞争来选择性进行。例如,可以封闭非特异性吸附位点和/或结合位点。本文可以并入封闭步骤,只要通过适当的方法进行封闭。
回收因此获得的表达的肽、肽集合或富集的肽集合的核酸。在mRNA的情况下,可以在逆转录反应成cDNA后确定核苷酸序列,以确定由所述核苷酸序列编码的氨基酸序列。此外,将回收的核酸转录成mRNA,并且可以将上面提及的操作循环重复一次至几次以高度富集结合靶标分子的肽集合。
如果所述肽、肽集合或富集的肽集合预先与亲和标签缀合,则可以有效地纯化所述肽或集合。例如,所述肽集合预先与作为标签的蛋白酶底物缀合,使得可以通过经由蛋白酶活性的切割来洗脱肽。
基于获得的序列信息和肽的功能等,可以进一步诱变获得的克隆或文库,并且可以从突变的文库获得其功能(例如,HTRA1抑制活性)、物理特性(热稳定性、储存稳定性等)、体内动力学(血液中的分布和半衰期)等改善的肽。
可以通过确定获得的肽是否具有HTRA1抑制活性来鉴定HTRA1-抑制肽。
在可以发挥HTRA1抑制活性的程度上,所述HTRA1-抑制肽优选能够维持野生型SPINK2的氨基酸序列中含有的由以下构成的三维结构:例如由16Ser至30Val组成的环结构,由31Cys和32Gly组成的β链(1)和57Ile至59Arg组成的β链(2)构成的β折叠,和由41Glu至51Gly组成的α螺旋,或与其类似或与其(或与这些位置)至少部分对应的环结构、β折叠或α螺旋。可以通过使用这种三维结构(整体结构或部分结构)作为指标的一部分来鉴定更优选的HTRA1-抑制肽。
4. 编码HTRA1-抑制肽的核酸分子,包含所述核酸分子的载体,包含所述核酸分子或所述载体的细胞以及用于产生重组HTRA1-抑制肽的方法
本发明还提供了包含编码在HTRA1-抑制肽中含有的氨基酸序列的核苷酸序列的多核苷酸(下文中被称为“编码HTRA1-抑制肽的核酸分子”),具有所述基因的插入物的重组载体,携带所述基因或载体的细胞(下文中被称为“含有编码HTRA1-抑制肽的核酸分子的细胞”)或产生HTRA1-抑制肽的细胞(下文中被称为“产生HTRA1-抑制肽的细胞”)。
编码本发明的HTRA1-抑制肽的核酸分子的一些优选实例可以包括包含以下核苷酸序列(a)至(e)中任一者的核酸分子(下文中被称为“HTRA1-抑制肽的核苷酸序列”),由包含HTRA1-抑制肽的核苷酸序列的核苷酸序列组成的核酸分子,和由HTRA1-抑制肽的核苷酸序列组成的核酸分子:
(a)核苷酸序列,其编码SEQ ID NO:3、5、7、9、11、13、15、17、19、21和23至29(图15、17、19、21、23、25、25、29、31、33和35至41)中任一者中所示的氨基酸序列;
(b) SEQ ID NO:4、6、8、10、12、14、16、18、20和22(图16、18、20、22、24、26、28、30、32至34)中任一者中所示的核苷酸序列;
(c)核苷酸序列,其在严格条件下与和核苷酸序列(a)或(b)互补的核苷酸序列杂交且编码具有HTRA1抑制活性的肽中包含的氨基酸序列;
(d)核苷酸序列,其通过取代、缺失、添加和/或插入1至20、1至15、1至10、1至8、1至6、1至5、1至4、1至3、1或2或1个核苷酸或核苷酸残基而衍生自核苷酸序列(a)或(b),且编码在具有HTRA1抑制活性的肽中包含的氨基酸序列;
(e)核苷酸序列,其与核苷酸序列(a)或(b)具有60%、70%、80%、85%、90%、92%、94%、96%、97%、98%或99%或更高同一性,且编码在具有HTRA1抑制活性的肽中包含的氨基酸序列。
然而,编码HTRA1-抑制肽的核酸分子不限于核苷酸序列(a)至(e)。包含编码具有HTRA1抑制活性的SPINK2突变体中包含的氨基酸序列和优选地SEQ ID NO:30(图42)中所示的氨基酸序列的核苷酸序列的每个核酸分子都包括在编码HTRA1-抑制肽的核酸分子的范围内。
可以使用对应于每个氨基酸的一个或两个或更多个密码子来设计编码氨基酸序列的核苷酸序列。因此,编码特定肽的单一氨基酸序列的核苷酸序列可以具有多个变异。为了选择此类密码子,可以根据用于表达的宿主细胞的密码子使用来适当地选择密码子,所述宿主细胞用于携带包含核苷酸序列的多核苷酸或包含所述多核苷酸的载体,或者可以适当地调整使用的多种密码子的频率或速率。例如,在使用大肠杆菌细胞作为宿主细胞的情况下,可以使用在大肠杆菌中具有高使用频率的密码子来设计核苷酸序列。
编码HTRA1-抑制肽的核酸分子可以功能性连接至一个或两个或更多个调节序列。短语“功能性连接”用于意指可以表达连接的核酸分子,或者所述分子中含有的核苷酸序列是可表达的。调节序列包括提供关于转录调节和/或翻译调节的信息的序列元件。尽管调节序列根据物种而变化,但该调节序列通常包括启动子并包括参与转录和翻译的起始的5'非编码序列,例如原核-35/-10盒和Shine-Dalgarno序列或真核TATA框、CAAT序列和5'加帽序列。该序列可以包含增强子元件和/或阻遏子元件,和可翻译的信号序列、前导序列等,用于将天然或成熟的肽递送至宿主细胞内部或外部的特定隔室。所述调节序列可以进一步包括3'非编码序列,并且该序列可以包含参与转录终止或聚腺苷酸化等的元件。然而,当在特定宿主细胞中功能不足时,与转录终止相关的序列可以被适用于细胞的序列取代。
启动子序列的实例可以包括原核tet启动子、lacUV5启动子和T7启动子,以及用于真核细胞的SV40启动子和CMV启动子。
编码HTRA1-抑制肽的核酸分子可以呈分离的形式或者呈在载体或另一种克隆媒介物(下文中,简称为“载体”;质粒、噬菌粒、噬菌体、杆状病毒、粘粒等)或在染色体中含有的形式,但形式不限于此。除了HTRA1-抑制肽的核苷酸序列和调节序列以外,所述载体还可以包含适合于用于表达的宿主细胞的复制序列和控制序列,以及赋予表型的选择标记,所述表型允许选择通过转化等携带核酸分子的细胞。
可以通过本领域技术人员已知的方法、诸如转化将编码HTRA1-抑制肽的核酸分子或包含HTRA1-抑制肽的核苷酸序列的载体转移至能够表达所述肽或核苷酸序列的宿主细胞中。可以在适合于表达所述肽或核苷酸序列的条件下培养携带所述核酸分子或载体的宿主细胞。所述宿主细胞可以是原核和真核细胞中的任一种。原核生物的实例可以包括大肠杆菌和枯草芽孢杆菌。真核细胞的实例可以包括酵母细胞、诸如酿酒酵母和巴斯德毕赤酵母,昆虫细胞、诸如SF9和High5,以及动物细胞、诸如HeLa细胞、CHO细胞、COS细胞和NS0。通过使用宿主细胞、诸如真核细胞表达的本发明的肽可以经历期望的翻译后修饰。翻译后修饰的实例可以包括添加官能团、诸如糖链,添加肽或蛋白,和转化氨基酸的化学特性。或者,可以根据期望人工修饰本发明的肽。所述肽的这种修饰形式也包括在本发明的“肽”的范围内。
本发明还包括用于产生HTRA1-抑制肽的方法。所述方法包括:步骤1:培养携带编码所述HTRA1-抑制肽的核酸分子或包含所述HTRA1-抑制肽的核苷酸序列的载体的宿主细胞,或表达所述HTRA1-抑制肽的细胞;和/或步骤2:从步骤1中获得的培养物回收所述HTRA1-抑制肽。可以将本领域技术人员已知的操作(诸如分级分离、色谱或纯化)应用于步骤2。例如,使用后面提及的本发明的抗体的亲和纯化可应用于此。
在本发明的一些方面,所述HTRA1-抑制肽具有分子内二硫键。可以优选的是,应当通过使用信号序列等将具有分子内二硫键的肽递送至具有氧化性氧化还原环境的细胞隔室。氧化环境可以由革兰氏阴性细菌、诸如大肠杆菌的周质、革兰氏阳性细菌的细胞外环境、真核细胞的内质网腔等提供。这种环境能够促进结构二硫键的形成。或者,可以在宿主细胞、诸如大肠杆菌细胞的细胞质中制备具有分子内二硫键的肽。在这种情况下,该肽可以以可溶性折叠状态直接获得或以包涵体的形式回收且随后在体外重构。此外,选择具有氧化性细胞内环境的宿主细胞,并且还可以在其细胞质中制备具有分子内二硫键的肽。另一方面,当所述HTRA1-抑制肽不具有分子内二硫键时,可以在具有还原性氧化还原环境的细胞隔室、例如革兰氏阴性细菌的细胞质中制备该肽。
本发明的HTRA1-抑制肽还可以通过本领域技术人员已知的其他方法来产生,所述其他方法诸如化学合成,例如Merrifield等人的固相肽合成方法,和使用叔丁氧基羰基(Boc)或9-芴基甲氧基羰基(Fmoc)的有机合成化学肽合成方法,和体外翻译。
5. 药物组合物
本发明还提供了包含所述HTRA1-抑制肽或其缀合物的药物组合物。
包含本发明的HTRA1-抑制肽或其缀合物的药物组合物可用于治疗和/或预防各种疾病,所述疾病由HTRA1诱导或恶化并且允许通过抑制或遏制HTRA1的表达或功能来遏制所述诱导或恶化,治愈、维持或改善症状,避免继发性疾病等(下文中,这些疾病被称为“HTRA1相关的疾病”)。所述HTRA1相关的疾病还包括各种疾病,所述疾病允许通过遏制感光细胞变性而遏制诱导或恶化,治愈、维持或改善症状,避免继发性疾病等。本发明的HTRA1-抑制肽对感光细胞变性具有抑制作用,并且可用于治疗和/或预防这些HTRA1相关的疾病。
HTRA1相关的疾病的实例包括但不限于各种遗传性和非遗传性眼部疾病,诸如色素性视网膜炎、涉及感光细胞变性的遗传性疾病以及涉及由PDE6基因突变(例如,对应于编码小鼠PDE6β亚基的Pde6b基因的人PDE6B基因的突变)或PDE6蛋白功能障碍导致的感光细胞变性的疾病(下文中统称为“与PDE6蛋白功能障碍相关的疾病”)。色素性视网膜炎的实例包括但不限于非典型的色素性视网膜炎、典型的色素性视网膜炎和与全身性疾病相关的色素性视网膜炎。涉及感光细胞变性的遗传性疾病的实例包括但不限于除了色素性视网膜炎以外的疾病,诸如黄斑营养不良。与PDE6蛋白功能障碍相关的疾病的实例包括但不限于色盲、常染色体显性先天性固定性夜盲和色素性视网膜炎。另外,本发明的药物组合物可以用作感光细胞变性抑制剂。
通过例如观察到与当将本发明的HTRA1-抑制肽施用于Rd10色素性视网膜炎模型小鼠(其中编码PDE6β亚基的Pde6b基因具有突变)时的对照组相比视网膜的外核层中的增加,可以证实本发明的药物组合物可以用于治疗或预防HTRA1相关的疾病(实施例15)。另外,具有视紫红质基因突变的模型动物中的HTRA1基因表达的增加与感光细胞变性相关(实施例16)。本发明的药物组合物可以用于治疗或预防色素性视网膜炎,除了色素性视网膜炎以外的涉及感光细胞变性的遗传性(不限于视紫红质基因)疾病,和/或与PDE6蛋白功能障碍相关的疾病。
本发明的HTRA1-抑制肽在组织渗透性的方面是优异的(实施例11),并且在其物理特性、稳定性、安全性、施用后的动力学、生产率等的方面也是优异的,并且因此可以优选地作为活性成分包含在药物组合物中。
本发明的药物组合物可以含有治疗或预防有效量的HTRA1-抑制肽或其缀合物以及药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂。
术语“治疗或预防有效量”用于意指通过剂型和施用途径发挥对特定疾病的治疗或预防作用的量,并且与“药理学有效量”同义。
本发明的药物组合物可以含有用于改变、维持或保持所述组合物或其中含有的本发明的肽或其缀合物的pH、渗透压、粘度、透明度、颜色、等渗性、无菌性或稳定性、溶解度、持续释放速率、吸收性、渗透性、剂型、强度、特性、形状等的物质(下文中被称为“药物物质”)。药物物质没有特别限制,只要所述物质是药理学可接受的。例如,无毒性或低毒性是所述药物物质优选具有的特性。
所述药物物质的实例可以包括以下物质,但不限于此:氨基酸,诸如甘氨酸、丙氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸和赖氨酸;抗微生物剂;抗氧化剂,诸如抗坏血酸、硫酸钠和亚硫酸氢钠;缓冲剂,诸如磷酸盐、柠檬酸盐或硼酸盐缓冲剂、碳酸氢钠和Tris-HCl溶液;填充剂,诸如甘露糖醇和甘氨酸;螯合剂,诸如乙二胺四乙酸(EDTA);络合剂,诸如咖啡因、聚乙烯吡咯烷酮、β-环糊精和羟丙基-β-环糊精;增量剂,诸如葡萄糖、甘露糖和糊精;其他碳氢化合物,诸如单糖、二糖、葡萄糖、甘露糖和糊精;着色剂;矫味剂;稀释剂;乳化剂;亲水性聚合物,诸如聚乙烯吡咯烷酮;低分子量多肽;成盐抗衡离子;防腐剂,诸如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸和过氧化氢;溶剂,诸如甘油、丙二醇和聚乙二醇;糖醇,诸如甘露糖醇和山梨糖醇;混悬剂;表面活性剂,诸如PEG、脱水山梨糖醇酯、聚山梨醇酯诸如聚山梨醇酯20和聚山梨醇酯80、triton、氨丁三醇、卵磷脂和胆固醇;稳定性增强剂,诸如蔗糖和山梨糖醇;弹性增强剂,诸如氯化钠、氯化钾、甘露糖醇和山梨糖醇;转运剂;稀释剂;赋形剂;和/或药物助剂。
将这种药物物质以所述HTRA1-抑制肽的重量的0.001至1000倍、优选0.01至100倍且更优选0.1至10倍的量添加至所述HTRA1-抑制肽。
在本发明的药物组合物内还包括含有HTRA1-抑制肽或其缀合物的脂质体,或含有包含HTRA1-抑制肽或其与脂质体缀合的缀合物的修饰形式的药物组合物。
赋形剂或载体没有特别限制,只要所述赋形剂或载体通常是液体或固体并且是注射用水、生理盐水、人工脑脊髓液或用于口服施用或肠胃外施用的制剂中使用的其他物质。生理盐水的实例可以包括中性生理盐水或含有血清白蛋白的生理盐水。
缓冲液的实例可以包括经制备以使药物组合物的最终pH达到7.0至8.5的Tris缓冲液,经制备以使其最终pH达到4.0至5.5的乙酸盐缓冲液,经制备以使其最终pH达到5.0至8.0的柠檬酸盐缓冲液,和经制备以使其最终pH达到5.0至8.0的组氨酸缓冲液。
本发明的药物组合物是固体、液体、悬浮液等。本发明的药物组合物的另一个实例可以包括冷冻干燥的制剂。可以使用赋形剂诸如蔗糖形成冷冻干燥的制剂。
本发明的药物组合物的施用途径可以是眼滴注、经肠施用、局部施用和肠胃外施用中的任一种。其实例可以包括结膜滴注、玻璃体内施用、静脉内施用、动脉内施用、肌肉内施用、皮内施用、皮下施用、腹膜内施用、经皮施用、骨内施用和关节内施用。
可以根据施用方法、HTRA1-抑制肽的HTRA1结合亲和力等来确定药物组合物的配方。针对靶标HTRA1具有更强的抑制活性(更小的IC
本发明的HTRA1-抑制肽或其缀合物的剂量不受限制,只要剂量是药理学有效量。剂量可以根据个体的物种、疾病的类型、症状、性别、年龄、预先存在的状况、所述肽对HTRA1肽的结合亲和力或其生物活性以及其他因素来适当地确定。所述剂量通常是0.01至1000mg/kg且优选0.1至100 mg/kg,其可以每天至每180天施用一次或每天施用两次或三次或更多次。
药物组合物的形式的实例可以包括注射剂(包括冷冻干燥的制剂和点滴输注)、栓剂、经鼻吸收制剂、经皮吸收制剂、舌下剂、胶囊、片剂、软膏、颗粒剂、气溶胶、丸剂、粉剂、混悬剂、乳剂、滴眼剂和生物植入物制剂。
包含HTRA1-抑制肽或其缀合物作为活性成分的药物组合物可以与额外的药物同时施用或与额外的药物分开施用。例如,包含HTRA1-抑制肽或其缀合物作为活性成分的药物组合物可以在施用额外的药物后进行施用,或者额外的药物可以在施用药物组合物后进行施用。或者,可以同时施用所述药物组合物和所述额外的药物。为了同时施用,所述HTRA1-抑制肽或其缀合物和额外的药物可以包含在单一制剂中,或者可以包含在分开的制剂(多种制剂)中。
与本发明的药物组合物组合使用的额外的药物的实例可以包括抗VEGF剂、抗炎剂、炎性细胞因子-中和剂和补体活化途径抑制剂。所述抗VEGF剂被分类为抗VEGF抗体、VEGF抑制剂、VEGF受体拮抗剂和可溶性VEGF受体等,并且包括贝伐单抗、兰尼单抗、阿柏西普、哌加他尼、brolucizumab等。所述抗炎剂没有特别限制,只要所述抗炎剂可以局部施用以遏制眼内或关节内炎症。所述炎性细胞因子-中和剂的实例包括抗TNFα抗体、抗白介素-6(下文中被称为“IL-6”)抗体、抗IL-6受体抗体和可溶性TNF受体,并且可以具体包括英夫利昔单抗、阿达木单抗、戈利木单抗、赛妥珠单抗、托西珠单抗和依那西普。所述补体活化途径抑制剂的实例可以包括lampalizumab。这些药物适合于治疗或预防HTRA1相关的疾病,并且还可以与本发明的药物组合物组合以治疗或预防除了HTRA1相关的疾病以外的疾病。
可以使用这些额外药物之一,或者可以施用或接受其中的两种或三种或更多种。这些方法被统称为“与额外的药物和本发明的药物组合物组合使用”或“与额外的药物和本发明的药物组合物组合”。本发明内还包括包含除了本发明的抗体以外的额外的药物、其结合片段或抗体或片段的修饰形式的本发明的药物组合物或与额外的疗法组合使用的包含除了本发明的抗体以外的额外的药物、其结合片段或抗体或片段的修饰形式的本发明的药物组合物,作为“与额外的药物组合使用”或“与额外的药物组合”的一个方面。
本发明还提供了用于治疗或预防HTRA1相关的疾病、诸如色素性视网膜炎的方法,其包括以下步骤:施用HTRA1-抑制肽或其缀合物,使用本发明的HTRA1-抑制肽或其缀合物用于制备用于治疗或预防所述疾病的药物组合物,以及使用HTRA1-抑制肽或其缀合物用于治疗或预防所述疾病。本发明还包括用于治疗或预防的试剂盒,其包含本发明的HTRA1-抑制肽或其缀合物。
本发明进一步提供了包含编码HTRA1-抑制肽或其缀合物的氨基酸序列的核苷酸序列的多核苷酸,包含所述多核苷酸的载体,以及包含所述多核苷酸或所述载体或包含表达本发明的HTRA1-抑制肽或其缀合物的细胞的药物组合物。例如,可以通过使用已知方法将所述多核苷酸和载体应用于HTRA1相关的疾病的基因疗法。可以通过使用已知方法将所述细胞应用于HTRA1相关的疾病的细胞疗法。而且,可以将所述多核苷酸或所述载体转移至例如自体细胞或同种异体细胞(同源细胞)以制备用于细胞疗法的细胞。在本发明中也包括这种多核苷酸和载体作为用于细胞疗法药物制备的组合物。然而,包含所述多核苷酸、载体、细胞等的本发明的药物组合物的形式不限于上述那些。
6. 用于诊断和检测HTRA1的组合物
本发明的HTRA1-抑制肽或其缀合物除了具有HTRA1蛋白酶抑制活性以外,还可以具有HTRA1结合活性,并且可以用于各种研究中,诸如在搜索HTRA1抑制剂、检测HTRA1、使用所述检测进行检查和诊断、分离HTRA1、试剂和其他目的的研究中用作阳性对照。为了检测或分离HTRA1,可以固定本发明的肽和HTRA1中的至少一种。
本发明提供了用于检测或诊断的组合物(下文中统称为“用于诊断的组合物”),其包含结合HTRA1的本发明的肽或其缀合物。
本发明的用于诊断的组合物可用于检查或诊断HTRA1相关的疾病、HTRA1表达等。在本发明中,检查或诊断的实例包括但不限于确定或测量获得疾病的风险,确定疾病的存在或不存在,测量进展或恶化的程度,测量或确定用包含HTRA1-抑制肽或其缀合物的药物组合物用药的效果,测量或确定除了药物以外的治疗的效果,测量复发的风险以及确定复发的存在或不存在。
本发明的用于诊断的组合物可用于针对本发明的肽或其缀合物、包含所述肽或其缀合物的组合物或包含所述肽或其缀合物的药物组合物鉴定受体个体。
所述用于诊断的组合物可以含有pH缓冲剂、渗透压调节剂、盐、稳定剂、防腐剂、显影剂、敏化剂、聚集防止剂等。
本发明还提供了用于检查或诊断HTRA1相关的疾病的方法,本发明的肽用于制备用于诊断疾病的组合物的用途以及本发明的结合HTRA1的肽或其缀合物用于检查或诊断疾病的用途。本发明还包括用于检查或诊断的试剂盒,其包含本发明的肽或其缀合物。
包含本发明的结合HTRA1的肽的检查或诊断方法期望地是夹心ELISA。或者,可以使用常规的检测方法,诸如ELISA、RIA、ELISPOT、斑点印迹、Ouchterlony方法、CIE、CLIA或流式细胞术。所述检查或诊断也通过基于免疫沉淀方法的方法来实现。
本发明还提供了用于检测或测量测试样品中的HTRA1的方法。这种检测或测量方法可以采用本发明的用于诊断的组合物。测试样品中的HTRA1可以通过如下检测:使HTRA1-抑制肽或其缀合物与测试样品接触(步骤1);且随后测量与所述肽结合的HTRA1的量(步骤2)。步骤1可以涉及例如经由蛋白G将HTRA1-抑制肽与免疫球蛋白Fc区的缀合物固定至磁性珠粒上,并向其中添加测试样品。步骤2可以涉及,例如,分离磁性珠粒,和通过SDS-PAGE或Western印迹分析与珠粒一起沉淀的可溶性蛋白,以检测HTRA1。除了人或非人动物来源的样品以外,甚至可以对人工处理的样品、诸如重组蛋白进行该测量。源自个体生物体的测试样品的实例可以包括但不限于血液、滑液、腹水、淋巴液、脑脊髓液、支气管肺泡灌洗液、唾液、痰液、组织匀浆上清液和组织切片。
HTRA1检测不仅可以在体外实施,而且可以在体内实施。在诊断成像的情况下,可以使用用药学上可接受的放射性核素或光发射体标记的HTRA1-抑制肽或其缀合物。步骤1可以涉及,例如,将标记的肽或其缀合物施用于测试受试者。步骤2可以涉及,例如,通过使用诊断成像技术、诸如PET/CT获得图像,和确定或检查HTRA1的存在。
本发明的用于诊断的组合物中含有的肽或其缀合物结合HTRA1,且优选具有HTRA1特异性结合活性。
本发明还包括用于针对本发明的药物组合物鉴定受体个体的方法。在这种鉴定方法中,使用本发明的HTRA1-结合肽测量源自个体的样品中的HTRA1,并且当在样品中检测到HTRA1时或者当与源自健康个体的样品中检测到的HTRA1的量相比在其中检测到更大量的HTRA1时,可以将个体确定为阳性。该方法可以采用本发明的用于诊断的组合物。
在鉴定方法的一个优选方面,所述个体具有HTRA1相关的疾病或具有获得所述疾病的风险。
在一个方面,可以将本发明的药物组合物施用于在鉴定方法中被确定为阳性的个体。
使用本发明的具有HTRA1-特异性结合活性的肽或其缀合物,可以从其中HTRA1与其他组分共存的样品特异性分离HTRA1。HTRA1从肽的释放可以例如在相对高的离子强度、低pH、适度的变性条件或离液盐存在的情况下非选择性进行,并且优选在不减弱HTRA1的蛋白酶活性的情况下进行。
7. 用于鉴定HTRA1相关的疾病的治疗药物或预防药物的方法
在一个方面,本发明提供了用于通过使用HTRA1抑制活性作为指标鉴定HTRA1-相关的疾病和优选色素性视网膜炎、除了色素性视网膜炎以外的涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的治疗药物或预防药物或其候选物的方法。所述方法可以包括:步骤1:在测试物质存在或不存在的情况下(或在媒介物存在的情况下)孵育HTRA1蛋白酶和底物;步骤2:在测试物质存在和不存在的情况下测定HTRA1蛋白酶活性;和/或步骤3:当在测试物质存在的情况下的HTRA1蛋白酶活性低于在测试物质不存在的情况下的HTRA1蛋白酶活性时,将测试物质确定为色素性视网膜炎、除了色素性视网膜炎以外的涉及感光细胞变性的遗传性疾病和/或与PDE6蛋白功能障碍相关的疾病的治疗药物或预防药物或其候选物。所述测试物质可以是肽的或非肽的。肽测试物质不限于SPINK2突变体。其实例可以包括但不限于抗体,具有非免疫球蛋白蛋白框架的除了SPINK2突变体以外的肽和HTRA1底物类似物。非肽测试物质的实例可以包括但不限于合成的低分子化合物和核酸。上述步骤中的一个或两个或更多个也可以优选地包括在用于鉴定对感光细胞变性具有抑制作用的物质或其候选物的方法中。本发明还涉及用于鉴定对感光细胞变性具有抑制作用的物质或其候选物的方法。
实施例
在下文中,将参考实施例更详细地描述本发明的一些方面。然而,本发明不限于这些实施例。
在以下实施例中,除非另有指明,否则根据"Molecular Cloning" (Sambrook,J., Fritsch, E. F.和Maniatis, T., 由Cold Spring Harbor Laboratory Press在1982年或1989年出版)中描述的方法或本领域技术人员使用的实验手册中描述的其他方法实施关于基因操作的单独操作,或者当已经使用市售的试剂或试剂盒时,所述实施例已经根据市售产品中包含的说明书实施。
实施例1. HTRA1-抑制肽的制备
(1-1) HTRA1-抑制肽表达载体的构建
(1-1-1) pET 32a(修饰的)_HTRA1-抑制肽的构建
首先,构建以SPINK2支架作为骨架的HTRA1-抑制肽表达载体。通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续30秒)×30个循环)用每种抑制肽的核苷酸序列(SEQ ID NO:4、6、8、10、12、14、16、18、20和22)和SPINK2的核苷酸序列(SEQ ID NO:2)作为模板使用以下引物和KOD-plus- (Toyobo Co., Ltd.)扩增抑制剂片段。
引物1:5'-AAAAGAATTCTGATCCGCAGTTTGGTCTGTTTAG-3' (SEQ ID NO:33)
引物2:5'-AAAACTCGAGTTATGCGGCCGCAGACGCGCCGCACGGACC-3' (SEQ ID NO:34)
每种扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pET 32a(修饰的)各自用限制性酶EcoRI (New England BioLabs Inc.)和XhoI (New England BioLabs Inc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquick PCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New England BioLabsInc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109(Toyobo Co., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。第二天,将转化的大肠杆菌接种至含有0.1 mg/ml氨苄青霉素的Terrific Broth培养基(Invitrogen Corp.),并在37℃下培养过夜。然后,使用QIAprep 96Turbo Miniprep试剂盒(Qiagen N.V.)回收质粒DNA(下文中,该处理被称为“小量制备处理”),并进行序列分析以构建“pET 32a(修饰的)_HTRA1-抑制肽”。
(1-1-2) pET 32a_HTRA1-抑制肽_Kex2的构建
同样,通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续30秒)×30个循环)用每种抑制肽的序列(序列表)和SPINK2的核苷酸序列作为模板使用以下引物和KOD-plus-(Toyobo Co., Ltd.)扩增抑制剂片段。
引物3:5'-AAAAGGATCCCTGGACAAACGTGATCCGCAGTTTGGTCTGTTTAG-3' (SEQ ID NO:35)
引物4:5'-AAAACTCGAGTTAGCCGCCGCACGGACCATTGCGAATAATTTTA-3' (SEQ ID NO:36)
每种扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pET 32a (Novagen)各自用限制性酶BamHI (New England BioLabs Inc.)和XhoI (New England BioLabsInc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquick PCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New EnglandBioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (Toyobo Co., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pET 32a_HTRA1-抑制肽_Kex2"。根据(1-1-1)中所述的方法进行操作。
(1-2) HTRA1-抑制肽的表达和纯化
将大肠杆菌Origami B (DE3) (Novagen)用(1-1-1)中构建的载体pET 32a(修饰的)_HTRA1-抑制肽转化,并使用含有0.1 mg/ml氨苄青霉素的2YT培养基在37℃下培养。然后,向其中添加IPTG (最终浓度:1 mM),并将大肠杆菌在16℃下培养过夜。第二天,在通过离心(3,000 g,20 min,4℃)收获后,使用BugBuster Master Mix (Novagen)制备裂解物,并使用TALON金属亲和树脂(Clontech Laboratories, Inc.)纯化目标His标签融合蛋白。接下来,硫氧还蛋白标签和期望的蛋白使用凝血酶切割捕获试剂盒(Novagen)切割,并使用TALON纯化。将所得物进行凝胶过滤色谱(Superdex 75 10/300 GL)或反相色谱(YMC-PackODS-AM)以制备HTRA1-抑制肽。获得的肽在其N末端与由S标签和接头组成的部分(SEQ IDNO:31:图43)缀合,并且在其C末端与C-末端六聚体(SEQ ID NO:32:图44)、而不是Gly-Gly缀合。
同样,将大肠杆菌Origami B (DE3) (Novagen)用(1-1-2)中构建的载体pET 32a_HTRA1-抑制肽_Kex2转化,并使用含有0.1 mg/ml氨苄青霉素的2YT培养基在37℃下培养。然后,向其中添加IPTG (最终浓度:1 mM),并将大肠杆菌在16℃下培养过夜。第二天,在通过离心(3,000 g,20 min,4℃)收获后,使用BugBuster Master Mix (Novagen)制备裂解物,并使用TALON金属亲和树脂(Clontech Laboratories, Inc.)纯化目标His标签融合蛋白。接下来,硫氧还蛋白标签和期望的蛋白使用Kex2 (酿酒酵母:登录CAA96143)切割,并使用TALON纯化。将所得物进行凝胶过滤色谱(Superdex 75 10/300 GL)或反相色谱(YMC-PackODS-AM)以制备HTRA1-抑制肽(其中N末端和C末端均未与标签、接头等缀合)。
实施例2. 针对HTRA1抑制活性评估HTRA1-抑制肽
人、小鼠、大鼠和猴HTRA1间的序列相似性显示于图1中。构成HTRA1蛋白酶结构域(204Gly至364Leu)(其为酶促活性结构域)的一级序列在人和猴之间是完全相同的。人和小鼠或大鼠HTRA1蛋白酶结构域序列相差1个残基。然而,该残基在结构上位于与酶的活性中心相对的一侧,且因此推测其对酶的活性中心没有影响(图1)。因此,所述HTRA1蛋白酶结构域有效地具有相同的序列,而与物种(人/小鼠/大鼠/猴)无关。因此,关于物种没有特别提及。
(2-1) HTRA1蛋白酶结构域HTRA1 (cat)的制备
(2-1-1) pET 21b_HTRA1 (cat)的构建
将人HTRA1 (Q92743)的不包括N-末端结构域和PDZ结构域的蛋白酶结构域(158Gly至373Lys)用作HTRA1 (cat),以构建HTRA1(cat)表达载体。通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续45秒)×30个循环)用人HTRA1-插入的质粒(GeneCopoeia, Inc.; GC-M0558)作为模板使用以下引物和KOD-plus- (Toyobo Co., Ltd.)扩增期望的DNA片段。
引物5:5'-AAACATATGGGGCAGGAAGATCCCAACAGTTTGC-3' (SEQ ID NO:37)
引物6:5'-AAACTCGAGTTTGGCCTGTCGGTCATGGGACTC-3' (SEQ ID NO:38)
扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pET 32a (Novagen)各自用限制性酶NdeI (New England BioLabs Inc.)和XhoI (New England BioLabs Inc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquickPCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New England BioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (ToyoboCo., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pET 21b_HTRA1 (cat)"。根据(1-1-1)中所述的方法进行操作。
(2-1-2) HTRA1 (cat)的制备
将大肠杆菌BL21 (DE3) (Novagen)用构建的pET 21b_HTRA1 (cat)转化,并使用含有0.1 mg/ml氨苄青霉素的2YT培养基在37℃下培养。然后,向其中添加IPTG (最终浓度:1mM),并将大肠杆菌在28℃下培养过夜。收获后,通过悬浮于含有1 mg/ml溶菌酶的磷酸盐缓冲液(50 mM磷酸钠和300 mM NaCl)中并超声处理来制备裂解物,并使用TALON (ClontechLaboratories, Inc.)回收期望的His标签融合蛋白。将所得物进行凝胶过滤色谱(Superdex 200 10/300 GL)以纯化HTRA1 (cat)。
(2-2) 全长HTRA1 (HTRA1 (全长))的制备
(2-2-1) pcDNA3.1_HTRA1 (全长)_His的构建
通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续90秒)×30个循环)用合成的人HTRA1 (Q92743) DNA (GeneArt)作为模板使用以下引物和KOD-plus- (Toyobo Co.,Ltd.)扩增期望的DNA片段。
引物7:5'-AAAAGAATTCGCCACCATGCAGATTCCTAGAGCCG-3' (SEQ ID NO:39)
引物8:5'-AAAACTCGAGTCAGTGGTGATGGTGGTGGTGGCCGG-3' (SEQ ID NO:40)
扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pcDNA3.1 (Thermo FisherScientific Inc.)各自用限制性酶EcoRI (New England BioLabs Inc.)和XhoI (NewEngland BioLabs Inc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquick PCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New England BioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (Toyobo Co., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pcDNA3.1_HTRA1 (全长)_His"。根据(1-1-1)中所述的方法进行操作。
(2-2-2) pcDNA3.3_HTRA1 (全长)_FLAG_His的构建
通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续90秒)×30个循环)用(2-2-1)中构建的pcDNA3.1_HTRA1 (全长)_His作为模板使用以下引物和KOD-plus- (Toyobo Co.,Ltd.)扩增片段A。
引物7
引物9:5'-CTTGTCGTCATCGTCCTTGTAGTCGCCGGGGTCGATTTCCTC-3' (SEQ ID NO:41)
接下来,通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续10秒)×30个循环)使用以下引物和KOD-plus- (Toyobo Co., Ltd.)扩增片段B。
引物10:5'-GCGACTACAAGGACGATGACGACAAGCACCACCACCATCATCAC-3' (SEQ ID NO:42)
引物11:5'-AAAAACTCGAGCTAGTGATGATGGTGGTGGTGCTTGTCGTC-3' (SEQ ID NO:43)
通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续90秒)×30个循环)用片段A和片段B作为模板使用引物7和11以及KOD-plus- (Toyobo Co., Ltd.)扩增期望的DNA片段。扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pcDNA3.3 (Thermo FisherScientific Inc.)各自用限制性酶EcoRI (New England BioLabs Inc.)和XhoI (NewEngland BioLabs Inc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquick PCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New England BioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (Toyobo Co., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pcDNA3.3_HTRA1 (全长)_FLAG_His"。根据(1-1-1)中所述的方法进行操作。
(2-2-3) HTRA1 (全长)的制备
将FreeStyle 293F (Thermo Fisher Scientific Inc.)用(2-2-2)中构建的pcDNA3.3_HTRA1 (全长)_FLAG_His使用Polyethylenimine Max (Polysciences, Inc.)转染。6天后,回收培养上清液。使用HisTrap excel (GE Healthcare)回收His标签融合蛋白,并使用抗FLAG M2亲和力琼脂糖凝胶(Sigma-Aldrich Co. LLC)进一步纯化HTRA1 (全长)。
(2-3) 无活性的HTRA1突变体HTRA1 (S328A)的制备
(2-3-1) pcDNA3.3_HTRA1(S328A)_FLAG_His的构建
为了构建无活性的HTRA1突变体HTRA1 (S328A)表达载体,用实施例(2-2-2)中构建的载体"pcDNA3.3_HTRA1 (全长)_FLAG_His"作为模板使用以下引物和QuikChange II定点诱变试剂盒(Agilent Technologies Japan, Ltd.)实施PCR ((95℃持续30秒,55℃持续1min,和68℃持续7 min)×18个循环)。
引物21:5'-CCATCATCAACTACGGCAACGCGGGCGGACCCCTCGTGAACC-3' (SEQ ID NO:55:图76)
引物22:5'-GGTTCACGAGGGGTCCGCCCGCGTTGCCGTAGTTGATGATGG-3' (SEQ ID NO:56:图77)
PCR反应后,根据试剂盒所附的方案,用以DpnI处理的PCR反应溶液转化大肠杆菌JM109(Toyobo Co., Ltd.)。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pcDNA3.3_HTRA1(S328A)_FLAG_His"。根据(1-1-1)中所述的方法进行操作。
(2-3-2) HTRA1 (S328A)的制备
根据(2-2-3)中所述的方法,使用FreeStyle 293F表达HTRA1 (S328A),并且通过亲和纯化制备HTRA1 (S328A)。
实施例3. 针对HTRA1抑制活性评估HTRA1-抑制肽
(3-1)使用肽底物针对HTRA1抑制活性评估HTRA1-抑制肽
将底物肽H2-Opt (Mca-IRRVSYSFK(Dnp)K) (Peptide Institute, Inc.:SEQ ID NO:54,图8)以10 mM溶解于DMSO中,用测定缓冲液(50 mM硼酸盐和150 mM NaCl, pH 8.5)稀释,并且以10 μM的最终浓度使用。将用测定缓冲液稀释的HTRA1 (HTRA1 (cat)或HTRA1(全长))和每种HTRA1-抑制肽以各自25 μL混合,并在37℃下反应20分钟。然后,向其中添加50 µL用测定缓冲液稀释的底物。使用Enspire (PerkinElmer, Inc.)测量荧光信号(在328nm处激发/在393 nm处发射)。HTRA1的最终浓度为100 nM,且HTRA1-抑制肽的最终浓度为1.875至1,000 nM。在反应和测量中使用PROTEOSAVE(R) SS96F黑板(Sumitomo BakeliteCo., Ltd.)。
计算每种浓度的HTRA1-抑制肽的底物肽分解率。当将0 nM的抑制剂浓度下的分解率定义为100%时,评估每种HTRA1-抑制肽的HTRA1 (cat)和HTRA1 (全长)抑制活性(图2和3)。作为使用GraphPad Prism (5.0版; GraphPad Software Inc.)计算50%抑制浓度(IC50)的结果,发现所有HTRA1-抑制肽都在低浓度下抑制HTRA1 (cat)和HTRA1 (全长)酶活性(图2A至2C和图3)。通过对照,野生型SPINK2 (wt)没有表现出HTRA1抑制活性(图2D)。
(3-2)使用蛋白底物针对HTRA1抑制活性评估HTRA1-抑制肽
以人玻连蛋白作为蛋白底物评估HTRA1-抑制肽的HTRA1抑制活性。将用测定缓冲液(50mM Tris和150 mM NaCl, pH 8.0)稀释的HTRA1 (cat)和每种HTRA1-抑制肽混合,并在37℃下反应1小时。接下来,向其中添加用测定缓冲液稀释的人玻连蛋白(BD Biosciences;354238),并在37℃下反应2小时。向其中添加SDS样品缓冲液,并通过在99℃下处理5分钟来终止酶反应。然后,通过SDS-PAGE和Western印迹分析评估人玻连蛋白的分解。HTRA1-抑制肽的最终浓度为0至25 μM,HTRA1 (cat)的最终浓度为1 μM,且人玻连蛋白的最终浓度为1μM。对于Western印迹分析,将人玻连蛋白抗体(R&D Systems, Inc.; MAB2349)用作一抗,并将抗小鼠IgG、HRP-连接的全Ab绵羊(GE Healthcare; NA931)用作二抗。
如(3-1)中,当将人玻连蛋白用作底物时,所述HTRA1-抑制肽也强烈表现出对HTRA1 (cat)的抑制(图4)。
(3-3)针对特异性评估HTRA1-抑制肽
通过使用底物肽的切割作为指标来评估对其他蛋白酶的特异性。以与(3-1)中所述的方法相同的方式,将用测定缓冲液稀释的每种蛋白酶和每种样品(最终浓度:1 μM)以各自25 μL混合,并在37℃下反应20分钟。然后,向其中添加50 µL用测定缓冲液稀释的每种底物。使用Enspire (PerkinElmer, Inc.)测量荧光信号(在380 nm处激发/在460 nm处发射)。与实施例2中相同的测定缓冲液(50 mM硼酸盐和150 mM NaCl, pH 8.5)用于评估HTRA2活性。测定缓冲液(50 mM Tris和150 mM NaCl, pH 8.0)用于评估除了HTRA2活性以外的蛋白酶活性。在反应和测量中使用PROTEOSAVE(R) SS96F黑板(Sumitomo BakeliteCo., Ltd.)。用于特异性评估中的蛋白酶和底物的组合如下。
牛胰蛋白酶抑制活性评估;5 nM(最终浓度)胰蛋白酶(Pierce;20233)和100 μM(最终浓度)底物肽Boc-VPR-AMC荧光肽底物(R&D Systems, Inc.; ES011)
牛α-胰凝乳蛋白酶抑制活性评估;10 nM(最终浓度)胰凝乳蛋白酶(WorthingtonBiochemical Corporation; LS001434)和100 μM(最终浓度)底物肽Suc-Leu-Leu-Val-Tyr-MCA (Peptide Institute, Inc.; 3120-v)
人类胰蛋白酶抑制活性评估;1 nM(最终浓度)类胰蛋白酶(Sigma-Aldrich Co. LLC;T7063)和100 μM(最终浓度)底物肽Boc-Phe-Ser-Arg-MCA (Peptide Institute, Inc.;3107-v)
人类胰凝乳蛋白酶抑制活性评估;100 nM(最终浓度)类胰凝乳蛋白酶(Sigma-AldrichCo. LLC; C8118)和100 μM(最终浓度)底物肽Suc-Leu-Leu-Val-Tyr-MCA (PeptideInstitute, Inc.; 3120-v)
人纤溶酶抑制活性评估;50 nM(最终浓度)纤溶酶(Sigma-Aldrich Co. LLC; P1867)和100 μM(最终浓度)底物肽Boc-Val-Leu-Lys-MCA (Peptide Institute, Inc.; 3104-v)
人凝血酶抑制活性评估;1 nM(最终浓度)凝血酶(Sigma-Aldrich Co. LLC; T6884)和100 μM(最终浓度)底物肽Boc-VPR-AMC荧光肽底物(R&D Systems, Inc.; ES011)
人matriptase抑制活性评估;1 nM(最终浓度) matriptase (R&D Systems, Inc.;E3946-SE)和100 μM(最终浓度)底物肽Boc-QAR-AMC荧光肽底物(R&D Systems, Inc.;ES014)
人蛋白C抑制活性评估;100 nM(最终浓度)蛋白C (Sigma-Aldrich Co. LLC; P2200)和100 μM(最终浓度)底物肽Boc-Leu-Ser-Thr-Arg-MCA (Peptide Institute, Inc.;3112-v)
人tPA抑制活性评估;10 nM(最终浓度) tPA (Sigma-Aldrich Co. LLC; T0831)和100μM(最终浓度)底物肽Pyr-Gly-Arg-MCA (Peptide Institute, Inc.; 3145-v)
人uPA抑制活性评估;10 nM(最终浓度) uPA (Sigma-Aldrich Co. LLC; T0831)和100μM(最终浓度)底物肽Pyr-Gly-Arg-MCA (Peptide Institute, Inc.; 3145-v)
人血浆激肽释放酶抑制活性评估;0.125 μg/ml(最终浓度)血浆激肽释放酶(Sigma-Aldrich Co. LLC; T0831)和100 μM(最终浓度)底物肽Z-Phe-Arg-MCA (PeptideInstitute, Inc.; 3095-v)
人HTRA2抑制活性评估;200 nM(最终浓度) HTRA2 (R&D Systems, Inc.; 1458-HT)和50 μM(最终浓度)底物肽H2-Opt (Peptide Institute, Inc.)
通过使用肽底物的分解作为指标以与(3-2)中相同的方式评估与除了HTRA1以外的蛋白酶的交叉反应性。在1 μM的最终抑制剂浓度下,每种HTRA1-抑制肽都不抑制任何蛋白酶的蛋白酶活性,表明每种HTRA1-抑制肽都具有HTRA1-特异性的抑制作用(图5)。
实施例4. 使用X-射线晶体结构分析HTRA1-抑制肽
(4-1) HTRA1 (cat)/HTRA1-抑制肽复合物的制备
根据(1-2)和(2-1)中所述的方法,各自制备HTRA1 (cat))和具有SEQ ID NO:3中所示的氨基酸序列的HTRA1-抑制肽。将这些在20 mM Tris-HCl和150 mM NaCl, pH 7.6的条件下混合。然后,将复合物分离并通过凝胶过滤色谱(Superdex 200 10/300 GL)纯化。
(4-2) X-射线晶体学
将(4-1)中制备的复合物溶液浓缩至18 mg/ml,且然后与储存溶液(1.0 M LiCl, 7.5%PEG6000和0.1 M Tris/HCl (pH 8.5))以1:1的比率混合,并且将混合物通过蒸汽扩散方法结晶。将获得的立方单晶浸入含有20%乙二醇的储存溶液中,且然后冷冻在液氮中。将冷冻的晶体在低温气流下暴露于X-射线以获得衍射图像(光子工厂BL5A:High EnergyAccelerator Research Organization)。通过使用HKL2000进行分析获得具有2.6埃的最大分辨率的缩放数据。通过使用丝氨酸蛋白酶HTRA1 (PDB ID:3NZI)作为模板的分子置换方法确定相。结构细化后,以2.6埃的分辨率测定HTRA1 (cat)和该肽的晶体复合物。在晶胞中含有HTRA1和SPINK2分子各一个。关于SPINK2分子,基于序列信息和观察到的电子密度,构建含有与HTRA1 (cat)的相互作用位点的部分分子模型。证实HTRA1-抑制肽结合含有HTRA1酶的活性中心的区域(图6和7)。
实施例5. 在通过光暴露诱导的视网膜损伤的大鼠模型中通过HTRA1的抑制带来的视网膜保护作用
(5-1)通过光暴露诱导的视网膜损伤的大鼠模型的制备
通过光暴露诱导的视网膜损伤的大鼠模型是通过光暴露诱导视网膜感光细胞的细胞死亡的模型,并且普遍用作视网膜变性的模型动物(Daniel T. Organisciak等人, (1996)Invest Ophthalmol Vis Sci. Vol. 37 (No. 11): p. 2243-2257)。在适应黑暗的条件下,向适应黑暗72小时的大鼠眼滴注0.5% (W/V)托吡卡胺-0.5%盐酸苯肾上腺素眼用溶液。然后,将大鼠暴露于5500 Lux的白光3小时。使因此暴露的大鼠再次适应黑暗约24小时,且然后在普通饲养的明-暗条件下饲养2天。安乐死后,将眼球切下并通过浸入3.7% (W/V) 甲醛-0.5至1% (W/V)甲醇-0.2% (W/V)苦味酸固定剂中24小时或更长时间来固定。石蜡包埋后,准备薄片切片。将切片用苏木精-伊红染色,并测定视网膜的横截面的外核层中的核计数以评估视网膜损伤。发现通过光暴露诱导的视网膜损伤的大鼠模型由于光暴露而在外核层中的核计数显著减少。
(5-2) 视网膜损伤时的细胞外HTRA1的表达的证实
为了检查HTRA1在通过光暴露诱导的视网膜损伤的大鼠模型中的参与,从(5-1)中制备的模型大鼠收集玻璃体液,并通过Western印迹分析评估HTRA1表达水平。对玻璃体液在还原条件下进行SDS-PAGE。使用作为一抗的人HTRA1/PRSS11抗体(R&D Systems, Inc.;AF2916)和作为二抗的绵羊IgG辣根过氧化物酶-缀合的抗体(R&D Systems, Inc.;HAF016)来检测大鼠HTRA1。与非暴露组相比,在光暴露组中证实玻璃体液中的HTRA1的量增加,表明在该模型中,HTRA1参与由光暴露诱导的视网膜损伤的过程(图9)。
(5-3) HTRA1-抑制肽在由光暴露诱导的视网膜损伤的大鼠模型中的视网膜保护作用
在大鼠即将光暴露前,在麻醉下玻璃体内注射5 µL浓度为0.04 mg/mL或0.2 mg/mL的HTRA1-抑制肽H308。对于生理盐水施用组,n = 4,且对于其他组,n = 5。光暴露减少生理盐水施用组中的视网膜的横截面上的外核层中的核计数,而在HTRA1-抑制肽施用组中证实抑制外核层中的核计数减少的效果(图10)。这些结果表明,HTRA1-抑制肽表现出对由HTRA1引起的组织损伤的药物作用。
实施例6. HTRA1-抑制肽衍生物的评估
(6-1) pET 32a_HTRA1-抑制肽H308_S16A_Kex2的构建
使用HTRA1-抑制肽H308作为模板,制备具有氨基酸序列的衍生物S16A,在所述氨基酸序列中,SEQ ID NO:9(图21)中所示的氨基酸序列中的16Ser被Ala取代。通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续15秒)×30个循环)使用以下引物和KOD-plus- (ToyoboCo., Ltd.)扩增片段C。
引物12:5'-CCGCAGTTTGGTCTGTTTAGCAAATATCGTACCCCGAATTGT-3' (SEQ ID NO:44)
引物13:5'-GCCATACCAGCATGGTCCGCACAATTCGGGGTACGATATTTGC-3' (SEQ ID NO:45)
接下来,通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续20秒)×30个循环)以HTRA1-抑制肽H308作为模板使用以下引物和KOD-plus- (Toyobo Co., Ltd.)扩增片段D。
引物14:5'-GCGGACCATGCTGGTATGGCATGTGTTGCTCTGTATGAAC-3' (SEQ ID NO:46)
引物15:5'-AAAACTCGAGTTAGCCGCCGCACGGACCATTGCGAATAA-3' (SEQ ID NO:47)
通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续20秒)×30个循环)使用片段C和D、以下引物和KOD-plus- (Toyobo Co., Ltd.)扩增期望的DNA片段。
引物16:5'-AAAAGGATCCCTGGACAAACGTGATCCGCAGTTTGGTCTGTTTAG-3' (SEQ IDNO:48)
引物15
扩增的片段进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pET 32a (Novagen)各自用限制性酶BamHI (New England BioLabs Inc.)和XhoI (New England BioLabs Inc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquickPCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New England BioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (ToyoboCo., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pET 32a_HTRA1-抑制肽H308_S16A_Kex2"。根据(1-1-1)中所述的方法进行操作。
(6-2) HTRA1-抑制肽_N-末端衍生物表达载体的制备
为了制备具有氨基酸序列(其中SEQ ID NO:9 (图21)中所示的氨基酸序列中的1Asp被Gly、Ser、Glu或Ser-Leu-Ile取代)的HTRA1-抑制肽的四种N-末端序列衍生物(分别指定为D1G、D1S、D1E和D1SLI),通过与(6-1)中相同的方法构建表达载体。通过PCR ((94℃持续15秒,60℃持续30秒,和68℃持续20秒)×30个循环)使用片段C和D、以下引物和KOD-plus-(Toyobo Co., Ltd.)扩增四种目标片段。
D1G制备引物
引物17:5'-AAAAGGATCCCTGGACAAACGTGGCCCGCAGTTTGGTCTGTTTAG-3' (SEQ ID NO:49)
引物15
D1S制备引物
引物18:5'-AAAAGGATCCCTGGACAAACGTAGCCCGCAGTTTGGTCTGTTTAG-3' (SEQ ID NO:50)
引物15
D1E制备引物
引物19:5'-AAAAGGATCCCTGGACAAACGTGAACCGCAGTTTGGTCTGTTTAG-3' (SEQ ID NO:51)
引物15
D1SLI制备引物
引物20:5'-AAAAGGATCCCTGGACAAACGTAGCCTGATTCCGCAGTTTGGTCTGTTTAG-3' (SEQ IDNO:52)
引物15
四种扩增的片段各自进行琼脂糖凝胶电泳。然后,从凝胶切下期望的DNA片段,并使用QIAquick凝胶提取试剂盒(Qiagen N.V.)制备DNA。将制备的DNA片段和pET 32a (Novagen)各自用限制性酶BamHI (New England BioLabs Inc.)和XhoI (New England BioLabsInc.)在37℃下处理1小时或更长时间。琼脂糖凝胶电泳后,从凝胶切下期望的DNA片段,并使用QIAquick PCR纯化试剂盒(Qiagen N.V.)纯化。使用T4 DNA连接酶(New EnglandBioLabs Inc.),使纯化的片段在16℃下反应过夜,用于连接反应。将连接溶液添加至大肠杆菌JM109 (Toyobo Co., Ltd.),并将混合物在冰上静置30分钟,然后在42℃下热处理45秒,在冰上进一步静置5分钟,并接种至含有0.1 mg/ml氨苄青霉素的2YT板上,随后在37℃下静态培养过夜以转化大肠杆菌。将转化的大肠杆菌培养,且然后实施小量制备和序列分析以构建"pET 32a_HTRA1-抑制肽H308_D1G_S16A_Kex2"、"pET 32a_HTRA1-抑制肽H308_D1S_S16A_Kex2"、"pET 32a_HTRA1-抑制肽H308_D1E_S16A_Kex2"和"pET 32a_HTRA1-抑制肽H308_D1SLI_S16A_Kex2"。根据(1-1-1)中所述的方法进行操作。
(6-3) HTRA1-抑制肽衍生物的制备
将大肠杆菌Origami B (DE3) (Novagen)用(6-1)和(6-2)中构建的五种载体各自转化,并使用含有0.1 mg/ml氨苄青霉素的2YT培养基在37℃下培养。然后,向其中添加IPTG(最终浓度:1 mM),并将大肠杆菌在16℃下培养过夜。第二天,在通过离心(3,000 g,20min,4℃)收获后,使用BugBuster Master Mix (Novagen)制备裂解物,并使用TALON金属亲和树脂(Clontech Laboratories, Inc.)纯化目标His标签融合蛋白。接下来,硫氧还蛋白标签和期望的蛋白使用Kex2 (上面提及)切割,并使用TALON纯化。将所得物进行凝胶过滤色谱(Superdex 75 10/300 GL)或反相色谱(YMC-Pack ODS-AM)以制备五种HTRA1-抑制肽衍生物。所述衍生物的氨基酸序列显示于SEQ ID NO:23至27 (图35至39)中。
(6-4) HTRA1-抑制肽衍生物的评估
作为根据(3-1)中所述的方法测量HTRA1 (cat)抑制活性的结果,所有衍生物都具有与H308的抑制活性等效的抑制活性(图11)。
实施例7. 对于针对HTRA1 (cat)的结合活性评估HTRA1-抑制肽
通过免疫沉淀方法使用实施例(1-2)中制备的三种HTRA1-抑制肽(H308、H321AT和H322AT)和(2-1)中制备的HTRA1 (cat),评估结合活性。在室温下,使2.5 μg的每种HTRA1-抑制肽和10 μg的HTRA1 (cat)反应30分钟。然后,向其中添加10 µL TALON金属亲和树脂(Clontech Laboratories, Inc.)。进一步反应30分钟后,将树脂作为免疫沉淀(IP)级分回收,并进行SDS-PAGE以评估结合活性。在反应中将PBS用作缓冲液。
当三种HTRA1-抑制肽或HTRA1(cat)各自与TALON反应时,在输入泳道中仅检测到His标签-融合的HTRA1 (cat)的条带。另一方面,仅在其中抑制肽与HTRA1 (cat)反应的IP泳道中检测到每种抑制肽和酶的条带。因此,证实了三种HTRA1-抑制肽各自都结合HTRA1(cat)(图12)。
实施例8. 针对HTRA1抑制活性评估HTRA1-抑制肽
(8-1)使用肽底物针对HTRA1抑制活性评估HTRA1-抑制肽
使用底物肽H2-Opt (n = 3)评估实施例6中构建的三种HTRA1-抑制肽(H308_D1G_S16A、H321AT_D1G_S16A和H322AT_D1G_S16A)的HTRA1 (cat)或HTRA1 (全长)抑制活性。将底物肽H2-Opt (Mca-IRRVSYSFK(Dnp)K) (Peptide Institute, Inc.:SEQ ID NO:54,图8)以10 mM溶解于DMSO中,用测定缓冲液(50 mM Tris, 150 mM NaCl和0.25% CHAPS, pH8.0)稀释,并且以10 μM的最终浓度使用。将用测定缓冲液稀释的HTRA1 (HTRA1 (cat)或HTRA1 (全长);实施例2)和每种HTRA1-抑制肽以各自25 μL混合,并在37℃下反应20分钟。然后,向其中添加50 μL用测定缓冲液稀释的底物。使用Enspire (PerkinElmer, Inc.)测量荧光信号(在328 nm处激发/在393 nm处发射)。HTRA1的最终浓度为100 nM,且HTRA1-抑制肽的最终浓度为1.875至1,000 nM。在反应和测量中使用PROTEOSAVE(R) SS96F黑板(Sumitomo Bakelite Co., Ltd.)。
计算每种浓度的HTRA1-抑制肽的底物肽分解率。当将0 nM的抑制剂浓度下的分解率定义为100%时,评估每种HTRA1-抑制肽的HTRA1 (cat)和HTRA1 (全长)抑制活性。
作为使用GraphPad Prism (5.0版; GraphPad Software Inc.)计算50%抑制浓度(IC50)的结果,发现所有HTRA1-抑制肽都在低浓度下抑制HTRA1 (cat)和HTRA1 (全长)酶活性(图66)。
(8-2)使用蛋白底物针对HTRA1抑制活性评估HTRA1-抑制肽
以人玻连蛋白作为蛋白底物评估HTRA1-抑制肽的HTRA1抑制活性。所述操作遵循实施例(3-2)。
如(8-1)中,当将人玻连蛋白用作底物时,所述HTRA1-抑制肽也强烈表现出对HTRA1 (cat)的抑制(图67)。
(8-3)针对特异性评估HTRA1-抑制肽
通过使用底物肽的切割作为指标来评估对其他蛋白酶的特异性。牛胰蛋白酶、牛α-胰凝乳蛋白酶、蛋白C、类胰蛋白酶、类胰凝乳蛋白酶、凝血酶、纤溶酶、tPA、血浆激肽释放酶、matriptase、uPA和HTRA2的操作遵循实施例(3-3)中所述的方法(n = 3)。测量针对其他蛋白酶的抑制活性的程序以及蛋白酶和底物的组合如下。
在反应和测量中使用PROTEOSAVE(R) SS96F黑板(Sumitomo Bakelite Co.,Ltd.)。将用测定缓冲液稀释的每种蛋白酶和每种样品(最终浓度:1 μM)以各自25 μL混合,并在37℃下反应20分钟。然后,向其中添加50 µL用测定缓冲液稀释的每种底物。使用Enspire (PerkinElmer, Inc.)测量荧光信号。
人胰蛋白酶抑制活性评估;1 nM(最终浓度)胰蛋白酶(Sigma-Aldrich Co. LLC;T6424)和100 μM(最终浓度)底物肽Boc-VPR-AMC荧光肽底物(R&D Systems, Inc.;ES011),荧光信号:在380 nm处激发/在460 nm处发射。
人胰凝乳蛋白酶抑制活性评估;10 nM(最终浓度)胰凝乳蛋白酶(Sigma-AldrichCo. LLC; C8946)和10 μM(最终浓度)底物肽Suc-Leu-Leu-Val-Tyr-MCA (PeptideInstitute, Inc.; 3120-v),荧光信号:在380 nm处激发/在460 nm处发射。
人因子XIIa抑制活性评估;100 nM(最终浓度)因子α-XIIa (Enzyme ResearchLaboratories Inc.)和100 μM(最终浓度)底物肽Pyr-Gly-Arg-MCA (Peptide Institute,Inc.; 3145-v),荧光信号:在380 nm处激发/在460 nm处发射。
人MMP-2抑制活性评估;1 nM(最终浓度)类胰蛋白酶(Calbiochem; PF023)和100μM(最终浓度)底物肽MOCAx-KPLGL-A2pr(Dnp)-AR (Peptide Institute, Inc.; 3226-v),荧光信号:在328 nm处激发/在393 nm处发射。
人TPP1抑制活性评估;0.5 μg/ml(最终浓度) TPP1 (Calbiochem; 2237-SE)和200 μM (最终浓度)底物肽AAF-MCA (Peptide Institute, Inc.; 3201-v),荧光信号:在380 nm处激发/在460 nm处发射。
通过使用肽底物的分解作为指标评估与除了HTRA1以外的蛋白酶的交叉反应性。在1 μM的最终浓度下,每种HTRA1-抑制肽都不抑制任何蛋白酶的蛋白酶活性,表明所述HTRA1-抑制肽具有HTRA1-特异性的抑制作用(图68)。
实施例9. 对于针对HTRA1 (cat)的结合活性评估HTRA1-抑制肽
使用实施例6中制备的三种HTRA1-抑制肽和(2-1)中制备的HTRA1 (cat),根据实施例7的操作,通过免疫沉淀方法评估结合活性。
当三种HTRA1-抑制肽或HTRA1(cat)各自与TALON反应时,在输入泳道中仅检测到His标签-融合的HTRA1 (cat)的条带。另一方面,仅在其中抑制肽与HTRA1 (cat)反应的IP泳道中检测到每种抑制肽和酶的条带。因此,证实了三种HTRA1-抑制肽各自都结合HTRA1(cat)(图69)。
实施例10. 在通过光暴露诱导的视网膜损伤的大鼠模型中通过HTRA1的抑制带来的视网膜保护作用(部分2)
使用在实施例(5-1)中构建的通过光暴露诱导的视网膜损伤的大鼠模型评估实施例6中制备的三种HTRA1-抑制肽的视网膜保护作用。该操作遵循实施例5。对于所有组,n = 6。
病理学评估视网膜的结果显示于图70中。三种HTRA1-抑制肽表现出对通过光暴露引起的外核层中的核计数减少的显著抑制作用。
实施例11. 通过抑制通过用含有氢醌的高脂饮食负载引起的视网膜损伤的大鼠模型中的HTRA1而对视网膜色素上皮细胞的保护作用
(11-1) 通过用含有氢醌的高脂饮食负载制备兔视网膜损伤模型
使用高脂饮食(HFD)和氢醌(HQ)制备的视网膜损伤模型是其中由促氧化剂诱导氧化应激以引起视网膜损伤的模型。仅对于小鼠报道了这些模型(Diego G. Espinosa-Heidmann等人, (2006) Invest Ophthalmol Vis Sci., Vol. 47 (No. 2): p. 729-737)。因此,向3岁的JW兔饲喂含有1.5% (W/V)椰子油-0.25% (W/V)胆固醇-1.5% (W/V)花生油-2.4% (W/V)氢醌(HFD-HQ)的RC4 (Oriental Yeast Co., Ltd.)饮食4个月,以构建兔视网膜损伤模型。安乐死后,切下眼球,并通过距角膜缘约5 mm的外切口移取眼的前区段。进一步分离玻璃体。然后,将视网膜-脉络膜-巩膜通过浸入4% (W/V)多聚甲醛固定剂中24小时或更长时间来固定。固定后,将脉络膜分离并使用作为一抗的ZO-1单克隆抗体(ZO1-1A12) (ThermoFisher Scientific Inc.; 33-9100)和作为二抗的鸡抗小鼠IgG (H+L)交叉吸附的二抗Alexa Fluor 594 (Thermo Fisher Scientific Inc.; A-21201)进行免疫染色。在荧光显微镜(BZ-9000; Keyence Corp.)下观察染色的脉络膜。确定染色的视网膜色素上皮(RPE)细胞的面积,以评估RPE细胞损伤。
图71显示了12周龄兔、3岁兔和负载HFD-HQ的3岁兔的RPE细胞的染色图像(图71(A))和RPE细胞的平均面积的图(图71(B))。RPE细胞被证实在3岁兔中比12周龄兔中更肥大,并且通过HFD-HQ负载进一步肥大。证实损伤出现在RPE细胞中。在年龄相关的黄斑变性患者的眼球中已经观察到类似的变化(Ding JD等人, (2011) Proc Natl Acad Sci U SA., Vol. 108 (No. 28): p. 279-87)。
(11-2) 视网膜损伤时AMD-相关因子C3表达水平的增加
为了评估AMD-相关因子的表达,分别从兔视网膜损伤模型的视网膜和RPE/脉络膜收集组织。使用RNeasy mini试剂盒(Qiagen N.V.)提取mRNA,且然后将其使用TaqMan GeneExpression Master Mix (Thermo Fisher Scientific Inc.)进行逆转录反应。使用7900HT快速实时PCR系统(Applied Biosystems, Inc.),通过TaqMan基因表达测定(Oc03397832_g1和Oc03824857_g1; Thermo Fisher Scientific Inc.)定量分析补体组分3 (C3)和内部标准品β-肌动蛋白的mRNA水平。对于3岁兔,以n = 4实施分析,并且对于负载HFD-HQ的3岁兔,以n = 10实施分析。
视网膜以及RPE细胞和脉络膜中的C3表达水平显示于图71 (C)和(D)中。对于两种组织,在给予HFD-HQ的兔组中,C3的表达水平被证实增加。
(11-3) 视网膜损伤时HTRA1蛋白水平的增加
为了检查HTRA1在兔视网膜损伤模型中的参与,从(11-1)中制备的兔模型收集玻璃体液,并将其用胰蛋白酶/Lys-C混合物(Promega Corp.)酶促消化。然后,使用LC (EASY-nLC1000; Thermo Fisher Scientific Inc.)-MS (TripleTOF 6600; AB Sciex Pte. Ltd)定量HTRA1的肽片段。在给予HFD-HQ的兔的玻璃体液中,发现HTRA1蛋白水平增加(图71(E))。从这些结果,证实RPE细胞的肥大以及AMD-相关因子C3和HTRA1的表达增加,表明兔视网膜损伤模型可用于对年龄相关性视网膜疾病的研究中。
(11-4) HTRA1抑制剂在兔视网膜损伤模型中的视网膜保护作用
使用兔模型评估在实施例1中制备的HTRA1-抑制肽H308的视网膜保护作用。从开始用HFD-HQ饲喂起2个月后,在麻醉下向一只眼睛玻璃体内施用50 μL 40 mg/mL H308溶液。向另一只眼睛玻璃体内注射生理盐水。对于所有组,n = 5。
从饲喂开始起4个月后,评估模型动物中的RPE细胞肥大。结果显示于图72中。如从两种指标(即,RPE细胞的平均面积(图72(A))和具有1500 μm
在给予所述HTRA1-抑制肽的正常兔的视网膜中证实了所述HTRA1-抑制肽的存在,表明所述HTRA1-抑制肽的高组织渗透性。
实施例12. HTRA1-抑制肽在使用人视网膜色素上皮细胞ARPE-19的VEGF mRNA诱导测试中的抑制作用
在具有0.4 mm孔无菌聚酯膜插入物(Corning Inc.)的12 mm Transwell中,使用含有10%胎牛血清(FBS)和青霉素-链霉素(Thermo Fisher Scientific Inc.)的DMEM/F-12培养基(Wako Pure Chemical Industries, Ltd.),在37℃和5% CO
结果显示在图74中。与涉及添加H
实施例13. HTRA1-抑制肽H308_D1G_S16A对人脐静脉内皮细胞(HUVEC)迁移的抑制作用
(13-1) HUVEC迁移测试
在37℃和5% CO
培养基1;含有0.1% BSA的无血清EGM
培养基2;补充有所有EGM(TM)-2 SingleQuots(TM)添加剂因子的EBM(TM)-2培养基(EGM生长培养基)
培养基3;含有300 nM H308_D1G_S16A的EGM生长培养基
将补充有细胞和样品的FluoroBlok HTS 96孔多孔支持系统在37℃和5% CO
迁移的细胞 = 含有HUVEC的孔的平均荧光强度(n = 3) - 空白孔的平均荧光强度(n = 3)。
结果显示于图75中。证实HTRA1-抑制肽H308_D1G_S16A对含有血清的培养基中诱导的HUVEC的迁移具有抑制作用。因此,发现本发明的肽表现出对血管生成(湿性年龄相关的黄斑变性的特征)的抑制作用。
实施例14. HTRA1-抑制肽在兔视网膜损伤模型中的视网膜保护作用(部分2)
使用在实施例(11-1)至(11-3)中制备和评估的兔视网膜损伤模型评估实施例1中制备的HTRA1-抑制肽H308或实施例6中制备的三种HTRA1-抑制肽之一对视网膜损伤的治疗效果。在麻醉下向每只模型动物的一只眼睛玻璃体内施用50 μL 40 mg/mL抑制肽溶液,并将动物饲养2个月。向另一只眼睛玻璃体内施用生理盐水。对于所有组,n = 5。
在生理盐水施用组中应发现RPE细胞面积的增加或RPE细胞计数的增加,而在HTRA1-抑制肽施用组中应抑制RPE细胞面积的增加或RPE细胞计数的增加。因此,可以证实所述HTRA1-抑制肽可用作抗衰老相关黄斑变性剂。在本实施例中,可以证实所述HTRA1-抑制肽尤其可用于治疗干性年龄相关的黄斑变性。
实施例15. 关于HTRA1-抑制肽在Rd10色素性视网膜炎模型小鼠中的感光细胞保护作用的研究
(15-1)Rd10小鼠的饲养
B6. CXB1-Pde6brd10/J (下文中被称为Rd10)小鼠在Pde6b基因中具有突变,并且是自发诱导感光细胞死亡的模型。它被广泛用作色素性视网膜炎的模型动物(Chang B1, HawesNL, Hurd RE, Davisson MT, Nusinowitz S, 和Heckenlivery JR., Vision Res.,February 2002, 42 (No. 4): p.517-25)。在正常饲养条件下饲养小鼠。
(15-2)向小鼠玻璃体施用测试物质
在P14和19,在氯胺酮麻醉下,使用33G针玻璃体内施用0.5 µL液体药物。将向一只眼睛施用PBS,并向另一只眼睛施用HTRA1-抑制肽(H308_D1G_S16A:SEQ ID NO:24,图36)。
(15-3)感光细胞死亡的评估和分析
安乐死后,将眼球切下,并通过将其浸入3.7% (W/V)甲醛-0.5-1% (W/V)甲醇-0.2%(W/V)苦味酸固定剂中24小时或更长时间来固定。石蜡包埋后,制备薄片切片。通过用苏木精-伊红染色切片并通过用内核层(INL层)的厚度校正视网膜切片的外核层(ONL层)的厚度来评估感光细胞保护作用。测量各自距离乳突0.6 mm和在乳突的任一侧的两个点作为中心部分,并测量各自距离乳突1.8 mm和在乳突的任一侧的两个点作为外围部分,然后计算两个中心部分的平均值和两个外围部分的平均值。使用Student氏配对的t检验方法用于统计分析。
(15-4)结果
与向其施用PBS的眼睛相比,在中心部分中的向其施用160 μg/眼的HTRA1-抑制肽的眼睛的外核层(其中聚集感光细胞的核)的厚度统计学显著性提高。在向其施用32 μg/眼的眼睛中没有观察到类似的药物作用,证实剂量依赖性(图78)。
实施例16. 在突变型视紫红质基因[P347L]-引入的兔中的HTRA1表达的分析
(16-1)兔视网膜中的HTRA1 mRNA表达的分析
使用RNeasy Mini试剂盒(QIAGEN)从雄性15周龄野生型(WT)和突变型视紫红质基因[P347L]-引入的(Tg)兔的视网膜提取RNA,并使用高容量cDNA逆转录试剂盒(ThermoFisher)将其逆转录为cDNA。然后,使用TaqMan探针(Thermo Fisher)和TaqMan基因表达测定法(Thermo Fisher)分析HTRA1的mRNA表达。
(16-2)使用激光显微切割对HTRA1 mRNA表达的位点特异性分析
使用10%中性缓冲福尔马林固定雄性的24周龄WT和Tg兔的视网膜。制备石蜡包埋的样本,然后切成薄片并用Nissl染色。使用LMD6500 (Leica)从染色的切片切割神经节细胞层、内核层和外核层,并使用QIAGEN RNeasy FFPE Mini Kit (QIAGEN)提取RNA。然后,使用SMARTer Stranded Total RNA-Seq Kit-Pico Input Mammalian (Clontech)为各自创建文库。使用Nextseq (Illumina)全面分析文库的序列。通过分析各层中特异性表达的标志物基因,证实切除没有问题。计算HTRA1 mRNA的拷贝数作为TPM(每百万的转录物)值。
(16-3)结果
(16-3-1)
在15周龄时,Tg兔的视网膜表达的HTRA1 mRNA为野生型兔的约1.5倍。另外,在外核层中发生感光细胞变性(Tg兔的数目为5,且野生型兔的数目4)。
(16-3-2)
当在24周龄时通过激光显微切割方法进行野生型兔和Tg兔中的位点特异性分析时,(a)神经节细胞层中的TPM值分别为11.76±1.47和9.99±3.94,(b)内核层中的TPM值分别为75.79±22.02和54.55±13.12,且(c)外核层中的TPM值分别为6.21±3.33和25.37±6.45(两个值之间存在统计学显著性差异)(例数为3至6)。
(16-3-3)
P347L转基因兔携带与人色素性视网膜炎患者相同的视紫红质基因突变。以与人色素性视网膜炎患者中相同的方式诱导感光细胞死亡,并且在15至24周龄时观察到感光细胞变性,这是此处使用的条件(Kondo M1, Sakai T, Komeima K, Kurimoto Y, Ueno S,Nishizawa Y, Usukura J, Fujikado T, Tano Y, 和Terasaki H., Invest OphthalmolVis Sci., May 2009, Vol. 50 (No. 3): p. 1371-7)。
外核层是其中感光细胞的核积累的部位,并且在感光细胞变性和增加的HTRA1基因表达之间观察到相关性,如果还考虑本发明的其他公开内容,则其表明其将是具有视紫红质基因突变、诸如P347L的色素性视网膜炎的有用治疗药物。
工业适用性
由本发明提供的肽或其缀合物和包含所述肽或其缀合物的药物组合物可用于色素性视网膜炎等的治疗或预防等。
序列表自由文本
SEQ ID NO:1 - 人SPINK2的氨基酸序列(图13)
SEQ ID NO:2 - 编码人SPINK2的氨基酸序列的核苷酸序列(图14)
SEQ ID NO:3 - 肽H218的氨基酸序列(图15)
SEQ ID NO:4 - 编码肽H218的氨基酸序列的核苷酸序列(图16)
SEQ ID NO:5 - 肽H223的氨基酸序列(图17)
SEQ ID NO:6 - 编码肽H223的氨基酸序列的核苷酸序列(图18)
SEQ ID NO:7 - 肽H228的氨基酸序列(图19)
SEQ ID NO:8 - 编码肽H228的氨基酸序列的核苷酸序列(图20)
SEQ ID NO:9 - 肽H308的氨基酸序列(图21)
SEQ ID NO:10 - 编码肽H308的氨基酸序列的核苷酸序列(图22)
SEQ ID NO:11 - 肽H321的氨基酸序列(图23)
SEQ ID NO:12 - 编码肽H321的氨基酸序列的核苷酸序列(图24)
SEQ ID NO:13 - 肽H322的氨基酸序列(图25)
SEQ ID NO:14 - 编码肽H322的氨基酸序列的核苷酸序列(图26)
SEQ ID NO:15 - 肽衍生物H308AT的氨基酸序列(图27)
SEQ ID NO:16 - 编码肽衍生物H308AT的氨基酸序列的核苷酸序列(图28)
SEQ ID NO:17 - 肽衍生物H321AT的氨基酸序列(图29)
SEQ ID NO:18 - 编码肽衍生物H321AT的氨基酸序列的核苷酸序列(图30)
SEQ ID NO:19 - 肽衍生物H322AT的氨基酸序列(图31)
SEQ ID NO:20 - 编码肽衍生物H322AT的氨基酸序列的核苷酸序列(图32)
SEQ ID NO:21 - 肽M7的氨基酸序列(图33)
SEQ ID NO:22 - 编码肽M7的氨基酸序列的核苷酸序列(图34)
SEQ ID NO:23 - 肽衍生物H308_S16A的氨基酸序列(图35)
SEQ ID NO:24 - 肽衍生物H308_D1G_S16A的氨基酸序列(图36)
SEQ ID NO:25 - 肽衍生物H308_D1S_S16A的氨基酸序列(图37)
SEQ ID NO:26 - 肽衍生物H308_D1E_S16A的氨基酸序列(图38)
SEQ ID NO:27 - 肽衍生物H308_D1SLI_S16A的氨基酸序列(图39)
SEQ ID NO:28 - 肽衍生物H321AT_D1G_S16A的氨基酸序列(图40)
SEQ ID NO:29 - 肽衍生物H322AT_D1G_S16A的氨基酸序列(图41)
SEQ ID NO:30 - HTRA1-抑制肽的通式(图42)
SEQ ID NO:31 - 由S标签和接头组成的氨基酸序列(图43)
SEQ ID NO:32 - C-末端六聚体的氨基酸序列(图44)
SEQ ID NO:33 - 引物1的核苷酸序列(图45)
SEQ ID NO:34 - 引物2的核苷酸序列(图46)
SEQ ID NO:35 - 引物3的核苷酸序列(图47)
SEQ ID NO:36 - 引物4的核苷酸序列(图48)
SEQ ID NO:37 - 引物5的核苷酸序列(图49)
SEQ ID NO:38 - 引物6的核苷酸序列(图50)
SEQ ID NO:39 - 引物7的核苷酸序列(图51)
SEQ ID NO:40 - 引物8的核苷酸序列(图52)
SEQ ID NO:41 - 引物9的核苷酸序列(图53)
SEQ ID NO:42 - 引物10的核苷酸序列(图54)
SEQ ID NO:43 - 引物11的核苷酸序列(图55)
SEQ ID NO:44 - 引物12的核苷酸序列(图56)
SEQ ID NO:45 - 引物13的核苷酸序列(图57)
SEQ ID NO:46 - 引物14的核苷酸序列(图58)
SEQ ID NO:47 - 引物15的核苷酸序列(图59)
SEQ ID NO:48 - 引物16的核苷酸序列(图60)
SEQ ID NO:49 - 引物17的核苷酸序列(图61)
SEQ ID NO:50 - 引物18的核苷酸序列(图62)
SEQ ID NO:51 - 引物19的核苷酸序列(图63)
SEQ ID NO:52 - 引物20的核苷酸序列(图64)
SEQ ID NO:53 - 人HTRA1 (全长)的氨基酸序列(图65)
SEQ ID NO:54 - H2-Opt的氨基酸序列(图8)
SEQ ID NO:55 - 引物21的核苷酸序列(图76)
SEQ ID NO:56 - 引物22的核苷酸序列(图77)。
- 用于治疗色素性视网膜炎的肽
- 用于治疗色素性视网膜炎的模拟肽环状化合物
