包含类泛素化修饰蛋白的药物组合物及其应用
文献发布时间:2023-06-19 10:05:17
技术领域
本发明属于生物医药领域,涉及一种包含类泛素化修饰蛋白的药物组合物及其应用,特别是涉及一种包含类泛素化修饰蛋白的用于促进神经元轴突生长和脊髓损伤修复的药物组合物及其应用。
背景技术
目前脊髓损伤后修复是世界性的难题之一,脊髓损伤修复的关键又是轴突再生,现如今如何使受损轴突再生已经成为一个科学热点。神经元细胞属于高度分化的细胞,所以其可塑性非常有限,包括脊髓在内的成年哺乳动物中枢神经系统的再生是困难的。目前通过改善受损轴突周围的微环境从而促进轴突部分再生的手段包括Rho-ROC抑制、抗NOGO抗体、细胞移植和生物材料的植入等。但是上述手段并不能充分的发挥轴突的再生潜能。对神经元细胞骨架构成极为重要的微管不仅是神经元细胞内物质运输的“货车”,而且对神经元突起的生长发育非常重要。但是胞内外信号如何精确调控神经元胞内骨架的重排至今未有定论。最近的研究发现微管和微管蛋白是可以受到大量的翻译后修饰,而且当被翻译后修饰的微管刺激微管切割酶对其敏感增高,进而调控神经元突起生长。因此神经元细胞的生长发育离不开微管的修饰、动态性和可塑性,那么受损轴突再生也是微管介导的过程,很多学者一直致力于研究受损轴突再生和细胞骨架之间的关系,从细胞内外信号的方面去探索细胞骨架的机制,进一步突破脊髓损伤后修复这个世界性难题。
微管是维持绝大多数细胞骨架的重要组成部分,为细胞提供结构和形状的支撑。微管蛋白有长约8nm的紧凑结构,拥有3个功能区域:氨基N末端、中间功能域和羧基C末端,不同的功能域有不同的生物活性。神经系统的发育时一个极其复杂的过程,受到神经细胞骨架的支持和调控,而神经细胞骨架是由微管、肌动蛋白和中间丝网络组成。而且神经元突起的形成与发育需要微管的切割和入侵。轴突和树突的发育和维持离不开微管,在轴突和树突的发育过程中,较长的微管可以作为阻止轴突或树突回缩的“支架”。微管在神经系统中还担当了“轨道”的角色,不仅将动力蛋白、靶向信息运送到神经元不同的区室,而且还能调控物质准确到达所需的位置。
Katanin是AAA切割蛋白家族的一员,AAA蛋白家族参与细胞周期调节、细胞器合成、蛋白囊泡运输等的调节,能够水解ATP产生的能力来实现不同的生物学功能。作为AAA家族的新成员,Katanin能够切割微管,现有的研究发现Katanin切管微管有四种模式:(1)当微管与动力蛋白结合,导致微管扭曲变形为“S”、“V”型,吸引Katanin对微管进行切割;(2)β微管含量多吸引Katanin进行切割;(3)Katanin识别微管分叉处进行切割微管;(4)当微管受到糖基化、谷氨酰化、乙酰化等修饰时,增强Katanin对微管的切割效率,去乙酰化修饰的微管则可有效减少Katanin的切割。
神经元系统中富含Katanin,其能通过在神经元突起生长过程中把长的微管切断并转运到轴突中,促进轴突分支的行程。其与另外一个切割蛋白Spastin是相似的,无论敲低或者过度表达都会严重损害轴突的生长。Katanin调控神经元的具体机制至今尚未明确,尽管已有少量研究发现Katanin可能会被泛素化蛋白所修饰进而调控神经元突起的生长,而对于其具体的机制仍然尚不明晰,且对于Katanin是否还受到其他类型修饰的调控更是一无所知。因此,有必要对Katanin在调控神经元轴突生长过程中的具体机制进行深入研究,从而为脊髓损伤修复的临床治疗提供新的理论基础和用药指导。
发明内容
本发明的目的在于解决现有技术中所存在的上述问题,从而针对Katanin p60在调控神经元轴突生长过程中的功能及机制进行了深入研究,发现Katanin p60受到类泛素化修饰的调控,明确了介导该修饰的关键蛋白,即类泛素化修饰蛋白(Small Ubiquitin-like Modifier,SUMO),揭示了SUMO化修饰调控Katanin p60在微管切割及神经元轴突生长方面的新机制,为脊髓损伤修复的临床治疗提供了切实的实验证据和科学依据。
为了解决上述技术问题,本发明是通过如下技术方案得以实现的。
本发明第一方面提供了一种促进神经元轴突生长和/或脊髓损伤修复的药物组合物,包括类泛素化修饰蛋白。
作为优选地,所述类泛素化修饰蛋白选自SUMO1、SUMO2、SUMO3、SUMO4中的一种或多种。
作为优选地,所述类泛素化修饰蛋白为SUMO2。
本发明第二方面提供了一种提高Katanin p60微管切割能力的组合物,包括类泛素化修饰蛋白。
作为优选地,所述类泛素化修饰蛋白选自SUMO1、SUMO2、SUMO3、SUMO4中的一种或多种。
作为优选地,所述类泛素化修饰蛋白为SUMO2。
作为优选地,所述Katanin选自Katanin p60、Katanin p80中的一种或多种。
作为优选地,所述Katanin 选自Katanin p60。
本发明第三方面提供了类泛素化修饰蛋白在制备促进神经元轴突生长和/或脊髓损伤修复的药物中的应用。
作为优选地,所述类泛素化修饰蛋白选自SUMO1、SUMO2、SUMO3、SUMO4中的一种或多种。
作为优选地,所述类泛素化修饰蛋白为SUMO2。
本发明第四方面提供了类泛素化修饰蛋白在制备提高Katanin微管切割能力的试剂中的应用。
作为优选地,所述类泛素化修饰蛋白选自SUMO1、SUMO2、SUMO3、SUMO4中的一种或多种。
作为优选地,所述类泛素化修饰蛋白为SUMO2。
作为优选地,所述Katanin选自Katanin p60、Katanin p80中的一种或多种。
作为优选地,所述Katanin 选自Katanin p60。
本发明第五方面提供了Katanin在制备促进神经元轴突生长和/或脊髓损伤修复的药物中的应用。
作为优选地,所述Katanin选自Katanin p60、Katanin p80中的一种或多种。
作为优选地,所述Katanin 选自Katanin p60。
SUMO化修饰时由SUMO蛋白介导的一种蛋白修饰方式,其修饰过程与泛素化修饰相似。哺乳动物体内存在4种SUMO蛋白亚型,分别为SUMO1、SUMO2、SUMO3、SUMO4。SUMO分子和Ub分子在三级结构高度相似,然而他们的生理学功能却是完全不同的,因为其表面电荷存在极大的差异。有研究表明基础SUMO化修饰被破坏后,会导致多种神经系统性疾病,包括神经退行性疾病,脊髓小脑共济失调、脑缺血和癫痫等,而对于SUMO化修饰在神经元轴突生长和脊髓损伤修复过程中所扮演的角色及其作用机制则未有研究。
本发明发明人通过大量的研究发现,Katanin p60能够被SUMO化修饰,SUMO化修饰能够显著增强Katanin p60切割微管的能力、促进神经元轴突生长,进而促进脊髓损伤的修复。针对SUMO化修饰过程,本发明发明人进行了深入研究,发现Katanin p60是行使微管切割功能的关键蛋白,其能够被SUMO化修饰,而修饰的关键位点则在K330,当对Katanin p60K330位点突变为Katanin p60 K330R后,则会导致其丧失切割微管的功能,从而不能促进神经元突起的生长。
本发明相对于现有技术具有如下技术效果:
(1)本发明发现了Katanin p60能够被SUMO化修饰,SUMO修饰后能够显著增加Kataninp60的微管切割水平、促进神经元轴突生长,进而促进脊髓损伤的修复。
(2)本发明对Katanin p60的SUMO化修饰过程中潜在的关键位点进行了深入研究,明确了Katanin p60是行使微管切割功能的关键蛋白,其能够被SUMO化修饰,而修饰的关键位点则在K330。
(3)本发明充分揭示了Katanin p60 SUMO化修饰在神经元轴突生长、脊髓损伤修复等过程中的的作用,肯定了Katanin p60类泛素化修饰的现象,明确了介导该修饰的关键位点,揭示了Katanin p60 SUMO化修饰调控神经元轴突生长的新机制,为脊髓损伤的临床治疗提供了切实的实验证据和科学依据。
附图说明
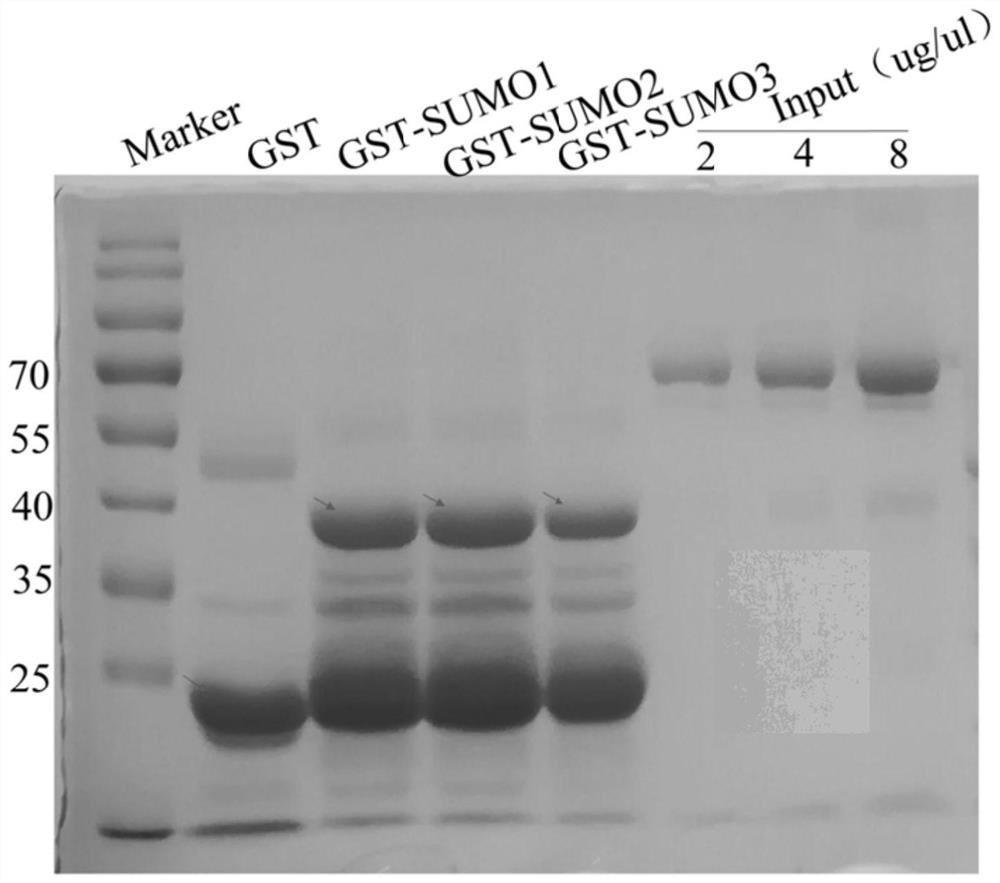
图1为纯化后的GST-SUMO1、GST-SUMO2、GST-SUMO3电泳结果。
图2为GST-SUMO1/2/3与Katanin p60在体外作用后的WB检测结果。
图3为Katanin p60与SUMO2在海马神经元共定位检测结果示意图。
图4为Katanin p60潜在的SUMO化位点示意图。
图5为Katanin p60潜在的SUMO化位点突变后对微管切割功能影响定性检测示意图。
图6为Katanin p60潜在的SUMO化位点突变后对微管切割功能影响定量检测示意图。
图7为Katanin p60-K330R和SUMO2蛋白免疫共沉淀结果示意图。
图8为Katanin p60的SUMO化修饰对微管切割功能定性检测示意图。
图9为Katanin p60的SUMO化修饰对微管切割功能定量检测示意图。
图10为Katanin p60及其突变体对海马神经元突起生长的影响示意图。
图11为Katanin p60及其突变体对海马神经元突起复杂程度的影响示意图。
图12为Katanin p60及其突变体对海马神经元突起总数量的影响示意图。
图13为Katanin p60及其突变体对海马神经元一级突起长度的影响示意图。
图14为Katanin p60及其突变体对海马神经元突起总长度的影响示意图。
图15为Katanin p60及其突变体K330R的SUMO化修饰对海马神经元突起生长的影响示意图。
图16为Katanin p60及其突变体K330R的SUMO化修饰对海马神经元突起总数量的影响示意图。
图17为Katanin p60及其突变体K330R的SUMO化修饰对海马神经元总长度的影响示意图。
具体实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
在无特别说明的情况下,本发明上下文中所列出的包括293T细胞、大鼠海马神经元细胞和COS7猴成纤维细胞等细胞工具均市售获得并根据细胞生物学中的常规方法进行培养。所有细胞系均通过中国典型培养物保藏中心(武汉)的短串联重复分析鉴定,并使用PCR检测试剂盒(上海Biothrive Sci)验证是否存在支原体污染,同时在液氮中冷冻保存并用于后续实验。本发明所使用的试剂中,均通过市售获得。本发明所使用的实验方法和技术,例如COS7培养、293T细胞培养、大鼠海马神经元培养、Western blot、载体构建、Pulldown实验、钙磷沉淀法转基因、分子克隆、PCR、免疫荧光染色、激光共聚焦、免疫共沉淀及动物实验等均为本领域的常规方法和技术。
生物学实验重复中选择具有代表性的结果呈现在上下文附图中,数据按照图示中规定的以mean±SEM展示。所有实验至少重复三次。数据采用GraphPad Prism 5.0或SPSS20.0软件进行分析。采用t检验或单因素方差分析比较两组或两组以上的平均值差异。p<0.05被认为是一个显著的差异。
实施例1 Katanin p60的类泛素化修饰
(1)构建GST-SUMO1、GST-SUMO2、GST-SUMO3质粒,将构建好的质粒转化进感受态BL21细胞;
(2)隔夜培养后挑选单克隆阳性菌落验证无误后取3 mL菌液于250 mL含有1%氨苄抗性的LB培养基培养,摇床37℃,180rpm,直至菌液OD为0.8;
(3)加入0.1mM IPTG于30℃诱导6-8h;
(4)于4℃,12000 rpm收集菌液,加入适量裂解液,冰浴1h,每隔15min震荡数次,使用超声破碎仪以20%强度,5s×5s,超声6次;
(5)于4℃,12000 rpm离心15min取上层浑浊上清液;
(6)于离心管中加入200μL beads,加入1mL裂解液,离心后去除上清,加入步骤(5)获得的浑浊上清液,于4℃翻转台翻转结合过夜;
(7)于4 ℃,1000 rpm离心5 min去除上清液,加入1mL裂解液进行清洗,重复清洗4次,获得纯化好的蛋白;
(8)将蛋白进行纯化后进行SDS-PAGE电泳,最后进行考马斯亮蓝染色;
结果如图1所示,该电泳图谱以左侧蛋白Marker所在泳道为第一泳道,从左至右依次编号为1-8,其中第6-8泳道分别为标准蛋白2μg、4μg、8μg。
随后将纯化的SUMO蛋白与大鼠脑裂解液混合孵育过夜后进行GST-Pulldown实验,具体步骤如下:
(1)称取鼠脑组织400mg;
(2)抽取适量的脑裂解液并加入100×PMSF(每100mg鼠脑组织加入500 μL细胞裂解液);
(3)用研磨棒在冰上研磨鼠脑组织,使得鼠脑组织裂解充分;
(4)4℃、12000rpm条件下离心15min,保留上清,另取200μL上清加入5×loadingbuffer,干热仪95℃加热6min,作为阳性对照(Input);
(5)EP管中加入50μLbeads,1mL细胞裂解液,离心清洗beads后加入500μL鼠脑裂解液,4℃翻转1h后离心取上清;
(6)分别取50μg纯化好的蛋白,加入鼠脑裂解液中,4℃翻转过夜,离心除去上清,保留beads;
(7)将步骤(6)获得的beads使用Washing Buffer进行清洗,加入适量裂解液,随后加入5×loading buffer,干热仪加热6min后,进行Western Blot检测。
结果如图2所示。结果显示,GST-SUMO2蛋白能够与大鼠脑裂解液中的Katanin p60相互结合,即SUMO2与Katanin p60在体外可相互结合。
实施例2 Katanin p60与SUMO2蛋白共定位
(1)培养海马神经元细胞,用4%PFA在4℃固定40min后,用预冷的PBS进行清洗;
(2)在室温下用TBST(含1% Triton X-100)进行打孔(每孔细胞加入500μL),5min/次,重复两次;
(3)制备3%封闭血清(0.3g BSA+10mL TBST),每孔细胞加入200μL封闭血清,室温下封闭1h;
(4)将Coverlips转移至抗体孵育盒,含细胞的玻片面朝上,用TBST清洗,抗体加入封闭血清进行稀释,每一Coverlips滴加60μL Katanin p60抗体和SUMO2抗体的混合稀释液,4℃孵育过夜;
(5)将步骤(4)中孵育过后的Katanin p60抗体和SUMO2抗体的混合稀释液回收后,用TBST清洗,加入二抗及封闭血清,每一Coverlips滴加60μL抗体稀释液,室温避光孵育1h;
(6)去除二抗稀释液,用TBST清洗,在载玻片上滴加适量的封片剂,Coverlips倒置覆盖封片剂,暗箱静置风干;
(7)于激光共聚焦显微镜下观察并拍摄细胞。
结果如图3所示,箭头所指的位置为Katanin p60和SUMO2共定位区域,局部放大后可以看到Merge后黄色信号,共定位的区域更加明显。
实施例3 Katanin p60突变体对微管切割功能的影响
(1)构建GFP-Katanin p60质粒(NCBI Reference Sequence: NP_001004217.2);
(2)通过生物信息学软件分析,确定Katanin p60内潜在的3个SUMO化修饰位点,分别为K77、K157和K330(参见图4);
(3)针对K77、K157和K330三个位点,对步骤(1)构建的GFP-Katanin p60质粒分别进行位点突变,获得GFP-Katanin p60-K77R,GFP-Katanin p60-K157R,GFP-Katanin p60-K330R以及三位点同时突变的PAN;
(4)将COS7细胞用10mM的Tubacin处理后,将GFF、步骤(1)构建的GFP-Katanin p60质粒及步骤(3)获得的突变质粒转染COS7细胞;
(5)通过免疫荧光化学染色观察其Tubulin的变化。
本发明发明人发现,Katanin p60对微管具有切割能力,尤其对乙酰化的微管切割效果更为显著。对此,在处理前,先使用Tubacin处理细胞以增加微管的乙酰化水平。结果如图5-6所示,其中图6为图5的定量统计分析结果。结果显示,与对照组GFP对比,过表达Katanin p60明显把微管切割成小的片段,而过表达全突变质粒PAN,则基本不能切割微管,说明Katanin p60 3个潜在的SUMO化位点全部突变后,Katanin p60丧失了微管切割的能力。而进一步的实验发现,K77R和K157R并不会影响微管切割,而K330R能够使Katanin p60的微管切割能力丧失,由此证明K330为Katanin p60的SUMO化位点,能够影响Katanin p60的切割能力,差异具有统计学意义。
实施例4 Katanin p60-K330R与SUMO2蛋白的免疫共沉淀实验
(1)分别构建HA-SUMO2、GFP-Katanin p60、GFP-Katanin p60-K330R和Flag-ubc9质粒;
(2)将步骤(1)构建的质粒分别转染至293T细胞内;
(3)培养48小时后加入细胞裂解液裂解细胞收集细胞上清液;
(4)向含有beads的EP管中加入200μL细胞上清液,4℃冰箱翻转1h后,留上清;
(5)向步骤(4)上清中加入HA抗体,4℃翻转孵育过夜;
(6)将步骤(5)溶液加入至含有经细胞裂解液预洗beads的EP管中,4℃翻转3h后,离心弃上清;
(7)加入20μL细胞裂解液和5×loading buffer,干热仪95℃加热6min;
(8)进行Western Blot验证免疫共沉淀产物中是否含有GFP-Katanin p60。
结果如图7所示,结果显示,Katanin p60野生型能够和SUMO2蛋白相互作用,而Katanin p60-K330R不能与SUMO2结合。进一步证K330为SUMO2结合的关键位点,在该位点突变后,Katanin p60即丧失了与SUMO2结合的能力而不能被类泛素化修饰,进而丧失对微管的切割功能。
实施例5 Katanin p60的SUMO化修饰对其微管切割功能的影响
(1)构建大鼠的SUMO化酶的mCherry-SUMO2质粒;
(2)将COS7细胞用10mM的Tubacin处理后,将步骤(1)构建的质粒分别和GFP-Kataninp60质粒、Katanin p60-K330R质粒共转COS7细胞,表达24 h;
(3)将COS7细胞用4%PFA在4℃固定40min后,用预冷的PBS进行清洗;
(4)在室温下用TBST进行打孔(每孔细胞加入500μL),5min/次,重复两次;
(5)制备3%封闭血清(0.3gBSA+10mLTBST),每孔细胞加入200μL封闭血清,室温下封闭1h;
(6)将Coverlips转移至抗体孵育盒,含细胞的玻片面朝上,用TBST清洗,Tubulin抗体加入封闭血清进行稀释,每一Coverlips滴加60μLTubulin抗体稀释液,4℃孵育过夜;
(7)将步骤(6)中孵育过后的Tubulin抗体稀释液回收后,用TBST清洗,加入二抗及封闭血清,每一Coverlips滴加60μL抗体稀释液,室温避光孵育1h;
(8)去除二抗稀释液,用TBST清洗,在载玻片上滴加适量的封片剂,Coverlips倒置覆盖封片剂,暗箱静置风干;
(9)观察并拍摄细胞。
结果如图8-9所示,其中图9为图8的定量检测结果,*为
实施例6 Katanin p60及其突变体对海马神经元突起的影响
(1)培养并观察海马神经元细胞,注意海马神经元细胞的状态以及是否有污染;
(2)将原培养基转移至辅孔,每一孔加入500μL Neurobasal培养基进行饥饿;
(3)使用磷酸钙转染试剂盒,向EP管中分别加入1μg GFP、GFP-Katanin p60及其突变体质粒和25μL CaCl
(4)将步骤(3)中的溶液进行混合,暗箱静置15min;
(5)每孔滴加50μL混合液,混合液分次在孔内不同方位滴加,轻柔摇晃数次,40min后,用1×SA清洗钙磷颗粒2次后,加入原培养基;
(6)转染48h后,使用4%PFA固定细胞,进行免疫荧光化学染色,于激光共聚焦下观察。
结果如图10-14所示,其中*为
进一步地,选择GFP-Katanin p60、GFP-Katanin p60-K330R分别与SUMO2共转神经元,观察对神经元突起生长影响的实验,结果如图15-17所示。结果显示,共表达GFP-Katanin p60WT和SUMO2能进一步促进突起生长,而如果过表达GFP-Katanin p60-K330R和SUMO2则没有促进作用。
综合上述结果,本发明发现了Katanin p60能够被SUMO化修饰,SUMO修饰后能够显著增加Katanin p60的微管切割能力、促进神经元轴突生长,进而促进脊髓损伤的修复;进一步地,本发明对Katanin p60的SUMO化修饰过程中潜在的关键位点进行了深入研究,明确了Katanin p60是行使微管切割功能的关键蛋白,其能够被SUMO化修饰,SUMO化修饰可显著增强Katanin p60对微管的切割能力;而修饰的关键位点则在K330,在该位点突变后,Katanin p60即丧失了与SUMO2结合的能力而不能被类泛素化修饰,进而丧失对微管的切割功能;本发明充分揭示了Katanin p60的SUMO化修饰在神经元轴突生长、脊髓损伤修复等过程中的的作用,肯定了Katanin p60类泛素化修饰的现象,明确了介导该修饰的关键位点,揭示了Katanin p60的SUMO化修饰调控神经元轴突生长的新机制,为脊髓损伤的临床治疗提供了切实的实验证据和科学依据。
以上具体实施方式部分对本发明所涉及的分析方法进行了具体的介绍。应当注意的是,上述介绍仅是为了帮助本领域技术人员更好地理解本发明的方法及思路,而不是对相关内容的限制。在不脱离本发明原理的情况下,本领域技术人员还可以对本发明进行适当的调整或修改,上述调整和修改也应当属于本发明的保护范围。
- 包含类泛素化修饰蛋白的药物组合物及其应用
- 一种包含Spastin泛素化修饰抑制剂的药物组合物及其应用
