治疗以PCSK9表达为特征的癌症的组合物和方法
文献发布时间:2023-06-19 10:32:14
相关申请
本申请要求于2018年6月25日提交的美国临时专利申请号62/689,288和于2018年11月26日提交的美国临时专利申请号62/771,293的优先权,其全部内容通过引用并入本文。
技术领域
本公开内容公开的主题涉及通过抑制PCSK9表达来治疗癌症的组合物和方法。
背景
免疫检查点抑制剂疗法的出现是癌症疗法最近的主要进展之一。抑制免疫检查点已被证实对多种类型的癌症(包括黑素瘤、肺癌、膀胱癌等)有效。然而,尽管免疫检查点抑制剂已经取得了巨大成功,它们仅对10-30%的癌症患者有效。不过,在对免疫检查点疗法有反应的患者亚组中所观察到的持久成功是前所未有的,并证明了癌症免疫疗法的巨大潜力。因此,显然迫切需要寻找可以与现有免疫检查点抑制剂互补或协同作用的其他分子靶标。
概述
本概述是用来介绍在下文的详述中将进一步描述的一系列概念。本概述既不用来确定所要求保护的主题的关键或必要特征,也不用来用于帮助限制所要求保护的主题的范围。
本公开内容部分地基于本发明人的发现,即PCSK(前蛋白转化酶枯草杆菌蛋白酶/kexin 9型前体)是癌症治疗的新靶标。PCSK9是一种分泌蛋白,已知在调节肝细胞和其他细胞类型中的LDL-R(低密度脂蛋白受体)水平中起关键作用。PCSK9通过与LDL-R结合并促进其在宿主细胞内的降解而对LDL-R进行负调控。先前发现,取决于它们是否增强或减弱PCSK9的LDL-R降解功能,PCSK9基因内的突变能够导致LDL血液浓度显著升高或降低。PCSK9耗竭还导致肿瘤细胞表面MHC-I表达的明显增加,其促进细胞毒性T细胞稳健的肿瘤内浸润。
在本发明的一个实施方案中,用于治疗个体的癌症的方法可包括给所述个体施用治疗有效量的PCSK9抑制剂。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的拮抗性抗体。在优选的实施方案中,拮抗性抗体可为
在本发明的另一个实施方案中,PCSK9抑制剂可为双特异性抗体,其中双特异性抗体的一条臂针对PCSK9具有拮抗作用,而另一条臂针对至少一种免疫检查点蛋白具有拮抗作用。
在本发明的另一个实施方案中,至少一种免疫检查点蛋白可选自PD1、PDL1、CTLA4、LAG3、TIM3、TIGIT、TGF-β及其组合。
在本发明的另一个实施方案中,PCSK9抑制剂可为双特异性抗体,其中所述双特异性抗体的一条臂针对PCSK9具有拮抗作用,而另一条臂针对免疫刺激性靶标具有激动作用。
在本发明的另一个实施方案中,免疫刺激性靶标可选自1BB、OX40和ICOS。
在本发明的另一个实施方案中,PCSK9抑制剂可为融合蛋白。在优选的实施方案中,融合蛋白可为膜联蛋白A2融合蛋白或膜联蛋白A2-Fc融合蛋白。
在本发明的另一个实施方案中,PCSK9抑制剂可为adnectin。在优选的实施方案中,adnectin可为BMS0962476[Bristol Myers Squib]。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的单结构域抗体。
在本发明的另一个实施方案中,PCSK9抑制剂可为EDF-A结构域模拟肽。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的RNAi Alnylam/ALN-PCS02。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的RNAi Alnylam/TheMedicines Company/ALN-PCSsc/Inclisaran。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的反义寡核苷酸。在优选的实施方案中,反义寡核苷酸可为ISIS394814、SPC4061[Santaris-Pharma]或PSC5011[Santaris-Pharma]。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的基于肽的疫苗。在优选的实施方案中,基于肽的疫苗可为AT04A[Affiris]或其他PCSK9疫苗,例如在WIPO专利申请公开号WO2011/027257中所述的那些疫苗。
在本发明的另一个实施方案中,PCSK9抑制剂可为小分子抑制剂。在优选的实施方案中,小分子抑制剂可为SX-PCSK9[Serometrix]或其他小分子PCSK9抑制剂,例如在WIPO专利申请公开号WO2014/150395中所述的那些小分子抑制剂。
在本发明的另一个实施方案中,所述方法还给所述个体施用至少一种免疫检查点抑制剂。
在本发明的另一个实施方案中,在施用至少一种免疫检查点抑制剂之前施用PCSK9抑制剂。
在本发明的另一个实施方案中,在施用至少一种免疫检查点抑制剂之后施用PCSK9抑制剂。
在本发明的另一个实施方案中,PCSK9抑制剂与至少一种免疫检查点抑制剂同时施用。
在本发明的另一个实施方案中,至少一种免疫检查点抑制剂可选自抗PD1抗体、抗PDL1抗体、抗CTLA4抗体、抗LAG3抗体、抗TIM3抗体、抗TIGIT抗体及其组合。
在本发明的另一个实施方案中,所述方法还包括给所述个体施用抗癌治疗,所述抗癌治疗选自放疗、常规化疗或靶向化疗。
在本发明的另一个实施方案中,所述方法还包括给所述个体施用血管生成因子的至少一种抑制剂。
在本发明的另一个实施方案中,血管生成因子的至少一种抑制剂选自VEGF的抑制剂、VEGFR1的抑制剂、VEGFR2的抑制剂、TEK的抑制剂及其组合。
在本发明的另一个实施方案中,血管生成因子的至少一种抑制剂包括小分子。
在本发明的另一个实施方案中,血管生成因子的至少一种抑制剂包括抗体。
在本发明的另一个实施方案中,血管生成因子的至少一种抑制剂包括融合蛋白。
在本发明的另一个实施方案中,癌症可为表达PCSK9的实体瘤。
在本发明的另一个实施方案中,癌症可为表达PCSK9的血源性癌症。
附图的简要说明
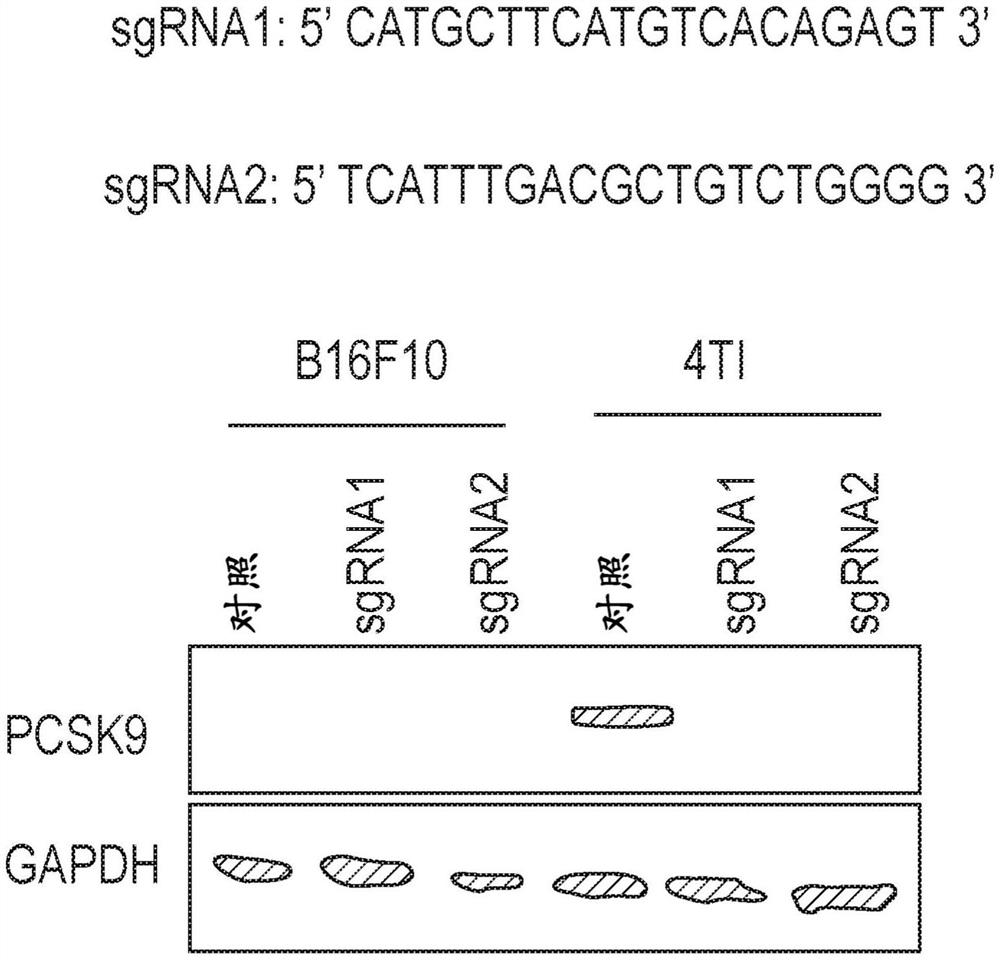
图1是显示B16F10和4T1肿瘤细胞中成功敲除PCSK9的蛋白质印迹:(a)用于敲除PCSK9细胞的两种sgRNA的序列;(b)将sgRNA序列克隆入重组慢病毒载体并分别用于感染B16F10和4T1细胞。
图2是显示PCSK敲除对肿瘤生长的影响的图像和图表:(a)显著减缓C57/BL/6小鼠B16F10模型的肿瘤生长;(b)显著减弱4T1肿瘤模型的肿瘤生长。
图3是显示通过PCSK9抗体
图4A-4H是显示PCSK9缺陷诱导的肿瘤生长抑制的图像和图表。
图5A-5K是显示PCSK9抑制克服了针对抗PD1治疗的肿瘤耐药的图像和图表。
图6A-6I是显示初始肿瘤接种治愈后的小鼠再攻击之后的肿瘤生长的图像和图表。
图7A-7E是显示总体淋巴细胞浸润到B16F10肿瘤中免疫荧光染色的图像和图表。
图8A-8O是显示PCSK9耗竭增强肿瘤内T细胞浸润和CTL活性的图像和图表。
图9A-9F是显示各种免疫效应细胞在介导PCSK9缺陷型肿瘤生长延迟中的作用的数据的图像和图表。
图10A-10H是显示PCSK9促进溶酶体介导的MHC-I在肿瘤细胞中的降解的图像和图表。
图11A-11D是显示小鼠或人肿瘤组织中PCSK9与MHC或HLA之间关系的数据的图像和图表。
图12是显示H2-K1过表达对B16F10肿瘤中抗PD1治疗的影响的图像和图表。
图13是显示研究PCSK9和H2-K1蛋白之间的上位效应关系和它们对免疫活性C57BL/6小鼠中B16F10肿瘤生长的影响的图像和图表。
图14是显示研究PCSK9和LDLR在决定B16F10黑素瘤细胞的细胞表面MHC-I表达和肿瘤形成能力之间的关系的图像和图表。
图15是显示PCSK mRNA水平与以下癌症中的存活率之间的相关性的图表:人肝脏的肝细胞癌(LIHC)、胰腺癌(PAAD)、皮肤的皮肤黑素瘤(SKCM)、葡萄膜黑素瘤(UVM)、人膀胱的尿路上皮癌(BLCA)、肺腺癌(LUAD)、肾脏的肾透明细胞癌(KIRC)、肾脏的肾乳头状细胞癌(KIRP)和卵巢癌(OV)。
图16是说明溶酶体中PCSK9介导的MHC-I降解的示意图。
详述
在下面的描述中,出于解释的目的,阐述了许多具体细节,以便提供对本发明的实施方案的透彻理解。本领域技术人员将认识到,可以在没有这些具体细节或具有等效布置的情况下实践本发明的实施方案。在其他情况下,为了避免使本发明的实施方案不必要地晦涩难懂,以框图形式显示众所周知的结构和装置。
本公开内容的主题具有足够的细节,以提供对更广泛的发明主题的一个或多个特定实施方案的理解。这些描述阐述并且示例了那些特定实施方案的特定特征,而不将本发明的主题限制为所明确描述的实施方案和特征。在不脱离本公开内容公开的主题的范围的情况下,鉴于这些描述的思考将可能得到另外的和类似的实施方案和特征。
如本文所用,“治疗(treatment)”、“治疗(therapy)”和/或“治疗方案(therapyregimen)”是指响应于由患者表现出的或患者可能易感的疾病、病症或生理状况而做出的临床干预。治疗的目的包括减轻或预防症状,减慢或停止疾病、病症或病况的进展或恶化和/或缓解疾病、病症或病况。
术语“有效量”或“治疗有效量”是指足以实现有益或期望的生物学和/或临床结果的量。
如本文所用,术语“受试者”和“患者”在本文可互换使用,并且既指人也指非人动物。本公开内容的术语“非人动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类、羊、狗、猫、马、牛、鸡、两栖动物、爬行动物等。
如本文所用,术语“疾病”包括但不限于影响生物体一部分的结构或功能的任何异常情况和/或病症。它可能是由外部因素(例如传染病)引起的,或者是由内部功能异常(例如癌症、癌症转移等)引起的。
如本领域中已知的,癌症一般被认为是不受控制的细胞生长。本公开内容的方法能够用于治疗以PCSK9表达为特征的任何癌症及其任何转移。此类癌症包括但不限于癌(carcinoma)、淋巴瘤、母细胞瘤、肉瘤和白血病。此类癌症的更具体实例包括乳腺癌、前列腺癌、结肠癌、鳞状细胞癌、小细胞肺癌、非小细胞肺癌、卵巢癌、宫颈癌、胃肠道癌、胰腺癌、胶质母细胞瘤、肝癌、膀胱癌、肝细胞瘤、结直肠癌、子宫颈癌、子宫内膜癌、唾液腺癌、间皮瘤、肾癌、外阴癌、胰腺癌、甲状腺癌、肝细胞癌、皮肤癌、黑素瘤、脑癌、神经母细胞瘤、骨髓瘤、各种类型头颈癌、急性淋巴细胞白血病、急性髓细胞性白血病、尤因肉瘤和周围神经上皮瘤。在一些实施方案中,癌症包括表达PCSK9的实体瘤。在其他实施方案中,癌症包括表达PCSK9的血源性癌症。
如本文所用,“前蛋白转化酶枯草杆菌蛋白酶kexin 9”或“PCSK9”是指在施用该抑制剂或之后能够降低受试者体内PCSK9的正常活性的任何分子。PCSK9是LDL胆固醇(LDL-C)代谢中的重要蛋白质。PCSK9在LDL受体(LDLR)的降解中起重要作用。在LDL代谢中,LDLR与循环血液中的LDL结合,并将LDL内化进网格蛋白包被小窝,以进行溶酶体降解。LDL内化后,LDLR然后循环回到质膜,其中它能够结合更多LDL。此过程不断重复。但是,LDLR的PCSK9降解会阻止LDLR循环到膜上,从而降低LDL从血液中的清除率。因此,PCSK9是用于抑制促进降低的LDL-C的重要靶标,因此是用于治疗高胆固醇血症和相关心血管疾病的治疗靶标。在PCT/US2008/056316中描述了PCSK9的晶体结构。此外,PCT/IB2004/001686描述了人PCSK9基因中与高胆固醇血症有关的突变。PCSK9是LDL-C代谢途径的一部分。
除非另有定义,否则本文中使用的所有技术术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。
本公开内容部分地基于本发明人的发现,即PCSK(前蛋白转化酶枯草杆菌蛋白酶/kexin 9型前体)是癌症治疗的新靶标。PCSK9是一种分泌蛋白,已知在调节肝细胞和其他细胞类型中的LDL-R(低密度脂蛋白受体)水平中起关键作用。PCSK9通过与LDL-R结合并促进其在宿主细胞内的降解而对LDL-R进行负调控。先前发现,取决于它们是否增强或减弱PCSK9的LDL-R降解功能,PCSK9基因内的突变能够导致LDL血液浓度显著升高或降低。
在本发明的一个实施方案中,用于治疗个体的癌症的方法可包括给所述个体施用治疗有效量的PCSK9抑制剂。在本发明的又一个实施方案中,所述方法还包括给所述个体施用至少一种免疫检查点抑制剂。
在一些实施方案中,PCSK9抑制剂可包括针对PCSK9的拮抗性抗体。抗体可以是单克隆、多克隆、单结构域或其片段。如本文所用,“单克隆抗体”或“MAb”是指来自基本上均质的抗体群的抗体(即,其中个体抗体彼此相同,但可能有一些自然发生的突变)。MAb是高度特异性的,针对单个抗原位点,并且通常针对抗原上的单个决定簇。抗体可以进一步被人源化。如本文所用,“人源化”抗体是指非人(例如鼠)抗体的形式,其为嵌合免疫球蛋白、免疫球蛋白链或其片段(例如Fv、Fab、Fab'、F(ab')2或抗体的其他抗原结合亚序列),其含有源自非人免疫球蛋白的最小序列。许多人源化抗体是人免疫球蛋白(受体抗体),其中受体的互补决定区(CDR)的残基被具有所需的特异性、亲和力和能力的非人物种(例如小鼠、大鼠或兔)(供体抗体)的CDR残基替换。
以下专利文献中描述了许多PCSK9拮抗性/抑制性抗体(及其片段),它们可适用于本文提供的方法:MERCK/SCHERING CORP.(PCT/US2008/081311);SCHERING CORP.(PCT/US2011/056649);REGENERON PHARMACEUTICALS,INC.(PCT/US2012/054756;PCT/US2012/048574;PCT/US2009/068013);SANOFI(PCT/EP2012/051318;PCT/EP2012/051320;PCT/EP2012/051321);ELI LILLY AND COMPANY(PCT/US2012/054737);AFFIRIS AG(PCT/EP2012/067950);PFIZER(PCT/IB2012/053534;PCT/IB2012/050924;PCT/IB2010/053784);NOVARTIS AG(PCT/EP2012/061045;PCT/US2012/041214;PCT/EP2008/054417);IRM LLC和NOVARTIS AG(PCT7US2012/024633;PCT/US2010/059959);GENENTECH INC.和HOFFMANN LAROCHE(PCT/US2011/024633);MERCK SHARP&DOHME(PCT/US2010/054714;PCT/US2010/054640;PCT/US2010/048849);RINAT NEUROSCIENCE CORP/PFIZER(PCT/IB2009/053990);MERCK&CO INC.(PCT/US2009/033369;PCT/US2009/033341;PCT/US2007/023223;PCT/US2007/023213;PCT/US2007/023212;PCT/US2007/023169);和AMGEN INC.(PCT/US2008/074097)。在其他实施方案中,根据本发明方法的针对PCSK9的拮抗性抗体包括但不限于
在另一个实施方案中,PCSK9抑制剂可包括双特异性抗体。在一个实施方案中,双特异性抗体可包括针对PCSK9具有拮抗作用的一条臂和针对至少一种免疫检查点蛋白具有拮抗作用的另一条臂。合适的免疫检查点蛋白包括但不限于PD1、PDL1、CTLA4、LAG3、TIM3、TIGIT、TGF-β及其组合。
在另一个实施方案中,双特异性抗体可包括针对PCSK9具有拮抗作用的一条臂和针对免疫刺激性靶标具有激动作用的另一条臂。合适的免疫刺激性靶标包括但不限于1BB、OX40和ICOS。
在另一个实施方案中,PCSK9抑制剂可包括融合蛋白。融合蛋白或嵌合蛋白是指通过将两个或多个最初编码为分开的蛋白质的基因连接起来而产生的那些蛋白质。在一个实施方案中,PCSK9抑制剂可包括膜联蛋白A2融合蛋白。在另一个实施方案中,PCSK9抑制剂可包括膜联蛋白A2-Fc融合蛋白。
在另一个实施方案中,PCSK9抑制剂可包括adnectin。如本文所用,术语“adnectin”是指基于第十纤连蛋白III型结构域并且被设计为以高亲和力和特异性结合治疗相关靶标的那些治疗性蛋白质。合适的实例包括但不限于PCSK9抑制剂BMS-962476(Bristol Myers Squibb)。
PCSK9抑制性分子还可包括RNAi。如本文所用,‘RNAi’意指包括本领域已知的任何基因沉默方法,包括转录后基因沉默(PTGS)方法。这些可包括但不限于以下任何一种或多种:微RNA(miRNA);小干扰(siRNA);短发夹RNA(shRNA);初级微RNA(pri-miRNA);不对称干扰RNA(aiRNA);小型内部分段RNS(sisiRNA);meroduplex RNA(mdRNA);RNA-DNA嵌合双链体;跨界RNA(tkRNA);tRNA-shRNA;串联siRNA(tsiRNA);串联发夹RNA(thRNA);pri-miRNA模拟簇和转录基因沉默(TGS)。在一个实施方案中,PCSK9抑制剂可包括EDF-A结构域模拟肽。在另一个实施方案中,PCSK9抑制剂可包括针对PCSK9的RNAi Alnylam/ALN-PCS02。在又一个实施方案中,PCSK9抑制剂可包括针对PCSK9的RNAi Alnylam/The Medicines Company/ALN-PCSsc/Inclisaran。
在其他实施方案中,PCSK9抑制剂可包括反义寡核苷酸。实例包括来自IsisPharmaceuticals/Bristol-Myers Squibb的PCSK9反义寡核苷酸(ISIS 394814;BMS-PCSK9Rx)。类似地,来自Santaris Pharma的锁核酸(SPC4061;SPC5011;LNA ASO)降低了小鼠的PCSK9 mRNA水平。LNA ASO与人和小鼠PCSK9 mRNA(登录号NM174936和NM153565)互补,是一种长13个核苷酸的gapmer,具有以下序列:GTctgtggaaGCG(大写LNA,小写DNA)和硫代磷酸酯核苷间键。Alnylam Pharmaceuticals在抑制PCSK9的siRNA(ALN-PCS)的临床试验中已显示出积极的结果。如下的专利文献描述了许多PCSK9抑制性寡核苷酸,它们在本公开内容的范围内:SANTARIS PHARMA A/S(PCT/EP2007/060703;PCT/EP2009/054499;PCT/EP2010/059257);ISIS PHARMACEUTICAL INC.(PCT/US2007/068404);SIRNA THERAPEUTICSINC.(PCT/US2007/073723);ALNYLAM PHARMACEUTICALS INC.(PCT/US2011/058682;PCT/US2010/047726;PCT/US2010/038707;PCT/US2009/032743;PCT/US2007/068655);RXIPHARMACEUTICALS CORP.(PCT/US2010/000019)INTRADIGM CORP.(PCT/US2009/036550);和NASTECH PHARM CO.(PCT/US2008/055554)。
在本发明的另一个实施方案中,PCSK9抑制剂可为针对PCSK9的基于肽的疫苗。在优选的实施方案中,基于肽的疫苗可为AT04A[Affiris]或其他PCSK9疫苗,例如在WIPO专利申请公开号WO2011/027257中所述的那些疫苗。
在本发明的另一个实施方案中,PCSK9抑制剂可为小分子抑制剂。在优选的实施方案中,小分子抑制剂可为SX-PCSK9[Serometrix]或其他小分子PCSK9抑制剂,例如在WIPO专利申请公开号WO2014/150395中所述的那些小分子抑制剂。以上描述和附图是说明性的,并且不应解释为将本发明限制为所公开的确切形式。相关领域的技术人员能够理解,根据以上公开内容,可以进行许多修改和改变。本公开内容描述了许多具体细节以提供对本公开内容的透彻理解。然而,在某些情况下,为了避免使描述晦涩难懂,没有描述众所周知的或常规的细节。
已经开发了模拟结合PCSK9的LDLR的EGFA结构域的肽来抑制PCSK9。类似地,已经开发了结合PCSK9的EGF-A肽、基于纤连蛋白的支架结构域蛋白和中和PCSK9的变体(例如具有Pro/Cat结构域),所有的这些均被证明抑制PCSK9活性。如下的专利文献描述了许多PCSK9抑制性肽,它们在本公开内容的范围内:SCHERING CORP.(PCT US2009/044883);GENENTECH INC.和HOFFMANN LA ROCHE(PCT US2012/043315);SQUIBB BRISTOL MYERS CO.(PCT/US2011/032231;PCT/US2007/015298);ANGELETTI P 1ST RICHERCHE BIO(PCT/EP2011/054646)和AMGEN INC.(PCT/US2009/034775)。
根据本发明的治疗组合物的施用可以与掺入制剂中以提供改善的转移、递送、耐受性等的合适的载体、赋形剂和其他试剂一起施用。可以在所有药物化学家都知道的配方中找到许多合适的制剂:Remington's Pharmaceutical Sciences,Mack PublishingCompany,Easton,Pa。这些制剂包括例如粉末、糊剂、软膏、胶冻剂、蜡、油、脂质、含脂质(阳离子或阴离子)的囊泡(例如
剂量可以根据待施用的受试者的年龄和尺码、靶标疾病、病况、施用途径等而变化。当本公开内容的PCSK9抑制剂用于治疗成年患者中与PCSK9相关的包括癌症等的各种病况和疾病时,通常以单剂量静脉内施用本公开内容的PCSK9抑制剂可能是有利的,所述单剂量为约0.01至约20mg/kg体重,更优选约0.02至约7、约0.03至约5或约0.05至约3mg/kg体重的单剂量。根据病况的严重程度,可以调整治疗的频率和持续时间。
各种递送系统是已知的并且可以用于施用本公开内容的药物组合物,例如,封装在脂质体、微粒、微胶囊中,能够表达突变病毒的重组细胞,受体介导的内吞作用(参见例如Wu et al.(1987)J.Biol.Chem.262:4429-4432)。引入方法可包括但不限于皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。组合物可以通过任何方便的途径施用,例如通过输注或团注,通过上皮或粘膜皮肤内衬(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂一起施用。施用可以是全身性施用,也可以是局部施用。
也可以在囊泡中、特别是在脂质体中递送药物组合物(参见例如Langer(1990)Science 249:1527-1533;Treat et al.(1989)于Liposomes in the Therapy ofInfectious Disease and Cancer,Lopez Berestein and Fidler(eds.),Liss,New York,pp.353-365;Lopez-Berestein,同上,pp.317-327;一般参见同上)。
在某些实施方案中,可以在控释系统中递送药物组合物。在一个实施方案中,可以使用泵(参见Langer,同上,Sefton(1987)CRC Crit.Ref.Biomed.Eng.14:201)。在另一个实施方案中,可以施用如Medical Applications of Controlled Release,Langer and Wise(eds.),CRC Pres.,Boca Raton,Florida(1974)中所述的聚合材料。在又一个实施方案中,控释系统可以放置在组合物的靶标附近,因此仅需要全身剂量的一小部分(参见例如Goodson,于Medical Applications of Controlled Release,同上,vol.2,pp.115-138,1984)。
在本发明的其他实施方案中,可注射制剂可包括用于静脉内、皮下、皮内和肌内注射、滴注等的剂型。这些可注射制剂可通过公知的方法制备。例如,可通过例如将上述PCSK9抑制剂(例如,拮抗性抗体或其盐)溶解、悬浮或乳化在无菌水性介质或常规用于注射的油性介质中来制备可注射制剂。作为用于注射的水性介质,可以使用例如生理盐水、包含葡萄糖和其他辅助剂的等渗溶液等,其可以与适当的增溶剂例如醇(例如乙醇)、多元醇(例如丙二醇、聚乙二醇)、非离子表面活性剂[例如聚山梨酯80、HCO-50(氢化蓖麻油的聚氧乙烯(50摩尔)加合物)]等组合使用。作为油性介质,可以使用例如芝麻油、大豆油等,其可以与增溶剂例如苯甲酸苄酯、苄醇等组合使用。由此制备的注射剂优选填充在适当的安瓿中。本公开内容的药物组合物可以用标准针头和注射器皮下或静脉内递送。另外,关于皮下递送,在递送本公开内容的药物组合物中容易地应用笔递送装置。这样的笔递送装置可以是可重复使用的或一次性的。可重复使用的笔递送装置通常利用包含药物组合物的可更换笔芯。一旦已经施用了笔芯内的所有药物组合物并且笔芯是空的,就可以容易地丢弃空的笔芯并用包含药物组合物的新笔芯替换。然后可以重新使用笔递送装置。在一次性笔递送装置中,没有可更换的笔芯。而是,一次性笔递送装置可以预填充有储存于该装置内的储器中的药物组合物。一旦储器中的药物组合物被清空,整个装置就可以丢弃了。
可以在皮下递送本公开内容的药物组合物中应用许多可重复使用的笔和自动注射器递送装置。仅举几例,实例包括但不限于
有利地,将上述用于口服或肠胃外用途的药物组合物制成适合于一定剂量的活性成分的单位剂量的剂型。这种单位剂量的剂型包括例如片剂、丸剂、胶囊剂、注射剂(安瓿)、栓剂等。
根据本发明的一些方法,给个体施用的PCSK9抑制剂的量通常可以是治疗有效量。在PCSK9抑制剂包括抗体的情况下,治疗有效量可为约0.05mg至约600mg,例如约0.05mg、约0.1mg、约1.0mg、约1.5mg、约2.0mg、约10mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约75mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg或约600mg的PCSK9抑制剂。
各个剂量中包含的PCSK9抑制剂的量可以以抗体的毫克/千克患者体重(即mg/kg)表示。例如,可以给患者以约0.0001至约10mg/kg患者体重的剂量施用抗PCSK9抗体。
根据本发明的某些实施方案,可以在限定的时间过程中给受试者施用多剂量的PCSK9抑制剂。根据本发明该方面的方法可以包括给受试者顺序施用多剂量的PCSK9抑制剂。如本文所用,“顺序施用”是指给受试者在不同的时间点(例如,在以预定间隔(例如小时、天、周或月)分开的不同天)施用每剂量的PCSK9抑制剂。本发明包括一些方法,所述方法可以包括给患者顺序施用单剂初始剂量的PCSK9抑制剂,随后施用一剂或多剂二次剂量的PCSK9抑制剂,和任选地施用一剂或多剂三次剂量的PCSK9抑制剂。
术语“初始剂量”、“二次剂量”和“三次剂量”是指施用PCSK9抑制剂的时间顺序。因此,“初始剂量”是在治疗方案开始时施用的剂量(也称为“基线剂量”);“二次剂量”是在初始剂量之后施用的剂量;“三次剂量”是在二次剂量之后施用的剂量。初始剂量、二次剂量和三次剂量都可能包含相同量的PCSK9抑制剂,但就施用频率而言通常会彼此不同。然而,在某些实施方案中,在初始、二次和/或三次剂量中包含的PCSK9抑制剂的量在治疗过程中将彼此不同(例如,适当地向上或向下调整)。
在本公开内容的某些示例性实施方案中,在紧接之前的剂量后的1至30天(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天或更多天)或在紧接之前的剂量后的1至12周(例如1、2、3、4、5、6、7、8、9、10、11、12周或更多周)施用每个二次和/或三次剂量。如本文所用,短语“紧接之前的剂量”是指在多次施用的序列中,在没有中间剂量的情况下在序列中的下一个剂量的施用之前给患者施用的PCSK9抑制剂的剂量。
根据本发明该方面的方法可以包括给患者施用任何数量的二次和/或三次剂量的PCSK9抑制剂。例如,在某些实施方案中,仅给患者施用单剂二次剂量。在其他实施方案中,给患者施用两次或更多次(例如2、3、4、5、6、7、8次或更多次)二次剂量。同样,在某些实施方案中,仅给患者施用单剂三次剂量。在其他实施方案中,给患者施用两次或更多次(例如2、3、4、5、6、7、8次或更多次)三次剂量。
在涉及多个二次剂量的实施方案中,每个二次剂量可以与其他二次剂量相同的频率施用。例如,每个二次剂量可以在紧接之前的剂量后的1至12周给患者施用(例如,每周一次[Q1W],每两周一次[Q2W],每三周一次[Q3W],每四周一次[Q4W],每六周一次[Q6W],每八周一次[Q8W]等)。类似地,在涉及多个三次剂量的实施方案中,每个三次剂量可以与其他三次剂量相同的频率施用。例如,每个三次剂量可以在紧接之前的剂量后的1至12周给患者施用(例如,每周一次[Q1W],每两周一次[Q2W],每三周一次[Q3W],每四周一次[Q4W],每六周一次[Q6W],每八周一次[Q8W]等)。备选地,给患者施用二次和/或三次剂量的频率可以在治疗方案的过程中发生变化。施用频率也可以在医生的治疗过程中根据临床检查后各个患者的需要进行调整。
根据某些实施方案,本发明的方法可包括给正在接受用于治疗癌症的抗癌治疗方案的患者施用包含PCSK9抑制剂的药物组合物,所述抗癌治疗方案在施用本公开内容的药物组合物时或刚好在施用本公开内容的药物组合物之前进行。例如,先前已被诊断出患有以PCSK9表达为特征的癌症(例如实体瘤或血源性癌症)的患者可能已经被开出处方,并且在施用包含PCSK9抑制剂的药物组合物之前和/或同时服用另一种药物的稳定治疗方案。例如,在一个实施方案中,可以与至少一种免疫检查点抑制剂、抗癌治疗和/或血管生成因子的抑制剂同时施用PCSK9抑制剂。在其他实施方案中,可以在施用至少一种免疫检查点抑制剂、抗癌治疗和/或血管生成因子的抑制剂之前施用PCSK9抑制剂。在其他实施方案中,可以在施用至少一种免疫检查点抑制剂、抗癌治疗和/或血管生成因子的抑制剂之后施用PCSK9抑制剂。
在一些实施方案中,免疫检查点抑制剂可选自抗PD1抗体、抗PDL1抗体、抗CTLA4抗体、抗LAG3抗体、抗TIM3抗体、抗TIGIT抗体及其组合。
在另一个实施方案中,抗癌治疗可选自放疗、常规化疗或靶向化疗。
在另一个实施方案中,血管生成因子的抑制剂可选自VEGF的抑制剂、VEGFR1的抑制剂、VEGFR2的抑制剂、TEK的抑制剂及其组合。在其他实施方案中,血管生成因子的抑制剂可包括小分子、由其组成或基本上由其组成。在其他实施方案中,血管生成因子的抑制剂可包括抗体、由其组成或基本上由其组成。在其他实施方案中,血管生成因子的抑制剂可包括融合蛋白、由其组成或基本上由其组成。
通过举例而非限制的方式提供以下实施例。
现在参考图1和图2,对PCSK9的抑制能够显著减弱体内肿瘤的生长。将图1中鉴定的两个sgRNA序列克隆到重组慢病毒载体中,分别用于感染B16F10和4T1细胞。蛋白质印迹分析表明,使用任一sgRNA序列均成功敲除B16F10和4T1细胞中的PCSK9。
图2证明敲除PCSK9在C57BL/6小鼠中显著减慢了B16F10细胞的体内肿瘤生长,并显著减弱了4T1细胞的体内肿瘤生长。上图描绘了肿瘤各自的肿瘤生长曲线,中图描绘了动物处死结束后的各个肿瘤大小,而下图描绘了肿瘤的重量。在B16F10和4T1的两个实验中N=6。
现在参考图3,对PCSK9的抑制能够与免疫检查点治疗和其他已建立的癌症治疗方法例如放疗、常规化疗和靶向化疗协同作用,从而进一步减弱肿瘤生长。图3描绘了B16F10黑素瘤模型中PCSK9抑制剂拮抗性抗体
使用CRISPR-Cas9技术敲除了4种恶性鼠癌细胞系(B16F10、4T1、MC38、CT26)中的PCSK9基因。PCSK9敲除没有改变肿瘤细胞的形态学或体外生长速率或者它们在软琼脂中形成3D集落的能力。
B16F10小鼠黑素瘤细胞、CT26小鼠结肠癌细胞、4T1小鼠乳腺癌细胞、MDA-MB-231人乳腺癌细胞购自Cell Culture Facility of Duke University School of Medicine。MC38小鼠结肠癌细胞获自Dr.Takuya Osada(Duke University,School of Medicine)。B16F10、CT26、4T1、MC38、MDA-MB-231细胞均在含有10%胎牛血清(FBS)和100单位/毫升青霉素和100微克/毫升链霉素抗生素的DMEM(Sigma)中生长。使用通用支原体检测试剂盒(ATCC)定期对所有细胞系进行支原体检测。
使用慢病毒介导的CRISPR/Cas9技术产生PCSK9敲除细胞。使用在线CRISPR设计工具(chopchop)设计靶向PCSK9基因的单个向导RNA(sgRNA)序列。靶向小鼠和人PCSK9基因的sgRNA序列在下表1中列出。将编码sgRNA序列的双链寡核苷酸克隆到BsmB1(ThermalFisher Scientific)消化的质粒LentiCRISPRv2(由MIT的Dr.Feng Zhang存放于Addgene,Cambridge,MA)中,它在同一载体中共表达Cas9和sgRNA。然后根据Zhang实验室建立的实验操作规程生产编码sgRNA的CRISPR慢病毒载体。为了产生敲除细胞系,用编码sgRNA的CRISPR慢病毒感染靶细胞,并在含10%FBS的DMEM中培养,并在嘌呤霉素中选择(B16F10、CT26、MC38、MDA-MB-231为1μg/ml,而4T1为4μg/ml),持续7-10天。通过蛋白质印迹检测感染细胞中PCSK9蛋白的表达,以验证其敲低。通常,将PCSK9敲除细胞的混合群体在体外培养10-12天,然后用于实验。
表1:靶向小鼠和人PCSK9的sgRNA序列
为了测量PCSK9缺陷型肿瘤细胞3D生长的能力,根据建立的方案进行了软琼脂测定。将细胞以每孔10,000个细胞的密度接种在6孔板中,一式两份。培养3周后,固定集落并用0.005%结晶紫染色。然后计数每孔的集落数。进行了两个独立的实验。
在这项研究中进行的所有动物实验均得到Duke University InstitutionalAnimal Use and Care Committee的批准。C57BL/6J、Balb/c小鼠和OT-1转基因小鼠(C57BL/6背景)购自Jackson Laboratory(Bar Harbor,ME)。NOD CRISPR PrkdcIl2rGamma(NCG)三重免疫缺陷型小鼠购自Charles River Laboratory(Wilmington,MA)。在注射肿瘤细胞之前,将周龄匹配的6-8周龄小鼠的侧腹剃毛。然后将肿瘤细胞与1.0×10
在涉及PCSK9中和抗体的实验中,在C57BL/6小鼠中皮下接种2.5×10
为了评估小鼠中免疫效应细胞具体子集的作用,分别在第-3、0、3和8天用150μg的i.p.注射的抗CD4(GK1.5)、100μg的抗CD8β(53-5.8)和200μg的抗NK1.1(PK136)(购自BioXcell)耗竭CD4
用靶向PCSK9(表1的sgRNA1、sgRNA2)或对照慢病毒载体分别感染稳定表达EGFP或tdTomato的B16F10细胞,并用1μg/ml嘌呤霉素选择10天。随后,将约5×10
对于体内实验,将PCSK9缺陷型(表达GFP)或对照载体(表达tdTomato)B16F10细胞分开接种至小鼠,10-12天后收获肿瘤。然后,将肿瘤细胞解聚并如上所述处理,使用抗H-2K
对于体外实验,在冰上分别用抗H-2K
用靶向PCSK9或对照慢病毒载体感染B16F10细胞,并用1μg/ml嘌呤霉素选择10天。然后,将约1×10
表2:该研究中使用的抗体
如上所述接种肿瘤细胞,并在接种后第10天收集它们用于基因组DNA提取。使用DNeasy血液和组织试剂盒(Qiagen)提取基因组DNA,并提交给Adaptive Biotechnologies进行小鼠TCRB CDR3调查测序。约2.6μg初始DNA被用作PCR反应的输入。使用AdaptiveBiotechnologies在线分析平台分析数据。
从OT-1C57BL/6小鼠的脾脏收获表达编码结合小鼠H-2K
用PBS洗涤细胞,然后在补充有蛋白酶抑制剂的RIPA缓冲液中裂解。通过SDS-PAGE分离等量的蛋白质,并将其转移到PVDF膜上。先用特异性抗体、再用与HRP偶联的二抗探测蛋白。使用ECL显影HRP信号。使用Image J(NIH)分析感兴趣的蛋白质的定量。
为了研究MHC-I在溶酶体和膜中的分布,使用5×10
用1ng/ml小鼠重组IFNγ孵育首先刺激B16F10对照-Td(表达TdTomato荧光蛋白)、B16F10 PCSK9KO-Td、B16F10对照-OVA-Td(表达鸡卵清蛋白基因)和B16F10 PCSK9 KO-OVATd细胞12小时。然后在含有小鼠重组IL2(30单位/ml)OT-1T细胞完全生长培养基中用OT-1T细胞以1:1的比例或者不用OT-1T细胞培养经刺激的肿瘤细胞24小时。随后,通过Zeiss Axio Observer.Z1荧光显微镜成像工作站捕获TdTomato荧光和明场图像(每孔3个视野),并通过ZEN成像软件(Carl Zeiss Microscopy GmbH)和ImageJ1.52h(NIH)分析,以计数表达TdTomato的肿瘤细胞。使用两因素方差分析和Holm-Sidak的多重比较检验来检验统计显著性。使用GraphPad Prism 6.0软件(GraphPad软件)绘制结果。
对于免疫荧光分析,将来自小鼠的肿瘤固定在10%中性缓冲的福尔马林中,包埋在石蜡中,切片,然后封片到载片上。然后根据标准程序,使用表2中所列的针对小鼠CD45或CD8a的抗体对它们进行染色。
对于溶酶体共聚焦实验,将细胞与Lyso示踪剂(深红色,Thermo FisherScientific)于37℃孵育20分钟,室温用4%多聚甲醛固定15分钟,并用封闭缓冲液(1%BSA,5%驴血清,0.1%洋地黄皂苷)室温通透30分钟。然后将细胞用抗Flag(Sigma,F1804)和抗PCSK9(Proteintech,55206-1-AP)一抗室温孵育1小时。用PBS洗涤后,用含有DAPI的封片介质(Vector Laboratories)将染色的切片封片。通过共聚焦显微镜捕获图像。
使用具有表3中所列的序列的PCR引物获得具有myc标签的小鼠PCSK9的2.2kb片段和具有flag标签的H2K
表3:用于PCR和RT-PCR的引物
用冰冷的PBS洗涤10-cm培养皿中培养细胞两次,并在冰上用500μl补充有蛋白酶抑制剂(Sigma-Aldrich)的IP裂解缓冲液(150nM NaCl,50mM Tris,0.1%NP-40)直接裂解。将细胞裂解液转移至1.7ml试管中,并于4℃端对端旋转15分钟。通过Bio-Rad蛋白质测定测量裂解液中的蛋白质浓度。对于加HA标签的PCSK9蛋白的IP,将500μl细胞裂解液与5μl抗HA抗体(Santa Cruz Biotechnology)在旋转仪上于4℃孵育过夜。然后,将带有c-HA抗体的裂解液与20μl蛋白A/G琼脂糖珠(Santa Cruz Biotechnology)在4℃偶联2小时。用IP裂解缓冲液洗涤3次后,将pull-down复合物在2X SDS上样缓冲液中煮沸,以进行SDS-PAGE和蛋白质印迹分析。
从CRISPR/Cas9载体对照或PCSK9敲除的B16F10肿瘤细胞中提取总RNA,并进行RNA-seq分析。由Duke University Sequencing and Genomic Technologies Core进行RNA-seq。使用Kapa Stranded mRNA-seq文库制备试剂盒制备测序文库。使用IlluminaHiseq 4000仪器对文库进行测序,该仪器的单端测序片段长度为50bp。
使用TrimGaloretoolkit处理RNA-seq数据,该工具使用Cutadapt从测序片段的3'末端修剪低质量的碱基和Ilumina测序接头。修剪后仅保留20nt或更长时间的测序片段用于进一步分析。使用STAR RNA-seq比对工具,将测序片段作图至小鼠基因组和转录组的GRCm38.p6。如果使用SAMtools将测序片段作图至单个基因组位置,则保留这些测序片段以进行后续分析。使用HTSeq工具编辑基因计数。在随后的分析中,仅使用在任何给定文库中具有至少10个测序片段的基因。使用具有R统计编程环境的DESesq2Bioconductor软件包进行标准化和差异表达。进行基因集富集分析(GSEA),以针对所进行的比较来鉴定差异调节的途径和基因本体术语。
使用RNeasy微型试剂盒(Qiagen)根据制造商的说明从来自荷瘤C57BL/6J小鼠的CRISPR/Cas9对照或PCSK9敲除的B16F10肿瘤(体积约200-300mm
为了确定PCSK9对MHC-I蛋白的溶酶体降解的影响,将载体对照或PCSK9敲除的MDA-MB-231细胞用20μg/ml的放线菌酮(CHX,Sigma)处理1、4、8、18、24小时,以抑制蛋白质的生物合成。对于溶酶体抑制,将MDA-MB-231细胞用20nM巴弗洛霉素(Baf A1,Sigma)处理1、2、4、8、24小时。然后收获细胞,并使用抗HLA-ABC抗体(Proteintech)通过蛋白质印迹检测MHC I类蛋白。
使用GraphPad Prism 6软件进行统计学分析,p值小于0.05确定统计学显著性。使用两因素方差分析进行肿瘤生长延迟实验中的多次比较。使用对数秩(Mantel-Cox)检验进行小鼠存活率分析。在其他实验中,两组之间的比较是通过使用未配对的Student t检验进行的。跨正常和肿瘤组织数据库的基因表达(GENT)用于分析指定患者队列中PCSK9和CD8A之间的关系。从TCGA数据库获得有关PCSK9基因表达和患者生存率的数据,并使用对数秩检验评估其关系,p<0.05被认为具有统计学显著性。
现在参考图4A-4H,当将PCSK9缺陷型细胞接种到同基因小鼠宿主中时,它们形成肿瘤的能力显著减弱(图4A、4C、4E、4G)。此外,在所有测试的四个鼠肿瘤系中,在PCSK9基因敲除组中,有长期存活者,其中宿主小鼠在肿瘤细胞接种后直至60天仍无肿瘤。相反,在给小鼠注射载体对照转导的肿瘤细胞的组中,由于肿瘤的生长最终必须处死所有小鼠(图4B、4D、4F、4H)。通过使用荧光蛋白在体内进一步证实了PCSK9缺陷型细胞的优先生长抑制。显然,PCSK9敲除细胞几乎完全消失,而对照细胞则大量残留在肿瘤块中。将约1×10
现在参考图5A-5K,为了进一步评估免疫系统在介导PCSK9缺陷诱导的生长抑制中的作用,在接种PCSK缺陷型B16F10黑素瘤、MC38结肠癌和CT26结肠癌模型的小鼠中使用抗PD1免疫检查点抑制剂进行了实验。结果表明,在所有三种肿瘤模型中,抗PD1抗体的施用与PCSK9缺陷协同抑制了肿瘤生长。实际上,大多数接种了PCSK9缺陷型肿瘤细胞的小鼠在用抗PD1抗体治疗后80-100天仍然没有肿瘤。图5A-5C描绘了在同基因小鼠中用抗PD1抗体治疗PCSK9敲除B16F10黑素瘤的结果。使用同种型对照抗体来对照抗PD1抗体。图5D-5F描绘了用抗PD1抗体小鼠治疗PCSK9敲除MC38结肠癌的结果。图5G-5K描绘了用抗PCSK9和抗PD1抗体联合治疗小鼠的野生型MC38结肠癌的结果。虽然单独施用抗PD1或抗PCSK9抗体可能会导致MC38肿瘤明显的生长延迟,但通过添加抗PD1抗体可以显著提高其功效。分别用依伏库单抗+抗PD1或阿利库单抗+抗PD1治疗的10只MC38小鼠中有5只或10只中有4只在接种后长达60天仍无肿瘤,表明可长期治愈。结果表明,抑制PCSK9能够在多种鼠肿瘤模型中有效克服针对PD1免疫检查点治疗的耐药性。
现在参考图6A-6I,评估了初始接种肿瘤细胞后长期(>30天)仍无肿瘤的小鼠抵抗再攻击的能力。将野生型肿瘤细胞注射到初始攻击后仍无肿瘤的那些小鼠中。结果表明,接种B16F10(PCSK9缺陷+PD1Ab处理)和4T1(仅PCSK缺陷)且无肿瘤小鼠中分别是13只中有11只和12只中有4只难以受到野生型亲本肿瘤细胞的再攻击。数据表,明PCSK9抑制与抗PD1抗体联合能够引起小鼠长期抗肿瘤记忆。图6A-6C显示了在初始接种PCSK9缺陷型4T1细胞43天后的Balb/C小鼠中,受到野生型4T1肿瘤细胞再攻击后,宿主小鼠的肿瘤生长率和存活率。图6D-6F显示了在用PCSK9缺陷型B16F10细胞初始接种并用抗PD1抗体处理后26天仍无肿瘤的C57BL/6小鼠中,受到野生型B16F10肿瘤细胞再攻击后,宿主小鼠的肿瘤生长率和存活率。图6G-6H显示了在用PCSK9缺陷型MC38细胞初始接种并用抗PD1抗体处理后34天仍无肿瘤的C57BL/6小鼠中,受到野生型MC38肿瘤细胞再攻击后,宿主小鼠的肿瘤生长率和存活率。
现在参考图7A-7E和8A-8F,分析了免疫细胞向肿瘤的浸润,以了解PCSK9抑制对抗肿瘤免疫的积极作用。图7A显示了在同基因C57BL/6J小鼠中生长的对照和PCSK9 KO肿瘤中CD45阳性淋巴细胞的免疫荧光染色。图7B显示了对照和PCSK9 KO肿瘤中CD45阳性淋巴细胞的定量估计。图7C显示了荷有对照和PCSK9KO肿瘤的小鼠脾脏中CD4
数据表明PCSK9耗竭导致肿瘤内淋巴细胞浸润的总体增加,这可以通过CD45
现在参考图8G-8H和图9A-9E,使用一种基于抗体的方法来耗竭CD4
为了进一步表征PCSK9缺陷对肿瘤内T细胞的性质的影响,对T细胞受体(TCR)库进行了分子分析。该分析表明,在PCSK9缺陷型肿瘤中,总TCR计数(图8I)以及独特TCR的数量(图8J)显著增加,表明在PCSK9缺陷型肿瘤中成熟T细胞的数量和多样性均显著升高。进一步的分析显示,生产性克隆性(其是个体T细胞克隆的占优势的一种度量)在PCSK9缺陷型肿瘤中显著升高(图8K),表明除总体上增加了成熟T细胞的多样性之外,T细胞克隆的一个子集显著扩增和占优势。仔细研究表明,在对照和PCSK9缺陷型肿瘤中,最占优势的个体T细胞克隆都接近0.3(30%),这表明一些T细胞克隆占所有肿瘤内T细胞群体的30%(图8L)。在PCSK9缺陷型肿瘤中最占优势的克隆与在对照肿瘤中最占优势的克隆不同(图8M)。
在进一步的实验中,确定了PCSK9缺陷对CTL介导的肿瘤细胞杀伤的影响。为此,分离了OT-1转基因小鼠模型,其中T细胞改造以表达特异性针对鸡OVA抗原(SIINFEKL)的TCR,并体外评估了针对OVA转导的tdTomato标记的载体对照和PCSK9缺陷型B16F10黑素瘤细胞产生的细胞毒性作用。结果表明,PCSK9缺陷导致B16F10细胞对细胞毒性T细胞活性明显更敏感(图8N和9F)。
通过使用可公开获得的数据库(GENT,正常和肿瘤组织中的基因表达)评估人癌症患者中PCSK9表达与肿瘤免疫特征之间的关系。研究结果表明,PCSK9 mRNA表达与人食管癌、结肠腺癌、胰腺腺癌和前列腺腺癌中CTL标志物CD8A的表达呈负相关(图8O),表明小鼠中的上述发现与人患者的结果相关。
现在参考图10A-10H,研究了PCSK9缺陷型肿瘤细胞CTL杀伤增强的分子机制。由于PCSK9在调节细胞表面蛋白水平(例如LDL-R)方面的已知活性,因此对PCSK9缺陷可能影响肿瘤细胞表面抗原呈递的假设进行了测试。由于MHC-I是关键的抗原呈递蛋白复合物,在调节CTL活性中起主要作用,因此分析了PCSK9缺陷对MHC-I呈递B16F10黑素瘤细胞中特征明确的OVA抗原(SIINFEKL)的能力的影响。流式细胞术分析是通过在对照和表达鸡卵白蛋白(OVA)基因的PCSK9缺陷型B16F10细胞中使用针对H-2K
研究了PCSK9敲除对体内生长的B16F10肿瘤细胞表面H-2K
对公共领域数据库(GENT)的调查表明,在几种人癌症类型(外阴癌、胰腺癌、食道癌、结肠癌和乳腺癌)中,癌组织中的PCSK9表达高于匹配的正常组织(图11C)。此外,在人皮肤癌中,较高的PCSK9表达与患者预后较差相关(图11D)。该数据表明PCSK9在确定人癌症患者的治疗结果中起关键作用。
现在参考图12和13,研究了MHC-I表达水平对免疫检查点治疗的重要性。H2-K1在B16F10黑素瘤细胞中过表达,研究了其形成肿瘤的能力以及对抗PD1治疗的反应。结果表明,H2-K1表达可以显著减弱肿瘤的生长。此外,H2-K1表达可以显著增强B16F10肿瘤的抗PD1治疗的功效(图12)。在确定MHC-I在肿瘤免疫治疗中的重要作用后,研究了在调节PCSK9抑制的抗肿瘤功效中是否需要MHC-I。生成了H2-K1 KO或H2-K1/PCSK9双敲除(DKO)B16F10,并评估了它们在C57BL/6小鼠中形成肿瘤的能力。结果表明,与对照组相比,H2-K1缺陷导致肿瘤生长速率显著增加。此外,它几乎完全消除了在PCSK9基因敲除肿瘤中观察到的肿瘤生长延迟(图13)。因此,这些结果确定了H2-K1是PCSK9在调节肿瘤生长中必不可少的下游因子。
现在参考图14,研究了PCSK9通过哪些控制细胞表面PCSK9表达的机制。以前有报道说胆固醇水平可能会影响MHC-I的循环,因此推测PCSK9能够通过LDLR间接调节MHC-I的可能性,LDLR是PCSK9既定的下游靶标,也是关键的胆固醇调节剂。为了确定LDLR水平是否能够调节PCSK9下游的MHC-I水平,产生了具有LDLR敲除或LDLR/PCSK9双重敲除的B16F10细胞。随后,比较了两种细胞系的肿瘤形成率,数据表明LDLR基因敲除并没有减少B16F10肿瘤中PCSK9缺陷引起的生长抑制。然后通过使用流式细胞术确定体内肿瘤细胞的MHC-I水平。数据表明在体内B16F10中的LDLR敲除对B16F10细胞表面上的MHC-I表达没有显著影响。此外,LDLR敲除没有减少PCSK9缺陷引起的MHC-I表面表达的上调。然后通过研究MHC II和PD-L1的肿瘤细胞表面表达水平来确定PCSK9抑制的MHC-I增强作用是否限于MHC-I。数据显示PCSK9的状态对MHC-II的表达没有影响,而仅对降低PD-L1表面的表达有非常小的影响(但具有显著性)。结合先前证明的H2-K1敲除消除PCSK9作用的数据,这些发现支持MHC-I是PCSK9调控肿瘤生长的主要下游靶标。
研究了PCSK9抑制介导的MHC-I细胞表面表达上调的分子机理。由于PCSK9具有通过物理相互作用和内吞作用进入溶酶体降解LDL-R蛋白以降解后者的能力,因此研究了PCSK9是否可以直接与MHC-I结合。结果表明,共表达的PCSK9和H2-K
现在参考图15,进行了与PCSK9相关的9个TCGA人癌症患者队列的生存率分析,包括人肝脏的肝细胞癌(LIHC)、胰腺癌(PAAD)、皮肤的皮肤黑素瘤(SKCM)、葡萄膜黑素瘤(UVM)、人膀胱的尿路上皮癌(BLCA)、肺腺癌(LUAD)、肾脏的肾透明细胞癌(KIRC)、肾脏的肾乳头状细胞癌(KIRP)和卵巢癌(OV)。结果显示,PCSK9 mRNA表达高的患者比PCSK9表达低的患者生存率更差,这与PCSK9抑制小鼠MHC-I表面表达能力的发现一致。
现在参考图16,在存在PCSK9的情况下,MHC-I被转运到溶酶体中并降解(左图)。在不存在PCSK9的情况下,由于抗体介导的中和作用或基因缺失,表面上MHC-I保持高水平,因此能够将肿瘤特异性肽抗原更有效地呈递给T细胞(右图)。
在本说明书中提到“一个实施方案”或“实施方案”是指结合该实施方案描述的特定特征、结构或特性包括在本公开内容的至少一个实施方案中。本说明书中各个地方出现的短语“在一个实施方案中”不一定全部指的是同一实施方案,也不是与其他实施方案互斥的分开的或替代的实施方案。而且,本说明书描述了可以由一些实施方案而不是其他实施方案展现的各种特征。类似地,本说明书描述了可能是一些实施方案的要求但不是其他实施方案的各种要求。
除非上下文清楚地另外要求,否则在整个说明书和权利要求书中,词语“包括”、“包含”等应理解为包含性含义,而不是排他性或穷举性含义;也就是说,是“包括但不限于”的意思。如本文所用,术语“连接”、“耦合”或其任何变体是指两个或更多个元件之间直接或间接的任何连接或耦合;元件之间的连接的耦合可以是物理的、逻辑的或其任意组合。另外,当在本申请中使用时,词语“本文”、“上文”、“下文”和类似含义的词语应整体上指本申请,而不是本申请的任何特定部分。在上下文允许的情况下,上述详述中使用单数或复数的词也可以分别包括复数或单数。涉及两个或多个项目的列表中的词“或”涵盖该词的以下所有解释:列表中的任何项目、列表中的所有项目以及列表中的所有项目组合。
本文提供的本公开内容的教导能够应用于其他系统,不一定是上文所述的系统。可以将上述各种实施方案的元素和动作组合以提供其他实施方案。
可以根据以上详述对本公开内容做出这些和其他改变。尽管上文的描述描述了本公开内容的某些实施方案,并且描述了预期的最佳模式,但是无论上文在文本中出现的多么详细,都可以以许多方式来实践教导。系统的细节在其实现细节方面上可以有很大的变化,同时仍然被本文所公开的主题所涵盖。如上所述,在描述本公开内容的某些特征或方面时使用的特定术语不应被认为暗示该术语在本文中被重新定义为限于与该术语相关联的本公开内容的任何特定特征、特性或方面。通常,除非以上详述部分明确定义了这些术语,否则不应将所附权利要求中使用的术语解释为将本公开内容限制为本说明书中公开的特定实施方案。因此,本公开内容的实际范围不仅涵盖所公开的实施方案,而且还包括实践或实现根据权利要求书的公开的所有等效方式。
在说明书中,在本公开内容的上下文中以及在使用每个术语的特定上下文中,本说明书中使用的术语通常具有本领域的普通含义。上文或本说明书的其他部分讨论了用于描述本公开内容的某些术语,以为从业者提供有关本公开内容的描述的附加指导。为方便起见,某些术语可能会突出显示,例如使用大写字母、斜体和/或引号突出显示。突出显示的使用不会影响术语的范围和含义;无论是否突出显示,在相同上下文中,术语的范围和含义都相同。应当理解,可以以一种以上的方式描述同一元件。
因此,可替代的语言和同义词可用于本文讨论的任何一个或多个术语,关于是否在本文中阐述或讨论术语也没有任何特殊意义。提供了某些术语的同义词。一个或多个同义词的记载不排除使用其他同义词。本说明书中任何地方的实例的使用,包括本文讨论的任何术语的实例,仅是说明性的,并不旨在进一步限制本公开内容或任何示例性术语的范围和含义。同样,本公开不限于本说明书中给出的各种实施方案。
在无意进一步限制本公开内容的范围的情况下,以下给出根据本公开内容的实施方案的仪器、设备、方法及其相关结果的实例。注意,为了方便读者,可以在实例中使用标题或子标题,这绝不应该限制本公开内容的范围。除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的相同含义。在发生冲突的情况下,以本文件及其定义为准。
本说明书的某些部分根据算法和信息操作的符号表示来描述本发明的实方案。这些算法的描述和表示通常由数据处理领域的技术人员用来将其工作的实质有效地传达给该领域的其他技术人员。这些操作虽然在功能上、计算上或逻辑上进行了描述,但应理解为由计算机程序或等效电路、微代码等来实现。此外,在不失一般性的情况下,将这些操作安排称为模块有时也很方便。所描述的操作及其相关的模块可以用软件、固件、硬件或其任何组合来体现。
最后,主要为了可读性和指导性目的选择了本说明书中使用的语言,并且可能没有选择其来描绘或限制本发明的主题。因此,意图是本发明的范围不受本详述的限制,而是由基于其的申请所发表的任何权利要求所限制。因此,本发明的实施方案的公开意图是说明性的,而不是限制本发明的范围,本发明的范围在所附权利要求书中阐明。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明公开的主题所属领域的普通技术人员通常理解的相同含义。尽管类似于或等同于本文描述的那些方法、装置和材料的任何方法、装置和材料都能够用于实践或测试本发明公开的主题,但是现在描述代表性的方法、装置和材料。
遵循长期的专利法惯例,当在包括权利要求书的本文中使用时,术语“一个(a)”、“一种(an)”和“该(the)”是指“一个或多个”。因此,例如提及“添加剂”可以包括多个这样的添加剂等。
除非另有说明,否则在本说明书和权利要求书中使用的所有表示组分、条件等的数量的数字在任何情况下均应理解为由术语“约”修饰。因此,除非有相反的指示,否则在本说明书和所附权利要求书中阐述的数字参数是近似值,其能够根据试图通过本发明公开的主题获得的期望特性而变化。
如本文所用,术语“约”在涉及质量、重量、时间、体积、浓度和/或百分比的值或量时,在一些实施方案中能够涵盖与规定的量发生+/-20%、在一些实施方案中+/-10%、在一些实施方案中+/-5%、在一些实施方案中+/-1%、在一些实施方案中+/-0.5%以及在一些实施方案中+/-0.1%的变化,因为这样的变化在所公开的产品和方法中是适当的。
- 治疗以PCSK9表达为特征的癌症的组合物和方法
- 治疗特征在于纺锤体和着丝粒相关复合物亚基3(SKA3)基因的高表达水平的癌症的方法
