使用离子导电膜对生物样本进行电泳染色的方法和设备
文献发布时间:2023-06-19 10:46:31
技术领域
本发明涉及生物样本染色方法和染色设备,更具体地涉及使用电泳技术的生物样本染色方法和染色设备。
背景技术
当利用光学装置(诸如显微镜)观察厚的生物组织样本时,会有以下问题:发生严重的光散射以及分辨率按几何级数地恶化,所以难以对厚的生物组织样本的内部组织进行成像。为了克服这些限制,已持续研究了组织透明化技术。
在透明的组织中,由于其内部形成了大孔和小孔,荧光抗体可以穿过该组织,因此免疫染色在理论上是可行的,但是当通过传统上使用的被动扩散来使用典型的免疫染色方法时,免疫染色时间随着透明的组织的厚度以指数方式增加,使得免疫染色实际上是不可能的。近来,关于此的研究还在持续,但是还没有得到在效率和有效性方面令人满意的结果。
已经被使用或近期开发的用于生物组织样本的免疫染色技术如下:
第一,如上所述,最常见的组织染色技术是扩散法。扩散法是通过将组织浸入包含免疫抗体的溶液中来使抗体扩散到组织中的方法,并且是被动染色。扩散法是最简单且最容易的方法,但是当生物组织样本的厚度为50μm至100μm或更大时,扩散法仅通过扩散来对组织的内部进行染色耗时很长,并且因为扩散法需要大量的高浓度抗体,因此不可能使扩散法商业化。第二,作为设计成对厚的生物样本进行染色的技术,有一种方法通过使用离心力将免疫抗体移动到样本中。如此,使用离心力的方法可以将抗体移动到相对厚的生物样本中,但是离心力对组织造成损伤,因此限制了观察原完整组织的形状。
第三,作为通过形成电场来进行免疫染色的技术,具有以下效率和实用性方面的限制:由于径直的电场而对球形的中心施加了最高的电阻,并且由此边缘和中心之间的抗体染色具有很大差异,使得均匀染色是不可能的;纳米孔膜被用于限制样本的移动,但是随着染色进行,由于渗透压而流入溶液使得抗体浓度降低;由于框架被固定,因此在对各种形状和尺寸的组织进行染色时具有物理限制;由于市场上可购买的纳米孔膜的孔尺寸是不变的,因此具有非常小的分子量的染色成分或缓冲液成分流出腔室;由于纳米孔膜的孔尺寸不是恒定的,因此染色的再现性降低;以及进行一次染色必须使用大量的免疫抗体。
在最小化组织损伤的同时,需要开发一种技术,该技术可以具有很好的效率和可用性,该技术可以具有用于各种类型的样本的灵活性,并且该技术可以使用最少量的免疫抗体在最短的时间内对生物组织进行免疫染色。
【现有技术文献】
【非专利文献】
(非专利文献1)"Structural and molecular interrogation of intactbiological systems",Chung等人,NATURE,第497卷No.6,2013年,332-337页。
(非专利文献2)"ACT-PRESTO:Rapid and consistent tissue clearing andlabeling method for 3-dimensional(3D)imaging",Lee等人,Scientific Report,第18631卷,2016年。
(非专利文献3)"Stochastic electrotransport selectively enhances thetransport of highly electromobile molecules",Kim等人,PNAS,第112卷no.46,2015年。
(非专利文献4)"Optimization of CLARITY for clearing whole-brain andother intact organ",Jonathan等人,eNeuro,2015年。
发明内容
技术问题
本发明提供了一种生物样本染色方法,该方法使用离子导电膜来防止用于生物样本的染色试剂与电极直接接触,以防止染色试剂的物理化学变性和损伤,并防止染色试剂与外部缓冲液混合以在染色过程期间保持恒定的抗体浓度,从而能够有效并快速地进行生物样本的染色,以及本发明提供了应用该方法的生物样本染色设备。
技术方案
本发明的实施方式提供一种生物样本染色方法,该方法包括:将生物样本定位成邻近用于生物样本的染色试剂,以及通过使用离子导电膜来将所述生物样本和所述用于生物样本的染色试剂与外部缓冲液分隔;以及形成电场,使得电流流过所述离子导电膜而流到所述用于生物样本的染色试剂和所述生物样本。所述生物样本分离自活体。
所述形成电场可以包括:形成电场,使得电流按正向、反向、或者正反两个方向依次流入与所述用于生物样本的染色试剂具有相同极性的电极、所述离子导电膜、所述用于生物样本的染色试剂、所述生物样本、以及与所述用于生物样本的染色试剂具有相反极性的电极。
所述形成电场可以包括:施加电压以使60mA至100mA的电流流动1小时至5小时。
可以执行施加电压,使得所述电流的方向以5分钟至60分钟的间隔改变。
所述生物样本染色方法在施加所述电压之后还可以包括:留置10分钟至2小时。
在留置之后,还可以进行洗涤1小时至3小时。
所述离子导电膜可以包括阳离子选择性渗透电解质膜。
所述用于生物样本的染色试剂可以是靶结合蛋白或靶结合核酸分子。
所述用于生物样本的染色试剂可以利用荧光标签来标记。
所述生物样本可以是厚度为0.1mm至10mm的组织。
所述生物样本可以是通过使用甲醛(HCHO)而固定的样本。
所述生物样本可以是含有CUBIC(库比克)和CLARITY(克拉里蒂)的组织清洁样本。
所述生物样本染色方法还可以包括:测量由所述生物样本的染色产生的信号。
所述生物样本染色方法还包括冷却。
所述冷却可以包括:交换电极缓冲液,使冷却水在所述离子导电膜外部循环,或以上两者。
所述生物样本染色方法还可以包括:回收未反应的用于生物样本的染色试剂。
本发明的另一实施方式提供一种样本室,包括:样本室框架,所述样本室框架包括沿第一方向布置在在所述第一方向上敞开的内部空间中的用于生物样本的染色试剂部件、生物样本固定部件、以及缓冲部件;生物样本架,所述生物样本架能够被固定到所述生物样本固定部件以及能够容纳生物样本;以及离子导电膜,所述离子导电膜在所述样本室框架外部,所述离子导电膜通过被固定到所述样本室框架的与所述内部空间对应的一部分而将所述内部空间与外部分隔。
所述生物样本架可以包括支架主体以及网格,所述支架主体具有孔,所述网格位于所述孔的两侧。
所述样本室还可以包括:膜固定板,所述膜固定板朝向所述样本室框架按压和固定所述离子导电膜至所述样本室框架的在所述第一方向上彼此面对的一对侧面。
可以通过在沿所述第一方向的前方和后方插入用于膜密封的垫片来将所述离子导电膜固定到所述样本室框架。
所述用于生物样本的染色试剂部件的体积可以形成为大于所述缓冲部件的体积。
本发明的另一实施方式提供一种生物样本染色设备,包括:所述样本室;以及电极部件,所述电极部件包括第一电极和第二电极,所述第一电极和所述第二电极位于所述样本室的在所述第一方向上彼此面对的一对侧面外侧。
所述生物样本染色设备还可以包括外部腔室,所述样本室被插入所述外部腔室的开口中,所述外部腔室通过水平壁被分割成第一空间和第二空间以及在所述水平壁的中间部分部分地敞开,其中,所述第一电极可以位于所述第一空间中,以及所述第二电极可以位于所述第二空间中。
所述生物样本染色设备还可以包括:缓冲液入口,所述缓冲液入口连接到所述外部腔室的第一空间和第二空间中的每一者并且位于所述外部腔室的下端部分;以及缓冲液出口,所述缓冲液出口从所述外部腔室的所述第一空间和所述第二空间中的每一者连接到外部并且从所述第一空间和所述第二空间中的每一者的上端部分向上敞开。
有益效果
根据本申请提供的生物样本染色方法,当通过使用电动力使用于生物样本的染色试剂(例如,抗体)移动至厚的组织样本时,可以使用具有离子导电膜的样本室来防止具有非常低的电阻且包括高分子的所有有机分子的泄漏。
此外,可以提供一种样本室,该样本室的形状可以根据生物样本的类型和尺寸来自由实现,该样本室中没有渗透压现象发生,并且该样本室中不会在电泳期间产生多余的热量,从而具有高的电效率。
另外,由于通过使用几乎不具有电阻的离子导电膜,从电极施加的电量几乎与施加到样本的电量相同,因此可以精确地测量施加到样本的电动力,由此实现高的可再现的且有效的染色。
另外,通过使用电动力可以加速抗体的移动,以加快样本的染色,由此能够进行有效的染色。
此外,通过使离子导电膜周围冷却,可以最小化用于染色的抗体的退化以及最小化对已染色的生物样本组织的损伤。
也就是说,根据本申请提供的生物样本染色技术,可以对厚的生物样本内部进行染色,可以明显缩短对生物样本进行染色所需的时间,以及即使当使用少量的用于生物样本的染色试剂时也可以有效地对生物组织进行染色。
附图说明
图1示意性地示出了根据一实施方式使用电泳法对生物样本进行染色的过程的视图。
图2a示出了在典型的电泳电压施加方法中电压与时间的图示,图2b示出了在延时电泳电压施加方法中电压与时间的图示。
图3示意性地示出了根据一实施方式的生物样本染色设备的侧表面的视图。
图4示意性地示出了根据另一实施方式的使用电场和磁聚焦的生物样本染色设备的示意图。
图5示出了根据一实施方式的生物样本染色设备的样本室的分解透视图。
图6示出了根据另一实施方式的生物样本染色设备的样本室的分解透视图。
图7示出了根据一实施方式的生物样本染色设备的透视图,并示出了在将样本室插入作为生物样本固定部的外部腔室中之前的状态。
图8示出了根据一实施方式的生物样本染色设备的部分放大透视图,并示出了将生物样本架插入生物样本固定部中的状态。
图9示出了根据一实施方式的生物样本染色设备的样本室的外观的透视图。
图10示出了根据一实施方式的生物样本染色设备的外部缓冲液循环装置的透视图。
图11示出了通过利用抗体通过使用离子导电膜的电泳法对作为生物样本的未经转化的大鼠的脑组织的明晰样本进行染色而获得的结果的荧光图像(比例尺:100μm)。
图12示出了通过利用凝集素通过使用离子导电膜的电泳法对作为生物样本的未经转化的大鼠的脑组织的明晰样本进行染色而获得的结果的荧光图像(比例尺:100μm)。
具体实施方式
为了描述本发明,将对本发明的操作优势和由本发明的实施方式实现的目的、本发明的优选实施方式进行说明,并将参照实施方式描述本发明。首先,本申请中使用的术语仅用于描述特定实施方式而不旨在限制本发明的范围,并且除非上下文另有明确指示,否则单数形式意欲包括复数形式。另外,在本申请中,应当理解术语“包含”、“包括”、“具有”、或“配置”表示本申请中所描述的特征、数目、步骤、操作、构成要素、部件、或其组合是存在的,但不排除预先的一个或多个其他特征、数目、步骤、操作、构成要素、部件、或组合的存在或附加的可能性。另外,在本申请中,表述为“A至B”的数值范围意味着包括A和B的在A与B之间的所有值(实数),并且还包括公认为等价范围的A和B的近似值。
本发明的一实施方式提供一种用于对生物样本进行染色的方法,在使用电场对生物样本进行染色时该方法包括以下步骤:
(a)将生物样本定位成邻近用于生物样本的染色试剂,以及通过使用离子导电膜来将生物样本和用于生物样本的染色试剂与外部缓冲液分隔;以及
(b)形成电场,使得电流流过离子导电膜而流到用于生物样本的染色试剂和生物样本。
在使用电场对生物样本进行染色时,具有电荷的用于生物样本的染色试剂在电场中移动并接触生物样本,以对生物样本的靶生物材料进行染色。通过使用电场来强制移动用于生物样本的染色试剂,与依赖于扩散的生物样本的被动染色相比,染色试剂进入样本的渗透效率和速度都更高。
步骤(b)具有以下优势:通过使电流流过离子导电膜来控制用于生物样本的染色试剂的移动,同时防止用于生物样本的染色试剂由于在电极与用于生物样本的染色试剂之间的直接接触而变性。更具体地,在步骤(b)中,形成电场(施加电压),使得电流穿过离子导电膜并流入用于生物样本的染色试剂和生物样本中,由于可以将电极、用于生物样本的染色试剂和生物样本与外部缓冲液在物理上分隔的框架,因此可以使用离子导电膜。因此,可以保证框架的流动性以及提高适用性和光的可及性。另外,由于离子导电膜允许电流穿过它,而离子导电膜不允许生物样本穿过它,因此它可以阻止用于生物样本的染色试剂与电极之间的直接接触。因此,可以防止用于生物样本的染色试剂变性并且同时防止用于生物样本的染色试剂外漏。
更具体地,步骤(b)可以包括施加电压的步骤,使得电流按顺序流入极性与用于生物样本的染色试剂相同的电极(第一电极)、离子导电膜、用于生物样本的染色试剂、生物样本、以及极性与用于生物样本的染色试剂相反的电极(第二电极)(例如,以正向和/或反向)。
应用于本实施方式的生物样本染色方法的离子导电膜具有非常低的电阻,因此它具有非常高的电导率。另外,由于离子导电膜不具有物理孔,因此它可以防止所有的有机分子以及高分子(例如,抗体)泄漏。此外,离子导电膜具有良好的耐久性,因此可以长时间使用,并且离子导电膜形成为平坦膜,使得当离子导电膜作为样本室实施时,对厚度、高度、形状等没有限制。由于离子导电膜可以仅使离子穿过形成在成分分子的键合结构之间的分子通道,因此可以根据实验方法不同地选择和应用阳离子选择性渗透电解质膜、阴离子选择性渗透电解质膜、和阳离子/阴离子交换膜。
同时,在根据该实施方式的生物样本染色方法中,在使用阳离子选择性渗透电解质膜作为离子导电膜的电泳期间,从外部腔室的电极产生的H
也就是说,在使用阳离子选择性渗透电解质膜的电泳期间,来自电极的H
为了防止该pH下降,可以使用以下方法。
在电极与离子导电膜之间保持适当距离(例如,约20mm或更大),以及可以在电极和膜之间的空间中以预定流速或更高的流速进行灌注。例如,当施加的电压为50V时,电极与离子导电膜之间的适当距离为约20mm或更大,流速可以被设置成500ml/min或更大以进行灌注。因此,从电极产生的氢离子可以在到达电解质膜之前扩散并被排出到外部缓冲液容器,并且排出的缓冲液可以通过与相反电极中形成的含OH
在长时间的电泳期间,pH下降可能以缓慢的速度发生,为了防止该现象,可以不同地设置样本室中的缓冲组合物和外部腔室中的缓冲组合物。也就是说,样本室可以包含适用于pH为9±0.5的样本的电解质组合物材料氢氧化锂(LiOH)或NaOH以及硼酸,而外部腔室可以包含适用于pH为10.6±0.5(其高于样本室的pH)的电解质组合物材料氢氧化锂(LiOH)或NaOH以及硼酸。
除了电解质之外,外部腔室还可以包含浓度为500mM或更小的pH缓冲材料,诸如Tris(三羟甲基氨基甲烷)、MOPS等,并且除了电解质之外,样本室还可以包含浓度为100mM或更小的pH缓冲材料,诸如Tris、MOPS等。
因此,当应用该方法时,样本室中的缓冲液pH可以被保持在约9超过24小时,这个时间足以用于对直径为10mm
图1示出了根据一实施方式使用电泳法对生物样本进行染色的过程的示意图,图2a示出了在典型的电泳电压施加方法中电压与时间的图示,图2b示出了在延时电泳电压施加方法中电压与时间的图示。
在生物样本染色方法中,在形成电场的步骤中,通过提供电力以通过电场移动(灌输)用于生物样本的染色试剂至生物样本中,来将用于生物样本的染色试剂引入至生物样本中,在这种情况下,施加电压使得约60mA至约100mA、约70mA至约90mA、或约75mA至约85mA的电流流动约1小时至约5小时、约1小时至约3小时、或约1小时至约2小时(参见图1中的步骤1)。在这种情况下,可以在以约5分钟至约60分钟、约5分钟至约15分钟、或约8分钟至约12分钟的间隔改变电流的方向的同时执行形成电场的步骤。因此,通过在以预定时间间隔改变电流方向的同时施加电压,已经穿过生物样本的未反应状态的用于生物样本的染色试剂可以返回到其原始位置(到同一电极侧)。因此,由于未反应的用于生物样本的染色试剂可以再利用,所以可以防止用于生物样本的染色试剂的浪费并且可以减少使用的用于生物样本的染色试剂的总量,并且可以通过使用于生物样本的染色试剂与生物样本反复接触来进一步提高染色效率。
为了使灌输到生物样本中的用于生物样本的染色试剂与靶生物材料充分反应(结合),在形成电场的步骤之后,生物样本染色方法还可以包括:通过使反应系统留置约10分钟至约2小时、或约10分钟至约1小时(不施加电压)来使用于生物样本的染色试剂反应(参见图1中的步骤2)。
也就是说,通常的电泳电压施加方法是如图2a所示那样相等地且持续地供应电压,而本实施方式中的电压施加方法可以如图2b所示那样应用延时电控制方法。延时电控制方法是如下技术:在短时间段内施加高电压,然后具有空闲时段,再然后重复相同的模式,从而使抗体能够更快地流入到高致密的样本中。在这种情况下,实际上施加到生物样本的总电量相同,并且可以通过空闲时段保证排出产生的热量的时间。
另外,生物样本染色方法还可以包括洗涤步骤(参见图1中的步骤3),该洗涤步骤用于在形成电场的步骤和/或生物样本染色试剂的反应步骤之后移除未反应的用于生物样本的染色试剂。洗涤步骤可以进行约1小时至约3小时、或约1小时至约2小时。
包括所有的形成电场的步骤、留置步骤、和洗涤步骤的生物样本染色方法可以在约10小时内、在约9小时内、在约8小时内、在约7小时内、在约6小时内、或在约5小时内(并且至少约2小时或2.5小时)完成生物样本的染色。
另一方面,本发明的另一实施方式可以用作分析方法,该分析方法包括:测量由生物样本的染色产生的信号的步骤,以及生物样本的染色步骤。生物样本的染色步骤与前述生物样本染色方法中的染色步骤相同,并且还可以包括:通过允许用于生物样本的染色试剂以及生物样本停滞而不施加电场来使它们反应的步骤,和/或用于移除和/或回收未反应的用于生物样本的染色试剂的洗涤步骤。
测量信号的步骤通过使用适当的测量部件测量根据所使用的用于生物样本的染色试剂产生的荧光信号和/或发光信号来执行。该测量可以包括收集信号、可视化信号、和/或数字化(量化)信号强度和/或信号区域(信号部分)。测量部件可以选自可以可视化和/或量化荧光信号和/或发光信号的所有部件,并且例如可以为所有种类的常用的荧光显微镜(例如,光学显微镜、激光显微镜等)、发光测量装置、荧光相机、和发光信号数字化(量化)装置中的一种或多种。
使用生物样本染色的分析方法可以是可视化或量化作为用于生物样本的染色试剂的目标的生物材料(例如,蛋白质等)的所有方法,并且例如该分析方法可以选自可视化或量化组织中存在或不存在靶生物材料、靶生物材料的三维分布图案和/或三维分布位置、和/或组织中的靶生物材料的成分的所有方法。
在生物样本染色方法中,形成电场的步骤可以通过向两个电极施加电压的步骤来执行。如上所述,反应系统的温度由于向两个电极施加电压产生的热能而升高,因此,可能发生用于生物样本的染色试剂(例如,诸如抗体的蛋白质试剂)变性的问题。为了解决该问题,生物样本染色方法还可以包括冷却反应系统的步骤,在该步骤中执行生物样本染色或生物样本分析。
可以通过交换电极缓冲液、和/或冷却离子导电膜的外部和/或电极部件和/或电极部件的缓冲液供应器来执行冷却步骤。在该实施方式中,冷却步骤可以包括:交换电极缓冲液的步骤,和/或在由离子导电膜从外部阻挡的生物样本架外部(例如,生物样本架侧(例如,其中没有设置电极的一对相对侧)、下表面(底面)、和/或上表面)、和/或在供应到电极部件的缓冲溶液的供应器的外部和/或内部循环冷却水的步骤。冷却步骤可以持续地或间歇地进行,使得反应系统的温度被保持在用于生物样本的染色试剂不会变性的温度。在该实施方式中,当诸如抗体的蛋白质被用作用于生物样本的染色试剂时,用于生物样本的染色试剂不会变性的温度可以是蛋白质不会变性的温度,例如37℃或更低、35℃或更低、30℃或更低、25℃或更低、20℃或更低、15℃或更低、10℃或更低、或者5℃或更低(该温度范围的下限值是缓冲液和/或用于冷却的冷却水的凝固点或更高)。冷却步骤通过循环缓冲液和/或冷却水来执行,因此在该情况下所使用的缓冲液和/或冷却水的温度可以通过在上述用于生物样本的染色试剂不会变性的温度范围内调节和循环该染色试剂来在上述范围内进行调节。
除了温度条件以外,生物样本染色方法可以在常规反应条件下进行,在常规反应条件下,用于生物样本的染色试剂以及生物样本不会变性或被损坏(例如,压力(例如,标准气压范围)、pH(例如,中性范围(pH 6至8))等)。
通过使用离子导电膜和/或通过保持反应温度,生物样本染色方法最小化了或不会导致用于生物样本的染色试剂的变性,所以未与靶生物材料反应的未反应的用于生物样本的染色试剂可以被回收并再利用。因此,生物样本的生物样本染色方法还可以包括在完成反应之后回收未反应的用于生物样本的染色试剂的步骤,并且在回收步骤之前、同时、和/或之后,生物样本染色方法还可以包括随意洗涤生物样本的步骤。在该实施方式中,洗涤生物样本的步骤可以通过改变电流方向并使电流流动10分钟至2小时、或30分钟至90分钟来执行,但不限于此。
根据上述生物样本染色方法,与常规方法相比,可以更有效地对甚至更厚的生物样本(例如,厚度为0.5mm或更大、0.75mm或更大、1mm或更大、1.25mm或更大、1.5mm或更大、1.75mm或更大、或者2mm或更大的生物组织(上限值可以为包括该生物组织的器官的厚度、或者10mm、7.5mm、5mm、4mm、3mm、或2.5mm))的内部进行染色和/或分析,并且可以大大减少所使用的用于生物样本的染色试剂的量(例如,可以利用约1μl至2μl的染色试剂(例如,抗体)对厚度为约1mm至约3mm或约1.5mm至约2.5mm(例如约2mm)以及直径为约5mm至约10mm的生物组织(例如,CLARITY脑组织等)进行染色)。
另外,根据生物样本染色方法,由于生物样本的高染色效率而可以大大减小生物样本的染色时间。在该实施方式中,在生物样本染色方法的情况下,生物样本的染色可以在约10小时内、在约9小时内、在约8小时内、在约7小时内、在约6小时内、或在约5小时内完成(需要至少约2小时或2.5小时),包括将用于生物样本的染色试剂灌输到生物样本中的时间(约1小时至约5小时、约1小时至约3小时、或约1小时至约2小时)、反应时间(用于生物样本的染色试剂与靶生物材料之间的反应(结合)时间;约10分钟至约2小时、或约10分钟至约1小时)、以及洗涤时间(约1小时至约3小时、或约1小时至约2小时)(参见图1)。与传统的通过扩散来完成生物样本染色的生物样本的被动染色(需要至少90小时或更多,例如96小时至120小时)相比,这大大缩短了时间。
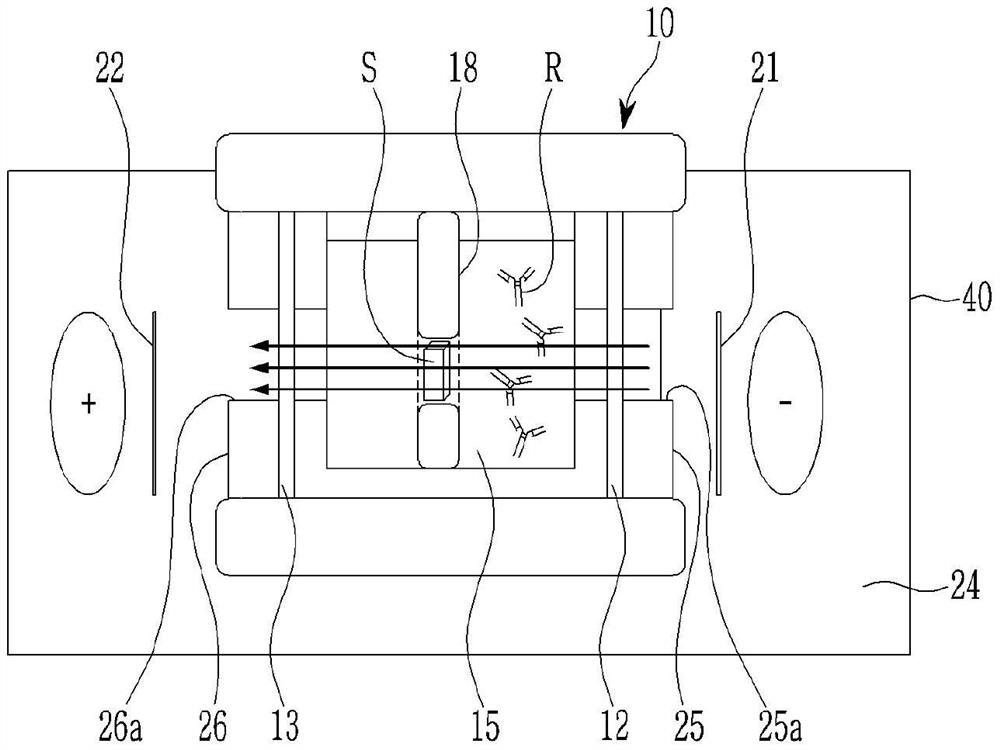
图3示意性地示出了根据一实施方式的生物样本染色设备(反应系统)的侧表面的视图。
在生物样本染色方法中,上述步骤可以在反应系统中执行,该反应系统包括:离子导电膜12和13;用于生物样本的染色试剂R,染色试剂R包括在用于生物样本的染色试剂部件15中,染色试剂部件15通过离子导电膜12和13与导电介质24阻隔;固定在生物样本架18中的生物样本S;以及位于一对彼此面对的离子导电膜12和13的侧面上的第一电极21和第二电极22,如图3所示。反应系统可以被充满导电介质24(例如,传统的缓冲溶液)。生物样本S可以固定在样本室10中,使得生物样本的宽的横截面面对两个电极21和22(即,沿与两个电极21和22所位于的离子导电膜12和13的侧表面平行的方向),用于生物样本的染色试剂R可以被供应电力以移动到生物样本S并通过电场渗透到样本中。
在本实施方式中,离子导电膜12和13可以为阳离子选择性渗透电解质膜。阳离子选择性渗透电解质膜通过在电泳期间选择性地仅使缓冲液中的电解质中的阳离子(例如,当使用LiOH缓冲液时为锂离子,而当使用NaOH缓冲液时为钠离子)渗透来允许电流流动。阳离子选择性渗透电解质膜不会使样本室10中的高分子(抗体)以及缓冲组合物泄漏到外部腔室40(电极所位于的腔室),因此样本室10中的抗体浓度和缓冲液浓度都可以完全保持。该特征可以防止用于pH缓冲的Tris(三羟甲基氨基甲烷)的泄漏,由此能够保持稳定的酸度。当阳离子选择性渗透电解质膜被浸入缓冲液中并用水湿润时,电阻可以极其低。为此,仅需要将待施加在实际的样本室10中的电压施加到外部腔室的电极。也就是说,由于施加到实际的样本室10的电量可以与施加到外部腔室40的电量相同,并且由于可以精确地知道所施加的电量而没有由样本室10产生的电损耗,因此可以保证实验的再现性和样本的稳定性。
相比之下,在使用纳米孔膜作为对比例的情况下,电阻非常大,比待施加在实际的样本室10中的电压高得多(例如高百分之几十至百分之几百)的电压必须被翻转或推测来使用,因此,电稳定性差且产生很多热量,实际的样本室10中的电量可能不能精确测量,因此样本可能损伤且染色速率可能降低。
同时,第一电极21和第二电极22可以被配置为包括离子导电膜12和13的侧表面外部的导电介质24(例如,传统的缓冲溶液)的电极部件。电极部件包括:第一电极21,第一电极21的极性与用于生物样本的染色试剂的电荷的极性相同,第一电极21在用于生物样本的染色试剂部件15一侧的离子导电膜12和13中的一者的外侧;和第二电极22,第二电极22的极性与用于生物样本的染色试剂的电荷的极性相反,第二电极22在与用于生物样本的染色试剂部件15的相对侧的缓冲部件16一侧的离子导电膜的外侧(例如,当诸如抗体的带负电荷的材料被用作用于生物样本的染色试剂时,阴极形成在用于生物样本的染色试剂的一侧,而阳极形成在相对侧)。
为了防止用于生物样本的染色试剂(例如,诸如抗体的蛋白质)通过自电极21和22产生的热量而变性,样本室10外部还可以包括冷却水循环通道(未示出)。冷却水循环通道可以位于除电极21和22所位于的一对侧表面之外的侧表面、底表面、和/或上表面上,样本室10和冷却水循环通道被以约0至0.5mm或更小的间隔彼此接触地定位,使得不会损失电场,但不限于此。
样本室10的形状不做具体限定,可以为内部具有空的空间的长方体形状(具有平行于长轴的敞开表面(上表面)的长方体形状)以方便使用和/或制造,但不限于此。当样本室10为具有一个敞开表面(上表面)的长方体形状时,电极部件可以位于该长方体形状的长轴的两个端部表面处,冷却水循环通道可以位于平行于长轴的两个侧表面和/或底表面处,可选地,在将生物样本架18固定到生物样本固定部件之后,冷却水循环通道可以覆盖在样本室10的上表面上。
生物样本染色设备还可以包括缓冲液供应器和/或冷却水供应器。缓冲液供应器使电极部件的缓冲液循环以防止由于电极产生的热量而温度升高。为此,缓冲液供应器可以连接到电极部件以供应控温缓冲液。
在另一实施方式中,生物样本染色设备还包括可视化和/或量化装置,用于实时分析(实时监控)由用于生物样本的染色试剂与生物样本之间的反应产生的信号(例如,荧光信号)。用于信号的可视化和/或量化装置可以为选自以下项构成的组中的一者或多者:光源、透镜、成像装置、和运算装置,例如,选自以下项构成的组中的一者或多者:荧光显微镜(例如,光学显微镜或激光显微镜)、荧光相机、显示器(监视器)、和计算机,但不限于此。
图4示意性地示出了根据另一实施方式的使用电场和磁聚焦的生物样本染色设备的视图。
参照图4,在根据本实施方式的生物样本染色设备中,电极21和电极22布置在样本室10的前面和后面,磁体30布置在样本室10的左侧和右侧。这里,样本室10的前后方向可以定义为与不同极性的电极21和电极22的相对方向平行的第一方向,左右方向可以定义为与前后方向正交的第二方向。在根据本实施方式的生物样本染色设备中,第一电极21、用于生物样本的染色试剂部件15、生物样本S、缓冲部件16、和第二电极22布置在第一方向上,而磁体30布置在样本室10的左侧和右侧以邻近于生物样本S。如上所述,样本室10可以由非导电结构形成,并且可以包括离子导电膜12和离子导电膜13,离子导电膜12和离子导电膜13布置成分别面对第二电极22和第一电极21。
在本实施方式中,磁体30位于样本室的左侧和右侧以邻近于生物样本S,由此在染色反应过程期间形成磁场以引起磁聚焦。通过如上所述一起使用电场和磁聚焦,可以防止用于生物样本的染色试剂散布到除样本以外的部分,同时可以提高用于生物样本的染色试剂的渗透效率。
位于样本室10的左侧和右侧以邻近于生物样本S的各个磁体30可以被定位成沿着第一方向彼此平行。另外,作为另一示例,位于样本室10的左侧和右侧的各个磁体30可以布置成相对于第一方向朝向彼此倾斜预定角度。例如,当基于在左侧和右侧的各个磁体30的第一方向的左侧磁体30沿顺时针方向倾斜15°且其右侧磁体30沿第一方向倾斜15°时,可以进一步改善磁聚焦效应。然而,本发明不限于该角度。
图5示出了根据一实施方式的生物样本染色设备的样本室的分解透视图,图6示出了根据另一实施方式的生物样本染色设备的样本室的分解透视图。
参照图5和图6,根据本实施方式的生物样本染色设备的样本室310包括样本室框架310a,生物样本架318被插入并固定在样本室框架310a中,离子导电膜312和313布置在样本室框架310a的前侧和后侧。这里,样本室框架310a的前后方向可以定义为与不同极性的电极321和电极322(参见图8)的相对方向平行的第一方向,左右方向可以定义为与前后方向正交的第二方向。
样本室310的样本室框架310a由具有内部空间的非导电结构制成,样本室框架310a可以具有敞开的上表面。在样本室框架310a内部形成的空间是空的空间,在该空间内可以包括用于生物样本的染色试剂部件315、缓冲部件316、和生物样本固定部件317。生物样本固定部件317位于用于生物样本的染色试剂部件315和缓冲部件316之间。
用于生物样本的染色试剂部件315是其中包括染色试剂的空间,缓冲部件316是其中包括缓冲溶液的空间。用于生物样本的染色试剂部件315可以具有能够承载对待加载的生物样本进行充分染色所需的用于生物样本的染色试剂的尺寸的空间(体积)。缓冲部件316是待被充满缓冲溶液的空间,并且是生物样本架318的孔(网格位置)或者是其中收集已经穿过其中加载的生物样本的用于生物样本的染色试剂的空间。
生物样本固定部件317是样本室框架310a的内部空间,承载生物样本的生物样本架318被固定(插入)在该内部空间中。生物样本架318包括其中具有孔的支架主体318a以及位于该孔的两侧以覆盖该孔的网格318b。支架主体318a具有大体上T形的形状,使得使用者可以容易地将生物样本插入并固定在样本室框架310a中。为了防止抗体在电泳期间下沉,可以在样本室框架310a的底部放置磁性自旋条,并且可以通过旋转在样本室框架310a外部的搅拌器来均匀地混合抗体。
生物样本被加载到支架主体318a中的孔与在孔两侧的网格318b之间的空间中。为了加载生物样本,位于两侧的网格318b的外周的全部或一部分(例如,外周的1/2或更多或者外周的3/4或更多)可以相对于支架主体318a是可拆卸的。例如,位于支架主体318a的孔的两面上的网格318b之一的外周的全部可以附接到支架主体318a,以形成其上可以加载生物样本的一个表面,在将生物样本放置在该表面上之后,对面的网格318b被覆盖并且外周的一部分或全部附接到支架主体318a以能够在两面上的网格318b之间加载生物样本。在这种情况下,网格318b被定位在接触所支撑的生物样本的大面积的横截面的两面上,并且具有用于生物样本的染色试剂(例如,抗体)可以穿过的孔。
支架主体318a的厚度和孔尺寸可以根据正在加载的生物样本的尺寸来确定,例如,待加载的生物样本的平均厚度和/或其宽的横截面的平均直径的1至1.5倍、1至1.4倍、1至1.3倍、1至1.2倍、1至1.1倍、或1至1.05倍。
生物样本架318被固定(插入)在生物样本固定部件317内部,使得其中加载的生物样本的大面积的横截面被定位在平行于样本室框架310a中的生物样本固定部件317的长轴的方向上。生物样本固定部件317具有生物样本架318可以插入的宽度,例如,生物样本的平均厚度的1至1.5倍、1至1.4倍、1至1.3倍、1.2倍、1至1.1倍、或1至1.05倍。
为了稳定地固定生物样本架318以及分隔(阻隔)染色试剂部件315和用于生物样本的缓冲部件316,生物样本固定部件317可以具有一空间,在该空间中,凹槽形成在生物样本固定部件317的两个端部所位于的样本室框架310a的一对面对的侧表面的内壁上,使得样本室框架310a的内壁朝向其外壁延伸。
图6中示出的样本室具有比图5中示出的样本室更厚的样本室框架,并因此包括具有更大的空间的染色试剂部件和用于生物样本的缓冲部件、以及生物样本固定部件。因此,更厚的生物样本架可以被安装在图6中所示的生物样本固定部件上。由此,可以通过仅改变样本室框架的尺寸来对各种尺寸的样本进行染色。
支架主体318可以由用于电子和生物样本的染色试剂、以及缓冲液(如需要)不能通过的材料制成。因此,通过形成电场而移动的用于生物样本的染色试剂在穿过生物样本架318时可以仅移动通过位于支架主体318a的孔中的网格318b,所以用于生物样本的染色试剂可以更集中于网格318b之间加载的生物样本上。
同时,可以按压和固定离子导电膜312和313的膜固定板325和326可以被定位在在样本室框架310a的第一方向(即前后方向)上面对彼此的一对侧表面外部。也就是说,样本室框架310a的内部空间在前后方向上是敞开的,并且通过利用离子导电膜312和313覆盖该内部空间,可以将生物样本固定部件317与用于生物样本的染色试剂部件315和缓冲部件316分隔(阻隔)。在这种情况下,通过使用多个螺钉来将膜固定板325和326联接到样本室框架310a,膜固定板325和326用于将离子导电膜312和313固定成与样本室框架310a紧密接触,为了保证固定的离子导电膜312和313的密封特性,在离子导电膜312和313的前侧和后侧分别插入用于膜密封的垫片325a和326a,以与离子导电膜一起被固定。这些膜固定板325和326以及用于膜密封的垫片325a和326a可以具有对应于形成在样本室框架310a中的内部空间的开口。
由于离子导电膜312和313具有在接触水时会柔性地伸展的特性,因此用于膜密封的垫片325a和326a被双重填补到相应的离子导电膜312和313,以通过使用多个螺钉来联接到彼此,并因此即使在水中也可以获得足够的密封效果。
在以上描述中,样本室310可以定义为包括生物样本架318,在这种情况下,生物样本架318可以包括包含或不包含生物样本的支架主体318a。
图7示出了根据一实施方式的生物样本染色设备的透视图,并示出了在将样本室插入作为生物样本固定部件的外部腔室中之前的状态,图8示出了根据一实施方式的生物样本染色设备的部分放大透视图,并示出了将生物样本架插入生物样本固定部件中的状态。
参照图7,根据本实施方式的生物样本染色设备300包括外部腔室340、固定到外部腔室340的样本室310、以及固定在外部腔室340中的电极321和322。这里,样本室310的前后方向可以定义为与不同极性的电极321和电极322的相对方向平行的第一方向,左右方向可以定义为与前后方向正交的第二方向。
参照图8,生物样本染色设备的外部腔室340可以由水平壁345大体上分割为两个空间,以分隔成第一空间341和第二空间342。第一电极321位于第一空间341中,而第二电极322位于第二空间342中。水平壁345的中间部分形成部分敞开的开口部分,使得第一空间341和第二空间342彼此连通,开口部分敞开的宽度达到对应于样本室310的尺寸的尺寸。因此,当样本室310被插入到水平壁345的开口部分中时,第一空间341和第二空间342可以彼此分离。
外部腔室340包括两个缓冲液入口347a和347b以及两个缓冲液出口348a和348b。缓冲液入口包括连接到第一空间341的第一入口347a和连接到第二空间342的第二入口347b,各个入口347a和347b被定位在外部腔室340的下端部以分别向空间341和空间342供应冷却缓冲液。缓冲液出口348a和348b包括从第一空间341通向外部的第一出口348a以及从第二空间342通向外部的第二出口348b。出口348a和348b中的每一者分别在外部腔室340的空间341和空间342的上端部处向上敞开。因此,流入缓冲液入口347a和347b中的冷却缓冲液几乎填满外部腔室340的每个空间,然后溢出并流出到每个缓冲液出口348a、348b。此外,缓冲液位保持坝349形成为邻近于每个缓冲液出口348a、348b突出,使得可以在外部腔室340的每个空间341、342中保持一定的缓冲液位。
在这种情况下,样本室310可以防止流体在样本室310内流动以保护样本。外部腔室340可以具有如下结构,在该结构中,流体在其内部快速循环以除去由电极产生的热量,从而可以通过快速循环流体使得由电极产生的H
图9示出了根据一实施方式的生物样本染色设备的样本室的外观的透视图,图10示出了根据一实施方式的生物样本染色设备的外部缓冲液循环装置的透视图。
参照图9,根据本实施方式的生物样本染色设备300具有主体301和外部腔室340,主体301大体上为长方体形状,其中一些角部为圆角,样本室310被固定到外部腔室340的上端部,使得生物样本染色过程得以执行。缓冲液供应器360被定位在外部腔室340的上部,以显示面板的形式暴露的控制器350可以布置在前表面上。可以通过控制器350来执行电泳电压和电流控制、缓冲液温度控制、周期性电流方向控制、和延时电控制。
参照图10,流入管337a和337b可以连接到外部腔室340的缓冲液入口347a和347b,而流出管338a和338b可以连接到外部腔室340的缓冲液出口348a和348b。流出管338a和338b连接到缓冲液供应器360以重新利用从外部腔室340排出的缓冲溶液,并且可以使从外部腔室340排出的缓冲溶液穿过包括热电元件和水冷式冷却器的冷却部件365来使其冷却。在穿过冷却部件365时被冷却的缓冲溶液可以由缓冲液循环泵367来泵送,以通过流入管337a和337b供应至外部腔室340的缓冲液入口347a和347b。以这种方式供应的冷却的缓冲溶液可以用于降低样本室310的反应温度(也就是说,冷却的缓冲溶液可以用于将反应温度保持在等于或低于用于生物样本的染色试剂的反应温度和/或生物样本的变性温度)。
同时,本申请中描述的生物样本可以是从脊椎动物和无脊椎动物分离的细胞、或细胞培养、细胞组织、或其器官,但不限于此,脊椎动物和无脊椎动物例如为诸如昆虫类、非洲爪蟾属、斑马鱼、哺乳类动物(例如,马、牛、绵羊、狗、猫、鼠科动物、啮齿类动物、非人灵长类动物、或人)的动物。生物样本可以从活的对象(例如,活体组织切片样本)收集(或分离),或者可以从死的对象(例如,尸体解剖或尸体剖检样本)收集。活的对象可以选自各种组织和器官,例如,造血、神经(中枢神经或神经末梢)、神经胶质、间叶细胞、皮肤、黏膜、间质、肌肉(骨骼肌、心脏肌、或平滑肌)、脾脏、网状内皮细胞、上皮细胞、内皮细胞、肝脏、肾脏、胰腺、胃肠、肺、或纤维原细胞。作为一个示例,生物样本可以为从哺乳类动物(包括脊椎动物,例如人)或者啮齿类动物的前脑分离的脑组织,但不限于此。
由于从活体分离的生物样本包含各种除待分析的生物材料以外的材料,这是获得精确分析结果的障碍,因此生物样本可以是其中除待分析的生物材料(例如,蛋白质和/或核酸分子)以外的生物材料(例如干扰分析(例如光学分析)的脂肪)被去除的样本。
可应用于本发明的生物样本可以从活体分离。
本发明具有可应用于相对厚的生物样本的优点,就这一点来说,生物样本可以是厚度为0.2mm或更大、0.3mm或更大、0.5mm或更大、0.75mm或更大、1mm或更大、1.25mm或更大、1.5mm或更大、1.75mm或更大、或者2mm或更大(上限值可以是包含生物组织的器官的厚度、或者10mm、7.5mm、5mm、4mm、3mm、或2.5mm)的生物组织,但不限于此,并且本发明可以应用于比上述范围薄的生物样本。生物样本的横截面可以具有接近圆形的形状,圆形的直径为约5mm至10mm,但不限于此,该横截面也可以根据支架主体的尺寸和/或形状来适当确定。
本申请中描述的用于生物样本的染色试剂意味着选自多种材料(例如,靶结合蛋白(诸如抗体和凝集素、核酸适体),靶结合核酸分子(诸如反义RNA、siRNA、shRNA),以及以生物样本(例如,生物组织)中的特定生物材料(例如,蛋白质、糖、核酸(DNA或RNA))为靶的小分子化学物质(例如,具有通过静电结合而结合到靶生物材料的发色团的有机化合物;例如,选自由亚甲蓝、甲苯胺蓝、苏木精、曙红、酸性品红、橙黄G、DAPI(4',6-二脒基-2-苯基吲哚)组成的组中的至少一者))组成的组中的一者或多者如需要则根据典型方法标记为可检测的标签材料。作为示例,用于生物样本的染色试剂可以是带电的。
待通过本申请提供的生物样本染色方法染色的部分不做具体限定,可以是选自由细胞膜、细胞质、细胞核、细胞核膜、和各种细胞内的细胞器组成的组中的一者或多者,并且可以选择适用于待染色部分的典型的用于生物样本的染色试剂。
标签材料可以是选自产生可检测信号(例如,荧光)的所有材料中的一者或多者。例如,荧光材料可以是选自由以下材料组成的组中的一者或多者,但不限于此:
(1)荧光蛋白:绿色荧光蛋白(GFP)、黄色荧光蛋白(YFP)、橙色荧光蛋白(OFP)、蓝绿色荧光蛋白(CFP)、蓝色荧光蛋白(BFP)、红色荧光蛋白(RFP)、红外荧光蛋白、近红外荧光蛋白、等等,
(2)荧光蛋白变体:GFP变体,诸如Emerald(Invitrogen公司,卡尔斯巴德,加利福尼亚州)、EGFP(Clontech公司,帕洛阿尔托,加利福尼亚州)、Azami-Green(MBLInternational,沃本,马萨诸塞州)、Kaede(MBL International,沃本,马萨诸塞州)、ZsGreen1(Clontech公司,帕洛阿尔托,加利福尼亚州)、CopGFP(Evrogen/Axxora有限责任公司,圣地亚哥,加利福尼亚州)、等等;CFP变体,诸如Cerulean(Rizzo,Nat Biotechnol.22(4):445-9(2004))、mCFP(Wang等人,PNAS USA.101(48):16745-9(2004))、AmCyanl(Clontech公司,帕洛阿尔托,加利福尼亚州)、MiCy(MBL International,沃本,马萨诸塞州)、CyPet(Nguyen和Daugherty,Nat Biotechnol.23(3):355-60(2005));BFP变体,诸如EBFP(Clontech公司,帕洛阿尔托,加利福尼亚州)、等等;YFP变体,诸如EYFP(Clontech公司,帕洛阿尔托,加利福尼亚州)、YPet(Nguyen和Daugherty,Nat Biotechnol.23(3):355-60(2005))、Venus(Nagai等人,Nat.Biotechnol.20(1):87-90(2002))、ZsYellow(Clontech公司,帕洛阿尔托,加利福尼亚州)、mCitrine(Wang等人,PNAS USA.101(48):16745-9(2004))、等等;OFP变体,诸如cOFP(Strategene公司,拉荷亚,加利福尼亚州)、mKO(MBLInternational,沃本,马萨诸塞州)、mOrange、等等,
(3)非蛋白质有机荧光染料:氧杂蒽衍生物,诸如荧光素、若丹明、俄勒冈绿、曙红、和德克萨斯红;青色素衍生物,诸如青色素、吲哚碳水化合物青色素(indocarbocyanine)、乙二酸碳水化合物青色素(oxacarbocyanine)、硫代碳水化合物青色素(thiacarbocyanine)、和部花青素;方酸衍生物,诸如Seta染料、SeTau染料、和Square染料、以及环取代方酸;萘衍生物(丹酰衍生物和氟硅酸钠衍生物);香豆素衍生物;恶二唑衍生物,诸如吡啶基恶唑(pyridyloxazole)、对硝基苄溴恶二唑(nitrobenzoxadiazole)、和苄溴恶二唑(benzoxadiazole);蒽衍生物,诸如蒽醌类,包括DRAQ5、DRAQ7、和CyTRAK Orange;芘衍生物,诸如瀑布蓝;嗪衍生物,诸如尼罗红、尼罗蓝、甲酚紫、嗪170;吖啶衍生物,诸如二氨基吖啶、吖啶橙、吖啶黄、等等;芳香基次甲基(arylmethine)衍生物,诸如金胺、结晶紫、和孔雀石绿;四吡咯衍生物,诸如卟吩、酞化青染料、胆红素(例如,CF染料(Biotium公司)、DRAQ探头和CyTRAK探头(BioStatus公司)、BODIPY(Invitrogen公司)、Alexa Fluor(Invitrogen公司)、DyLight Fluor(Thermo Scientific,Pierce)、Atto和Tracy(SigmaAldrich)、FluoProbes(Interchim)、Abberior染料(Abberior)、DY染料和MegaStokes染料(Dyomics)、Sulfo Cy染料(Cyandye)、HiLyte Fluor(AnaSpec)、Seta染料、SeTau染料和Square染料(SETA BioMedicals)、Quasar染料和Cal Fluor染料(BiosearchTechnologies)、SureLight染料(APC,RPEPerCP,Phycobilisomes)(ColumbiaBiosciences)、APC、APCXL、RPE、BPE(Phyco-Biotech,Greensea,Prozyme,Flogen)、Vio染料(Miltenyi Biotec)、等等)。
本申请中描述的离子导电膜可以通过根据实验方法而不同地选择阳离子选择性渗透电解质膜、阴离子选择性渗透电解质膜、和阳离子-阴离子交换膜来应用,并且仅离子可以穿过形成在成分分子的键合结构之间的分子通道。
本申请中描述的离子导电膜具有非常低的电阻,因此其具有高的电导率。另外,由于离子导电膜不具有物理孔,因此它可以防止所有的有机分子以及高分子(例如,抗体)泄漏。此外,离子导电膜具有良好的耐久性,因此可以长时间使用,并且离子导电膜形成为平坦膜,使得当离子导电膜作为样本室时,对厚度、高度、形状等没有限制。
本申请中所使用的样本室框架和支架主体可以由固体材料制成,该固体材料不导电且不允许缓冲液和免疫染色试剂通过。为了在光学分析期间不由于光的折射、散射或色散引起障碍,样本室框架和支架主体可以由透明材料制成。例如,样本室框架和支架主体可以由相同或不同的材料制成,样本室框架和支架主体可以分别(各自)由选自由非导电材料(诸如亚克力、玻璃、塑料、橡胶、陶瓷、和石油化合物)组成的组中的一者或多者制成。样本室框架或支架主体可以由以上材料制成。
冷却水循环通道具有内部连接的冷却水循环通路,并且可以具有其中除了冷却水入口和出口之外的所有表面都是封闭且密封的任何类型的结构,但对材料不做具体限定,具有极好的导热性且可以使液体循环而无损失的任何材料都是足够的。
支架主体中包括的网格可以由选自由丝织物、亚麻、和石油化合物衍生的纤维组成的组中的一者或多者制成,但不限于此。此外,网格可以具有孔,孔的尺寸使得生物样本不可以通过而用于生物样本的染色试剂可以通过。例如,当抗体用作用于生物样本的染色试剂时,网格可以具有平均直径为约30nm或更大、约50nm或更大、约70nm或更大、约100nm或更大、或者约1μm或更大的孔,使得抗体可以通过(孔直径的最大值可以等于或小于所加载的生物样本不可以通过且可以被保持在加载框架中的尺寸)。在该实施方式中,网格可以具有平均直径为30nm至100μm、50nm至100μm、70nm至100μm、100nm至100μm、1μm至100μm、30nm至10μm、50nm至10μm、70nm至10μm、10nm至10μm、或者1μm至10μm的孔,但不限于此。
样本室的内部空间和电极部件可以被充满常用的缓冲溶液。在该实施方式中,缓冲溶液可以选自包括电离提供材料(电解质)的缓冲溶液。对电离提供材料不做具体限定,例如其可以为选自由氢氧化锂、氯化钠、氯化钾、氢氧化钠等组成的组中的一者或多者,但不限于此,并且可以使用能够电离的任何材料。缓冲溶液可以为选自由硼酸盐缓冲剂、磷酸生理盐水(PBS)、磷酸盐缓冲剂、台式(Tyrode)缓冲剂、氨丁三醇缓冲剂、甘氨酸缓冲剂、柠檬酸盐缓冲剂、和醋酸盐缓冲剂组成的组中的一者或多者,但不限于此。在该实施方式中,缓冲溶液可以包含50mM的氢氧化锂,但不限于此。
另一方面,作为本发明的另一实施方式,可以通过使用离子导电膜和电场的电泳来实现使生物组织明晰化的方法。也就是说,可以通过在上述生物样本染色方法中应用透明化试剂来实现该方法。
已经典型地用于使生物组织明晰化的试剂是十二烷基硫酸钠(SDS),SDS溶解脂肪(脂肪是生物样本的细胞膜的主要成分),以使生物样本明晰化。SDS明晰化方法已经被主要用作被动透明化方法(其中,样本被浸入SDS溶液中,并且由于自然扩散,脂肪被溶解并被透明化)。然而,由于高分子SDS的低的组织渗透率,该方法耗费大量时间用于组织透明化。
利用电泳的SDS加速方法用作提高该低的组织渗透率的方法,但是其具有很多问题,诸如电泳导致SDS的氧化以及电极中产生的氧化碳导致样本的污染。最近披露的纳米孔膜介导的电泳技术可以去除氧化碳,但是由于其高电阻,必须使用非常高的电动力,并因此膜的孔可能由于样本损坏或过量产生的氧化碳而被阻塞。
根据本实施方式的使用离子导电膜的电泳生物明晰方法几乎没有电阻,因此仅使用明晰化所需的适当的电动力,并最小化氧化碳的产生,由此持续保持离子导电膜的性能。由于氧化碳不可以穿过离子导电膜,因此可以在无任何污染的情况下获得生物样本的透明化。此外,与纳米孔膜不同,离子导电膜不具有物理孔,使得从根本上阻止了氧化碳等对孔的阻塞。该性质使得即使在长期的明晰化试验中也不需要更换膜,从而可以获得有效的生物组织明晰化。
下文中,将更详细地描述本发明的实施方式。以下实施方式是使用用于对生物样本进行染色的抗体执行免疫染色方法的情况。这些实施方式仅用于更详细地解释本发明,而本领域普通技术人员将清楚地理解本发明的范围不限于这些实施方式。
使用未经转化的大鼠(SD大鼠,4-6周大)的大脑通过典型的CLARITY方法来制备透明的脑组织样本。
通过心脏灌注,使血从大脑微脉管流干。将大脑从大鼠切离,浸入水凝胶单体溶液,并在4℃进行2天的孵化,其中,该水凝胶单体溶液中,4%(w/v)的丙烯酰胺、0.25%(w/v)的VA-044、以及4%(w/v)的PFA(多聚甲醛)被溶解在磷酸生理盐水(PBS)溶液中。
然后,大脑被在黑暗中放置在真空状态下2小时至4小时,同时通过使用特制机器(CLARITY Easy-Imbedding,LCI)来提升温度至37℃。
此后,在将大脑切成所需的样本尺寸(厚度:500μm、1mm、1.5mm、2mm、5mm;直径:5mm、10mm)之后,通过使用CLARITY机器(CLARITY Easy-Clearing,LCI)来执行电组织透明化(Electro-Tissue Clearing,ETC)。在这种情况下,使用含有4%的SDS、50mM的LiOH、和25mM的硼酸的缓冲溶液。根据样本的尺寸,透明化在50V至70V和35℃的条件下进行,并进行1天至5天。
已完成如上所述的CLARITY过程的组织被在37℃的条件下浸入硼酸盐缓冲剂(50mM的LiOH,25mM的硼酸)1天并被洗涤以去除干扰抗体结合的所有残余的SDS。
所制造的样本室被安装在包括电源、两个电极部件、缓冲液供应部件和冷却器的装置的各个电极部件之间,每个电极部件包括位于一侧的下部的缓冲液入口以及位于相对侧的上部的缓冲液出口,缓冲液供应部件(硼酸盐缓冲器;50mM的LiOH,25mM的硼酸)连接到两个电极部件的缓冲液入口和缓冲液出口,并且冷却器连接到缓冲液供应部件。所述装置包括冷却水循环通道,该冷却水循环通道布置成与除样本室的与电极接触的两个侧面之外的两个侧面、下表面、和上表面完全接触,并具有冷却水可以循环通过的内部空间,并且冷却水供应器连接到冷却水循环通道。
通过利用离子导电膜的电泳技术使用胶质纤维酸性蛋白(GFAP)抗体来对示例1中获得的未经转化的大鼠(SD大鼠,4-6周大)的脑纤维的CLARITY样本进行免疫染色,然后进行成像。
示例1中制备的直径为10mm、厚度为1mm的脑组织样本被插入示例2中制备的装置中的样本室的支架主体中,并被插入待固定的生物样本固定部件中,然后电极部件和样本室的各个空间被充满硼酸盐缓冲剂(50mM的LiOH,25mM的硼酸)。免疫染色试剂部件(抗体供应部件)中以GFAP为靶的抗体(第一抗体,Abcam,UK)以及以第一抗体的Fc部分为靶且由荧光材料标记的抗体(第二抗体,Alexa-488,Abcam,UK)被以1.5μl的量灌输,并经由循环通道通过使保持在4℃的冷却水循环而被充分冷却,其中第一抗体为大脑的神经胶质细胞标记,免疫染色试剂部件为生物样本固定部件的两个空间中的阴极侧空间。
随后,供应电力120分钟,并同时调节电压和电流分别为50V和100mA。在这种情况下,电压方向以10分钟的间隔改变,以将穿过的抗体返回到其原始位置。此后,抗体被留置30分钟至1小时,以与组织样本中的目标蛋白质充分结合。然后,以相反方向供应100mA的电流60分钟,以去除未结合的抗体。
在成像之前,通过将样本浸泡在FocusClear(CelExplorer Labs Co.,FC-101)或87%的甘油(Sigma)溶液中,样本的折射率被调节成与显微镜的透镜油的折射率相同(折射率=1.454)。成像通过使用共焦显微镜A1型号(Nikon,日本)和10X透镜(Nikon,日本)进行。
获得的结果在图11中示出(比例尺=100μm)。如图11所示,可以看出,通过使用离子导电膜的电泳技术的免疫染色有效地应用于使用第一抗体和第二抗体的常规免疫染色。
除了使用凝集素染色试剂(Lectin-594,Vector,USA)代替GFAP抗体,以与示例3相同的方法执行使用离子导电膜的电泳法,并且对获得的结果进行成像。然而,染色时间花费1小时。
获得的结果在图12中示出(比例尺=100μm)。如图12所示,可以看出,即使当通过使用凝集素试剂执行使用离子导电膜的电泳法时,染色也能很好地进行到1mm的深度。
适用于pH为9±0.5的样本的电解质组合物材料氢氧化锂(LiOH)或NaOH以及硼酸被灌输到示例2中制备的样本室中,而适用于pH为10.6±0.5(高于样本室的pH)的样本的电解质组合物材料——氢氧化锂(LiOH)或NaOH以及硼酸被灌输外部腔室中。
为了比较在应用以上方法时酸度的变化,当使用施加的电压为50V、施加的电流为100mA时,样本室的内部和外部在相同的条件下,以及在不同地设置缓冲组合物的条件下,对pH随时间的变化进行测量,所测量的结果在表1中示出。
[表1]
因此,可以看出,当应用该方法时,样本室中的缓冲液pH可以被保持在约9超过24小时,这个时间足以对直径为10mm
在示例2中制备的装置中,在改变所施加的电压的同时测量系统内电流的量,结果如下表2所示,结果是,电流的量根据离子导电膜的存在或不存在的减小表现出非常小的大约2%的差异。
[表2]
在示例2中制备的装置中,在使用具有不同分子量的染色试剂的电泳期间,进行离子导电膜的泄漏实验且结果在下表3中示出,如表3中所示,确认了无论分子量如何,所有染色试剂都没有泄漏。
[表3]
尽管已经结合当前被认为是实用的示例性实施方式描述了本发明,但是应理解本发明不限于所公开的实施方式,相反,本发明意图涵盖所附权利要求的精神和范围内包括的各种改变和等价配置。
[附图标记说明]
10:样本室 12,13:离子导电膜
15:用于生物样本的染色试剂部件
16:缓冲部件
18:生物样本架
R:用于生物样本的染色试剂
S:生物样本 21:第一电极
22:第二电极 24:导电介质
24a:缓冲液入口 24b:缓冲液出口
25,26:膜固定板 28:缓冲液供应器
30:磁体 40:外部腔室
- 使用离子导电膜对生物样本进行电泳染色的方法和设备
- 多腔室样本测试设备和使用所述设备进行样本测试的方法
