基于石墨烯光热传感的肺癌标志物miRNA定量检测方法
文献发布时间:2023-06-19 10:54:12
技术领域
本发明基于石墨烯光热传感的肺癌标志物miRNA定量检测方法,属于miRNA检测技术领域。
背景技术
肺癌作为死亡率最高的癌症之一,其发病率和致死率都呈现出逐年增长的趋势,极大地危害着人类的健康。肿瘤标志物的检测有利于癌症的早期发现、早期诊断以及早期治疗,并且可以实时监控患者的治疗效果。肿瘤标志物主要由蛋白质、DNA和RNA组成,在所有的标志物中,miRNA(MicroRNA)作为蛋白转运的调节者,关于其独特性质的研究以及广泛应用于癌症诊断和预后当中可能性的研究已经被大量的开展。miRNA是一类由18-25个核苷酸组成的单链RNA,在细胞的发育、增殖和分化的过程当中起着关键的调节作用。现有研究表明,miRNA参与到了肿瘤发生的每个过程,包括肿瘤的生长、转移和凋亡等,在肿瘤的发生和发展中发挥了重要的作用。因此miRNA的检测在肿瘤的早期诊断和治疗中有着非常好的应用前景。
尽管miRNA的检测对于肺癌的诊断和治疗非常重要,但是由于其序列短、浓度低以及序列同源性高等特点使其检测非常困难,这也促使了研究者发展新型的检测技术,实现对miRNA的高灵敏度检测。目前,常规的miRNA检测技术主要由微阵列以及核酸扩增技术组成。此外,表面等离子体共振、表面增强拉曼光谱法、电化学分析法、以及基于量子点的生物传感器等技术也被用于肺癌标志物miRNA的高灵敏度检测。
miRNA微阵列分析通常是首先将高密度的DNA探针固定在固相载体上,随后与目标miRNA发生相互作用产生检测信号。微阵列技术可用于多种类的miRNA同时检测。然而微阵列的生产与检测成本较高,此外,微阵列上可用样本量少的特点导致了该技术的检测灵敏度较低。因此,微阵列技术通常需要结合荧光、化学发光和电化学检测等方法来提高检测的灵敏度。基于电化学的免疫传感器有着灵敏度高、成本低等优势,在检测生物分子的相互作用中发挥着极其重要的作用。2013年,新加坡国立大学刘志强课题组发展了一种等温信号放大电化学传感器,研究者通过互补金属氧化物来制作检测阵列,以及采用微流控技术代替手动操作等优化,极大地提高了miRNA的检测灵敏度(
发明内容
本发明基于石墨烯光热传感的肺癌标志物miRNA定量检测方法,克服了现有技术存在的不足,实现对肺癌标志物miRNA的高灵敏度检测。
为了解决上述技术问题,本发明采用的技术方案为:一种基于石墨烯光热传感的肺癌标志物miRNA定量检测方法,包括以下步骤:
配置用于肺癌标志物miRNA检测的石墨烯光热传感装置;
在石墨烯的表面进行DNA探针链的接种;
合成AuNPs(金纳米小球)标记的ODN(寡聚脱氧核苷酸);
将已知不同浓度浓度的肺癌标志物miRNA和一定浓度AuNPs标记的ODN混合溶液注入微流通道,与石墨烯表面的DNA探针链进行竞争性免疫反应,建立肺癌标志物miRNA的浓度与石墨烯光热传感装置输出的光强差的对应关系建立标准曲线;
将未知浓度的肺癌标志物miRNA和一定浓度AuNPs标记的ODN混合溶液与石墨烯表面的DNA探针链反应,根据石墨烯光热传感装置输出的信号来确定肺癌标志物miRNA的浓度。
进一步地,所述石墨烯光热传感装置包括探测光源、带有石墨烯的棱镜、平衡探测器、锁相放大器、泵浦光源和CCD相机,探测光源产生探测光依序通过偏振片和半波片后经过反射镜的反射,射出的光经过聚焦物镜以全反射角入射到带有石墨烯的棱镜的入射面,其出射面射出的光依序经过聚焦物镜和分光棱镜后分为强度相同的两束探测光并进入平衡探测器,平衡探测器用于测量两束探测光的光强差,锁相放大器与平衡探测器相连,锁相放大器与计算机相连;
泵浦光源产生泵浦光依序通过可调衰减器和光强调制单元后经过反射镜的反射,射出的光经过聚焦物镜入射到带有石墨烯的棱镜的反射面,CCD相机用于观测在石墨烯的棱镜的反射面上探测光和泵浦光重合的光斑;
带有石墨烯的棱镜包括直角棱镜,石英片,石墨烯和微流通道,石英片通过折射率匹配液耦合在直角棱镜的反射面上,微流通道键合在石英片上,微流通道为一横截面为矩形的凹槽结构,微流通道的两端设有进液口,石墨烯通过高温还原法制备在石英片上,石墨烯与微流通道键合。
进一步地,所述探测光的波长为980 nm-1100 nm,其波长远离ODN上标记的AuNPs的吸收峰;所述泵浦光的波长为510 nm-540 nm,其波长位于AuNPs的吸收峰。
进一步地,所述在石墨烯的表面进行DNA探针链的接种,具体包括:在所述微流通道注入EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)溶液和NHS(N-羟基琥珀酰亚胺)溶液反应一段时间,用来激活石墨烯表面的含氧官能团,之后用磷酸盐缓冲液洗涤,注入一定浓度的DNA探针链,反应一段时间,之后用超纯水洗涤,用氮气吹干。
进一步地,所述EDC溶液的浓度为100 mM,所述NHS溶液的浓度为50 mM,所述EDC溶液和所述NHS溶液的反应时间为15 min,所述DNA探针链的浓度是300 μM,所述DNA探针链和所述石墨烯的反应时间为30 min。
进一步地,所述合成AuNPs标记的ODN,具体包括:将AuNPs溶液与一定浓度的ODN溶液按照一定的体积比混合,室温下放置30 min,之后加入聚乙二醇溶液终止反应,将得到的悬浮液离心,除去多余的ODN,最终将AuNPs标记的ODN的最终浓度调整至50 μM。
进一步地,所述AuNPs的直径为30 nm,所述ODN溶液的浓度为100 μM,所述AuNPs溶液和所述ODN溶液的体积比为1:20。
进一步地,所述AuNPs标记的ODN混合溶液中ODN的浓度为50 μM,所述肺癌标志物miRNA溶液与所述AuNPs标记的ODN混合溶液的体积比为1:1。
本发明与现有技术相比具有以下有益效果。
本发明提供的检测方法是利用石墨烯在全反射条件下的古斯汉欣位移效应,并引入经过强度调制的泵浦光,通过锁相放大和平衡探测等弱信号检测技术实时检测石墨烯光热信号。在石墨烯表面接种与肺癌标志物miRNA互补的DNA探针链,通过检测目标miRNA和金纳米小球标记的寡聚脱氧核苷酸链的竞争性免疫过程,实现对肺癌标志物miRNA的高灵敏度检测。基于石墨烯的光热传感检测方法具有免标记、高灵敏度、所需样本量小的优点,为肺癌的早期诊断提供助力。
附图说明
图1为石墨烯表面DNA探针链的接种的示意图。
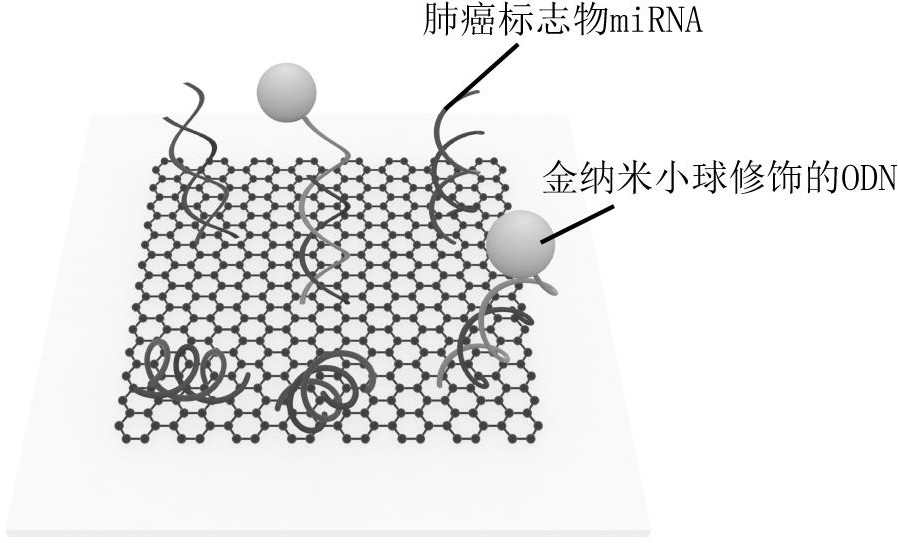
图2为当待测溶液中不存在肺癌标志物miRNA时,AuNPs修饰的ODN与探针链特异性结合的示意图。
图3为当待测溶液中存在肺癌标志物miRNA时,肺癌标志物miRNA与ODN竞争性的与DNA探针链结合的示意图。
图4为肺癌标志物miRNA检测装置的结构示意图。
图5为带有石墨烯的棱镜的结构示意图。
图6为不同浓度的肺癌标志物miRNA与ODN溶液混合后对应的石墨烯光热信号。
图中,1-探测光源,2-偏振片,3-半波片,4-反射镜,5-聚焦物镜,6-带有石墨烯的棱镜,7-分光棱镜,8-平衡探测器,9-锁相放大器,10-泵浦光源,11-可调衰减器,12-斩波器,13-CCD相机,61-石英片,62-石墨烯,63-微流通道。
具体实施方式
下面结合附图对本发明做进一步的说明。
本发明实施例提供一种基于石墨烯光热传感的肺癌标志物miRNA定量检测方法,包括以下步骤:
S1.配置用于肺癌标志物miRNA检测的石墨烯光热传感装置。
具体的,如图4所示,石墨烯光热传感装置包括探测光源1、带有石墨烯的棱镜6、平衡探测器8、锁相放大器9、泵浦光源10和CCD相机13,探测光源1产生探测光依序通过偏振片2和半波片3后经过反射镜4的反射,射出的光经过聚焦物镜5以全反射角入射到带有石墨烯的棱镜6的入射面,其出射面射出的光依序经过聚焦物镜5和分光棱镜7后分为强度相同的两束探测光并进入平衡探测器8,平衡探测器8用于测量两束探测光的光强差,锁相放大器9与平衡探测器8相连,锁相放大器9与计算机相连。
泵浦光源10产生泵浦光依序通过可调衰减器11和斩波器12后经过反射镜4的反射,射出的光经过聚焦物镜5入射到带有石墨烯的棱镜6的反射面,CCD相机13用于观测在石墨烯的棱镜6的反射面上探测光和泵浦光重合的光斑。
如图5所示,带有石墨烯的棱镜6包括直角棱镜,石英片61,石墨烯62和微流通道63,石英片61通过折射率匹配液耦合在直角棱镜的反射面上,微流通道63键合在石英片61上,微流通道63为一横截面为矩形的凹槽结构,微流通道63的两端设有进液口,石墨烯62通过高温还原法制备在石英片61上,石墨烯62与微流通道63键合。
石墨烯光热传感装置的工作原理如下:探测光经过偏振片和半波片使其成为
其中,石墨烯是经过高温还原氧化石墨烯的方法制备的,用紫外臭氧清洗机分别处理石墨烯和微流通道,石墨烯和用PDMS制备好的微流通道用紫外臭氧清洗机进行处理,处理时间为10 min,在真空干燥箱的加热温度是70 °C,加热时间为15 min。这样经过高温加热可以实现石墨烯和通道的有效键合,再通过折射率匹配液放置在直角棱镜表面。
S2.在石墨烯的表面进行DNA探针链的接种。
本步骤具体为:在微流通道注入EDC和NHS溶液,用来激活石墨烯表面的含氧官能团,之后用磷酸盐缓冲液洗涤,注入一定浓度的DNA探针链溶液,反应一段时间,之后用超纯水洗涤,用氮气吹干。其中,EDC溶液的浓度为100 mM,NHS溶液的浓度为50 mM,EDC溶液和NHS溶液的反应时间为10-15min,磷酸盐缓冲液的浓度为10 mM,PH值为7.4,DNA探针链的浓度是300 μM,DNA探针链和石墨烯的反应时间为30 min。
S3.合成AuNPs标记的ODN。
具体步骤为:将AuNPs溶液与一定浓度的ODN溶液按照一定的体积比混合,室温下放置30 min,之后加入聚乙二醇溶液终止反应,将得到的悬浮液离心,除去多余的ODN,最终将AuNPs标记的ODN的最终浓度调整至50 μM。其中,AuNPs的最优尺寸是直径30 nm,小球尺寸过大时,会导致DNA/AuNPs胶体悬浮液稳定性很差,而较小的尺寸会导致AuNPs的光热效应较弱,引起石墨烯光热信号变化过小。ODN溶液的浓度为100 μM,AuNPs溶液和ODN溶液的体积比为1:20。
探测光的波长为980 nm-1100nm,其波长远离ODN上标记的AuNPs的吸收峰;泵浦光的波长为510 nm-540 nm,其波长位于AuNPs的吸收峰,这样设置可以引起液态介质折射率的最大变化。
S4. 将已知不同浓度的肺癌标志物miRNA和一定浓度AuNPs标记的ODN混合溶液注入微流通道,与石墨烯表面的DNA探针链进行竞争性免疫反应过程,根据肺癌标志物miRNA的浓度与石墨烯光热传感装置输出的光强差的对应关系建立标准曲线。
本步骤具体包括:将AuNPs标记的ODN注入微流通道中,ODN与石墨烯表面的DNA探针链结合,ODN链端的AuNPs具备优异的光热性能,将引起石墨烯光热信号的极大变化。将芯片再生之后,分别注入已知的不同浓度的肺癌标志物miRNA与AuNPs标记的ODN溶液 (体积比为1:1),miRNA与AuNPs标记的ODN竞争性的与石墨烯表面DNA探针链结合,将导致石墨烯光热信号发生变化,曲线如图6所示。
本步骤是为了在石墨烯表面竞争性免疫过程。当AuNPs标记的ODN与石墨烯表面的探针链结合时会导致石墨烯光热信号的极大变化。如图1-图3所示,图1为石墨烯表面DNA探针链的接种的示意图。图2为当待测溶液中不存在肺癌标志物miRNA时,AuNPs修饰的ODN与探针链特异性结合的示意图。图3为当待测溶液中存在肺癌标志物miRNA时,肺癌标志物miRNA与ODN竞争性的与DNA探针链结合的示意图。
S5.将未知浓度的肺癌标志物miRNA和一定浓度AuNPs标记的ODN混合溶液与石墨烯表面的DNA探针链结合,参照步骤S4得到的标准曲线,根据石墨烯光热传感装置输出的信号确定肺癌标志物miRNA的浓度,实现肺癌标志物miRNA的定量检测。
尽管已经参照其示例性实施例具体显示和描述了本发明,但是本领域的技术人员应该理解,在不脱离权利要求所限定的本发明的精神和范围的情况下,可以对其进行形式和细节上的各种改变。
- 基于石墨烯光热传感的肺癌标志物miRNA定量检测方法
- 基于石墨烯光热传感的肺癌标志物miRNA定量检测方法
