用于核酸递送的叔氨基脂化的阳离子肽
文献发布时间:2023-06-19 10:58:46
本申请要求2018年9月28日提交的美国临时专利申请第62/738,717号和2019年8月9日提交的美国临时专利申请第62/885,036号的优先权和利益,其各自的公开内容均通过引用整体并入本申请。
技术领域
本公开涉及叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,和更具体地,涉及用于核酸递送的叔氨基脂化和/或聚乙二醇化的类肽及其复合物。本公开还提供了用于制备其复合物的方法,该复合物包含一种或多种叔胺基脂化和/或聚乙二醇化的阳离子肽与聚阴离子化合物(如核酸),以及用于将聚阴离子化合物递送至细胞的方法。
背景技术
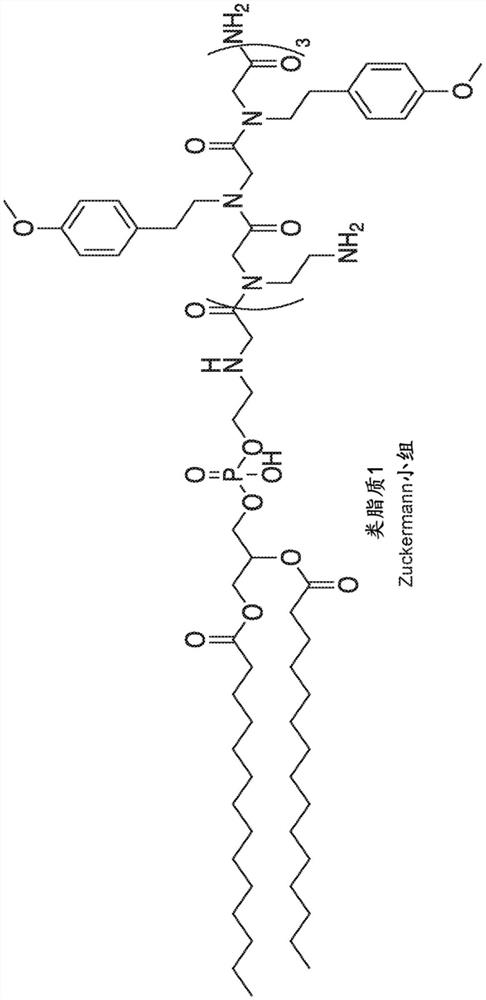
人们一般认为,用于将核酸递送和转移至细胞中的一致、有效的方法对于基因治疗,基于siRNA、miRNA、反义或mRNA的治疗的任何实际应用至关重要。阳离子类肽-磷脂缀合物构建体,也称为类脂质(lipitoids),是被开发用于在体内包封聚阴离子核酸并稳定核酸对抗核酸酶的这样一类试剂,同时也促进多核苷酸被摄取到细胞中并随后释放到细胞溶质中。类脂质,例如类脂质1(图1中所示),已证明其自身是与核酸(例如质粒DNA(pDNA)和短干扰RNA(siRNA))进行复合和细胞内递送的有效且非免疫原性的囊泡。
然而,由于核酸的多种类型—具有不同的碱基对长度、链数和构象等,每种特定类型的核酸在试图优化其插入细胞中时存在不同的挑战。尽管类脂质对于改善多种核酸的摄取方面取得显示了成功,但现有的类脂质构建体主要集中在某些类型的多核苷酸(例如pDNA和siRNA)的递送上,可能不一定同样有效地促进其他多核苷酸(例如信使RNA(mRNA))的细胞内摄取。另外,即使对于针对特定核酸类型优化的类脂质构建体,类脂质-核酸的复合物在体内仍可能遭受进一步的复杂性,包括例如颗粒稳定性和聚集。因此,迄今为止,尚未批准使用类脂质的药物用于人体。
因此,仍然需要用于以更少的体内复杂性如颗粒聚集将核酸(尤其是mRNA)递送至细胞中的替代试剂。
发明内容
本公开提供了基于用于脂质和甚至用于聚乙二醇化的替代缀合方法的类脂质,其具有更大的适应性以克服其他形式类脂质遇到的困难。
在第一方面,提供了一种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐:
其中:
m是0至10的整数;
n是0至5的整数;
s是0至5的整数;
t是0至10的整数;
其中m、n、s和t中的至少一个是非零的;
r是1到20的整数;
每个o独立地为整数0、1或2;
每个q独立地为整数0、1或2;
每个p独立地为整数1或2;
R
其中R
每个R
每个R
每个R
每个R
每个R
R
R
在该方面的一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物具有n或s中的至少一个是非零的。在该方面的某些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-脂化的氨基酸残基的嵌段,其中n和s中的至少一个为至少2、至少3或至少4,任选地为2、3或4。在该方面的一些实施方案中,每个R
在可与前述实施方案中的任何一个或多个组合的该方面的再进一步的实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含含有至少两个具有阳离子部分R
在可与前述实施方案中的任何一个或多个组合的该方面的一些实施方案中,每个中性间隔基部分R
在本方面的再进一步的实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含含有至少两个具有R
在可与任何一个或多个前述实施方案组合的该方面的再其他的实施方案中,当m为0至3的整数时,每个u独立地为20至200的整数,任选地为30至50;并且当m是4至10的整数时,每个u独立地是2至10的整数。
在可与任何一个或多个前述实施方案组合的该方面的一些实施方案中,当t为0至3的整数时,每个v独立地为30至50的整数;且当t为4至10的整数时,每个v独立地为2至10的整数。在可与任何一个或多个前述实施方案组合的该方面的其他实施方案中,m为1,和u为40至45的整数;和/或t为1,和v为40至45的整数。在可与任何一个或多个前述实施方案组合的该方面的其他实施方案中,R
本公开的另一方面提供式(I)的叔氨基脂化和聚乙二醇化的阳离子肽化合物或其盐:
其中:
m是0至10的整数;
n是0至5的整数;
s是0至10的整数;
t是0至5的整数;
其中m和t中的至少一个是非零的,和n和s中的至少一个是非零的;
r是1到20的整数;
每个o独立地为整数0、1或2;
每个q独立地为整数0、1或2;
每个p独立地为整数1或2;
R
其中R
每个R
每个R
每个R
每个R
每个R
R
R
本公开的又一方面提供了复合物,其包含与聚阴离子化合物复合的在其任何和所有各种实施方案中的前述方面任一或两者的一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物。在该方面的某些实施方案中,聚阴离子化合物包括核酸。在包括核酸的该方面的特定实施方案中,该核酸是编码多肽的mRNA。在该方面的再进一步的实施方案中,所述核酸是编码蛋白质的mRNA。在可与前述实施方案组合的包括核酸的该方面的某些实施方案中,复合物包含质量比为0.5:1至50:1的至少一种叔氨基脂化和/或聚乙二醇化阳离子肽和核酸。在可与前述实施方案任一或两者组合的包括核酸的该方面的某些实施方案中,该复合物包括:一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、核酸、磷脂、结构脂质和PEG脂质。在可与任何前述实施方案组合的再进一步实施方案中,复合物进一步包含一种或多种小分子活性剂或药物物质。
本公开的又一方面提供了向细胞递送聚阴离子化合物的方法,包括使细胞与其任何和所有各种不同实施方案中的前述方面的复合物接触。在该方面的某些实施方案中,接触是通过内吞作用。在可与前述方面组合的该方面的其他实施方案中,细胞在体内或在体外接触。在可与前述任一或两个实施方案组合的包括编码多肽的核酸的该方面的某些实施方案中,细胞在与复合物接触后表达该多肽。在可与任何前述实施方案中的一个或多个组合的包括编码蛋白质的核酸的该方面的某些实施方案中,细胞在与复合物接触后表达该蛋白质。
本公开的另外的方面提供了通过将叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物接触来形成与复合物及其任何和所有各种实施方案相关的方面的复合物的方法。在该方面的一个实施方案中,通过将包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的溶液与包含聚阴离子化合物的溶液接触而形成复合物。
附图说明
图1显示了示例性仲胺磷脂化的阳离子肽“类脂质1”。
图2A-2F总体显示了叔氨基脂化的阳离子类肽。图2A显示了叔氨基脂化类肽的广义结构。图2B显示了示例性叔氨基脂化的阳离子类肽。图2C显示了示例性的脂质单体。图2D显示了示例性的阳离子单体。图2E显示了示例性间隔单体和聚乙二醇单体。图2F显示了示例性叔氨基脂化的阳离子类肽化合物8。
图3A-3E显示了通过在固相中顺序添加氨基酸残基制备叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的示例性过程。图3A显示了树脂结合的仲胺与酰化剂溴乙酸的广义酰化反应。图3B显示了所得酰化产物与合适的胺通过亲核取代以生成相应的N-取代氨基酸残基的反应。图3C和图3D显示了酰化和亲核取代反应的连续重复,以产生所需的树脂结合的阳离子肽化合物。图3E显示了阳离子肽化合物从固体树脂支持物的切割以提供游离肽。
图4描绘了如对于在体外用以2:1、3.5:1、5:1和7.5:1的类肽:mRNA质量比单独地与萤火虫荧光素酶(Fluc)mRNA复合的叔氨基脂化的类肽化合物1-18处理的HeLa细胞测量的平均生物发光(RLU)结果的图。
图5显示了在体外用含有类脂质1或本公开的氨基脂化类肽化合物的一种选择的多组分脂质制剂处理的HeLa细胞中观察到的平均生物发光(RLU)的图。类脂质1或选择的氨基脂化类肽化合物以三种质量比(50:16:32:2、63:0:35:2和42:23:33:2)与胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(DMG-PEG2000)组合,并进一步以7:1或10:1的任一类肽:mRNA质量比与萤火虫荧光素酶(Fluc)mRNA混合以提供测试制剂。
图6A-6B显示了Fluc mRNA在用41:23:33:3的类肽:胆固醇:DOPE:DMG-PEG2000质量比和10:1的类肽:mRNA质量比的氨基脂化类肽与胆固醇、DOPE和DMG-PEG2000的多组分脂质制剂处理的HeLa细胞中的体外表达。图6A和图6B显示了用制剂1-36(图6A)和37-72(图6B)处理的HeLa细胞中观察到的平均生物发光。
图7A-7B显示了用皮下施用的41:23:33:3的类肽:胆固醇:DOPE:DMG-PEG2000质量比和10:1的类肽:mRNA质量比的氨基脂化类肽与胆固醇、DOPE和DMG-PEG2000的多组分脂质制剂处理的Balb/c小鼠中的Fluc mRNA体内表达。图7A和图7B显示了施用制剂1-36(图7A)和37-72(图7B)后6小时观察到的平均生物发光。
具体实施方式
以下描述阐述了示例性方法、参数等。然而,应当认识到这种描述并非旨在限制本公开的范围,而是作为示例性实施方案的描述提供。
本公开提供了用于将核酸和其他聚阴离子物质递送至细胞中的N-取代的阳离子肽化合物及其组合物和复合物。更具体地,本公开涉及在N-末端和/或C-末端处或其附近包含一个或多个被脂质部分和/或(低聚和/或聚)乙二醇部分N-取代的氨基酸残基的阳离子肽化合物,以促进信使RNA(mRNA)和其他多核苷酸的有效复合和细胞内递送。
与先前的类脂质结构(例如类脂质1)相反,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物不仅在肽的N末端和C末端处或其附近用N-脂化的氨基酸残基替代类脂质缀合物的磷脂成分,而且还允许沿着肽的主链存在多个脂质部分以及并入低聚和/或聚乙二醇部分。与包含单一末端磷脂或其他脂质部分的先前类脂质构建体相比,沿本文所述化合物的寡肽主链包含多个脂质部分和/或低聚和聚乙二醇部分导致改善的与核酸的复合,且因此也导致核酸的细胞摄取。
本文中使用的“烯基”指不饱和的直链或支链单价烃链或其组合,其具有至少一个烯属不饱和位点(即,具有至少一个式C=C的部分)并具有指定的碳原子数(即,C
术语“烷基”是指且包括饱和直链和支链单价烃结构及其组合,其具有指定碳原子数(即,C
本文中使用的“亚烷基”指与烷基相同的残基,但具有二价性。特定的亚烷基是具有1-6个碳原子(“C
本文中使用的“炔基”指不饱和的直链或支链单价烃链或其组合,其具有至少一个炔属不饱和位点(即,具有至少一个式C≡C的部分)并具有指定的碳原子数(即,C
术语“芳基”是指并包括多不饱和芳族烃基。芳基可包含另外的稠合环(例如,1至3个环),包括另外稠合芳基、杂芳基、环烷基和/或杂环基环。在一种变型中,芳基包含6至14个环碳原子。芳基的例子包括但不限于苯基、萘基、联苯基等。
“羰基”指C=O基团。
本文中使用的“复合物”包括两个或更多个分子之间的任何化学缔合,其可通过离子相互作用、氢键键合、范德华相互作用、金属-配体配位、其他化学力及前述一种或多种的组合来介导。复合物可以形成更高阶的结构,包括例如polyplexes、凝聚复合物(coacervate complexes)、纳米复合物、纳米颗粒和微粒。
术语“环烷基”是指并包括环状单价烃结构,其可以是完全饱和的、单不饱和的或多不饱和的,但其是非芳族的,具有指定的碳原子数(例如,C
“卤基”或“卤素”指原子序数9至85的第17族系列的元素。优选的卤基包括氟、氯、溴和碘。当残基被一个以上卤素取代时,它可以通过使用对应于所连接的卤素部分数量的前缀来指称,例如二卤代芳基、二卤代烷基、三卤代芳基等指被两个(“二”)或三个(“三”)卤代基团取代的芳基和烷基,其可以是但不一定是相同的卤基;因此,4-氯-3-氟苯基属于二卤代芳基的范围。其中每个氢被卤素基团取代的烷基称为“全卤代烷基”。优选的全卤代烷基是三氟烷基(-CF
术语“杂芳基”是指并包括具有1-10个环碳原子和至少一个环杂原子(包括但不限于如氮、氧和硫的杂原子)的不饱和芳族环状基团,其中氮和硫原子任选被氧化,且氮原子任选季铵化。杂芳基可以在环碳或环杂原子处连接到分子的其余部分。杂芳基可包含另外的稠合环(例如,1至3个环),包括另外稠合的芳基、杂芳基、环烷基和/或杂环基环。杂芳基的例子包括但不限于吡啶基、嘧啶基、噻吩基、呋喃基、噻唑基等。
术语“杂环”或“杂环基”指具有1-10个环碳原子和1-4个环杂原子如氮、硫或氧等的饱和或不饱和非芳族基团,其中氮和硫原子任选被氧化,且氮原子任选季铵化。杂环基可以有单一环或多个稠环,但不包括杂芳基。包含超过一个环的杂环可以是稠合的、螺环的或桥连的,或其任意组合。在稠合环体系中,一个或多个稠合的环可以是芳基或杂芳基。杂环基的例子包括但不限于四氢吡喃基、二氢吡喃基、哌啶基、哌嗪基、吡咯烷基、噻唑啉基、噻唑烷基、四氢呋喃基、四氢噻吩基、2,3-二氢苯并[b]噻吩-2-基、4-氨基-2-氧代嘧啶-1(2H)-基等。
“氧代”指=O部分。
“硫代羰基”指C=S基团。
除非另有说明,“任选取代的”指基团可以是未取代的或被一个或多个(例如1、2、3、4或5个)为该基团列出的取代基取代的,其中取代基可以是相同或不同的。在一个实施方案中,任选取代的基团具有一个取代基。在另一个实施方案中,任选取代的基团具有两个取代基。在另一个实施方案中,任选取代的基团具有三个取代基。在另一个实施方案中,任选取代的基团具有四个取代基。在一些实施方案中,任选取代的基团具有1-2、2-5、3-5、2-3、2-4、3-4、1-3、1-4或1-5个取代基。
术语“取代的”指一个部分的一个或多个氢原子被单价或二价基团取代。“任选取代的”表示该部分可以是取代的或未取代的。合适的取代基包括,例如,羟基、硝基、氨基(例如,-NH
叔氨基脂化和/或聚乙二醇化的阳离子肽化合物
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是包含N-取代氨基酸残基的肽链。本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含寡肽主链,其中该寡肽主链包含任选地与N-取代的中性(“间隔基”)和/或脂质氨基酸残基交错的N-取代的阳离子氨基酸残基的重复亚单元。寡肽主链在N-和/或C-端进一步通过被脂质部分N-取代(“N-脂化”)和/或被低聚乙二醇和/或聚乙二醇N-取代(“N-聚乙二醇化”)的氨基酸残基封端。
在一个方面,本文提供了式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐:
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可以通过肽化合物中存在的氨基酸残基总数表征,其中每个氨基酸残基由一般结构-(NR-CR
在其他实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物具有净零电荷或净正电荷。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基脂化的阳离子肽化合物的某些实施方案中,叔氨基脂化的阳离子肽化合物具有至少+1的净正电荷。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基聚乙二醇化的阳离子肽化合物或叔氨基脂化和聚乙二醇化的阳离子肽化合物的其他实施方案中,阳离子肽化合物具有净零电荷(即,是电中性的)或净正电荷。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基聚乙二醇化的阳离子肽化合物或叔氨基脂化和聚乙二醇化的阳离子肽化合物的一些实施方案中,该阳离子肽化合物具有+1的净正电荷。在某些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物具有(r×p)+的净正电荷。
在某些实施方案中,本文所述的阳离子肽化合物的氨基酸残基是天然存在的氨基酸或非天然存在的氨基酸的N-取代变体,其中碳侧链由R
在一些实施方案中,每个R
在其他实施方案中,每个R
寡肽主链或重复亚单元及结构基序
如本文所述,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可用于与聚阴离子化合物(如核酸)的复合,以及用于将这种聚阴离子化合物递送至细胞中。本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-取代的阳离子氨基酸残基(其任选地与N-取代的中性间隔氨基酸残基和/或N-脂化的氨基酸残基交错)的重复亚单元的寡肽主链,如以下式(I)的片段所示:
寡肽主链的重复亚单元中的阳离子氨基酸残基赋予本公开的化合物正电荷,这允许与聚阴离子物质如核酸的有利静电相互作用和电荷中和。中性或脂化的氨基酸残基在阳离子残基之间的交错允许更好地控制正电荷在整个叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中的空间分布,这使得能够改善阳离子肽化合物与具有特定长度、电荷分布和/或构象的聚阴离子物质的复合。
在寡肽主链中,r代表叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中阳离子和中性和/或脂化的氨基酸残基的重复亚单元的数量。在一些实施方案中,r是1至25的整数。在某些实施例中,r是1至20的整数。在其他实施方案中,r是1至15的整数。在一些实施方案中,r是1至5的整数。在某些实施方案中,r是2至4的整数。
应当认识到,每个亚单元r可以与整个叔氨基脂化和/或聚乙二醇化阳离子肽化合物内的其他亚单元严格相同或不严格相同。例如,在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中,每个亚单元r可以包含阳离子氨基酸残基,并且任选地还包含中性和/或脂化的氨基酸残基,其相对于其他亚单元中存在的阳离子和中性和/或脂化的氨基酸残基独立地选择。
阳离子部分
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的每个重复亚单元包含至少一个阳离子氨基酸残基。阳离子氨基酸残基提供正电荷,其通过与核酸或聚阴离子化合物上的负电荷的相互作用使得本文所述的肽化合物能够与核酸或其他聚阴离子化合物形成静电复合物。核酸的复合部分地或完全地屏蔽核酸的负电荷,并促进通过细胞的脂质膜的转运和进入细胞内部。
在每个亚单元r内,p代表该亚单元中存在的阳离子氨基酸残基的数量。在一些实施方案中,每个p独立地为整数1或2。在某些实施方案中,p为1。
每个阳离子氨基酸残基在N-位包含阳离子部分R
本文所述的阳离子部分可以是在生理相关的pH范围内具有稳定的净正电荷的取代基。例如,生理pH为至少约5.5,通常为至少约6.0。更典型地,生理pH为至少约6.5。通常,生理pH小于约8.5,通常小于约8.0。更典型地,生理pH小于约7.5。阳离子部分可以通过例如,该部分中存在的官能团的阈pKa值(其足以在生理pH下产生正电荷)来表征。在某些实施方案中,阳离子部分具有至少7.5的pKa值。在其他实施方案中,阳离子部分具有在生理pH和更酸性的pH(例如pH 4.5-5.5)之间的pKa值。在另外的实施方案中,使用具有多个独立pKa值的取代基。
应当认识到,本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可沿寡肽主链包含多个彼此紧密接近的阳离子部分。当沿着寡肽主链存在多个阳离子部分时,某些阳离子部分的质子化或去质子化状态可能影响紧密接近的其他阳离子部分的pKa值。通过这一机制,本文所述的阳离子肽化合物中特定阳离子部分的pKa可相对于其孤立测量的pKa值被改变。例如,寡肽主链中一个胺的质子化(具有约8的pKa)可将附近阳离子部分的pKa值从约7.5的正常值降低至pKa约5-6。
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物容纳多个以不同程度彼此接近的阳离子部分的能力使得这些阳离子肽化合物及其任何复合物能够对生理pH的变化以高灵敏度作出反应。这些化合物及其复合物对生理pH变化的敏感性对于促进核酸的递送和在内体转运(核内体区室pH为约4.5至5.5)后释放到胞质溶胶中可能是重要的。
阳离子或带正电的部分可包括,例如,基于氮的取代基,例如包含以下官能团的那些:氨基、胍基、肼基和脒基。这些官能团可以是芳族的、饱和环状的或脂族的。在一些实施方案中,每个R
在某些实施方案中,每个R
在其中阳离子残基是整个肽化合物的末端残基的再进一步的实施方案中,可以使用不与合成或脱保护条件相容的(例如酸不稳定的接头)或对于其不存在合适的保护基策略(例如多胺)的另外的阳离子部分R
在其他实施方案中,末端阳离子残基的阳离子部分R
在再进一步的实施方案中,末端阳离子残基的阳离子部分R
应当进一步认识到,肽链中未取代的氮原子(即其中R
中性间隔基部分
在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的寡肽主链内,阳离子氨基酸残基可任选地与中性间隔氨基酸残基交错,从而在N-位具有中性间隔基部分。中性氨基酸残基可用于调节叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中正电荷的空间分布,以改善与待与阳离子肽化合物复合的聚阴离子化合物(包括多核苷酸)的静电相互作用。
在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的每个重复亚单元中,中性氨基酸残基可以作为一个或多个R
每个中性间隔氨基酸残基在N-位包含中性间隔基部分R
还应认识到,中性间隔基部分可包括在生理相关的pH范围内为中性或具有零净电荷的任何取代基。在一些实施方案中,每个中性部分R
脂质部分
除了叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的寡肽主链内中性氨基酸残基与阳离子氨基酸残基的任选交错外,N-脂化氨基酸残基(具有在N-位的脂质部分)也可任选地与阳离子(和任选的中性间隔基)氨基酸残基交错。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-脂化的氨基酸残基的一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是N-脂化的。与中性氨基酸残基类似,寡肽主链内的N-脂化氨基酸残基可用于调节叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中正电荷的空间分布,以及增强其亲脂性用于改善聚阴离子材料的包封和细胞内递送。脂质沿类肽主链的间距也可能影响脂质流动性/结晶度,其已知影响细胞摄取和核内体释放。
如同中性间隔残基一样,在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的每个重复亚单元中,N-脂化的氨基酸残基可以作为一个或多个R
每个N-脂化的氨基酸残基在N-位包含脂质部分R
合适的脂质部分可包括,例如,任选取代的支链或直链脂族部分,或衍生自天然脂质化合物(包括脂肪酸、甾醇和类异戊二烯)的任选取代的部分。
在一些实施方案中,脂质部分可包括具有约6至约50个碳原子或约10至约50个碳原子的支链或直链脂族部分,任选地包含一个或多个杂原子,并任选地包含一个或多个双键或三键(即,饱和或者单不饱和或多不饱和的)。在某些实施方案中,脂质部分可包括任选取代的脂族、直链或支链部分,每个疏水性尾独立地具有约8至约30个碳原子或约6至约30个碳原子。在某些实施方案中,脂质部分可包括例如衍生自脂肪酸和脂肪醇的脂族碳链。在一些实施方案中,每个脂质部分R
在可与任何前述实施方案组合的再其他实施方案中,每个脂质部分R
本发明的实施中使用的天然脂质部分可以衍生自例如磷脂、甘油酯(如二或三甘油酯)、糖基甘油酯、鞘脂、神经酰胺及饱和和不饱和的固醇、类异戊二烯和其他类似的天然脂质。
其他合适的脂质部分可包括亲脂性碳环或芳族基团,例如任选取代的芳基、环烷基、环烷基烷基或芳基烷基部分,包括例如萘基或乙基苄基,或包含酯官能团的脂质,包括例如固醇酯和蜡酯。在再其他的实施方案中,脂质部分R
结构基序
在一些实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可包含阳离子、中性间隔基和脂化的氨基酸残基相对于彼此的特定序列或排列,其可类似于线性共聚物的各种分类(无规、嵌段、交替、周期性、立构嵌段等)进行描述。
例如,在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含类属部分R
阳离子和中性间隔氨基酸残基的交替序列的一个例子可以由R
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽包含至少一个具有阳离子部分R
阳离子域可包括,例如,在连续的线性序列中具有多个R
在其他实施方案中,“阳离子域”可包括相邻氨基酸残基的嵌段,其中多个阳离子残基具有间隔在两个阳离子残基之间的额外的非阳离子(即,中性或脂化的)残基,使得嵌段内没有任何一个阳离子残基与另一个阳离子残基直接键合。例如,在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含“阳离子域”,其中该阳离子域包含至少两个具有阳离子部分R
在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含阳离子域的一些实施方案中,每个R
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可包含一个或多个不同的阳离子部分(R
侧链功能化和肽缀合化合物
如上所述,寡肽主链主要包含具有存在于天然或非天然存在的氨基酸上的侧链部分(R
在一个方面,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的R
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽包含一个或多个含有反应性基团或连接基团的氨基酸残基。合适的反应性基团可包括但不限于酯、酰胺、异氰酸酯、硫醇或“点击”化学相容部分(例如叠氮基、炔基)。
在另一方面,本公开进一步提供了叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,其中该肽化合物与治疗剂和/或靶向元件共价结合或缀合。在某些实施方案中,治疗剂和/或靶向元件是小分子、肽序列、抗体或抗体片段、适体、单糖或寡糖(例如,半乳糖)或聚糖。
对特定生理条件环境敏感或在特定生理条件环境下不稳定的连接基团或连接可能有助于实现向特定器官或细胞的靶向递送,随后选择性地将治疗剂和/或聚阴离子材料释放至细胞中(在细胞中释放)。此外,不稳定的连接也可促进在多阴离子物质递送后叔氨基脂化和/或聚乙二醇化的阳离子化合物从细胞(或器官或全身)的消除和清除。在某些实施方案中,选择连接基团以使得叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与治疗剂或靶向元件之间的共价键是水解不稳定的、化学不稳定的、pH不稳定的、光不稳定的、热不稳定的或可酶促裂解的。
末端(封端)残基和保护端基
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含寡肽主链,其在N末端和/或C末端通过被脂质部分N-取代(“N-脂化”)和/或被低聚乙二醇和/或聚乙二醇N-取代(“N-聚乙二醇化”)的氨基酸残基封端。阳离子肽化合物的N-脂化赋予该化合物以及该化合物与聚阴离子物质之间形成的任何复合物有利的亲脂性。N-聚乙二醇化提供对颗粒形成和体内聚集的更好控制。N末端和C末端的末端氨基和羧酸部分可进一步被保护端基封端。
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可包含N-脂化和/或N-聚乙二醇化的氨基酸残基。本文提供的阳离子肽化合物包含至少一个N-脂化或N-聚乙二醇化的氨基酸残基。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基脂化的阳离子肽化合物。在其他实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基聚乙二醇化的阳离子肽化合物。还在其他的实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-脂化和N-聚乙二醇化的氨基酸残基两者。在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基脂化和聚乙二醇化的阳离子肽化合物。
脂质部分
如上所述,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可在N末端和/或C末端包含氨基酸残基,其中该氨基酸残基被脂质部分N-取代,或“N-脂化”。在本文所述的阳离子肽化合物的N-末端和/或C-末端并入N-脂化的氨基酸残基提高化合物的亲脂性。阳离子肽化合物亲脂性的增加增强了其对疏水性环境(如细胞膜的脂质双层)的亲和力,因此增加了叔氨基脂化和/或聚乙二醇化的阳离子肽化合物及其与聚阴离子化合物的任何复合物转运至细胞中的倾向。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是N-脂化的。在一些实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端包含N-脂化的氨基酸残基。在其他实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在C末端包含N-脂化的氨基酸残基。在某些实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端和C末端包含N-脂化的氨基酸残基。
在一些实施方案中,本文所述的阳离子肽化合物在N末端的N-脂化氨基酸残基的数量通过n表示。在其他实施方案中,本文所述的阳离子肽化合物在N末端的N-脂化氨基酸残基的数量通过s表示。
在一些实施方案中,n是0至8的整数。在某些实施方案中,n是0至5的整数。在其他实施方案中,n是整数0、1、2、3、4、5、6或7。在再其他的实施方案中,n是整数1、2、3或4。在一些实施方案中,s是0至8的整数。在某些实施方案中,s是0至5的整数。在其他实施方案中,s是整数0、1、2、3、4、5、6或7。在再其他的实施方案中,s是整数1、2、3或4。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是N-脂化的一些实施方案中,n或s中的至少一个是非零的。在一些实施方案中,n是非零的。在其他实施方案中,s是非零的。在某些实施方案中,n和s都是非零的。
在一些实施方案中,n和s之和是1至8、2至7或4至6的整数。在其他实施方案中,n和s之和为至少2、至少3或至少4,任选地为2、3或4。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-脂化残基的嵌段,或“N-脂质嵌段”,其中叔氨基脂化和/或聚乙二醇化的阳离子肽包含至少两个、至少三个或至少四个彼此相邻的N-脂化残基(例如,R
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽中的N-脂化氨基酸残基被脂质部分R
应当认识到,N-脂化氨基酸残基的特定序列或排列对于改善与核酸的复合和核酸的递送可能特别有用的。例如,在其中叔氨基脂化和/或聚乙二醇化的阳离子化合物包含一组具有两个不同的脂质部分R
合适的脂质部分可包括,例如,任选取代的支链或直链脂族部分,或衍生自天然脂质化合物(包括脂肪酸、甾醇和类异戊二烯)的任选取代的部分。
在一些实施方案中,脂质部分可包括具有约6至约50个碳原子或约10至约50个碳原子的支链或直链脂族部分,任选地包含一个或多个杂原子,并任选地包含一个或多个双键或三键(即饱和或者单不饱和或多不饱和的)。在某些实施方案中,脂质部分可包括任选取代的脂族、直链或支链部分,每个疏水性尾独立地具有约8至约30个碳原子或约6至约30个碳原子。在某些实施方案中,脂质部分可包括例如衍生自脂肪酸和脂肪醇的脂族碳链。在一些实施方案中,每个R
在可与任何前述实施方案组合的再其他实施方案中,每个R
本发明的实施中使用的天然脂质部分可以衍生自例如磷脂、甘油酯(如二或三甘油酯)、糖基甘油酯、鞘脂、神经酰胺及饱和和不饱和的固醇、类异戊二烯和其他类似的天然脂质。
其他合适的脂质部分可包括亲脂性碳环或芳族基团,如任选取代的芳基、环烷基、环烷基烷基或芳基烷基部分,包括例如萘基或乙基苄基,或包含酯官能团的脂质,包括例如固醇酯和蜡酯。在再其他的实施方案中,脂质部分R
乙二醇部分
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽可在N末端和/或C末端包含被乙二醇的低聚物或聚合物N-取代的(即被低聚乙二醇和/或聚乙二醇N-取代的)封端氨基酸残基。将低聚和/或聚乙二醇部分并入本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物中可促进与核酸形成的复合物的颗粒稳定性并防止体内的颗粒聚集。
应当认识到,术语“聚乙二醇化的”在本文中用于描述包含可被低聚乙二醇、聚乙二醇或其组合N-取代的末端氨基酸残基的阳离子肽化合物。在一些实施方案中,本文提供的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是N-聚乙二醇化的。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端包含N-聚乙二醇化的氨基酸残基,如以下式(I)的片段中所示的:
在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端包含N-聚乙二醇化的氨基酸残基的某些实施方案中,m代表N末端的N-聚乙二醇化的氨基酸残基的数量,并且每个R
在一些实施方案中,m是0至10的整数、0至3的整数或4至10的整数。在一些实施方案中,每个u独立地为2至200的整数、2至100的整数、2至50的整数、50至200的整数、50至100的整数、100至200的整数或150至200的整数。
在某些实施方案中,m是0至3的整数,并且每个u是20至200的整数,或者任选地是30至50的整数。在某些实施方案中,m为0至3的整数,和u为40至45的整数。还在其他的实施方案中,m为1,和u为40至45的整数。在其他实施方案中,m是4到10的整数,并且每个u是从2到10的整数。在某些实施方案中,m是4至10的整数,和u是2至5的整数。还在其他的实施方案中,m是7至10的整数,和u是3。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在C末端包含N-聚乙二醇化的氨基酸残基,如以下式(I)的片段中所示的:
在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在C末端包含N-聚乙二醇化的氨基酸残基的某些实施方案中,t代表N末端的N-聚乙二醇化的氨基酸残基的数量,并且每个R
在一些实施方案中,t是0至10的整数、0至3的整数或4至10的整数。在一些实施方案中,每个u独立地为2至200的整数、2至100的整数、2至50的整数、50至200的整数、50至100的整数、100至200的整数或150至200的整数。
在一些实施方案中,t是0至3的整数,并且每个v是30至50的整数。在某些实施方案中,t为0至3的整数,和v为40至45的整数。还在其他的实施方案中,t为1,和v为40至45的整数。在其他实施方案中,t是从4到10的整数,并且每个v是2到10的整数。在某些实施方案中,t是4至10的整数,和v是2至5的整数。还在其他的实施方案中,t是7至10的整数,和v是3。
在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是N-聚乙二醇化的一些实施方案中,m或t中的至少一个是非零的。在一些实施方案中,m是非零的。在其他实施方案中,t是非零的。在某些实施方案中,m和t都是非零的。
N-脂化的和/或N-聚乙二醇化的
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可包含被N-脂化和/或N-聚乙二醇化的氨基酸残基。本文提供的阳离子肽化合物包含至少一个被N-脂化或N-聚乙二醇化的氨基酸残基。在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的一些实施方案中,m、n、s或t中的至少一个是非零的。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是其中n和s中至少一个是非零的叔氨基脂化的阳离子肽化合物。在某些实施方案中,n和s都是非零的。在再某些实施方案中,式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是式(Ia)的叔氨基脂化的阳离子肽化合物:
其中n和s中的至少一个是非零的,并且其中R
在其他实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是其中m和t中至少一个是非零的叔氨基聚乙二醇化的阳离子肽化合物。在某些实施方案中,m和t都是非零的。在其他实施方案中,式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是式(Ib)的叔氨基聚乙二醇化的阳离子肽化合物:
其中m和t中的至少一个是非零的,并且其中R
还在其他的实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物包含N-脂化和N-聚乙二醇化的氨基酸残基两者。在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基脂化和聚乙二醇化的阳离子肽化合物。在其中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是叔氨基脂化和聚乙二醇化的阳离子肽化合物的某些实施方案中,m和t中的至少一个是非零的,且n和s中的至少一个是非零的。
在再进一步的实施方案中,式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是式(Ic)的叔氨基脂化和聚乙二醇化的阳离子肽化合物:
其中m和t中的至少一个是非零的,且n和s中的至少一个是非零的,并且其中R
在其他实施方案中,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物也可包含在N末端或C末端具有其他中性屏蔽聚合物或部分(其提供与N-聚乙二醇化残基类似的屏蔽效果)的N-取代的氨基酸残基。这些可包括如羟烷基、透明质酸、多糖、聚磷酸盐和聚磷酸酯、聚(乙烯吡咯烷酮)、多元醇、亲水性多肽或其他合成的亲水性聚合物的实例。
N末端和C末端端基
本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可以具有分别为其游离胺和游离酸形式或为受保护的形式的N末端和C末端。在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端和/或C末端残基处进一步包含保护或末端封端基团。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在N末端残基处包含保护或末端封端基团R
在其他实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物在C末端残基处包含保护或末端封端基团R
在再进一步的实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的N末端和C末端可被选择或进一步修饰以使得R
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽的R
反应性连接基团随之可用于将其他有用的化合物(包括靶向元件或治疗剂)与肽化合物共价结合。在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与治疗剂和/或靶向元件共价结合或缀合。在某些实施方案中,治疗剂和/或靶向元件是小分子、抗体或抗体片段。
另外,用于R
如上所述,对特定生理条件环境敏感或在特定生理条件环境下不稳定的连接基团或连接可促进聚阴离子材料向特定细胞的靶向递送,并改善特定的药代动力学性质如消除。在某些实施方案中,选择连接基团以使得叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与治疗剂或靶向元件之间的共价键是水解不稳定的、化学不稳定的、pH不稳定的、光不稳定的、热不稳定的或可酶促裂解的。
叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的合成
在另一方面,本文提供了制备本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的方法。
现有的类脂质构建体通常限于在N端的直接脂质缀合,或使用在残基侧链上的反应性连接基团以将脂质部分间接缀合至寡肽化合物。此外,对于类脂质,仅在寡肽完全合成时才进行修饰以将脂质与寡肽化合物缀合。本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可以在不需要额外的接头种类以将脂质部分与寡肽核心缀合的情况下合成。对于本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,脂质和乙二醇部分与肽本身内的氮原子共价和直接结合,也就是说,在氨基酸残基中的酰胺氮或N-位处。因此,叔氨基脂化和/或聚乙二醇化的阳离子肽可以完全通过本领域已知用于在肽链中产生N-取代残基的方法合成。
叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可通过对于待添加的每一个氨基酸残基的一系列酰化(酰胺化)和亲核取代(胺化)反应来制备,无论该残基在N-位是否具有阳离子、中性、脂质或低聚/聚乙二醇部分。本文所述的阳离子肽化合物通过顺序添加单个残基到肽链上而合成的。残基的顺序添加可以重复进行,直至达到所需的氨基酸的序列和长度。
本发明的化合物可以通过固相和液相方法合成。下文讨论了通过固相合成制备N-取代的肽(包括本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物)的示例性方法,并在图3A-3E中示出。
如图3A所示,在合成开始时提供具有末端仲胺的固体树脂支持物。酰化剂用合适的肽偶联试剂和溶剂添加到末端仲胺以在末端仲胺和酰化剂之间形成酰胺键。酰化剂优选为乙酰化剂。酰化剂包含至少两个合适的离去基团以促进在α-碳上的酰胺化和后续的胺化。在某些实施方案中,酰化剂是卤代乙酸。在其他实施方案中,酰化剂为溴乙酸。
在图3B中,图3A中产生的酰化产物与所需的取代伯或仲胺反应以提供相应的N-取代的末端氨基酸残基。选择的伯胺或仲胺替代α-碳上的离去基团,如溴乙酸中的溴,以产生相应的胺化产物。在一些实施方案中,伯胺或仲胺是选自NHR
酰胺化和胺化反应系列地重复(图3C)直至获得所需的肽序列(图3D)。应当认识到,本文所述的制备叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的方法可进一步包括保护和脱保护步骤以防止在顺序的酰胺化/胺化反应过程中与肽链中的反应性部分发生任何不希望的反应。例如,保护基R
N末端和C末端(R
取决于上述合成中使用的任何保护方案,在合适的反应条件下,如包括盐酸、氢溴酸或三氟乙酸的酸性条件下,所需的肽化合物从固体树脂支持物上切除(图3E)。叔氨基脂化和/或聚乙二醇化的阳离子肽化合物从固体树脂支持物上的切割在溶液中产生相应的游离阳离子肽化合物。
可以采取进一步的步骤以从溶液中分离和纯化阳离子肽化合物,包括例如从固体树脂支持物过滤含肽溶液和冷冻干燥分离的滤液以提供固体产物。
由于用于实现树脂切割的酸性条件,应当认识到叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可以相应的酸性盐形式存在。例如,在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物是其盐形式。在某些实施方案中,盐形式为酸加成盐。在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的盐是盐酸盐(盐酸加成盐)、氢溴酸盐(氢溴酸加成盐)或三氟乙酸盐(三氟乙酸加成盐)。在某些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的盐是叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的三氟乙酸加成盐或三氟乙酸盐。
叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的酸加成盐形式可通过本领域的方法(例如,离子交换)进一步修饰,以获得一种或多种药学上可接受的盐形式。短语“药学上可接受的”指物质或组合物必须与组成制剂的其他成分和/或该制剂施用的受试者化学和/或毒理学上相容。术语“药学上可接受的酸加成盐”可包括但不限于与无机酸(如盐酸、氢溴酸、氢碘酸、硫酸、硝酸、碳酸、磷酸)和选自有机酸的脂族、环脂族、芳族、芳基-脂族、杂环、羧酸和磺酸种类的有机酸(如甲酸、乙酸、丙酸、葡萄糖酸、乳酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、天门冬酸、抗坏血酸、谷氨酸、苯甲酸、苯乙酸、甲磺酸“甲磺酸盐”、乙磺酸、对甲苯磺酸和水杨酸)形成的那些药学上可接受的盐。
在一些实施方案中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的盐是药学上可接受的盐。在某些实施方案中,盐为盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、甲酸盐、乙酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、丙酮酸盐、草酸盐、马来酸盐、丙二酸盐、琥珀酸盐、富马酸盐、酒石酸盐、酒石酸氢盐、柠檬酸盐、天冬氨酸盐、抗坏血酸盐、谷氨酸盐、苯甲酸盐、甲磺酸盐、乙磺酸盐、对甲苯磺酸盐或水杨酸盐。
叔氨基脂化和/或聚乙二醇化的阳离子肽与聚阴离子化合物的复合物、其制剂及制备复合物及其制剂的方法
叔氨基脂化和/或聚乙二醇化的阳离子肽与聚阴离子化合物的复合物
如本文所述,本公开的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可用于与一种或多种聚阴离子化合物(如核酸)的复合。叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物的复合物可用于将聚阴离子化合物递送至细胞内部,与用其他聚阳离子构建物(例如类脂质1)形成的复合物相比,该复合物具有改善的效率。
在一个方面,本公开提供了包含与一种或多种聚阴离子化合物复合的如本文所述的一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐的复合物。在一些实施方案中,一种或多种聚阴离子化合物包括核酸。本文所用的核酸包括天然存在的核酸,如DNA、RNA和/或其杂合体,以及具有非天然主链和修饰的主链连接如硫代磷酸酯、非天然和修饰的碱基以及非天然和修饰的末端的非天然存在的变体。示例性的核酸包括基因组DNA、cDNA、mRNA、miRNA和siRNA。
核酸可以是重组产生的或化学合成的分子。核酸可以是单链、双链、三链和四链的,以及更复杂的三维形式(包括单链和双链区域)。
根据核酸的类型,核酸的长度(适当地以核苷酸单元或碱基对(bp)定义)可能变化。在其中所述核酸为mRNA的一些实施方案中,mRNA可具有100至10,000个核苷酸单元或1,000至3,000个核苷酸单元。在其中核酸为DNA的其他实施方案中,DNA可具有5,000bp至20,000bp,或约10,000bp。
在其中核酸是mRNA的一些实施方案中,mRNA是编码蛋白质或肽的mRNA。在其中所述核酸是mRNA的一些实施方案中,mRNA是编码肽(包括寡肽或多肽)的mRNA。在某些实施方案中,mRNA是编码多肽的mRNA。在再进一步的实施方案中,mRNA是编码蛋白质的mRNA。在其他实施方案中,mRNA是编码肽的mRNA。如上所述,mRNA可以是天然存在的(例如,分离的肿瘤RNA),或可以是合成的(例如,通过体外转录产生)。对于合成的或非天然存在的mRNA变体,mRNA可包含具有修饰的主链连接如硫代磷酸酯、非天然和修饰的碱基和/或非天然和修饰的末端的非天然主链。在其中所述核酸是mRNA的某些实施方案中,mRNA可包含特殊序列,如自扩增序列或内部核糖体进入位点。
在一些实施方案中,两种或多种特定核酸一起的联合递送对于治疗应用可能特别有用。例如,在一些实施方案中,一种或多种聚阴离子化合物包括作为CRISPR序列的sgRNA(单指导RNA)和编码Cas9的mRNA的组合。在再进一步的实施方案中,核酸也可以与蛋白质复合,例如与CRISPR/Cas9核糖核蛋白复合物复合。
在一些实施方案中,一种或多种聚阴离子化合物可包括非核酸的阴离子或聚阴离子化合物。合适的阴离子化合物可包括但不限于蛋白质、聚磷酸盐或肝素。在一些实施方案中,一种或多种聚阴离子化合物包括一种或多种蛋白质。在一个实施方案中,一种或多种聚阴离子化合物包括Cas9蛋白。在其他实施方案中,一种或多种聚阴离子化合物包括聚磷酸盐。在再其他实施方案中,一种或多种聚阴离子化合物包括肝素或其他糖胺聚糖衍生物。
尽管叔氨基脂化和/或聚乙二醇化的阳离子肽特别适合携带和递送聚阴离子负载到细胞中,但应当承认,本文所述的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物也可用于与其他非阴离子试剂或负载(包括疏水化合物)形成复合物以递送至细胞中。这些其他负载可包括但不限于,例如,一种或多种小分子活性剂或药物物质(作为单独的治疗剂或与另一药剂(如核酸)组合)和/或免疫佐剂。应当进一步认识到,这些其他负载分子可以与本文所述的任何聚阴离子化合物组合或不组合用于复合。在一些实施方案中,本文所述的复合物包含内体逃逸调节剂、TLR激动剂和化学治疗剂。在其他实施方案中,本公开的复合物包含佐剂或免疫共刺激剂。例如,在一些实施方案中,复合物包含选自CpG寡脱氧核苷酸(ODNs)、脂多糖(LPS)及其任何组合的免疫佐剂。
本文所述的复合物可通过叔氨基脂化和/或聚乙二醇化的阳离子肽上的阳离子基团数量与核酸上的阴离子磷酸酯基团数量的比率表征。在一些实施方案中,复合物包含阳离子:阴离子电荷比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。在某些实施方案中,复合物包含阳离子:阴离子电荷比2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。还在进一步的其他实施方案中,复合物包含阳离子:阴离子电荷比为3:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。
或者,本文所述的复合物可通过复合物中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物和/或其他负载的相对质量比表征。基于用于制备复合物的各组分储备溶液的已知浓度和体积可以容易地计算复合物中组分的质量比。此外,如果复合物中存在非阴离子负载,则质量比可以提供与阳离子:阴离子电荷比相比更精确的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与总体负载的相对量的表示,该阳离子:阴离子电荷比不考虑非阴离子材料。
在一些实施方案中,复合物包含质量比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5的叔氨基脂化和/或聚乙二醇化的阳离子肽与一种或多种聚阴离子化合物和/或非阴离子化合物。在某些实施方案中,复合物包含质量比为2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和一种或多种聚阴离子化合物和/或非阴离子化合物。还在进一步的其他实施方案中,复合物包含质量比为3:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和一种或多种聚阴离子化合物和/或非阴离子化合物。
在其中复合物包含核酸的某些实施方案中,复合物包含质量比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。在某些实施方案中,复合物包含质量比为2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。还在其他的实施方案中,复合物包含质量比为3:1的叔氨基脂化和/或聚乙二醇化的阳离子肽和核酸。
本公开的复合物包含与至少一种聚阴离子化合物或其他合适的负载化合物复合的至少一种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物。在一些实施方案中,本文所述的复合物可包含一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物。本公开的多种阳离子肽化合物的混合物和组合在单一复合物中的使用可以使得能够制备针对特定药代动力学和药效学性质定制的制剂。相关的药代动力学和药效学性质可包括但不限于生物分布、免疫原性、制剂稳定性、包封百分比、转染效率、血浆半衰期等。不同的应用可能需要这些性质的不同组合。
例如,在某些实施方案中,复合物可包含一种或多种富阳离子的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与一种或多种高度脂化的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的组合。理论上,通过提供更大的电荷稳定性(通过富阳离子的肽化合物)以及更大的亲脂屏蔽(通过脂化的肽化合物),这种组合可以赋予改善的聚阴离子化合物的递送。应当进一步认识到,可以调整单个叔氨基脂化和/或聚乙二醇化的阳离子肽化合物各自的单独量以获得所需的性质。在一些实施方案中,复合物可包括叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物之外的进一步的组分。
叔氨基脂化和/或聚乙二醇化的阳离子肽和其他脂质组分与聚阴离子化合物的复合物及其组合物
本公开进一步提供了包含复合物的组合物,其中复合物包含一种或多种聚阴离子化合物和三种或更多种脂质成分。在前述的一些实施方案中,所述复合物包含一种或多种聚阴离子化合物、一种或多种叔氨基脂化和/或阳离子肽化合物以及两种或更多种其他脂质组分。在其中包含一种或多种叔氨基脂化和/或阳离子肽化合物与一种或多种聚阴离子化合物和/或非阴离子化合物的组合物和复合物进一步包含两种或更多种脂质组分(如本文所述的磷脂、结构脂质和/或屏蔽脂质(例如,PEG脂质))的一些实施方案中,组合物可被描述为脂质制剂。在其中组合物包含两种或更多种脂质组分的某些实施方案中,脂质组合物可被描述为多组分脂质制剂或组合物。在其中复合物包含叔氨基脂化和/或阳离子肽化合物、聚阴离子化合物、磷脂、结构脂质和屏蔽脂质的某些实施方案中,该组合物包含脂质纳米颗粒。在其中组合物包含脂质纳米颗粒复合物的再其他实施方案中,组合物可被表征为脂质纳米颗粒(LNP)组合物。
除了用于作为负载的聚阴离子化合物的电荷中和而使用的主要脂质组分的叔氨基脂化和/或阳离子肽化合物外,多组分脂质组合物和其中的复合物可包含其他脂质组分,包括结构脂质、磷脂和屏蔽脂质。本文所述的另外的脂质组分为阳离子肽化合物和聚阴离子材料的复合物提供物理结构和稳定性,这有助于它们在溶液中的施用并促进复合物摄取到细胞中。
例如,在一些实施方案中,本公开的组合物包含一种或多种聚阴离子化合物和脂质组分的复合物,其中脂质组分包含任选地一种或多种结构脂质;一种或多种磷脂、一种或多种屏蔽脂质和一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐。在一些实施方案中,本公开的组合物包含一种或多种聚阴离子化合物和脂质组分的复合物,其中脂质组分包含一种或多种磷脂、一种或多种屏蔽脂质和一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐。在其他实施方案中,组合物包含一种或多种聚阴离子化合物和脂质组分的复合物,其中脂质组分包含一种或多种结构脂质;一种或多种磷脂、一种或多种屏蔽脂质和一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐。
在一些实施方案中,该复合物包含:叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、任选的结构脂质和PEG脂质。在其中复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、任选的结构脂质和PEG脂质的某些实施方案中,复合物为脂质纳米颗粒(LNP)或两亲性纳米颗粒(ANP)。在一些实施方案中,复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、结构脂质和PEG脂质。在其他实施方案中,复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂和PEG脂质。
磷脂可以掺入本公开的复合物和组合物中。通过其两亲特性和破坏细胞膜的能力,磷脂为溶液中的复合物提供了进一步的稳定化,以及促进细胞内吞作用。在一些实施方案中,本文提供的组合物包含含有一种或多种磷脂作为脂质组分的复合物。在某些实施方案中,一种或多种磷脂包括一种或多种两性离子磷脂。
在一些实施方案中,磷脂选自1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(DLPC)、1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱(DMPC)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(DPPC)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(DSPC)、1,2-二-十一酰基-sn-甘油-3-磷酸胆碱(DUPC)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(POPC)、1,2-二-O-十八烯基-sn-甘油-3-磷酸胆碱(18:0Diether PC)、1-油酰基-胆甾醇基半琥珀酰基-sn-甘油-3-磷酸胆碱(OChemsPC)、1-十六烷基-sn-甘油-3-磷酸胆碱(C 16Lyso PC)、1,2-二亚麻酰基-sn-甘油-3-磷酸胆碱、1,2-二花生四烯酰基-sn-甘油-3-磷酸胆碱、1,2-二-二十二碳六烯酰基-sn-甘油-3-磷酸胆碱、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺(DPPE)、1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(ME 16.0PE)、1,2-二硬脂酰基-sn-甘油-甘油-3-磷酸乙醇胺、1,2-二亚油酰基-sn-甘油-3-磷酸乙醇胺、1,2-二亚麻酰基-sn-甘油-3-磷酸乙醇胺、1,2-二花生四烯酰基-sn-甘油-3-磷酸乙醇胺、1,2-二-二十二碳六烯酰基-sn-甘油-3-磷酸乙醇胺、1,2-二油酰基-sn-甘油-3-磷酸-rac-(1-甘油)钠盐(DOPG)、鞘磷脂及其任何混合物。在某些实施方案中,磷脂为DOPE。
应当认识到,由磷脂提供的有助于破坏细胞膜用于内吞作用的两亲性属性可以可选地由非磷脂的两性离子脂质提供。在一些实施方案中,组合物包含含有一种或多种非磷脂的两性离子脂质的复合物。在再进一步的实施方案中,组合物包含含有一种或多种磷脂、一种或多种两性离子脂质或其任何组合的复合物。如本文所述,结构脂质可用于赋予多组分组合物中聚阴离子化合物的复合物物理稳定性,并增强复合物的亲脂特性以促进与靶细胞的结合和内吞。在一些实施方案中,本公开的组合物包含含有任选地一种或多种结构脂质作为脂质组分的复合物。在一些变型中,组合物包含含有一种或多种结构脂质的复合物。
适用于本公开的组合物和复合物的结构脂质可包括但不限于固醇。在一些实施方案中,结构脂质选自胆固醇、粪甾醇、谷甾醇、麦角甾醇、菜油甾醇、豆甾醇、菜籽甾醇、番茄碱、熊果酸、α-生育酚及其混合物。在某些实施方案中,结构脂质是胆固醇。
然而,应当注意,在本公开的一些实施方案中,本文提供的组合物和复合物不含结构脂质,但仍表现出非常良好的递送效率。在某些其他实施方案中,本文提供的组合物和复合物不含结构脂质。如本文所述,本公开的复合物和组合物可进一步包括一种或多种屏蔽脂质。屏蔽脂质(如聚乙二醇化脂质或PEG脂质)可以对作为一种或多种聚阴离子化合物反电荷的一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物提供额外的电荷中和层,并防止被细胞吞噬过程清除。在一些实施方案中,本文提供的组合物包含含有一种或多种作为脂质组分的屏蔽脂质的复合物。
在一些实施方案中,屏蔽脂质是PEG脂质。在其他实施方案中,PEG脂质选自PEG修饰的磷脂酰乙醇胺、PEG修饰的磷脂酸、PEG修饰的神经酰胺、PEG修饰的二烷基胺、PEG修饰的二酰基甘油、PEG修饰的二烷基甘油及其混合物。在一些实施方案中,PEG脂质是PEG修饰的磷脂酰乙醇,其选自PEG修饰的DSPE(DSPE-PEG)、PEG修饰的DPPE(DPPE-PEG)和PEG修饰的DOPE(DOPE-PEG)。在某些实施方案中,PEG脂质选自二肉豆蔻酰甘油-聚乙二醇(DMG-PEG)、二硬脂酰甘油-聚乙二醇(DSG-PEG)、二棕榈酰甘油-聚乙二醇(DPG-PEG)和二油酰甘油-聚乙二醇(DOG-PEG)。在某些实施方案中,PEG脂质为DMG-PEG。
应当进一步认识到,前述PEG脂质中的PEG链的特定分子量可特别有利于掺入到本公开的复合物中。例如,在一些实施方案中,PEG链的分子量为350-6,000克/摩尔、1,000-5,000克/摩尔或2,000-5,000克/摩尔。在某些实施方案中,PEG脂质的PEG链具有约350克/摩尔、500克/摩尔、600克/摩尔、750克/摩尔、1,000克/摩尔、2,000克/摩尔、3,000克/摩尔、5,000克/摩尔或10,000克/摩尔的分子量。在某些其他实施方案中,PEG脂质的PEG链具有约500克/摩尔、750克/摩尔、1,000克/摩尔、2,000克/摩尔或5,000克/摩尔的分子量。例如,在某些实施方案中,聚乙二醇化的脂质是二肉豆蔻酰甘油-聚乙二醇2000(DMG-PEG2000)。
在再进一步的实施方案中,一种或多种PEG脂质包含式(I)的叔氨基聚乙二醇化的阳离子肽化合物,其包含至少一个低聚或聚乙二醇部分。本公开的式(I)叔氨基脂化和/或聚乙二醇化的阳离子肽化合物通过其在沿肽链主链容纳脂质和聚乙二醇部分两者的灵活性并取决于其特定取代基的性质,不仅可用作用于电荷中和的脂化的阳离子肽化合物,而且可用作稳定阳离子化合物-聚阴离子化合物复合物的合适屏蔽脂质。应当认识到,式(I)的叔氨基聚乙二醇化的阳离子肽化合物可以与其他式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物组合。
在一些实施方案中,PEG脂质是如本文所述的式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,其中m和t中的至少一个是非零的(即,N-聚乙二醇化的)。在再进一步的实施方案中,PEG脂质是式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,其中m和t独立地为0至10的整数,并且其中m和t中的至少一个是非零的。在一些实施方案中,PEG脂质是式(Ib)的叔氨基聚乙二醇化的阳离子肽化合物。还在其他实施方案中,PEG脂质是式(Ic)的叔氨基脂化和聚乙二醇化的阳离子化合物。
与上述PEG脂质一样,前述叔氨基脂化和聚乙二醇化的阳离子肽化合物中PEG链的特定分子量可特别有利于掺入本公开的复合物中。例如,在一些实施方案中,PEG链的分子量为350-6,000克/摩尔、1,000-5,000克/摩尔或2,000-5,000克/摩尔。在某些实施方案中,叔氨基脂化和聚乙二醇化的阳离子肽化合物的PEG链具有约350克/摩尔、500克/摩尔、600克/摩尔、750克/摩尔、1,000克/摩尔、2,000克/摩尔、3,000克/摩尔或5,000克/摩尔的分子量。在某些其他实施方案中,PEG脂质的PEG链具有约500克/摩尔、750克/摩尔、1,000克/摩尔、2,000克/摩尔或5,000克/摩尔的分子量。
然而,应当认识到,式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物可以包含几个短的低聚乙二醇部分,而不是更少的较长聚乙二醇部分,并为复合物提供类似的颗粒稳定性。在其中PEG脂质为式(I)的N-聚乙二醇化阳离子肽化合物的一些实施方案中,叔氨基脂化和/或聚乙二醇化阳离子肽化合物包含至少一个式-CH
在一些实施方案中,PEG脂质是如本文所述的式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物,其中m和t中的至少一个是非零的,且n和s中的至少一个是非零的(即,N-脂化的)。在其中式(I)的N-聚乙二醇化阳离子肽化合物也是N-脂化的某些实施方案中,n和s中的至少一个是非零的。在一些实施方案中,n和s之和为至少1、2、3或4。在某些实施例中,s为4。在再进一步的实施方案中,n为4。
如上所述,本公开的组合物包含含有一种或多种聚阴离子化合物和脂质组分的复合物,其中脂质组分包含一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、一种或多种磷脂、一种或多种屏蔽脂质和任选地一种或多种结构脂质。本文所述的复合物和组合物的物理性质可受到对于给定聚阴离子化合物的脂质组分的特定选择以及复合物和组合物中各组分的量的影响。在一些实施方案中,复合物及其组合物中的脂质组分可通过脂质组分(单独或组合)相对于存在的总脂质组分的质量百分比和/或单个脂质组分相对于彼此的质量比表征。
在一些实施方案中,本公开的组合物通过存在的脂质组分的质量百分比表征。如本文所述,脂质组分的总质量或重量是存在的任何叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、任何结构脂质、任何磷脂和任何屏蔽脂质的单个质量的总和。
在一些实施方案中,组合物和其中的复合物包含脂质组分总重量的40-80%w/w的一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐。在某些变型中,组合物和其中的复合物包含脂质组分总重量的40-70%w/w的一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐。
如本文所述,包含复合物的组合物可任选地包含一种或多种结构脂质。在可与任何前述实施方案组合的一些实施方案中,组合物和其中的复合物包含脂质组分总重量的0-25%w/w的一种或多种结构脂质。在某些变型中,组合物和其中的复合物包含脂质组分总重量的0-25%w/w的胆固醇。
本文所述的组合物和复合物还包含一种或多种磷脂。在再其他的实施方案中,组合物和其中的复合物包含脂质组分总重量的10-60%w/w的一种或多种磷脂。在某些变型中,组合物和其中的复合物包含脂质组分总重量的20-40%w/w的一种或多种磷脂。在一些实施方案中,组合物和其中的复合物包含脂质组分总重量的10-60%w/w的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)。在某些实施方案中,组合物和其中的复合物包含脂质组分总重量的20-40%w/w的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)。
在进一步的实施方案中,组合物和其中的复合物包含一种或多种屏蔽脂质。在一些实施方案中,组合物和其中的复合物包含脂质组分总重量的1-5%的一种或多种屏蔽脂质。在某些实施方案中,组合物和其中的复合物包含脂质组分总重量的1-5%的一种或多种PEG脂质。在再其他的实施方案中,组合物和其中的复合物包含脂质组分总重量的1-5%的1,2-二肉豆蔻基-rac-甘油-3-甲氧基聚乙二醇(DMG-PEG)。
在其他实施方案中,本公开的组合物和其中的复合物包含脂质组分总重量的40-80%w/w的一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐;0-25%w/w的胆固醇;10-60%w/w的DOPE;和1-5%的DMG-PEG2000。还在进一步的实施方案中,本公开的组合物和其中的复合物包含脂质组分总重量的40-70%w/w的一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物或其盐;0-25%w/w的胆固醇;20-40%w/w的DOPE;和1-5%的DMG-PEG2000。
在其中复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、核酸、磷脂、PEG脂质以及任选地结构脂质的一些实施方案中,复合物可通过单个组分彼此的质量比,或者一种或多种组分与一种或多种其他组分的质量比表征。例如,在一些实施方案中,本公开的组合物和复合物可以通过叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与磷脂与结构脂质(如果存在)与屏蔽脂质的第一质量比和叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与核酸的第二质量比来描述。或者,在其他实施方案中,本文提供的组合物和复合物可通过总脂质组分与核酸的质量比来描述,其中总脂质组分包括存在的任何叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、结构脂质、磷脂和屏蔽脂质。
在另一方面,本公开的复合物和组合物可通过单个组分彼此的质量比表征。例如,如本文所述,本公开的复合物包含一种或多种磷脂和任选地一种或多种结构脂质。在其中组合物包含含有一种或多种结构脂质和一种或多种磷脂的复合物的一些实施方案中,组合物可通过一种或多种结构脂质与一种或多种磷脂的质量比表征。在一些实施方案中,一种或多种结构脂质(当存在时)与一种或多种磷脂的质量比在0.5:1至2:1之间。在其中组合物包含胆固醇和DOPE的某些实施方案中,胆固醇与DOPE的质量比在0.5:1至2:1之间。
如上所述,包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、任选的结构脂质和PEG脂质的复合物通过质量百分比和/或质量比表征。在其中所述复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、任选的结构脂质和PEG脂质的一些实施方案中,复合物可以通过单个组分彼此的质量比或者一种或多种组分与一种或多种其他组分的质量比表征。例如,在一些实施方案中,本公开的复合物可以通过叔氨基脂化和/或聚乙二醇化的阳离子肽与磷脂与结构脂质与PEG脂质的第一质量比以及叔氨基脂化和/或聚乙二醇化的阳离子肽与核酸的第二质量比来描述。
就本公开的复合物和组合物中存在的聚阴离子化合物而言,复合物以及因此组合物内的聚阴离子化合物的量可通过多种方式表征。在一些实施方案中,本文所述的组合物和复合物可通过叔氨基脂化和/或聚乙二醇化的阳离子肽化合物上的阳离子基团数与核酸上阴离子磷酸酯基团数的比率表征。在一些实施方案中,复合物包含阳离子:阴离子电荷比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和核酸。在某些实施方案中,复合物包含阳离子:阴离子电荷比2:1至5:1的叔氨基脂化和/或聚乙二醇化阳离子肽化合物和核酸。还在进一步的其他实施方案中,复合物包含阳离子:阴离子电荷比3:1的叔氨基脂化和/或聚乙二醇化阳离子肽化合物和核酸。
或者,本文所述的复合物和包含该复合物的组合物可通过复合物中叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物和/或其他负载的相对质量比表征。基于用于制备复合物的各组分储备溶液的已知浓度和体积可以容易地计算复合物中组分的质量比。此外,如果复合物中存在非阴离子负载,则质量比可以提供与阳离子:阴离子电荷比相比更精确的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与总体负载的相对量的表示,该阳离子:阴离子电荷比不考虑非阴离子材料。
在一些实施方案中,复合物包含质量比为0.5:1至50:1、0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5的一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与一种或多种聚阴离子化合物和/或非阴离子化合物。在某些实施方案中,复合物包含质量比为2:1至5:1的一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和一种或多种聚阴离子化合物和/或非阴离子化合物。还在进一步的其他实施方案中,复合物包含质量比为3:1的一种或多种叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和一种或多种聚阴离子化合物和/或非阴离子化合物。
在其中复合物包含核酸的某些实施方案中,复合物包含质量比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至20:1、2:1至10:1或2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和核酸。在某些实施方案中,复合物包含质量比为2:1至5:1的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和核酸。还在其他的实施方案中,复合物包含质量比为3:1的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和核酸。
在再其他的实施方案中,复合物及其组合物中存在的聚阴离子化合物的量可以通过脂质组分(叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、磷脂、屏蔽脂质和结构脂质(如果存在))与一种或多种聚阴离子化合物的质量比表征。在一些实施方案中,脂质组分与一种或多种聚阴离子化合物的质量比为0.5:1至50:1、0.5:1至20:1、0.5:1至10:1、0.5:1至5:1、1:1至20:1、1:1至10:1、1:1至5:1、2:1至25:1、2:1至20:1、2:1至10:1或2:1至5:1。在某些实施方案中,脂质组分与一种或多种聚阴离子化合物的质量比为5:1至10:1或6:1至7:1。
另外的组分
还可以向复合物添加另外的组分以促进聚阴离子负载的高度包封和/或其靶向的受控释放。这些另外的组分可包括例如聚合物和表面活性组分。
聚合物掺入本文所述的复合物中可通过形成聚合物纳米颗粒囊泡或者在另外的脂质组分存在下形成混合脂质-聚合物纳米颗粒来稳定包含叔氨基脂化和/或聚乙二醇化的阳离子肽和聚阴离子化合物的复合物。在一些实施方案中,本公开的复合物包含聚合物。合适的聚合物可包括中性聚合物(例如聚(乳酸-共-乙醇酸)(PLGA)或聚乙醇酸(PGA))、阴离子聚合物(包括聚(天冬氨酸)、聚(谷氨酸)和肝素)和/或阳离子聚合物(例如,聚乙烯亚胺、鱼精蛋白)。
在其他实施方案中,本文所述的复合物包含表面活性组分,如靶向配体、稳定剂和/或表面活性剂。
在另一方面,本公开提供了包含本文所述复合物的制剂。本文所述的制剂包括用于制备本文的复合物的储备溶液的混合物以及用于施用的纯化药物制剂。应当理解,包含本公开的复合物的制剂也必然包含本文所述复合物中存在的组分。
在一些实施方案中,制剂为溶液、悬浮液、胶体悬浮液、喷雾或气溶胶。在其他实施方案中,制剂为脂质复合物制剂。在一些实施方案中,制剂为肠内制剂、胃肠外制剂或局部制剂。在一些实施方案中,制剂为可注射制剂,例如静脉内制剂、皮下制剂、肌内制剂、皮内制剂、眼内制剂或鞘内制剂。在其他实施方案中,制剂为口服制剂。在再其他的实施方案中,制剂为粘膜制剂,包括例如鼻制剂、肛门内制剂、口腔制剂或阴道内制剂等。
如以上针对本公开的复合物所述的,本文提供的制剂可包含一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与一种或多种聚阴离子化合物和/或非阴离子化合物。除了叔氨基脂化和/或聚乙二醇化的阳离子肽和一种或多种聚阴离子化合物和/或非阴离子化合物外,应当认识到,制剂中还可包含其他组分以调节其药代动力学和药效学性质。
在一些实施方案中,复合物可包括可用于向细胞递送核酸负载和其他化合物的进一步的组分。这些组分可包括但不限于共同形成例如固体脂质纳米颗粒(LNP)或其他相当的超复合物或递送系统(例如,混合脂质-聚合物纳米颗粒)的那些组分。在一些实施方案中,制剂包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、结构脂质和PEG脂质。在其中复合物包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸、磷脂、结构脂质和PEG脂质的某些实施方案中,所述制剂包含脂质纳米颗粒。
在其中包含一种或多种式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与一种或多种聚阴离子化合物和/或非阴离子化合物的制剂进一步包含一种或多种脂质组分(如本文所述的磷脂、结构脂质和/或PEG脂质)的一些实施方案中,该制剂可被描述为脂质制剂。在其中脂质制剂包含两种或更多种脂质组分的某些实施方案中,该脂质制剂可被描述为多组分脂质制剂。在其中脂质制剂包含脂质纳米颗粒复合物的再其他的实施方案中,脂质制剂可被表征为脂质纳米颗粒制剂。
在其他实施方案中,制剂包含叔氨基脂化和/或聚乙二醇化的阳离子肽、核酸和聚合物(例如,PLGA)。
应进一步认识到,用于制备本公开的复合物和制剂的组分以及用于制备所述复合物或制剂的工艺参数可根据复合物和/或制剂是否旨在立即使用(“及时”)或储存以备将来使用而进行适应。特别地,对于储存的考虑因素可包括复合物和/或制剂保持的温度(例如,在室温、4℃、-20℃、-78℃下)和储存持续时间。
合适的赋型剂可包括但不限于有助于施用或提高储存稳定性的那些赋型剂(例如,冷冻保护剂)。例如,除了上述组分外,本文所述的制剂可包含药学上可接受的赋形剂,如载体、溶剂、分散剂、稀释剂、填充剂、稳定剂、防腐剂等。
制备复合物及其制剂的方法
可通过多种物理和/或化学方法制备叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物及其复合物的复合物和制剂以调节其物理、化学和生物学性质。这些通常包括在水中或与水混溶的有机溶剂中的叔氨基脂化和/或聚乙二醇化的阳离子肽(例如,氨基脂化类肽)与在水或水性缓冲液中的所需的聚阴离子化合物(例如,寡核苷酸)快速组合。这些方法可包括通过移液或微流体混合工艺(例如涉及T型混合器、涡流混合器或其他无序混合结构的那些)的组分简单混合。
在一个方面,本公开提供了形成本文所述的复合物的方法,包括将叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物接触。
在一些实施方案中,形成包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的方法包括将包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的溶液与包含聚阴离子化合物的溶液接触。在某些实施方案中,聚阴离子化合物包括核酸。
还在另一方面,本公开提供了一种制备包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的制剂的方法,其中聚阴离子化合物是核酸,该方法包括将包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的溶液与包含聚阴离子化合物的溶液接触以提供制剂。
复合物和制剂中的另外的组分如形成脂质纳米颗粒的脂质组分、聚合物、表面活性剂或赋形剂可以在叔氨基脂化和/或聚乙二醇化的阳离子肽化合物与聚阴离子化合物混合之前、期间或之后与水或水混溶有机溶剂中的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物混合和组合。
制备本文所述复合物和制剂的特定工艺条件可相应调整或选择以提供复合物和制剂所需的物理性质。例如,可能影响最终复合物和制剂的用于混合复合物和制剂的组分的参数可包括但不限于混合的顺序、混合的温度、混合速度/速率、流速、储备溶液浓度、组分质量比(例如,肽:负载)和溶剂。
使用复合物及其制剂的方法
如上所述,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物、其与聚阴离子化合物的复合物及其制剂有助于将聚阴离子化合物递送至细胞,特别是细胞内环境。因此,肽化合物、其与聚阴离子化合物的复合物及其制剂可用于许多临床应用和研究应用。将聚阴离子化合物递送至细胞可用于临床应用,例如与预防、诊断和/或治疗方法相关的那些应用。例如,在一些实施方案中,合适的临床应用可包括疫苗接种、癌症免疫治疗、蛋白质替代治疗和/或体内基因编辑、离体细胞治疗转染、离体干细胞诱导。将聚阴离子化合物递送至细胞的方法也可用于研究或非临床应用,包括生物测定和试剂。
在另一方面,本文提供了向细胞递送聚阴离子化合物的方法。在一些实施方案中,将聚阴离子化合物递送至细胞的方法包括使细胞与包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的复合物接触。在其他实施方案中,将聚阴离子化合物递送至细胞的方法包括使细胞与包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的制剂接触。在前述方法的一些实施方案中,接触是通过内吞作用。
在一些实施方案中,将聚阴离子化合物递送至细胞的方法包括使细胞与包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的复合物接触,其中细胞在体外、离体或在体内接触。在一些实施方案中,将聚阴离子化合物递送至细胞的方法包括使细胞与包含叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和聚阴离子化合物的制剂接触,其中细胞在体外、离体或在体内接触。
在其中细胞在体外接触的一些实施方案中,细胞是HeLa细胞。在其中细胞在体内接触的其他实施方案中,本公开的复合物或制剂施用于哺乳动物受试者。哺乳动物受试者可包括但不限于人或小鼠受试者。在其中细胞离体接触的再其他的实施方案中,细胞从人或小鼠受试者获得。
在其中细胞在体内接触的前述方法的一些实施方案中,本文所述的复合物和制剂可通过注射施用。在某些实施方案中,本文所述的复合物和制剂可通过注射(静脉内(IV)、皮下(SC)、肌内(IM)、鞘内)施用。在一些实施方案中,复合物和制剂通过静脉内(IV)、皮下(SC)、肌内(IM)或鞘内注射施用。在其他实施方案中,本文所述的复合物和制剂通过浓注或静脉输注施用。在其中细胞在体内接触的其他实施方案中,本公开的复合物和制剂通过经鼻或经口吸入施用。在其中细胞在体内接触的一些实施方案中,本文所述的复合物和制剂经口施用。在其中细胞在体内接触的再其他的实施方案中,复合物和制剂通过吸收到粘膜中(包括局部、肛门内、口腔、阴道内等)施用。
应当理解,临床应用,例如以上公开的诊断、预防和治疗实例,可涉及给药方案(例如,施用的剂量水平和时间进程),其可针对所使用的具体复合物和/或制剂、施用途径、复合物和/或制剂的施用对象和/或期望的生理效果而适当变化。例如,在一些实施方案中,本公开的方法包括以0.0001mg/kg至约10mg/kg体重的剂量施用复合物或制剂。
在对本发明进行了一般性描述后,通过参考特定的具体实施例将更好地理解本发明,这些实施例被包括在本文中以进一步说明本发明,并且无意限制权利要求书所定义的本发明的范围。
实施例
在以下实施例中进一步详细描述了本公开,这些实施例不以任何方式限制所要求保护的本公开的范围。附图应被视为本公开的说明书和描述的组成部分。提供以下实施例是为了说明而非限制所要求保护的公开。
实施例1-用于核酸递送的示例性叔氨基脂化阳离子肽的合成
以下实施例描述了合成如本文所述的式(I)的叔氨基脂化和/或聚乙二醇化的阳离子肽化合物的一般方案。
在以下提供的描述中,所有R
Fmoc-Rink酰胺树脂用作固体支持物。树脂上的Fmoc基团用20%(v/v)哌啶-二甲基甲酰胺(DMF)脱保护。氨基树脂然后用溴乙酸酰胺化。随后通过用伯胺亲核取代溴对α-碳进行胺化。连续重复这两个步骤以产生所需的阳离子肽序列。
除非另有说明,所有反应和洗涤在室温下进行。树脂的洗涤是指向树脂添加洗涤溶剂(通常DMF或二甲基亚砜(DMSO)),搅拌树脂以获得均匀的浆料,然后将溶剂从树脂彻底排干。通过反应容器的烧结底部真空过滤除去溶剂,直至树脂表现为干的。在所有的合成中,树脂浆料通过烧结容器的底部鼓泡氩气进行搅拌。
初始树脂脱保护。烧结的反应容器中加载Fmoc-Rink酰胺树脂。将DMF加入树脂中,搅拌该溶液使树脂溶胀。然后,排干DMF。通过向树脂中加入DMF中的20%哌啶、搅拌树脂并排干树脂来去除Fmoc基团。向树脂中加入DMF中的20%哌啶,并搅拌15分钟,然后排干。然后用DMF洗涤树脂,六次。
酰化/酰胺化。然后去阻断的胺通过向树脂中加入DMF中的溴乙酸,随后加入DMF中的N,N-二异丙基碳二亚胺(DIC)酰化(图3A)。该溶液在室温下搅拌30分钟,然后排干。该步骤重复第二次。树脂然后用DMF洗涤两次和用DMSO洗涤一次。这是一个完整的反应循环。
亲核取代/胺化。酰化树脂用所需的伯胺或仲胺处理以经历在α-碳上溴离去基团的亲核取代(图3B)。重复该酰化/置换循环(图3C)直至获得所需的肽序列(图3D)。
从树脂的肽切割。干燥的树脂置于包含特氟龙涂覆的微型搅拌棒的玻璃闪烁小管中,并加入95%三氟乙酸(TFA)水溶液。将溶液搅拌20分钟,然后通过配备有聚乙烯玻璃料的固相萃取(SPE)柱过滤至聚丙烯锥形离心管中。
树脂用1mL 95%TFA洗涤。然后将合并的滤液从1:1的乙腈:水冻干三次。将冻干的肽(图3E)以5mg/mL的浓度重新溶解于无水乙醇或以10mg/mL的浓度溶解于DMSO中。
纯化和表征。重新溶解的粗肽通过制备型HPLC纯化。纯化后的肽通过LC-MS分析表征。
实施例2-代表性氨基脂化类肽的合成和表征
通过以上实施例1中所描述的亚单体方法用溴乙酸和N,N’-二异丙基碳二亚胺(DIC)合成氨基脂化的聚甘氨酸化合物(“类肽”)。聚苯乙烯支持的MBHA Fmoc保护的Rink酰胺(200毫克代表性规模,0.64毫摩尔/克加载,Protein Technologies)树脂用作固体支持物。对于溴乙酰化,树脂与2M溴乙酸和2M N,N’-二异丙基碳二亚胺(DIC)的1:1混合物组合5分钟。胺置换使用DMF中的1M胺溶液进行1小时。合成后,粗制类肽使用5ml的95:2.5:2.5三氟乙酸(TFA):水:三异丙基硅烷的混合物在室温下从树脂切割40分钟。通过过滤除去树脂,并使用Biotage V10蒸发器浓缩滤液。粗制类肽通过冻干从25%的MeCN水溶液进一步浓缩。在Waters Acquity UPLC Peptide BEH C4柱上使用Waters Acquity UPLC系统(具有Acquity Diode Array UV检测器和Waters SQD2质谱仪)在5-95%的梯度内分析纯度和身份。在Waters XBridge BEH300 Prep C4柱上通过具有Waters 2489UV/可见光检测器的制备型Waters Prep150LC系统在30分钟内使用具有0.1%TFA的水中的5-40%乙腈梯度纯化选择的粗制类肽。
表1A显示了通过实施例2中所描述的方法制备的代表性氨基脂化类肽化合物1-72。表1B提供了表1A中制备的氨基脂化类肽化合物1-72的表征数据,包括预测的分子量、保留时间(以分钟计,通过λ=218nm的UPLC-UV测量确定)和主要的观察质荷比(m/z,MH
表1A
表1B
实施例3-代表性氨基脂化类肽与寡核苷酸的配制以形成纳米颗粒组合物
以下实施例描述了如本文所述的式(I)的叔氨基脂化和/或聚乙二醇化阳离子肽化合物与寡核苷酸的配制的一般方案。
在标准配制中,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物以0.5mg/mL(用于体外实验)或5mg/mL(用于体内实验)的浓度溶解于无水乙醇中。所得溶液在室温下稳定,但应在-20℃下储存。核酸负载以0.2mg/mL(用于体外实验)或1mg/mL(用于体内实验)的最终浓度溶于不含DNAse或RNAse的水中。这些溶液应储存在-20℃下或在-78℃下(更长时间)。
为制备纳米颗粒制剂,叔氨基脂化和/或聚乙二醇化的阳离子肽化合物通过移液以约1:1(肽化合物:负载)至20:1的质量比与核酸混合。在配制前,将叔氨基脂化和/或聚乙二醇化的阳离子肽化合物和负载(如核酸)分别稀释在乙醇和酸性缓冲液(PBS,用0.1M HCl调节至pH5.5)中至1:3的体积比,并以约0.05mg/mL至0.2mg/mL的最终负载浓度为目标。
实施例4-代表性的mRNA/类肽制剂的物理性质的表征
将实施例2中所描述的示例性氨基脂化的阳离子类肽1-36与萤火虫荧光素酶(Fluc)mRNA组合以形成用于针对体外或体内治疗和/或预防目的评估的纳米颗粒组合物。制剂根据实施例3的方案制备,并通过简单移液混合。
通过动态光散射(DLS)评估类肽:负载质量比5:1的mRNA/类肽制剂,以确定mRNA/类肽复合物的体积平均颗粒尺寸/直径(nm)和制剂内的尺寸多分散性指数(PDI)。通过Triton X-100在颗粒裂解之前和之后的Qubit RNA HS(Invitrogen)染料的荧光来确定示例性化合物的每种制剂的mRNA包封百分比。结果显示于下表2中。
表2
NA=样品不适合于DLS测量
实施例5-用代表性Fluc mRNA/氨基脂化的阳离子类肽制剂处理后萤火虫荧光素酶(Fluc)的体外表达
基于其向培养的细胞递送萤火虫荧光素酶(Fluc)报告基因的能力,在体外评估了mRNA/氨基脂化类肽制剂的效力。将实施例2的氨基脂化的阳离子类肽1-36以5:1w/w的比率单独与Fluc mRNA组合,并将所得颗粒以100ng/孔(总体积100μL)的剂量加入培养的HeLa细胞中。在处理6小时和24小时后,通过发光板阅读仪测量所得的荧光素酶表达(RLU)。下表3显示了在两个时间点对于Fluc mRNA/氨基脂化类肽制剂观察到的荧光素酶表达。
表3.用代表性的Fluc mRNA/氨基脂化类肽制剂处理后萤火虫荧光素酶(Fluc)的体外表达
还对实施例2的示例性氨基脂化的阳离子类肽化合物1-18以2:1、3.5:1、5:1和7.5:1的类肽:mRNA质量比进行了体外荧光素酶表达测量。观察到的荧光素酶表达通过发光平板阅读仪作为平均生物发光(RLU)测量,如图4所示的。
实施例6-在多组分脂质制剂中用代表性Fluc mRNA/氨基脂化的类肽复合物处理后萤火虫荧光素酶(Fluc)的体外表达
基于其在体外向培养的HeLa细胞递送萤火虫荧光素酶(Fluc)报告基因的能力,评估了多组分脂质制剂中的mRNA/氨基脂化类肽的效力。使用胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(DMG-PEG2000)相对于氨基脂化的类肽制备三种具有不同质量百分比的脂质组分的脂质制剂(类肽:胆固醇:DOPE:DMG-PEG2000,50:165:32:2、63:0:35:2和42:23:33:2)。然后将氨基脂化类肽的每种基础制剂以质量比7:1或10:1(类肽:负载)与mRNA组合。本实施例中评估的六种脂质制剂的组成如下表4所示。使用类脂质1代替氨基脂化的阳离子类肽化合物的制剂以表4中相同的质量百分比制备用于比较。
表4
细胞培养:在处理前18小时将HeLa细胞以10,000孔接种在100μL含有10%FBS和1%青霉素/链霉素的DMEM中,并使其粘附。在转染前立即用100μL新鲜的含血清DMEM替换培养基。
mRNA制备:采用标准体外转录(IVT)方法内部制备用于转染实验的Fluc mRNA。
mRNA配制:根据上述比例,使用氨基脂化类肽(化合物2和6-18)或类脂质1(乙醇中5mg/mL)、胆固醇(5mg/mL)、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE,5mg/mL)和2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(DMG-PEG2000,0.5mg/mL)的主原液制备脂质混合物。考虑到剩余体积(并调整总脂与mRNA的有效比率),加入100%的乙醇。然后将8μL的该脂质混合物以15ng/μL的浓度加入到24μL溶于酸化PBS(pH 5.5)中的mRNA。混合后,将10μL所得溶液加入到96孔板的相应孔中。所有处理一式三份进行,并且值表示为平均值。用所得溶液处理HeLa细胞6小时,之后用新鲜DMEM替换培养基。作为阴性对照,HeLa细胞用单独mRNA的溶液处理。对于Lipo条件,根据制造商的指示,mRNA用Lipofectamine 2000(ThermoFisher)配制。
体外成像:在成像前,向每个孔中加入10μl的30mg/mL D-荧光素溶液,然后在37℃下孵育10分钟。这之后,使用SpectraMax iD3平板阅读仪(Molecular Devices)测量整个平板的发光。图5描绘了每种脂质制剂的观察的平均生物发光(RLU)的柱状图。
实施例7-用多组分质脂制剂中的代表性Fluc mRNA/氨基脂化类肽复合物处理后萤火虫荧光素酶(Fluc)的体外表达
进行了额外的实验以评价氨基脂化类肽1-72与胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(DMG-PEG2000)的制剂至HeLa细胞的体外递送效率,其中类肽:胆固醇:DOPE:DMG-PEG2000的质量比为41:23:33:3且类肽:Fluc mRNA比率为10:1。
如实施例6中所述的方案被用于多组分脂质制剂氨基脂化类肽1-72的全组评估。简而言之,用制剂处理HeLa细胞6小时(每孔50ng Fluc mRNA),之后培养基用新鲜的DMEM替换。在成像前,向每个孔中加入10升的30mg/mL D-荧光素溶液,随后在37℃下孵育10分钟。此后,使用SpectraMax iD3平板阅读仪(Molecular Devices)测量整个平板的发光。观察到的氨基脂化类肽化合物1-72的平均发光(RLU)见图6A(化合物1-36)和图6B(化合物37-72)。所有处理一式三份进行,且表示为平均值。
实施例8-在皮下施用代表性Fluc mRNA/氨基脂化多组分脂质制剂后萤火虫荧光素酶(Fluc)的体内全身表达。
通过皮下注射施用进一步评估氨基脂化类肽化合物对Balb/c小鼠(n=3)的FlucmRNA的体内递送效率。制备了包含氨基脂化类脂质1-72与Fluc mRNA(2g)、胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(DOPE)和2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(DMG-PEG2000)的多组分脂质制剂,其中类肽:胆固醇:DOPE:DMG-PEG2000的质量比为41:23:33:3和类肽:Fluc mRNA比率为10:1。制剂通过尾静脉注射以0.1毫克/千克的剂量(约2克Fluc mRNA/剂量)施用,且6小时后量化所得的生物发光。
图7A和7B显示了Fluc在测试小鼠中的体内全身表达,其量化为平均生物发光(RLU)。
- 用于核酸递送的叔氨基脂化的阳离子肽
- 用于核酸递送的包含脂化的阳离子肽化合物的脂质纳米颗粒制剂
